Как стентирование спасает при инфаркте миокарда
Инфаркт миокарда – это поражение сердечной мышцы, вызванное внезапным нарушением ее кровоснабжения из-за тромбоза (закупорки) одной из сердечных артерий. Последствия инфаркта можно свести к минимуму, если быстро восстановить кровоток в пораженном сосуде. Наиболее эффективным методом для этого является стентирование.
Из-за чего возникает и как развивается инфаркт миокарда?
В стенках сердечных артерий с возрастом образуются атеросклеротические бляшки. Бляшка уменьшает просвет сосуда, но может никак не проявлять себя до тех пор, пока не случается ее разрыв. На поврежденной бляшке за несколько минут образуется тромб, который перекрывает просвет сосуда. К участку сердечной мышцы прекращается доступ кислорода и питательных веществ. Мышечные клетки на этом участке перестают сокращаться и, если не восстановить кровообращение в течение часа, погибают. Возникает очаг омертвения (некроза). Это и есть инфаркт миокарда.
Как проявляется инфаркт миокарда?
Главный симптом инфаркта миокарда — сильная боль за грудиной. Она может распространяться на левую руку, плечо, шею, проявляться в спине. Часто боль сопровождается страхом. Вот как описывает свои ощущения один из пациентов: «Представьте себе, что вы разом проглотили половину твердого зеленого яблока. Кусок застрял на полпути — ни туда, ни сюда. И это очень больно, потому что распирает». Иногда инфаркт миокарда проявляется нетипичными симптомами: острой болью в животе, приступом астмы, спутанностью сознания и речи. В редких случаях, в основном у больных сахарным диабетом, инфаркт миокарда может протекать совершенно без боли, сопровождаясь только внезапной слабостью и одышкой.
Что делать при подозрении на инфаркт миокарда?
Немедленно вызвать cкорую медицинскую помощь. Самый эффективный метод лечения острого инфаркта миокарда — стентирование — можно выполнять только в стационаре с сосудистым отделением, куда больного нужно доставить как можно скорее.
При стентировании к закупоренной сердечной артерии в сжатом виде доставляют сетчатую металлическую трубочку – стент. В месте тромбоза стент расширяют.
В расправленном виде стент восстанавливает нормальный кровоток в сосуде и не дает его стенкам вновь сомкнуться. К пораженному участку сердечной мышцы начинают поступить кислород и питательные вещества — развитие инфаркта останавливается. Всю операцию проводят под местным наркозом, через небольшой прокол в артерии на ноге или руке. Чем раньше сделать стентирование при инфаркте миокарда, тем меньше пострадает сердечная мышца. Идеальным временем для проведения стентирования врачи считают 1,5-2 часа от начала симптомов. При отсутствии осложнений пациента могут выписать домой уже на следующий день после стентирования — он сохранит не только жизнь, но и работоспособность. Вовремя сделанное стентирование снижает смертность от инфаркта в несколько раз.
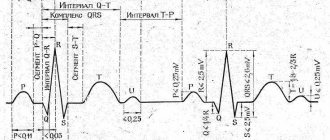
Термины, которые часто используют врачи
Распространенное выражение «инфаркт миокарда» знакомо многим, но сейчас врачи при первичной диагностике и выборе лечения чаще используют термин «острый коронарный синдром» (ОКС). Он включает в себя два диагноза: нестабильная стенокардия и собственно инфаркт миокарда. Нестабильная стенокардия проявляется внезапной болью в сердце и может быть предвестником инфаркта. Об инфаркте миокарда говорят, когда уже наступило поражение сердечной мышцы. ОКС проявляется в двух основных формах: ОКС с подъемом сегмента ST на электрокардиограмме, который в большинстве случаев заканчивается инфарктом миокарда, и ОКС без подъема сегмента ST, который может проявляться и как как инфаркт миокарда, и как нестабильная стенокардия.
Стентирование мочеточников при мочекаменной болезни: проблемы, пути решения
Стрельцова О.С., Крупин В.Н., Почтин Д.П., Юнусова К.Э., Щербатюк Т.Г., Яшанова М.И., Мамонов М.В.
Cреди урологической патологии мочекаменная болезнь (МКБ) занимает второе место в мире после воспалительных заболеваний почек и мочевыводящих путей, и встречается не менее чем у 3-4% населения планеты. По данным статистики в Российской Федерации МКБ составляет 38-40% всей урологической патологии, причем в 70% случаев болезнь выявляют у пациентов трудоспособного возраста (20-60 лет) [1]. После эндоскопического удаления камней, после обширных полостных операций на мочевой системе, при угрозе обструкции мочеточника или перфорации его при травматичных вмешательств, возникает необходимость установки катетера-стента с целью поддержания просвета мочеточника. [2]. Дренирование мочеточниковыми стентами может осуществляться сроком до трех месяцев, а при необходимости и более. Одной из основных проблем длительного пребывания стента в просвете мочеточника является его инкрустация солями, а также высокая вероятность бактериальной колонизации. Несмотря на поиски различных способов устранения этой проблемы вопрос остается по-прежнему не решeнным.
Целью работы явилось изучение влияние лекарственного препарата «Роватинекс» на состояние мочи и стентов у больных МКБ.
МАТЕРИАЛЫ И МЕТОДЫ
Изучены результаты хирургического лечения 1579 больных мочекаменной болезнью, из них 368 пациентам (23,3%) в мочеточник были установлены катетеры – стенты. Целью стентирования явилось купирование воспалительного процесса в почке как в период подготовки к плановой операции, так и в послеоперационном периоде. Обструкция стента солевыми наслоениями, развитие бактериальной инфекции были ведущим показанием для рестенирования.
В качестве препарата, профилактирующего литогенную инкрустацию стентов, в комплексном лечении был применен лекарственный препарат Роватинекс (РоваФармасьютикалз Лимитед, Ирландия), имеющий шестидесятилетний положительный опыт применения.
Проведен анализ лабораторных показателей мочи (анализ мочи, посев мочи на флору) и состояния стентов после их удаления у 40 больных: 20 – традиционного ведения (группа К), 20 – получавших с момента установки стента до шести недель «Роватинекс» по две капсулы три раза в день (группа Р). При этом 10 пациентов имели обычный питьевой режим (Р1), 10 употребляли жидкость более 2 литров в день (Р2). В исследовании использованы термопластичные стенты одной фирмы. Среднее время дренирования почек стентом составило 32+10 дней. После удаления все стенты были оценены визуально и тактильно на наличие солевых наслоений. Поперечный их срез исследовали методом световой микроскопии при увеличении окуляра 10х10.
Для определения способности мочи к кристаллизации у больных, получающих Роватинекс, нами впервые был применен метод клиновидной дегидратации.
Метод клиновидной дегидратации, описанный В.Н. Шабалиным и С.Н Шатохиным, основан на анализе кристаллической структуры биологической жидкости, позволяет визуализировать системную структурную организацию биологической жидкости при переводе ее в твердую фазу путем высушивания капли на предметном стекле [3, 4].
Изучено 63 твердых образца мочи от 14 пациентов: у 7 больных с МКБ мочу забирали до приема препарата Роватинекс и через 5 дней на фоне его приема. Для сравнения изучали высушенные капли мочи 7 здоровых респондентов. Особенности стуктуропостроения кристаллов мочи от каждого пациента оценивали по трем твердым (высушенным) образцам. Высушенные образцы мочи (фации) исследовали с помощью светового микроскопа в проходящем свете. Фотографирование фаций производили с помощью микроскопа МикМед 1 и цифровой фотокамеры CanonPowerShort A480 с последующим формированием компьютерной базы изображений. Анализ фаций включал в себя определение наличия и характеристик зон и детальное описание особенностей структуропостроения каждой зоны. Процесс кристаллообразования фации оценивали по 4-х балльной шкале по степени выраженности показателя: 0отсутствие кристаллов, 1-слабая степень выраженности, 2 – умеренная степень выраженности, 3 – высокая степень выраженности. При необходимости вводились промежуточные значения (1,5 и 2,5). На рисунке 1 представлены варианты образцов мочи здоровых пациентов.
РЕЗУЛЬТАТЫ
В посевах мочи на флору до установки стентов в обеих группах флора была выделена в 22,5% (9/40)в титре более 103 КОЕ/мл. Преобладали Е.coli, Enterococcus spp., Klebsiella, Staphylococcus spp. Перед удалением стента в группе К флора была выявлена в трех случаях, в группе Р – все посевы мочи были отрицательные. Исходно количество лейкоцитов в моче более 7 в поле зрения в группах выявлено у 12 и 10 пациентов соответственно. Перед удалением стента воспалительный процесс по лабораторным показателям в группе Р зафиксирован в трех случаях, в группе контроля в два раза чаще – в шести. Количество лейкоцитов в анализе мочи по Нечипоренко в группе К составило 3650 в 1 мл, в группе Р – не превышало референсных значений. Количество выделяемой в сутки мочи отличалось. В группе Р в среднем 1750+250 мл (Р1-1500 – 1750 мл, Р21800 – 2100 мл), в группе К – 1150+ 250 мл (от 900 до 1400 мл). Относительная плотность мочи в группе Р составила 1009-1018, в группе К1014-1030.
Визуальный анализ удаленных стентов больных группы К: в 45% (n=9) они меняли цвет на более темный или приобретали тусклую шероховатую поверхность – свидетельство агрессивного действия мочи. Из них в 25% случаях (n=5) имелись солевые наслоения. В группе Р – визуально литогенные наслоения отсутствовали.
При световой микроскопии 90% стентов (n=18) больных группы К имели литогенные наслоения (рис. 2, К а, б, в ). У получавших Роватинекс менее интенсивные инкрустации выявлены в 45% (n=9), причем на фоне обычного питьевого режима в 7 случаях из 10 (рис. 2, Р 1 а1, б 1,в1), на фоне усиленной водной нагрузки – у 2 из 10 (рис. 2, Р2 а2, б2, в2).
Рис.1. Исследование мочи методом клиновидной дегидратации у здоровых пациентов: а, б – варианты нормы. Выраженность кристаллообразования в фациях в баллах: медиана 3; среднее 2,6
Рис.2. Исследование мочеточниковых стентов методом световой микроскопии в группах: К а,б,в примеры стенов пациентов группы контроля; Р1, Р2 примеры стентов пациентов, получавших Роватинекс; а1, б1, в1 при обычном питьевом режиме; а2, б2, в2 на фоне усиленной водной нагрузке
Метод клиновидной дегидратации. Характеристика структурообразующих элементов дегидратированной капли мочи на фоне приема Роватинекса отличалась от исходной: после введения препарата наблюдалось разнонаправленное изменение структуры фации. После приема фитопрепарата (9 фаций – 42,9% от трех пациентов) наблюдалось увеличение количества кристаллов (медиана до лечения – 1, после лечения – 2), при этом было зарегистрировано появление кристаллов «крестовидной» и «дендритной» форм, характерных для здоровых волонтеров (рис. 3 а1, б1). У одного пациента после лечения наблюдалось изменение в структуре «подложки» фации, а именно увеличение ее «пористости». Анализ показал, что исходно у этих больных была зарегистрирована лейкоцитурия – более 70 лейкоцитов в поле зрения.
У трех пациентов, количество лейкоцитов в анализе мочи которых соответствовало норме, после пятидневного приема Роватинекса наблюдалось уменьшение кристаллообразования (медиана до лечения 1,5, после – 1) – 9 фаций, что составило 42,9%. Причем в двух случаях наблюдалось уменьшение размеров кристаллов и изменение их формы на «неопределенную» по сравнению с показателями кристаллов фации больных до лечения (рис. 3: в1, г1); и у одного больного наблюдалось полное отсутсвие кристаллов.
Рис. 3. Исследование мочи методом клиновидной дегидратации до и через 5 дней с момента начала приема фитопрепарата (описание в тексте).
Применение препарата никак не отразилось на кристаллической структуре фации мочи у одного пациента (медиана-1). Пациент Г. (68 лет) с двухсторонним нефролитиазом после чрескожной пункционной нефролитотрипсии с одной стороны три недели находился со стентом. Госпитализирован для замены стента в связи обструкцией его солями, обострением пиелонефрита: фебрилитет, в общем анализе мочи лейкоциты до 100 в поле зрения. В стационаре проведено эмпирическое лечение цефалоспориновым антибиотиком третьего поколения. За 5 дней до замены стента в лечение введен Роватинекс. Стент заменен. В контрольном анализе мочи лейкоцитов 150 в поле зрения, единичные кристаллы мочевой кислоты на фоне кислой реакции мочи (рH 5,0). На фоне приема Роватинекса при выраженной лейкоцитурии усиления кристаллообразования не зафиксировано (рис. 3 д, д1).
Генез литогенных наслоений многофакторный, в связи с чем соблюдение известных общих принципов метафилактики МКБ, а также индивидуальной схемы ведения больного МКБ со стентом неукоснительно должно соблюдаться пациентом и врачом. Результат некорректного ведения больного представлен на рисунке 4. Стент больному С., 51 года, был установлен в связи с травматичной трипсией камня мочеточника, конверсией в уретеролитотомию. В связи с дизурией пациент ограничивал прием жидкости до 600 – 700 мл в сутки, получал по рекомендации врача ЦРБ фурамаг 100 мг 3 раза в сутки, что является нерациональным при калькулезном пиелонефрите. Выяснено, что Роватинекс после выписки из стационара получал неполным курсом, лишь 10 суток. При УЗИ лоханочный конец катетера инкрустирован солями. В анализе мочи: уд. вес – 1008, лейкоцитов – 60 в поле зрения, эритроцитов – 3-5 в поле зрения. Удаление стента выполнено на 28 день с момента установки в условиях операционной после механического разрушения солевых структур через уретероскоп щипцами (рис. 4).
Рис. 4. Стент пациента С. Время стояния 28 дней: а) визуальная характеристика: темного цвета, покрыт солями, пузырный и лоханочный концы с конкрементами. б) при световой микроскопии поперечный срез сужен солевыми наслоениями
ОБСУЖДЕНИЕ
Одной из основных причин развития «докаменного» нефролитиаза считают гипоксию почки [5]. В то же время доказано, что терпены, вещества из ненасыщенных углеводородов, влияют на микроциркуляторные процессы в почках и являются патогенетически обоснованными в комплексном лечении [6]. В препарате Роватинекс имеется шесть терпеновых компонентов (активные ингредиенты: пинен [α+β] 31,0 мг, камфен 15,0 мг, цинеол 3,0 мг, фенхон 4,0 мг, борнеол 10,0 мг, анетол 4,0 мг), выработанных из эфирных масел хвойных растений [7]. Терпены природного происхождения, входящие в состав Роватинекса, оказывают спазмолитическое, диуретическое и противовоспалительное действие. Они жирорастворимые и быстро усваиваются, претерпевают метаболические изменения в организме, превращаясь в глюкурониды, которые выводятся с мочой и являются стабилизаторами, препятствующими камнеобразованию.
Любые дренажи, стенты в частности, как инородные тела мочевых путей, сами являются факторам риска рецидива камнеобразования. Вокруг стентов развивается асептическое воспаление со всеми присущими этому процессу молекулярными и клеточными реакциями [8-10]. У больных со стентами даже небольшое бактериальное число патогенных микроорганизмов в моче способно привести к инфекционно-воспалительным изменениям с образованием биопленок на поверхности импланта, которые, в свою очередь, нечувствительны к используемым антибактериальным препаратам [11]. Анализ лабораторных показателей мочи в группах свидетельствует о противовоспалительном эффекте Роватинекса и препятствии прогрессии пиелонефрита. Наши результаты согласуются с данными других авторов, свидетельствующих о том, что у принимающих Роватинекс пациентов существенно реже развивается клинически значимая бактериурия. В работах И.В. Казанской [12] показано, что Роватинекс препятствует манифестации инфекционных осложнений и даже потенцирует антибактериальную терапию за счет воздействия на микроорганизм через более широкий спектр биохимических механизмов. Препарат может использоваться как в активной стадии воспаления в комбинации с антибактериальными препаратами, так и в качестве поддерживающей противорецидивной терапии [6]. Минимальные жалобы больных на присутствие стента в мочевом пузыре, клинико-биохимические показатели пациентов, принимавших фитопрепарат, свидетельствуют о его спазмолитическом и антисептическом эффектах.
В свою очередь, структурные патологические изменения надмембранной системы эпителия почечных канальцев, чем бы они ни были вызваны – бактериальным повреждением, ишемией и др., являются основными причинами усиленного выделения органического субстрата в литогенности мочи [13]. Любое изменение в составе мочи отражается на показателях ее «механических» характеристик (вязкости, структуре, поверхностном натяжении), которые определяют форму образующихся структур высыхающей капли биологической жидкости. Включение фитопрепарата в схему ведения больных со стентами не только препятствовало манифестации инфекционных осложнений, но и влияло на биохимические показатели мочи, на коллоиды мочи, соответственно на ее литогенные свойства, что подтверждено методом клиновидной дегидратации в нашем исследовании. Анализ структуропостроения мочи у больных МКБ, получающих Роватинекс, свидетельствует о его способности модулировать процесс формирования кристаллов и уролитов.
Компонентом комплексной профилактики инкрустации стентов солями должна быть водная нагрузка, влияющая на фактор насыщения для всех возможных преципитирующих солей.
В эксперименте на животных В.М. Брюхановым и соавт. продемонстрирована прямая зависимость литогенных процессов в тканях почек от изменений именно концентрации ионов в моче, а не от экскреции этих ионов [14]. Таким образом, важным параметром, поддерживающими работоспособность стентов, является объем суточной мочи. Результаты нашего исследования свидетельствуют о том, что Роватинекс стимулирует функцию почек, увеличивая диурез (группа Р1).
По данным разных авторов бактериальная контаминация дренажей, в том числе и мочевых стентов, происходит в срок от нескольких часов, до нескольких суток [11,13]. Методом клиновидной дегидратации определено, что назначение препарата Роватинекс уже через 5 суток влияло на формирование кристаллической структуры высушенной мочи.
ЗАКЛЮЧЕНИЕ
Назначение фитопрепарата Роватинекс, как компонента профилактики инкрустации стента солями, патогенетически оправдано по многим параметрам. Роватинекс способен оказывать комбинированный эффект на ключевые функции почек и потенцировать ингибирующий эффект камнеобразования. Режим профилактики литогенных наслоений на стенте необходимо вводить за несколько дней до планового стентирования. Обязательным компонентом профилактики должен быть увеличенный объем потребления жидкости.
ЛИТЕРАТУРА
1. Междисциплинарные проблемы в урологии. Руководство для врачей [под ред. П.В. Глыбочко, Ю.Г. Аляева]. М.: Медфорум, 2015.580 с.
2. Lukenda J, Biocina-Lukenda D. Stent, endovascular prosthesis, net or strut? What would British dentist Charles Stent (1807-1885) have to say on all this? Lijec Vjesn 2009;131(1-2):30-33.
3. Шабалин В.Н. Шатохина С.Н. Принципы аутоволновой самоорганизации биологических жидкостей. Вестник РАМН 2000;(3):45-49.
4. Шабалин В.Н., Шатохина С.Н. Морфология биологических жидкостей человека. М.: Хризостом, 2001. 304 c.
5. Татевосян А.С., Осипов А.А., Опольский А.Б., Татевосян Т.С. Способ консервативного лечения мочекаменной болезни и предупреждения рецидивного образования камней почек. Патент РФ публикация патента: 10.06.2005. URL: https://www.freepatent.ru/patents/2253366
6. Гуденко Ю.А., Казанская И.В., Лобжанидзе З.Д. Применение препарата Ровтинекс в детской урологии. Экспериментальная и клиническая урология 2013;(3):61-65.
7. Инструкция по медицинскому применению препарата Роватинекс. URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?idReg=85572&t=
8. Серегин А.В., Мулабаев Н.С., Толордава Э.Р. Современные аспекты этиопатогенеза мочекаменной болезни. Лечебное дело 2012;(4):4-10
9. Venkatesan N, Shroff S, Jeyachandran K, Doble M. Effect of uropathogens on in vitro encrustation of polyurethane double J ureteral stents. Urol Res 2011;39(1):29-37.
10. Rosman BM, Barbosa JA, Passerotti CP, Cendron M, Nguyen HT. Evaluation of a novel gel-based ureteral stent with biofilmresistant characteristics. Int Urol Nephrol 2014; 46(6):1053-1058.
11. Коган М.И., Шводкин С.В., Любушкин А.В., Мирошниченко О.В. Направления и перспективы в разработке урологических стентов (обзор литературы). Экспериментальная и клиническая урология 2014;(4):64-71
12. Казанская И.В., Бабанин И.Л., Ростовская В.В., Матюшина К.М., Воронцов А.Л. Влияние фитопрепарата «Роватинекс» на уродинамику верхних мочевыводящих путей и дисметаболические процессы у детей с гидронефорозом и обструктивным мегауретером. Экспериментальная и клиническая урология 2015;(4):117-122.
13. Газымов М.М., Газымова Д.М., Филиппов Д.С. Мочекаменная болезнь: Этиотропное и патогенетическое лечение, метафилактика. Чебоксары: Издво Чуваш. ун-та, 2010.174 с.
14. Брюханов В.М., Зверев Я.Ф., Лампатов В.В., Жариков АЮ., Кудинов А.В., Мотина Н.В. Влияние питьевых режимов на движущие силы кристаллизации при экспериментальном нефролитиазе. Урология 2011;(1):6-11.
Журнал «Экспериментальная и клиническая урология» Выпуск № 3 за 2016 год
Тематики и теги
Мочекаменная болезнь
Журнал
Журнал «Экспериментальная и клиническая урология» Выпуск №3 за 2016 год
Комментарии
Для отправки комментариев необходимо войти или зарегистрироваться