В кардиологии существует понятие отклонений, не несущих вреда здоровью человека, поэтому рассматриваемых врачами как вариант нормы. Одно из таких явлений – синдром наджелудочкового гребешка. Столкнувшись с диагнозом впервые, пациенты проявляют беспокойство и ищут пути преодоления проблемы. Медики сходятся во мнении, что явление не несёт опасности для жизни и здоровья, поэтому не нуждается в лечении или коррекции. Чаще синдром встречается у детей и обусловлен индивидуальными особенностями строения сердца.
Причины возникновения синдрома
Говоря об этиологии явления, специалисты приходят к выводу о том, что невозможно выделить ряд причин, приводящих к его развитию. Прежде всего необходимо отметить, что гребешковый синдром – это не болезнь. Обусловлен же он физиологическими особенностями строения сердца человека.
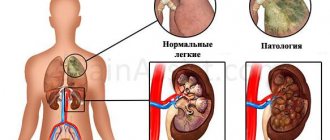
Главный орган кровеносной системы состоит из четырёх камер. Поступая в сердце, кровь попадает в правое предсердие, после – в правый желудочек. Проходя через клапан и поступая к лёгким, где происходит газообмен, кровяной поток возвращается к левому предсердию, далее – в левый желудочек и уже оттуда идёт в главную артерию – аорту.
Правый желудочек, в котором и расположен так называемый гребешок – начало малого круга кровообращения. Представляет собой одну из четырёх сердечных камер. От левого его отделяют межжелудочковые борозды, а от одноимённого предсердия он отгорожен венечной бороздой.
Форма данной сердечной камеры – неправильная пирамида, состоящая из трёх граней, с плоской задней и выпуклой передней и внутренней стенками, одна из которых образует перегородку с левым желудочком.
Будучи полым образованием, данная камера состоит из двух отделов, один из которых (передний, так называемый артериальный конус) узкий, а второй (задний) более широкий.
Между предсердием и желудочком расположен клапан, который не позволяет произойти обратному забросу крови.
В правом желудочке, равно как и в левом, есть особые структуры, которые относятся к проводящей системе сердца, и отвечают за координацию работы разных его отделов. К этим образованиям относятся волокна, узлы и пучки – именно последние и образуют так называемый гребешок. Отклонения в его работе, которые, однако, являются вариантом нормы, и вызывают явление, называемое синдромом наджелудочкового гребешка.
Иногда описываемое состояние ошибочно называют синдром поджелудочного гребешка, у детей оно диагностируется довольно часто и гораздо реже – у взрослых пациентов.
Этиология
Наджелудочковый гребешок представляет собой пучок мышечных волокон сердца, который располагается в правом желудочке, между задним и передним его отделами, и принимает активное участие в так называемом круговороте кровообращения. Через него проходит правая ножка пучка Гиса, при нарушении работы которого и говорят о развитии синдрома поджелудочного гребешка.
Мышечные волокна обладают свойством сокращаться. А так как у детей сердце бьется намного быстрее, при проведении ЭКГ и выявляются подобные изменения. Они являются пределами нормы и не требуют стороннего вмешательства, но только в том случае, если до этого у ребенка не было выявлено сердечных патологий. Если же они были, то при диагностировании синдрома, врачи также назначают УЗИ и уже после этого определяются, требуется ли малышу специальное лечение или нет.
Если же во время проведения электрокардиограммы у ребенка не были выявлены шумы и от него не поступает никаких жалоб, то в проведении терапии вообще нет нужды. Как только детский организм окрепнет и его сердце начнет работать как у взрослого, признаки синдрома на ЭКГ исчезнут.
У людей старше 18 лет нарушения в работе наджелудочного гребешка могут спровоцировать различные патологии:
- Порок сердца.
- Ишемическая болезнь.
- Стенокардия.
- Аритмия и т.д.
Но нужно также сказать, что и у взрослого человека наличие данного синдрома не оказывает негативного влияния на работу сердца. Поэтому при постановке такого диагноза требуется просто периодически проходить ЭКГ. Лечение необходимо осуществлять только в том случае, если при прохождении электрокардиограммы будут выявлены более серьезные нарушения в функциональности органа.
Характерные признаки
Выраженных внешних симптомов синдром гребешка не имеет, внутренне он также не доставляет ни боли, ни дискомфорта. Обнаруживается при проведении кардиограммы.
У взрослых
Синдром у взрослых пациентов (лиц, достигших восемнадцатилетнего возраста) диагностируется крайне редко. Обусловлено это тем, что с годами сердечные структуры становятся полностью сформированными и функционируют стабильно. Тем не менее синдром гребешка на ЭКГ у взрослых в редких случаях всё же фиксируется. Кроме того, что явление регистрируется на термобумаге в процессе исследования, оно больше ничем себя не проявляет.
У детей
У ребёнка или подростка отклонения данного рода фиксируются довольно часто и вызывают напрасные опасения у родителей. Как и в случае со взрослыми пациентами, такие состояния не вызывают болезненных ощущений или стойкого дискомфорта в покое. У некоторых пациентов могут возникать такие симптомы:
- учащённое сердцебиение;
- быстрая утомляемость;
- боль в грудной клетке после значительных физических нагрузок.
При наличии синдрома ЭКГ у ребенка показывает некоторые отклонения от нормы, которые и являются единственным его подтверждением.
Диагностика и лечение
Для принятия решения о возможных методах лечения того или иного заболевания специалист отправляет пациента на комплексное обследование.
Диагностика
Достоверную картину при диагностировании описываемого состояния может дать лишь один метод инструментального обследования – электрокардиограмма. Исследование, как правило, проводится в случае жалоб по поводу сопутствующего заболевания либо в профилактических целях. Таким образом, отклонения в работе наджелудочковых структур обнаруживаются случайно. Во время осмотра и простого прослушивания нарушения подобного рода не фиксируются.
Поскольку синдром преимущественно обнаруживается у детей, имеет смысл подробнее рассмотреть, по каким ЭКГ-признакам делается вывод о его наличии.
- Меньшая длина линии интервалов P-Q, Q-T.
- Уменьшенная ширина желудочкового комплекса.
- Отклонение электрической оси сердца вправо.
- Разница между сердечными сокращениями более десяти процентов.
- Преобладание правого желудочка перед левым.
- Изменение амплитуды зубцов (завышение).
- Отрицательные зубцы Т в схеме V1-V3.
- Физиологическая альтернация желудочкового комплекса.
- Расщепление комплекса QRS в отведении V4.
- Деформация желудочкового комплекса (на записи выглядит как зазубренность восходящего колена зубца S или как узкий, с малой амплитудой r’ в схеме V3R — V5R и V1).
Вышеописанные особенности являются вариантом нормы для детей. Некоторые из них обусловлены физиологически малой (для данного возраста оптимальной) толщиной грудной стенки, другие – расположением органа в грудной клетке. Когда речь идёт о взрослом пациенте с некоторыми из вышеуказанных признаков, проявляющихся на кардиограмме, имеют место индивидуальные особенности функционирования сердца.
Поскольку иногда синдром может вызывать дискомфорт после больших физических нагрузок, имеет смысл говорить о дифференциальной диагностике. Так, нередко за сердечную боль могут принять неприятные ощущения, вызванные сбоем в работе поджелудочной железы, желудка и так далее.
Лечение
Поскольку рассматриваемое состояние не является заболеванием и не представляет опасности для здоровья и жизни человека, в лечении или коррекции оно не нуждается.
Мнительные пациенты, особенно если речь идёт о родителях ребёнка, у которого отмечаются ЭКГ симптомы синдрома наджелудочкового гребешка, часто настаивают на лечении и оказании медицинской помощи. В таких случаях могут быть прописаны витаминно-минеральные комплексы и некоторые иные препараты для профилактики заболеваний и для укрепления сердечно-сосудистой системы.
Взрослые пациенты могут попасть в группу риска развития сердечно-сосудистых недугов в следующих случаях:
- наследственная предрасположенность;
- наличие вредных привычек (курение, злоупотребление алкоголем);
- повышенный уровень холестерина в крови;
- высокие показатели артериального давления;
- малоподвижный образ жизни;
- лишний вес.
В таких случаях стоит озаботиться профилактикой, для чего рекомендуется проконсультироваться с кардиологом. Возможен приём таких препаратов:
- В чистом виде витамины – A, B1, B6, E, C, P, F, Q10.
- В чистом виде минеральные вещества – калий, магний, кальций, фосфор, селен.
- «Аскорутин».
- «Аспаркам».
- Другие витаминно-минеральные комплексы, сбалансированные по составу и назначаемые в случае наличия причин для развития заболеваний.
- К профилактике можно отнести коррекцию образа жизни, правильное питание, умеренную физическую активность и отсутствие вредных привычек.
Синдром преждевременного возбуждения желудочков.
Нарушения ритма сердца считаются важной кардиологической проблемой, поскольку нередко осложняют течение и ухудшают прогноз многих заболеваний и являются одной из самых частых причин внезапной смерти.
Особый интерес как клиницистов, так и электрофизиологов вызывает синдром преждевременного возбуждения желудочков (СПВЖ), который в одних случаях, при отсутствии клинических проявлений, может быть электрокардиографической находкой, а в других – сопровождаться опасными для жизни тахиаритмиями.
Несмотря на успехи, достигнутые в изучении СПВЖ, вопросы его диагностики, тактики ведения больных и лечения остаются актуальными и в настоящее время.
Определение. Классификация
СПВЖ (синдром предвозбуждения, преэкситации, preexcitation syndrome) – это ускоренное проведение импульса возбуждения от предсердий к желудочкам по дополнительным аномальным проводящим путям. В результате часть миокарда или весь миокард желудочков начинают возбуждаться раньше, чем при обычном распространении возбуждения по атриовентрикулярному узлу, пучку Гиса и его ветвям.
Согласно рекомендациям группы экспертов ВОЗ (1980) преждевременное возбуждение желудочков, не сопровождающееся клинической симптоматикой, называют «феноменом предвозбуждения», а в случае, когда имеются не только электрокардиографические признаки предвозбуждения, но и развиваются пароксизмы тахиари.
Анатомическим субстратом СПВЖ служат пучки специализированных мышечных волокон вне проводящей системы сердца, способные проводить электрические импульсы к разным участкам миокарда, вызывая их преждевременное возбуждение и сокращение.
Дополнительные предсердно-желудочковые соединения классифицируют по их расположению относительно фиброзных колец митрального или трикуспидального клапанов, типу проводимости (декрементный тип – нарастающее замедление проведения по дополнительному пути в ответ на увеличение частоты стимуляции – или недекрементный), а также по их способности на антеградное, ретроградное или сочетанное проведение. Обычно дополнительные проводящие пути имеют быстрое недекрементное проведение, аналогичное таковому в нормальной ткани проводящей системы Гиса–Пуркинье и миокарда предсердий и желудочков.
В настоящее время известно несколько видов аномальных проводящих путей (трактов):
- предсердно-желудочковый (Кента), соединяющий миокард предсердий и желудочков в обход атриовентрикулярного узла;
- атрионодальный (Джеймса), расположенный между синоатриальным узлом и нижней частью атриовентрикулярного узла;
- нодовентрикулярный (Махейма), связывающий атриовентрикулярный узел (или начало пучка Гиса) с правой стороной межжелудочковой перегородки или разветвлениями правой ножки пучка Гиса;
- атриофасцикулярный (Брешенмаше), соединяющий правое предсердие с общим стволом пучка Гиса.
Существуют также и другие дополнительные пути проведения, в том числе «скрытые», способные проводить электрический импульс ретроградно от желудочков к предсердиям. У небольшой (5–10 %) части больных имеется несколько аномальных путей проведения.
В клинической практике выделяют:
- синдром Вольфа–Паркинсона–Уайта (синдром WPW), обусловленный наличием пучков Кента;
- синдром Клерка–Леви–Кристеско (синдром CLC, синдром укороченного интервала Р-Q (R)), обусловленный наличием пучка Джеймса.
Электрокардиографические проявления СПВЖ зависят от степени преэкситации и постоянства проведения по дополнительным путям. В связи с этим выделяют следующие варианты синдрома:
- манифестный СПВЖ (на ЭКГ постоянно имеются признаки предвозбуждения);
- интермиттирующий (преходящий) СПВЖ (на ЭКГ признаки предвозбуждения имеют преходящий характер);
- латентный СПВЖ (ЭКГ в обычных условиях нормальная, признаки предвозбуждения появляются только в период пароксизма тахикардии или при провокации – физической нагрузке, электрофизиологическом исследовании (ЭФИ), вагусных или медикаментозных пробах);
- скрытый (на стандартной ЭКГ изменения не выявляются из-за проведения возбуждения по дополнительным путям только ретроградно).
Распространенность
По разным данным, распространенность СПВЖ в общей популяции составляет примерно 0,15 %. При этом пароксизмы тахиаритмий возникают у каждого второго пациента (в 80–85 % случаев – ортодромная тахикардия, 20–30 % – фибрилляция предсердий (ФП), 5–10 % – трепетание предсердий и антидромная тахикардия). Скрытый СПВЖ выявляют у 30–35 % больных.
СПВЖ – это врожденная аномалия, но клинически может проявиться в любом возрасте, спонтанно или после какого-либо заболевания. Обычно данный синдром манифестирует в молодом возрасте. В большинстве случаев иной патологии сердца у пациентов нет. Однако описываются сочетания СПВЖ с аномалией Эбштейна, кардиомиопатиями, пролапсом митрального клапана. Существует предположение о наличии взаимосвязи между СПВЖ и дисплазией соединительной ткани.
В семьях больных, страдающих этим синдромом, был выявлен аутосомно-доминантный тип наследования дополнительных проводящих путей у родственников I, II, III степени родства с различными клинико-электрокардиографическими проявлениями.
Частота случаев внезапной смерти у пациентов с СПВЖ составляет 0,15–0,6 % в год. Почти в половине случаев остановка сердца у лиц с СПВЖ – его первое проявление.
Исследования больных с СПВЖ, перенесших остановку сердца, ретроспективно определили ряд критериев, с помощью которых можно выявить лиц с повышенным риском внезапной смерти. К ним относят наличие следующих признаков:
- укороченного интервала R-R – менее 250 мс во время спонтанной или индуцированной ФП;
- симптоматической (гемодинамически значимой) тахикардии в анамнезе;
- множественных дополнительных путей;
- аномалии Эбштейна.
История
ЭКГ с укороченным интервалом P-Q и одновременно уширенным комплексом QRS впервые описали A. Cohn и F. Fraser в 1913 г. Единичные подобные случаи были описаны в последующем и некоторыми другими авторами, однако в течение многих лет причиной такой картины ЭКГ считалась блокада ветвей пучка Гиса.
В 1930 г. L. Wolff, J. Parkinson и P. White представили доклад, в котором электрокардиографические изменения такого типа рассматривали как причину пароксизмальных нарушений ритма сердца. Эта работа дала основание для проведения всесторонних исследований, направленных на выяснение патогенеза указанных изменений на ЭКГ, названных в последующем синдромом Вольфа–Паркинсона–Уайта.
Спустя два года M. Holzman и D. Scherf предположили, что в основе синдрома WPW лежит распространение импульса возбуждения по дополнительным предсердно-желудочковым путям. В 1942 г. F. Wood предоставил первое гистологическое подтверждение наличия мышечного соединения между правым предсердием и правым желудочком, выявленного при аутопсии больного 16 лет с эпизодами пароксизмальной тахикардии в анамнезе.
Несмотря на эти данные, активный поиск альтернативных механизмов развития синдрома продолжался до 1970-х, когда ЭФИ и хирургические методы лечения подтвердили теорию дополнительных проводящих путей.
Патогенез
Проведение импульсов от предсердий к желудочкам при СПВЖ происходит одновременно по нормальной проводящей системе сердца и по дополнительному пути. В проводящей системе на уровне атриовентрикулярного узла всегда наблюдается некоторое замедление проведения импульсов, не характерное для аномального тракта. В результате этого деполяризация определенного участка миокарда желудочков начинается преждевременно еще до распространения импульса по нормальной проводящей системе.
Степень предвозбуждения зависит от соотношения скоростей проведения в нормальной проводящей системе сердца, прежде всего в атриовентрикулярном узле, и в дополнительном пути проведения. Увеличение скорости проведения по дополнительному проводящему пути или замедление скорости проведения по атриовентрикулярному узлу приводят к повышению степени предвозбуждения желудочков. В некоторых случаях деполяризация желудочков может быть целиком обусловлена проведением импульсов по дополнительному пути. В то же время при ускорении проведения импульсов по атриовентрикулярному узлу или замедлении проведения по дополнительному пути степень аномальной деполяризации желудочков снижается.
Основное клиническое значение дополнительных путей проведения состоит в том, что они нередко включаются в петлю кругового движения волны возбуждения (re-entry) и способствуют таким образом возникновению наджелудочковых пароксизмальных тахиаритмий.
При СПВЖ чаще всего встречается ортодромная реципрокная наджелудочковая тахикардия, при которой импульс проводится антеградно по атриовентрикулярному узлу, а ретроградно – по дополнительному проводящему пути. Пароксизм ортодромной наджелудочковой тахикардии характеризуется частыми (140–250 в 1 мин), лишенными признаков преэкситации нормальными (узкими) комплексами QRS. В ряде случаев после комплекса QRS наблюдаются инвертированные зубцы Р, что указывает на ретроградную активацию предсердий.
При антидромной наджелудочковой тахикардии импульс циркулирует в противоположном направлении: антеградно – по аномальному проводящему пути, ретроградно – по атриовентрикулярному узлу. Пароксизм антидромной наджелудочковой тахикардии у больных с СПВЖ проявляется на ЭКГ частым регулярным ритмом (150–200 в 1 мин) с желудочковыми комплексами по типу максимально выраженной преэкситации (QRS і 0,11 с), после которых иногда выявляются инвертированные зубцы Р.
У 20–30 % пациентов с СПВЖ возникают пароксизмы ФП, при которых в результате антеградного проведения по дополнительному пути большого числа предсердных импульсов частота сокращений желудочков (ЧСЖ) может превышать 300 в 1 мин.
Клиника
Во многих случаях СПВЖ протекает бессимптомно и выявляется только электрокардиографически. У 50–60 % больных имеются жалобы на приступы сердцебиений, одышку, боль или дискомфорт в груди, чувство страха и обмороки. Особую опасность при СПВЖ приобретают пароксизмы ФП, поскольку они сопровождаются большой ЧСЖ, гемодинамическими нарушениями и нередко могут трансформироваться в фибрилляцию желудочков. В таких случаях у больных не только наблюдают синкопальные состояния, но и имеется высокий риск внезапной смерти.
Независимыми факторами риска развития ФП у пациентов с СПВЖ являются возраст, мужской пол и наличие в анамнезе синкопальных состояний.
Диагностика
Основным методом диагностики СПВЖ является ЭКГ.
При синдроме WPW на фоне синусового ритма выявляют укорочение интервала P-Q (<0,12 с) и D-волну (пологий наклон в первые 30–50 мс) на восходящей части зубца R или нисходящей части зубца Q, комплекс QRS обычно расширен (і0,11 с). Характерно также отклонение сегмента SТ и зубца Т в сторону, противоположную D-волне и основному направлению комплекса QRS.
Электрокардиографическими признаками синдрома CLC являются укорочение интервала P-Q (R), продолжительность которого не превышает 0,11 с, отсутствие в составе комплекса QRS дополнительной волны возбуждения – D-волны, наличие неизмененных (узких) и недеформированных комплексов QRS (за исключением случаев сопутствующей блокады ножек или ветвей пучка Гиса).
При СПВЖ, обусловленном функционированием пучка Махейма, определяется нормальный интервал P-Q при наличии D-волны.
Одновременное функционирование пучков Джеймса и Махейма приводит к появлению на ЭКГ признаков, характерных для синдрома WPW (укорочение интервала P-Q (R) и наличие D-волны).
В связи с распространением в последние годы хирургических методов лечения больных с СПВЖ (деструкция аномального пучка) постоянно совершенствуются способы точного определения его локализации.
На ЭКГ местоположение пучка Кента обычно определяют по направлению начального моментного вектора деполяризации желудочков (первых 0,02–0,04 с), который соответствует времени формирования аномальной D-волны. В тех отведениях, активные электроды которых располагаются непосредственно над участком миокарда, возбуждающимся аномально за счет пучка Кента, регистрируется отрицательная D-волна. Это указывает на распространение раннего аномального возбуждения в сторону от активного электрода данного отведения.
Особый практический интерес представляют возможности метода пространственной вектор-электрокардиографии, позволяющего с высокой точностью установить локализацию дополнительных проводящих путей.
Более подробную, по сравнению с данными ЭКГ, информацию о местоположении дополнительных путей проведения можно получить с помощью магнитокардиографии.
Однако наиболее достоверными и точными являются методы внутрисердечного ЭФИ, в частности эндокардиальное (предоперационное) и эпикардиальное (интраоперационное) картирование. При этом с помощью сложной методики определяют область наиболее ранней активации (предвозбуждения) миокарда желудочков, которая соответствует локализации дополнительного аномального пучка.
Лечение
У больных с бессимптомным течением СПВЖ лечения обычно не требуется. Исключение составляют лица, в семейном анамнезе которых были случаи внезапной смерти, спортсмены и те, чья работа связана с опасностью для самих себя и окружающих (например, водолазы и летчики).
При наличии пароксизмов наджелудочковой тахикардии лечение заключается в купировании приступов и их профилактике с помощью различных медикаментозных и немедикаментозных методов. При этом важное значение имеет характер аритмии (орто-, антидромная тахикардия, ФП), ее субъективная и объективная переносимость, ЧСЖ, а также наличие сопутствующих органических заболеваний сердца.
При ортодромной реципрокной наджелудочковой тахикардии импульс возбуждения проводится антеградно нормальным путем, поэтому ее лечение должно быть направлено на угнетение проводимости и блокаду импульсов в атриовентрикулярном узле. С этой целью используют рефлекторные вагусные пробы, которые наиболее эффективны при возможно более раннем применении.
Препаратом первого ряда для купирования ортодромной реципрокной наджелудочковой тахикардии считают аденозин, потенциальным недостатком которого является преходящее повышение возбудимости предсердий, способное провоцировать их экстрасистолию и фибрилляцию сразу же после купирования пароксизма такой тахикардии. Другим средством выбора для купирования ортодромной тахикардии при отсутствии выраженной артериальной гипотензии и тяжелой систолической сердечной недостаточности принято считать верапамил. В качестве препаратов второго ряда обычно используют b-адреноблокаторы.
При неэффективности этих средств применяют новокаинамид с целью блокады проведения через добавочный атриовентрикулярный путь. По своей безопасности и эффективности новокаинамид является препаратом выбора при лечении тахикардии с широкими комплексами QRS, когда диагноз ортодромной реципрокной наджелудочковой тахикардии вызывает сомнения.
Препаратами резерва являются амиодарон, соталол и антиаритмические препараты (ААП) 1С класса: пропафенон или флекаинид.
При антидромной реципрокной наджелудочковой тахикардии импульс проводится ретроградно через атриовентрикулярный узел, поэтому применение верапамила, дилтиазема, лидокаина и сердечных гликозидов для ее купирования противопоказано в связи со способностью данных препаратов ускорять антеградное проведение по добавочному пути и тем самым увеличивать ЧСЖ. Применение этих средств, а также аденозина может провоцировать переход антидромной наджелудочковой тахикардии в ФП. Препаратом выбора для купирования такой тахикардии является новокаинамид, при неэффективности которого используют амиодарон или ААП 1С класса.
При возникновении пароксизма ФП основной целью медикаментозной терапии является контроль частоты ритма желудочков и замедление проводимости одновременно по добавочному пути и АВ узлу. Препаратом выбора в таких случаях также является новокаинамид. Высокоэффективно и внутривенное введение амиодарона и ААП 1С класса.
Следует отметить, что применение верапамила, дигоксина и b-адреноблокаторов при ФП с целью контроля ЧСЖ у лиц с СПВЖ противопоказано из-за их способности увеличивать скорость проведения по добавочному пути. Это может перенести фибрилляцию с предсердий на желудочки.
Для профилактики пароксизмов наджелудочковых тахиаритмий, обусловленных наличием дополнительных проводящих путей, используют ААП IА, IС и III классов, обладающие свойством замедлять проведение по аномальным путям.
К немедикаментозным методам купирования приступов наджелудочковых тахиаритмий относят трансторакальную деполяризацию и предсердную (чреспищеводную или эндокардиальную) электрокардиостимуляцию, а для их профилактики – катетерную или хирургическую абляцию добавочных путей.
У больных с СПВЖ электрическую кардиоверсию применяют при всех формах тахикардии, которые сопровождаются выраженными нарушениями гемодинамики, а также при неэффективности медикаментозной терапии и в случаях, когда она вызывает ухудшение состояния больного.
Радиочастотная катетерная абляция добавочных путей является в настоящее время основным методом радикального лечения СПВЖ. Показаниями к ее выполнению являются высокий риск внезапной смерти (прежде всего наличие пароксизмов ФП), неэффективность или плохая переносимость медикаментозной терапии и профилактики приступов наджелудочковой тахикардии, а также нежелание больного принимать ААП. В случае выявления короткого эффективного рефрактерного периода аномального тракта у лиц с редкими и нетяжелыми пароксизмами аритмии, вопрос о целесообразности абляции в целях профилактики внезапной смерти решается индивидуально.
Перед катетерной абляцией выполняется ЭФИ, цель которого – подтверждение наличия дополнительного проводящего пути, определение его электрофизиологических характеристик и роли в формировании тахиаритмии.
Эффективность радиочастотной катетерной абляции высока (достигает 95 %), а летальность, связанная с процедурой, не превышает 0,2 %. Наиболее частыми серьезными осложнениями данного метода лечения являются полная атриовентрикулярная блокада и тампонада сердца. Рецидивы проведения по дополнительному пути возникают приблизительно в 5–8 % случаев. Повторная радиочастотная абляция, как правило, полностью устраняет проведение по дополнительным путям.
В настоящее время область применения хирургической деструкции добавочных путей значительно сузилась. При тех же показаниях, что и к катетерной абляции, к хирургическому лечению прибегают в случаях невозможности выполнения последней по техническим причинам или ее безуспешности, а также при необходимости проведения операции на открытом сердце в связи с сопутствующей патологией.
Литература
- Сычев О.С. Нарушения ритма сердца // Руководство по кардиологии / Под ред. В.Н. Коваленко. – К.: Морион, 2008. – С. 1059-1248, 1215-1218.
- ACC/AHA/ESC 2006 Guidelines for the management of patients with atrial fibrillation // Circulation. – 2006. – № 114. – P. 257-354.
- ACC/AHA/ESC Guidelines for the management of patients with supraventricular arrhythmias – executive summary // JACC. – 2003. – № 8. – Р. 1493-1531.
- Griffin B., Topol E. Manual of Cardiovascular Medicine. – The Lippincott Williams & Wilkins, 2004. – P. 1248.
- Hanon S., Shapiro M., Schweitzer P. Early history of the preexcitation syndrome // Europace. – 2005. – № 7. – P. 28-33.
- Keating L., Morris А., Brady W.О. Electocardiographic Features of Wolff–Parkinson–White syndrome // Emerg. Med. J. – 2003. – № 20. – Р.491-493.
Н.Т. Ватутин, Н.В. Калинкина, Е.В. Ещенко.
Донецкий национальный медицинский университет им. М. Горького;
Институт неотложной и восстановительной хирургии им. В.К. Гусака АМН Украины.
Укркардіо
Возможные осложнения и прогноз
Поскольку рассматриваемое явление не является патологией, возможных осложнений оно не имеет. Один из прогнозов развития синдрома – это неполная блокада правой ножки пучка Гиса, но описываемое состояние редко перетекает в такую форму. В случае возникновения блокады нарушается процесс проведения электрического импульса. Как правило, такое отклонение также рассматривается как вариант нормы, не проявляет себя и фиксируется лишь при проведении кардиограммы. Если отсутствуют сопутствующие заболевания, в лечении такое состояние не нуждается.
Прогноз при диагностированном синдроме наджелудочкового гребешка в отсутствие иных заболеваний сердца благоприятный.
(1 оценок, среднее: 5,00 из 5)
Патогенез
Кардиограмма ребенка имеет свои физиологические и патологические особенности. Стоит сказать, что изменения на ней зависят от возраста пациента, когда как для взрослого человека существует единая норма. Среди «детских» особенностей можно перечислить укорочение интервалов PQ и QT, комплекс GRS тоже сужается, иногда может наблюдаться аритмия, с сохранением положительного зубца Р.
Патофизиологи объясняют эти феномены тем, что у ребенка сердце бьется чаще, чем у взрослого. Потенциалы действий смещаются и наслаиваются друг на друга. Либо же возбуждение не успевает охватить все кардиомиоциты перед сокращением – так по ЭКГ появляются артефакты.
Синдром наджелудочкового гребешка – один из таких физиологических феноменов. Его наличие не свидетельствует о какой-либо патологии, поэтому врачи не акцентируют на нем внимание и со временем ребенок его перерастает.