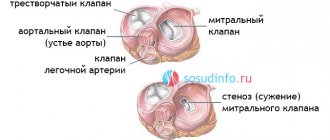
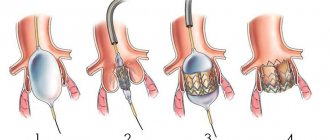
1.Замена сердечного клапана
Замена сердечного клапана
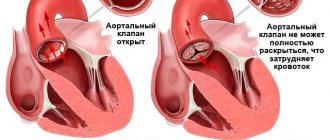
– в настоящее время это очень эффективная процедура с малым риском осложнений. Она показана больным с симптомами стеноза аортального клапана. Отказ от этой передовой хирургической технологии для некоторых больных означает существенное сокращение продолжительности жизни или опасность внезапной смерти. Если нет явных противопоказаний к операции (например, ишемическая болезнь сердца, перенесённый инфаркт), то обычно эта операция назначается и рекомендуется всем больным со степенью стеноза выше средней. При тяжёлых симптомах (боль в груди, обмороки, проблемы с дыханием) продолжительность жизни многих больных без операции на сердце не превышает 5 лет, поскольку заболевание со временем прогрессирует.
Операция по замене сердечного клапана может производиться открытым способом
или
малоинвазивно.
Хотя это довольно сложная процедура, огромный опыт такого хирургического лечения в настоящее время значительно снизил возможные риски. Все этапы отработаны до мелочей. Во время замены клапана учитывается возможность осложнений и внештатных ситуаций, поэтому операционная и медицинский состав подготавливаются с учётом разного развития ситуации в ходе операции.
Замена сердечного клапана проходит в восемь этапов.
Перед этим больной проходит
подготовку к операции
(амбулаторно или в условиях стационара), соблюдая определённые назначения и принимая ряд препаратов. В некоторых случаях необходима, наоборот, отмена регулярно принимаемых лекарств.
Обязательно для ознакомления! Помощь в лечении и госпитализации!
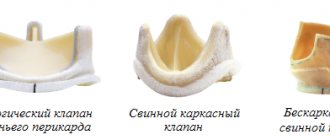
Различные виды протезов широко представлены в современной хирургии корня аорты. При протезировании аортального клапана (АК) механическим протезом существуют необходимость пожизненного приема антикоагулянтов, высокий риск тромбоэмболических осложнений, акустический дискомфорт. Протезирование АК бескаркасными протезами либо полное протезирование корня аорты ауто- или ксенографтом не всегда оправдано у пациентов пожилого и старческого возраста ввиду технической сложности такой операции. С этих позиций каркасные биопротезы занимают промежуточное положение, практически не отличаясь по технологии имплантации от механических протезов, этот тип ксеноклапанов позволяет отказаться от назначения пероральных антикоагулянтов через 3-6 мес после операции, что, безусловно, является значимым фактом у пациентов пожилого и старческого возраста.
В работе представлены 3-летние результаты имплантации низкопрофильного каркасного обработанного глютаральдегидом протеза БиоЛАБ КА/ПТ отечественного производства, который применяется в клинике нашего института с 2008 г. Существуют исследования, которые содержат рекомендации, рассматривающие данный ксеноклапан в качестве протеза выбора у пациентов старшей возрастной группы [2]. Однако в этих работах не проводился анализ факторов, формирующих транспротезный градиент давления, а также анализ влияния гемодинамических характеристик протеза на отдаленные результаты. Кроме того, не описано ни одного случая дисфункции биопротеза в различные сроки после операции. Наш опыт, описывающий как положительные, так и отрицательные впечатления от клинического применения этого биопротеза, может быть полезен не только кардиохирургам и кардиологам, но и исследователям, имеющим непосредственное отношение к разработке и производству ксеноклапанов.
Материал и методы
В период с декабря 2008 г. по декабрь 2011 г. 166 пациентам были имплантированы низкопрофильные ксеноперикардиальные биопротезы БиоЛАБ КА/ПТ в аортальную позицию. Средний возраст пациентов составил 69,3±4,5 года (60-82 года), из них 75 (45%) мужчин и 91 (55%) женщина. В среднем хроническая сердечная недостаточность у пациентов соответствовала III функциональному классу. Недостаточность кровообращения I стадии диагностирована у 5 (3%) больных, IIA стадии — у 122 (74%), IIБ стадии — у 39 (23%). Причиной формирования аортального порока у 113 (68%) пациентов были дегенеративные изменения, у 35 (21%) — хроническая ревматическая болезнь сердца, у 8 (5%) — патология врожденного двухстворчатого АК, у 10 (5%) — первичный инфекционный эндокардит. Средняя площадь поверхности тела составила (по DuBois) 1,7±0,1 м2 (1,3-2,2 м2). Размеры имплантируемых протезов определяли до операции, исходя из данных ультразвукового исследования и интраоперационной оценки размеров фиброзного кольца. Выбранный в соответствии с размером фиброзного кольца АК биопротез в течение 90 мин отмывали в изотоническом растворе натрия хлорида с трехкратной сменой последнего через каждые 30 мин. Следующим этапом имплантировали биопротез в аортальную позицию отдельными П-образными швами с использованием полиэфирных нитей 2-0. С целью имплантации протеза максимального диаметра предпочтение отдавали супрааннулярной позиции.
Протезы №20 имплантировали 53 (32%) больным, протезы №22 — 76 (46%), протезы №24 — 34 (20%), протезы №26 — 2 (1%). В 94 (60%) случаях коррекцию аортального порока выполняли в рамках комбинированного вмешательства на сердце (табл. 1)
.
Результаты
Уже к моменту выписки из клиники у большинства пациентов существенно уменьшились явления недостаточности кровообращения в большом и малом круге кровообращения, выросла толерантность к физической нагрузке.
На госпитальном этапе зафиксировали 5 (3%) случаев смерти после операции. У 4 (2,4%) больных причиной смерти явилась сердечная недостаточность, у 1 (0,6%) — острое нарушение мозгового кровообращения.
В период пребывания в стационаре отмечены 2 (1,2%) случая дисфункции протезов. У 1 пациента на 25-е сутки после операции диагностировали дисфункцию аортального протеза с формированием пикового чреспротезного градиента давления (ПЧГД) 72 мм рт.ст. Данному пациенту успешно выполнено деклотирование биологического протеза АК. На операции с желудочковой поверхности протеза в проекции комиссур обнаружен смешанный тромб. У второго пациента на 26-е сутки после операции по данным эхокардиографии с уровня створок протеза отмечалась выраженная струя регургитации, занимающая 50% объема левого желудочка (ЛЖ). Данному пациенту успешно выполнено повторное протезирование АК. На операции выявлено провисание левой коронарной створки в полость желудочка с нарушением коаптации в центральной части протеза (см. рисунок, а)
.
Рисунок 1. Удаленные во время повторной операции биопротезы БиоЛАБ КА/ПТ. а — провисание левой коронарной створки в полость желудочка с нарушением коаптации в центральной части протеза.
У одного пациента выявлено расслоение аорты II типа по Де Бейки на 30-е сутки после операции. Причиной отслоения интимы послужили выраженные атеросклеротические изменения сосудистой стенки в области аортотомного доступа. Этому пациенту успешно выполнили супракоронарное протезирование восходящего отдела аорты. Остальные осложнения, не потребовавшие повторной операции, представлены в табл. 2
.
Для выявления факторов, оказывающих наибольшее влияние на формирование градиента давления на биопротезе БиоЛАБ КА/ПТ, провели корреляционный анализ, предварительно исключив выпадающие значения («выбросы»). В анализ включили показатели ПЧГД, типоразмера протеза, площади поверхности тела (ППТ), индекса массы тела (ИМТ), ударного объема (УО) ЛЖ после операции, индексированные к ППТ послеоперационные показатели конечного диастолического объема ЛЖ, конечного диастолического размера ЛЖ и массы миокарда, фракцию выброса ЛЖ.
В ходе анализа выявлено, что ПЧГД находится в прямой и статистически значимой зависимости от ИМТ (r
=0,55) и УО ЛЖ (
r
=0,35), в обратной — от размера протеза (
r
= –0,27). Остальные параметры либо имели слабую связь с ПЧГД, либо не имели вовсе. Для выявления характера этой взаимосвязи провели нелинейный регрессионный анализ. При моделировании взаимосвязей функция зависимости ПЧГД от указанных величин выглядела следующим образом: ПЧГД=40,3+0,34·ИМТ+ 0,1·УО ЛЖ — 1,65·(№ протеза).
Согласно полученным данным, функциональное состояние миокарда, выраженное в величине фракции выброса ЛЖ, а также степень гипертрофии сердечной мышцы не оказывают статистически значимого влияния на формирование чреспротезного сопротивления току крови у пациентов данной группы.
Длительность пребывания в палате отделения реанимации составила 2,5±1,8 дня, в общем отделении — 21±10 дней.
В отсутствие показаний к постоянному приему пероральных антикоагулянтов (фибрилляция предсердий, тромбоз полостей сердца в анамнезе, сниженная сократительная способность миокарда, атриомегалия) антикоагулянтную терапию назначали на период, необходимый для эндотелизации оплетки протеза (6 мес).
Полнота наблюдения пациентов в течение трехлетнего периода составила 81% (128 пациентов), средний срок наблюдения — 28,9±7,4 мес (4-48 мес).
В отдаленном периоде умерли 2 (1,2% от выписанных) пациента. Причиной смерти в одном случае было неконтролируемое желудочно-кишечное кровотечение на фоне тяжелого сепсиса и синдрома диссеминированного внутрисосудистого свертывания. Пациент умер через 4 мес после операции. Патологоанатомическое исследование не проводили, однако по данным неоднократных контрольных ультразвуковых исследований сердца, признаков дисфункции биопротеза в аортальной позиции не выявили. В другом случае непосредственной причиной смерти стала дисфункция протеза, обусловленная острым протезным эндокардитом с некрозом тканей корня аорты, отрывом протеза на ⅔ окружности фиброзного кольца, что обусловило необходимость повторного хирургического вмешательства по жизненным показаниям через 4 мес после операции. Смерть больного была констатирована интраоперационно, а причиной смерти было признано неконтролируемое кровотечение.
Таким образом, актуарная выживаемость, рассчитанная по методу Каплана-Майера, к концу 1-го и 3-го годов наблюдения составила 98±2%.
При динамическом наблюдении у выживших пациентов отмечали положительную динамику физического статуса в виде уменьшения ФК (NYHA). Средний ФК при динамическом наблюдении у 92% пациентов составил II (р
<0,001 по сравнению с показателем до операции). Основные изменения ФК происходили в течение первого года после операции, сохраняясь в дальнейшем на практически неизменном уровне.
В исследуемой нами группе пациентов 5 больным (3% от выписанных) потребовалась повторная операция на АК в сроки от 4 до 40 мес после операции и 1 (0,6%) больного через 16 мес после исходной операции повторно оперировали по поводу дисфункции митрального протеза. В 5 из 6 случаев причиной дисфункции являлся протезный эндокардит. В одном случае дисфункция протеза была обусловлена провисанием одной из створок, аналогично случаю, представленному выше. У второго больного диагностировали парапротезную фистулу на протяжении 1 см с выраженным объемом сброса с уровня протеза. У 2 больных протезный эндокардит привел к структурной дисфункции протеза. В первом случае наблюдались сморщивание створок и отрыв одной из створок от стойки протеза, что привело к нарушению коаптации (см. рисунок, б)
.
Рисунок 1. Удаленные во время повторной операции биопротезы БиоЛАБ КА/ПТ. б — сморщивание створок и отрыв одной из створок от стойки протеза. Во втором случае через 40 мес после операции причиной дисфункции послужила кальциевая дегенерация биоткани. Кроме описанного летального случая, все пациенты успешно оперированы повторно.
Явления протезного эндокардита в раннем послеоперационном периоде (до 1 мес) наблюдались у 5% больных, однако они не приводили к изменениям имплантированных ксеноклапанов или параклапанных структур. Все эти случаи эндокардита были успешно купированы к моменту выписки. Таким образом, показатель 5% в раннем послеоперационном периоде мы считаем достаточно хорошим. Но развитие протезного эндокардита в течение 1 года после операции у 8% пациентов, выписанных в стабильном состоянии, без клинических, лабораторных или инструментальных признаков активной инфекции, мы расцениваем как достаточно высокий уровень риска. Возможно, данное осложнение связано с наличием синтетической оплетки протеза, которая становится местом оседания и размножения патогенной микрофлоры. Наиболее высокий риск развития протезного эндокардита наблюдается в первые 12 мес после операции и составляет 0,8-2,4%. В дальнейшем риск развития протезного эндокардита снижается до 0,1-0,2%. Учитывая данные, полученные в отношении риска раннего протезного эндокардита, следует рекомендовать проведение чреспищеводной эхокардиографии при любом подозрении на активность внутрисердечной инфекции, независимо от данных трансторакального ультразвукового исследования.
У 1 больного через 2 мес после операции диагностировали острый тромбоз подмышечной артерии, несмотря на постоянный уровень Международного нормализованного отношения в пределах 2,5-3,5. Этот случай был единственным, а число больных без тромбоэмболий и тромбозов (исключая тромбоз протеза в раннем послеоперационном периоде) составило 99±1% к концу 3-го года наблюдения.
«Малые» кровотечения (носовые, кровоточивость десен) наблюдали у 2 (1,2% от выписанных) больных.
Таким образом, актуарная частота отсутствия необходимости повторного хирургического вмешательства в отдаленном периоде составила 97±1% к концу 1-го года наблюдения и 92±4% к концу всего периода наблюдения, частота отсутствия структурной дисфункции — 98%.
Как при выписке, так и при динамическом наблюдении всем пациентам выполняли контрольную эхокардиографию, по данным которой отмечен статистически значимый регресс гипертрофии миокарда ЛЖ (табл. 3)
.
Динамика эхокардиографических параметров в зависимости от размера протеза представлена в табл. 4
.
Обсуждение
Современный этап развития хирургии приобретенных пороков сердца характеризуется повышением уровня безопасности и результативности хирургического лечения болезней сердца, разработкой новых экономичных и эффективных технологий, расширением спектра корригируемой патологии и сокращением числа противопоказаний к выполнению операции. Совершенствование хирургической техники, инструментария, методик искусственного кровообращения и защиты миокарда привели к значительному улучшению непосредственных результатов хирургического лечения аортальных пороков. Непосредственные результаты хирургического лечения порока определяются как его этиологией, исходной тяжестью течения заболевания и выраженностью изменений клапана, так и правильностью выбора метода и адекватностью коррекции [5]. Имплантация механических протезов клапанов сердца все еще сопряжена с такими недостатками, как необходимость постоянного приема антикоагулянтов, высокий риск развития тромбоэмболических осложнений, что существенно снижает качество жизни пациентов. Альтернативно используемые биологические протезы обеспечивают лучшее качество жизни, формируют структуру кровотока, близкую к физиологической, и у большинства больных не требуют приема антикоагулянтов [3, 4].
По данным зарубежных авторов [7], интерес к протезированию АК каркасными биопротезами не ослабевает. И причина тому — новые методы обработки и хранения ксеноткани, которые увеличили срок службы биопротезов, а также увеличение числа больных пожилого и старческого возраста. У пациентов старше 60 лет с имплантированным биологическим протезом риск кровотечения гораздо ниже, чем с механическими протезами. В 2002 г. впервые мировые продажи биологических заменителей превысили продажи механических клапанов на 100 млн долларов США при общей сумме 800 млн [6]. В России также с каждым годом увеличивается доля биопротезов: в 2007 г. число имплантированных биопротезов составляло всего 4% от общего числа, а в 2009 г. увеличилось до 10,5% [1]. Это обусловлено, с одной стороны, неудовлетворенностью хирургов отдаленными результатами применения механических протезов, в частности количеством специфических осложнений и качеством жизни пациентов, а с другой — разработкой новых перспективных конструкций и технологий изготовления биопротезов клапанов сердца.
Протезирование АК ксеноперикардиальным протезом сопровождается низкой летальностью как в ранние, так и в отдаленные сроки, низкой частотой развития специфических осложнений. Хорошие гемодинамические характеристики, устойчивость к инфекции, низкий риск тромбообразования и «больших» осложнений, обусловленных приемом антикоагулянтов, по мнению многих авторов, делают каркасные биопротезы реальной альтернативой современным механическим протезам. Достаточно низкая тромбогенность каркасных биопротезов позволила нам у большинства больных отказаться от пролонгированной или пожизненной антикоагулянтной терапии, что особенно важно у пациентов старшей возрастной группы, у которых она нежелательна. В то же время мы придерживались общепринятой методики, согласно которой постоянный прием антикоагулянтов под строгим контролем состояния свертывающей системы крови рекомендовали всем пациентам, у которых основным ритмом была фибрилляция предсердий, больным с низкой фракцией выброса ЛЖ и тромбозами полостей сердца в анамнезе.
Выводы
Величина пикового градиента давления крови на протезе БиоЛАБ КА/ПТ определяется формулой ПЧГД=40,3+0,34·ИМТ+ 0,1·УО ЛЖ — 1,65·(№ протеза). При динамическом наблюдении в сроки до 3 лет величина пикового транспротезного градиента давления статистически значимо не меняется.
У больных аортальным стенозом к концу 1-го года после имплантации каркасного биопротеза БиоЛАБ КА/ПТ отмечается уменьшение массы миокарда ЛЖ в среднем на 31% (с 212±0,14 до 155±38 г/м2; р
<0,001). Выраженность процессов обратного развития гипертрофии миокарда ЛЖ не зависит от размера имплантированного протеза (
р
>0,05).
Основным осложнением, обусловленным протезом, после имплантации ксеноклапана БиоЛАБ КА/ПТ является протезный эндокардит. Наиболее высокий риск развития протезного эндокардита наблюдается в первые 12 мес после операции и составляет 0,8-2,4%. В дальнейшем риск развития протезного эндокардита снижается до 0,1-0,2%.
2.Этапы операции
На первом этапе
больного подключают к кардиомониторам, обрабатывается грудная клетка, подводятся дыхательные трубки от аппарата искусственного дыхания, который подключается только после того, как начнет действовать наркоз (т.е. единственным дискомфортом для больного может стать некоторое першение и саднение в горле после операции).
Анестезиолог вводит пациента в состояние общего наркоза. С этого момента оперируемый не ощущает ничего.
Через пищевод в область сердца помещается ультразвуковое устройство, транслирующее изображение сердца на монитор в течение всей операции.
Второй этап
– это открытие грудной клетки. После разметки кардиохирург делает разрез на груди от вершины грудной клетки до пупка. При малоинвазивном методе длина разреза меньше на две трети.
Целью третьего этапа
является подключение к аппарату, обеспечивающему искусственное кровообращение. Во время операции обогащение крови кислородом происходит вне лёгких, затем она возвращается в аорту и движется по большому кругу кровообращения.
На этом этапе хирург останавливает сердце, промывает его и помещает в специальный раствор, поддерживающий его жизнеспособность вне кровообращения.
Четвёртый и пятый этапы
– это собственно замена клапана. Аорта разрезается, удаляется больной клапан. Если поражена и часть аорты, она тоже удаляется и ставится трансплантат. Отверстие клапана замеряется для подбора нового клапана нужного размера. Новый клапан пришивается, затем необходимо проконтролировать отсутствие истечений через него.
Шестой этап
– это отключение от аппарата искусственного кровообращения. Зашивается аорта, из полости сердца удаляется попавший в него воздух. Сердце начитает биться под током собственной крови. Если наблюдается неровный ритм, применяется электрошок, который восстанавливает ровный пульс.
Седьмой этап
– закрытие грудной клетки. Кости и ткани сшиваются, грудина закрывается швом, которые остаётся видимым на всю жизнь.
Вся операция обычно длится от 2 до 5 часов.
Немаловажным для исхода лечения является восьмой этап.
Начинается он в палате интенсивной терапии. Выписка из стационара происходит на 5-9 день после операции. Послеоперационная реабилитация продолжается амбулаторно.
Посетите нашу страницу Кардиология
Последствия и реабилитация в послеоперационный период
После операции пациент находится в отделении реанимации. Врачи наблюдают за состоянием больного, так как возможны негативные последствия и ему нужна будет реабилитация. В первые сутки могут быть такие осложнения, как внутреннее кровотечение, тромбоэмболия, нарушение сердечного ритма, инфекционный эндокардит, инфаркт (менее чем в 5 % случаев). Через двое суток пациенту разрешают вставать и ходить. В это время он может жаловаться на боли в грудной клетке и повышенную усталость. Выписывают пациента домой в сроки от 4 до 10 дней, где он находится под наблюдением врача.
Послеоперационный период длится 3 недели, в течение которого возможны временные нарушения сна, зрения, аппетита, отеки ног. Через месяц пациент проходит полное обследование. Кардиолог рассчитывает адекватную физическую нагрузку, диету, назначает поддерживающее лечение. Важно выполнять лечебную физкультуру для укрепления сердечной мышцы.
4.Срок функционирования сердечных клапанов
На сегодняшний день в хирургии сердца применяют два вида имплантатов сердечных клапанов: искусственные и биологические.
Первые — долговечные, но их установка связана с пожизненным приёмом ряда препаратов для устранения риска тромбообразования. Биологические клапаны наиболее близки живым тканям, но быстрее изнашиваются. Кардиологи постоянно ведут работу по разработке и внедрению в медицинскую практику новых типов клапанов, сочетающих в себе лучшие свойства обоих видов — долговечность и максимальную приемлемость для организма. Срок службы искусственных клапанов 10-15 лет. Более новые материалы пока только проходят изучение. Широкая практика их применения в ближайшем будущем даст кардиологам более точную информацию о сроке их службы.
Телемедицинская консультация в Центре Бакулева
По результатам консультации в телемедицинском отделе НЦССХ имени Бакулева пациентке показано оперативное лечение в условиях искусственного кровообращения — протезирование аортального клапана.
Поликлиника НЦССХ
Через две недели после телемедицинской консультации в поликлинике НЦССХ проведено обследование, по результатам которого уточнён диагноз:
«Кальцинированный порок аортального клапан — критический стеноз. Относительная митральная недостаточность. Относительная трикуспидальная недостаточность. Лёгочная гипертензия. Постоянная форма фибрилляции предсердий. Атеросклероз коронарных артерий. НК 2А. ФК 3».
Принято решение о госпитализации.
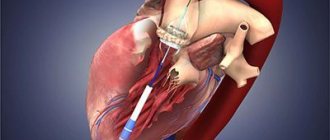
Подготовка к процедуре TAVI
За несколько дней до лечебной катетеризации вы пройдете диагностическую катетеризацию, в ходе которой медицинская бригада сможет наглядно ознакомиться с состоянием вашего клапана и всей сердечной мышцы в целом. Вас также попросят пройти анализ крови, чтобы проверить общие показатели крови, факторы коагуляции и пр. В день самой процедуры вас попросят на несколько часов воздержаться от приема пищи, даже если планируется местная анестезия или седация.