Публикации в СМИ
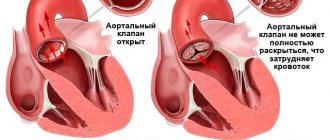
Стеноз трёхстворчатого клапана — сужение отверстия трёхстворчатого клапана, препятствующее поступлению крови из правого предсердия (ПП) в правый желудочек (ПЖ). Частота • Выраженный стеноз трёхстворчатого клапана наблюдают у 14–15% больных с пороками сердца • Соотношение мужчин к женщинам — 4:1.
Этиология • Ревматизм • Инфекционный эндокардит • Фиброэластоз субэндокардиальный • Врождённые аномалии (аномалия Эбштайна и др.) • Идиопатический кальциноз • Миксома правого предсердия • Вторичные опухоли правого предсердия (прорастание нефробластомы из нижней полой вены, метастазы).
Патофизиология • Нарушения гемодинамики сходны с таковыми при трикуспидальной недостаточности. Отличия состоят в том, что нет изменений ПЖ, и застой в большом круге кровообращения наступает и прогрессирует гораздо быстрее • Поскольку в подавляющем большинстве случаев трикуспидальному стенозу сопутствуют недостаточность и пороки других клапанов, общий патогенез складывается из соответствующих отдельных нарушений • По степени сужения отверстия клапана выделяют умеренный (2,5–3 см2), выраженный (1,5–2,5 см2) и резкий (менее 1,5 см2) стенозы.
Клиническая картина и диагностика
• Жалобы см. Недостаточность трёхстворчатого клапана.
• Клапанные симптомы •• Усиление I тона, щелчок открытия трёхстворчатого клапана •• При синусовом ритме — веретенообразный низкочастотный диастолический шум (усиливается на вдохе) •• Интенсивность и продолжительность шума зависят от диастолического транстрикуспидального градиента давления •• Аускультативная диагностика порока затруднена из-за звуковых феноменов, связанных с сопутствующими аномалиями других клапанов.
• Симптомы недостаточности кровообращения по большому кругу см. Недостаточность трёхстворчатого клапана.
• Симптомы основного заболевания (ревматизма, миксомы сердца).
Специальные исследования
• ЭКГ см. Недостаточность трёхстворчатого клапана.
• Яремная флебограмма: увеличение амплитуды волны A и пологий Y-спад.
• Рентгенография органов грудной клетки •• Выбухание дуги правого предсердия (при изолированном пороке — без отклонения контрастированного пищевода) •• Расширение теней полых вен •• Признаки сопутствующих поражений других клапанов •• При умеренном изолированном пороке может быть нормальная рентгенологическая картина.
• ЭхоКГ •• Расширение полости правого предсердия •• Расширение верхней полой вены •• Сращение, деформация и утолщение створок трикуспидального клапана, уменьшение амплитуды их раскрытия и куполообразное выбухание в диастолу •• В импульсноволновом допплеровском режиме определяют диастолический градиент давления •• Уменьшение площади отверстия трикуспидального клапана подсчитывают в допплеровском режиме (по градиенту давления) и В-режиме (за основу для диагностики берут наименьшее значение) •• Кандидатам на оперативное лечение измеряют внутренний диаметр фиброзного кольца •• Признаки других клапанных или врождённых аномалий •• Смещение фиброзного кольца клапана и атриализация ПЖ, а также увеличение амплитуды движения створок при аномалии Эбштайна •• Выявление объёмных образований при опухолях ПП •• Чреспищеводную ЭхоКГ проводят всем пациентам для исключения тромбоза ПП и вегетаций, даже при нормальном ритме.
• Катетеризация правых отделов сердца •• Увеличение давления в ПП, сглаженный Y-спад, крутой X-спад, увеличение амплитуды волны A и транстрикуспидального диастолического градиента давления •• При тяжёлом трикуспидальном стенозе, особенно в сочетании с митральным стенозом и лёгочной гипертензией, сердечный выброс низкий •• При опухолях правых отделов сердца катетеризация противопоказана.
• Правая атриография и коронарная ангиография. Проводят при подозрении на трикуспидальный стеноз, когда данных ЭхоКГ недостаточно, а также для диагностики других клапанных пороков и ИБС.
ЛЕЧЕНИЕ
• Консервативная терапия. Лечение правожелудочковой недостаточности: диуретики и венозные вазодилататоры (применять с осторожностью, поскольку для поддержания преднагрузки необходимо более высокое, чем обычно, ЦВД).
• Хирургическое лечение •• Показания ••• Стеноз III степени с выраженными клиническими проявлениями ••• Стеноз II степени при необходимости одномоментного вмешательства на сердце по поводу других заболеваний •• Противопоказания ••• Тяжёлая сопутствующая патология, угрожающая жизни больного ••• Терминальная стадия недостаточности кровообращения ••• Активность ревматического процесса не считают противопоказанием к оперативному лечению •• Методы хирургического лечения ••• Открытую комиссуротомию или баллонную вальвулопластику проводят при сохранности клапанного аппарата и при сопутствующей трикуспидальной недостаточности не выше I степени ••• В остальных случаях проводят протезирование клапана биологическим протезом или, реже, механическим ••• См. также Недостаточность трёхстворчатого клапана.
Специфические осложнения см. Недостаточность трёхстворчатого клапана.
Прогноз см. Недостаточность трёхстворчатого клапана.
Синонимы • Стеноз трикуспидального клапана • Стеноз правого предсердно-желудочкового отверстия • Трикуспидальный стеноз
Сокращения • ПЖ — правый желудочек • ПП — правое предсердие.
МКБ-10 • I07 Ревматические болезни трёхстворчатого клапана
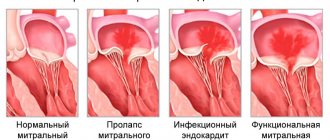
Трикуспидальный клапан (ТК) и его патология по сравнению с аортальным и митральным клапаном (МК) не получают должного внимания кардиологов и кардиохирургов. В результате имеется недостаток исследований и научных публикаций в этом направлении, в том числе в нашей стране. Точное понимание механизмов развития функциональной недостаточности ТК, определение тактики лечения при коррекции порока остаются до конца не решенной проблемой в клапанной хирургии сердца.
Под функциональной недостаточностью ТК, как правило, принято понимать недостаточность без структурных изменений элементов клапана на фоне дилатации и дисфункции правого желудочка (ПЖ), дисфункции левого желудочка (ЛЖ), легочной гипертензии, которые возникают при патологии МК, реже аортального клапана.
По данным разных авторов [10, 22, 37], функциональная недостаточность ТК встречается у 8—35% оперированных по поводу порока МК или аортального клапана.
Как известно, трикуспидальная регургитация (ТР) служит независимым прогностическим фактором прогрессирования хронической сердечной недостаточности и смерти после адекватной коррекции пороков МК и/или аортального клапана [11, 21, 25]. Так, по данным J. Nath и соавт. [47], годичная выживаемость для пациентов со II и III степенью регургитации составила 78,9 и 63,9% соответственно, независимо от функции ЛЖ, степени легочной гипертензии и возраста. При этом, по данным A. Calafiore и соавт. [16, 18], 5-летняя выживаемость пациентов со II и III степенью ТР после изолированной коррекции митрального порока составила 46%.
Этиологическим фактором в возникновении функциональной трикуспидальной недостаточности (ТН) являются патологические процессы, вызывающие пороки левых отделов сердца или легочную гипертензию [10, 41, 51, 53, 55]. Чаще всего это ревматическая болезнь сердца, ишемическая митральная недостаточность, миксоматозная дегенерация, дегенеративное (атеросклероз) поражение клапанов, инфекционный эндокардит левых отделов сердца, дилатационная кардиомиопатия, тромбоэмболия легочной артерии. В то же время в ряде исследований [59] достоверной связи между выраженностью порока МК и тяжестью ТН не находят.
Основным фактором развития регургитации большинство авторов [9, 27, 51, 55] считают дилатацию фиброзного кольца. По мнению G. Dreyfus и соавт. [25], дилатация фиброзного кольца — более объективный показатель тяжести ТН, чем степень ТР. С этим нельзя не согласиться, так как известно, что степень ТР, определяемая при эхокардиографии, может меняться в зависимости от пред-, посленагрузки и сократимости ПЖ. Считается, что при дилатированном кольце выраженная ТР с течением времени в большинстве случаев так или иначе проявится. С.Г. Суханов и соавт. [5] проследили результаты сочетанных операций — аннулопластики МК и реваскуляризации миокарда. Прогностическими факторами возникновения функциональной ТН после этих операций они считают дилатацию фиброзного кольца и фракцию выброса ЛЖ. Л.А. Бокерия и соавт. [1], кроме того, отмечают корреляцию между диаметром фиброзного кольца и степенью ТР.
Кроме, собственно, расширения фиброзного кольца, имеются данные об изменении и пространственной трехмерной конфигурации кольца в сторону его «уплощения» [8]. T. Ton-Nu и соавт. [60] исследовали трехмерную конфигурацию ТК у лиц без ТР и имеющих регургитацию на клапане. В группе без регургитации кольцо клапана имеет отчетливо более высокое положение переднезадних сегментов (относительно медиолатеральных) и эллипсовидную форму. При развитии функциональной ТН кольцо клапана «уплощается» и принимает более округлую форму. Сходные данные приводит S. Fukuda и соавт. [29] на меньшем числе наблюдений.
В качестве других факторов, вызывающих регургитацию, называют дилатацию ПЖ и следующее за ней смещение папиллярных мышц, что приводит к увеличению аннулоапикального расстояния, избыточному натяжению хорд и нарушению коаптации створок. Это состояние в англоязычной литературе обозначается термином «tethering», или «tenting» [9, 55]. Кроме того, по некоторым данным дилатация ПЖ увеличивает число ассоциированных с клапанными пороками осложнений [44].
M. Antunes и соавт. [10] в качестве одного из механизмов развития и усугубления дисфункции ПЖ, а следовательно и ТР, описали «рестрикционно-дилатационный синдром». Этот механизм представляет собой «порочный круг», когда дисфункция ЛЖ через повышение давления и/или объема в малом круге кровообращения приводит к дисфункции ПЖ. Это в свою очередь усугубляет дисфункцию ЛЖ посредством межжелудочкового взаимодействия через межжелудочковую перегородку.
Еще одним немаловажным элементом в развитии ТН является легочная гипертензия. M. De Bonis и соавт. [23] выявили зависимость между систолическим давлением в легочной артерии и степенью дисфункции ЛЖ. Аналогичные данные приводят S. Fukuda и соавт. [28]. В другом исследовании R. Ghanta и соавт. [33] обнаружили, что больные, у которых давление в легочной артерии после пластики ТК составляет 52 мм рт.ст. и выше, более подвержены рецидиву ТР. J. Nath и соавт. [47] отметили, что давление в легочной артерии более 40 мм рт.ст. утяжеляет ТР и повышает смертность.
По данным G. Lin и соавт. [39], одной из причин развития ТН может быть имплантация эндокардиальных электродов для кардиостимуляторов и кардиовертер-дефибрилляторов.
Таким образом, понимание механизмов развития ТН помогает в определении основных направлений при хирургической коррекции порока.
Длительное время под влиянием публикации N. Bra- unwald и соавт. [15] считалось, что коррекция ТР после успешной коррекции порока левых отделов сердца не требуется и что ТР регрессирует самостоятельно. О. Yilmaz и соавт. [62] в своем ретроспективном исследовании показали, что даже ТР III степени и выше регрессировала в течение 3 лет наблюдения после изолированной пластики МК. На этом основании они считают, что бессимптомная ТР не требует обязательной коррекции.
Однако есть сообщения, противоречащие этому убеждению. По данным A. Calafiore и соавт. [16, 18], 5-летняя выживаемость пациентов со II и III степенью ТР после изолированной коррекции митрального порока составила 45—46%, а с I степенью или без регургитации — 74,5—88,2%. Показано также, что, несмотря на уменьшение степени регургитации в раннем послеоперационном периоде у пациентов с некорригированной ТН, в отдаленном периоде она прогрессирует. H. Song и соавт. [57] отследили течение некорригированной ТН I и II степени у 638 пациентов, оперированных по поводу пороков левых отделов сердца. У 7,7% пациентов впоследствии развилась ТР III или IV степени. K. Matsuyama и соавт. [41] проанализировали отдаленные результаты коррекции пороков левых отделов без вмешательств на ТК с регургитацией в пределах II степени. У 16% пациентов в сроки наблюдения до 8 лет произошло прогрессирование ТН до III степени и выше. Дооперационная регургитация II степени, фибрилляция предсердий и атриомегалия левого предсердия более 60 мм были идентифицированы как факторы, ухудшающие течения ТР в отдаленном периоде.
A. Matsunaga и соавт. [40] представили результаты лечения 124 больных с ишемической митральной недостаточностью. При этом у 30% пациентов имелась выраженная ТР и только 43% из них выполнена аннулопластика. К окончанию наблюдения у 49% пациентов имелась регургитация не ниже III степени, у 74% пациентов без регургитации до операции в срок более 3 лет отмечалось появление регургитации на ТК. У пациентов с ТР как до операции, так и после нее, выявлен высокий индекс диаметра кольца/площадь поверхности тела.
При определении показаний к коррекции функциональной ТН существуют разные мнения. У большинства хирургов не вызывает сомнений необходимость коррекции выраженной регургитации III и IV степени [11, 17, 23, 49]. Однако вопрос о коррекции регургитации I и II степени остается нерешенным. G. Dreyfus и соавт. [25] пациентам с диаметром фиброзного кольца клапана менее 7 см, измеренного между переднесептальной и переднезадней комиссурами, выполняли коррекцию только митрального порока, а имевшим диаметр 7 см и более — коррекцию митрального порока и аннулопластику ТК. Степень регургитации до операции в обеих группах в среднем была менее I. В отдаленном периоде отмечено усугубление ТР более чем на две степени у 48% пациентов, которым не выполняли аннулопластику, и только у 2% получивших аннулопластику. В итоге они сделали вывод, что ориентация на диаметр трикуспидального кольца при определении показаний к коррекции ТН дает лучший результат.
N. Van de Veire и соавт. [61] пришли к заключению, что выполнение аннулопластики пациентам с дилатацией фиброзного кольца более 40 мм, по данным эхокардиографии, без значимой регургитации предотвращает дальнейшее прогрессирование ТН и способствует обратному ремоделированию ПЖ. У пациентов с ТР I, II степени и дилатацией фиброзного кольца, которым аннулопластика не выполнялась, констатировано прогрессирование ТН и дилатация ПЖ. Другие авторы [56] также предлагают выполнять аннулопластику ТК пациентам с умеренной степенью регургитации, если имеется дилатация фиброзного кольца более 40 мм или легочная гипертензия. V. Chan и соавт. [21] указывают, что ТР III и IV степени ассоциируется с повышенной смертностью в послеоперационном периоде. Выполнение аннулопластики ТК препятствует прогрессированию недостаточности и улучшает функциональный класс сердечной недостаточности пациентов, но не влияет на среднеотдаленную выживаемость. Наличие у пациентов с ТР III степени и выше в сочетании с дилатацией фиброзного кольца более 30 мм являются факторами, определяющими дальнейшее прогрессирование ТН. В.А. Иванов [3] показанием к коррекции функциональной недостаточности ТК также считает регургитацию II степени и выше и дилатацию фиброзного кольца более 40 мм (по данным чреспищеводной эхокардиографии).
Имеется определенная разница в руководствах по выполнению коррекции пороков ТК, предложенных Американской коллегией кардиологов/Американской ассоциацией сердца (ACC/AHA) и Европейским кардиологическим обществом (ESC).
Показания к коррекции трикуспидального порока, утвержденные ACC/AHA, включают следующие:
— пластика ТК показана при выраженной ТР пациентам с пороком МК, требующим операции (уровень доказательности В);
— протезирование или пластика ТК целесообразна у пациентов с первичной тяжелой симптомной ТР (уровень доказательности С);
— протезирование ТК целесообразно при выраженной ТР и измененных створках в случаях неэффективности пластики (уровень доказательности С);
— аннулопластика ТК возможна у пациентов с ТР менее IV степени во время операции на МК, если имеется легочная гипертензия или дилатация фиброзного кольца клапана (уровень доказательности С);
— пластика или протезирование ТК не показана пациентам с бессимптомной изолированной ТР и систолическим давлением в легочной артерии менее 60 мм рт.ст. (уровень доказательности С);
— протезирование или пластика ТК не показана пациентам с первичной ТР менее III степени (уровень доказательности С).
Согласно руководству по коррекции трикуспидальных пороков, принятым ESC, вмешательство на ТК показано в следующих случаях:
— пациентам с выраженной ТР во время коррекции пороков левых отделов сердца;
— пациентам с выраженной первичной ТР с клиническими проявлениями, не поддающейся медикаментозной терапии даже в отсутствие дисфункции желудочков;
— пациентам с выраженным трикуспидальным стенозом (с ТР или без нее), не поддающимся медикаментозной терапии;
— пациентам с выраженным трикуспидальным стенозом (с ТР или без нее), подвергающимся вмешательствам на левых отделах сердца;
— пациентам с умеренной органической ТР во время коррекции пороков левых отделов сердца;
— пациентам с вторичной умеренной ТР и дилатацией кольца более 40 мм во время коррекции пороков левых отделов сердца;
— пациентам с выраженной симптомной ТР с корригированными пороками левых отделов, в отсутствие дисфункции миокарда, клапанов, дисфункции ПЖ и легочной гипертензии;
— пациентам с выраженной изолированной малосимптомной ТР при прогрессирующей дилатации ПЖ и нарастании его дисфункции [43].
Наиболее распространенными методами хирургической коррекции функциональной ТН являются аннулопластика опорным кольцом, предложенная A. Carpentier в 1971 г., и шовная аннулопластика, предложенная N.G. De Vega в 1973 г., и их модификации [6, 19, 24].
И.И. Скопин и соавт. [4] выявили 3 типа строения ТК и выдвинули положение, что выбор типа аннулопластики должен производиться с учетом анатомического строения ТК.
По некоторым данным [14, 48, 49, 59], аннулопластика опорным кольцом обеспечивает более стойкий эффект в отдаленном периоде и более высокую выживаемость.
В частности, по данным P. McCarthy и соавт.[42], через 1 мес после аннулопластики по De Vega пациенты с регургитацией III и IV степени составили 13,6%, а через 8 лет — 33%. После пластики опорным кольцом этот показатели составили 15,2 и 17% соответственно. Несмотря на низкую частоту повторных операций (3% за 8 лет наблюдения), авторы отмечают высокую послеоперационную летальность после повторных вмешательств. Летальность составила 8%, а 5- и 8-летняя выживаемость — 65 и 50% соответственно. F. Filsoufi и соавт. [27] сообщали о хороших ближайших результатах после применения опорных колец трехмерной конфигурации и не наблюдали значимого увеличения степени регургитации.
G. Gatti и соавт. [31, 32] представили результаты использования эластичной полосы из политетрафторэтилена для аннулопластики. Летальность составила 5,7%, 4-летняя актуарная выживаемость — 91,7%. В среднеотдаленном периоде у 89,8% пациентов имелись ТР менее II степени и удовлетворительный функциональный статус. A. Calafiore и соавт. [17] предложили метод аннулопластики стандартной 50-миллиметровой полосой без учета площади поверхности тела и сообщили об удовлетворительных ближайших результатах. После такой пластики диаметр трикуспидального отверстия приближался к измерителю N25.
J. Bernal и соавт. [11] при коррекции функциональной ТН применяли шовную аннулопластику по De Vega и ее модификации. Летальность составила 8,1%, выживаемость в срок 6,8 года — 23,3%. Актуарная 12-летняя выживаемость составила 50,5%. Отмечена положительная динамика эхокардиографических показателей в виде уменьшения размеров ПЖ, уменьшения давления в легочной артерии. В период наблюдения ТР отсутствовала или была I степени у 50,6% пациентов, II степени — у 44,8%. Степень резидуальной ТР не влияла на смертность и частоту повторных операций на клапане в отдаленном периоде. Дооперационная тяжелая ТР была ассоциирована с большей частотой повторных операций. Повторная операция потребовалась 3,1% пациентам с функциональной ТН. Смертность после повторных операций составила 18,5%. A. Calafiore и соавт. [18] при выполнении аннулопластики по De Vega сообщали о 5-летней выживаемости 74,5% и прогрессировании ТР до III, IV степени у 5% пациентов; при этом летальность составила 5,5%. С.С. Добротин и соавт. [2] также отмечают удовлетворительные среднеотдаленные результаты после аннулопластики по De Vega. A. Sarraj и соавт. [54] сделали сообщение об использовании ими регулируемой сегментарной аннулопластики ТК, очень похожей на технику, предложенную Н.М. Амосовым в 1972 г., с удовлетворительными среднеотдаленными результатами.
R. Ghanta и соавт. [33] не выявили статистически значимых различий по среднеотдаленным результатам между шовной бикуспидализацией и кольцевой аннулопластикой; обе методики, по мнению авторов, дают хороший, стойкий эффект.
O. Alfieri и соавт. [7] в 2002 г. представили использованную ими для коррекции посттравматической ТР «технику клевера». В последующем E. Castedo и соавт. [20] описали подобную технику у пациентов с рецидивом ТН, назвав ее техника край в край. Y. Lai и соавт. [38] применяли данную технику как дополнительную процедуру в случаях неадекватной коррекции недостаточности кольцевой аннулопластикой и пластикой по Key и получили удовлетворительные результаты. M. De Bonis и соавт. [23] также представили результаты применения «техники клевера». Они использовали ее в дополнение к аннулопластике при пролабировании створок и при их натяжении, в 97% случаев — вследствие смещения папиллярных мышц, в 3% — изолированно. В среднеотдаленном периоде у 87,7% пациентов регургитация отсутствовала или соответствовала I степени, проявлений стеноза ТК не было.
G. Dreyfus и соавт. [26] для адекватной коррекции выраженной ТР у пациентов с нарушением коаптации вследствие смещения папиллярных мышц предложили выполнять увеличение передней створки заплатой из аутоперикарда с последующей имплантацией опорного кольца. Данное вмешательство выполнялось пациентам с глубиной коаптации более 8 мм. В сроки наблюдения от 6 до 20 мес резидуальная регургитация была не более I степени. F. Roshanali и соавт. [52] сравнили группы пациентов с тяжелой ТР, которым выполнялась аннулопластика и аннулопластика в сочетании с увеличением створки заплатой из аутоперикарда, если глубина коаптации была больше 8 мм или площадь глубины коаптации более 16 мм2. Через год резидуальная регургитация в группах, которым выполнена аннулопластика по De Vega и кольцевая аннулопластика, составила 28 и 14% соответственно, а в группах с пластикой по De Vega в сочетании с увеличением створки и кольцевой аннулопластики и увеличением створки — 10 и 8% соответственно.
U. Kappert и соавт. [35] предложили иной подход для коррекции ТН вследствие выраженной дилатации ПЖ — резекцию свободной стенки ПЖ в сочетании с кольцевой аннулопластикой. Через год наблюдения ТР не определялась.
R. Moraca и соавт. [46] при анализе результатов протезирования и пластики ТК не выявили различий в послеоперационном и отдаленном периодах. В заключение авторы указывают, что у пациентов, имеющих риск рецидива ТР, более предпочтительно протезирование клапана как более надежного и радикального вмешательства по редукции недостаточности. C. Park и соавт. [50] приводят схожие данные; они отметили лишь тенденцию к лучшей отдаленной выживаемости пациентов с пластикой клапана. Более того, не было летальных исходов у больных, которым выполнялось протезирование ТК в дополнение к коррекции порока левых отделов сердца. Авторы также считают, что в случаях с выраженной ТР и дисфункцией ПЖ следует отдавать предпочтение протезированию клапана. Другие авторы [13] определяют протезирование ТК как прогностический фактор повышенной летальности.
Несмотря на многочисленные сообщения о хороших результатах коррекции функциональной ТН, в ряде случаев наблюдается рецидив или прогрессирование ТР.
P. McCarthy и соавт. [42] в качестве независимых прогностических факторов, обусловливающих прогрессирование ТН, определили высокую дооперационную степень ТР, дисфункцию ЛЖ, наличие эндокардиального электрода, фибрилляцию предсердий и виды аннулопластик, отличные от кольцевой. M. De Bonis и соавт. [23] представили данные по коррекции ТР у пациентов с дилатационной кардиомиопатией и митральной недостаточностью. Через 1,8 года наблюдения у 12% пациентов имелась регургитация III или IV степени, у 18% пациентов с дооперационной регургитацией II степени и ниже в последующем произошло ее прогрессирование на две степени и выше. В качестве прогностических факторов прогрессирования ТР до III, IV степени рассматриваются выраженная регургитация на момент выписки и дооперационная дисфункция ПЖ. G. Gatti и соавт. [32] сообщают, что у пациентов с дооперационной регургитацией более II степени, фракцией укорочения ПЖ менее 35% и постоянным водителем ритма имелась тенденция к рецидиву ТР. R. Ghanta и соавт. [33] обнаружили, что такие факторы, как давление в легочной артерии после пластики ТК 52 мм рт.ст. и выше, а также высокая дооперационная степень регургитации, определяют склонность к рецидиву ТР.
В проспективном исследовании Y. Kim и соавт. [36] как независимый прогностический фактор неблагоприятного течения ТН после коррекции порока расценена дисфункция ПЖ. Чувствительным показателем дисфункции ПЖ представлена конечная систолическая площадь ПЖ; так, при площади менее 20 см2 отмечена более низкая частота развития сердечно-сосудистых осложнений в среднеотдаленном периоде. Сходные данные представили C. Park и соавт. [50].
S. Fukuda и соавт. [28] определили дооперационные глубину коаптации («tethering height») более 0,51 см и площадь «натяжения» («tethering area») более 0,8 см2, раннюю послеоперационную фракцию выброса ЛЖ менее 36,6% в качестве эхокардиографических прогностических факторов рецидива или персистенции ТР через год и более после операции. Также они обнаружили корреляцию между давлением в ПЖ и степенью ТР, и взаимосвязь между давлением в ПЖ и фракцией выброса ЛЖ в сроки наблюдения более года. Схожие данные авторы получили и для раннего послеоперационного периода [30].
S. Min и соавт. [45] в своей работе в качестве дооперационных эхокардиографических прогностических факторов резидуальной ТН выявили объем «натяжения» («tethering volume») более 1,68 мл и переднезадний размер кольца более 36 мм, а в качестве послеоперационных факторов — давление в легочной артерии.
H. Je и соавт. [34] показали, что возраст, ревматическая этиология митрального порока и невыполненная процедура Maze являются прогностическими факторами прогрессирования ТР II степени. Аналогичные данные представили H. Song и соавт. [57]. J. Stulak и соавт. [58] также сравнили группы пациентов с успешной процедурой Maze и коррекцией митрального порока с группой, в которой ритм не восстановился. Авторы сделали вывод, что успешная процедура Maze препятствует прогрессированию ТН. У пациентов с синусовым ритмом после операции степень ТН уменьшилась в 42% случаев, прогрессировала в 9%, а у пациентов с фибрилляцией предсердий — в 36 и 45% соответственно.
C. Yoon и соавт. [63] выявили, что уровень B-натрийуретического пептида более 200 пг/мл является неблагоприятным прогностическим фактором у больных с выраженной ТН.
По разным данным, летальность после коррекции ТН в сочетании с коррекцией пороков левых отделов сердца колеблется от 0 до 18%, но большинство авторов приводят цифры 4,4—8,1%. По данным J. Bernal и соавт. [12], летальность при повторных операциях после выполненной ранее пластики ТК составила 33,8%, частота осложнений развития 64,9%. Актуарная выживаемость через 10 лет после повторных операций составила 40%, а через 26 лет — 11,8%. В других работах авторы [11, 42] приводят летальность после повторных операций на уровне 18,5—37%.
Таким образом, функциональная ТН — достаточно серьезная проблема, которая сопутствует порокам левых отделов сердца и утяжеляет их течение. Выраженная ТР должна корригироваться без сомнения. Однако частые неудовлетворительные отдаленные результаты некорригированной регургитации I и II степени, возможно, обусловливают необходимость более активной хирургической тактики. Нуждаются в рассмотрении и другие параметры в качестве дополнительных или равнозначных степени регургитации при определении показаний к коррекции порока. До сих пор нет полной ясности, какая из методик аннулопластики является операцией выбора, хотя есть тенденция в сторону кольцевых методов аннулопластики. Остается также проблемой прогрессирование ТР после коррекции у пациентов с дилатированным ПЖ, которые нуждаются, видимо, в применении других хирургических пособий, нежели изолированная аннулопластика.
Пороки клапанов сердца и их лечение
Терапия клапанов сердца включает несколько методов: 1) медикаментозное лечение; 2) операция по реконструкции клапана; 3) операция по замене клапана; и 4) замена клапана чрескатетерным способом. Хотя лекарственная терапия не может устранить дисфункцию клапана, во многих случаях она может облегчить симптомы. Если появляется необходимость в реконструкции или протезировании клапана, ваш кардиолог, хирург или специалист по интервенционной кардиологии расскажет Вам о возможных методах лечения. Выбор между протезированием или реконструкцией зависит от ряда факторов, включая какой именно клапан поражен, тяжесть заболевания, наличие стеноза или регургитации.
Ваша бригада кардиологов
Если Вам предстоит операция по реконструкции или протезированию клапана сердца, за Вами будет наблюдать группа медицинских специалистов, которые стремятся обеспечить вашу безопасность и комфорт до, во время и после операции. Далее представлена информация, описывающая различных медицинских работников, с которыми Вы можете встретиться в ходе лечения.
Врач общей медицинской практики (терапевт) Возможно, первым обнаружит симптомы порока клапана сердца или заболевания, которые могут вызвать порок или нарушение работы клапана. Терапевт может назначить специальные исследования для подтверждения диагноза или направить Вас к соответствующему специалисту.
Кардиолог — врач, специализирующийся на заболеваниях сердца. Кардиолог не выполняет операций на сердце, но обычно проводит диагностические исследования, чтобы определить причину проблем с сердцем и назначить курс лечения для устранения нарушений работы сердца. Кардиолог может назначить прием лекарств и/или направить Вас к сердечно-сосудистому хирургу.
Сердечно-сосудистый хирург — врач, специализирующийся на операциях на сердце, в том числе по реконструкции или протезированию пораженных клапанов сердца. Хирург — основой специалист в процессе принятия решения о сроках и наилучшей стратегии, включая методику операции и выбор медицинского изделия для Вашего случая поражения клапана.
Специалист по интервенционной кардиологии (интервенционный кардиолог) — врач, прошедший дополнительную специализированную подготовку для проведения катетерных процедур по лечению заболеваний сердца. Интервенционный кардиолог сотрудничает с хирургом, чтобы сделать правильный выбор в вопросе необходимости проведения замены аортального клапана транскатетерным методом.
Анестезиолог — врач, обученный проводить седацию или давать общий наркоз (сон) при проведении хирургического вмешательства.
Врачи и медицинские сестры отделения интенсивной терапии — в отделении интенсивной терапии пациент находится под пристальным наблюдением и содержится после большинства видов хирургического вмешательства. Совместно с вашим хирургом и/или кардиологом врачи отделения интенсивной терапии и медсестры заботятся о Вас в этот период.
Подходы к хирургическому лечению пороков клапанов сердца
Большинство операций на сердце выполняется через разрез по всей длине грудной клетки, или грудины. Такой разрез называют срединной стернотомией. Как правило, процесс заживления проходит довольно хорошо, требуется около 6 недель для полного восстановления кости.
У некоторых пациентов операция на клапане сердца может быть выполнена с использованием небольших, то есть минимально инвазивных разрезов. Разрезы меньшего размера дают пациентам рад преимуществ. Предоперационные исследования, включая коронарографию, эхокардиографию и, во многих случаях, КТ грудной клетки (компьютерная аксиальная томография), помогают определить, каким пациентам может быть показана минимально инвазивная операция. Хирургические подходы, при которых выполняют небольшие разрезы, также подразумевают использование аппарата искусственного кровообращения, как и операции с проведением стернотомии.
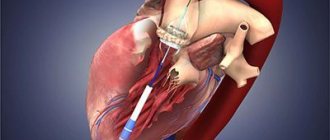
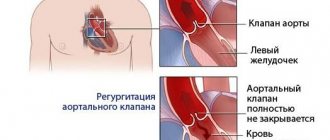
Транскатетерное протезирование аортального клапана (англ. TAVR): менее инвазивная альтернатива операции на открытом сердце
Если пациенту был диагностирован стеноз аорты тяжелой степени, но операция на открытом сердце сопряжена с умеренным или высоким риском, доступен другой вариант: транскатетерная протезирование аортального клапана (англ. TAVR). Данную процедуру также называют транскатетерной имплантацией аортального клапана (англ. TAVI). Это минимально-инвазивная операция, которая не требует вмешательства на открытом сердце.
| Процедура транскатетерного протезирования аортального клапана позволяет установить новый клапан в Ваш пораженный аортальный клапан. Новый клапан отодвигает створки Вашего пораженного клапана в сторону. Каркас имплантируется в створки Вашего пораженного клапана, чтобы обеспечить правильное расположение. |
Такая минимально-инвазивная процедура отличается от операции на открытом сердце. В ходе транскатетерного протезирования аортального клапана вместо рассечения грудной клетки и полного удаления пораженного клапана замену клапана проводят с помощью катетера.
Транскатетерное протезирование аортального клапана может быть выполнено несколькими способами, однако наиболее часто используют трансфеморальный (через разрез на бедре). Только бригада кардиологов может определить наилучший способ, принимая во внимание состояния здоровья человека и другие факторы.
Операция по протезированию клапана
Если сердечно-сосудистый хирург примет решение заменить сердечный клапан пациента, первым шагом является удаление пораженного клапана (удаление клапана и отложений кальция), а вторым — имплантация протеза клапана сердца на его место. Протезы клапанов, используемые для замены пораженных естественных клапанов, изготавливают из различных материалов и различных размеров.
Существуют две обширные категории протезов клапанов сердца, которые используются для замены пораженных клапанов:
- Биологические протезы, изготавливаемые в основном из тканей животных, а именно бычьего (коровьего) перикарда (прочной сумки, окружающей сердце), клапана аорты свиньи или же клапанов человека, взятых у посмертного донора.
- Механические клапаны изготовлены из синтетического материала, преимущественно углерода.
Биопротезы клапанов
Существует большое разнообразие биопротезов клапанов:
- Гетеротрансплантат (или ксенотрансплантат) — ткань клапана или перикарда животного происхождения, пригодная для использования в медицине (например, крупного рогатого скота (коров) или свиней).
- Гомотрансплантат (или аллотрансплантат) — человеческие клапаны, полученные от посмертного донора.
- Аутотрансплантат/собственная ткань — здоровый клапан, который был перемещен из одного места в организме человека в другое для замены пожаренного клапана (касается только клапана легочной артерии, который используют для замены клапана аорты).
Ксенотрансплантат — это биологический клапан, изготовленный из ткани животного происхождения. Так, створки клапана из перикарда обычно изготавливают из бычьего (коровьего) перикарда (сумки, окружающей сердце) и пришивают к гибкому или полужесткому каркасу. Кроме того, биологические протезы клапанов изготавливают из свиных клапанов. Клапан изготавливают из аортального клапана свиньи и обычно пришивают к гибкому или полужесткому каркасу и получают «каркасный» клапан. В ином случае, естественный корень аорты свиньи остается неизмененным и выступает в роли каркаса в «бескаркасном» клапане. Каждый клапан окружен тканевым кольцом (манжетой) для пришивания. Швы накладываются через манжету, чтобы прикрепить клапан к сердцу.
| Биологические протезы клапанов |
Механические клапаны
Створки механических клапанов изготовлены из специального типа углерода. Такие клапаны обычно имеют две створки. Створки открываются и закрываются в ходе сердечного цикла, обеспечивая движение крови в одном направлении.
Критерии и выбор сердечных клапанов
Выбор между механическим и биологическим протезом клапана зависит от индивидуальной оценки преимуществ и рисков каждого клапана, а также образа жизни, возраста и состояния здоровья каждого пациента.
Биопротезы не требуют длительного применения препаратов, подавляющих естественную способность крови к свертыванию (антикоагулянтов). Это важно для тех, кто не может принимать антикоагулянты из-за ранее перенесенных крупных кровотечений (например, желудочно-кишечной или мочеполовой системы) или повышенного риска травматических повреждений и кровотечений, связанных с активным времяпрепровождением, спортом или преклонным возрастом. Биопротезы обычно служат не менее 10 лет, а в некоторых случаях — более 30 лет. Если пациенту в возрасте до 60 лет имплантируют биопротез клапана, существует высокая вероятность того, что в какой-то момент возникнет повторная необходимость протезирования клапана, в то время как большинству пациентов в возрасте 70 лет и старше этого не требуется.
Механические клапаны мало подвержены износу. Однако, они требуют ежедневного приема антикоагулянтов, что может потребовать изменений в питании или образе жизни.
Зачастую решение о выборе биологического или механического протеза клапана связано с возрастом пациента, причем пожилым пациентам преимущественно устанавливают биопротезы. Однако нет единого мнения относительно точного возраста, в котором биопротез может быть предпочтительнее механического клапана.
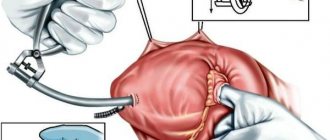
Операции по реконструкции клапанов
Если это представляется возможным, предпочтительнее реконструировать клапан пациента, а не заменять его протезом. Обычно в ходе операции по реконструкции клапана хирург корректирует ткань или основные структуры митрального или трикуспидального клапанов.
Почти все операции по реконструкции клапанов включают в себя установку кольца или полукольца для аннулопластики. Это покрытое тканью изделие, которое имплантируется по окружности, или отверстию, митрального или трикуспидального клапана. Оно обеспечивает поддержку собственному клапану пациента и позволяет плотнее закрыть его створки, потенциально уменьшая протечки через клапан. Существует множество различных изделий для аннулопластики. Хирург выберет то, которое лучше всего подойдет для клапана Вашего сердца.
| Кольца для аннулопластики |
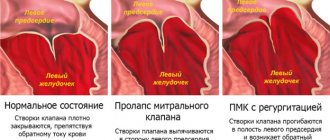
В дополнение к аннулопластике, реконструкция митрального клапана часто требует коррекции проблем со створками или хордами, которые прикрепляют створки клапана к сердцу. Если протечки обусловлены пролапсом митрального клапана, фиксация створок и хорд (и имплантация кольца или полукольца для аннулопластики) восстанавливает нормальную работу клапана.
Уход за пациентом после операции на клапане сердца
В норме период восстановления после стандартной операции на клапане сердца занимает от четырех до восьми недель. Восстановление может протекать быстрее, если был выполнен малый разрез, например, при минимально-инвазивных и транскатетерных операциях. За это время пациенты постепенно набираются сил и возобновляют нормальную повседневную деятельность. Регулярное обследование у кардиолога имеет большое значение. Обращайтесь к своему лечащему врачу по телефону или лично, если у Вас возникают вопросы или опасения по поводу здоровья, особенно при возникновении каких-либо необычных симптомов или изменении общего состояния здоровья.
Питание и физические упражнения
Два дополнительных важных аспекта восстановления и хорошего самочувствия в целом — это здоровое питание и регулярное выполнение физических упражнений. Если Ваш врач рекомендовал специальную диету, важно обязательно соблюдать ее. Здоровое питание является неотъемлемой частью здоровой жизни. В ходе восстановительного периода употребление богатых питательными веществами блюд обеспечит ваше тело энергией и может помочь ускорить процесс выздоровления.
Для улучшения общего состояния сердечнососудистой системы рекомендуется сочетать сбалансированную диету с рекомендациями врача по физической нагрузке и контролю веса. Регулярное выполнение программы физических упражнений является важной частью поддержания здорового образа жизни. Под руководством Вашего врача Вы должны постепенно наращивать физическую нагрузку и уровень активности. Прежде чем приступить к новому виду спортивной деятельности, проконсультируйтесь с врачом.
Антикоагулянты — важно следовать указаниям Вашего врача по приему лекарств, особенно если был назначен антикоагулянт. Антикоагулянты, или противосвертывающие препараты, подавляют естественную способность крови к свертыванию. Если Вам показан прием антикоагулянтов, Вам потребуется периодически выполнять анализ крови, чтобы оценить способность крови к свертыванию. Результат такого исследования поможет Вашему врачу определить необходимую дозировку антикоагулянта. Установление правильной дозировки препарата может занять некоторое время, но последовательность и сотрудничество с Вашим врачом имеют большое значение. Иногда возможно проводить исследование самостоятельно в домашних условиях, спросите об этом у врача. Проконсультируйтесь с Вашим врачом о взаимодействии с другими препаратами, которые Вы принимаете, и об ограничениях, касающихся диеты, которые действуют при приеме антикоагулянтов. Узнайте обо всех признаках, которые могут указывать на то, что Ваша дозировка слишком высока.
Прочая медицинская информация — Перед выполнением любых стоматологических процедур, включая профгигиену, проведением эндоскопии или операции, сообщайте врачу об установленном протезе сердечного клапана. Пациенты с протезом клапана более восприимчивы к инфекциям, которые могут в будущем привести к поражениям сердца. Поэтому, возможно, до и после некоторых медицинских процедур Вам потребуется принимать антибиотики, чтобы снизить риск заражения.
Кроме того, отправляясь в поездку более чем на несколько дней, старайтесь поддерживать диету и уровень физических упражнений как можно ближе к своей норме. Обязательно обсудите все препараты, которые Вы принимаете (в том числе безрецептурные), с Вашим врачом и не меняйте дозировку без особого на это указания.
Митральный стеноз (стеноз митрального клапана)
От первой ревматической атаки до появления характерных для митрального стеноза жалоб в странах с умеренным климатом проходит в среднем 20 лет, поэтому жалобы обычно появляются в 30-40 лет. Все чаще встречаются больные, у которых связь болезни с ревматизмом установить не удается. По данным, полученным до широкого распространения кардиохирургии, от момента появления одышки в покое до смерти обычно проходит 2-5 лет. В развивающихся странах (Южная и Юго-Восточная Азия, Центральная Америка, Ближний Восток) болезнь прогрессирует быстрее и часто проявляется уже к 20 годам. В то же время в Западной Европе и США все чаще выявляют медленно прогрессирующий митральный стеноз у пожилых.
При легком стенозе жалоб часто нет, хотя физикальное исследование выявляет многие симптомы порока. Однако даже при небольшом повышении трансмитрального градиента давления в покое увеличение сердечного выброса (при физической и эмоциональной нагрузках, половом акте, лихорадке, тяжелой анемии, пароксизмальных тахикардиях, беременности, тиреотоксикозе) резко увеличивает ДЗЛА, вызывая одышку и кашель. Резкое же увеличение кровотока на фоне тяжелого стеноза ведет к отеку легких. В положении лежа растет застой в легких, возникают ортопноэ и ночные приступы сердечной астмы. Чем меньше площадь отверстия митрального клапана, тем хуже больные переносят физическую нагрузку и тем выше вероятность предсердных аритмий — экстрасистолии, пароксизмальных тахикардии, трепетания предсердий, мерцательной аритмии.
Высокая частота сокращения желудочков при мерцательной аритмии вызывает резкое усиление одышки. Появление постоянной формы мерцательной аритмии- критический момент в течении болезни, ее прогрессирование после этого идет заметно быстрее.
Кровохарканье при митральном стенозе возникает из-за разрывов легочных вен при росте давления в них — обычно при высоком давлении в левом предсердии в отсутствие существенного повышения легочного сосудистого сопротивления. Такое кровохарканье почти никогда не смертельно, со временем легочные вены утолщаются и кровохарканье проходит. Надо, однако, отличать его от других видов кровохарканья, тоже нередко встречающихся при митральном стенозе и вызванных отеком легких, инфарктом легкого или бронхитом.
По мере прогрессирования болезни и роста легочного сосудистого сопротивления (или за счет присоединения трикуспидального стеноза или недостаточности) симптомы застоя в легких часто ослабевают, отек легких и кровохарканье бывают реже и протекают легче. Однако легочная гипертензияувеличивает посленагрузку правого желудочка, и возникает правожелудочковая недостаточность: появляются слабость, тяжесть в животе (из-за гепатомегалии), отеки, асцит, гидроторакс (чаще правосторонний).
Повторные ТЭЛА, иногда с инфарктом легкого, — одна из основных причин смерти при митральном стенозе.
Часто встречаются бронхит, бронхопневмония, крупозная пневмония. Инфекционный эндокарди тдля изолированного митрального стеноза нехарактерен, но при сочетании стеноза с митральной недостаточностью бывает довольно часто.
У 10% больных имеется боль в груди, обычно она вызвана легочной гипертензией или ИБС, но часто причину ее так и не находят.
Изменения в легких. Кроме легочной гипертензии часто развиваются склероз и утолщение капилляров и альвеолярных перегородок. Снижаются ЖЕЛ, общая емкость легких, максимальная вентиляция легких и отношение поглощения кислорода к МОД. Последний показатель у больных с тяжелым митральным стенозом при нагрузке не растет, как это должно быть в норме.
Рост давления в легочных капиллярах при нагрузке еще больше снижает податливость легких. Иногда повышается сопротивление дыхательных путей. Все это увеличивает работу дыхания и вызывает одышку. Из-за склероза альвеол и уменьшения капиллярного кровотока может падать диффузионная способность легких, особенно при нагрузке. Играет роль и выпот в интерстициальное пространство и альвеолы. Избыток жидкости удаляется благодаря усилению лимфооттока, что предотвращает альвеолярный отек легких. Из-за высокого давления в левом предсердии перфузия нижних отделов легких в положении стоя снижается, а верхних — возрастает.
Тромбоэмболии. В левом предсердии, особенно в его расширенном ушке, могут возникать тромбы. Это чревато тромбоэмболиями артерий головного мозга, почек, селезенки, конечностей. Риск тромбоэмболии выше при мерцательной аритмии, у пожилых, при низком сердечном выбросе и тромбоэмболиях в анамнезе. Тромбоэмболия возможна даже при легком митральном стенозе и бывает первым его проявлением. После недавней тромбоэмболии вероятность обнаружить тромб в левом предсердии (например, при операции) ниже, чем в отсутствие тромбоэмболии; это говорит о том, что тромбоэмболии обычно вызваны свежими, а не старыми тромбами. Изредка крупные тромбы на узком основании и свободные тромбы перекрывают отверстие митрального клапана, симптомы в этом случае (обмороки, боль в груди, зависимость шумов в сердце от положения тела) напоминают миксому левого предсердия.
Классификация. Наиболее широкое распространение получила классификация митрального стеноза, предложенная А.Н. Бакулевым и Е.А. Дамир. Она включает 5 стадий развития порока:
- I – стадия полной компенсации кровообращения. Больной не предъявляет никаких жалоб, однако при объективном обследовании обнаруживаются признаки, характерные для митрального стеноза. Площадь митрального отверстия составляет 3-4 см2, размер левого предсердия — не более 4 см.
- II – стадия относительной недостаточности кровообращения. Больной жалуется на одышку, возникающую при физической нагрузке, выявляются признаки гипертензии в малом круге кровообращения, несколько повышено венозное давление, однако выраженных признаков недостаточности кровообращения не выявляется. Площадь митрального отверстия около 2 см2. Размер левого предсердия от 4 до 5 см.
- III – начальная стадия выраженной недостаточности кровообращения. В этой стадии имеются явления застоя в малом и большом кругах кровообращения. Сердце увеличено в размерах. Венозное давление значительно повышено. Отмечается увеличение печени. Площадь митрального отверстия составляет 1-1,5 см2. Размер левого предсердия — 5 см и более.
- IV – стадия резко выраженной недостаточности кровообращения со значительным застоем в большом круге. Сердце значительно увеличено в размерах, печень больших размеров, плотна. Высокое венозное давление. Иногда небольшой асцит и периферические отеки. К этой стадии также относятся и больные с мерцательной аритмией. Терапевтическое лечение дает улучшение. Митральное отверстие менее 1 см2, размер левого предсердия превышает 5 см.
- V – соответствует терминальной дистрофической стадии недостаточности кровообращения по В.Х. Василенко и Н.Д. Стражеско. Отмечаются значительное увеличение размеров сердца, большая печень, резко повышенное венозное давление, асцит, значительные периферические отеки, постоянная одышка, даже в покое. Терапевтическое лечение не дает эффекта. Площадь митрального отверстия менее 1 см2, размер левого предсердия более 5 см.
Атрезия трехстворчатого клапана. Принцип операции Фонтена
Слово атрезия означает полное отсутствие нормального сообщения между сердечными камерами или между ними и отходящими от них магистральными сосудами, а иногда — и отсутствие отделов самих сосудов. Термин атрезия применяется к трехстворчатому, митральному, аортальному и легочному клапанным отверстиям, к аорте и легочной артерии.
Другой термин — гипоплазия — означает, что сообщение есть, но оно уменьшено в размерах в сравнении с нормальным. Говорят о гипоплазии трехстворчатого или митрального клапанов, отделов аорты, легочной артерии, но так же и о размерах полости одного из желудочков (гипоплазия правого или левого желудочка).
Атрезия трехстворчатого клапана
В нормально развитом сердце трехстворчатый клапан соединяет правое предсердие с правым желудочком. При атрезии этот клапан не развился и на его месте имеется плотная мембрана, через которую поток крови пройти никак не может. Поскольку этот участок закрыт, то у плода не развился и тоже отсутствует весь приточный отдел правого желудочка, т.е. первый из двух конусов, образующих желудочек. Таким образом, измененным оказывается не только клапан, но и весь правый желудочек — у него отсутствует половина.
Однако, и плод, и родившийся ребенок могут с этим жить, во всяком случае, какое-то время. Шунтирование крови и ее смешивание в сердце происходит через дефекты в перегородках.
Из полых вен кровь попадает в нормальное правое предсердие. Но вход в желудочек — закрыт. Остается один путь: сквозь дефект межпредсердной перегородки — в левое предсердие. Затем через нормально развитый митральный клапан кровь поступает в левый желудочек. А вот здесь открыто два пути. Один — в аорту, другой — через дефект межжелудочковой перегородки — в оставшуюся часть правого желудочка (второй из конусов, который нормально развит) и отсюда — в легочную артерию и легкие.
Потоки крови в левом желудочке смешиваются — венозная кровь из полых вен, достигшая желудочка таким сложным путем, смешивается с артериальной кровью, пришедшей из вен легких.
Путь дальнейшего ее «распределения» зависит от того, куда легче идти основному потоку: в аорту или через дефект межжелудочковой перегородки — в легочную артерию и легкие. Кровь так и разделяется на два рукава, и разница в объеме двух потоков зависит от разницы сопротивления сосудов тела (т.е. большого круга кровообращения) и сопротивления, создаваемого дефектом перегородки.
В большинстве случаев существенно больший объем крови проходит в аорту и меньший — в легкие. Во-первых, значительная часть крови остается недонасыщенной, и у ребенка будет цианоз. Степень этого цианоза, однако, не столь выражена, как при полной транспозиции магистральных сосудов — ведь в желудочке все-таки происходит смешение артериальной и венозной крови. А, во-вторых, левый желудочек работает на оба круга, т.к. правого почти нет. Нагрузка, которая выпала на его долю — тяжелая, и очень она может быстро вызвать недостаточность кровообращения в большом круге — одышку, увеличение печени, отеки и т.д.
В сущности, и качество, и продолжительность жизни таких детей зависит от величины кровотока в легких, т.е. определяется размером дефектов в межжелудочковой и межпредсердной перегородках — этих, в данном случае, естественных шунтов «во спасение».
Со временем, по мере роста ребенка (и сердца) положение ухудшается, т.к. в легкие идет все меньше крови. Нарастает цианоз и около 90% детей не доживут до своего первого дня рождения, если им не оказать хирургическую помощь.
Оставшиеся 10% имеют достаточно большой дефект в перегородке, и кровоток в легкие у них нормальный, а иногда даже и усиленный. Они чувствуют себя неплохо, относительно нормально развиваются и почти не синюшные. Такие дети могут прожить более 10-15 лет, но у них постепенно будут развиваться признаки сердечной недостаточности и нарастать цианоз со всеми его осложнениями и последствиями.
Что же может быть сделано и — когда?
В лечении атрезии трехстворчатого клапана хирургия, особенно за последние два десятилетия, добилась значительных успехов и тактика лечения, выбор операции и времени ее проведения сегодня разработаны достаточно, чтобы добиться убедительных хороших результатов. Но нужно понимать, что, если у сердца изначально не было одного из четырех клапанов и большого участка одного из желудочков, то их сделать заново нельзя
. Таких методов пока нет.
Поэтому весь процесс лечения сведется к созданию иных, более оптимальных путей для кровотока
. Другими словами, лечение будет облегчающим, «паллиативным», и его нельзя выполнить в один раз, а надо постепенно готовить и сердце, и легкие к новым, более нормальным условиям кровотока, чем те, в которых они оказались при рождении.
Детям с выраженным цианозом в течение первых месяцев надо сделать операцию наложения анастомоза между большим и малым кругами кровообращения, как это описано для тетрады Фалло. Эта операция значительно улучшит их состояние на первых порах. Они начнут развиваться, будут выглядеть и вести себя соответственно возрасту, пройдет синюшность.
Но это — только первый, «жизнеспасающий» этап. Если больше ничего не делать, ребенок скоро снова станет очень больным и, чем хуже будет его состояние, тем более рискованными будут последующие этапы лечения.
Между первым и вторым годом жизни становится возможным выполнение второго этапа, а именно, снятие первого анастомоза и создание другого пути для венозной крови в легкие — прямое соединение верхней полой вены с легочной артерией, в обход правой половины сердца. Почему этого не делают сразу? Дело в том, что в первые месяцы жизни сопротивление сосудистого русла легких может оказаться слишком высоким. Подумайте, ведь давление в венах очень низкое — 5-7 мм ртутного столба, а мы хотим, чтобы оно было достаточным, чтобы без сердечного «насоса» кровь пассивно текла в легочную артерию. Для этого между венами и сосудами легких должна быть разница в сопротивлении и давлении, иначе кровь в легкие просто не потечет.
Бывают ситуации, и их довольно много, когда мы выполняем эту операцию — двунаправленный кавапульмональный анастомоз на первом году жизни, без ранее выполненного системно-легочного анастомоза. Данное клиническое решение принимает Ваш кардиолог и кардиохирург, вырабатывая таким образом наилучшую тактику лечения Вашего ребенка.
Мы останавливаемся на этом столь подробно, т.к. сам принцип так называемого прямого кава-пульмонального анастомоза применяется сегодня широко и при других пороках, когда сердце изменено настолько, что порок невозможно исправить хирургически. Так вот на этом, втором этапе, верхняя полая вена соединяется с легочной артерией таким образом, что кровь из нее поступает в оба легких. Иными словами, кровь от верхней половины тела уже идет туда, куда надо. Но пока — только от половины.
Дети обычно хорошо переносят операцию. Эта операция не только улучшит состояние ребенка, но и подготовит сердце и сосуды легких к третьей, заключительной стадии в процессе лечения — соединения нижней полой вены с легочной артерией.
Наилучшим моментом для выполнения третьей операции будет возраст 4-5 лет, хотя иногда ее делают и раньше этого срока.
Эта операция делается с искусственным кровообращением и заключается во вшивании большой заплаты или протеза в нижнюю полую вену одним концом и в легочную артерию — другим. Таким образом, теперь вся венозная кровь от всего организма идет в легкие, а окисленная в полном объеме — в левые отделы сердца, т.е. в его теперь единственный желудочек.
Эту операцию называют операцией Фонтена — по имени французского хирурга, который ее предложил.
Сегодня ее применяют не только при атрезии трехстворчатого клапана, но и при многих сложных врожденных пороках, когда хирургическое создание двух равноценных желудочков невозможно. Эта операция произвела революцию в лечении пороков, которые совсем недавно считались неоперабельными. Больным с такими пороками просто отказывали даже в самых лучших кардиоцентрах. Сегодня все изменилось, и благодаря операции Фонтена можно помочь и уже помогли тысячам больных. Сам принцип такого подхода — принцип Фонтена — однако, всего лишь паллиация, пусть и хорошо функционирующая. Операция Фонтена, т.е. заключительный этап хирургического лечения нельзя назвать «радикальной коррекцией» (как, например, при закрытии дефекта межпредсердной перегородки), к ней больше подходит название «постоянной паллиации», т.е. это не исправление порока, а последняя возможность максимальной в данном случае нормализации кровообращения. Человек живет без правого желудочка, а кровь пассивно течет в легкие из венозной системы. Здоров ли этот человек? Может ли он переносить те физические и психологические нагрузки, которые ожидают его в жизни? О том, что сегодня известно об этом, мы поговорим немного ниже, а сейчас вернемся к трикуспидальной атрезии.
Как ни парадоксально это выглядит, но, чем тяжелее состояние ребенка с этим пороком изначально, тем яснее путь его лечения. Но каждый ребенок — индивидуален, и можно столкнуться с различными вариантами и сочетаниями внутрисердечных нарушений: слишком маленьким дефектом между предсердиями, слишком большим межжелудочковым сообщением, врожденным сужением легочной артерии и ее ветвей и т.д.
В каждом случае надо выбрать наиболее рациональный и безопасный способ помощи. Иногда следует вначале расширить межпредсердный дефект в рентгенохирургическом кабинете, иногда — наложить манжетку на легочный ствол, чтобы уменьшить легочный кровоток и предупредить развитие других осложнений. Сегодня все эти методы хорошо известны, но тактика лечения и последовательность — индивидуальны. Главное, чтобы ребенок сразу попал в специализированное учреждение, где есть соответствующий опыт.
Сможет ли ребенок долго и нормально жить, не имея одной из частей сердца — правого желудочка? Оказывается, сможет, и долго, и совсем неплохо. Сегодняшняя статистика говорит о том, что подавляющее большинство больных, живущих с «фонтеновским кровообращением», относятся к так называемому функциональному классу I-II степени, т.е. практически здоровы. Примерно четверти из них, оперированных 10 и более лет назад, потребовались повторные операции по замене ранее вшитых протезов, но сегодня по мере совершенствования техники операции, можно надеяться, что число таких случаев значительно уменьшится.
Главным осложнением в отдаленные сроки после операции является так называемая протеиновая энтеропатия, выражающаяся в отеках, скоплении жидкости в полостях, потере белка. Оно поддается консервативному лечению. Так что будем оптимистами.
Понятно, что ребенок должен постоянно (минимум раз в полгода) наблюдаться у детского кардиолога, даже если нет видимых осложнений. Ребенок – не инвалид ни в коем случае, но наблюдать его должен квалифицированный и опытный врач.
В любом случае, вашему ребенку со сложнейшим ВПС было сделано все, что может предложить современная медицина, и это — такая же победа врачей, как и ваша.
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
Онлайн-консультации