Пролапс митрального клапана — норма или патология?
П
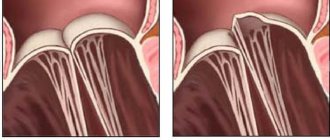
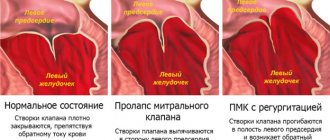
од термином пролапс митрального клапана (ПМК) понимают
провисание одной или обеих створок митрального клапана в полость левого предсердия в систолу
. Данный феномен описан относительно недавно – только во второй половине 60–х годов, когда появился метод эхокардиографии. Тогда было замечено, что у лиц со среднесистолическим щелчком и систолическим шумом в I точке аускультации при эхокардиографии створка(–и) митрального клапана в систолу провисает в полость левого предсердия.
В настоящее время различают первичный (идиопатический) и вторичный ПМК. Причинами вторичного ПМК
являются ревматизм, травма грудной клетки, острый инфаркт миокарда и некоторые другие заболевания. Во всех данных случаях происходит отрыв хорд митрального клапана, вследствие чего створка начинает провисать в полость предсердия. У больных с ревматизмом из–за воспалительных изменений, затрагивающих не только створки, но и прикрепляющиеся к ним хорды, чаще всего отмечен отрыв мелких хорд 2 и 3–го порядка. Согласно современным воззрениям, для того чтобы убедительно подтвердить ревматическую этиологию ПМК, необходимо показать, что у больного данный феномен отсутствовал до дебюта ревматизма и возник в процессе болезни. Однако в клинической практике сделать это весьма затруднительно. В то же время у больных с недостаточностью митрального клапана, направленных на кардиохирургическое лечение, даже без четкого указания на ревматизм в анамнезе, примерно в половине случаев при морфологическом исследовании створок митрального клапана находят воспалительные изменения как самих створок, так и хорд.
Травма грудной клетки
является причиной острого отрыва хорд и развития тяжелой митральной недостаточности с клинической картиной острой левожелудочковой недостаточности. Нередко это является причиной смерти таких пациентов.
Острый задний инфаркт миокарда
, затрагивающий заднюю папиллярную мышцу, также приводит к отрыву хорд и развитию пролапса задней створки митрального клапана.
Популяционная частота ПМК, по данным разных авторов (от 1,8 до 38%), существенно колеблется в зависимости от используемых критериев диагностики, однако большинство авторов считают, что она составляет 10–15%. При этом на долю вторичного ПМК приходится не более 5% всех случаев. Распространенность ПМК существенно колеблется с возрастом – после 40 лет число лиц с данным феноменом резко уменьшается и в возрастной популяции старше 50 лет составляет всего 1–3%. Поэтому ПМК – это патология лиц молодого трудоспособного возраста
.
У лиц с ПМК по результатам многих исследователей установлена повышенная частота развития серьезных осложнений:
внезапная смерть, жизненно опасные нарушения ритма, бактериальный эндокардит, инсульт, тяжелая недостаточность митрального клапана. Их частота невелика – до 5%, однако учитывая, что эти пациенты работоспособного, призывного и детородного возраста, проблема выделения среди огромного числа лиц с ПМК подгруппы больных с повышенным риском развития осложнений становится крайне актуальной.
Идиопатический (первичный) ПМК
в настоящее время является самой распространенной патологией клапанного аппарата сердца. По мнению абсолютного большинства авторов, основой патогенеза идиопатического ПМК являются генетически детерминированные нарушения различных компонентов соединительной ткани, что приводит к «слабости» соединительной ткани створок митрального клапана и поэтому их пролабированию в полость предсердия под давлением крови в систолу. Поскольку центральным патогенетическим звеном в развитии ПМК считают дисплазию соединительной ткани, то у этих пациентов должны быть признаки поражения соединительной ткани и со стороны других систем, а не только сердца. Действительно, многие авторы описали комплекс изменений соединительной ткани разных систем органов у лиц с ПМК. По нашим данным, у этих пациентов достоверно чаще по сравнению с лицами без ПМК выявляются астенический тип конституции, повышенная растяжимость кожи (более 3 см над наружными концами ключиц), воронкообразная деформация грудной клетки, сколиоз, плоскостопие (продольное и поперечное), миопия, повышенная гипермобильность суставов (3 и более суставов), варикозное расширение вен (в том числе варикоцеле у мужчин), положительные признаки большого пальца (возможность вывести дистальную фалангу большого пальца за ульнарный край ладони) и запястья (первый и пятый пальцы перекрещиваются при обхвате запястья противоположной руки). Поскольку эти признаки выявляются при общем осмотре, их называют фенотипическими признаками дисплазии соединительной ткани. При этом у лиц с ПМК одновременно выявляется не менее 3–х из перечисленных признаков (чаше 5–6 и даже более). Поэтому для выявления ПМК мы рекомендуем направлять на эхокардиографию лиц с одновременным наличием 3–х и более фенотипических признаков дисплазии соединительной ткани.
Нами проводилось морфологическое исследование биоптатов кожи у лиц с ПМК при помощи светооптического исследования (гистологические и гистохимические методы). Выделен комплекс морфологических признаков патологии кожи – дистрофия эпидермиса, истончение и сглаженность сосочкового слоя, деструкция и дезорганизация коллагеновых и эластических волокон, изменение биосинтетической активности фибробластов и патология сосудов микроциркуляторного русла и некоторые другие. При этом в биоптатах кожи лиц контрольной группы (без ПМК) подобных изменений обнаружено не было. Выявленные признаки свидетельствуют о наличии у лиц с ПМК дисплазии соединительной ткани кожи, а следовательно, о генерализации процесса «слабости» соединительной ткани.
Клиническая картина
Клиническая картина при ПМК весьма многообразна и может быть условно поделена на 4 больших синдрома
– вегетативной дистонии, сосудистых нарушений, геморрагический и психопатологический.
Синдром вегетативной дистонии
(СВД) включает в себя боли в левой половине грудной клетки (колющие, ноющие, без связи с физической нагрузкой, длительностью либо несколько секунд для колющих болей, либо часами для ноющих), гипервентиляционный синдром (центральный симптом – чувство нехватки воздуха, желание сделать глубокий, полноценный вдох), нарушение вегетативной регуляции деятельности сердца (жалобы на сердцебиение, чувство редкого биения сердца, ощущение неровного биения, «замирания» сердца), нарушения терморегуляции (ощущение «познабливания», длительно сохраняющийся субфебрилитет после инфекций), расстройства со стороны желудочно–кишечного тракта (синдром «раздраженного кишечника», функциональные желудочные диспепсии и др.), психогенную дизурию (частое или, напротив, редкое мочеиспускание в ответ на психоэмоциональную нагрузку), повышенную потливость. Естественно, в такой ситуации должны быть исключены все возможные органические причины, которые могут вызывать сходную симптоматику.
Синдром сосудистых нарушений
включает синкопальные состояния – вазовагальные (обмороки в душных помещениях, при длительном стоянии и др.), ортостатические, а также предобморочные состояния в тех же условиях, мигрени, ощущение ползанья мурашек в ногах, холодные на ощупь дистальные отделы конечностей, утренние и ночные головные боли (в основе которых лежит венозный застой), головокружения, идиопатические пастозность или отечность. В настоящее время гипотеза об аритмогенной природе синкоп при ПМК не нашла подтверждений, и их рассматривают, как вазовагальные (т.е. нарушение вегетативной регуляции сосудистого тонуса).
Геморрагический синдром
объединяет жалобы на легкое образование синяков, частые носовые кровотечения и кровотечения из десен, обильные и/или длительные менструации у женщин. Патогенез этих изменений сложен и включает нарушение коллаген–индуцированной агрегации тромбоцитов (вследствие патологии коллагена у этих пациентов) и/или тромбоцитопатий, а также патологию сосудов по типу васкулита. У лиц с ПМК и геморрагическим синдромом часто обнаруживают тромбоцитоз и повышение АДФ–агрегации тромбоцитов, которые расценивают, как реактивные изменения системы гемостаза по типу гиперкоагуляции, как компенсаторную реакцию данной системы на хронический геморрагический синдром.
Синдром психопатологических расстройств
включает неврастению, тревожно–фобические расстройства, расстройства настроения (чаще всего в виде его неустойчивости). Интересен тот факт, что выраженность клинической симптоматики напрямую коррелирует с количеством фенотипических признаков «слабости» соединительной ткани со стороны других систем органов и с выраженностью морфологических изменений кожи (см. выше).
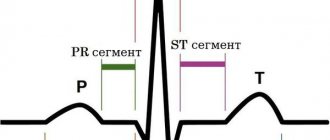
Изменения ЭКГ при ПМК чаще всего выявляются при холтеровском мониторировании. Достоверно чаще у этих пациентов отмечены отрицательные зубцы Т в отведениях V1,2, эпизоды пароксизмальной наджелудочковой тахикардии, дисфункция синусового узла, удлинение интервала QT, суправентрикулярные и желудочковые экстрасистолы в количестве более 240 за сутки, горизонтальная депрессия сегмента ST (продолжительностью более 30 минут за сутки). Поскольку депрессия сегмента ST имеется у лиц с болями в левой половине грудной клетки, отличными от стенокардии, учитывая также молодой возраст этих пациентов, отсутствие дислипидемии и других факторов риска ИБС, данные изменения не трактуются, как ишемические. В их основе лежат неравномерность кровоснабжения миокарда и/или симпатикотония. Экстрасистолы, особенно желудочковые, в большей степени были выявлены в положении больных лежа. При этом во время пробы с физической нагрузкой экстрасистолы исчезали, что свидетельствует об их функциональном характере и о роли гиперпарасимпатикотонии в их генезе. При специальном исследовании мы отметили преобладание парасимпатического тонуса и/или снижение симпатических влияний у лиц с ПМК и экстрасистолией.
При проведении пробы с максимальной физической нагрузкой мы установили высокую или очень высокую физическую работоспособность пациетов с ПМК, которая не отличалась от таковой у лиц контрольной группы. Однако у этих лиц выявлены нарушения гемодинамического обеспечения физической нагрузки в виде более низких пороговых значений частоты сердечных сокращений (ЧСС), систолического артериального давления (АД), двойного произведения и их более низкого прироста на пороговую нагрузку, что напрямую коррелировало с тяжестью СВД и фенотипической выраженностью дисплазии соединительной ткани.
Обычно в клинической практике ПМК ассоциируется с наличием артериальной гипотонии. По нашим данным, частота артериальной гипотонии достоверно не отличалась у лиц с наличием или отсутствием ПМК, однако частота артериальной гипертонии (1 степени по ВОЗ–ВНОК) была достоверно выше, чем в контрольной группе. Артериальная гипертония выявлена нами примерно у 1/3 обследованных молодых (18–40) лиц с ПМК, тогда как в контрольной группе (без ПМК) – лишь у 5%.
Функционирование вегетативной нервной системы при ПМК имеет важное клиническое значение, поскольку до последнего времени считали, что у этих пациентов преобладают симпатические влияния, поэтому препаратами выбора для лечения были b-блокаторы. Однако в настоящее время точка зрения на этот аспект существенно изменилась: среди этих людей имеются лица как с преобладанием тонуса симпатического, так и с преобладанием тонуса парасимпатического звена вегетативной нервной системы. При этом последние даже преобладают. По нашим данным, повышение тонуса того или иного звена больше коррелирует с клиническими симптомами. Так, симпатикотония отмечена при наличии мигрени, артериальной гипертонии, болях в левой половине грудной клетки, пароксизмальной наджелудочковой тахикардии, ваготония – при синкопальных состояниях, экстрасистолии.
Наличие СВД и тип вегетативной регуляции у лиц с ПМК напрямую связан с четвертым синдромом клинической картины – психопатологическими расстройствами. При наличии этих расстройств увеличивается частота выявления и тяжесть СВД, а также частота обнаружения гиперсимпатикотонии. По мнению многих авторов, именно психопатологические расстройства у этих лиц являются первичными, а симптомы СВД – вторичные, возникающие в ответ на эти психопатологические особенности. Косвенно в пользу данной теории свидетельствуют и результаты лечения лиц с ПМК. Так, применение b-блокаторов, хотя и позволяет ликвидировать объективные признаки гиперсимпатикотонии (например, ЧСС достоверно снижается), но все другие жалобы сохраняются. С другой стороны, лечение лиц с ПМК противотревожными препаратами приводило не только к коррекции психопатологических расстройств, значительному улучшению самочувствия пациентов, но и к исчезновению гиперсимпатикотонии (снижались ЧСС и уровень АД, уменьшались или исчезали суправентрикулярные экстрасистолы и пароксизмы наджелудочковой тахикардии).
Диагностика
Основным методом диагностики ПМК по–прежнему является эхокардиография
. В настоящее время считают, что необходимо использовать только В–режим, в противном случае можно получить большое количество ложноположительных результатов. В нашей стране принято делить ПМК на 3 степени в зависимости от глубины пролабирования (1–я – до 5 мм ниже клапанного кольца, 2–я – 6–10 мм и 3–я – более 10 мм), хотя многими отечественным авторами установлено, что ПМК глубиной до 1 см прогностически благоприятен. При этом лица с 1–й и 2–й степенью пролабирования практически не отличаются друг от друга по клинической симптоматике и частоте осложнений. В других странах принято делить ПМК на органический (при наличии миксоматозной дегенерации) и функциональный (в отсутствие ЭхоКГ–критериев миксоматозной дегенерации). На наш взгляд, такое деление более оптимально, поскольку от наличия миксоматозной дегенерации (независимо от глубины ПМК) зависит вероятность развития осложнений.
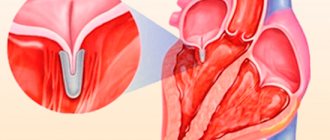
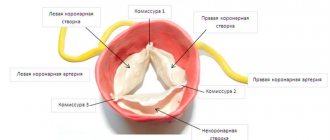
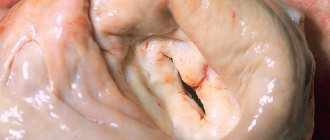
Под миксоматозной дегенерацией
понимают комплекс морфологических изменений створок митрального клапана, соответствующих «слабости» соединительной ткани (см. выше описание морфологических изменений кожи) и описанных морфологами в результате изучения материалов, полученных при проведении кардиохирургических операций (у лиц с ПМК и тяжелой, гемодинамически значимой, митральной регургитацией). В начале 90–х годов японские авторы создали эхокардиографические критерии миксоматозной дегенерации – их чувствительность и специфичность составляет около 75%. Они включают утолщение створки более 4 мм и ее пониженную эхогенность. Выявление лиц с миксоматозной дегенерацией створок представляется очень важным, поскольку все осложнения ПМК (внезапная смерть, тяжелая недостаточность митрального клапана, требующая хирургического лечения, бактериальный эндокардит и инсульты) в 95–100% случаев отмечены только при наличии миксоматозной дегенерации створок. По мнению ряда авторов, таким больным необходимо проводить антибиотикопрофилактику бактериального эндокардита (например, при удалении зубов). ПМК с миксоматозной дегенерацией считают также одной из причин инсульта у молодых людей с отсутствием общепринятых факторов риска развития инсульта (прежде всего артериальной гипертонии). Мы изучали частоту ишемических инсультов и транзиторных ишемических атак у больных в возрасте до 40 лет по архивным данным 4 клинических больниц Москвы за 5–летний период. Доля этих состояний у лиц до 40 лет составляла в среднем 1,4%. Из причин инсультов у молодых следует отметить гипертоническую болезнь – 20% случаев, однако у 2/3 молодых лиц отсутствовали какие–либо общепринятые факторы риска развития ишемического поражения головного мозга. Части из этих пациентов (кто дал согласие на участие в исследовании) выполнена эхокардиография, и в 93% случаев обнаружен ПМК с миксоматозной дегенерацией пролабирующих створок. Миксоматозно измененные створки митрального клапана могут являться основой для формирования микро– и макротромбов, поскольку потеря слоя эндотелия с появлением мелких ульцераций вследствие увеличения механического напряжения сопровождается отложением на них фибрина и тромбоцитов. Следовательно, инсульты у этих пациентов имеют тромбоэмболический генез, и поэтому лицам с ПМК и миксоматозной дегенерацией ряд авторов рекомендуют ежедневный прием малых доз ацетилсалициловой кислоты. Другой причиной для развития острых нарушений мозгового кровообращения при ПМК является бактериальный эндокардит и бактериальные эмболы.
Лечение
Вопросы лечения этих пациентов практически не разработаны. В последние годы все большее количество исследований посвящено изучению эффективности пероральных препаратов магния
. Это обусловлено тем, что ионы магния необходимы для укладки волокон коллагена в четвертичную структуру, поэтому дефицит магния в тканях обусловливает хаотичность расположения волокон коллагена – основной морфологический признак дисплазии соединительной ткани. Известно также, что биосинтез всех компонентов матрикса в соединительной ткани, а также поддержание их структурной стабильности является функцией фибробластов. С этой точки зрения представляется важным выявленное нами и другими авторами уменьшение содержания РНК в цитоплазме фибробластов дермы, что свидетельствует о снижении биосинтетической активности последних. Учитывая сведения о роли дефицита магния в нарушении функции фибробластов, можно предположить, что описанные изменения биосинтетической функции фибробластов и нарушение структуры экстрацеллюлярного матрикса связаны с дефицитом магния у больных с ПМК.
Ряд исследователей сообщали о дефиците магния в тканях у лиц с ПМК. Нами установлено достоверное снижение уровня магния в волосах у 3/4 пациентов с ПМК (в среднем 60 и менее мкг/г при норме 70–180 мкг/г).
Мы провели лечение 43 пациентов с ПМК в возрасте от 18 до 36 лет в течение 6 месяцев препаратом Магнерот
, содержащим 500 мг оротата магния (32,5 мг элементарного магния) в дозе 3000 мг/сут (196,8 мг элементарного магния), на 3 приема.
После применения Магнерота у больных с ПМК выявлено достоверное уменьшение частоты всех симптомов СВД
. Так, частота нарушений вегетативной регуляции ритма сердца уменьшилась с 74,4 до 13,9%, нарушений терморегуляции – с 55,8 до 18,6%, болей в левой половине грудной клетки – с 95,3 до 13,9%, расстройств желудочно–кишечного тракта – с 69,8 до 27,9%. До лечения легкая степень СВД диагностирована в 11,6%, средняя – в 37,2%, тяжелая в 51,2% случаев, т.е. преобладали больные с тяжелой и средне–тяжелой выраженностью синдрома вегетативной дистонии. После лечения отмечено достоверное уменьшения тяжести СВД: появились лица (7%) с полным отсутствием данных нарушений, в 5 раз увеличилось количество больных с легкой степенью СВД, при этом тяжелой степени СВД не обнаружено ни у одного больного.
После терапии у больных с ПМК также достоверно уменьшились частота и выраженность сосудистых нарушений:
утренней головной боли с 72,1 до 23,3%, синкопов с 27,9 до 4,6%, предобморочных состояний с 62,8 до 13,9%, мигрени с 27,9 до 7%, сосудистых нарушений в конечностях с 88,4 до 44,2%, головокружений с 74,4 до 44,2%. Если до лечения легкая, средняя и тяжелая степени были диагностированы у 30,2, 55,9 и 13,9% лиц соответственно, то после лечения в 16,3% случаев сосудистые нарушения отсутствовали, в 2,5 раза увеличилось число больных с легкой степенью сосудистых расстройств, тяжелая же степень не выявлена ни у одного из обследованных после лечения Магнеротом.
Установлено и достоверное уменьшение частоты и тяжести геморрагических нарушений:
обильных и/или длительных менструаций у женщин с 20,9 до 2,3%, носовых кровотечений – с 30,2 до 13,9%, исчезала кровоточивость десен. Число лиц без геморрагических нарушений увеличилось с 7 до 51,2%, со средней степенью выраженности геморрагического синдрома – уменьшилось с 27,9 до 2,3%, а тяжелая степень не выявлена.
Наконец, после лечения у больных с ПМК достоверно уменьшилась частота неврастении
(с 65,1 до 16,3%) и расстройств настроения (с 46,5 до 13,9%), хотя частота тревожно–фобических расстройств не изменилась.
Выраженность клинической картины в целом после лечения также достоверно уменьшилась. Поэтому неудивительно, что было отмечено высокодостоверное повышение качества жизни этих больных
. Под этим понятием подразумевают субъективное мнение больного об уровне своего благополучия в физическом, психологическом и социальном плане. До лечения по шкале самооценки общего самочувстия лица с ПМК оценили его хуже, чем контрольная группа (лица без ПМК) – примерно на 30%. После лечения больные с ПМК отметили достоверно улучшение качества жизни по этой шкале – в среднем на 40%. При этом оценка качества жизни по шкалам «работа», «социальная жизнь» и «личная жизнь» до лечения у лиц с ПМК также отличалась от контроля: при наличии ПМК больные расценили имеющиеся у них нарушения по этим трем шкалам, как начальные или умеренные – примерно в равной степени, тогда как здоровые люди отмечали отсутствие нарушений. После лечения у больных с ПМК выявлено высокодостоверно улучшение качества жизни – на 40–50% по сравнению с исходным.
По данным холтеровского мониторирования ЭКГ после терапии Магнеротом по сравнению с исходным уровнем установлено достоверное уменьшение средней ЧСС (на 7,2%), количества эпизодов тахикардии (на 44,4%), продолжительности интервала QT и количества желудочковых экстрасистол (на 40%). Особенно важным представляется положительный эффект Магнерота в лечении желудочковой экстрасистолии
у этой категории пациентов.
По данным суточного мониторирования АД выявлены достоверное снижение до нормальных значений среднего систолического и диастолического АД, гипертонической нагрузки. Данные результаты подтверждают ранее установленный факт, что между уровнем магния в тканях и уровнем АД существует обратная зависимость, а также тот факт, что дефицит магния является одним из патогенетических звеньев развития артериальной гипертонии.
После лечения выявлено уменьшение глубины пролабирования митрального клапана, достоверное уменьшение числа пациентов с гиперсимпатикотонией, при этом увеличилось количество лиц с равным тонусом обоих отделов вегетативной нервной системы. Подобные сведения содержатся и в работах других авторов, посвященных лечению лиц с ПМК пероральными препаратами магния.
Наконец, по данным морфологического исследования биоптатов кожи после терапии Магнеротом в 2 раза уменьшилась выраженность морфологических изменений.
Таким образом, после 6–ти месячного курса терапии препаратом Магнерот у пациентов с идиопатическим ПМК установлено значительное улучшение объективной и субъективной симптоматики с полной или почти полной редукцией проявлений болезни более чем у половины больных. На фоне лечения отмечено уменьшение тяжести синдрома вегетативной дистонии, сосудистых, геморрагических и психопатологических расстройств, нарушений ритма сердца, уровня АД, а также улучшение качества жизни пациентов. Кроме того, на фоне лечения достоверно уменьшилась выраженность морфологических маркеров дисплазии соединительной ткани по данным биопсии кожи.
Литература:
1. Мартынов А.И., Степура О.Б., Остроумова О.Д. и соавт. Пролапс митрального клапана. Часть I. Фенотипические особенности и клинические проявления. // Кардиология. – 1998,№1 – С.72–80.
2. Мартынов А.И., Степура О.Б., Остроумова О.Д. и соавт. Пролапс митрального клапана. Часть II. Нарушения ритма и психологический статус. // Кардиология. – 1998,№2 – С.74–81.
3. Степура О.Б., Остроумова О.Д. и соавт. Роль магния в патогенезе и развитии клинической симптоматики у лиц с идиопатическим пролапсом митрального клапана. // Российский кардиологический журнал – 1998, №3 – С.45–47.
4. Степура О.Б., Мельник О.О., Шехтер А.Б. и соавт. Результаты применения магниевой соли оротовой кислоты «Магнерот» при лечении больных с идиопатическим пролапсом митрального клапана. // Российские медицинские вести – 1999 – №2 – С.12–16.
Симптомы
Наиболее типичная жалоба – это одышка, которая возникает при умеренной и тяжелой хронической митральной недостаточности и клиника острой левожелудочковой недостаточности при острой митральной недостаточности. Наличие фибрилляции предсердий до операции является независимым предиктором снижения отдаленной выживаемости после операции на митральном клапане по поводу хронической митральной недостаточности.
Дифференциальный диагноз
Проводится дифференциальная диагностика с приобретенными пороками сердца, основанная, прежде всего, на аускультативных данных (в особенности при наличии систолического шума, который свидетельствует о митральной регургитации).
Дифференциальная диагностика идиопатического ПМК и миокардита. Аускультативно: при миокардите появившийся шум в течение нескольких дней постепенно прогрессирует по интенсивности и площади, а затем в той же последовательности регрессирует. Одновременно с этим наблюдается изменение границ сердца влево с последующим возвращением к прежнему уровню. При миокардите не выслушивается систолического «клика». Подтверждением диагноза служат снижение фракции выброса и некоторое расширением камеры левого желудочка при эхокардиографическом исследовании, а также динамика биохимических изменений в крови.
Указанные выше заболевания, так же как и кардиомиопатия, ишемическая болезнь сердца, артериальная гипертензия, сопровождаются вторичным пролабированием створок митрального клапана. Это связано в основном с ослаблением или разрывом хордальных нитей или изменением функции папиллярных мышц. Опорным пунктом в диагностике, в особенности при невозможности произвести эхокардиографию, выступает наличие постоянного грубого шума, интенсивность которого соответствует степени митральной регургитации и не зависит от нагрузочных проб, информативных для первичного ПМК.
Также дифференциальный диагноз проводится с аневризмой межпредсердной перегородки, которая, как правило, располагается в области овального окна и связана с несостоятельностью соединительнотканных элементов. Она является врожденной аномалией развития или возникает при наследственных дисплазиях соединительной ткани, после спонтанного закрытия дефекта межпредсердной перегородки. Аневризматическое выпячивание обычно небольшое, не сопровождается гемодинамическими нарушениями и не требует хирургического вмешательства. Подозрение на аневризму может возникнуть при наличии щелчков в сердце, аналогичных таковым при ПМК. Возможно также сочетание аневризмы и пролапса. С целью уточнения характера звуковых изменений в сердце проводят эхокардиографию. Подтверждением аневризмы является наличие выпячивания межпредсердной перегородки в сторону правого предсердия в области овального окна. Дети с данным пороком предрасположены к развитию наджелудочковых тахиаритмий, синдрома слабости синусового узла.
Общая информация
Краткое описание
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Клиническая картина
Cимптомы, течение
У женщин клинические симптомы встречаются чаще. Среди них тошнота и «ком в горле», повышенная потливость, вегетативные кризы, астеновегетативный синдром, периоды субфебрилитета, синкoпальные состояния. Вегетативные кризы могут появляться спонтанно или ситуационно, повторяются не менее трех раз в течение трех недель, не связаны со значительным физическим напряжением или угрожающей жизни ситуацией. В основном кризы не сопровождаются яркой эмоциональной и вегетативной аранжировкой.
Характерные аускультативные признаки ПМК
— изолированные щелчки (клики); — сочетание щелчков с позднесистолическим шумом; — изолированные позднесистолические шумы (ПСШ); — голосистолические шумы.
Необходимо различать щелчки ПМК и щелчки изгнания, которые возникают в раннюю систолу и могут быть аортальными и легочными. Аортальные щелчки изгнания выслушиваются, как и при ПМК, на верхушке, не меняют свою интенсивность в зависимости от фазы дыхания. Легочные щелчки изгнания выслушиваются в области проекции клапана легочной артерии. Их интенсивность изменяется при дыхании, они лучше слышны во время выдоха.
Наиболее часто ПМК проявляется сочетанием систолических щелчков с позднесистолическим шумом, который обуславливается турбулентным током крови, возникающим из-за выбухания створок и вибрации натянутых сухожильных нитей. Зачастую более отчетливо сочетание систолических щелчков и позднего шума выявляется в вертикальном положении после физической нагрузки.
Позднесистолический шум лучше выслушивается в положении лежа на левом боку. Он усиливается при проведении пробы Вальсальвы и меняет свой характер при глубоком дыхании: на выдохе шум усиливается и иногда приобретает музыкальный оттенок.
В некоторых случаях при сочетании систолических щелчков с поздним шумом в вертикальном положении может регистрироваться голосистолический шум.
Примерно в 15% случаев наблюдается изолированный позднесистолический шум. Он выслушивается на верхушке, проводится в подмышечную область. Шум продолжается до II тона, носит грубый, «скребущий» характер, лучше определяется в положении лежа на левом боку. Изолированный позднесистолический шум не является патoгномоничным признаком ПМК. Он может встречаться при обструктивных поражениях левого желудочка.
Позднесистолический шум следует отличать от среднесистолических шумов изгнания, которые возникают также в отрыве от первого тона после открытия полулунных клапанов, имеют максимум звучания в среднюю систолу.
Среднесистолические шумы изгнания наблюдаются при:
Диагностика
Эхокардиографические критерии миксоматозного митрального клапана:
Основные электрокардиографические (ЭКГ) нарушения при ПМК: изменения конечной части желудочкового комплекса, нарушения сердечного ритма и проводимости.
На стандартной ЭКГ изменения процесса реполяризации регистрируются в различных отведениях. Типичные варианты: 1. Изолированная инверсия зубцов Т в отведениях от конечностей; II, III, avF без смещения сегмента ST (инверсия чаще связана с особенностями расположения сердца (вертикальное «капельное» сердце, срединно расположенное в грудной клетке по типу «подвешенного» сердца). 2. Инверсия зубцов Т в отведениях от конечностей и левых грудных отведениях (преимущественно в V5-V6) в сочетании с небольшим смещением ST ниже изолинии. Такая инверсия свидетельствует о наличии скрытой миокардиальной нестабильности, частота возрастает в 2 раза при регистрации стандартной ЭКГ в ортостатическом положении. 3. Инверсия зубцов Т в сочетании с подъемом сегмента ST, который обусловлен синдромом ранней реполяризации желудочков (электрокардиографический феномен, заключающийся в псевдокоронарном подъеме ST выше изолинии). В основе синдрома лежат врожденные индивидуальные особенности электрофизиологических процессов в миокарде, приводящие к ранней реполяризации его субэпикардиальных слоев. Встречается в популяции с частотой от 1,5% до 4,9%; у мальчиков в 3 раза чаще, чем у девочек.
Рентгенография. При отсутствии митральной регургитации не наблюдается расширения тени сердца и его отдельных камер. Малые размеры сердца в 60% сочетаются с выбуханием дуги легочной артерии. Обнаруживаемое выбухание дуги легочной артерии подтверждает неполноценность соединительной ткани в структуре сосудистой стенки легочной артерии, при этом зачастую определяются пограничная легочная гипертензия и «физиологическая» легочная регургитация.