Причины аортального порока
Существует множество патологических состояний, которые со временем могут приводить к дегенеративным изменениям, отложению кальция на створках аортального клапана, изменению его функции.
Сердце человека способно некоторое время компенсировать нарушение кровообращения. Рано или поздно возникают клинические проявления: головокружение, одышка, обмороки, сердцебиение, синдром стенокардии. Консервативно (с помощью медикаментов) можно частично компенсировать состояние пациента, но не изменить его кардинально и не улучшит качество жизни..
Как выполняется протезирование аортального клапана в клинике ЦЭЛТ?
Эффективный метод лечения аортального порока — замена клапана искусственным биологическим протезом. Существует два способа такой операции – традиционный хирургический и эндоваскулярный (без разрезов грудной клетки).
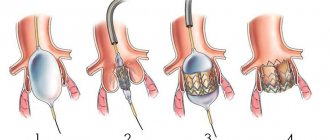
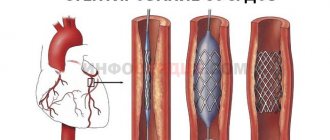
Традиционно операция по замене аортального клапана уже многие годы выполняется открытым способом — то есть через вскрытие грудной полости. Операция проводится с исключением сердца пациента из системы кровообращения и использованием аппарата искусственного кровообращения (АИК). Однако технологии в медицине не стоят на месте. Несколько лет назад появилась новейшая малоинвазивная методика — транскатетерная имплантация аортального клапана (TAVI). В ряде случаев пациенту возможно выполнить протезирование аортального клапана именно таким способом.
Принцип операции эндоваскулярного протезирования аортального клапана похож на операции по стентированию и состоит в том, что доступом через бедренную артерию к месту поврежденного аортального клапана подводится специальный катетер с размещенным на его конце искусственным клапаном (биопротезом) в сложенном виде. Перед установкой этого искусственного клапана производят расширение просвета собственного аортального клапана с помощью специального баллона. Биопротез для TAVI представляет собой специально обработанный трехстворчатый клапан из бычьего перикарда, закрепленный в стенте (металлическом каркасе). Операция для пациента безболезненна, так как выполняется под наркозом. Существует два вида клапанов: баллон расправляющийся и саморасправляющийся.
Обычно TAVI выбирается в качестве метода лечения пациентов старше 75 лет с тяжелым аортальным стенозом, имеющих противопоказания к проведению открытой хирургической операции, но на сегодняшний день показания расширены и для пациентов с низким и средним хирургическим риском.
Коррекция или замена (протезирование) сердечных клапанов
Показания
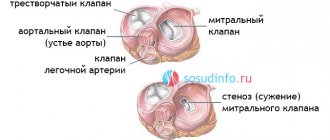
Существуют 2 клапана, отделяющие верхние камеры сердца (предсердия) от нижних (желудочков) — митральный (двухстворчатый) и трикуспидальный (трехстворчатый), а также 2 клапана, отделяющие нижние камеры сердца от крупных артерий – аортальный и пульмональный.
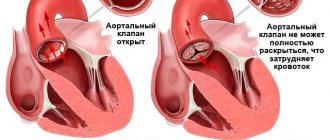
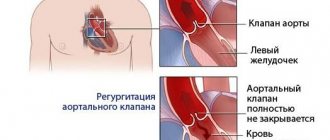
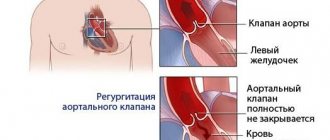
Каждый из этих четырех клапанов отвечает за однонаправленный ток крови при сокращениях предсердий и желудочков – так, чтобы кровь, поступающая в сердце, попадала в крупные артерии и, далее, по всему телу. Если один из клапанов поврежден – будь то негерметичное закрытие створок (клапанная недостаточность) или выраженное сужение отверстия (стеноз), кровоток нарушается, и как следствие нарушается функция всего сердца. В первом случае во время сокращения желудочка клапан не в состоянии предотвратить ретроградный кровоток из желудочка в предсердие (возникает так называемая регургитация). Во втором случае клапан недостаточно открывается, чтобы обеспечить свободный кровоток из предсердия в желудочек или из желудочка в аорту/ в легочный ствол.
Клапанная недостаточность может быть результатам разрыва нескольких сухожильных хорд, соединяющих каждую из створок клапана с сосочковыми мышцами – это возможно при некоторых сердечных заболеваниях, при заболеваниях соединительной ткани (в т.ч. врожденных), а также при травматических поражениях. Стеноз нередко встречается на фоне ревматических заболеваний.
Коррекция или замена сердечных клапанов показана и в том, и в другом случае — как при клапанной недостаточности, так и при стенозе. Вопрос о необходимости хирургического вмешательства решается в зависимости от выраженности недостаточности/стеноза.
При недостаточности клапанов применяются различные виды хирургических вмешательств. Вот некоторые из них:
1) установка синтетических хорд вместо разорванных;
2) треугольная/четырехугольная резекция створки;
3) пересадка собственных хорд;
4) пластика «край в край» по методике Альфиери;
5) при недостаточности митрального клапана на фоне ишемической болезни сердца применяется аннулопластика или имплантация биологического протеза без удаления собственного клапана.
По окончании коррекции выполняется чреспищеводная ЭхоКГ для оценки эффективности вмешательства. При неудовлетворительных результатах производится либо дополнительная коррекция, либо замена клапана.
При стенозе клапанов также применяются различные виды хирургических вмешательств. В том числе:
Каковы преимущества транскатетерной имплантации аортального клапана перед открытой операцией?
При внутрисосудистом протезировании аортального клапана отсутствуют большие разрезы, что значительно сокращает длительность послеоперационной реабилитации, уменьшает болевой синдром и исключает развитие осложнений, связанных с воспалением (нагноением) послеоперационных швов. К другим важным преимуществам TAVI можно отнести:
- Возможность выполнять операцию пациентам с высоким хирургическим риском, пожилым пациентам и пациентам с тяжелыми сопутствующими заболеваниями
- Небольшая продолжительность операции, уменьшенные операционные травмы.
- Операция проводится под местной анестезией (в некоторых случаях под наркозом)
- Отсутствие необходимости подключения к аппарату искусственного кровообращения и «выключения» сердца пациента
- Сокращение сроков нахождения в стационаре
- Низкий процент послеоперационных осложнений и быстрая адаптации после выписки из стационара
Развитие кардиохирургии за последние десятилетия позволило в значительной степени расширить показания к коррекции пороков сердца и улучшить выживаемость пациентов в отдаленные сроки после операции. В значительной степени увеличилось количество операций при клапанной патологии сердца, выполняемых в условиях искусственного кровообращения (ИК). В силу ряда объективных причин растет и количество повторных вмешательств, что связано с рецидивом порока после реконструктивных пластических операций, дисфункцией механического протеза, обусловленной эндокардитом или неадекватной антикоагулянтной терапией, дегенерацией биологических протезов и т.д. В то же время повторные операции на клапанах сердца технически намного сложнее и многими авторами рассматриваются как фактор риска [1, 3, 8].
Цель исследования — анализ непосредственных результатов повторных хирургических вмешательств у пациентов, ранее перенесших операцию при клапанной патологии в условиях ИК.
Материал и методы
За период с 2003 по 2012 г. в отделении хирургии пороков сердца ФГБНУ РНЦХ им. акад. Б.В. Петровского повторные вмешательства на клапанном аппарате сердца выполнены 90 (6,8%) пациентам. У 51 (56,7%) пациента первичная операция выполнялась в других медицинских учреждениях. Возраст пациентов варьировал от 18 до 70 лет (в среднем 54,6±9,5 года). Среди больных были 33 (36,7%) мужчины и 57 (63,3%) женщин (табл. 1)
.
В исследование были включены пациенты, поступившие для проведения повторного вмешательства после успешной первичной коррекции. Из исследования исключались пациенты, которым проведение повторного вмешательства требовалось в результате возникшего осложнения в течение их пребывания в стационаре после первичной операции. Сроки между первой операцией и повторным вмешательством колебались от 2 мес до 36 лет, в среднем 11,6±8,5 года. Трем пациентам в нашем исследовании операция на клапанах сердца была выполнена в третий раз, интервал между вторым и третьим вмешательствами составил 9, 12 и 15 лет.
Среди первичных вмешательств реконструктивные пластические операции на митральном клапане были выполнены 34 (37,8%) пациентам; изолированное протезирование митрального клапана — 32 (35,6%); изолированное протезирование аортального клапана — 20 (22,2%); протезирование митрального и аортального клапанов сердца проведено 4 (4,4%). У 50 (89,2%) пациентов при первичной операции использовались механические протезы клапанов сердца, биологические протезы были имплантированы у 6 (10,8%).
Показания к проведению повторной операции представлены в табл. 2
.
Рецидив порока сердца в большинстве случаев (43 пациента, 47,8%) был вызван прогрессированием ревматического процесса с фиброзной деформацией и кальцинозом створок клапана, подклапанных структур и фиброзного кольца. У 10 больных за прошедшие годы после операции сформировался порок ревматической этиологии на неоперированном клапане. Среди причин дисфункции механических протезов клапанов были выявлены: тромбоз (см. рисунок на цв. вклейке)
— 16 (17,8%) случаев, паннус — 14 (15,6%), парапротезные фистулы — 13 (14,4%).
Рисунок 1. Обструкция механического клапана сердца тромбом. У 10 больных образование парапротезных фистул было связано с протезным инфекционным эндокардитом, у 3 признаков эндокардита выявлено не было.
Рестернотомия выполнялась по стандартной методике с удалением проволочных лигатур и использованием осциллирующей пилы. Этот этап операции был в значительной степени облегчен, если при первичной операции было выполнено ушивание перикарда на всем протяжении. Спаечный процесс в перикарде различной степени выраженности наблюдался у всех пациентов. Кардиолиз осуществляли тупым и острым путем. В первую очередь выделяли структуры, необходимые для подключения аппарата ИК. Подключение аппарата ИК проводили по схеме аорта-полые вены. В случае нарушений гемодинамики кардиолиз продолжали на параллельном ИК и осуществляли только в объеме, необходимом для проведения основного этапа операции, что позволило минимизировать кровопотерю на этом этапе операции.
Основной этап проводили в условиях гипотермической перфузии, с охлаждением до 28-30 °С, и фармакохолодовой кардиоплегии раствором консол или кустодиол. Кардиоплегический раствор доставлялся через роликовый насос аппарата ИК антеградно в корень аорты, селективно в устья коронарных артерий или ретроградно через коронарный синус. Для снижения кровопотери применяли системы для возврата аутологичной крови Cell Saver. Для доступа к митральному клапану использовали левую атриотомию (14 случаев) по старому шву параллельно межпредсердной борозде, а при больших размерах правого предсердия отдавали предпочтение доступу через правое предсердие и межпредсердную перегородку (47).
И только в 5 случаях выполняли доступ по Дюбосту, который обладает максимальной обзорностью митрального клапана в условиях неполного кардиолиза, но в то же время является наиболее травматичным. Для доступа к аортальному клапану производили аортотомию в типичном месте.
При повторном вмешательстве во всех случаях после реконструктивной пластической операции прибегали к протезированию клапана. Изолированное репротезирование митрального или аортального клапана сердца выполнено 36 (40%) пациентам, ушивание парапротезной фистулы с пластикой трехстворчатого клапана по Де Вега — 2 (2,2%). Повторные вмешательства на митральном и аортальном клапанах были проведены 14 (15,6%) пациентам, из них протезирование митрального и аортального клапанов после первичной пластики выполнены 6 (6,7%). Протезирование митрального и трикуспидального клапанов сердца выполнено 1 (1,1%) пациенту, репротезирование митрального и аортального клапанов — 2 (2,2%), репротезирование митрального клапана и протезирование аортального клапана — 3 (3,3%), репротезирование аортального клапана и протезирование митрального клапана — 2 (2,2%) пациентам. Кроме того, 3 (3,3%) больным дополнительно выполнено аортокоронарное шунтирование, 31 (34,4%) — пластика трикуспидального клапана по Де Вега.
При протезировании клапанов сердца у 11 (12,2%) пациентов были использованы биопротезы, механические протезы имплантированы 79 (85,9%).
Время ИК составило в среднем 113,6±34,7 мин (от 50 до 212 мин), время пережатия аорты — 80,4±29,3 мин (32-172 мин). Интраоперационная кровопотеря в среднем составила 1024,5±110,2 мл (400-2000 мл). Применение системы для возврата аутологичной крови Cell Saver, а также дооперационная заготовка аутоплазмы позволили более чем в половине случаев избежать применения донорских компонентов крови.
Результаты
Среднее время нахождения в стационаре составило 15,5±9,4 сут (8-45 сут), средняя продолжительность пребывания в отделении реанимации и интенсивной терапии — 2,5±1,4 сут (от 1 до 16 сут).
Летальность составила 2,2% (2 пациента). Причинами летальных исходов были в первом случае массивная кровопотеря вследствие спонтанного разрыва миокарда левого желудочка в 1-е сутки после репротезирования митрального и аортального клапанов сердца, во втором — тромбоэмболия легочной артерии и аритмогенная остановка сердца в 1-е сутки после протезирования аортального и митрального клапанов сердца.
Среди нелетальных осложнений в ближайшем послеоперационном периоде (табл. 3)
наиболее часто встречались нарушения ритма сердца — у 35 (38,9%) пациентов.
У 6 (6,5%) больных вследствие сохраняющегося узлового ритма был установлен временный электрокардиостимулятор на срок более 10 сут. В 9 (10%) случаях развилось трепетание предсердий, в 8 из них была успешно проведена кардиоверсия. У 1 пациента трепетание предсердий было резистентно к электроимпульсной терапии, и впоследствии была выполнена радиочастотная абляция. Установка постоянного электрокардиостимулятора была произведена 5 пациентам, показаниями являлись полная поперечная блокада, узловая брадикардия, дисфункция синусового узла и фибрилляция предсердий с паузами больше 2,5 с.
Второе место по частоте развития заняла сердечная недостаточность, которая отмечалась у 30 (33,3%) пациентов. У 10 (11,1%) больных выраженная сердечная недостаточность, потребовавшая кардиотонической поддержки более 2 сут, была обусловлена исходно тяжелым состоянием пациентов, объемом или сочетанным характером повторного вмешательства.
Дыхательная недостаточность отмечалась у 10 (11,1%) пациентов. Осложнения со стороны центральной нервной системы в ближайшем послеоперационном периоде отмечены у 4 (4,4%) пациентов: у 3 диагностирована энцефалопатия, острое нарушение мозгового кровообращения в системе левой средней мозговой артерии на 2-е сутки после репротезирования митрального клапана — у 1 (1,1%). У 2 (2,2%) больных возникла транзиторная печеночная недостаточность, у 3 (3,3%) — почечная недостаточность, причем в одном наблюдении потребовалось проведение сеансов гемодиализа. Инфекционные осложнения возникли у 2 пациентов: в одном случае был диагностирован медиастинит, во втором — нагноение мягких тканей послеоперационной раны. Послеоперационное кровотечение, потребовавшее проведения рестернотомии, развилось у 1 (1,1%) больного.
Обсуждение
Число повторных операций на клапанах сердца ежегодно возрастает. Повторные вмешательства на митральном клапане составляют около 10% от всех операций на митральном клапане в США [9]. В нашем центре в 2012 г. повторные операции на клапанах составили 6,8% от всех операций на клапанном аппарате.
Повторная хирургия сердца остается сложной проблемой для сердечно-сосудистых хирургов. Она несет множество рисков во время рестернотомии помимо самой операции. Многие хирурги предпочитают проведение торакотомии для снижения частоты осложнений и уменьшения продолжительности пребывания больного в отделении реанимации и общей продолжительности госпитализации, в особенности у больных, которым ранее была выполнена открытая операция на сердце [9].
Другим подходом, вызывающим дискуссии, является выполнение повторной операции с минимально инвазивным доступом. По мнению ряда авторов [8], он позволяет избежать массивного кровотечения и ранения крупных сосудов. Минимально инвазивный доступ в основном применяется для изолированных повторных операций на митральном клапане и после предшествующей операции аортокоронарного шунтирования. Цель минимально инвазивного доступа — уменьшить риск возникновения массивного кровотечения во время осуществления хирургического доступа. A. Vleissis и соавт. [11] предпочитали применять минимально инвазивный доступ при повторных вмешательствах на митральном клапане. По их данным, в группе из 22 повторных операций на митральном клапане через миниинвазивный доступ не было зарегистрировано летальных исходов и случаев инфицирования послеоперационной раны.
F. Casselman и соавт. [1] опубликовали результаты исследования 80 пациентов, которым провели эндоскопическую повторную операцию на митральном клапане через мини-торакотомный доступ без разведения ребер. Летальность в их серии составила 3,8%.
По данным исследования R. Umakanthan и соавт. [10], включающем 90 пациентов, минимально инвазивная правосторонняя торакотомия без пережатия аорты может быть хорошей альтернативой традиционной рестернотомии при выполнении повторных вмешательств на митральном клапане. В своей работе авторы сделали выводы о безопасности и эффективности минимально инвазивного доступа, снижении операционной летальности у пациентов высокого риска.
M. Ghoreishi и соавт. [5] предпочитают доступ путем рестернотомии при повторных вмешательствах на митральном клапане, но проводят перед операцией компьютерную томографию органов грудной клетки для определения риска ранения крупных сосудов во время рестернотомии. В серии повторных операций на митральном клапане они разделили больных на две группы по результатам компьютерной томографии: низкого риска (крупные сосуды находились на расстоянии более 1 см от задней поверхности грудины) и высокого риска (крупные сосуды располагались на расстоянии менее 1 см от задней поверхности грудины). По данным авторов, ранение крупных сосудов во время стернотомии оказывает существенное негативное влияние на результаты хирургического вмешательства. Интраоперационная летальность была существенно выше при ранении крупных сосудов. Больным, входящим в группу высокого риска, перед рестернотомией выполняли канюляцию периферических сосудов для возможности экстренного перевода на ИК.
В настоящем исследовании мы применяли только трансстернальный доступ. Большинство пациентов имели сочетанную патологию клапанов сердца: помимо дисфункции аортального или митрального клапана присутствовала недостаточность трикуспидального клапана или сочетание дисфункции аортального и митрального клапанов. Минимально инвазивный доступ при повторной операции на клапанах имеет ограничения для одновременного выполнения сопутствующих вмешательств на сердце. При использовании минимально инвазивного доступа возникают затруднения для выполнения вмешательства одновременно на двух или трех клапанах, операции «лабиринт» у пациентов с фибрилляцией предсердий. Для проведения подобных операций, по нашему мнению, более оправдано выполнение стандартной рестернотомии, которая в наибольшей степени обеспечивает доступ ко всем структурам сердца. Чтобы уменьшить опасность ранения сердца и крупных сосудов при выполнении рестернотомии, при первичной операции мы рутинно выполняем ушивание перикарда на всем протяжении.
По данным P. Ellman и соавт. [2], установка ИК перед рестернотомией не снижала риск интраоперационного ранения крупных сосудов. В исследовании повторных операций на клапанах сердца мы не выполняли канюляцию периферических сосудов перед рестернотомией, случаев возникновения массивного кровотечения при проведении рестернотомии не наблюдалось.
Согласно результатам M. Murzi и соавт. [8], объем гемотрансфузии при повторных операциях на клапанах сердца выше при применении минимально инвазивного доступа по сравнению со стандартной рестернотомией (4,1 ЕД против 2,7 ЕД). Операционная летальность при минимально инвазивном доступе составила 5,7%, при рестернотомии — 5,9%. Частота перехода на стандартную рестернотомию во время выполнения минимально инвазивного повторного вмешательства на клапанах составила 1,7%. В настоящем исследовании при использовании исключительно традиционной рестернотомии летальность была 2,2%.
В 10-летнем одноцентровом исследовании H. Vohra и соавт. [13] выявили факторы риска летальности и послеоперационных осложнений, среди которых наиболее значимые: фракция выброса левого желудочка менее 50%, необходимость выполнения многоклапанной коррекции и экстренность вмешательства.
В исследовании P. Vogt и соавт. [12], посвященном повторным операциям при дегенерации биологических протезов аортального клапана, факторами риска экстренной повторной операции были: активный инфекционный эндокардит перед проведением первичной операции, послеоперационная пневмония после первичной операции, длительно существующая дисфункция биологического протеза, острая регургитация на биопротезе и легочная гипертензия. Независимыми факторами риска летальности при операции репротезирования биологического клапана названы: экстренная операция, высокий трансвальвулярный градиент при первичной операции и двух- или трехсосудистое поражение коронарных артерий. По нашим данным, повторные операции в первые 3 года после проведения первичной операции выполнены у 18 пациентов, они были связаны с эндокардитом перед первичным вмешательством, тромбозом протеза клапана, парапротезной фистулой и высоким трансвальвулярным градиентом перед первичной операцией. Общая летальность в течение 30 сут после репротезирования аортального клапана составила 5,2% (9 из 172 пациентов). При этом летальность в группе планового репротезирования была всего 1,4% (2 из 141), тогда как экстренное репротезирование сопровождалось летальностью 22,6% (7 из 31) [12]. В нашем исследовании не было летальных исходов при выполнении экстренных повторных вмешательств на клапанах. У обоих умерших выполнялось двухклапанное протезирование.
По данным исследований [5], одновременное выполнение операций на двух клапанах отличается более высокой летальностью. Основной причиной ранней летальности при одновременном репротезировании митрального и аортального клапанов была тяжелая сердечная недостаточность с низкой фракцией выброса [7]. По нашим данным, первой причиной летального исхода был спонтанный разрыв миокарда левого желудочка 2-го типа, при этом кардиолиз левых отделов сердца не выполнялся, и не было предпосылок для травмы миокарда в зоне разрыва. Причиной второго летального исхода была тромбоэмболия легочной артерии.
Парапротезная фистула была причиной повторной операции у 13 (10,9%) пациентов. У 10 из них парапротезная фистула возникла после протезирования митрального клапана и у 3 — после протезирования аортального клапана. У 2 больных после протезирования митрального клапана удалось выполнить ушивание парапротезной фистулы, хотя размер парапротезных фистул был более 1 см.
N. Fukunaga и соавт. [4] провели ретроспективный анализ 118 повторных операций протезирования митрального клапана, проведенных на протяжении 20 лет. Ухудшение выживаемости после повторной операции на митральном клапане наблюдалось у пациентов с трикуспидальной регургитацией 2+ и выше. По результатам исследования был сделан вывод о необходимости поддержания уровня трикуспидальной регургитации в послеоперационном периоде не выше 2+ для улучшения долгосрочной выживаемости. В нашей серии из 90 повторных операций на клапанах сердца мы выполнили аннулопластику трикуспидального клапана по Де Вега во время повторного вмешательства 31 пациенту. Аннулопластику трикуспидального клапана проводили у больных, имеющих 2 и выше степень трикуспидальной регургитации на момент повторной операции.
Заключение
Повторные операции на сердце являются одной из самых сложных категорий хирургических вмешательств, сопровождаются высокой летальностью и большим количеством осложнений. В нашей группе пациентов нам удалось получить хорошие результаты по летальности и количеству послеоперационных осложнений. Эти успехи мы связываем прежде всего со слаженной работой всех служб, обеспечивающих хирургическое вмешательство и послеоперационный уход. С хирургической точки зрения выбор методики доступа для визуализации структур сердца индивидуален, однако мы наиболее часто отдаем предпочтение стандартной рестернотомии, которая имеет ряд неоспоримых преимуществ: обеспечивает наиболее полный обзор всех структур сердца, позволяет выполнить сопутствующие вмешательства на сердце и имеет высокий уровень безопасности при правильной технике ее выполнения.
В 3-летний период после первичной операции наиболее частыми причинами для повторной операции были: инфекционный эндокардит, тромбоз механического протеза, парапротезная фистула.