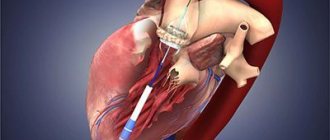
Сердечные клапаны – это основа внутреннего каркаса сердца, представляющая собой складки соединительной ткани. Функции их сводятся к тому, чтобы разграничивать объемы крови в предсердиях и желудочках, позволяя указанным камерам поочередно расслабляться после выталкивания крови в момент сокращения.
Если клапан по каким либо причинам не может выполнять свою функцию, нарушается внутрисердечная гемодинамика, или внутренний ток крови
. Из-за этого постепенно изнашивается сердечная мышца, и развивается сердечная недостаточность. Кроме этого, кровь уже не может нормально циркулировать по организму, так как насосная функция сердца нарушена, и возникает застой крови во внутренних органах – почках, печени, головном мозге. Рано или поздно при отсутствии лечения застойные явления приводят к дистрофии всех органов человека, и, как следствие – к летальному исходу. Поэтому патология клапанов является достаточно серьезной проблемой, в некоторых случаях требующей кардиохирургического вмешательства.
Существует два вида операций на клапанах – пластика и протезирование клапана. В первом случае осуществляется реконструкция клапана на опорном кольце, и применяется при недостаточности сердечного клапана. Второй вид операций заключается в полном замещении клапана протезом. Ниже подробнее будет рассмотрено протезирование клапанов сердца. Чаще всего протезируются митральный и аортальный клапаны сердца.
Показания к операции
Основным показанием для замены клапана в сердце является его грубое органическое поражение с формированием порока сердца,
оказывающее значимое влияние на гемодинамику. Пороки клапанов могут развиваться в результате ревматической лихорадки (ревматизма) – одной из форм стрептококковой инфекции, характеризующейся поражением суставов и сердца (обычно возникает в результате частых ангин, хронического тонзиллита).
Необходимость замены клапана учитывается исходя из стадии сердечной недостаточности, а также согласно данным, полученным при УЗИ сердца (эхокардиоскопии).
клапанное строение сердца и пример стеноза митрального клапана, требующего протезирования
Итак, клинические показания к операции:
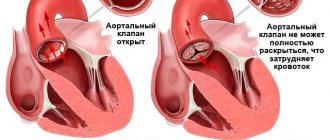
- Обмороки, боли в груди, одышка у пациентов со стенозом аортального клапана,
- Клинические проявления аортального стеноза у пациентов, перенесших аорто-коронарное шунтирование,
- Тяжелые стадии хронической сердечной недостаточности – выраженная одышка при малейшей бытовой активности и/или в покое, значительные отеки конечностей, лица, всего тела (анасарка) у пациентов с умеренным или выраженным стенозом митрального клапана,
- Начальные признаки сердечной недостаточности (одышка при значительных физических нагрузках, нарушения сердечного ритма) у пациентов с незначительным стенозом митрального клапана,
эндокардит – одна из причин поражения клапанов
Инфекционный, или бактериальный эндокардит – вегетации бактериального воспаления на внутренней оболочке сердца, в том числе и на клапанах.
Данные эхокардиоскопии:
- Тяжелый (критический) аортальный стеноз, даже при отсутствии клинических проявлений – площадь отверстия аортального клапана менее 1 см2,
- Сниженная фракция выброса (объем крови, выбрасываемой в аорту при каждом сокращении левого желудочка) менее 50%,
- Площадь митрального кольца менее 1.5 см2,
- Фракция выброса при митральном стенозе менее 60%.
Новый подход к оценке ремоделирования сердца при протезировании митрального клапана
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Диагностический вклад каждого из применяемых сегодня структурно-геометрических показателей ремоделирования сердца обладает достаточной информативностью, но отражает только один из множества аспектов этого сложного процесса. Роль показателя, способного комплексно и в полной мере отразить динамику ремоделирования сердца, на наш взгляд, может выполнять соотношение объемов полостей сердца, получившее название индекса ремоделирования объемов (ИРО) полостей сердца. ИРО отражает соотношение объема желудочка к объему предсердия. Его можно использовать отдельно для оценки ремоделирования правых и левых отделов сердца. Поскольку специально проведенное исследование показало, что ремоделирование и левых, и правых отделов сердца происходит по идентичному алгоритму, наиболее целесообразным признано оценивать степень ремоделирования сердца по изменению индекса ремоделирования объемов левых камер [1, 2].
Механические дисковые протезы нарушают физиологическую структуру кровотока: разделяют единый кровоток на два эксцентричных потока, неравных по объему и скорости (основной и малый), что и приводит к нарушению однородности течения, превышению скоростей течения выше физиологических значений и образованию зон замедленного течения крови. Как правило, хирурги ориентируют эти протезы большим отверстием в сторону задней стенки левого желудочка (ЛЖ). Отклонение направления потока может потребовать дополнительного времени для адаптации полости ЛЖ к измененному кровотоку и более протяженных сроков восстановления геометрии формы. Эксцентричность потока (смещение центра потока от центра проходного отверстия дискового протеза) является их ключевой гемодинамической характеристикой. Для двустворчатых протезов характерен центральный характер потока (совмещение центра потока с центром проходного отверстия протеза), что, очевидно, более благоприятно для восстановления геометрии полости ЛЖ. Симметричность расположения запирательных элементов облегчает диастолическое заполнение. Структура кровотока на этих протезах более однородная, отклонение оси движения кровотока значительно меньше, чем у дисковых моделей [1-10].
В целом дисковые протезы при митральном протезировании не уступают двустворчатым типам ПКС по эффективности и безопасности функционирования, показателям выживаемости пациентов и развития осложнений в течение 10 лет после операции [7]. Но возможности дисковых типов ПКС в создании необходимого физиологически подобного потока в полости ЛЖ после митрального протезирования более ограничены, какой бы ни была ориентация большого отверстия протеза в полости ЛЖ (рис. 1).
Рис. 1.
ЭхоКГ изображение дискового протеза в митральной позиции.
а)
Апикальный доступ.
б)
Апикальный доступ, с увеличением.
в)
По короткой оси.
г)
С цветным картированием транспротезного потока.
Двустворчатые протезы, обладая меньшей по сравнению с дисковыми ПКС высотой профиля, соответствуют хирургическим требованиям частичного или полного сохранения хордального аппарата ЛЖ при протезировании митрального клапана [1-2]. Характер потока за двустворчатым клапаном в большей степени отвечает организации близкого к физиологическому типу транспротезного потока, способствующего более эффективному восстановлению геометрии полости ЛЖ (рис. 2).
Рис. 2.
ЭхоКГ изображение двустворчатого протеза в митральной позиции.
а)
Апикальный доступ.
б)
Апикальный доступ, с увеличением.
в)
По короткой оси.
г)
С цветным картированием транспротезного потока.
В многочисленных исследованиях установлено, что протезирование митрального клапана механическими протезами обоих типов приводит к достоверному улучшению геометрических и структурно-морфологических параметров всех полостей сердца. И дисковые, и двустворчатые протезы способствуют таким изменениям геометрии полостей сердца, которые приводят к улучшению внутрисердечной гемодинамики и повышению качества жизни больного. В исследованиях доказано, что конструктивные особенности протезов достоверно влияют на процессы ремоделирования полостей сердца. Имплантация двустворчатых протезов создает более благоприятные условия для восстановления внутрисердечной гемоди намики и геометрии сердца [1, 2, 5].
Наиболее близким к нативному является кровоток у биологических протезов: гибкие створки биопротеза в диастолу обеспечивают свободу просвета проходного отверстия клапана и создают гораздо меньшее препятствие для транспротезного кровотока. Кровоток через биологический протез носит преимущественно ламинарный характер, ориентированный по длинной оси ЛЖ к его верхушке (рис. 3).
Рис. 3.
ЭхоКГ изображение биологического протеза (Sorin Perikarbon) в митральной позиции.
а)
Апикальный доступ.
б)
Апикальный доступ, с увеличением.
в)
По короткой оси.
г)
С цветным картированием транспротезного потока.
При открытии протеза плоскости ксеноперикардиальных створок, прикрепленные к стойкам, создают некое подобие короткого сосуда, протяженностью равной высоте стоек каркаса протеза (что составляет 18-22 мм), за пределами которого вокруг ламинарного диастолического транспротезного потока возникают небольшие парапоточные завихрения, практически не искажающие ламинарный характер трансклапанного потока, его гемодинамические характеристики и направление [1, 2, 5].
По сравнению с механическими протезами в отдаленные сроки после протезирования у пациентов с биологическими протезами структурно-геометрические показатели сердца оказываются ближе к норме, чем у пациентов с механическими протезами [5], причем положительное ремоделирование полостей сердца после имплантации биологических протезов начинается уже в ранние послеоперационные сроки.
Также установлено, что при протезировании митрального клапана восстановление геометрии предсердий значительно отстает от восстановления желудочков. Поэтому полного восстановления нормального соотношения полостей сердца не происходит, но наступает значительное улучшение, о чем свидетельствует динамика значений соотношения объемов полостей сердца. ИРО позволил оценить степень патологического ремоделирования сердечных камер при приобретенных пороках митрального клапана до операции и на всех этапах хирургического лечения. Статистический анализ, проведенный нами ранее [1], подтвердил хорошее качество и высокую прогностическую достоверность предлагаемой модели оценки степени патологического ремоделирования сердечных камер по индексу ИРО. Были предложены три варианта сценария восстановления геометрии сердечных камер в зависимости от исходного уровня ИРО, отражающего степень патологического ремоделирования с прогностической оценкой восстановления геометрии сердца [1]:
- I тип (легкая степень) — область благоприятного прогноза (ИРО ≥ 0,9);
- II тип (средняя степень) — область неполного восстановления (ИРО 0,6-0,8);
- III тип (тяжелая степень) — область неблагоприятного прогноза (ИРО ≤ 0,5).
Данная классификация апробирована на 368 пациентах, распределенных на 3 группы в зависимости от типа протеза, имплантированного в митральную позицию. При сравнительном анализе особенностей ремоделирования сердца в этих группах достоверно установлена корреляция между характером изменений послеоперационного ремоделирования сердца и типом митрального протеза (рис. 4).
Рис. 4.
Изменение типа (степени тяжести) ремоделирования у пациентов:
а)
1-й группы с двустворчатыми протезами (%).
б)
2-й группы с дисковыми протезами (%).
в)
3-й группы с биологическими протезами (%).
Анализ геометрии сердца в исследуемых группах по типу ремоделирования до операции показал, что в 1-й группе у пациентов с двустворчатыми клапанами доля прогностически благоприятного I типа составляет 38,9%, что почти на 3,0% меньше, чем во 2-й группе больных с дисковыми протезами, и на 13,9% больше, чем в 3-й группе пациентов с биологическими протезами. Доля пациентов с прогностически неблагоприятным III типом оказалась наибольшей в группе пациентов с биологическими протезами и составила 50,0%. Это оказалось на 22,2% выше, чем в группе с двустворчатыми протезами, и на 15,7% больше, чем в группе с дисковыми протезами.
Восстановление внутрисердечной гемодинамики и соответственно геометрии полостей сердца во всех исследуемых группах началось практически сразу после операции (см. рис. 4).
В ранние сроки после протезирования митрального клапана незначительно увеличилась доля пациентов с I типом ремоделирования: в 1-й группе пациентов с двустворчатыми протезами — на 3,9%, в 3-й группе пациентов с биологическими протезами — на 16,6%. Во 2-й группе пациентов c дисковыми протезами доля лиц с I типом снизилась на 22,7%. Во всех группах достоверно уменьшилась доля лиц с прогностически неблагоприятным III типом ремоделирования: в 1-й — на 8,7%, во 2-й — на 9,3%, а в 3-й группе была отмечена наиболее выраженная положительная динамика (в ранние сроки после операции доля пациентов с III неблагоприятным типом ремоделирования снизилась на 41,7%).
В отдаленные сроки после операции в 1-й группе доля пациентов с I типом возросла еще на 23,9%, во 2-й группе — на 33,1% и в 3-й группе — на 47,3%. В результате доля пациентов с I типом в 1-й группе составила 66,7%, во 2-й группе — 52,2% и в 3-й — 88,9%. Доля пациентов с неблагоприятным III типом уменьшилась по сравнению с ранними послеоперационными сроками в 1-й группе еще на 12,4%, во 2-й — на 16,3% и в 3-й группе больных с III типом не осталось. В группах с механическими протезами доли пациентов с III типом оказались практически равными: 6,7% и 8,7% в 1-й и 2-й группах.
Доля пациентов со II, умеренно благоприятным типом ремоделирования в 1-й группе до операции составляла 33,3%, во 2-й — 23,8% и в 3-й — 50,0%. В ранние сроки после операции доля пациентов со II типом достоверно увеличилась во всех группах: в 1-й — на 4,8%, во 2-й — на 32,1% и 3-й — на 25,0%. В отдаленные сроки после операции она снизилась во всех группах: в 1-й — на 11,4%, во 2-й — на 16,5%, в 3-й — на 38,9%. В результате по сравнению с исходными данными доля пациентов со II типом ремоделирования в 1-й группе уменьшилась на 3,3%, в 3-й — на 13,9%, а во 2-й группе она увеличилась на 15,6%, по всей вероятности, за счет улучшения геометрии сердца у пациентов с III типом ремоделирования (см. рис. 4).
Структура транспротезных кровотоков, конструктивные и гемодинамические особенности различных типов протезов оказывают непосредственное влияние на интенсивность послеоперационного восстановления геометрии сердца. Поэтому уменьшение доли пациентов с I типом и увеличение со II типом в раннем послеоперационном периоде можно объяснить тем, что гемодинамика дисковых протезов в меньшей степени соответствует требованиям быстрого восстановления внутрисердечной гемодинамики и геометрии полостей сердца, чем у двустворчатых протезов. Поэтому в ранние послеоперационные сроки в группе лиц с дисковыми протезами, по-видимому, происходит адаптация к измененному транспротезному кровотоку, в результате чего и отмечается некоторый регресс геометрических параметров полостей сердца. Тем не менее применение дискового типа протезов для митральной позиции протезирования вполне оправдано, так как в течение 5 лет сердце постепенно адаптируется к специфике функционирования дискового протеза и геометрия сердечных камер постепенно восстанавливается, в результате чего доля пациентов с III, прогностически неблагоприятным типом ремоделирования у них практически сближается долей пациентов с двустворчатыми протезами. Структура кровотока через биологический протез максимально приближена к гемодинамическим характеристикам нативного клапана, создает наиболее благоприятные условия для восстановления геометрии сердечных камер. Именно в 3-й группе больных с биологическими протезами отмечена наиболее заметная положительная динамика в ремоделировании сердца по индексу ИРО. Помимо гемодинамических характеристик транспротезного кровотока, столь выраженной положительной динамике способствовало то, что в этой группе оказалось мало пациентов с ревматическим поражением митрального клапана, но все пациенты с отрывом хорд от створок митрального клапана оказались в этой группе.
В группе с биологическими протезами до операции доли пациентов с I и II типами оказались равными (по 25%), число пациентов с III типом составило 50%. Таким образом, пациентов с III, самым неблагоприятным типом ремоделирования в 3-й группе оказалось на 26,3% больше, чем в группе с двустворчатыми протезами, и на 15,7% больше, чем в группе с дисковыми протезами. Такое значительное количество пациентов с прогностически неблагоприятным типом ремоделирования находит объяснение: именно в группе с биологическими протезами оказалось самое большое количество пациентов с IV ФК (62,8%). Выраженность положительной динамики в ремоделировании сердечных камер отмечалась практически сразу после операции. Наконец, в исследовании отмечена выраженная положительная динамика у пациентов с III типом ремоделирования, доля которых уже в ранние сроки после операции уменьшилась на 41,7%, а в отдаленные сроки больных с этим типом ремоделирования в группе с биологическими протезами не осталось. Это вполне согласуется с закономерностями ремоделирования всех структурногеометрических параметров сердца в этой группе. Динамика значений указывает на то, что гемодинамические характеристики транспротезного кровотока через биологический протез наиболее приближены к нативным и создают условия, наиболее близкие к естественным, что создает условия, наиболее благоприятные для восстановления внутрисердечной гемодинамики и геометрии камер сердца (см. рис. 4, в).
Заключение
Настоящее исследование на клиническом материале подтвердило, что все виды протезов, имплантированных в митральную позицию, способствуют эффективному восстановлению внутрисердечной гемодинамики. На характер и интенсивность восстановления геометрии сердца достоверно оказывают влияние особенности транспротезного кровотока, обусловленные конструктивными характеристиками протеза. Представленные результаты исследования убедительно доказывают, что протезирование митрального клапана механическими протезами в отдаленные сроки после операции приводит в конечном итоге к идентичным результатам, но характер и сроки восстановления полостей сердца значительно различаются. Так, у пациентов с дисковыми протезами в ранние сроки после операции произошел достоверный регресс в геометрии сердца, который можно расценить как реакцию на специфику эксцентричного транспротезного кровотока с нарушенной однородностью и высокой скоростью течения, с образованием зон замедленного течения и т.д. Тем не менее дисковый протез достоверно улучшает внутрисердечную гемодинамику, что постепенно приводит к улучшению геометрии сердечных камер. Структуру транспротезного кровотока двустворчатого протеза, разделенного двумя симметричными створками, отличает более физиологичный характер. Поэтому уже в ранние сроки после операции отмечается положительная динамика в ремоделировании сердечных камер, которая в итоге приводит к значительному улучшению геометрии сердца. В результате пациентов с I, самым благоприятным типом ремоделирования в группе с двустворчатыми протезами стало на 14,5% больше, чем в группе с дисковыми протезами, а с III, самым неблагоприятным типом — на 2% меньше. Зато в группе с биологическими протезами в отдаленные сроки после операции пациентов с III типом не осталось совсем. Полностью открытое свободное проходное отверстие биологического протеза не создает препятствия для транспротезного кровотока, сохраняя его структуру аналогичной структуре кровотока на нативном митральном клапане человека, что способствует быстрому восстановлению геометрии сердца и переходу в более благоприятный тип ремоделирования уже в ранние сроки после операции. В отдаленные сроки самый благоприятный I тип ремоделирования в этой группе составил 88,9%, а II, умеренно благоприятный тип — 11,1%. Отсутствие в группе с биологическими протезами в отдаленные сроки после операции прогностически неблагоприятного III типа достоверно свидетельствует о том, насколько важным фактором в восстановлении геометрии сердца является характер транспротезного кровотока. Чем ближе к физиологическим параметрам характер транспротезного кровотока, тем быстрее и полноценнее восстанавливается геометрия сердца. Поэтому одним из продуктивных направлений усовершенствования конструктивной формы механического протеза является поиск решения, обеспечивающего максимальную свободу просвета проходного отверстия.
Выводы
- Восстановление геометрии сердца в отдаленные сроки после операции можно определять по динамике изменений индекса ИРО, который отражает переход состояния геометрии сердца из одного типа ремоделирования в другой.
- После протезирования митрального клапана геометрия сердца улучшается, но степень и характер восстановления достоверно зависят не только от характера и тяжести исходной патологии, но и от особенностей транспротезного кровотока, оказывающего влияние на процессы ремоделирования полостей сердца.
- Двустворчатые протезы являются более эффективными из всех современных механических протезов в митральной позиции для восстановления геометрии сердечных камер. Дисковые протезы в большей степени, чем двустворчатые, искажают нормальную физиологическую структуру кровотока, что приводит к нарушению однородности течения, превышению скоростей течения выше физиологических значений, образованию зон замедленного течения крови. Это может потребовать дополнительного времени для адаптации сердечных камер к измененному кровотоку и способствует умеренному регрессу ИРО сердечных камер в ранние сроки после операции, увеличивая общую продолжительность времени восстановления геометрической формы сердца.
- Наиболее выраженная положительная динамика в восстановлении геометрии полостей сердца отмечена при имплантации биологических протезов в митральную позицию. Полностью открытое свободное проходное отверстие биологического протеза не создает препятствия для транспротезного кровотока, сохраняя его структуру аналогичной структуре кровотока на нативном митральном клапане человека, что способствует быстрому восстановлению геометрии сердца и переходу в более благоприятный тип ремоделирования уже в ранние сроки после операции.
Литература
- Бокерия Л.А., Косарева Т.И., Макаренко В.Н. Типы патологического ремоделирования сердца у пациентов с приобретенными пороками митрального клапана // Клиническая физиология кровообращения. 2011 (в печати).
- Бокерия Л.А., Косарева Т.И., Макаренко В.Н. и др. Оценка соотношения объемов полостей сердца как индекса ремоделирования при приобретенных пороках митрального клапана // Клиническая физиология кровообращения. 2010. N1. С. 22-30.
- Бокерия Л.А., Косарева Т.И., Макаренко В.Н. и др. Ремоделирование полостей сердца в зависимости от типа механического протеза после митрального протезирования // Бюллетень НЦ ССХ им. АН. Бакулева «Сердечно-сосудистые заболевания». 2010. N6. С. 54-62.
- Ивлева О.В. Оценка процессов ремоделирования левого желудочка у пациентов с синусовым ритмом и фибрилляцией предсердий до и после протезирования митрального клапана. Дисс. …канд. мед. наук. М., 2008. 202 с.
- Косарева Т.И., Макаренко В.Н., Муратов Р.М., Фадеев А.А. Эхокардиографическая оценка ремоделирования полостей сердца при протезировании митрального клапана механическими и биологическими протезами // Клиническая физиология кровообращения. 2010. N2. С. 28-35.
- Abhayaratna W.P., Barnes M.E., Langins A.P. Reversal of left atrial remodeling in patients with «isolated» left ventricular diastolic dysfunction // J Am Coll Cardiol. 2007. N49 (Suppl A). P. 91A (abstr).
- Fiore A.C., Swartz M.T., Sharp T.G. Double-Valve Replacement with Medtronic-Hall or St. Jude Valve // Ann. Thorac. Surg. 1995. V. 59. P. 1113-1119.
- Greffe G., Henaine R., Metton O. et al. Choice of echocardiography method for postoperative evaluation of mitral valve replacement with a mechanical prosthesis // Arch. Cardiovasc. Dis.; 2008; 101(4): 204-212.
- Machler H., Gert R., Mathias P. et al. Influence of a tilting prosthetic mitral valve orientation on the left ventricular flow — an experimental in vivo magnetic resonance imaging study // Eur J Cardiothorac Surg. 2007. V. 32. P. 102-107.
- Machler H., Perthel M., Reiter G. et al. Influence of bileaflet prosthetic mitral orientation on left venticular flow — an experimental in vivo magnetic resonanse imaging study // Eur J Cardiothorac Surg. 2004. V. 26. P. 747-753.
Журнал «SonoAce Ultrasound»
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Противопоказания к операции
Операция по протезированию клапанов сердца противопоказана при следующих заболеваниях и состояниях:
- Острый инфаркт миокарда,
- Острые нарушения мозгового кровообращения (инсульты),
- Острые инфекционные заболевания, лихорадка,
- Обострения и ухудшение течения хронических заболеваний (сахарный диабет, бронхиальная астма),
- Крайне тяжелая сердечная недостаточность с фракцией выброса менее 20% при митральном стенозе, при этом лечащему врачу следует решить вопрос о необходимости пересадки сердца.
Протезы клапанов сердца – какие бывают?
С 70-хх годов прошлого столетия конфигурация протезов клапанов претерпела некоторые изменения. Одним из самых устаревших считаются клапаны на основе шариковых протезов.
Позднее начали применяться клапаны на основе шарнирных дисковых протезов.
Самыми современными считаются клапаны на основе двустворчатых шарнирных протезов, которые и применяются в настоящее время.
Кроме этого, у пациентов с повышенным риском тромбообразования используются модели, полученные из сердца свиньи – биологические протезы, или ксенотрансплантанты.
Недостатком механических протезов является высокая скорость образования тромбов на створках клапанов
, что связано с высоким риском тромбоэмболии легочной артерии, ишемического инсульта, тромбоза бедренных артерий с возможной ампутацией конечности и т. д. В связи с этим,
у лиц пожилого возраста (старше 65 лет) предпочтительнее проводить операцию по протезированию клапанов биологическим протезом.
Также возможна операция с протезированием аортального клапана собственным клапаном легочной артерии с одномоментным протезированием последнего биологическим протезом.
Недостатком биологических протезов является высокий риск повторного развития бактериального воспаления на установленном свином клапане.
Срок службы клапанов при отсутствии осложнений составляет от 10 до 15 лет, при износе клапана возможно проведение повторной операции по его замене.
Информация для пациентов
- КЛЕТОЧНАЯ ТРАНСПЛАНТАЦИЯ: реальные достижения и возможности клинического применения
- Выбор протеза в российских условиях
- Операция аортокоронарного шунтирования без искусственного кровообращения — что следует учитывать при выборе клиники для ее выполнения?
- «Плетью обуха… перешибёшь!», или правда об аортокоронарном шунтировании и стентировании
- Задержки в выписке рецептов на клопидогрель пациентам после выполненного стентирования являются частой и смертельно опасной проблемой
Традиционным видом хирургического лечения пораженных клапанов сердца у нас в стране и за рубежом является замена их различными протезами.
На раннем этапе развития кардиохирургии врачи пытались применять в качестве заместительного материала клапанные устройства, основанные на биологических тканях ксеногенного (т.е. заимствованного у животных) или аллогенного (гомогенного) (т.е. заимствованного у человека) происхождения. Главным недостатком этих устройств явился ограниченный срок службы клапана в связи с постепенным разрушительным воздействием на биоткани со стороны организма реципиента. Так как в те годы (60-70 г.г.) любая операция на сердце воспринималась как тяжелейшее испытание для пациента (да и для хирурга), первостепенной задачей являлась разработка такого типа протеза, имплантация которого была бы окончательной в хирургическом лечении клапанного порока. Биопротезы явно не соответствовали этому условию. Начался поиск материалов и моделей для создания синтетических, механических протезов. Создано более нескольких десятков моделей, из которых только два конструктивных типа имеют современное всемирное признание и распространение: протез с одним откидным округлым диском (рис.1) и протез с двумя створками в форме полукруга (рис.2-1, рис.2-2).
| Рис.1 Отечественный однодисковый протез «ЛИКС-2» | Рис.2-1 Отечественный двустворчатый протез «Карбоникс-1» | Рис.2-2 Двустворчатый протез фирмы Sulzer Carbomedics (США) |
Имплантация механических протезов с самого раннего этапа сопровождалась частыми случаями развития нарушений мозгового кровообращения с глубокой инвалидизацией пациентов или их смертью, в связи с чем было выработано главное условие жизни больного с механическим протезом – прием препаратов, нарушающих процесс свертывания крови за счет снижения выработки белков коагуляции в печени. Целенаправленное избирательное подавление функции печени с этой целью достигалось назначением больному специфических веществ – производных кумарина. Лечение производными кумарина относится к так называемой антикоагулянтной терапии, а сами вещества названы непрямыми антикоагулянтами. Несколько десятилетий применения механических протезов дали не столь удовлетворительные результаты, как это ожидалось, вне зависимости от модели протеза. Главной проблемой после их имплантации остается высокая частота развития нарушений кровообращения в органах, в том числе в мозге, за счет отрыва от синтетических подвижных частей протеза мелких кровяных свертков, возможность образования которых существует даже при старательной и избыточной антикоагулянтной терапии. С другой стороны, медикаментозное углубление нарушений свертывания крови повышает риск кровотечений различной локализации, нередко фатальных. Поэтому у пациентов, имеющих язву желудка и двенадцатиперстной кишки, выраженную гипертоническую болезнь с опасностью мозговых кровоизлияний и пр. применение антикоагулянтов очень опасно.
В настоящее время можно с уверенностью утверждать, что попытки видоизменения механизмов крепления створок механических протезов, придание им подвижности, создание протеза из гибких синтетических структур и т.д. полностью исчерпали свои возможности в снижении частоты развития тромбоэмболических нарушений кровообращения, а применение антикоагулянтной терапии со всеми возможными ее осложнениями обязательно при любом механическом протезе.
Исчерпав резервы изменения моделей механических протезов в отношении снижения нарушений кровообращения, исследователи и клиницисты пытаются найти способы точного управления действием непрямых антикоагулянтов в надежде иметь возможность углубления антикоагулянтной терапии с минимизацией осложнений последней. С середины 80-х годов в странах Западной Европы и Северной Америки существует лабораторная система тестирования всех реактивов для выполнения анализа на степень глубины антикоагулянтной терапии (реактивов для определения т.н. протромбинового индекса, времени, отношения) в сравнении с эталоном Всемирной Организации здравоохранения (ВОЗ). Реактивы, чувствительность которых отличается от эталона ВОЗ более чем на 20%, считаются непригодными для применения. Остальные реактивы используются с корригирующим коэффициентом для определения современной формы выражения протромбинового времени – Международного нормализованного отношения (МНО).
Наконец, фирмами-производителями механических протезов созданы персональные коагулометры, основанные на определении МНО с помощью полосок с сухими реагентами. Пациент сам или с помощью родственников осуществляет забор крови путем прокалывания подушечки пальца, наносит каплю крови на определенное место на полоске с реактивами, а затем вводит полоску в аппарат, на экране которого через 30-60 сек. выдается показатель МНО.
В кардиохирургической литературе сейчас с надеждой оценивают влияние новых методов контроля за терапией непрямыми антикоагулянтами на частоту возникновения нарушений мозгового кровообращения и длительность жизни пациентов с механическими протезами в целом.
Из выше изложенного можно заключить, что несмотря на все предпринимаемые меры, тромбообразование на механическом протезе остается высоко вероятным, а небезопасная сама по себе антикоагулянтная терапия обязательна для пациента с любым механическим протезом.
Теперь оценим российские условия жизни пациента с механическими протезами.
Отечественные однодисковые протезы достаточно надежны и показали низкую частоту поломок в организме человека в процессе длительного функционирования, чего нельзя сказать о двустворчатых отечественных моделях, с нарушением функции которых чисто технического свойства (выпадение или фрагментация створок) связана серия скандальных судебных процессов в середине 90-х годов. Подобные поломки клинически протекают крайне тяжело, и если пациент находится далеко от специализированного кардиохирургического центра, смертельный исход вероятен почти в 100% случаев. Справедливости ради, необходимо отметить, что все крупные мировые производители механических протезов не избежали случаев технических поломок своих моделей, хотя частота их возникновения была невысокой.
Что же касается проблем свертывания крови на протезе, все выше изложенные моменты можно полностью перенести на наши российские протезы, но с некоторыми национальными особенностями, которые изложены ниже.
Во – первых, в России существуют реальные трудности в точном определении протромбинового теста в том или ином варианте в связи с закупкой больницами самых разнообразных реагентов, зачастую весьма далеких от эталонов ВОЗ. Имеется порочная практика длительного хранения приготовленного реагента с целью экономии, в результате чего цифровое выражение протромбинового теста совершенно дезинформирует и больного, и лечащего врача. Определение же современной формы выражения протромбинового времени, т.е. МНО, выполняется еще в меньшем количестве лабораторий страны. В результате, получить достоверный анализ можно исключительно в больницах, где выполняются операции на сердце и верификации методики уделяется большое внимание. Из этого вытекает вторая особенность.
Во – вторых, если учесть, что таких больниц и центров в России лишь несколько десятков, то можно представить себе препятствия в получении анализа, которые носят территориальный характер.
В – третьих, в России непрямые антикоагулянты не производятся. Из недорогих препаратов имеется препарат фенилин производства Харьковского химфармзавода (ХФЗ) и Таллинского ХФЗ. Несмотря на одинаковую дозировку, производимое действие препаратов заметно отличается. Мало того, мы замечали отличие и между разными сериями препарата одного и того же завода. Все это опять же требует приближения пациента к лаборатории, могущей дать оценку эффекта от приема препарата. К счастью, сейчас в России имеется в продаже высоко стандартизированный непрямой антикоагулянт варфарин фирмы Никомед, а также ввозятся в Россию индивидуальные коагулометры фирмы Зульцер, но стоимость этих продуктов несравнима с выше упомянутыми препаратами, и они недоступны для большинства россиян.
В – четвертых, осведомленность провинциальных российских врачей о принципах проведения терапии непрямыми антикоагулянтами совершенно недостаточна. Наша практика дает обилие примеров полного непонимания врачом, как соотносятся результаты анализа и дозировка препарата, какую тактику избрать при выполнении хирургических процедур у больного с приемом непрямых антикоагулянтов и т.д. В результате, больной сам должен глубоко разбираться в этом предмете, т.е. работает принцип — «спасение утопающих – дело рук самих утопающих».
За годы увлечения механическими протезами, годы надежд и разочарований, кардиохирургия шла вперед, снижая и снижая смертность, связанную с операцией, в результате чего повторное вмешательство на сердце стало обыденностью, выполняемой с риском, не отличающимся от первичной операции.
В новых условиях необходима переоценка наших взглядов на протезирование клапанов, заключающаяся в том, что качество жизни больного с протезом должно быть для нас более значимым, чем страх перед второй операцией, что кажущаяся надежность и долговечность механического протеза оборачивается заменой одной болезни на другую, иногда более опасную, чем первая. Вот почему мы предлагаем пациентам вернуться к имплантации протезов из биологических тканей. Эти протезы не требуют терапии непрямыми антикоагулянтами, современные методики обработки биоткани позволяют обеспечить нормальную работу протеза до 10-12, а иногда и до 20 лет, биологическая деградация протеза происходит постепенно, без возникновения критических ситуаций, подобно природному человеческому клапану, пораженному патологическим процессом. Заглянем в инструкцию к биологическому протезу Sulzer Mitroflow Synergy в раздел «Показания»: «…клапан предложен для использования у тех пациентов, которым нежелательна долговременная антикоагулянтная терапия по разным причинам, как-то проживание в отдаленных областях, наличие болезней желудочно-кишечного тракта или других потенциальных источников кровоточивости, у которых ожидается хирургическая операция в других областях, у пожилых пациентов, и при прочих ситуациях, когда предвидятся трудности в проведении антикоагулянтной терапии по социальным или медицинским причинам». А есть ли вообще пациенты, которым показана имплантация механического протеза? Кто может знать, что ждет больного с механическим протезом в будущем, не возникнет ли у него язва желудка, не потребуется ли операция, не захочет ли молодая женщина родить ребенка? Жизнь с механическим протезом полна опасностей и ограничений.
Вот почему мы имеем в нашем арсенале и предлагаем больным большой набор заменителей клапанов, созданных из биотканей. Среди них ксеноартериальные (рис.3) и ксеноперикардиальные (рис.4) протезы бразильской фирмы BRAILE, биологические протезы фирмы Зульцер (рис.5-1), (рис.5-2), отечественные биопротезы «КемКор» (г. Кемерово) (рис.6) и, наконец, донорские гомографты оригинального производства (рис.7).
| Рис. 3 Биологический ксеноаортальный протез BRAILE (Бразилия) | Рис.4 Биологический ксеноперикардиальный протез BRAILE (Бразилия) | Рис. 5-1 Биологический ксеноперикардиальный протез Mitraflow Synergy (США) |
| Рис. 5-2 Биологический ксеноаортальный протез «LABCOR» (США) | Рис.6. Отечественный биологический ксеноаортальный протез «КемКор» | Рис.7 Гомоаортальный трансплантат (гомографт,аллографт) |
Подготовка к операции
После установки диагноза порока сердца или инфекционного эндокардита решение о необходимости протезирования пораженного клапана должно быть принято как можно скорее. После этого пациент проходит необходимый минимум клинических исследований и направляется лечащим врачом в кардиохирургический центр. Как правило, операция может быть проведена уже через несколько месяцев после постановки диагноза. Если пациент предъявляет заявление в региональный департамент здравоохранения на предоставление квоты (бюджетных ассигнований из средств федерального бюджета для оказания высокотехнологической помощи населению), то ответ на предоставление квоты можно получить уже через 20 дней.
Для госпитализации в кардиохирургическое отделение необходимы следующие документы и обследования:
- Паспорт, страховой полис, СНИЛС,
- Направление лечащего кардиолога или терапевта,
- Выписка из предыдущего места госпитализации (отделение кардиологии, терапии) с проведенными методами обследования,
- Если пациент не был госпитализирован, необходимо амбулаторно выполнить общеклинические анализы крови и мочи, биохимическое исследование крови, определение группы и свертывающей способности крови, УЗИ сердца, ЭКГ, суточное мониторирование ЭКГ и АД, рентген грудной клетки, пробы с физической нагрузкой (тредмил-тест, велоэргометрия),
- Возможно, понадобятся консультации ЛОР-врача, гинеколога, уролога и стоматолога для исключения очагов хронической инфекции.
Методика операции
Больному делают общий наркоз. После открытия грудной клетки пациента подключают к аппарату искусственного кровообращения. Протезирование митрального клапана сердца предусматривает вскрытие левого предсердия, а аортального – стенки аорты. Врач удаляет пораженный клапан и вшивает новый. Длительность операции составляет 3 — 6 часов.
Если пациенту такая операция противопоказана, протезирование аортального клапана сердца возможно проводить эндоваскулярно или применять малоинвазивные операции.
Как проходит операция?
Предоперационная подготовка сводится к назначению седативных и снотворных препаратов. Операция проводится под общим наркозом в этот же или на следующий день после госпитализации с применением аппарата искусственного кровообращения, выполняющего функции перекачивания крови по организму во время манипуляций.
После погружения пациента в глубокий сон выполняется срединная стернотомия – продольное рассечение кожи и грудины. Далее выполняют разрез левого предсердия при протезировании митрального клапана и стенки аорты при протезировании аортального клапана. После этого фиксируют кольцо протеза непрерывными швами и ушивают рассеченную часть сердца.
После установки протеза обязательно накладывают электроды для временной электрокардиостимуляции, и ушивают операционную рану. Для сращения краев грудины накладывают проволочные швы.
В раннем постоперационном периоде пациент находится в отделении интенсивной терапии с проведением искусственной вентиляции легких, прекращение которой возможно лишь при полной стабилизации пациента и восстановлении самостоятельного дыхания.
Время операции составляет от трех до шести часов, а время пребывания в стационаре определяется общим состоянием пациента и составляет от двух до четырех недель.
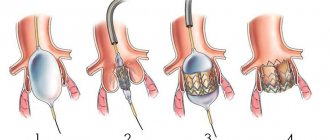
Кроме операций на открытом сердце в настоящее время возможно проведение малоинвазивных операций, в частности, с мини-доступом из межреберного разреза справа или слева без рассечения грудины, а также с проведением эндоваскулярного вмешательства.
малоинвазивная замена аортального клапана
Последнее применяется только при протезировании аортального клапана и проводится путем внедрения биологического протеза через бедренную вену в правое, а затем и в левое предсердие с дальнейшим расположением в аорте.
Эндоваскулярное протезирование сердечного клапана в первую очередьпредпочтительно для лиц, операция на открытом сердце которым противопоказана.
Видео: репортаж об операции по протезированию клапана
Кардиохирургия пороков митрального клапана сердца
Вернуться в раздел:
Кардиохирургическое отделение
Митральный клапан находится между левым предсердием и левым желудочком.
В норме он открывается в диастолу, пропуская артериальную кровь из левого предсердия в левый желудочек, и закрывается в систолу под действием давления крови при сокращении левого желудочка, препятствуя обратному движению крови из левого желудочка в левое предсердие.
Существует 3 вида пороков митрального клапана:
1) Митральная недостаточность. При патологии соединительной ткани или изменениях сердечной мышцы происходит нарушение строения митрального клапана, что ведёт к «прогибанию» его створок в полость левого предсердия во время сокращения левого желудочка, часть крови поступает обратно в предсердие.
2) Митральный стеноз. Вследствие перенесенных инфекционных заболеваний, таких как ревматизм, происходит сужение МК, что приводит к нарушению поступления крови из левого предсердия в левый желудочек.
3) Сочетанный порок МК (недостаточность + стеноз).
В настоящее время в современной кардиохирургии пороков митрального клапана сердца выполняются реконструктивные (клапан сохраняющие) операции, а также операции по замене (протезированию) клапанов механическим или биологическим протезом. Реконструктивные операции выполняют как при стенозе, так и при недостаточности митрального клапана.
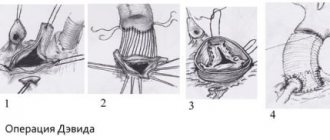
Реконструктивые операции
| Рис.1. Митральная аннулопластика на опорном кольце. |
Примером является аннулопластика, заключающаяся в восстановлении функции пораженного клапана с помощью жесткого либо эластичного опорного кольца.
Оно фиксируется к стенкам сердца на уровне отверстия, соединяющего предсердие с желудочком. Вследствие вшивания такого опорного кольца уменьшается диаметр предсердно-желудочкового отверстия, благодаря чему обеспечивается более полное смыкание створок и нормализуется внутрисердечный кровоток.
Другой вариант реконструктивных хирургических вмешательств на клапанах сердца – операции с использование различных техник шовной пластики.
В ходе данной процедуры хирург проводит пластику тканей створок клапана, удаляет кальцинированные отложения, или восстанавливает структуру измененных сухожильных хорд, которые контролируют движение створок.
Рис. 2. Шовная пластика митрального клапана.А, Б – резекция измененного участка задней створки МК;
В, Г, Д – этапы устранения промежутка в клапане.
Протезирование МК.
Радикальным методом лечения митрального клапана является его замена. Применяются современные механические (искусственные клапаны сердца) и биологические клапаны.
| Механический протез МК | Биологический протез МК |
Рис.3. Механический (слева) и биологический (справа) митральный клапан.
В случае резко выраженных морфологических изменений собственного клапана больного, когда сохранение его уже невозможно, проводится удаление клапана с последующим протезированием. Хирургическое протезирование митрального клапана выполняется на неработающем сердце с применением аппарата искусственного кровообращения.
Механические (искусственные клапаны сердца) очень надежны, служат всю жизнь и не нуждаются в замене, но требуют постоянного приёма специальных медикаментов для понижения свёртываемости крови.
Биологические клапаны (животного или человеческого происхождения) со временем могут разрушаться, при этом срок службы этих клапанов сильно зависит от возраста больного и его сопутствующих заболеваний. С возрастом процесс разрушения биологических клапанов сильно замедляется. Решение о том, какой клапан в конкретной ситуации является наилучшим вариантом, принимается индивидуально перед операцией в обязательной беседе между хирургом и больным.
Технический прогресс в кардиохирургии, а именно внедрение в повседневную хирургическую практику новых инструментов, позволяющих модифицировать оперативные доступы к сердцу, неизбежно выдвигают цель выполнения их с минимальной интраоперационной травмой для пациента.
Выбор наиболее рационального доступа к различным отделам сердца является одним из необходимых условий для решения этой проблемы.
Оперативный доступ должен обеспечить решение основных задач:
- предоставить хирургу достаточный простор для удобства манипуляций в зоне оперативного вмешательства;
- оперативный доступ должен быть предпочтительно менее травматичным для пациента.
Традиционным оперативным доступом к сердцу является продольная срединная стернотомия (Рис.4).
| Схема выполнения срединной стернотомии | Вид послеоперационного рубца |
С одной стороны она даёт возможность хирургу провести на сердце необходимое хирургическое пособие при разнообразных формах его патологии и является максимально удобной для подключения аппарата искусственного кровообращения.
С другой стороны данный доступ не может быть оптимальным. Это объясняется целым рядом причин:
- Большая травматичность, нарушается целостность грудной клетки, что требует более длительного периода заживления послеоперационной раны.
- Высокий риск развития послеоперационных осложнений (нестабильность грудины). Особую опасность эти осложнения несут у пожилых пациентов.
- Сомнительный косметический эффект.
Рис.5. Вид операционного поля при реконструктивных вмешательствах на митральном клапане из миниинвазивного доступа к сердцу.
Все кардиохирурги согласятся с тем, что реконструктивные вмешательства на митральном клапане через минимально инвазивный доступ (правостронняя миниторакотомия) должны быть выполнены пациенту с тем же мастерством и качеством, что и при операциях через срединную полную стернотомию.
Коррекция митрального клапана из правосторонней миниторакотоми выполняется в 4 межреберье длиной 6 см в проекции IV межреберья справа.
| Схема выполнения правосторонней миниторакотомии | Вид послеоперационного рубца |
Преимущества малоинвазивной хирургии клапана
- Меньший болевой синдром. Поскольку доступ к сердцу осуществляется через правостороннюю боковую миниторакотомию, где длина кожного разреза составляет около 7 см, также сохраняется каркасная функция грудной клетки, т.е. не нарушается ее целостность, чем при традиционном доступе – срединной стернотомии, где длина кожного разреза составляет около 20 см, и для осуществления хирургической манипуляции на сердце необходимо распилить грудину по срединной линии.
- Снижение риска осложнений. Поскольку грудная клетка сохраняет свою целостность, риск развития такого осложнения, как послеоперационная нестабильность грудины, исключается.
- Более быстрое восстановление и возвращение к нормальной деятельности. Меньшая операционная травма и сохранение каркасной функции грудной клетки после миниторакотомии позволяет осуществлять раннюю активизацию и реабилитацию пациентов, что способствует уменьшению сроков стационарного лечения.
- Меньше заметен шрам. Большинство пациентов очень довольны косметическим результатом после операции.
← Назад
Стоимость операции
В большинстве случаев операция по замене клапанов сердца проводится бесплатно, благодаря квотам системы здравоохранения РФ по системе ОМС. Тем не менее, если по каким-то причинам получить квоту не представляется возможным, всегда есть вариант проведения операции за собственный счет.
Стоимость самой операции, протеза и реабилитации в раннем постоперационном периоде составляет от 90 до 300 тысяч рублей
, причем цена тем выше, чем сложнее операция, например, одномоментная замена аортального клапана и клапана легочной артерии выше, чем одного из них.
Операции по протезированию сердечного клапана проводятся во всех крупных городах России, и сейчас такие вмешательства не являются редкими или недоступными для населения.
Виды операций по замене клапанов сердца
Хирурги проводят 2 вида операций. Недостаточность клапанов устраняется с помощью пластики. При сужении клапана (стенозе), проводится его полное замещение. Чаще всего проводится операция по замене сердечного митрального или аортального клапана.
Используют 2 вида протезов – биологический и механический. Биологический, свиной клапан, устанавливают пожилым пациентам. Он не провоцирует тромбообразование и служит 8-15 лет. Недостатком свиного протеза является высокий риск его бактериального воспаления. Срок службы механического клапана более 20 лет, но с ним человек должен пожизненно принимать препараты для разжижения крови.
Замена сердечного клапана проводится при его износе. Стоимость операции определяется хирургом на основании полного обследования больного.
Осложнения
Самыми грозными осложнениями после внедрения протеза являются тромбоэмболические. Профилактикой их развития служит пожизненная антитромботическая терапия с помощью антикоагулянтов и антиагрегантов – препаратов, «разжижающих» кровь. К таким препаратам относятся:
- Подкожные инъекции гепарина в раннем постоперационном периоде,
- Постоянный прием варфарина под ежемесячным контролем МНО (международного ассоциированного отношения) – важного показателя тромбообразующей системы крови, в норме он должен быть в пределах 2.5 – 3.5,
- Постоянный прием аспирина (тромбоАсс, ацекардол, аспирин Кардио и др).
Не менее опасными последствиями являются развитие или рецидивирование инфекционного эндокардита, профилактикой которого является рациональное назначение антибиотиков в постоперационном периоде, а также дальнейший их прием при проведении любых операций и малоинвазивных вмешательств (удаление зуба, гинекологические и урологические манипуляции и т. д.).
Образ жизни
Дальнейшая жизнь человека после операции сводится к следующим моментам:
- Регулярное посещение врача – ежемесячное в первый год после операции, раз в полгода во второй год и ежегодное в последующем, с постоянным мониторингом функций сердечно-сосудистой системы с помощью ЭКГ и эхокардиоскопии,
- Регулярный прием назначенных препаратов (антикоагулянтов, антибиотиков),
- Лечение остаточной сердечной недостаточности с помощью постоянного приема дигоксина и мочегонных препаратов (индапамид, верошпирон, диувер и др),
- Адекватная физическая активность,
- Соблюдение режима труда и отдыха,
- Соблюдение диеты – исключение жирных, жареных, соленых продуктов, употребление большого количества овощей, фруктов, кисломолочных и крупяных изделий,
- Полное исключение вредных привычек.
Прогноз
Прогноз после операции несомненно выше, чем без нее,
так как при пороках сердца развивается тяжелая сердечная недостаточность, не только ухудшающая переносимость обычных физических нагрузок, но и приводящая к летальному исходу. У пациентов после операции летальность намного ниже, и связана в основном с развитием тромбоэмболических осложнений (0.2 % случаев смертей в год). Поэтому операция по замене клапанов сердца является вмешательством, существенно продлевающим жизнь больного и улучшающим ее качество.
МенюРКДЦ
Какие существуют искусственные клапаны сердца
В настоящее время имеется два основных типа искусственных клапанов сердца: механические и биологические, которые имеют свои особенности, преимущества и недостатки.
Механические клапаны сердца
Это протезы, которые служат для замены функции естественного клапана сердца человека. Сердце человека имеет четыре клапана: трехстворчатый, митральный, пульмональный и аортальный. Предназначение клапанов сердца — обеспечить беспрепятственный ток крови через сердце по малому и большому кругу кровообращения к органам и тканям. В результате различных заболеваний нарушается работа клапанов (одного или нескольких), что проявляется сужением отверстия клапана или его недостаточностью. Оба этих процесса могут привести к постепенному развитию сердечной недостаточности и ухудшению самочувствия. Механические клапаны сердца предназначены для замены пораженного клапана протезом, чтобы восстановить его функцию и тем самым восстановить адекватную работу сердца.
Типы механических клапанов сердца
Существует три типа механических клапанов сердца: шариковые, наклонный диск и двустворчатые — в различных модификациях.
Первый искусственный клапан сердца был шариковый, он состоит из металлического каркаса, в котором заключен шарик из силиконового эластомера. Когда давление крови в камере сердца превышает давление снаружи камеры, шарик выталкивается против каркаса и дает течь току крови. По завершении сокращения сердечной мышцы давление в камере снижается и становится ниже, чем за клапаном, поэтому шарик движется в обратную сторону, закрывая проход крови из одной камеры сердца в другую. В 1952 году Чарльз Хафнейджел имплоантировал шариковый клапан сердца десяти пациентам (шесть из них выжило после операции), что означало первый успешный опыт долгосрочного применения искусственных клапанов сердца. Подобный же клапан был изобретен Майлз «Лоуэлл» Эдвардсом и Альбертом Старром в 1960 году (в литературе он встречается под названием силастиковый шариковый клапан). Первый имплантат клапана сердца у человека был сделан 21 сентября 1960 года. Он состоял из силиконового шарика, заключенного в каркас, созданный из основания клапана. Шариковый клапан характеризуется высокой тенденцией к образованию тромбов, поэтому такие пациенты вынуждены постоянно принимать высокие дозы антикоагулянтов. прекратила производство этих клапанов в 2007 году.
Вскоре были созданы дисковые клапаны сердца. Первым доступным в клинике искусственным дисковым клапаном сердца был клапан Бйорк-Шили, который с момента изобретения в 1969 году претерпел различные значительные изменения. Дисковый клапан состоит из одного кругового обтуратора, который регулируется металлической распоркой. Они производятся из металлического кольца, покрытого пористым политетрафторэтиленом, Механические протезы значительно более долговечны, но требуют пожизненной антикоагулянтной терапии, менее физиологичны. В общем, проблема выбора протеза — действительно большая проблема как для хирурга, так и для пациента. Поэтому девиз «Каждому больному — свой протезочень актуален и вряд ли утратит актуальность в обозримом будущем.в котором подшиты нити для удерживания клапана на месте. Металлическое кольцо с помощью двух металлических опор, держит диск, который открывается и закрывается во время выполнения сердца своей насосной функции. Сам диск такого клапана обычно делается из чрезвычайно твердого углеродного материала (пиролитический углерод), для того, чтобы клапан мог работать без изнашивания в течение многих лет. В США наиболее популярной моделью дискового клапана сердца является модель Medtronic-Hall. В некоторых моделях механических клапанов сердца диск разделен на две части, которые открываются и закрываются как двери.
St. Jude Medical является лидером в производстве двустворчатых клапанов, который состоит из двух полукружных клапанов, которые вращаются вокруг распорки, прикрепленной к основанию клапана. Этот дизайн был предложен в 1979 году и, хотя, они помогали справиться с некоторыми проблемами, которые отмечались с некоторыми клапанами, двустворчатые клапаны подвержены наличию обратного тока крови (регургитации) и поэтому они не могут считаться идеальными. Однако, двустворчатые клапаны обеспечивают более естественный ток крови, по сравнению с шариковыми или дисковыми клапанами. Одним из преимуществ этих клапанов является то, что они хорошо переносятся пациентом.
Механические клапаны сердца сегодня являются наиболее надежными и заслуживающими доверия и позволяют пациенту жить нормальной жизнью. Большинство механических клапанов служат минимум в течение 20-30 лет.
Гидравлика
Многие осложнения, связанные с механическими клапанами сердца могут быть объяснены гидравликой. Например, образование тромба является побочным эффектом врезающего воздействия, созданного формой клапанов. Идеальный искусственный клапан в перспективе должен быть с минимальным давлением на свои компоненты, характеризоваться минимальной регургитацией, минимальной турбулентностью и не разделять ток крови в области клапана.
Воздействие на кровь
Одним из главных недостатков механических клапанов сердца является то, что пациенты с такими клапанами вынуждены постоянно принимать препараты, разжижающие кровь (антикоагулянты). Тромбы, которые формируются в результате разрушения эритроцитов и тромбоцитов могут блокировать просвет сосудов, что ведет к серьезным последствиям.
Все модели механических клапанов сердца подвержены образованию тромбов ввиду высокой стрессовой активности, стагнации и разделения потока крови. Шариковый дизайн клапана приводит к воздействию на стенки, что повреждает клетки, а также разделению поток крови. Дисковый клапан также страдает разделением потока крови за распоркой клапана и диском в результате сочетания быстрого и медленного потоков. Двустворчатые клапаны характеризуются высокой стрессовой активностью, а также протечкой и замедлением тока крови рядом с клапаном.
В целом, повреждение клеток крови отмечается как в митральном, так и аортальном искусственных клапанах. Вальвулярный тромбоз характерен чаще всего для искусственного митрального клапана.
Так как механические клапаны сердца подвержены стрессовому воздействию, пациентам требуется постоянный прием антикоагулянтов. Биопротезы менее подвержены образованию тромбов, но учитывая их срок службы, они обычно наиболее применимы у людей старше 55 лет.
Механические клапаны сердца также могут вызывать гемолитическую анемию и гемолиз эритроцитов, когда они проходят через клапан.
Биологические клапаны
Биологическое клапаны — это клапаны, которые создаются из животных тканей, например, из ткани клапанов сердца свиньи, при этом они проходят предварительно некоторую химическую обработку для того, чтобы они были пригодны для имплантации в сердце человека. Все дело в том, что свиное сердце больше других схоже с сердцем человека, и поэтому лучше всего подходит для использования в замене клапанов сердца. Имплантация свиных клапанов сердца — это тип т.н. ксенотрансплантации.
В другом типе биологических клапанов применяется биологическая ткань, которая подшивается к металлическому каркасу. Ткань для таких клапанов берется из бычьего или лошадиного перикарда. Ткань перикарда очень подходит для клапанов ввиду своих чрезвычайных физических свойств. Этот тип биологических клапанов очень эффективен для замены. Ткань для таких клапанов стерилизуется, ввиду чего они перестают быть чужеродными для организма, и реакции отторжения не отмечается. Такие клапаны гибкие и прочные.
Механические протезы значительно более долговечны, но требуют пожизненной антикоагулянтной терапии, менее физиологичны. В общем, проблема выбора протеза — действительно большая проблема как для хирурга, так и для пациента. Поэтому девиз «Каждому больному — свой протез» очень актуален и вряд ли утратит актуальность в обозримом будущем.