Шунтирования артерий нижних конечностей ниже паховой связки бывают:
- бедренно—подколенное шунтирование,
- бедренно-тибиальное шунтирование,
- бедренно—дистально подколенное шунтирование.
Выше паховой связки выполняется:
- аорто-бедренное шунтирование,
- аорто-двубедренное шунтирование (аорто-бедренное бифуркационное шунтирование),
- аорто-подвздошное шунтирование,
- подвздошно-бедренное шунтирование,
- бедренно-бедренное перекрестное шунтирование,
- аорто-мезентереальное шунтирование, в зависимости от того какой сосуд нуждается в шунтировании.
Подробнее о видах шунтирования аорты
Операции по аорто-бедренному шунтированию, бедренно—подколенному шунтированию, бедренно-тибиальному шунтированию и другим видам шунтирования создают новые пути для доставки крови к тканям в обход больных артерий. Шунтирование артерий не лечит заболевание артерий. Этот вид лечения (операций) применяется, когда медикаментозная терапия и миниинвазивные процедуры (баллонная ангиопластика артерий, стентирование артерий) — не купируют имеющиеся симптомы заболевания.
Аорто-бедренное шунтирование (аортобифеморальное шунтирование)
Это выполнение шунта соединяющего аорту с бедренными артериями, который обходит больные артерии и увеличивает приток крови к ногам пациента.
Доступ к аорте осуществляется либо срединной лапаротомией, либо косопоперечным разрезом по Робу. Доступ к бедренным артериям осуществляется вертикальным разрезом в обоих паховых областях. Используя тонкие нити, шунт пришивается выше и ниже закупорки артерий. Затем послойно над шунтом зашиваются ткани.
Подключично-бедренное / подмышечно-бедренное / подмышечно-двубедренное шунтирование
Этот вид шунтирования используется в некоторых сложных ситуациях. Вместо аорты, как истока крови, используется подключичная или подмышечная артерия. Делается разрез ниже ключицы, а также в одной или двух паховых областях. Шунт пришивается тонкими нитями к подключичной или подмышечной артерии и бедренной/-ым артерии/-ям.
Боль в области послеоперационных швов может наблюдаться в течении нескольких дней.
Время операции варьирует в широких пределах, в зависимости от веса человека, рубцовых изменений тканей, от степени тяжести заболевания.
Цветовое дуплексное сканирование после шунтирующих операций на артериях нижних конечностей
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике.
Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
Введение
Современные клинические рекомендации по диагностике и лечению стеноокклюзирующих заболеваний аорты и артерий нижних конечностей рассматривают цветовое дуплексное сканирование в качестве эффективного метода в оценке характера, локализации, протяженности и степени поражения в каждом сегменте артериального русла (класс показаний I, уровень доказательности В) [1-4]. При динамическом наблюдении пациентов, перенесших операцию шунтирования на артериях нижних конечностей, ультразвуковое исследование сосудов является методом выбора для диагностики стеноза шунта и осложнений реконструктивных операций [5]. Многочисленные исследования показали, что без превентивного хирургического вмешательства риск тромбоза стенозированного шунта составляет около 25% [6-8], а регулярное наблюдение с помощью дуплексного сканирования позволяет уточнять или определять показания к превентивным вмешательствам, включая ангиопластику или замену фрагмента шунтирующего сосуда [4].
Виды шунтирующих операций
Операции шунтирования, в зависимости от уровня наложения проксимального (центрального) и дистального анастомозов, подразделяют на аорто-бедренное (аорто-бифеморальное) шунтирование, подвздошно-бедренное, бедренно-подколенное (выше или ниже щели коленного сустава), бедренно-заднебольшеберцовое шунтирование и др. В качестве шунтирующего сосуда (трансплантанта) может быть использована аутовена и протезы (синтетические или биологические), которые анастомозируются с артериями по типу «конец в конец» (рис. 1, 2) или «конец в бок» (рис. 3-5) [9,10].
Рис. 1.
Бедренно-подколенное шунтирование комбинированным протезом, анастомоз по типу «конец в конец».
Продольное сечение, стрелка 1 — место соединения синтетического протеза из дакрона (стрелка 2) и биологического протеза (внутренняя грудная артерия быка, стрелка 3). Локализация промежуточного анастомоза — выше уровня щели коленного сустава (уровень верхнего края надколенника).
Рис. 2.
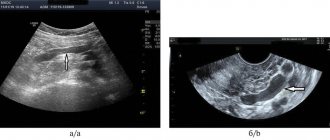
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, проксимальный анастомоз по типу «конец в конец».
а)
Ангиограмма. Продольное сечение, стрелка 1 — место соединения общей подвздошной артерии (стрелка 2) с протезом (стрелка 3).
б)
Эхограмма. Продольное сечение, стрелка 1 — место соединения общей подвздошной артерии (стрелка 2) с протезом (стрелка 3).
Рис. 3.
Аорто-бедренное шунтирование синтетическим протезом из дакрона, проксимальный анастомоз с аортой по типу «конец в бок».
Продольное сечение, стрелка 1 — аорта, стрелка 2 — протез, стрелка 3 — просвет между аортой и протезом.
Рис. 4.
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, дистальный анастомоз с общей бедренной артерией по типу «конец в бок».
а)
Продольное сечение на уровне дистального анастомоза. Стрелка 1 — стенка синтетического протеза, стрелка 2 — сегмент поверхностной бедренной артерии, стрелка 3 — сегмент глубокой бедренной артерии, стрелка 4 — задняя стенка общей бедренной артерии.
б)
Поперечное сечение на 3-5 мм выше уровня дистального анастомоза (уровень поперечного сечения показан точкой на рисунке «а»). Стрелка 1 — протез, стрелка 2 — общая бедренная артерия.
в)
Поперечное сечение на уровне дистального анастомоза. Стрелка 1 — передняя стенка протеза, стрелка 2 — задняя стенка общей бедренной артерии.
Рис. 5.
Бедренно-подколенное шунтирование аутовеной, дистальный анастомоз с подколенной артерией по типу «конец в бок».
Продольное сечение. Стрелка 1 — аутовена, стрелка 2 — подколенная артерия.
При реконструктивных операциях на артериях бедренно-подколенного и берцового сегментов аутовенозное шунтирование (в позиции in situ или реверсированной большой подкожной веной) характеризуется меньшей частотой тромбоза шунта в отдаленном периоде по сравнению с шунтированием протезом [4, 11-12] (рис. 5-7).
Рис. 6.
Стеноз бедренно-подколенного аутовенозного шунта более 70%, группа наивысшего риска. Стеноз вне зоны анастомоза — верхняя 1/3 шунта (средняя 1/3 бедра).
а)
Допплерограмма кровотока из шунта на 3-5 см выше зоны стеноза (Vps — 83 см/с).
б)
Допплерограмма кровотока из зоны стеноза (Vps — 430 см/с).
в)
Допплерограмма кровотока на 8-10 см дистальнее зоны стеноза (Vps — 35 см/с).
г)
Допплерограмма кровотока из шунта на 2-3 см выше уровня дистального анастомоза (Vps — 25 см/с).
Рис. 7.
Бедренно-подколенный аутовенозный шунт без признаков стеноза, низкий риск тромбоза шунта.
а)
Область проксимального анастомоза, продольное сечение, отсутствует дефект наполнения в режиме ЦДК.
б)
Допплерограмма кровотока из зоны проксимального анастомоза (Vps — 125 см/с).
в)
Допплерограмма кровотока из средней 1/3 шунта (Vps — 76 см/с).
г)
Допплерограмма кровотока из шунта на 2-3 см выше уровня дистального анастомоза (Vps — 80 см/с).
Самым длительным эффектом обладают аорто-бедренные шунты [13-14]. При аорто-бедренном шунтировании используют синтетические протезы, материал которых может быть представлен фторлавсаном или дакроном с ребристой структурой (см. рис. 2-4), политетрафторэтиленом или полиуретаном [4, 10] с гладкой внутренней поверхностью (рис. 8).
Рис. 8.
Аорто-бедренное шунтирование синтетическим протезом из политетрафторэтилена, проксимальный анастомоз.
Стрелка 1 — аорта, стрелка 2 — протез.
В ряде исследований показана высокая эффективность операций с применением биологических протезов [15-16], которые представляют собой специально обработанную пупочную вену или сосуды животных (крупного рогатого скота, свиней). Биологические протезы не отличаются по своей структуре от нативной артерии или вены (рис. 9). Однако биологические протезы, по сравнению с аутовенозными и синтетическими, в большей степени могут быть подвергнуты аневризматическому расширению и последующему тромбообразованию (рис. 10).
Рис. 9.
Бедренно-подколенное шунтирование биологическим протезом (внутренняя грудная артерия быка), средняя 1/3 протеза.
Стрелка 1 — биологический протез, стрелка 2 — анэхогенное жидкостное образование (экссудат) в парапротезном пространстве, косвенный признак воспаления.
Рис. 10.
Аневризматическое расширение и пристеночный тромбоз биологического протеза.
Показана средняя 1/3 бедренно-подколенного шунта, протез неравномерно расширен. Стрелка 1 — функционирующий просвет протеза, стрелка 2 — тромбомассы на уровне максимального аневризматического расширения.
В некоторых случаях в качестве шунтирующего сосуда используют комбинацию протезов (синтетический протез соединяется с аутовеной или соединяют между собой синтетический и биологический протезы) (см. рис. 1). Если реконструкция бедренно-подколенного сегмента выполняется после коррекции поражения аортоподвздошного сегмента, то лучшие результаты наблюдаются при формировании анастомоза с браншей протеза в области дистального анастомоза [4].
Периодичность дуплексного сканирования
Пациенты, перенесшие аутовенозное шунтирование, должны быть периодически (по крайней мере в течение первых 2 лет после операции) обследованы методом дуплексного сканирования с измерением пиковой систолической скорости кровотока (Vps) и расчетом соотношения скоростей кровотока на протяжении всей длины шунта (класс показаний I, уровень доказательности С) [4]. Обследование методом дуплексного сканирования рекомендуется в первый месяц от момента хирургического вмешательства. В том случае, если стеноз аутовенозного шунта не выявляется в первый месяц (примерно 80% шунтов), рекомендуется наблюдение с 6-месячным интервалом в течение первого года, а затем, по истечении первого года после аутовенозного шунтирования, ежегодно [10, 17]. Наблюдение за протезными реконструкциями, как и после аутовенозных реконструкций, рекомендуется с 6-месячным интервалом [17]. Однако в одной из ключевых клинических рекомендаций — Trans-Atlantic Inter-Society Consensus (TASC II) отмечается необходимость только регулярного клинического обследования и измерения плечелодыжечного индекса давления [18].
Основные задачи дуплексного сканирования
В связи с тем, что тромбоз шунта сопровождается низкой вероятностью сохранения конечностей, первостепенными задачами динамического ультразвукового исследования сосудов после шунтирующих операций являются обнаружение ультразвуковых признаков повышенного риска развития тромбоза шунта и ранняя диагностика тромбоза шунта.
Диагностика тромбоза шунта не вызывает затруднений. Заключение о тромбозе делается на основании обнаружения структур в просвете шунта в В-режиме, при отсутствии кровотока в шунте по данным цветового и импульсно-волнового допплеровских режимов (рис. 10, 11), а также на основании характеристик кровотока ниже области дистального анастомоза.
Рис. 11.
Тромбоз (окклюзия) шунта.
а)
Средняя 1/3 бедренно-подколенного аутовенозного шунта. В просвете шунта визуализируются гетерогенные, преимущественно гиперэхогенные структуры (стрелка), кровоток в режиме ЦДК не регистрируется.
б)
Бедренно-подколенное шунтирование протезом из политетрафторэтилена. Средняя 1/3 протеза, анэхогенные структуры в протезе (стрелка), кровоток в режиме ЦДК не регистрируется.
Обнаруженные при ультразвуковом исследовании косвенные признаки воспаления (экссудата) в проекции протеза и инфицирования протеза (см. рис. 9) являются неблагоприятными прогностическими факторами, сопровождающимися высоким риском тромбоза шунта в раннем послеоперационном периоде.
Наиболее значимыми и распространенными предвестниками тромбоза шунта являются стенозы центрального и/или дистального анастомозов, стенозы шунтов вне зон анастомозов, а также снижение скоростных показателей кровотока по шунту [10] (рис. 6, 12, 13). Детально изучена роль дуплексного сканирования после операций аутовенозного шунтирования. Установлено, что около 20% инфраингвинальных аутовенозных шунтов имеют остаточный послеоперационный стеноз или стеноз развивается в течение первого года после реконструкции [6, 10]. Стенозы локализуются как в области анастомозов, так и в любом другом сегменте шунта. Для искусственных или биологических протезов стенотическое поражение протеза вне зон анастомозов менее характерно по сравнению с аутовенозными шунтами [10] (см. рис. 6).
Рис. 12.
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, стеноз в области дистального анастомоза 50-75%, группа высокого риска.
а)
Допплерограмма кровотока из шунта на 3-5 см выше уровня дистального анастомоза (Vps — 34 см/с).
б)
Допплерограмма кровотока из зоны стеноза (Vps — 292 см/с).
в)
Поперечное сечение поверхностной бедренной артерии в области дистального анастомоза, планиметрическая оценка степени стеноза «по диаметру», стеноз 59%.
г)
Магистральный кровоток в поверхностной бедренной артерии в средней 1/3 бедра (Vps — 111 см/с). Нормальные характеристики кровотока ниже дистального анастомоза позволяют исключить стеноз более 75% и подтверждают результаты планиметрической оценки «по диаметру».
Рис. 13.
Подвздошно-бедренное шунтирование синтетическим протезом из фторлавсана, низкоскоростной кровоток в протезе.
Допплерограмма кровотока из средней 1/3 протеза (Vps — 30 см/с), значимые сужения проксимальных и дистальных сегментов сосудистого русла не обнаружены.
В протоколе ультразвукового исследования аорты и артерий нижних конечностей после шунтирующих операций особое внимание уделяется описанию структурно-анатомических изменений приносящих сосудов и характеристике кровотока в них, характеристике кровотока и оценке состояния проксимального, дистального анастомозов и шунтирующего сосуда на всем протяжении, а также описанию структурно-анатомических изменений выносящих сосудов и характеристике кровотока в них [10].
При исследовании шунтирующего сосуда делаются акценты на анализе Vps и расчете отношения пиковой скорости кровотока в зоне ее локального увеличения (в зоне стеноза) к пиковой скорости кровотока, зарегистрированной проксимальнее стеноза (Vps-ratio). Кроме того, протокол ультразвукового исследования требует максимально полного описания планиметрических характеристик стенозированного сегмента шунта, а в случае аутовенозного шунтирования — оценки диаметра шунтирующей вены в поперечном сечении над и ниже стеноза, протяженности стеноза и четкого указания анатомической локализации стеноза.
Допплерографическая градация степени стеноза и группы риска тромбоза шунта
Существует допплерографическая градация степени стеноза аутовенозных шунтов, которая базируется на оценке Vps в зоне стеноза и Vps-ratio [19], разработанная на основании сопоставления данных дуплексного сканирования с результатами ангиографии (табл.).
Таблица.
Допплерографические критерии степени сужения аутовенозного шунта.
| Степень стеноза,% | Vps в зоне стеноза, см/с | Vps-ratio, у.е. |
| 20-50 | 1,5-2,4 | |
| 50-75 | > 180 | 2,5-4,0 |
| > 75 | > 300 | > 4,0 |
Однако наибольшей прогностической эффективностью обладает оценка степени риска тромбоза аутовенозного шунта на основе комбинации таких показателей, как Vps в зоне стеноза, Vps-ratio, средняя Vps в шунте (среднее значение пиковой систолической скорости кровотока из 3-4 равноудаленных зон шунта вне области стеноза) и лодыжечно-плечевой индекс давления (ЛИД). Низкая скорость кровотока по шунту увеличивает риск тромбоза [20]. Риск тромбоза аутовенозного шунта ниже по сравнению с искусственным протезом [10], а профилактическое назначение антикоагулянтной и дезагрегантной терапии снижает риск развития тромбоза низкоскоростных шунтов [6-7].
К группе наивысшего риска (I степень) с угрозой тромбоза в ближайшее время относятся шунты, стенозированные более чем на 70% с Vps в зоне стеноза > 300 см/с, Vps-ratio > 3,5 у.е., с низкоскоростным кровотоком по шунту (средняя Vps
К группе высокого риска тромбоза (II степень) относятся шунты, стенозированные более чем на 70% с Vps в зоне стеноза > 300 см/с, Vps-ratio > 3,5 у.е., с нормальной скоростью кровотока по шунту вне области стеноза (средняя Vps > 45 см/с) и уменьшением ЛИД (по сравнению с предшествующей оценкой) менее чем на 0,15 у.е.
Группы наивысшего и высокого риска тромбоза (I и II степень) требуют ревизии шунта и хирургического восстановления его проходимости. Вероятность прогрессирования стеноза или развития тромбоза в этих группах в течение 3-6 месяцев составляет 40-50%. Для группы наивысшего риска (I степень) рекомендуется немедленное восстановление проходимости шунта, в то время как для группы высокого риска (II степень) возможно восстановление в плановом порядке в течение 1-2 нед.
К группе умеренного риска тромбоза (III степень) относятся шунты, стенозированные на 50-70% с Vps в зоне стеноза 180-300 см/с, Vps-ratio > 2 у.е., с нормальной скоростью кровотока по шунту вне области стеноза (средняя Vps > 45 см/с) и уменьшением ЛИД (по сравнению с предшествующей оценкой) менее чем на 0,15 у.е.
К группе низкого риска тромбоза (IV степень) относятся шунты, не стенозированные или стенозированные 45 см/с) и уменьшением ЛИД (по сравнению с предшествующей оценкой) менее чем на 0,15 у.е. (см. рис. 7).
В группах риска III и IV степени поражения шунта, обнаруженные в первые 3 мес. от момента шунтирования, в 20-30% случаев регрессируют, в 10-20% случаев остаются стабильными, а в 40-50% случаев прогрессируют до стеноза более 70%.
Для группы умеренного риска рекомендуется динамическое наблюдение с интервалом в 4-6 нед для подтверждения или исключения прогрессирования стеноза. При динамическом исследовании прогрессирование стеноза подтверждается увеличением Vps в зоне стеноза, уменьшением среднего значения Vps по шунту вне области стеноза и снижением ЛИД > 0,15 у.е. и, соответственно, переходом в группу высокого или наивысшего риска [10].
В сравнении с аутовенозным шунтированием исследования, посвященные роли дуплексного сканирования в наблюдении протезных шунтов и определении показаний к хирургическому вмешательству на измененных протезах, не так многочисленны. Однако было показано, что после протезного шунтирования включение в программу наблюдения дуплексного сканирования и выполнение реконструктивного вмешательства на шунтирующих сосудах на основании его результатов сопровождается 5-летней проходимостью шунтов около 88% и превосходит таковые показатели без динамического дуплексного наблюдения [7]. При бедренно-бедренном протезном шунтировании ультразвуковыми предвестниками тромбоза шунта являются Vps в приносящей подвздошной артерии более 300 см/с, наличие стеноза протеза с локальным увеличением Vps более 300 см/с и средним значением Vps в протезе менее 60 см/с [7]. Детальная допплерографическая градация степени стеноза и степени риска тромбоза для синтетических и биологических протезов отсутствует. В связи с этим допустимо использование ультразвуковых критериев степени стеноза и степени риска тромбоза аутовенозных шунтов для синтетических и биологических протезов (рис. 12).
В качестве прогностического критерия риска тромбоза протезного шунта может быть использовано среднее значение Vps в протезе менее 45 см/с [8]. Однако низкая скорость кровотока по шунту (рис. 13) прежде всего предполагает тщательное исследование проксимальных и дистальных сегментов сосудистого русла с целью исключения/подтверждения значимых сужений. Самостоятельное значение низкой скорости кровотока по шунту до конца не определено, однако требует в протоколе ультразвукового исследования указания: «снижение скоростных показателей кровотока по шунту».
Одним из предрасполагающих факторов к развитию тромбоза является перегиб (перекрут) шунта/протеза (рис. 14), сопровождающийся сужением функционирующего просвета и локальными нарушениями кровотока в виде увеличения Vps.
Рис. 14.
Аорто-бедренное шунтирование синтетическим протезом из дакрона, перегиб протеза.
а)
Продольное сечение протеза на 2-4 см ниже уровня проксимального анастомоза, стрелкой показан перегиб протеза.
б)
Допплерограмма кровотока из области перегиба, Vps локально увеличена до 150 см/с.
Диагностика осложнений шунтирующих операций
Дуплексное сканирование обладает высокой точностью в диагностике таких осложнений шунтирующих операций, как аневризма сосудов в области проксимального (центрального) и/или дистального анастомозов (рис. 15), аневризма протеза на протяжении (более характерно для биологических протезов, рис. 10), диагностике пульсирующей гематомы (рис. 16), ложной аневризмы в области проксимального или дистального анастомозов (рис. 17), а также в диагностике артериовенозных фистул (рис. 18, 19).
Рис. 15.
Подвздошно-бедренное шунтирование синтетическим протезом из дакрона, аневризма в области дистального анастомоза.
а)
Допплерограмма кровотока из шунта на 1-2 см выше уровня дистального анастомоза (Vps — 120 см/с).
б)
Зона дистального анастомоза, стрелка 1 — протез, стрелка 2 — расширенная общая бедренная артерия (диаметр — 17 мм).
в)
Магистральный кровоток в поверхностной бедренной артерии на 1-2 см ниже уровня дистального анастомоза (Vps — 70 см/с).
Рис. 16.
Пульсирующая гематома в подвздошно-паховой области. Исследование проведено в первые сутки от момента хирургического вмешательства.
а)
Продольное сечение. Стрелка 1 — полость гематомы, стрелка 2 — общая бедренная артерия, стрелка 3 — канал между общей бедренной артерией и полостью гематомы, диаметр канала — 3-3,5 мм.
б)
Допплерограмма кровотока из канала, Vps локально увеличена до 320 см/с.
Рис. 17.
Ложная аневризма в области дистального анастомоза подвздошно-бедренного шунта. Исследование проведено через 3 месяца от момента хирургического вмешательства.
а)
Продольное сечение. Стрелка 1 — аневризматический мешок, стрелка 2 — широкое основание аневризматического мешка, стрелка 3 — синтетический протез, стрелка 4 — поверхностная бедренная артерия.
б)
Допплерограмма из шунта перед областью аневризматического мешка, магистральный кровоток, Vps — 84 см/с.
в)
Допплерограмма из средней 1/3 поверхностной бедренной артерии, дистальнее аневризматического мешка, магистральный кровоток, Vps — 103 см/с.
Рис. 18.
Артериовенозная фистула между поверхностной бедренной артерией и поверхностной бедренной веной, верхняя 1/3 бедра. Состояние после тромбэктомии из поверхностной бедренной артерии.
а)
Допплерограмма кровотока из области фистулы, диаметр фистулы — 2,5-3 мм. Стрелка 1 — поверхностная бедреннартерия, стрелка 2 — поверхностная бедренная вена.
б)
Допплерограмма из поверхностной бедренной вены на 3-5 см дистальнее фистулы, характер кровотока псевдоартериальный, Vps — 45 см/с.
Рис. 19.
Артериовенозная фистула после аутовенозного шунтирования in situ в нижней 1/3 бедра. Исследование через 1-е сутки после шунтирования.
а)
Допплерограмма кровотока из аутовенозного шунта на 4-5 см выше фистулы (притока аутовены), средняя 1/3 бедра, характер кровотока магистрально-измененный (низкорезистентный), Vps — 120-130 см/с, RI — 0,8 у.е.
б)
Допплерограмма из фистулы (притока аутовены), характер кровотока артериальный, Vps — 95 см/с.
Заключение
Очевидно, что дуплексное сканирование — это первичная диагностическая процедура при подозрении на нарушение функционирования шунта в любой период от момента проведения реконструктивной операции. Результаты дуплексного сканирования, проведенного опытным специалистом, могут рассматриваться в качестве показаний для проведения ангиографического исследования [9] или для превентивного хирургического вмешательства на шунтирующих сосудах [4].
Литература
- Hirsch A.T., Haskal Z.J., Hertzer N.R., et al. ACC/AHA 2005 Guidelines for the Management of Patients With Peripheral Arterial Disease (Lower Extremity, Renal, Mesenteric, and Abdominal Aortic): A Collaborative Report from the American Association for Vascular Surgery/Society for Vascular Surgery, Society for Cardiovascular Angiography and Interventions, Society for Vascular Medicine and Biology, Society of Interventional Radiology, and the ACC/AHA Task Force on Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Peripheral Arterial Disease) // J Am Coll Cardiol. 2006. N 47. P. e1-e192.
- Layden J., Michaels J., Bermingham S., et al. Diagnosis and management of lower limb peripheral arterial disease: summary of NICE guidance // BMJ. 2011. N 345. P. e4947.
- Rooke T.W., Hirsch A.T., Misra S., et al. ACCF/ AHA Focused Update of the Guideline for the Management of Patients With Peripheral Artery Disease (Updating the 2005 Guideline) // J Am Coll Cardiol. 2011. V. 58. N 19. P. 2020-2045.
- Национальные рекомендации по ведению пациентов с заболеваниями артерий нижних конечностей (Рос. об-во ангиологов и сосудистых хирургов, Ассоц. сердечн.-сосуд. хирургов России, Рос. науч. об-во рентгенэндоваскулярных хирургов и интервенционных радиологов, Всерос. науч. об-во кардиологов, Ассоц. флебологов России) // Ангиология и сосудистая хирургия. 2013. Т. 19. Приложение 2. С. 2-67.
- Tendera M., Aboyans V., Bartelink M.L., et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the Task Force on the Diagnosis and Treatment of Peripheral Artery Diseases of the European Society of Cardiology (ESC) // Eur Heart J. 2011. V. 32. N 22. P. 2851-2906.
- Tinder C.N., Chavanpun J.P., Bandyk D.F., et al. Efficacy of duplex ultrasound surveillance after infrainguinal vein bypass may be enhanced by identification of characteristics predictive of graft stenosis development // J Vasc Surg. 2008. V. 48. P. 613-618.
- Stone P.A., Armstrong P.A., Bandyk D.F., et al. Duplex ultrasound criteria for femoral-femoral bypass revision // J Vasc Surg. 2006. V. 44. P. 496-502.
- Brumberg S.R., Back M.R., Armstrong P.A., et al. The relative importance of graft surveillance and warfarin therapy in infrainguinal prosthetic bypass failure // J Vasc Surg. 2007. V. 46. P. 1160-1166.
- Haimovici’s vascular surgery. 6th edition / edited by Ascher Å., Veith F.J., Gloviczki P., et al. — Blackwell Publishing. 2012. 1317 pp.
- Rutherford’s vascular surgery. 6th edition / edited by Cronenwett J.L., Johnston K.W. — Elsevier Health Sciences. 2014. 2688 pp.
- Bradbury A.W., Adam D.J., Bell J., et al. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial: Analysis of amputation free and overall survival by treatment received // Journal of Vascular Surgery. 2010. V. 51. P. 18S-31S.
- Conte M.S. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) and the (hoped for) dawn of evidence-based treatment for advanced limb ischemia // Journal of Vascular Surgery. 2010. V. 51. P. 69S-75S.
- Szilagyi D.E., Elliott J.P., Smith R.F., et al. A thirty-year survey of the reconstructive surgical treatment of aortoiliac occlusive disease // J Vasc Surg. 1986. V. 3. N 3. P. 421-436.
- Nevelsteen A., Wouters L., Suy R., et al. Aortofemoral Dacron reconstruction for aorto-iliac occlusive disease: a 25-year survey // Eur J Vasc Surg. 1991. V. 5. P. 179-186.
- Барбараш Л.С., Иванов С.В., Журавлева И.Ю. и др. 12-летний опыт использования биопротезов для замещения инфраингвинальных артерий // Ангиология и сосудистая хирургия. 2006. Т. 3. № 12. С. 91-97.
- Журавлева И.Ю., Кудрявцева Ю.А., Иванов С.В. и др. Пути и перспективы совершенствования инфраингвинальных артериальных биопротезов // Патология кровообращения и кардиохирургия. 2005. № 1. С. 78-83.
- Mohler E.R., Gornik H.L., Gerhard-Herman M., et al. ACCF/ACR/AIUM/ASE/ASN/ICAVL/SCAI/ SCCT/SIR/SVM/SVS 2012 appropriate use criteria for peripheral vascular ultrasound and physiological testing, part 1: arterial ultrasound and physiological testing // J Am Coll Cardiol. 2012. V. 60. P. 242-276.
- Norgren L., Hiatt W.R., Dormandy J.A., et al. TASC II Working Group: Inter-Society consensus for the management of peripheral arterial disease (TASC II) // J Vasc Surg. 2007. V. 45. P. S5-S67.
- Jaff M., Mohler E., Roman M., et al. Guidelines for noninvasive vascular laboratory testing: a report from the American Society of Echocardiography and the Society for Vascular Medicine and Biology // Vasc Med. 2006. V. 11. N 3. P. 183-200.
- Bandyk D., Cato R., Towne J. A low velocity predicts failure of femoropoliteal and femorotibial bypass grafts // Surgery. 1985. V. 98. P. 799-809.
УЗИ аппарат RS85
Революционные изменения в экспертной диагностике.
Безупречное качество изображения, молниеносная скорость работы, новое поколение технологий визуализации и количественного анализа данных УЗ-сканирования.
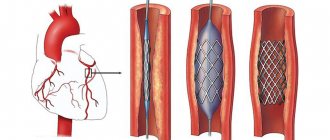
Стентирование или шунтирование, что лучше?
Стентирование это миниинвазивный метод лечения облитерирующего атеросклероза сосудов. При своевременном обращении пациентов и незапущенности заболевания, выполнение такой процедуры имеет преимущество.
Если же ситуация не позволяет произвести стентирование (закупорка сосудов на большом протяжении,невозможность провести стент через закупоренный сосуд) в таком случае выполняют шунтирование. Есть ситуации требующие гибридного подхода в лечении атеросклероза артерий нижних конечностей. Например сужение подвздошной артерии и закупорка бедренной артерии. В таком случае выполняется стентирование подвздошной артерии и бедренно-подколенное шунтирование.
В послеоперационном периоде пациент нашего отделения пребывает под наблюдением лечащего врача в палатах повышенной комфортности в течении 5-7 дней, где выполняются перевязки и уход за послеоперационными ранами.
Часто спрашиваю какую группу инвалидности дают после шунтирования. Вопрос об инвалидности решается в МСЭК по месту жительства.
Проведение шунтирования
Суть оперативного вмешательства обстоит в создании искусственного обходного пути между окклюдированными артериями, по ходу которого пускается кровоток. В качестве шунта традиционно используется большая подкожная вена нижней конечности, которая не извлекается из собственного ложа. Если ее применение невозможно, используются прочие аутовены рук и ног, которые впоследствии компенсируются организмом самостоятельно. Синтетические протезы внедряются редко из-за повышенного риска тромбообразования и последующего отторжения.
Поскольку венозные сосуды служат для обратного перенаправления крови к сердцу, а при ее включении в артериальную систему ток крови обращается к периферии, врач должен предварительно произвести деструкцию клапана вены, чтобы устранить препятствия стеканию крови в нижнюю часть. Один конец вены фиксируется выше окклюдированного участка бедренной артерии, противоположный размещается на большеберцовой артерии.
Плановая длительность операции составляет около 3-х часов. Для обезболивания применяется общий наркоз или эпидуральная анестезия. Последняя используется чаще и предполагает фиксацию тонкого катетера в области корешков головного мозга, что способствует уменьшению необходимой дозировки анестетического препарата.
Подготовка к хирургическому вмешательству
Поскольку атеросклероз является хроническим системным заболеванием, любой пациент должен пройти комплексное обследование и исключить поражение других сосудов тела. Минимизация риска сердечных и мозговых осложнений в результате операции предполагает предварительные диагностические мероприятия комплексного характера.
Стандартный список исследований включает в себя:
- Анализы крови (общий, биохимию, коагулограмму, прочие тесты по персональному назначению врача);
- Анализ мочи (общий);
- Электрокардиограмму (ЭКГ);
- Флюорографию (рентген органов грудной клетки);
- УЗИ сосудов.
Перед операцией необходимо уведомить сосудистого хирурга о схематически принимаемых лекарствах. От некоторых из них следует отказаться за неделю до проведения шунтирования (противовоспалительные лекарства и антикоагулянты). Важно исключить курение и употребление алкогольных напитков не позднее, чем за 2 недели до процедуры. Вечером накануне операции допускается легкий ужин, но после полуночи нельзя есть и пить. Операция выполняется натощак.
Показания и противопоказания к методу лечения
На шунтирование отбираются пациенты, сохранные по общему состоянию. Поэтому проводится детальная оценка сопутствующих заболеваний, ожирения и других факторов риска для жизни. Только непосредственная угроза жизни является поводом для риска у больных с тяжелыми сопутствующими заболеваниями.
Необходимо детально оценить сосудистое русло с помощью УЗИ диагностики и ангиографии, чтобы сформулировать четкую концепцию для операции.
Необходима тщательная оценка подкожных вен, так как от их качества зависит успех шунтирования и продолжительность работы шунта. Использование в качестве шунтов искусственных протезов является операцией отчаяния, так как такие шунты закрываются в половине случаев в течение 2 лет.
Возможные осложнения при лечении
Бедренно-берцовое шунтирование in situ.
Этот метод предполагает использование собственной большой подкожной вены пациента, которая остается на своем привычном месте, однако с помощью особых приемов по ней пускается артериальный кровоток в мелкие артерии на голень и стопу. Бедренно-тибиальное шунтирование является основным способом лечения критической ишемии и угрожающей гангрены. Успех ,при правильных показаниях к операции, достигается у 90% больных с начинающейся артериальной гангреной (некрозы пальцев, артериальные трофические язвы). Сохраняется возможность ходить на своей ноге. Венозный шунт можно делать из вен ног или рук, если не сохранена основная подкожная вена.
Шунтирование малоберцовой артерии
Самая маленькая артерия голени меньше всего поражена атеросклеротическим процессом. Однако ее емкости часто не хватает для полноценной работы аутовенозного шунта, что приводит к тромбозу. Особенностями операций на малоберцовых артериях является необходимость четко оценить объем кровотока. Для разгрузки артерии нередко используются специальные приемы — разгрузочные фистулы с венами далеко от анастомоза.
Многоэтажные «прыгающие» шунты
Часто пациентам отказывают в сохранении ноги по причине отсутствия хорошей длиной и проходимой артерии на голени, однако при этом, мы нередко видим отдельные участки и ветви артерий с сохраненным кровотоком. Нашим ведущим сосудистым хирургом Калитко И.М. для таких ситуаций разработана методика многоэтажного шунтирования артерий голени. Нередко выполняется несколько коротких шунтов к отдельным проходимым сегментам артерий. Важным условием для нормальной работы такой сложной реконструкции является достоверная оценка приходящего и распределяющегося объема крови. При перегрузке шунтов могут использоваться разгрузочные фистулы.
Преимущества лечения в ИСЦ
Инновационный сосудистый центр — единственная в нашей стране клиника, где комплексно применяются уникальные микрохирургические, эндоваскулярные и пластические методы для лечения больных с начавшейся гангреной и диабетической стопой. Сосудистые хирурги нашей клиники успешно применяют метод восстановления кровообращения в конечности с помощью микроскопа, разработанный в университетской клинике г. Аахена (Германия), для пациентов с поражением мелких артерий голени и стопы. Это микрохирургическое шунтирование артерий голени и стопы с помощью собственной подкожной вены пациента. Микрохирургия позволяет выполнять успешное соединение венозных шунтов и мельчайших сосудов с высоким качеством. Это дает возможность врачам нашей клиники сохранять конечности больным, уже приговоренным к ампутациям.
С 2011 года наша клиника является лидером в России по применению шунтирования артерий голени и стопы и имеет самые лучшие результаты по сохранению конечностей на фоне атеросклероза малых артерий.
Как подготовиться
Подготовка состоит из полноценной диагностики, куда прежде всего относятся:
- ультразвуковое обследование сонных артерий;
- функциональная диагностика работы сердца;
- ЭХО-кардиография;
- ультразвуковые исследования сосудов нижних конечностей.
Кроме того, во избежание риска кровотечения после операционного вмешательства выполняется гастроскопия. Также необходимы компьютерная ангиография пораженных артерий, анализы и диагностика состояния почек. До основной процедуры корректируется имеющийся дисбаланс электролитного и белкового обменов, нормализуется уровень гемоглобина. За двое суток до операции запрещается употребление спиртного и табака. Непосредственно накануне вмешательства выполняется очищение кишечника при помощи клизмы.
Какая операция лучше?
Для каждой операции есть свои показания и противопоказания. Метод оперативного лечения выбирает врач на основе множества различных факторов, учитывая не только данные УЗИ и ангиографии, но и состояние здоровья пациента, наличие сопутствующих заболеваний, возраста и т.д. Некоторым пациентам может потребоваться комбинация различных методик, например стентирование одного участка артерии и протезирование другого. Такие операции называются «гибридные».
Операции на магистральных сосудах – одна из наиболее частых операций в мире, которая спасла жизнь и сохранила здоровье миллионам людей.
Консультации Онлайн (Skype, Viber, Whats App)
Записаться на консультацию
Диагностика
Очень часто пациенты не предъявляют никаких жалоб. Но если симптомы появляются, то они носят неспецифичный характер. Среди наиболее распространенных симптомов следует отметить боль в брюшной полости, спине или в области грудной клетки. Пациенты описывают эту боль по-разному: одни чувствуют умеренную или сильную боль или болезненные ощущения в средней или верхней части живота, или же в пояснице, другие — ощущают саму аневризму, как бьющуюся и пульсирующую массу в брюшной полости. Но, как отмечалось, многие могут не ощущать никаких симптомов. Иногда аневризма брюшной аорты
может быть обнаружена во время обычного физического осмотра. При пальпации живота врач может обнаружить выпуклость или пульсацию в брюшной полости. Но наиболее часто аневризму выявляют во время таких медицинских исследований, как ультразвуковое исследование (УЗИ) брюшной полости или компьютерная томография (КТ). Размер и локализация аневризмы брюшной аорты, а также общее состояние пациента помогают правильно выбрать метод лечения. Если аневризма небольшая, врач может рекомендовать динамическое наблюдение (регулярные осмотры с целью наблюдения за ее размерами). Аневризма больших размеров или быстро увеличивающаяся аневризма имеет высокую вероятность разрыва и требует лечения.
После процедуры
По завершении хирургического вмешательства пациента переводят в послеоперационную палату на одни сутки. В это время его наблюдают врачи (анестезиолог и хирург). Назначается профилактика пареза кишечника. Потом прооперированного переводят в общую палату, где он находится до 7 суток. По истечении этого срока удаляют швы и готовят пациента к выписке.
Надежность и срок функционирования шунта зависят от выполнения медицинских предписаний. Прежде всего, следует отказаться от курения и регулярно наблюдаться у врача, периодически проходить УЗИ. Для предотвращения развития атеросклероза время от времени выполняют нормализацию обменных процессов и уменьшают содержание холестерина.