Эксперты клиник:
- Зотов Александр из ФНКЦ ФМБА
- Васильев Владислав из НМИЦ кардиологии
- Амир Крамер из TASMC
- Дмитрий Певный из TASMC
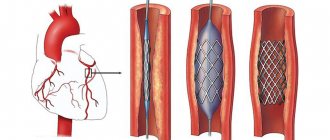
При тяжелой стенокардии, атеросклерозе, ишемической болезни сердца наилучшим выходом является операция АКШ (аортокоронарного шунтирования). Именно эта процедура не только спасает жизнь человека, но и существенно улучшает ее качество. Клиника Медис предлагает пациентам, у которых есть соответствующие показания, пройти шунтирование сердца в Москве или Израиле у наиболее опытных и компетентных кардиохирургов, владеющих самыми современными техниками вмешательств на сердце, в условиях госпиталей премиум-класса. Также предлагаем замену или хирургию аортального или митрального клапана, а также замену корня аорты. Стоимость АКШ и госпитализации — 300 тысяч рублей в исполнении ведущего кардиохирурга в ведущем центре кардиохирургии страны.
Мы очень тщательно подходим к выбору врачей и сотрудничаем только с добросовестными, честными докторами, имеющими огромный практический опыт и работавшими в различных крупных клиниках не только в России, но и за границей. Международный опыт, умение выполнять самые современные процедуры высокотехнологичными и безопасными для пациента способами, следование принятым сейчас в мире медицинским протоколам, а также постановка во главу угла здоровья и благополучия человека – вот то, что мы и наши пациенты ценим в докторах.
Об операции АКШ
Аортокоронарное шунтирование (АКШ) – один из самых эффективных метод в лечении ишемической болезни сердца (ИБС). Операция выполняется на работающем сердце, без применения метода искусственного кровообращения и показана в тех случаях, когда поражение артерий сердца выражено настолько, что использование других методов восстановления коронарного кровотока невозможно.
В нашей клинике ФНКЦ ФМБА коронарное шунтирование выполняется несколькими методами:
- на «работающем» сердце без использования искусственного кровообращения;
- на работающем сердце в условиях вспомогательного искусственного кровообращения.
Риски и осложнения
- послеоперационное кровотечение;
- воспалительный процесс послеоперационной раны;
- дыхательные осложнения;
- нарушения ритма сердца;
- болевые ощущения, связанные с нервными волокнами, спазмом мышц или вывихом реберных хрящей;
- энцефалопатии;
- сердечная слабость, периоперационное повреждение миокарда, инсульт, летальный исход.
Риск операции может рассчитать любой человек, используя международную таблицу подсчета риска кардиохирургических вмешательств EuroSCORE II, что занимает несколько минут.
Показания к аортокоронарному шунтированию
Показания к АКШ определяются различной степенью поражения артерий и проявлениями ишемической болезни сердца:
Как правило, АКШ не проводится:
- выраженной полиорганной недостаточности;
- в течение первых месяцев после нарушения мозгового кровообращения;
- злокачественных новообразованиях.
Терапевтические мероприятия
Лекарственные средства применяются с целью:
- нормализации пульса и АД;
- предупреждения формирования тромбов;
- уменьшения количества содержащегося в крови холестерина;
- нормализации проводимости и питания сердечной мышцы.
Список основных медикаментозных препаратов представлен:
- Аторвастатином;
- Бисопрололом;
- Брилинтой;
- Лизиноприлом;
- Плавиксом;
- Предукталом;
- ТромбоАССом.
Приобрести лекарства можно в аптеке или купить их в интернет-магазине. На виртуальных площадках купить медикаменты проще, там чаще проводятся акции, существует собственная система скидок. Сайты позволяют получать продукцию со склада или бронировать их в магазинах.
Подготовка к аортокоронарному шунтированию
В ФНКЦ ФМБА перед проведением аортокоронарного шунтирования сердца врач составляет план предоперационного обследования. Оно включает лабораторные анализы и инструментальные исследования:
- общий анализ крови, мочи;
- биохимию крови;
- коагулограмма развёрнутая;
- АДФ агрегация тромбоцитов;
- группа крови и резус фактор;
- маркеры инфекций: ВИЧ, гепатит В, гепатит С, сифилис;
- Pro-BNP, СРБ;
- ЭКГ;
- Эхо-КГ;
- рентгенологическое обследование;
- ЭГДС (максимальная давность – 1 месяц). Исключение – пациенты с поражением ствола ЛКА;
- УЗДС брахиоцефальных артерий (максимальная давность – 3 месяца);
- УЗДС артерий нижних конечностей (максимальная давность – 3 месяца);
- УЗДС вен нижних конечностей (максимальная давность – 7 дней);
- ФВД (максимальная давность – 7 дней);
- УЗИ внутренних органов;
- коронарография.
При наличии сопутствующей патологии могут быть назначены дополнительные анализы:
- ОНМК в анамнезе — КТ головного мозга.
- заболевания щитовидной железы — ТТГ, Т4, Т3 (максимальная давность — 30 дней). Консультация эндокринолога при наличии изменений гормонального профиля.
- сахарный диабет — гликемическая кривая (максимальная давность – 7 дней). Консультация эндокринолога при гликемии более 10 ммоль/л.
- Подагра — мочевая кислота (максимальная давность – 1 месяц). При превышении значения в 420 мкмоль/л – консультация терапевта и подбор терапии.
- консультация стоматолога, уролога, гинеколога.
За день до операции пациента осматривает хирург и анестезиолог. Накануне АКШ рекомендуется легкий ужин не позднее 12 часов до операции, с ночи не есть, не пить, отменить прием лекарств. На ночь ставится очистительная клизма. Утром пациент принимает душ.
После подписания информированного согласия пациенту делается премедикация — вводятся лекарства, которые снизят эмоциональную напряженность, помогут успокоиться. Через 40-60 минут пациент доставляется в операционный блок.
В кардиологическом центре ФНКЦ ФМБА вы можете сдать все анализы и пройти исследования, рекомендованные врачом перед операцией. Структура нашего центра позволяет быстро пройти подготовительный предоперационный этап и получить результаты на руки. Имея свою лабораторию, мы отвечаем за правильность взятия анализов и качество клинико-лабораторных исследований.
Аортокоронарное шунтирование (АКШ) занимает важное место в комплексе современных методов лечения больных ишемической болезнью сердца (ИБС). В большинстве клиник эту операцию до сих пор проводят в условиях искусственного кровообращения (ИК) и кардиоплегии. Реже АКШ выполняют без ИК на работающем сердце с использованием технологии OPCAB (off-pump coronary artery bypass). Доказаны преимущества OPCAB перед традиционным АКШ с ИК у пациентов с мультифокальным атеросклерозом, хронической обструктивной болезнью легких, хронической болезнью почек и другими тяжелыми сопутствующими заболеваниями [3, 7, 28, 57]. В то же время при их отсутствии у пациентов малого риска отказ от ИК не приводит к значимому улучшению результатов АКШ [3, 8]. Более того, у больных с инвалидизированным миокардом, значительной дилатацией и низкой насосной функцией левого желудочка применение технологии OPCAB сопряжено с повышенным риском тяжелых гемодинамических расстройств во время дислокации сердца. Оптимальным тактическим решением у таких больных можно считать АКШ с ИК во вспомогательном режиме без кардиоплегии, что исключает указанные нарушения центральной гемодинамики и возможные осложнения, связанные с аноксией миокарда [14, 61, 65].
В ряде клиник большинство операций АКШ выполняется без ИК [64, 66]. Однако следует констатировать, что к ним сохраняется сдержанное отношение, и общемировая доля таких вмешательств среди всех операций АКШ не превышает 20% [33]. Причин этому, на наш взгляд, несколько. Во-первых, отсутствуют доказанные преимущества OPCAB у вышеупомянутой, достаточно большой группы больных малого риска без тяжелых сопутствующих заболеваний. Во-вторых, отличные результаты традиционного АКШ с ИК не всегда способствуют мотивации для внедрения в практику новых технологий [15, 72]. В-третьих, даже большой и успешный опыт выполнения АКШ в условиях ИК и кардиоплегии не гарантирует успеха в освоении технологии OPCAB, что также негативно сказывается на отношении многих кардиохирургов к этой операции [31]. В связи с этим необходимо упомянуть крупные рандомизированные мультицентровые исследования ROOBY и DOORS, в которых авторы показали достоверно худшую проходимость аутовенозных шунтов после операций OPCAB в сравнении с традиционным АКШ при одинаковой проходимости маммарно-коронарных анастомозов и отсутствии достоверных различий в частоте неблагоприятных кардиальных и цереброваскулярных событий в течение года после операции [20, 73]. Однако их оппоненты вполне резонно отметили существенный недостаток этих исследований, заключавшийся в небольшом опыте операций OPCAB у многих хирургов, следствием чего являлась высокая частота конверсий на ИК (12,4%), которая не могла не отразиться негативно на представленных результатах [33]. Напротив, опыт регулярного выполнения большого числа операций без ИК, когда их доля превышает 60% от всех операций АКШ, реализуется в высокое качество формируемых анастомозов, что позитивно отражается на полученных результатах. Авторы таких публикаций [50], в частности, крупного рандомизированного исследования JOCRI (Japanese Off-Pump Coronary Investigation), не нашли достоверных различий как в проходимости аутовенозных, радиальных и маммарно-коронарных шунтов, так и в клиническом состоянии пациентов в течение 2 лет после АКШ в условиях ИК и без него. Подтверждают это и J. Puskas и соавт. [67], которые в ходе рандомизированного исследования не получили достоверной разницы между операциями OPCAB и АКШ с ИК в проходимости шунтов и частоте неблагоприятных кардиальных и цереброваскулярных событий как в ближайшие сроки, так и через 8 лет после операции.
Очевидно, что OPCAB можно рассматривать как операцию выбора для больных высокого риска в руках опытных хирургов, выполняющих ее регулярно и качественно. При таком условии отказ от ИК не отражается на проходимости шунтов в послеоперационном периоде, а отдаленные результаты OPCAB ни в чем не уступают таковым после традиционного АКШ с И.К. Такой подход позволяет значительно расширить возможности технологии OPCAB и применять ее у большинства оперируемых пациентов, если хирург предпочитает выполнять реваскуляризацию миокарда без ИК.
Важнейший тренд современной кардиохирургии — стремление к минимальной операционной травме и максимально быстрая реабилитация пациента, чему во многом способствует внедрение в клинику новых, все более совершенных миниинвазивных хирургических технологий [2, 5, 17]. В соответствии с решениями I Всемирного конгресса по миниинвазивной хирургии сердца, основной целью миниинвазивной реваскуляризации миокарда являются уменьшение числа осложнений и ускорение выздоровления пациента при условии сохранения эффективности и длительности лечебного эффекта операции [12]. Один из основных принципов такой операции — минимизация области вмешательства. Применение мини-доступов в кардиохирургии весьма актуально, учитывая травматичность стернотомии и связанные с ней специфические осложнения [17]. Даже при отсутствии последних многие пациенты отмечают снижение качества жизни в течение нескольких месяцев после операции из-за определенного дискомфорта в области стернотомии [69]. Однако рассматривать лишь малый размер хирургического доступа в качестве определяющего фактора, снижающего операционную травму, не совсем верно. Ряд кардиохирургов считают не менее важным критерием «малой инвазивности» исключение из средств обеспечения операции И.К. По их мнению, отказ от ИК и кардиоплегии снижает риск вмешательства в большей степени, чем уменьшение размера хирургического доступа [1].
OPCAB — операция без ИК через традиционную, продольную стернотомию. Можно ли считать ее миниинвазивной? Видимо, нет, поскольку эта операция не в полной мере соответствует всем вышеуказанным критериям. По мнению A. Calafiore [29], под термином «миниинвазивная реваскуляризация миокарда» следует понимать только те операции коронарного шунтирования, которые выполняют без стернотомии и И.К. Если руководствоваться этим определением, т. е. все основания считать пионером этого направления в коронарной хирургии В.И. Колесова, который в 1964 г. первым выполнил операцию маммарно-коронарного анастомоза через левостороннюю торакотомию [9, 51]. В 1971 г. его сын Е.В. Колесов [10] обобщил и представил результаты 271 такой операции. За рубежом коронарное шунтирование с помощью внутренней грудной артерии (ВГА) без ИК через левостороннюю торакотомию получило наибольшее распространение в Аргентине, где высокой хирургической активностью отличался F. Benetti [21], который в 1991 г. сообщил о результатах 700 таких операций. С 1994 г. берет начало современная миниинвазивная коронарная хирургия, когда F. Benetti и соавт. [20], а также V. Subramanian и соавт. [76] практически одновременно представили результаты маммарно-коронарного шунтирования без ИК через переднелевую мини-торакотомию. Через 2 года отличные результаты такой операции у 115 пациентов с госпитальной летальностью 0,6% продемонстрировала группа итальянских кардиохирургов во главе с A. Calafiore [68]. К этому времени был достигнут определенный прогресс в техническом обеспечении реваскуляризации миокарда на работающем сердце, появились первые механические системы локальной стабилизации миокарда, которые обеспечивали неподвижное поле в месте формирования коронарного анастомоза [29]. В 1996 г. за операцией было закреплено название MIDCAB (Minimally Invasive Direct Coronary Artery Bypass), под которым она существует и по сей день. В России она получила распространение в 1997—1998 гг. Пионерами и активными инициаторами внедрения MIDCAB в клинику были Ю.В. Белов и Г.П. Власов [1, 2]. Еще одним решением, которое представлялось инновационным, стало торакоскопическое выделение левой ВГА (ЛВГА). Данная процедура исключала чрезмерную тракцию ребер при прямом выделении ЛВГА с помощью несовершенных и травматичных ретракторов того времени. Впервые об использовании видеоподдержки при MIDCAB сообщили F. Benetti и соавт. в 1994 г., а в России — Г.М. Соловьев и соавт. в 1997 г. [13, 22].
При несомненном соответствии вышеперечисленным принципам миниинвазивной реваскуляризации миокарда MIDCAB не было лишено весьма существенных недостатков. Во-первых, объем реваскуляризации был ограничен одной передней нисходящей артерией (ПНА), изредка двумя коронарными артериями, включая ее диагональную ветвь (ДВ). В силу этого и показания к MIDCAB возникали при необходимости вмешательства только на ПНА. Очень скоро достигнутый высокий уровень рентгенэндоваскулярной хирургии позволил большинству больных с таким поражением эффективно выполнять коронарную ангиопластику с имплантацией интракоронарных стентов с лекарственным покрытием. Поэтому в настоящее время показания к MIDCAB ограничены ситуациями, когда по каким-либо причинам невозможно выполнить коронарную ангиопластику. Во-вторых, мини-торакотомия не позволяет осуществить моментальное подключение ИК в случаях экстренной конверсии. Если этот минус MIDCAB устраним за счет опыта применения периферического ИК, то первый стал основной причиной значительного снижения интереса к этой операции. В последующие годы несравнимо большее распространение получила вышеупомянутая технология OPCAB. Внедрение в хирургическую практику вакуумных систем позиционирования и локальной стабилизации миокарда расширило возможности этой технологии и позволило выполнять операции множественного АКШ без ИК у пациентов с многососудистым поражением коронарного русла и стенозом ствола левой коронарной артерии, в совокупности составляющих подавляющее большинство оперируемых больных ИБС [11, 16, 42, 67]. Однако при всех его достоинствах ОРСАВ нельзя считать миниинвазивным вмешательством. Всевозможные проблемы, связанные с полной стернотомией, остаются. В этом нет никаких отличий от традиционного АКШ в условиях ИК [52, 78]. Данное обстоятельство имело большое значение в сохранении мотивации кардиохирургов к поиску новых технологий, которые в отличие от OPCAB в полной мере могли бы соответствовать определению «мини-инвазивной реваскуляризации миокарда» и в отличие от MIDCAB могли бы быть применены у большинства оперируемых больных при различном объеме поражения коронарного русла.
Сейчас можно констатировать, что дальнейшее развитие миниинвазивной реваскуляризации миокарда идет по нескольким направлениям. Первое, наиболее распространенное — гибридная реваскуляризация миокарда (HCR, Hybrid Coronary Revascularization), которая сочетает в себе преимущества MIDCAB и чрескожного коронарного вмешательства. Первоначально HCR рассматривали в качестве метода лечения, способного обеспечить адекватную реваскуляризацию миокарда у пациентов высокого риска. Приемлемые результаты способствовали его дальнейшему внедрению в клинику, и сейчас HCR включена в большинство современных рекомендаций по лечению больных ИБС [45, 80]. В частности, данная технология показана к применению при тяжелом атерокальцинозе восходящей аорты, «плохом» состоянии целевых коронарных артерий, дефиците кондуитов, неблагоприятном для стентирования поражении ПНА при низком показателе SYNTAX score.
Существует 3 варианта выполнения HCR, каждый из которых имеет свои преимущества и недостатки. Первый вариант вмешательства возможен при наличии гибридной операционной, в которой сначала делают MIDCAB и затем немедленно интракоронарное стентирование. Положительными моментами такого варианта являются первоначальное восстановление кровотока в ПНА и последующий ангиографический контроль качества маммарно-коронарного анастомоза, отрицательными — высокий риск кровотечения из-за необходимости начала дезагрегантной терапии сразу после нейтрализации гепарина, а также опасность развития контраст-индуцированной нефропатии на фоне хирургического стресса. Все вышесказанное требует скоординированной, высокопрофессиональной работы кардиохирургов, анестезиологов и интервенционных кардиологов. Второй вариант – отсроченное на несколько дней после MIDCAB интракоронарное стентирование, что не требует наличия гибридной операционной. Ранее восстановленный кровоток в ПНА позволяет в таких ситуациях проводить безопасно ангиопластику при поражении ствола левой коронарной артерии (ЛКА) и устьевом поражении огибающей артерии (ОА), есть возможность ангиографического контроля качества маммарно-коронарного анастомоза. Высокий риск кровотечения отсутствует, однако пациент подвергается двум вмешательствам, при этом в периоде ожидания ангиопластики существует риск развития ишемии нереваскуляризированного миокарда. Третий вариант гибридного вмешательства с первоначальной коронарной ангиопластикой и отсроченным MIDCAB выполняется редко, в основном при остром коронарном синдроме и необходимости интракоронарного стентирования инфаркт-ответственных ОА или правой коронарной артерии (ПКА). Гибридная операционная в таких ситуациях не требуется. Кроме того, существует риск тромбоза ранее имплантированных стентов при временном прерывании дезагрегантной терапии и нейтрализации гепарина после MIDCAB [70].
В целом ряд исследователей [43, 44, 81] указывают на определенные преимущества HCR перед множественным коронарным шунтированием у определенной, тщательно отобранной группы больных высокого риска с низким показателем SYNTAX score. На госпитальном этапе лечения эти преимущества заключаются в сокращении длительности искусственной вентиляции легких (ИВЛ) и времени пребывания в отделении кардиореанимации, снижении потребности в переливании компонентов крови и уменьшении времени госпитализации. Однако различия в показателях госпитальной летальности, частоте неблагоприятных кардиоваскулярных событий в 1-й год после HCR уже отсутствуют. В дальнейшем необходимость в повторной реваскуляризации миокарда достоверно выше после гибридного вмешательства.
Наиболее высокотехнологичным методом миниинвазивной реваскуляризации миокарда является робот-ассистированное, полностью эндоскопическое коронарное шунтирование (TECAB – Total Endoscopic Coronary Artery Bypass). За 20 лет своего развития со времени экспериментальных работ E. Stephenson и C. Ducko, первой в мире операции TECAB, успешно выполненной D. Loulmet в парижской клинике в 1998 г., коронарная роботохирургия достигла впечатляющего прогресса [37, 56, 75]. В настоящее время она сосредоточена в ряде кардиохирургических центров США, Канады, Германии и стран Юго-Восточной Азии. Первоначально применение роботизированных систем Zeus, а затем и первых поколений da Vinci было ограничено выделением ВГА и формированием маммарно-коронарного анастомоза между ЛВГА и ПНА. Хирургический доступ к другим целевым коронарным артериям осуществляли через продольную стернотомию и гораздо реже через левую переднюю мини-торакотомию [32, 34—36]. В 2000 г. U. Kappert и соавт. [48] из Дрездена впервые сообщили об успешной операции полностью эндоскопического билатерального маммарно-коронарного шунтирования, в ходе которой ЛВГА использовали для ветви тупого края ОА, а правую ВГА — для ПНА. Вполне естественно, что на начальном этапе своего развития робот-ассистированное коронарное шунтирование нередко сопровождалось интраоперационными осложнениями, частота которых доходила до 50%. Проблемы касались как выделения ВГА, так и формирования дистальных анастомозов. Такие осложнения часто влекли за собой конверсию на обычное АКШ, сопровождались увеличением времени операции, ИВЛ, пребывания пациентов в кардиореанимации и стационаре, но, к счастью, не приводили к росту госпитальной летальности [25]. По мере накопления опыта наблюдалась четкая тенденция к значительному снижению частоты осложнений, а сама TECAB становилась все более конкурентоспособной в сравнении с традиционным АКШ. Преимущества TECAB заключались в меньшей продолжительности госпитализации, быстрой физической реабилитации и менее выраженных болевых ощущениях в первые месяцы после операции [23]. S. Savista и соавт. [74] в 2010 г. представили результаты TECAB 1, 2 и 3 коронарных артерий, выполненных в 2004—2007 гг. Помимо блестящих ближайших и отдаленных результатов, авторы сообщили об отличной проходимости шунтов, составившей 98,6%.
Современное TECAB — это операция множественного бимаммарно-коронарного шунтирования, выполняемая с полным сохранением целостности грудной клетки без какого-либо хирургического доступа. Объем реваскуляризации миокарда – от 1 до 4 коронарных артерий [24]. При сохранной грудной клетке длины двух ВГА in situ
обычно достаточно для создания необходимого количества коронарных анастомозов. ВГА выделяют скелетизированно [27]. У большинства пациентов операции проводят в условиях периферического ИК с трансфеморальной канюляцией. Кардиоплегию осуществляют через эндоаортальный баллонный катетер, который вводят через боковое ответвление артериальной магистрали. Под контролем чреспищеводной эхокардиографии катетер подводят в восходящую аорту, раздувают баллон, полностью обтурируют аорту и проводят, как правило, кровяную кардиоплегию [53]. Не менее распространено TECAB на работающем сердце в условиях параллельного ИК, которое целесообразно применять у пациентов с низкими функциональными резервами миокарда [53, 74]. Операции без ИК выполняют относительно редко, ввиду большого риска расстройств центральной гемодинамики при дислокации сердца внутри закрытой грудной полости. До недавнего времени исключение составляло изолированное маммарно-коронарное шунтирование ПНА [38, 39]. Однако в настоящее время наметилась тенденция к росту числа операций робот-ассистированного множественного коронарного шунтирования без ИК [19, 79]. Следует отметить, что TECAB может быть как самостоятельным методом хирургического лечения, так и компонентом HCR, тем самым усиливая его миниинвазивный характер [26, 40, 74].
Несмотря на все очевидные достоинства, технология TECAB пока не нашла широкого применения в кардиохирургической практике в первую очередь из-за своей высокой стоимости. Многие клиники по финансовым соображениям не могут себе позволить приобретение и эксплуатацию современных роботизированных систем. Кроме того, продолжительная кривая обучения TECAB свидетельствует о более сложном и длительном процессе достижения необходимой квалификации по сравнению с другими методами реваскуляризации миокарда [53]. Поэтому данная технология, несмотря на постепенное расширение своей географии, все же остается прерогативой небольшого числа специализированных и высокобюджетных центров [19, 27, 39].
Вышеперечисленных недостатков во многом лишено другое направление миниинвазивной реваскуляризации миокарда, ориентированное на выполнение множественного коронарного шунтирования через левую переднебоковую мини-торакотомию (MICS CABG — Minimally Invasive Cardiac Surgery/Coronary Artery Bypass Grafting). Первую такую операцию без ИК выполнили J. McGinn и соавт. [59] в январе 2005 г. в Нью-Йорке в Институте сердца. К 2014 г. по этой технологии здесь произведено более 1000 хирургических вмешательств. Операция получила распространение в ряде клиник США и Канады, Европы, Японии, Индии и Китая [4, 41, 49, 54, 58, 61]. В России MICS CABG выполняют в кардиохирургических клиниках Астрахани, Санкт-Петербурга и Москвы [6, 7, 17].
Все этапы операции проводит хирург под прямым контролем зрения без видеоассистенции. Какой-либо необходимости в дорогостоящих роботизированной системе и расходном материале нет. Технология MICS CABG отличается от MIDCAB возможностью выполнения множественного шунтирования у пациентов с многососудистым поражением коронарных артерий. В этом операция аналогична традиционному АКШ через серединную стернотомию [70]. Однако в отличие от него MICS CABG сопровождается минимальной хирургической травмой и полным сохранением каркаса грудной клетки, быстрой реабилитацией и отличным косметическим эффектом. В силу этого сокращаются время пребывания пациентов в отделении интенсивной терапии, длительность госпитализации после операции (в среднем 4 дня), полностью отсутствуют риск стернальной инфекции и необходимость в прерывании даже двойной дезагрегантной терапии [71]. Полная реваскуляризация миокарда может быть выполнена у 95% больных, оперированных по данной технологии. Периоперационная летальность не превышает 1.3%. Кроме того, не вызывает сомнений снижение потребности в гемотрансфузии, а также раннее возвращение пациентов к полной физической и социальной активности [58]. Подводя итог 10-летнему опыту выполнения MICS CABG, J. McGinn и соавт. [59] высоко оценили его клиническую эффективность. В сроки до 8 лет после операции (в среднем в течение 2,9±2,0 года) выживаемость составила 96%, частота неблагоприятных кардиальных и цереброваскулярных событий — 2%, потребность в повторной реваскуляризации миокарда — 7%, при этом частота повторных вмешательств на ранее шунтированных коронарных артериях составила 1%. Столь значительный клинический результат операции, не уступающий традиционному АКШ, находит свое объяснение в высокой функциональной состоятельности шунтов после MICS CABG. Общая их проходимость через полгода после операции составляет 92% при абсолютной (100%) проходимости шунтов из ВГА [58, 71]. Качественное выполнение анастомозов является непременным условием достижения таких показателей. Помимо необходимого опыта и хирургического мастерства, полноценная реализация этого условия зависит от экспозиции и визуализации целевых коронарных артерий. В связи с этим следует отметить, что мини-торакотомию, как правило, выполняют более латерально по сравнению с операцией MIDCAB. Такой доступ позволяет шире развести ребра с меньшим риском их повреждения и обеспечить оптимальную экспозицию не только ПНА, но и ветвей ОА и ПКА [70]. Выделение обеих ВГА, а также формирование проксимальных анастомозов на восходящей аорте значительно облегчают однолегочная ИВЛ правого легкого – обязательный элемент анестезиологического пособия при MICS CABG [4, 59]. Затем две ВГА можно использовать как in situ
, так и в композитных конструкциях для множественного бимаммарного коронарного шунтирования, исключив манипуляции на аорте. Кроме того, некоторые хирурги предлагают торакоскопическое выделение ВГА, что уменьшает размер мини-торакотомии и исключает чрезмерную тракцию межреберья, возможную при мобилизации ВГА под прямым визуальным контролем [46].
В соответствии с одним из основополагающих принципов миниинвазивной кардиохирургии, операцию MICS CABG выполняют, как правило, без И.К. Однако иногда при большом объеме реваскуляризации, сниженной фракции изгнания левого желудочка обоснованно использование ИК во вспомогательном режиме, для чего используют его периферическое подключение через канюляцию бедренных сосудов [70]. Данная методика оптимальна для спокойной работы со сложными пациентами, что крайне важно для приобретения необходимого опыта таких операций. Кроме того, операция может быть выполнена в условиях полного ИК и кардиоплегии. Поступление кардиоплегического раствора осуществляется через катетер, интегрированный в артериальную магистраль контура ИК, на нем же фиксирован баллон, раздувание которого приводит к обтурации восходящей аорты. Пережатие аорты может быть осуществлено и снаружи зажимом, подведенным к ней через дополнительный порт, с инфузией кардиоплегического раствора в восходящую аорту.
При всех несомненных достоинствах технология MICS CABG все же имеет определенные ограничения. Однако только некоторые из них можно считать противопоказаниями к ее применению. Большинство других, как правило, обусловлены недостаточным опытом таких операций и могут быть нивелированы по мере его накопления. К первым следует отнести низкую толерантность к однолегочной вентиляции, которая, как правило, встречается при тяжелой хронической обструктивной болезни легких [46]. О степени ее тяжести можно судить по индексу Тиффно — отношению объема форсированного выдоха за 1 с (ОФВ1) к форсированной жизненной емкости легких (ФЖЕЛ). Его снижение менее 0,5 свидетельствует о выраженной бронхиальной обструкции и крайне высоком риске однолегочной вентиляции. MICS CABG не показана пациентам, ранее перенесшим операцию с инвазией в левую плевральную полость. Кроме того, операция противопоказана при значительном атеросклеротическом поражении артерий нижних конечностей, что исключает возможность безопасного подключения периферического И.К. Большую осторожность следует проявлять при использовании этой технологии у больных с инвалидизированным миокардом и кардиомегалией, когда при позиционировании сердца существенно возрастает риск гемодинамических нарушений. Таким пациентам безопаснее выполнять операцию в условиях параллельного ИК с его трансфеморальным или центральным подключением, отказавшись в последнем случае от минидоступа в пользу традиционной стернотомии.
На этапе освоения MICS CABG определенные ограничения могут быть связаны с ее техническим исполнением у некоторых групп больных. Возможные трудности экспозиции операционного поля через мини-торакотомию у пациентов с избыточным весом диктуют необходимость накопления первоначального опыта этой операции у пациентов-нормостеников с широкими межреберными промежутками. Анатомические условия в таких случаях близки к идеальным, обеспечивают оптимальную визуализацию целевых коронарных артерий. Объективные сложности формирования дистальных анастомозов при диффузном поражении коронарных артерий, нередко возникающая необходимость эндартерэктомии при традиционном АКШ могут стать серьезным препятствием для достижения успеха первых операций MICS CABG. Напротив, многососудистое, но локальное поражение с достаточным диаметром целевых коронарных артерий и хорошим состоянием их дистального русла несомненно будет способствовать этому успеху. Однако вышеперечисленные трудности нельзя считать противопоказаниями к MICS CABG, т.к. при достаточном опыте и высокой квалификации хирурга они не препятствуют выполнению этих операций.
Таким образом, современная тенденция к минимизации хирургической травмы получила свое развитие в хирургии ишемической болезни сердца сразу по нескольким направлениям. Возможность выполнения гибридной реваскуляризации миокарда (HCR) прежде всего следует рассматривать при высоком риске множественного коронарного шунтирования, дефиците кондуитов, неблагоприятном для стентирования поражении ПНА при низком показателе SYNTAX score, выраженном атерокальцинозе восходящей аорты без шансов применения хирургической техники «no-touch aorta». Робот-ассистированное, полностью эндоскопическое коронарное шунтирование (TECAB) позволяет выполнить полную реваскуляризацию миокарда вообще без доступа, сведя к минимуму хирургическую травму больного. Несомненно, что самые передовые технологии TECAB обеспечивают максимальную реализацию профессионального мастерства хирурга в достижении необходимого результата операции при минимальной травматизации пациента. Однако высокая стоимость, длительный и достаточно сложный период обучения являются факторами, до сих пор сдерживающими внедрение этой технологии в широкую кардиохирургическую практику. В отличие от TECAB, операция MICS CABG не предполагает столь значительных материальных затрат, кривая обучения свидетельствует о ее высокой воспроизводимости. Как правило, опыт операций OPCAB позволяет быстро овладеть данной технологией [70]. По мере накопления опыта ее применения показания к ней могут быть существенно расширены. В силу этого в ближайшей перспективе операцию MICS CABG можно рассматривать в качестве одного из основных методов миниинвазивной реваскуляризации миокарда.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflict of interest.
Сведения об авторах
Жбанов И.В. — e-mail
Киладзе И.З. — https://orcid.org/0000-0002-3342-2440; e-mail
Урюжников В.В. — https://orcid.org/0000-0002-5187-8169; e-mail
Шабалкин Б.В. — e-mail
Автор, ответственный за переписку:
Киладзе И.З. — e-mail: [email protected]
КАК ЦиТИРОВАТЬ:
Жбанов И.В., Киладзе И.З., Урюжников В.В., Шабалкин Б.В. Миниинвазивная коронарная хирургия. Кардиология и сердечно-сосудистая хирургия
. 2019;12(5):377-385. https://doi.org/10.17116/kardio201912051
Проведение АКШ
Аортокоронарное шунтирование на работающем сердце начинается с обеспечения доступа к месту проведения операции — послойно разрезается кожа, подкожные слои, мышцы.
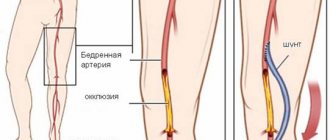
Трансплантат (шунт) — здоровый участок вены или артерии — забирается из грудной клетки пациента или его конечности (бедра, голень). Для выполнения операции на работающем сердце применяется специальное оборудование, позволяющее стабилизировать миокард в месте формирования анастомоза. Один конец здорового сосуда подшивается к аорте, другой — к коронарной артерии ниже стенозированного/суженного участка. Затем восстанавливается полная работа сердца, рана ушивается, пациента переводят в отделение реанимации.
Коронарное шунтирование в большинстве клиник проводят с остановкой сердечной деятельности с применением аппарата искусственного кровообращения. Использование этого метода связано с риском развития осложнений, которые удлиняют сроки восстановления, ухудшают выздоровление, могут привести к кровотечениям, инсульту, инфаркту. Проведение операции без искусственного кровообращения — на работающем сердце — позволяет снизить риск послеоперационных осложнений.
Отзывы пациентов
Георгий Ц.: Как говорят, если шунтирование аорты будет выполнено на отлично, то и забыть об этом нужно, а если посредственно, то три-пять лет проживешь и удача. Вот я и решил сделать на отлично, узнал у своего специалиста, кто чего стоит и решил заказать все выполнить клинике Медис. Про выбор врача я промолчу, но выбрал из лучших, прилетел в Москву на операцию известный кардиохирург, а бригада с ним местная была, но из лучших. И как мне в Медисе объяснили, выхаживание тоже много значит для выздоровления, вот они его и обеспечили на уровне. Все прошло удачно, из ноги взяли материал для шунта, благо вены на ноге у меня хорошие. На остановленном сердце операцию мне делал израильский хирург Амир Крамер. Выхаживал израильский врач, контролировал все. Это конечно «спецзаказ», то есть специально выстроенный под меня продукт, это я как ген. директор говорю. Именно так и можно обеспечить самый высокий уровень выполнения АКШ.
Самвел Карапетян: Я попросил организовать операцию по аортокоронарному шунтированию Медис и за триста тысяч все было сделано очень хорошо, быстро и качественно.
После операции
В целом реабилитация и восстановление после АКШ без искусственного кровообращения проходит быстрее и легче. Если ранний послеоперационный период проходит без осложнений, то через сутки удаляют катетеры и пациента переводят в отделение, где он находится до 7-10 дней. Там будет отслеживаться состояние сердца и всего организма.
В послеоперационном периоде пациенту индивидуально подбирается план реабилитации и назначается лечебная физкультура.
Хорошим методом поддержания здоровья являются пешие прогулки длительностью от 10 минут в самом начале (после того как разрешат ходить) до 30-60 минут через 2-3 недели после операции.
Важно, чтобы при физической нагрузке, ЧСС не поднимался выше 100-115 ударов в минуту и не было одышки.
Если после операции и реабилитационного периода в палате – в отделении кардиохирургии вы переживаете о самостоятельном восстановлении, можете пройти программу реабилитации в нашем центре.
При выписке из стационара лечащий врач выдаст памятку о правилах профилактики после операции, назначит лекарственные препараты. Прием любых других препаратов, в том числе из домашней аптечки, должен быть согласован с кардиологом.
Курить, употреблять алкоголь после операции АКШ нельзя пожизненно. Также нужно будет соблюдать диету с уменьшенным содержанием соли, жиров, сладостей.
После вам необходимо будет пройти исследование сердца через 1 месяц, 3, 6, 12 месяцев. Это вы также можете сделать в нашем центре.
Врачи, которые оперируют пациентов
Мы «сотрудничаем» с такими светилами, как легендарный профессор Ренат Акчурин, то есть, если у вас сложная проблема, то мы постараемся, чтобы вы попали к академику. Также работаем с известным в мире кардиохирургом Маруо дель Джильо, а также с известными израильскими кардиохирургами Амиром Крамером и Дмитрием Певным, и другими высококлассными специалистами, в которых мы полностью уверены. Бригада медиков, которая участвует в операции и выхаживании, также высокой квалификации и дают нашим пациентам максимум внимания.
Что вы получаете, обращаясь за лечением к нам: