Почему возникает дискомфорт?
Дело в том, что все время в организме человека циркулирует кровь, даже когда человек абсолютно не подвержен. В то время как в желудочки сердца попала кровь, сердечная мышца спазмируеться, и кровь находящаяся в желудочках под давлением, выходит в сосуды. Процесс заполнения сосудов происходит настолько быстро, что создаётся давление.
Как только в этом механизме происходит сбой, человек начинает ощущать ухудшение общего состояния.
Можно сделать вывод, что артериальное давление зависит от того, насколько интенсивно сокращается сердце. Как только вы увидели, что давление отклонилось от нормы, нужно немедленно обратиться к врачу. Вполне возможно, что это связано с заболеванием сердца. В случае, если проблем с сердцем не обнаружили, стоит поискать проблему в других областях работы сердечно-сосудистой системы.
Артериальное давление, которое фиксируется в момент выталкивания сердечной мышцей крови из сердца называется символическим или верхним давлением.
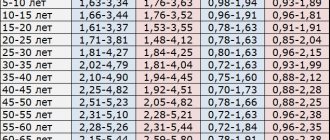
в чем разница между высоким и низким давлением
С помощью систолического давления можно точно узнать частоту сокращений сердца. В норме оно составляет около 110-130.
С возрастом давление человека повышается. После 50 лет давление 140 считается нормальным.
А вот, давление на стенки артерий в момент полного расслабления сердечной мышцы называется диастолическим или нижним давлением.
Из этого показателя можно судить о силе, с которой кровь двигается по сосудам организма. Если человек абсолютно здоров, то показатель может быть 65-80.
Как вы заметили, разница между давлением артериальным и сердечным
65 и 80 существенна. Она обусловлена индивидуальными особенностями каждого отдельного человека. Если у вас сосуды в хорошем тонусе и достаточно эластичные, тогда и давление будет около 75-80 единиц.
Как все это работает? Несколько слов о строении сердца и его отделов
Строение сердца у млекопитающих, имеющих 2 круга кровообращения, примерно одинаково. Сердце состоит из двух предсердий (первых камер на пути притекающей крови), двух желудочков, клапанов между этими камерами и входящих и отходящих от сердца сосудов с клапанами у их начала.
Между правым предсердием и правым желудочком находится правый клапан предсердно-желудочковый
, или а
трио-вентрикулярный
, который состоит из 3-х створок. Поэтому его называют
трехстворчатым
, или
трикуспидальным
.
Между левым предсердием и левым желудочком находится левый предсердно-желудочковый клапан
, который состоит из двух створок и называется
митральным
.
Клапаны
, расположенные в устьях сосудов, отходящих от сердца, или магистральных сосудов, а именно –
аорты
и
легочной артерии
– соответственно носят названия
«аортальный»
и
«легочный»
.
Атрио-вентрикулярные клапаны
– створчатые, т.е. их устройство напоминает двери на створках: открылись и закрылись, вниз — вверх.
Клапаны аорты
и
легочной артериидругие по строению
. Каждый из них состоит из 3-х полулунных створок, замыкающихся в центре. При открытии они прижимаются к стенке своего сосуда (аорты или легочной артерии), а закрываются, полностью замыкая просвет сосуда. При этом их вид напоминает фирменный знак .
Ткань самих створок, как атрио-вентрикулярных, так и полулунных — тонкая, у детей даже прозрачная, но поразительно эластичная и прочная, рассчитанная природой на непрекращающуюся ритмичную работу, исчисляемую миллиардами однообразных действий.
Между полостями сердца, или его камерами, расположены перегородки, разделяющие потоки венозной и артериальной крови. Это межпредсердная перегородка, т.е. между правым и левым предсердиями, и межжелудочковая перегородка – между правым и левым желудочками. В нормальном, сформированном сердце они полностью закрыты, в них нет никаких отверстий или дефектов
и, таким образом, кровь из одной половины сердца в другую никогда не поступает.
Остановимся подробнее на анатомическом устройстве сердца и его камер. Ведь даже те из них, которые называются одинаково (предсердия или желудочки), устроены абсолютно по-разному и выполняют разные функции.
Сердце по форме напоминает грушу, лежащую несколько на боку, с верхушкой, расположенной слева и внизу, а основанием — правее и вверху. Верхушка сердца – это та его часть, движения которой можно почувствовать, если положить ладонь на грудную клетку в пятом межреберье слева от грудинной кости. Его толчок легко можно ощутить и у себя, и у ребенка. Это движения верхушки сердца при каждом сокращении. Сокращения почти синхронны с пульсом, который тоже можно легко прощупать на руке (там, где предплечье переходит в кисть) или на шейных сосудах. Пульс – это наполнение сосудов волной крови, поступающей из сердца с каждым его сокращением. Частота пульса, его ритмичность являются косвенным и легко доступным отражением деятельности самого сердца.
Верхушка — самая подвижная часть сердца, хотя и всё оно, все его отделы находятся в постоянном движении.
Работа сердца, его движение, состоит из двух чередующихся фаз — сокращения (систолы) и расслабления (диастолы).
Ритмичное, постоянное чередование этих фаз, необходимое для нормальной работы, обеспечивается возникновением и проведением электрического импульса по системе особых клеток – по узлам и волокнам проводящей системы сердца
. Импульсы возникают вначале в самом верхнем, так называемом,
синусовом узле
, далее проходят ко второму,
атрио-вентрикулярному узлу
, а от него – по более тонким волокнам – к мышце правого и левого желудочков, вызывая сокращение всей их мускулатуры.
Правое предсердие
принимает венозную кровь из полых вен, т.е. от всего тела и вдобавок венозную кровь самого сердца. Это – большая по объему и, пожалуй, самая растягиваемая камера сердца. При необходимости она способна вместить в несколько раз больше крови, чем в обычных условиях, т.е. обладает гигантским «запасом» объема. Стенка правого предсердия состоит из слоя тонких мышечных волокон. Помимо функции «приема» венозной крови, правое предсердие выполняет функцию водителя сердечного ритма. В его стенках залегают оба главных узла проводящей системы сердца.
Правое предсердие соединяется или, точнее, открывается в правый желудочек через предсердно-желудочковое отверстие
, регулируемое
трикуспидальным клапаном
. Это отверстие достаточно широкое, чтобы пропустить весь объем крови из предсердия в правый желудочек в период расслабления его мышц, т.е. в фазу диастолы, и заполнить его полость.
Правый желудочек — значительно более толстостенная, чем предсердие, мышечная структура. Это — самый передний отдел сердца, лежащий тотчас под грудинной костью. Он относительно растяжимый в случае необходимости. Форма его полости напоминает новый месяц, появившийся в небе. Если внимательно присмотреться, то видно, как светящаяся полоса месяца полукругом охватывает большой темный шар неосвещенной части Луны. Так и правый желудочек обтекает своей полостью мощный цилиндрический левый.
Внутри этот желудочек состоит из двух, продолжающихся один в другой, конусов: конус входного отдела и конус выходного отдела. Они сходятся своими верхушками у верхушки сердца и разделены вверху мышечным валиком, так называемым наджелудочковым гребнем.
Правый желудочек открывается в легочную артерию, которая вместе с аортой является так называемым магистральными, или «великим», сосудом. На переходе от желудочка в легочную артерию расположен трехстворчатый, полулунный клапан легочного ствола, пропускающий кровь в одном направлении — в легкие.
Левое предсердие — самая заднерасположенная из сердечных камер. Оно принимает окисленную, артериальную кровь из легочных вен. Вен всего четыре и они впадают в заднюю стенку левого предсердия. Камера этого предсердия значительно меньше, чем правого, и способность ее к растяжению существенно меньше.
Левое предсердие открывается через предсердно-желудочковое отверстие в левый желудочек. В этом отверстии находятся двухстворчатый — митральный — клапан, открытие и закрытие которого регулирует процесс заполнения и опорожнения желудочка в фазы систолы и диастолы.
Левый желудочек — главный в сердце, да и во всей системе кровообращения. Это — мощная мышечная камера, стенки которой в 3-4 раза толще, чем у правого соседа. Это — компактный конус с отверстием входа (с митральным клапаном) и выхода (с трехстворчатым аортальным полулунным клапаном), лежащими рядом друг с другом и тесно взаимосвязанными.
Чтобы вся эта сложная система стройно и четко работала, она должна получать постоянное необходимое питание в виде кислорода и питательных веществ, а отработанные продукты должны удаляться. Для этого существуют артериальная и венозная системы самого сердца.
Артериальная система самого сердца состоит из двух — левой
и
правой
–
коронарных (венечных) артерий
, которые отходят в самом начале, в устье восходящей аорты. Это ее первые ветви. Они тот час делятся на более мелкие и разносят кровь по всем участкам непрерывно двигающегося сердца. «Отработанная», отдавшая кислород, кровь втекает по многочисленным мелким венам, которые собираются в одну большую — венечный синус — и впадают в полость правого предсердия. Таким образом, сердце питает само себя, и от правильного положения и состояния венечных артерий его функция зависит напрямую.
Итак, подведем итог. Анатомически сердце — это мощный мышечный орган, имеющий четыре камеры и четыре клапана. Строение камер и клапанов отлично друг от друга, т.к. подчинено выполнению разных задач. Правые отделы сердца отделены от левых перегородками и между собой не сообщаются.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. Сердце ребенка. Книга для родителей о врожденных пороках сердца
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
Онлайн-консультации
Какая же разница в норме между систолическим и диастолическим давлением?
Давайте узнаем, какая разница в давлении считается нормальной
. Если взять показатели нормы, которые для взрослого человека составляют 120/80 мм. рт. ст. , то несложно подсчитать разницу, которая составляет 40 единиц.
Но, если эта разница становится больше 65, это звонок о возможности скорого развития сердечно-сосудистых заболеваний. К тому же, некорректная робота сердца и сосудов приводит к их раннему окрашиванию и, соответственно, ускорению процесса старения.
О появлении в организме патологических процессов может говорить разница больше 45 или меньше 35 единиц. Симптомы могут не проявляться при такой разнице, иногда встречаются общая слабость и сонливость.
Если говорить о людях старшего возраста, то у них разница до 50 единиц между систолическим и диастолическим давлением считается возрастной нормой. Ведь их ткани достаточно износились и потеряли эластичность сосудов.
Диастолическая сердечная недостаточность и жесткость сосудов
Академик Ивашкин В.Т.: – Я прошу Оксану Михайловну сделать очередное сообщение. «Диастолическая сердечная недостаточность и жесткость сосудов». Пожалуйста. Профессор Драпкина О.М.: – Спасибо большое. Уважаемые коллеги, я сегодня говорила о фиброзе миокарда, и, в принципе, говоря о фиброзе миокарда, так или иначе касаешься диастолической сердечной недостаточности. Мы в клинике и на кафедре занимаемся этой проблемой, соответственно, сейчас тоже есть определенные возможности поделиться тем опытом, который мы накопили.
Мы говорим о диастолической сердечной недостаточности, мы говорим об артериальной гипертензии и говорим, что все-таки нарушенная диастола – это участь пациентов с высоким риском артериальной гипертензии. Но когда высок риск артериальной гипертензии по SCORE, мы знаем, что это и выраженное поражение органов-мишеней и более трех факторов риска или, например, метаболический синдром, когда есть другие факторы риска (сегодня Сергей Руджерович рассказывал, и мы вместе вспоминали исследование «Юпитер», где в качестве маркера у здоровых людей было повышение высокочувствительного C-реактивного белка).
Таким образом, возникает вопрос. Мы все время говорим: «Пациенты к нам приходят с инфарктом миокарда, потому что мы неправильно лечили артериальную гипертензию». А если мы правильно лечили артериальную гипертензию? Тогда получится гипертрофия миокарда и, соответственно, повышение жесткости. Так что же получается, что хроническая сердечная недостаточность с сохраненной фракцией выброса – это правильное лечение артериальной гипертензии и что другого пути нет?
Конечно, это не так. Но тем не менее этим слайдом мне бы хотелось привлечь внимание к такому постулату: отсрочить инфаркт миокарда у пациента с артериальной гипертензией – это не единственная наша задача. Спектр наших задач гораздо больше, в том числе предотвратить вот эту ступень, когда пациент перешагивает от просто гипертоника к гипертонику с хронической сердечной недостаточностью, как правило с сохраненной фракцией выброса.
Поэтому еще раз несколько слов о терминологии. Речь пойдет о сердечной недостаточности с сохраненной фракцией выброса. В принципе, это и есть правильный термин, но мы, медицинское сообщество, разрешаем друг другу называть эту сердечную недостаточность диастолической сердечной недостаточностью – наверное, просто для сокращения.
Эпидемиология известна. Есть немного разные данные – европейские и наши. По данным исследования ЭПОХА, более 70 % пациентов с сердечной недостаточностью имеют сохраненную фракцию выброса. Конечно, это удел пожилых, поскольку мы все боремся за то, что население у нас становится старше, мы все боремся за продолжительность жизни. Это приведет к тому, что пациентов с диастолической сердечной недостаточностью тоже будет больше, и нам их надо будет долгие годы каким-то образом вести.
Вот, на мой взгляд, интересные данные. Ежегодная смертность пациентов с диастолической сердечной недостаточностью, она действительно несколько ниже. Но когда посмотрели на смертность через три года, то она практически выравнивается. Но, самое главное, статистика говорит, что среди больных с хронической сердечной недостаточностью с фракцией выброса более 50 % за три года в живых остается менее 60 %, значит 40 % – погибает.
Но вот, я бы сказала, шокирующие меня данные. Если прогноз на фоне лечения при сердечной недостаточности с сохраненной фракцией выброса улучшается (и мы здесь видим диапазон с 1987 года, когда мы в основном говорили о кардиоренальной теории хронической сердечной недостаточности), то, обратите внимание, уважаемые коллеги, ничего не происходит с улучшением прогноза пациентов с сохраненной фракцией выброса – как 60 % их умирало через три года, собственно говоря, после постановки диагноза, так все и остается. Это поднимает вопрос о том, что мы, наверное, пока не знаем точно, как лечить эту форму хронической сердечной недостаточности.
Ну, и очень коротко я хотела бы напомнить те основные знания, которые мы получаем из курса физиологии на третьем курсе, так называемом экваторе (студенты говорят «экватор»; третий курс прошел – значит прошел половину обучения в институте). Вот эта кривая «давление-объем в левом желудочке», и как раз изменение этой кривой характеризует основные изменения, которые возникают у пациентов с жестким миокардом и сначала с диастолической дисфункцией, а затем – с диастолической сердечной недостаточностью.
Итак, окончание диастолы как бы знаменует фазу изоволюмического сокращения. Мы видим, что здесь давление в левом желудочке стремительно нарастает без изменения его объема. Открывается аортальный клапан и происходит та самая систола, или фаза изгнания. Как раз в тени этой систолы всегда была диастола, поскольку мы оценивали работу сердца именно по тому, как оно сокращается, по сократительной функции.
Затем период систолы закрывается, закрывается, естественно, аортальный клапан, и происходит как раз та самая интересная на сегодняшний момент, на момент сегодняшнего моего повествования, стадия – это диастола. Первый период, он как раз характеризуется стадией изоволюмического расслабления (мы видим, что она очень похожа на стадию изоволюмического сокращения), то есть резкое снижение давления в левом желудочке, открывается митральный клапан, и наконец происходит стадия наполнения. Надо понимать, что эта стадия – это достаточно энергоемкий процесс, поэтому для того, чтобы диастола была совершенной, нужно достаточное количество макроэргов.
Ну, и закрывается митральный клапан, и мы видим (там, где точка, которая показывает закрытие митрального клапана), что окончание диастолы происходит на таком положительном конечном диастолическом давлении. Так вот, если левый желудочек жесткий, то этот небольшой подъем будет более крутым, и давление, которое будет в левом желудочке, оно будет выше.
График двумерный, поэтому здесь невозможно – я во всяком случае не смогла – показать время, так называемое «тау», изоволюмического расслабления. Это очень важный показатель, и мы к нему вернемся чуть ниже.
Таким образом, мы можем суммировать те факторы, которые влияют на диастолу. Суммировать мы их можем, разбив на две, на мой взгляд, абсолютно неравнозначные, но достаточно важные группы. Первая – это, конечно, работа желудочка, это раннее диастолическое наполнение желудочка. И как раз такие факторы, как: эластический возврат крови в левый желудочек, сократительная функция левого желудочка, жесткость левого желудочка в диастолу, свойства легочных вен, площадь отверстия митрального клапана, – и дают 80-типроцентный вклад в полноценную диастолу.
Но есть еще маленький вклад, и тем не менее о нем тоже не стоит забывать, особенно, когда к нам приходит, например, пациент с нарушениями ритма, и хроническая сердечная недостаточность переходит к черте декомпенсированной. Это вклад предсердия. И здесь очень важны: интервал PQ, сократительная функция самого предсердия (сейчас есть методы, которые оценивают эту сократительную функцию, они не инвазивные – эхокардиографические), частота сердечных сокращений (понятно, чем реже сердце бьется, тем лучше диастола) и активность симпатической нервной системы.
Таким образом, портрет типичного пациента с артериальной гипертензией и с диастолической сердечной недостаточностью – это пожилая женщина (чаще это женщина, хотя, конечно, это может быть и мужчина) с длительным анамнезом артериальной гипертензии, все-таки плохо леченой; с букетом другой патологии, который тоже вносит вклад в возможные процессы фиброзов в сердце таких пациентов: это сахарный диабет, это ишемическая болезнь сердца, это суправентрикулярное нарушение ритма, дисфункция почек, которую мы как раз определяем по скорости клубочковой фильтрации, и с фиброзом сосудов.
Ключевые различия есть, и мы их можем обнаружить уже на этапе знакомства с пациентом и на этапе его обследования. Глухие тоны сердца характерны для систолической сердечной недостаточности со сниженной фракцией выброса. При сохраненной фракции выброса тоны могут быть вполне приличные, и даже первый тон может быть сохранен.
Чаще всего мы слышим и в том и в другом случае ритм галопа, и как раз если мы говорим о систолической сердечной недостаточности, то она себя проявляет появлением протодиастолического ритма галопа – за счет S3, дополнительного тона, третьего тона. А, наконец, диастолическая сердечная недостаточность, где больший вклад предсердий, измученных высоким конечным диастолическим давлением в левом желудочке, – это S4.
Диастолическая сердечная недостаточность иногда быстро прогрессирует до оттека легких. И вот тоже удивительные данные. Дмитрий Александрович, я хочу с вами их обсудить. Оказывается (попалась мне такая статья), когда… Пациенты с отеком легких, совершенно клинически оправданный отек легких, поступают в отделение интенсивной терапии, и им всем измерили фракцию выброса левого желудочка. Потом купировали отек легких и опять измерили фракцию выброса левого желудочка. Так вот, никакой закономерности не было. Казалось бы, купировали отек легких – фракция выброса должна повыситься, или поступили с отеком легких – фракция выброса должна быть низкой. Были пациент с высокой фракцией выброса во время кульминации отека легких, и наоборот.
Как вы думаете, как нам, клиницистам, это оценивать, ведь мы так часто уповаем на этот параметр – фракцию выброса?
Профессор Затейщиков Д.А.: – Ну, как говорится, тем хуже для фракции выброса. На самом деле, уже давно многие говорят, что фракция выброса – это, так скажем, не очень хороший параметр. И, очевидно, с появлением новых неинвазивных методик – томографии, магнитно-резонансной томографии – мы получим в руки более точный способ оценки. И, возможно, то, что мы сегодня принимаем за эту самую диастолическую дисфункцию, частично перейдет все-таки в другой разряд, в разряд систолической. Трудно сказать.
Но в любом случае, на мой взгляд, это еще раз показывает, что это не единственный параметр: систола – не только систола, но и что-то еще.
Профессор Драпкина О.М.: – И все-таки клиника, клиническая картина – это то, что должно определять в основном наше отношение к этому больному и к его прогнозу.
Вернемся к слайдам. Таким образом, споры есть, они не закончены. Один это синдром, в котором спровоцированная диастола является как бы предтечей сниженной фракции выброса, или это два синдрома? Есть и сторонники, есть и противники различных теорий. Честно говоря, я стою на позиции того, что это все-таки два разных синдрома. Потому что даже портрет этих сердец, который мы видим при патологоанатомическом вскрытии, он настолько разный, что возникает сразу вопрос, как можно такие разные сердца лечить одинаковыми подходами? Ну, это вопрос, наверное, пока вечный, ответа на него нет.
Тем не менее мы таких пациентов должны лечить, мы должны диагностировать сердечную недостаточность с сохраненной фракцией выброса. На помощь, как всегда, приходят алгоритмы.
Алгоритм Европейского общества кардиологов тоже во главу угла ставит клиническую картину хронической сердечной недостаточности. Но переведя на рельсы нашей ежедневной практики, это тучная пациентка, которая пришла с одышкой. Затем нормальная или лишь незначительно сниженная систолическая функция. Опять переводим на наши реалии, это женщина, пришедшая с одышкой, нами прослушанная, осмотренная, мы видим, что она тучная, мы видим, что есть мелкопузырчатые хрипы в легких.
Мы ее отправляем для уточнения диагноза на эхокардиографическое исследование и с удивлением видим, что фракция выброса нормальная. Это не повод отправлять эту пациентку к пульмонологу, это повод сделать такой пациентке как минимум тест шестиминутной ходьбы. И мы увидим, что она может пройти не те 450 метров, которые не относят ее к пациентке с сердечной недостаточностью.
Затем, действительно, большое внимание уделяется биомаркерам хронической сердечной недостаточности, в частности натрийуретическому пептиду и его концевому фрагменту. Если он больше 220 и у нас имеются доплеровские признаки, то есть мы делаем обычное доплеровское исследование и видим при оценке потоков, что отношение E к A меньше 0,5, или всего лишь левое предсердие большое, или у пациента есть фибрилляция предсердий, – то мы можем сказать, что перед нами пациент с диастолической сердечной недостаточностью.
Но, на самом деле, трудностей больше, чем каких-то обоснованных фактов, поскольку ни один из эхо-кардиографических критериев не обладает сегодня достаточной точностью. Мы говорим, что тканевой доплер – очень хорош, и вот это отношение E/E’ – наиболее хорошо, но тоже не идеально характеризует диастолу. Малодоступно провести (как раз то, о чем мы сейчас говорили) МРТ и различные инвазивные исследования гемодинамики. Ну и, на мой взгляд, не определены точные пороговые значения различных биологических маркеров сердечной недостаточности.
Отсюда возникает вопрос: может быть, нам стоит поискать возможные механизмы развития диастолы на периферии? Почему? Во-первых, при диастолической сердечной недостаточности возникают и определенные моменты жесткости аорты, а ведь аорта – это второе сердце, если она эластична. Если происходит повышение жесткости вообще сосудов, то вот эти отраженные волны (мы чуть ниже сейчас о них скажем), которые собираются на периферии, идут к центру, к сердцу. Идут они, получается, как раз в момент систолы, приходят чуть позже, чем должны были прийти, и сталкиваются с вновь формирующейся пульсовой волной.
Опять вопрос: на периферии ли начинается диастолическая сердечная недостаточность? Мы знаем, что сосуды при артериальной гипертензии – и виновники, и жертва. Потому что само высокое давление действует на сосуды, и в то же время жесткость сосудов, по другим причинам спазм может привести к высокому артериальному давлению.
Если говорить об основных механизмах, то, наверное, основным механизмом, который виновен в развитии диастолической сердечной недостаточности, служит как раз повышение преднагрузки ввиду жесткости периферических сосудов. Увеличивается, как я уже сказала, скорость распространение пульсовых волн, повышается преднагрузка на левый желудочек и повышается центральное пульсовое давление. Вот сейчас центральному пульсовому давлению, или давлению в аорте, и вариабельности давления как раз отдают наибольшее значение в прогнозе гипертоников.
Как это происходит? Представим наши сосуды. В принципе, это трубки. Они эластичные. И если они эластичные, как показано на первом рисунке, на выброс потока крови – большого потока крови, поскольку кровь распространяется с высокой скоростью… Эластичный сосуд как бы демпфирует эту волну, то есть он немножко расширяется, а потом приходит в норму, и мы видим такую схематичную пульсовую волну, которая показана под эластичной аортальной капиллярной трубкой.
Если сосуд жесткий, то он не может демпфировать волну, он не может немножко расслабиться и затем снова сократиться. И это приводит к так называемому феномену аугментации пульсовых волн.
Вот, уважаемые коллеги, мы можем на этой схеме рассмотреть этот феномен. Серой линией показана пульсовая волна, которая отражает выброс крови из левого желудочка в аорту. Пунктирной линией, которая смещена чуть вправо, изображена отраженная волна, которая идет уже от периферии, от наших сосудов, которые обладают демпфирующими способностями, к центру. И когда наслаиваются эти две волны друг на друга, происходит наличие волны типа «С», или пульсовая волна типа «С», которой характеризуются все здоровые люди.
Сейчас стрелками будет показано то, что происходит у гипертоников, что происходит при жесткой аорте. Итак, этот график смещается влево, этот график смещается вверх, и происходит формирование так называемой волны типа «А» или «В», которая характеризует увеличение преднагрузки на миокард левого желудочка, и снижение диастолического артериального давления.
Таким образом, анализ этой проблематики, на мой взгляд, дает возможность дать схему в помощь практикующему врачу. Повышение жесткости сосудов приводит к повышению центрального систолического давления в аорте и снижению диастолического, отсюда пульсовое давление – увеличивается. Повышенное систолическое давление в аорте приводит к повышению преднагрузки на левый желудочек. Гипертрофия и сама преднагрузка на левый желудочек и нарушение релаксации приводят к субэндокардиальной ишемии. Низкое диастолическое давление в аорте приводит к снижению коронарной перфузии, поскольку коронарная артерия наполняется именно во время диастолы. Вот это диастолическое давление не очень низкое тоже важно. Исследование аорты подтвердило, что снижать диастолическое давление ниже 70 для сердечнососудистых катастроф плохо. Присоединяющийся миокардиальный фиброз приводит к диастолической дисфункции.
Мы решили провести пилотное исследование, для того чтобы: оценить степень повреждения эндотелия и сосудов разного калибра у пациентов с диастолической сердечной недостаточностью; сравнить различные методы оценки эндотелиальной функции – фотоплетизмографический и с помощью АнгиоСкана; и посмотреть, что же происходит на фоне терапии, основанной на разных классах препаратов – ингибиторов АПФ и блокаторов кальциевых каналов.
Не забыли мы обратить внимание и на биологические маркеры. Наряду с хорошо известным N-концевым прогормоном мозгового натрийуретического пептида мы посмотрели у пациентов с диастолической сердечной недостаточностью и уровень галектина-3. Это маркер, или такой биологический субстрат, который в большей степени отвечает за фиброз – всего: печени, сосудов, сердца и так далее.
Представлен дизайн исследования. Пациенты – высокого риска с сохраненной фракцией выброса. Всеми возможными методами мы анализируем эндотелиальную функцию, рандомизируем пациентов на группу лечения на основе блокаторов кальциевых каналов и на основе ингибиторов АПФ (в качестве ингибитора был выбран амприлан). Наблюдаем пациентов в течение 3-5 недель в стационаре и затем повторяем те же самые исследования.
Уважаемые коллеги, я не буду останавливаться на общих характеристиках групп пациентов, лишь скажу, что они были сопоставимые по возрасту, по индексу массы тела, по различным клиническим характеристикам.
Первый день исследования, или старт исследования, был для нас крайне важен, поскольку мы определяли все те показатели, которые можно посмотреть при контурном анализе пульсовой волны: и продолжительность систолы, и возраст сосудистой стенки, и индекс аугментации, индекс жесткости. Кроме того, в этот же день мы делали окклюзионную пробу, как бы подтверждали друг другом – и фотоплетизмографическим методом и по данным УЗИ.
Конечно, выполнение вот этого показало нам, что с помощью УЗИ смотреть эндотелиальную функцию и окклюзионную пробу крайне сложно: пять минут сидеть в определенном положении, на пять минут пережать артерию, 300 мм ртутного столба накачать… Поэтому, конечно, фотоплетизмографический метод, он нас покорил именно простотой.
Вот так приблизительно выглядела волна типа «С» при нормальных сосудах.
Результаты. Первый вывод, который мы сделали: у всех пациентов с диастолической сердечной недостаточностью есть изменения пульсовой волны. Регистрируются волны типа «В» и «А», которые характеризуются как раз высокой амплитудой и большим размахом между систолой и диастолой.
Результаты контурного анализа пульсовой волны до начала терапии. Мы видим, что они не различаются, наши пациенты, ни по индексу жесткости, ни по индексу отражения, ни по давлению в центральном сосуде.
Что оказалось на фоне терапии? Хорошо и то и другое. То есть чем ниже мы снижаем давление, тем лучше для сосуда нашего гипертоника. Но тем не менее на индекс жесткости чуть большее значение оказывал амприлан. И на давление в аорте тоже чуть большее значение оказывал амприлан.
Результаты пробы с реактивной гиперемией, это окклюзионная проба. Тоже мы видим, что и та и другая группа продемонстрировали хорошие результаты. Тем не менее несколько большее влияние ингибиторов АПФ на сосудистую стенку тоже было доказано в данном исследовании.
Средний уровень гормонов NT-proBNP составил 153, средний уровень галектина-3 – 0.98.
Оценка функции сосудов эндотелия происходила вот таким образом. Мы видим, что после окклюзионной пробы, которая длилась пять минут… нам бы хотелось увидеть прирост диаметра в плечевой артерии, а внизу как раз показано то, что происходит с пульсовыми волнами.
Мы нашли, что есть связь между уровнем NT-proBNP и очень многими параметрами, как то: тестом 6-тиминутной ходьбы, оценкой пациента по Шкале оценки клинического состояния, которую мы используем у пациентов с сердечной недостаточностью.
Не было выявлено корреляции между уровнем NT-proBNP и фракцией выброса левого желудочка и параметрами диастолической дисфункции.
Что касается галектина-3, то оказалось, что, один раз повысившись, галектин-3 уже не менялся. Что, в общем-то, согласуется с данными литературы. И поэтому мы предлагаем именно совместное применение галектина-3 и натрийуретического пептида, это в большей степени может быть оценено нами как прогноз течения заболевания.
Вот это комбинированное применение. В первой графе – значение, во второй графе – интерпретация. И риск неблагоприятного исхода, мы видим, наиболее высокий, когда есть высокий уровень галектина-3 и натрийуретических пептидов.
Ну и наконец, клинический пример. Пожилая пациентка, ей больше 60 лет. Мы видим, что ее сосуды жесткие. И индекс жесткости, и индекс реактивности, и индекс аугментации высоки. На фоне применения амприлана мы видим изменение пульсовой волны, это видно, так сказать, визуально. Кроме того, это, конечно, видно и по тем расчетным индексам, которые есть. Обратите внимание, индекс реактивности снизился с 24 практически до 8.9, и насколько снизилось центральное давление!
Это, естественно, нашло свое отражение в улучшении эндотелиальной функции. То есть прирост… верхняя картинка по сравнению с нижней картинкой… мы видим увеличение амплитуды пульсовых волн в 1.3 раза.
Таким образом, уважаемые коллеги, анализ данной проблемы дает возможность сделать пока такие предварительные выводы. Наверное, правомочно высказывание о том, что диастолическая сердечная недостаточность начинается с периферии, во всяком случае жесткость сосудов определенный вклад в изменение диастолы вносит.
Второй вывод: биологические маркеры хронической сердечной недостаточности опять достойны дальнейшего изучения, и новый маркер галектин-3 для прогноза пациентов с диастолической сердечной недостаточностью, наверное, будет очень многообещающим.
Ну и наконец, наше исследование продемонстрировало то, что снизьте давление чем-нибудь, снизьте до нормальных значений, до тех значений, которые нам дают рекомендации. Но все же применение ингибиторов АПФ, и в частности амприлана, в нашем исследовании позволяло говорить о лучшем влиянии на функцию эндотелия и о лучшем влиянии на функцию резистентности сосудов у пациентов с артериальной гипертензией и диастолической сердечной недостаточностью. Спасибо за внимание.
Вывод
Оптимальная разница между систолическим и диастолическим давлением 70
составляет 40 мм.рт.ст. Но, и небольшое отклонение на 10 единиц в большую или меньшую сторону тоже в пределах допустимого.
профилактика артериального давления
При изменении давления на 20 больше или меньше, и нормальном самочувствии, скорее всего, имело место неправильное измерение давления. Если же самочувствие действительно становится хуже, стоит немедленно обратиться к врачу.
В случае разницы между систолическим и диастолическим давлением
составляет шестьдесят и больше, это риск развития заболеваний сердца и сосудов. В этом случае необходимо постоянно консультироваться с врачом. Для записи к нашему специалисту оставьте заявку на сайте или позвоните по телефону.
Ишемия миокарда и нарушение диастолической функции левого желудочка
В последние годы внимание многих исследователей привлекает возможность изучения функции миокарда в фазу диастолы, т.е. диастолической функции миокарда левого желудочка.
Интерес к данной проблеме основан на том, что в целом ряде исследований продемонстрирована ведущая роль нарушения диастолической функции левого желудочка в развитии сердечной недостаточности при многих заболеваниях. Известно также, что некоторые нарушения ритма сопровождаются явлениями диастолической дисфункции. Все вышесказанное делает проблему изучения процесса расслабления левого желудочка весьма актуальной.
Накопленные на сегодня данные свидетельствуют о том, что диастолическое наполнение левого желудочка определяется многими факторами, среди которых наибольшее значение придают активному расслаблению миокарда левого желудочка в раннюю фазу диастолы, эластическим свойствам самого миокарда, в частности, степени его ригидности, давлению, которое создается в левом предсердии в момент его систолы, состоянию митрального клапана и связанных с ним подклапанных структур [1—4]. При различных заболеваниях сердца патологические изменения самого миокарда левого желудочка могут привести к нарушению диастолической функции левого желудочка.
Принято выделять следующие периоды диастолы:
период раннего диастолического наполнения левого желудочка, который состоит из фазы быстрого и медленного наполнения, и период позднего диастолического наполнения левого желудочка, совпадающий с систолой левого предсердия [8,13]. Объем кровотока через митральный клапан и его скорость во время раннего диастолического наполнения определяется активным энергозависимым расслаблением миокарда левого желудочка, жесткостью камеры [2,3] и уровнем давления в левом предсердии в начале диастолы левого желудочка [4,5]. Рядом исследований показано, что расслабление левого желудочка в раннюю диастолу представляет собой активный энергозависимый процесс, управляемый такими основными механизмами, как нагрузка сокращения, расслабления, неоднородность распределения нагрузки [2]. На период раннего диастолического наполнения левого желудочка влияют диастолическая деформация полости желудочка, а также внутрижелудочковое давление в момент открытия митрального клапана [1,2]. Совокупность действия перечисленных факторов создает так называемую присасывающую функцию левого желудочка, которая и определяет перемещение части объема крови из полости левого предсердия в полость левого желудочка. По окончании быстрого наполнения разница в давлении между левыми камерами снижается, наступает фаза медленного наполнения, во время которой градиент между предсердием и желудочком невелик, и кровоток из предсердия в желудочек небольшой. К моменту наступления систолы левого предсердия этот градиент начинает вновь возрастать, что проявляется в повторном ускорении кровотока через митральный клапан [5].
Во время систолы предсердия объем трансмитрального кровотока, поступающий в полость левого желудочка, зависит от давления в левом предсердии во время систолы, от ригидности стенок левого желудочка, конечного диастолического давления в полости желудочка. Дополнительным фактором, влияющим на процесс наполнения, следует считать также вязкость крови [1,2]. В норме объем и скорость кровотока через митральный клапан в период ранней диастолы значительно превышают эти показатели в период систолы предсердий.
Методические вопросы определения диастолической функции
В последние годы с внедрением в широкую практику допплер-кардиографии появилась возможность измерения скоростей трансмитрального кровотока в различные периоды диастолы неинвазивным путем.
Следует заметить, что допплерографическое исследование трансмитрального кровотока позволяет надежно верифицировать только фазу раннего быстрого диастолического наполнения и фазу систолы предсердия, поскольку волна L, отражающая медленное диастолическое наполнение, может быть выявлена на допплерограмме только в 25% случаев и к тому же очень вариабельна по величине и продолжительности [1].
При отсутствии нарушений диастолической функции левого желудочка у здоровых лиц молодого и среднего возраста пиковая скорость Е (Еmax) и площадь под кривой Е (интеграл скорости Е, обозначаемый Еi) превышают величину пиковой и интегральной скоростей А
(соответственно Аmax и Аi) [1,6—8]. По данным разных авторов, соотношение скоростей периодов раннего и позднего диастолического наполнения левого желудочка колеблется от 1,0 до 2,2 для интегралов скоростей и от 0,9 до 1,7 для пиковых скоростей. Измеряемое при одновременной записи митрального и аортального потоков время изометрического расслабления миокарда левого желудочка также в значительной мере зависит от возраста, наиболее часто оно составляет 74±26 мс [1,2].
В ряде работ показана также взаимосвязь между возрастанием вклада предсердной составляющей диастолического наполнения левого желудочка и возрастом обследуемых, что выражается уменьшением соотношений скоростей периодов раннего и позднего диастолического наполнения за счет возрастания скоростей периода предсердной систолы и уменьшения скоростей периода раннего диастолического наполнения. Следует также отметить, что данные по фазовому анализу диастолы в литературе неполны и неоднородны в терминологическом определении, что требует дальнейшего исследования этого вопроса.
На основании вышеизложенного можно сделать вывод, что в норме диастолическая функция левого желудочка определяется следующими наиболее существенными моментами:
диастолической деформацией левого желудочка, давлением в его полости к моменту открытия митрального клапана, ригидностью стенок левого желудочка, сохранностью структур митрального комплекса и реологическими свойствами самой крови.
Нарушение диастолической функции при ишемии миокарда
При наличии хронической ишемии миокарда возрастает жесткость или ригидность его стенок [4,6,9]. В частности, ряд исследователей убедительно показали наличие тесной корреляции между диастолическими свойствами сердца и максимальным потреблением кислорода миокардом в покое и при нагрузке.
На современном уровне разработки этого вопроса патогенетический механизм нарушения диастолического расслабления левого желудочка выглядит следующим образом:
недостаточное обеспечение миокарда кислородом приводит к возникновению дефицита макроэргических соединений, что в свою очередь приводит к замедлению процесса раннего диастолического расслабления левого желудочка.
Указанные изменения сказываются на процессе наполнения камеры желудочка в раннюю диастолу: вследствие более медленного, чем обычно, снижения давления в камере левого желудочка, момент, когда уровни давления между желудочком и предсердием сравниваются, достигается позже. Это приводит к увеличению продолжительности периода изометрического расслабления миокарда левого желудочка. После открытия митрального клапана градиент давления между желудочком и предсердием оказывается меньшим, чем в норме, и, следовательно, поток раннего диастолического наполнения уменьшается. Своеобразная компенсация обеспечивается в период систолы предсердия, когда объем крови, необходимый для адекватного наполнения левого желудочка, поступает во время активного сокращения камеры предсердия. Таким образом, предсердный вклад в формирование ударного объема камеры возрастает [1—4, 6, 8, 10]. Вышеуказанные гемодинамические изменения относят к раннему типу нарушения диастолы желудочка, при котором не происходит существенного повышения давления в камере левого предсердия, и, соответственно, изменений гемодинамики малого круга кровообращения и признаков застойной сердечной недостаточности при этом не наблюдается [2,11].
Значительно сложнее выглядит объяснение патогенетических моментов влияния ишемии у больных с нарушением диастолической функции по рестриктивному типу. Для формирования данного вида нарушения диастолы необходимы следующие основные моменты: высокое конечно-диастолическое давление в полости левого желудочка, формируемое значительной жесткостью его миокарда [2,11,12], высокое давление в полости левого предсердия [4,11,13], обеспечивающее адекватное наполнение желудочка в раннюю диастолу, снижение систолической функции левого предсердия. Большинство авторов в этой связи указывают на достаточно редкую встречаемость рестриктивного типа нарушения диастолы у больных ИБС [4 6], поскольку высокая жесткость миокарда чаще связана с его органическим поражением, например, при рестриктивной кардиомиопатии, инфильтративных кардиопатиях [7,8]. Для больных коронарной болезнью сердца характерно наличие очаговой патологии миокарда и формирование высокой его жесткости
в связи с длительной, хронической его ишемией и развитием фиброза.
Таким образом, на сегодняшний день достаточно очевидным является факт отрицательного влияния ишемии миокарда на процесс диастолического наполнения левого желудочка. Поэтому целесообразно коснуться также и вопросов диагностики нарушения диастолической функции у рассматриваемой категории больных.
Диагностика
Наряду с инвазивными методами исследования (вентрикулография) и радионуклидными методами (радионуклидная вентрикулография) все большее значение приобретает в последние годы допплер-кардиография
[8,11,12]. Общепринятым на сегодня является выделение 2 типов нарушения диастолической функции левого желудочка по данным допплер-кардиографии [8].
1-й тип
, при котором в результате нарушения ранней фазы диастолы желудочка уменьшаются скорость и объем кровотока через митральное отверстие в раннюю фазу диастолы (Епик) и увеличиваются объем и скорость кровотока в период предсердной систолы (Апик), при этом отмечается увеличение времени изометрического расслабления миокарда левого желудочка (ВИРМ) и удлинение времени замедления (ВЗ) потока Е.
2-й тип, обозначаемый как псевдонормальный
, или рестриктивный, который предполагает наличие значительной ригидности миокарда желудочка, что приводит к повышению диастолического давления в камере желудочка, а затем и в предсердии, причем давление в камере предсердия может значительно превышать давление в полости желудочка к моменту начала диастолы последнего, что обеспечивает наличие значительного градиента давления между камерами в начале диастолы; при этом меняется характер трансмитрального кровотока: увеличивается Епик и уменьшается Апик, укорачиваются и ранее указанные временные интервалы (ВИРМ и ВЗ).
Ряд авторов предлагают разделять нарушения диастолической функции левого желудочка на 3 типа: ранний, псевдонормальный и рестриктивный
. Так, Е.Braunwald [2] предлагает дифференцировать псевдонормальный тип нарушения от нормы и рестриктивного типа на основании продолжительности времени замедления пика Е раннего наполнения, который, как известно, укорачивается при псевдонормальном и рестриктивном типах нарушения диастолы. Правомерность такого подхода вызывает сомнения в свете наличия в литературе данных о существенном влиянии на продолжительность временных интервалов диастолы частоты сердечных сокращений в момент исследования.
Другие авторы указывают на возможность дифференциации между псевдонормальным типом нарушения и нормой с помощью оценки потоков в легочных венах. При псевдонормальном типе имеется повышение давления в левом предсердии, что сказывается на характере наполнения левого предсердия [11].
Роль и место цветной допплеровской М-модальной ЭхоКГ в дифференциальной диагностике между вышеуказанными типами наполнения левого желудочка на сегодняшний день не вполне ясны. Ряд авторов считает, что указанная методика помогает отличить псевдонормальный тип наполнения от рестриктивного и нормы [1,2], в то же время остается открытым вопрос о степени и характере влияния на точность измерений в этом режиме таких факторов, как частота сердечных сокращений, вязкость крови, состояние миокарда левого предсердия и др. Думается, что цветное допплеровское картирование в этой ситуации не имеет принципиальных преимуществ перед обычной допплерограммой, потому что при М-модальной развертке цветного допплеровского изображения также проводится измерение временных интервалов, описанных выше, а значит, сохраняется и влияние всех ранее указанных ограничивающих факторов.
Важной представляется возможность изучения сегментарной диастолической функции
при помощи метода допплеровской визуализации тканей с М-модальной разверткой [8,11]. Применение этого метода дает возможность оценить не только общее состояние диастолической функции, но и характер расслабления отдельных сегментов, что особенно важно при оценке влияния ишемии миокарда на эти параметры в покое и при проведении нагрузочных проб.
Клиническое значение диастолической дисфункции левого желудочка и возможности медикаментозного воздействия
ИБС является одной из самых частых причин возникновения диастолической дисфункции левого желудочка [1,4,6] вследствие нарушения раннего диастолического расслабления на фоне острой или хронической ишемии, повышения жесткости миокарда в месте постинфарктного рубца и формирования соединительной ткани на фоне хронической ишемии. Кроме того, повышение жесткости гипертрофированного интактного миокарда у больных ИБС может быть связано с ишемией на фоне коронарной недостаточности
вследствие стеноза артерии, кровоснабжающей этот участок миокарда, и в результате относительной коронарной недостаточности, которая часто имеет место при гипертрофии. Известно также, что диастолическая дисфункция может возникать и без нарушения систолической функции левого желудочка [2,14]. Но нарушение диастолической функции даже в изолированном виде приводит к существенному ухудшению центральной гемодинамики и может способствовать возникновению или прогрессированию существовавшей ранее систолической сердечной недостаточности [11,14].
Прогноз у больных ишемической болезнью сердца, у которых имеется диастолическая дисфункция, более неблагоприятный [1,2,14], что делает актуальной проблему ее медикаментозной коррекции.
Вопросам медикаментозной терапии нарушения диастолической функции у больных ИБС посвящено мало работ. Кроме того, на сегодняшний день нет ни одного крупного исследования по этому вопросу. В научной литературе за последние годы опубликованы в основном экспериментальные работы на животных, посвященные изучению влияния антиангинальных препаратов различных групп
, а также
ингибиторов АПФ (эналаприл – SOLVD – investigators)
на процесс диастолического расслабления миокарда [15,16,17,18]. По результатам этих исследований
наибольшая эффективность отмечена при применении антагонистов кальция, b-адреноблокаторов, ингибиторов АПФ
. Так, например, E.Omerovic и соавт. (1999) продемонстрировали положительный эффект селективного b1-блокатора
метопролола
на состояние систолической и диастолической функции левого желудочка при инфаркте миокарда.
Существуют и отдельные клинические работы, посвященные этому вопросу. A.Tsoukas и соавт. (1999), изучая влияние комбинированной терапии диуретиками и ингибиторами АПФ
на состояние центральной гемодинамики у больных с рестриктивным типом трансмитрального кровотока и сниженной фракцией выброса левого желудочка (<40%), отметили положительное влияние указанной комбинации препаратов у 25% пациентов.
Устранение диастолической дисфункции при наличии ишемии миокарда в значительной мере определяется адекватностью индивидуально подобранной антиангинальной терапии или хирургической реваскуляризацией миокарда [7,14,16].
С этой целью наиболее часто используют
антагонисты кальция (в частности амлодипин), b-адреноблокаторы, нитраты.
Интересными представляются также данные C. Stanescu и соавт. (опубликованы в материалах 21-го конгресса Европейской ассоциации кардиологов в 1999 г.) о частоте назначения различных групп препаратов у больных с сердечной недостаточностью различной этиологии (ИБС — 35%, ГБ — 24%, клапанные пороки сердца — 8%, кардиомиопатии — 3%, другие причины — 17%). Согласно данным этих авторов, из 1360 пациентов, госпитализированных по поводу сердечной недостаточности, в 38 % случаев была диагностирована диастолическая сердечная недостаточность. После эхокардиографического исследования частота назначения различных препаратов у этих больных была следующей: диуретики — 57%, антагонисты кальция — 44%, b-блокаторы — 31%, ингибиторы АПФ — 25%, сердечные гликозиды — 16%. В то время, как до эхокардиографического исследования и определения наличия диастолической формы сердечной недостаточности частота назначения вышеуказанных препаратов у этих больных была следующей: диуретики — 53%, антагонисты кальция — 16%, b-блокаторы — 10%, ингибиторы АПФ — 28%, сердечные гликозиды — 44%. Таким образом, после эхокардиографического исследования антагонисты кальция назначали в 3 раза чаще, а сердечные гликозиды — реже, чем до исследования.
В заключение целесообразно отметить, что проблема коррекции нарушений диастолической функции у коронарных больных далека от разрешения. Спорными остаются некоторые вопросы диагностики диастолической дисфункции, нет и единого мнения относительно медикаментозной терапии. Думается, многие аспекты данной проблемы будут разрешены при появлении результатов крупных исследований, посвященных влиянию терапии на состояние диастолической функции у коронарных больных.
Литература
1. Барац С.С., Закроева А.Г. Диастолическая дисфункция сердца по показателям трансмитрального кровотока и потока в легочных венах: дискуссионные вопросы патогенеза, терминологии и классификации. Кардиология 1998; 5: 69—76.
2. E. Braunwald ed., Heart disease, 5th Ed., W.B. Saunders company 1997.
3. Caash W.H., Apstein C-S., Levine H.J. et al. Diastolic properties of the left ventricle. In.- The LV-basic and clinical aspects. Ed. H.J.Levine. Boston. 1985; 143.
4. Choong C.Y. Left ventricle: diastolic function — its principles and evaluation.-Principles and practice of echocardiography. Ed. A.Weiman. Philadelphia. Lea and Febiger. 1994; 1721—9.
5. Bonow P.O., Frederick 1.М., Bacliarach S.J. et al. Atrial systole and left ventricular filling in Hypertrophic cardiomyopathy: effect of verapamil. Amer J Cardiology 1983; 51: 1386.
6. Бащинский С.Е., Осипов М.А. Диагностическая ценность изучения диастолической функции левого желудочка при проведении стресс-допплер-эхокардиографии у больных ишемической болезнью сердца. Кардиология 1991; 9: 28—31.
7. Bessen M., Gardin J-N. Evaluation of left ventricular diastolic function. Cardiol.Clinics 1990; 18: 315—32.
8. Feigenbaum H. Echocardiography.- 5th Edition.- Lea & Ebiger.-Philadelphia. 1994; 166—72,189—91.
9. Желнов В.В., Павлова И.Ф., Симонов В.И., Батищев А.А. Диастолическая функция левого желудочка у больных ишемической болезнью сердца. Кардиология 1993; 5: 12—4.
10. Добротворская Т.Е., Супрун Е.К., Шуков А.А. Влияние эналаприла на систолическую и диастолическую функцию левого желудочка при застойной сердечной недостаточности. Кардиология 1994; 12: 106—12.
11. Christopher P., Appleton M.D. Doppler assesement of left venricular diastolic function: the refinements continue. JACC 1993; 21(7): 1697—700.
12. Cecconi M.,Manfrin M., Zanoli R. et al. Doppler echocardiographic evaluation of left ventricular end-diastolic pressure in patients with coronary artery disease. J Am Soc Echocardiol 1996; 110: 241—50.
13. Castello D., Vaughn M., Dressler F.A. et al. Relation between pulmonary venous flow and pulmonary weige pressure: influence of cardiac output. Amer Heart J 1995; 130: P.127—31.
14. Vasan R.S., Benjamin E.J., Levy D. Congestive heart failure with normal left ventricular systolic function. Arch Intern Med. 1996: 156: 146—57.
15. Barbier Р., Tamborini G., Alioto G., Pepi M. Acute filling pattern changes of the failing left ventricle after captopril as related to ventricular structure. Cardiology 1996; 87: 153—60.
16. Goldstein S. Beta-blockers: insights into the mechanism of action in patients with left ventricular dysfunction. J Heart Failure. 1996: 13: 115.
17. Poultur H., Rousseau M.F., van Eyll C., et. al. Effects with long-term enalapril therapy on left ventricular diastolic properties in patients with depressed ejection fraction. SOLVD Investigators. Circulation 1993 Aug 88: 2 481-91
18. Sasaki M.,Oki T., Inchi A., Tabata T., et. al. Relationship between the angiotensin converting enzyme gene polymorphism and the effects of enalapril on left ventricular hypertrophy and impaired diastolic filling in essential hypertension: M-mode and pulsed Doppler echocardiographic studies. J Hypertens 1996 Dec 14: 12 1403-8
Эналаприл –
Эднит (торговое название)
(Gedeon Richter)
Амлодипин –
Амловас (торговое название)
(Unique Pharmaceutical Laboratories)
| Приложения к статье |
| Диастолическое наполнение левого желудочка определяется многими факторами, среди которых наибольшее значение придают активному расслаблению миокарда левого желудочка в раннюю фазу диастолы, эластическим свойствам самого миокарда, в частности, степени его ригидности, давлению, которое создается в левом предсердии в момент его систолы, состоянию митрального клапана и связанных с ним подклапанных структур |
| ИБС является одной из самых частых причин возникновения диастолической дисфункции левого желудочка вследствие нарушения раннего диастолического расслабления на фоне острой или хронической ишемии, повышения жесткости миокарда в месте постинфарктного рубца и формирования соединительной ткани на фоне хронической ишемии |
| У больных ишемической болезнью сердца, у которых имеется диастолическая дисфункция, прогноз более неблагоприятный, что делает актуальной проблему ее медикаментозной коррекции |
Перикардит — симптомы и лечение
Первая немедикаментозная рекомендация для пациентов — ограничить физическую активность до обычного сидячего образа жизни, пока не исчезнут симптомы и не нормализуется уровень СРБ. Зачастую это происходит за несколько дней [9][10].
Медикаментозная терапия
Противовоспалительная терапия — ведущий метод лечения острого перикардита. Применяется ацетилсалициловая кислота (АСК), Ибупрофен и Колхицин. Они признаны основными препаратами для лечения острого перикардита, не связанного со специфическими инфекциями, например туберкулёзом. Предпочтительным препаратом считается АСК. При её непереносимости принимают Ибупрофен.
Для лечения рецидивирующего перикардита также используются НПВП. Кроме Ибупрофена, применяют противовоспалительный препарат Индометацин. Дозировку лекарств и продолжительность приёма определяет лечащий врач.
НПВП увеличивают риск развития желудочно-кишечных кровотечений, поэтому, начиная с первых часов лечения острого перикардита, обязательно принимают лекарства, защищающие желудок от эрозий и язв.
Колхицин рекомендуется пациентам с острым перикардитом в дополнение к АСК или другим НПВП. Препарат повышает эффективность медикаментозной терапии и снижает риск рецидива. Курс длится, пока симптомы полностью не исчезнут и СРБ не опустится ниже 3,0 г/л (как правило, не менее шести месяцев). Длительный приём Колхицина и его постепенная отмена позволяют снизить риск рецидива [9][10].
Глюкокортикостероиды (ГКС) применяют для лечения острого перикардита, если АСК и НПВП противопоказаны, недостаточно эффективны или по специфическим показаниям (например, при перикардите, вызванном аутоиммунными заболеваниями). ГКС, в частности Преднизолон в низких дозах, уменьшают риск развития рецидива, осложнений после лечения и других побочных эффектов.
Терапия ГКС быстро устраняет симптомы перикардита. Чтобы уменьшить риск рецидивов и тем более при рецидивирующем перикардите дозу ГКС снижают медленно. При рецидиве нужно приложить все усилия, чтобы не увеличивать дозу препарата или не возобновлять кортикостероидную терапию.
Приём ГКС часто вызывает стероидную зависимость, которая проявляется воспалением даже при небольшом снижении доз. К побочным эффектам ГКС относятся задержка жидкости, отёки и нарушение баланса электролитов.
Применение Азатиоприна в сочетании с ГКС наиболее эффективно при аутоиммунных причинах перикардита. К частым побочным явлениям относятся умеренное повышение аминотрансфераз, снижение уровня лейкоцитов и нарушение пищеварения [7][9][10].
Анакинра (антагонист рецепторов IL‑1) эффективен при рецидивирующем перикардите: препарат снижает риск рецидива в шесть раз, госпитализации в стационар — в семь раз, в блок интенсивной терапии — в 11 раз, а также значительно сокращает потребность в ГКС [10].
Внутривенное введение иммуноглобулина широко применяется при лечении аутоиммунных заболеваний. Препарат достаточно безопасен, но эффект от терапии непродолжителен, при перикардите он применяется редко.
Специфическое антимикробное лечение показано при гнойном перикардите. Это редкое заболевание опасно для жизни, но при адекватной терапии большинство пациентов выздоравливает. Внутривенная антимикробная терапия до получения результатов посевов назначается эмпирически, т. е. в зависимости от реакции организма на терапию. Чтобы предотвратить появление замкнутых «карманов» в полости перикарда (часто встречается при гнойном перикардите), необходимо своевременно дренировать полость перикарда.
Дренирование перикарда показано для лечения тампонады сердца [11].
На ранних стадиях перикардита проводится внутриперикардиальный тромболизис — это медикаментозная терапия, которая позволяет предотвратить развитие констриктивного перикардита.
Специфическое противовирусное лечение показано при подтверждённой вирусемии — состоянии, при котором вирусы попадают в кровоток и распространяются по всему телу. Особенно такая терапия важна при иммунодефиците [10].
Хирургическое лечение
Во многих случаях операция становится единственным подходящим методом лечения, но её проводят по строгим показаниям: если перикардит влияет на внутрисердечное кровообращение, при констриктивном перикардите и обызвествлении перикарда («панцирном» сердце).
Перикардэктомия (удаление перикарда) может быть рекомендована пациентам с хроническим рецидивирующим экссудативным перикардитом при одышке, боли в груди и невозможности бытовых нагрузок. Также её проводят при выраженной боли в груди, которая не ослабляется медикаментозной терапией.
После перикардэктомии внутрисердечное кровообращение восстанавливается у 60 % пациентов. Боль обычно значительно уменьшается, но может сохраниться остаточная боль в груди[3][10].
Риск летального исхода при операции составляет 10–20 %. Он особенно высок при застойной сердечной и почечной недостаточности, сахарном диабете, хронической обструктивной болезни лёгких, облучении грудной клетки и предшествующих операциях на сердце [10].
Диастола
А Wiggers диаграмма , показывающая различные события во время диастолы. Во время ранней желудочковой диастолы —
см. Вертикальную черту с надписью «Изоволюметрическая релаксация» — давление в каждом желудочке (голубая кривая) начинает быстро падать с высоты волны, достигнутой во время систолы. Когда желудочковое давление падает ниже предсердных камер, атриовентрикулярные (митральный и трикуспидальный) клапаны открываются, в результате чего объем крови (красный след) в предсердиях течет в желудочки. + В
поздней желудочковой диастоле
две предсердные камеры начинают сокращаться ( систола предсердий ), вызывая повышение артериального давления в обоих предсердиях и вынуждая дополнительный объем крови в желудочки. Это начало систолы предсердий известно как толчок предсердий — см. График «Желудочковый объем» (красный) прямо над зубцом P на графике электрокардиограммы (темно-синий).
Для здорового человеческого сердца весь сердечный цикл обычно длится менее одной секунды. То есть, для типичной частоты сердечных сокращений 75 ударов в минуту (ударов в минуту) цикл требует 0,3 секунды систолы (сокращения) желудочков — перекачки крови ко всем системам организма из двух желудочков; и 0,5 секунды в диастоле (дилатации), повторно заполняя четыре камеры сердца, в общей сложности 0,8 секунды для завершения цикла. [2]
Ранняя желудочковая диастола
Во время ранней желудочковой диастолы давление в двух желудочках начинает падать с пика, достигнутого во время систолы. Когда давление в левом желудочке падает ниже, чем в левом предсердии, митральный клапан открывается из-за отрицательного перепада давления (всасывания) между двумя камерами, в результате чего кровь в предсердии (накапливается во время предсердной диастолы) течет в желудочек (см. рисунок вверху). Точно так же одно и то же явление протекает одновременно в правом желудочке и правом предсердии через трехстворчатый клапан .
Поток наполнения желудочков (или поток из предсердий в желудочки) имеет ранний (E) диастолический компонент, вызванный всасыванием желудочков, а затем поздний, создаваемый систолой предсердий (A). Отношение E / A используется в качестве диагностической меры, поскольку его уменьшение указывает на возможную диастолическую дисфункцию . [3]
Поздняя желудочковая диастола
Ранняя диастола — это механизм всасывания между предсердной и желудочковой камерами. [4] Затем, в позднюю желудочковую диастолу, две предсердные камеры сокращаются (систола предсердий), вызывая повышение артериального давления в обоих предсердиях и заставляя дополнительный кровоток в желудочки. Это начало систолы предсердий известно как предсердный толчок —
см. Диаграмму Виггерса. Предсердный толчок
не
обеспечивает больший объем кровотока (во время сердечного цикла), так как около 80 процентов собранного объема крови попадает в желудочки во время периода активного всасывания. [5]
Предсердная диастола
В начале сердечного цикла все четыре камеры сердца, два предсердия и два желудочка синхронно приближаются к релаксации и расширению, или диастоле. Предсердия наполняются отдельными объемами крови, возвращающимися в правое предсердие (из полой вены ) и в левое предсердие (из легких). После того, как давление в камере и противодавление уравняются, митральный и трехстворчатый клапаны открываются, и возвращающаяся кровь течет через предсердия в желудочки. Когда желудочки полностью заполнены, предсердия начинают сокращаться (систола предсердий), заставляя кровь под давлением попадать в желудочки. Теперь желудочки начинают сокращаться, и по мере повышения давления внутри желудочков митральный и трикуспидальный клапаны закрываются.
Поскольку давление внутри желудочков продолжают расти, они превышают «обратное давление» в аорте ствола
и легочных артерий
ствола
. Открываются аортальный и легочный клапаны, и кровь выбрасывается из сердца. Изгнание вызывает падение давления в желудочках, и одновременно предсердия начинают наполняться (диастола предсердий). Наконец, давление внутри желудочков падает ниже обратного давления в стволах аорты и легочных артериях, и аортальный и легочный клапаны закрываются. Желудочки начинают расслабляться, митральный и трикуспидальный клапаны начинают открываться, и цикл начинается снова. [6]
Таким образом, когда желудочки находятся в систоле и сокращаются, предсердия расслаблены и собирают возвращающуюся кровь. Когда в поздней диастоле желудочки становятся полностью расширенными (что на изображениях обозначается как LVEDV и RVEDV), предсердия начинают сокращаться, перекачивая кровь в желудочки. Предсердия обеспечивают постоянный приток крови к желудочкам, тем самым служа резервуаром для желудочков и гарантируя, что эти насосы никогда не будут работать всухую. [7] Эта координация гарантирует, что кровь перекачивается и циркулирует эффективно по всему телу. [8]