Пельвиоперинеальный рефлюкс (ППР) — патологическое состояние, характеризующееся ретроградным кровотоком из внутритазовых вен в поверхностные вены промежности и нижних конечностей [1—3]. Его регистрируют у 25—62% пациенток с варикозной болезнью таза (ВБТ) [4—6]. Клиническим проявлением ППР служит варикозная трансформация вен наружных половых органов, промежности, заднемедиальной поверхности бедер. Инструментальная диагностика данной патологии основана на применении лучевых методов исследования, выбор которых служит предметом активных дискуссий среди исследователей [7—9]. Одни из них, помимо ультразвукового ангиосканирования (УЗАС) вен таза, рассматривают оварикографию и тазовую флебографию (ОГТФ) как обязательный компонент обследования больных с вульварным (ВВ) и промежностным варикозом (ПВ) вне зависимости от наличия симптомов тазового венозного полнокровия (ТВП) [3, 9—11]. Другие авторы [12—14], руководствуясь принципом разумной достаточности, утверждают, что для определения тактики лечения и выбора способа ликвидации ППР и варикозных вен промежности и вульвы (флебэктомия либо склерооблитерация) у больных ВБТ без признаков ТВП вполне достаточно выполнения УЗАС тазовых и промежностных вен.
Цель настоящего исследования — определение диагностической ценности и целесообразности выполнения ОГТФ у пациенток с ВБТ, ВВ и ПВ.
Коротко о методе диагностики
Контрастная флебография (венография, восходящая контрастная флебография или контрастная венография) — это рентгенологическое исследование глубоких или поверхностных вен с использованием контрастного вещества, которое обеспечивает изображение кровеносного сосуда. Флебография определяет проходимость глубоких вен, наличие тромбов, функцию клапанов и позволяет в целом оценить состояние глубоких вен.
Флебография может применяться, когда есть подозрение на тромбоз глубоких вен, а с помощью УЗИ диагностики невозможно точно его исключить. Исследование позволяет достоверно оценить состояние подвздошных вен у тучных пациентов, когда невозможно детально провести ультразвуковое сканирование.
Контрастная флебография чаще всего применяется либо в ходе эндоваскулярной операции на глубоких венах (ангиопластика или установка кава-фильтра). Ретроградную флебографию мы используем для оценки состоятельности венозных клапанов при планировании операции по поводу рефлюкса венозного оттока после венозного тромбоза.
Результаты
В обеих группах больных основным этиологическим фактором развития ВБТ, ВВ и ПВ, по данным анамнеза, служили беременность и роды. Именно во время беременности (первичной или повторной) у женщин возникли ВВ и ПВ, а после родов — тазовые боли. Количество беременностей и родов в группах статистически не различалось и находилось в пределах 1—3. В табл. 1 представлена
Таблица 1. Клиническая характеристика больных 1-й и 2-й групп Примечание. Здесь и в табл. 2, 3: в скобках — процент. клиническая характеристика обследованных больных.
Ультразвуковые исследования.
В 1-й группе у 10 пациенток выявлена клапанная недостаточность левой гонадной вены, у 2 — двустороннее поражение гонадных вен, у 1 — клапанная недостаточность внутренних подвздошных вен (ВПВ). При УЗАС внутритазовых вен не пытались оценить состояние париетальных притоков ВПВ (запирательная, внутренняя срамная и нижняя ягодичная вены), так как, во-первых, их визуализация связана со значительными временными затратами, во-вторых, ультразвуковое исследование представляется малоинформативным способом оценки клапанного аппарата притоков ВПВ и, в-третьих, всем больным планировали выполнение рентгеноконтрастной флебографии, которая до настоящего времени считается наиболее точным методом изучения внутритазовых вен, в том числе притоков внутренних подвздошных вен. Патологии магистральных поверхностных вен нижних конечностей не обнаружено ни в одном наблюдении (табл. 2).
Таблица 2. Результаты УЗАС вен таза, промежности и нижних конечностей у пациенток 1-й и 2-й групп
ППР в 1-й группе обнаружен у 16,6% пациенток, во 2-й — у 100%.
Флебографические исследования.
Каких-либо осложнений в ходе выполнения флебографии и после нее не зарегистрировано. Продолжительность диагностической процедуры составила 20—30 мин.
1-я группа.
Клапанная недостаточность гонадных вен выявлена у 100% больных: у 10 (83,3%) диагностировано левостороннее поражение, у 2 (16,6%) — правостороннее. Ни в одном из случаев по данным флебографии не установлено анатомической связи между яичниковыми и поверхностными венами промежности либо нижних конечностей (рис. 1).
Рис. 1. Флебограммы. а — клапанная недостаточность левой гонадной вены (1); б — клапанная недостаточность гроздьевидного венозного сплетения (2), параметральных (3) и маточных (4) вен (указано стрелками).
Ретроградное контрастирование параметральных вен обнаружено у всех пациенток, маточных вен — у 8 (66,6%). Рефлюкс контрастного вещества по стволу левой ВПВ зарегистрирован у 2 (16,6%) женщин, по левой запирательной вене — у 2 (16,6%) (рис. 2).
Рис. 2. Тазовая флебограмма. Рефлюкс контрастного вещества по левой внутренней подвздошной (1) и левой запирательной (2) венам (указано стрелками).
Следует заметить, что визуализация этого париетального притока получена у одной женщины с клапанной недостаточностью левой ВПВ и у одной без таковой. У остальных пациенток даже селективная катетеризация притоков ВПВ не сопровождалась визуализацией ППР, т. е. не было зарегистрировано рефлюкса контрастного вещества из притоков внутренних в поверхностные вены промежности, включая 2 пациенток с ВВ.
В одном случае выявлен уретероовариальный конфликт, когда правый мочеточник был сдавлен правой гонадной веной, что сопровождалось нарушением пассажа мочи и пиелоэктазией (рис. 3).
Рис. 3. Оварикограмма. Правый мочеточник (1) и правая гонадная вена (2), правосторонняя пиелоэктазия (3) (указано стрелками).
Компрессия левой общей подвздошной вены правой общей подвздошной артерией (синдром Мея—Тернера) диагностирована у 2 пациенток (рис. 4).
Рис. 4. Тазовая флебограмма. Сдавление левой общей подвздошной вены правой общей подвздошной артерией (указано стрелкой).
Таким образом, результаты применения ОГТФ в группе больных ВБТ и ТВП доказали, что этот метод необходим для подтверждения диагноза, выявления особенностей анатомического строения гонадных и внутритазовых вен, тазовых артериовенозных и уретеровенозных конфликтов. Это имеет крайне важное значение для выбора метода лечения и очередности выполнения хирургических вмешательств.
2-я группа.
Клапанная недостаточность левой гонадной вены обнаружена у 15% пациенток. Анатомической связи между гонадными и поверхностными венами промежности и нижних конечностей не выявлено в одном из наблюдений. Рефлюкс контрастного вещества по параметральным венам диагностирован у 100% обследованных, по маточным венам — лишь у 10%. Ретроградное контрастирование ствола левой ВПВ зарегистрировано у 3 (15%) пациенток, левой запирательной вены — у 2 (10%), левой внутренней срамной — у 1 (5%) пациентки (рис. 5).
Рис. 5. Тазовая флебограмма. Катетеризация ствола левой внутренней подвздошной вены. Контрастирование внутренней срамной (1) и запирательной (2) вен (указано стрелками).
Следует заметить, что рефлюкс контрастного вещества по притокам ВПВ выявлен лишь в случае их селективной катетеризации. При введении контраста в ствол ВПВ слева и справа и выполнении пробы Вальсальвы с задержкой дыхания не менее чем на 5 с ретроградного поступления контраста в париетальные притоки ВПВ не обнаружено. Визуализация внутренней срамной и запирательной вен не показала дальнейшего распространения контрастного вещества в поверхностные вены промежности либо нижних конечностей, т. е. согласно результатам флебографии отсутствовала очевидная связь между внутритазовыми, вульварными и промежностными венами, а значит, отсутствовал непрерывный, постоянный ППР.
Артериовенозные и уретеровенозные конфликты в этой группе больных не выявлены.
Результаты ультразвуковых и флебографических исследований показали сопоставимые, практически идентичные результаты (табл. 3).
Таблица 3. Результаты ультразвуковых и рентгенологических методов исследования вен таза, промежности и нижних конечностей у пациенток 1-й и 2-й групп
Подготовка к диагностике
- В течение четырех часов перед исследованием нельзя есть, а пить можно только воду.
- Пациенты, у которых есть аллергия (в частности на йод) или уже была реакция на контраст, должны сообщить об этом врачу.
- Для успокоения пациента может быть назначено седативное средство.
- Вас могут попросить соблюдать определенные диетические ограничения перед исследованием, в зависимости от конкретной процедуры.
- Сообщите своему врачу о лекарствах, травах или добавках, которые вы принимаете. Вам может быть рекомендовано прекратить прием некоторых из этих препаратов перед исследованием.
Клиническое обследование
Наиболее простым и распространенным методом диагностики патологии венозной системы организма является клиническое обследование пациента. Проведенный осмотр и опрос грамотным специалистом (флебологом, сосудистым хирургом, ангиологом,), с достаточным клиническим опытом поможет заподозрить и диагностировать заболевания вен уже на ранних стадиях болезни, что значительно повысит шансы добиться наибольших успехов в лечении. Клиническое обследование предполагает анализ жалоб больного, грамотный сбор анамнеза и тщательный осмотр пациента.
Жалобами специфичными для заболеваний вен следует считать: боли и тяжесть в икроножных мышцах (носит тупой, ноющий характер, чаще беспокоят к вечеру или при длительных статических нагрузках: долгом нахождении в положении «сидя», «стоя»); быстрая утомляемость и онемение ног; периодические ночные судороги.
Объективными признаками хронической венозной недостаточности следует считать: появление телеангиэктазий (сосудистых звездочек, гемангиом); варикозное расширение подкожных вен; отеки нижних конечностей; трофические расстройства кожи (появление участков гиперпигментации, шелушение кожи на голенях, появление трофических язв, варикозной экземы, дерматита)
К сожалению данных только клинического обследования зачастую недостаточно для определения нозологического варианта заболеваний вен и определения тактики дальнейшего лечения. В таких случаях на помощь приходят многочисленные инструментальные методики обследования пациента.
Как проходит диагностика
Во время процедуры пациент лежит на специальном рентгеновском столе. Область, в которую будет вставлен катетер очищается (обычно это вена на руке, чтобы во время процедуры можно вводить любые необходимые лекарства). Иногда вводится местная анестезия.
Через катетер доставляется раствор контраста. Инъекция красителя вызывает ощущение тепла, которое может распространяться по телу. Контраст также может вызвать легкую тошноту. Около 18% пациентов испытывают дискомфорт от контрастного раствора. Чтобы заполнить глубокую венозную систему красителем, плотную ленту (или жгут) иногда накладывают вокруг лодыжки, или же конечности могут быть наклонены. Пациенту предлагается держать ногу неподвижно. Врач наблюдает за движением раствора через вену с помощью флюороскопа. В то же время делается серия снимков.
Когда исследование закончено, физиологический раствор вводится в тот же катетер, чтобы очистить вены от контраста, затем катетер удаляют, а на место инъекции накладывается повязка.
Особенности флебографии (по месторасположению исследуемых вен):
Венография нижней конечности: пациент позиционируется, опираясь на наклонный рентгеновский стол. Стол наклонен так, чтобы ноги были подняты либо опущены. Катетер вводится в выбранную ногу либо в руку. Процедура может занять от 30 до 45 минут.
Надпочечниковая флебография: пациент лежит на спине на рентгеновском столе. Катетер вводится в бедренную вену. Под руководством рентгеноскопической визуализации он тщательно ориентируется либо на почечные, либо надпочечные вены в брюшной полости. Процедура занимает около 1 часа.
Абдоминальная флебография: пациент лежит на спине на рентгеновском столе. Катетер вводится в бедренную артерию. Процедура занимает около 1 часа.
Обсуждение
Проведенное исследование показало на первый взгляд парадоксальные результаты. Во-первых, достаточно часто в сравнении с имеющимися данными литературы выявлены уретероовариальный конфликт и синдром Мея—Тернера [15, 16]. Это можно объяснить как случайным совпадением, так и конкретной выборкой больных, когда в течение 6 мес диагностированы эти три редко встречающиеся патологии. При этом у одной больной обнаружена правосторонняя компрессия мочеточника гонадной веной в сочетании со сдавлением левой общей подвздошной вены правой общей подвздошной артерией. Кроме того, следует учитывать особенность настоящего исследования, в котором сосудистый хирург и рентгеноангиохирург совместно и целенаправленно изучали состояние внутритазовых вен, избегая поверхностных суждений и трактовок. В повседневной практике зачастую такой кооперации нет.
Другой неожиданной находкой стало то, что ни в одном из 32 флебографических исследований не зарегистрировано очевидной связи между внутритазовыми и поверхностными венами промежности и нижних конечностей, несмотря на то что выполнялась селективная катетеризация притоков ВПВ. О чем это свидетельствует? Можно предположить, во-первых, что существует определенный контингент женщин, у которых беременность сопровождается расширением париетальных притоков ВПВ и рефлюксом крови по ним с формированием ВВ и ПВ. У них, вероятно, имеются наследственные и анатомические факторы (нарушение синтеза коллагена III, гипоплазия либо агенезия клапанов тазовых вен, латентные формы синдрома Мея—Тернера и ВБТ), способствующие варикозной трансформации вен таза, которые реализуются либо усугубляются во время беременности. Во-вторых, активное функционирование, «открытие» тазовых перфорантных вен можно рассматривать как компенсаторное явление, направленное на саморегуляцию венозного оттока из малого таза во время беременности. В последующем у большинства родивших женщин этот компенсаторный механизм подвергается обратному развитию, а у части женщин продолжает функционировать вследствие вышеуказанных причин, что и обусловливает сохранение варикозных вен промежности и наружных половых органов после родов. И наконец, третий возможный путь развития событий заключается в том, что после родов рефлюкс крови по притокам внутренних подвздошных вен исчезает, а варикозные вены промежности и вульвы сохраняются в связи с их значительным расширением и невозможностью обратного развития варикоза.
Наиболее вероятно предположение, что ретроградный кровоток из внутритазовых вен в промежностные и поверхностные вены нижних конечностей — это не постоянное явление у конкретной больной, а эпизод, возникший в результате воздействия фактора (чаще всего беременности) и повлекший расширение вульварных, перинеальных, ягодичных вен, который разрешается после устранения воздействующего фактора (роды). Вместе с тем нельзя полностью исключить существование постоянного ППР, коррекция которого предполагает использование эндоваскулярной окклюзии соединяющего сосуда. Возможно такие пациентки не попали в это исследование.
Полученные в исследовании результаты абсолютно противоположны данным зарубежных авторов [1, 5, 7], выявляющих ППР с помощью флебографии и выполняющих эндоваскулярную эмболизацию париетальных притоков ВПВ. Так, G. Asciutto и соавт. [5] обнаружили клапанную недостаточность ВПВ в 58% случаев, а рефлюкс контрастного вещества в паховую область и нижние конечности — в 62%. M. Greiner и G. Gilling-Smith [7] сообщают о выявлении клапанной недостаточности внутренней срамной вены у 26%, запирательной — у 12% больных ВБТ и с рецидивом варикозной болезни нижних конечностей (ВБНК). J. Lasry и соавт. [1] сообщили о рефлюксе контрастного вещества при флебографии по запирательной и внутренней срамной венам у 10% обследованных больных ТВП.
Этот диссонанс отчасти можно объяснить включением в исследования пациенток преимущественно с симптомами ТВП и рецидивом ВБНК, выполнением дистальной катетеризации и контрастирования запирательных либо внутренних срамных вен, что в свою очередь обеспечивает визуализацию прямой связи внутритазовых и поверхностных вен промежности. Кроме того, важна интерпретация полученных при тазовой флебографии данных. Например, в настоящем исследовании контрастирование запирательных вен не рассматривали как ППР. Напротив, в работе M. Greiner и G. Gilling-Smith [7] такая картина расценивалась именно как ППР, хотя на представленных в их публикации флебограммах нет изображений прямой связи притоков ВПВ с вульварными либо промежностными венами. В связи с этим, если трактовать визуализацию запирательных и внутренних срамных вен по данным тазовой флебографии, выполненной в этой работе, результаты не столь значительно разнятся с данными J. Lasry и соавт. [1] — 15,65% пациентов общей группы.
Сведения о состоянии вен таза и нижних конечностей по данным этих двух методик не совпадают лишь в оценке ВПВ и их притоков. УЗАС имеет преимущества в изучении вен промежности и нижних конечностей. Кроме того, следует учитывать значительное давление, под которым вводится контрастное вещество при флебографии, и прямую катетеризацию ветвей ВПВ. В этом отношении УЗАС более физиологично и приближено к естественным условиям функционирования тазовых вен. В работе A. Whiteley и соавт. [6] только на основании результатов трансвагинального ультразвукового исследования ППР выявлен у 25,6% больных с рецидивом ВБНК. Важно, что авторы не исследовали с помощью УЗАС состояние притоков ВПВ и судили о них по визуально обнаруженным варикозным венам промежности и нижних конечностей.
После диагностики
После флебографии необходимо наблюдение в клинике не меньше суток. В зависимости от процедуры может быть рекомендовано отдыхать в постели в течение определенного периода времени.
Пациенты должны пить большое количество жидкости, чтобы смыть оставшийся контрастный раствор из организма. Область в месте введения катетера возможно будет побаливать в течение нескольких дней. Если вы заметите отек, покраснение, боль или повышение температуры, сообщите об этом врачу. В большинстве случаев пациент может возобновить обычные действия на следующий день.
О месте, времени и выгодных преимуществах
В клинике для проведения исследования есть специально оборудованный кабинет. Новейший компьютерный томограф Siemens Somatom Definition AS соответствует самым последним требованиям медицинской науки.
Преимущества данного метода обследования не единичны, к ним относятся:
- Высокая информативность метода.
- Данные КТ флебографии отражают состояние ваших сосудов на текущий момент.
- Трехмерное изображение позволяет с максимальной точностью выяснить причину патологии и подобрать индивидуальный вариант лечения.
- КТ флебография не требует специальной подготовки пациента.
Возможные осложнения
Флебография может вызывать осложнения, такие как флебит, повреждение тканей и образование тромбоза глубоких вен в здоровой ноге. Осложнения встречаются довольно редко, но их надо учитывать при планировании лечения, чтобы риск исследования не превосходил риск заболевания, по поводу которого оно проводится.
Редкий побочный эффект (до 1% случаев) серьезная аллергическая реакция на контрастный краситель. Обычно она проявляется через 30 минут после инъекции красителя и требует медицинской помощи.
Возможные риски включают образование тромба в вене, кровотечение, повреждение кровеносных сосудов или инфекцию в месте введения катетера.
Некоторые люди могут испытывать аллергическую реакцию на контрастный краситель на основе йода. Это может вызывать такие симптомы, как тошнота, чихание, рвота, крапивница, а иногда и угрожающая жизни реакция, называемая анафилактическим шоком (особенно у пожилых пациентов с хроническим обезвоживанием или легкой почечной недостаточностью).
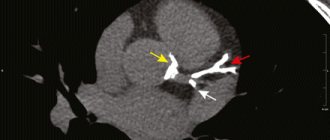
МР флебография головного мозга
Магнитно-резонансная флебография (МРФ) головного мозга
Введение
MРФ (MRV) означает магнитно-резонансная флебография. МРФ используется для оценки нарушений венозного оттока в сосудах головного мозга. Двумерная (2D) (TOF) МР флебография (MRV) и трехмерная (3D) фазово-контрастная ангиография (РС) это методики, обычно используемые для оценки состояния церебральных венозных синусов, поскольку просты в выполнении и не требуют контрастного усиления.
Времяпролетная ангиография (time-of-flight, TOF)
Это методика получения контрастности между неподвижными тканями и током крови, путем воздействия на величину намагниченности.
Величина намагниченности от движущихся спинов очень велика по сравнению с таковой от неподвижных спинов. Это приводит к образованию высокого сигнала от перемещения спинов крови и сниженного сигнала от неподвижных спинов тканей. Для работы с изображениями времяпролетная ангиография (TOF) использует продольный вектор намагниченности.
Фазово-контрастная ангиография (Phase-contrast, PC)
Это методика получения контрастности между неподвижными тканями и током крови, путем воздействия на величину намагниченности. Фаза намагниченности от неподвижных спинов равна нулю, и соответственно фаза намагниченности от движущихся спинов не равна нулю. Фаза является мерой того, насколько процесс намагничивания от времени отклоняется в поперечной плоскости до момента, пока не будет обнаружен. Для того чтобы уменьшить сигнал от стационарной ткани, используется биполярный градиентный импульс равный по величине и противоположный по значению.
Фазово-контрастная ангиография (PCA) использует вектора поперечной намагниченности. В фазе разностных изображений, сигнал линейно пропорционален скорости спинов. Быстро перемещающиеся спины вызывают больший сигнал и способствуют движению спинов в одном направлении, обозначены яркими сигналами и выглядят белыми на изображении, а спины, движущиеся в противоположном направлении, обозначены темными сигналами и выглядят черными соответственно. Фазово-контрастные методы чувствительны к диапазону скоростей, поэтому исследователь должен с осторожностью выбирать это значение. Чтобы выделить различные сосуды, при разных сканированиях могут быть применены различные значения скорости кодирования. Высокая скорость кодирования характерна для артерий (40-70 см/сек), в связи с быстрым артериальным притоком. Низкая скорость кодирования характерна для вен (10-20 см/сек), в связи с медленным венозным оттоком.
Методика фазово-контрастной ангиографии может быть использована для получения 2D или 3D изображений.
Показания для магнитно-резонансной флебографии (МРФ) сосудов головного мозга:
- Диагностика тромбоза;
- Опухоль венозного синуса твердой мозговой оболочки;
- Сонливость и спутанность сознания, сопровождающие головную боль
Противопоказания для магнитно-резонансной флебографии (МРФ) сосудов головного мозга:
- Любой электрический, магнитный или механический активированный имплантат (например, кардиостимулятор, биостимулятор инсулиновой помпы, нейростимулятор, кохлеарный имплант, и слуховые аппараты);
- Внутричерепные (интракраниальные) аневризмальные клипсы (кроме титановых);
- Беременность (в случае если риск превышает пользу);
- Наличие ферромагнитных хирургических зажимов или скоб;
- Наличие металлического инородного тела глазу;
- Наличие в организме металлического шрапнеля, пули.
Подготовка пациента к МР- флебографии сосудов головного мозга
- Перед процедурой сканирования необходимо получить письменное согласие пациента на проведение исследования;
- Попросить пациента вытащить все металлические предметы, включая ключи, мелочь, колешек, пластиковые карты с магнитными полосами, ювелирные изделия, слуховые аппараты и шпильки;
- При необходимости обеспечить сопровождающего, для пациентов страдающих клаустрофобией (например, родственника или сотрудника);
- Предложить пациенту беруши, или наушники с музыкой для дополнительного комфорта;
- Необходимо разъяснить пациенту суть процедуры и порядок ее проведения;
- Предупредить пациента сохранять спокойствие во время процедуры;
- Отметить вес пациента.
Положение при проведении МРФ сосудов головного мозга
- Лежа на спине головой вперед (по направлению к магниту);
- Расположите голову в головной катушке и иммобилизуйте ее подушками;
- Для дополнительного комфорта подложите под ноги пациента валики;
- Центр лазерного луча фокусируется над переносицей.
Рекомендуемые протоколы, параметры и планирование
Локалайзер
Первично при планировании последовательности должны быть выполнены снимки в 3 плоскостях. Выдержка снимков менее 25 сек, с получением Т1-взешенных изображений низкого разрешения.
Серия Т2 турбо спин-эхо, аксиальный срез
Планирование аксиальных срезов на сагиттальной плоскости; угловое расположение блока должно быть параллельно колену и валику мозолистого тела. Эти срезы должны полностью покрывать головной мозг от темени до уровня большого затылочного отверстия. Проверьте расположение блока на 2-х других плоскостях. Соответствующий угол должен быть получен в коронарной плоскости при наклонном положении головы (перпендикулярно линии, соединяющей третий желудочек и ствол головного мозга).
Параметры
| TR | TE | SLICE | FLIP | PHASE | MATRIX | FOV | GAP | NXA(AVRAGE) |
| 3000-4000 | 100-120 | 5мм | 130-150 | R˃L | 320X320 | 210-230 | 10% | 2 |
Времяпролетная ангиография 2D — time-of-flight (TOF) или фазово—контрастная ангиография 3D — phase-contrast (PC)
Планирование сагиттальных 3D или 2D – блоков на аксиальной плоскости; угловое расположение блока должно быть под углом 10° к срединной линии головного мозга. Проверьте расположение блока на коронарной плоскости и расположение блока под углом 10° к срединной линии головного мозга. Эти углы необходимо соблюсти, чтобы уменьшить на плоскости эффекты сатурации. Установите полосы насыщения в нижней части блока в сагиттальной и фронтальной плоскости, чтобы подавить сигналы артериальной пульсации. Эти срезы должны полностью покрывать головной мозг от одной до противоположной височной доли.
Параметры
3D phase-contrast (PC)
| TR | TE | FLIP | NXA | SLICE | MATRIX | FOV | PHASE | GAP | velocity |
| 68-75 | 8-9 | 15 | 2 | 1 мм | 256X256 | 280 | А˃Р | 20% | 10 |
velocity – скорость
2D time-of-flight (TOF)
| TR | TE | FLIP | NXA | SLICE | MATRIX | FOV | PHASE | GAP | MTC |
| 28-35 | 5-8 | 60 | 1 | 2 мм | 256X256 | 250 | А˃Р | -50% | ON |
MTC (Magnetization Transfer Contrast) – перенос намагниченности
Проекция максимальной интенсивности (MIP)
MIP является наиболее часто используемым методом обработки записи МР исследований сосудов. MIP позволяет реконструировать проекции 2D-изображения с помощью 3D-данных, используя алгоритм трассировки лучей, который создает изображение белых пикселей, в качестве сигналов максимальной интенсивности исследуемой области.
MIP is the most commonly used post processing technique in MRI vascular studies. MIP reconstructs a 2D projection image from 3D data by a ray tracing algorithm, which produces an image of white pixels representing the highest intensity signal in that location within the examined volume.
НАЖМИТЕ ПОСЛЕДОВАТЕЛЬНО НА ПУНКТЫ, ПРЕДСТАВЛЕННЫЕ НИЖЕ ДЛЯ ПРОВЕРКИ СКАНИРОВАНИЯ