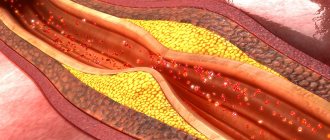
Основной причиной смерти населения развитых стран является инфаркта миокарда, к которому ведет атеросклероз коронарных артерий. Коронарный атеросклероз проявляется возникновением атеросклеротических бляшек – поражений стенки сосуда представляющих собой округлые выпуклые образования, наполненные сначала почти жидким холестерином в виде пенистой субстанции, а затем. постепенно рубцующиеся (зарастающие соединительной тканью) и накапливающие кальций.
Обнаружение кальция в коронарных артериях однозначно указывает на наличие атеросклеротического процесса и атеросклеротических бляшек, а количество этого кальция (коронарный кальциевый индекс или индекс Агатстона) на тяжесть атеросклеротического поражения.
Каким способом обнаруживают кальций в коронарных артериях?
Наличие и количество кальция в коронарных артериях можно определить при помощи компьютерной томографии сердца (КТ). Этот метод основан на последовательном выполнении рентгеновских снимков человеческого тела на разных уровнях, которые затем сводятся компьютером в целостную картину. Современные компьютерные томографы способны создать трехмерное изображение исследуемого органа, в том числе и сосудов.
КТ коронарных артерий для определения содержания кальция – неинвазивная методика (выполняется без проникновения во внутреннюю среду организма).
Изображение, полученное при КТ. Белые поля, обозначенные стрелками, это отложения кальция в коронарных артериях.
Материал и методы
Проведен анализ литературы в поисковых системах Pubmed, GoogleScholar, Scopus и РИНЦ cписком ключевых слов «coronary artery calcification», «coronary artery calcification score», «кальциноз коронарных артерий», «кальциевый индекс». В данный обзор включена 51 работа по исследованиям, проведенным с 1990 по 2021 г., в которых описывались использование различных шкал для оценки степени тяжести поражения коронарных артерий, а также исследования, в которых изучались результаты прямой реваскуляризации миокарда при кальцинозе коронарных артерий.
Патогенез кальциноза коронарных артерий
Долгое время считалось, что механизмы развития ККА представляют собой пассивный дегенеративный процесс и некую конечную стадию атеросклероза, что подтверждалось корреляцией степени кальциноза с возрастом пациента [5]. Современные исследователи склоняются к тому, что кальциноз артерий является активным процессом, в основе которого лежат механизмы, регулирующие обмен кальция, в частности механизмы роста и формирования костей [6]. Существует концепция, рассматривающая атеросклероз как хронический воспалительный процесс, индуцирующий остеогенную дифференцировку гладкомышечных клеток сосудов (ГМКС), которая приводит к ККА [7]. Не вызывает сомнений, что кальцификация бляшек начинается уже на стадии формирования липидных полос и только прогрессирует на всех остальных этапах атерогенеза. В настоящее время считается, что механизм кальциноза коронарных артерий аналогичен процессу формирования костной ткани.
Существует два признанных морфологических типа ККА: атеросклеротическая кальцификация с преимущественным поражением интимы и кальциноз медиального слоя артерий. При первом типе происходит индукция остеогенной дифференциации ГМКС медиаторами воспаления и липидами атеросклеротических бляшек [7]. Развитие событий по второму сценарию ассоциировано с преклонным возрастом, диабетом и хроническим заболеванием почек (ХЗП). Ранее считавшийся доброкачественным процессом, кальциноз медии способствует повышению артериальной жесткости, что увеличивает риск неблагоприятных сердечно-сосудистых событий [8]. Кальциноз коронарных артерий в том и другом варианте приводит к снижению эластичности стенки артерии, патологическим вазомоторным ответам и нарушению перфузии миокарда [9].
Известно, что бляшка, имеющая кальцинированную покрышку, намного более устойчива и резистентна к разрывам, чем «мягкая» бляшка и даже нормальная сосудистая стенка [10]. По-видимому, такой вывод применим только в случае гомогенной кальцификации. Согласно отдельным исследованиям, у пациентов при остром коронарном синдроме выявляются множественные мелкие включения кальция, называемые «пестрыми» или «пятнистыми», тогда как при хроническом течении ИБС определяются более крупные и равномерные кальцинаты [11]. Считается, что зона, образующаяся между кальцинированной покрышкой и некальцинированной сосудистой стенкой, является зоной потенциального разрыва [12]. При проведении ЧКВ высока вероятность развития диссекции именно в такой зоне; описано, что большие бляшки с явной «пятнистой» кальцификацией имеют тенденцию к разрыву [13].
В развитии кальциноза играют роль остеопонтин, остеопротегерин, RANKL, фетуин-А, костные морфогенетические белки. Все эти вещества вырабатываются в сосудистой стенке в процессе прогрессирования атеросклероза; доказано их участие в регуляции кальцификации бляшки. В ряде исследований выявлена связь уровня остеопонтина с уровнем коронарного кальция, измеренным с помощью мультиспиральной компьютерной томографии (МСКТ) [14]; предложено рассматривать остеопонтин как независимый фактор риска сердечно-сосудистых событий. Показано, что остеопонтин и костный морфогенетический белок 7-го типа определяют дифференциацию ГМКС в остеобластоподобные клетки и индуцируют процессы отложения кальция в стенке сосудов, а остеопротегерин играет ингибиторную роль в сосудистой кальцификации [15—17]. В норме между регуляторами кальцификации существует баланс, а ККА может развиваться при нарушении баланса в пользу индукторов. Точные механизмы этого процесса еще предстоит изучить.
Распространенность кальциноза коронарных артерий
Распространенность ККА зависит от возраста и пола. По данным большинства авторов, в возрастной категории старше 70 лет ККА встречается более чем у 90% мужчин и более чем у 67% женщин [18]. Высокий риск развития ККА отмечается у пациентов с высоким индексом массы тела, повышенным артериальным давлением, дислипидемией, гипергликемией, семейной предрасположенностью, ХЗП, высоким уровнем фибриногена и повышенным уровнем С-реактивного белка [19], т. е. при всех общепризнанных факторах рисках атеросклероза.
Диагностика
Компьютерная томография (КТ) является основой неинвазивной диагностики ККА; метод способен количественно оценивать кальциноз и обладает высокой чувствительностью и специфичностью. Мультиспиральная компьютерная томография (МСКТ) основана на измерении и компьютерной обработке разности ослабления рентгеновского излучения по плотности тканей. Для количественной оценки степени ККА используется расчетный показатель — кальциевый индекс (КИ). КИ коррелирует с тяжестью коронарного атеросклероза, наличием гемодинамически значимых стенозов коронарных артерий и риском развития коронарных осложнений [20]. Используется подсчет КИ по методике, предложенной в 1990 г. A. Agatston и соавт. [21]: КИ вычисляют путем умножения площади кальцинированного поражения коронарной артерии на условный фактор плотности. Фактор плотности вычисляют по пиковой плотности зоны кальциноза, выражаемой в единицах Хаунсфилда (G. Hounsfield) — HU. Он принимается за 1 ед. для кальцинатов плотностью 130—199 HU, за 2 ед. — для кальцинатов плотностью 200—299 HU, за 3 ед. — для кальцинатов плотностью 300—399 HU и за 4 ед. — для кальцинатов плотностью 400 HU и более. Так, например, при выявлении кальцината площадью 6 мм2 с пиковой плотностью 265 HU КИ составит 12 ед. (6×2), а для кальцината той же площади, но с пиковой плотностью 432 HU — уже 24 ед. (6×4). Суммарный К.И. вычисляется как сумма индексов, определенных на всех томографических срезах. Также предложены алгоритмы подсчета объемного КИ и подсчета массы фосфата кальция [22]. American College of Cardiology и American Heart Association (2010 г.) считают целесообразным неинвазивно измерять степень ККА для оценки риска сердечно-сосудистых заболеваний у бессимптомных пациентов с промежуточным риском (10-летний риск 10—20%); класс рекомендации IIa [23].
Показано, что по мере увеличения кальциевого индекса теряется чувствительность и повышается специфичность при прогнозировании ИБС [24]. Другими словами, при тяжелом кальцинозе коронарных артерий и очень высоком КИ детализировать топографию поражения и его степень становится сложно. Исходя из этого, Z. Qian и соавт. предложили отдельные методики оценки кальциноза атеросклеротических бляшек (lesion-specificscore) и коронарных артерий (vessel-specificscore) как дополнение к уже существующей шкале по Agatston. Использование lesion-specific and vessel-specific calcium score увеличивает чувствительность исследования (при 80% специфичности), что превосходит традиционный показатель шкалы Agatston при прогнозировании ИБС [25].
Коронарная ангиография обладает более низкой чувствительностью по сравнению с КТ-сканированием при определении ККА, но в то же время обладает высокой специфичностью. По данным ангиографии ККА оценивается с использованием следующих критериев: 1) оценка кальциноза целевого сосуда по 4-балльной шкале (0 — нет кальциноза, 1 — едва заметный кальциноз, 2 — легко визуализируемый, умеренный кальциноз и 3 — тяжелый кальциноз), 2) глубина кальциноза после введения контраста (поверхностный при кальцинозе ближе к просвету сосуда, глубокий — при кальцинозе ближе к адвентиции), 3) определяется ли ККА достоверно в двух и более ортогональных проекциях и 4) определяется ли ККА на участках, отличных от целевого сосуда [26].
Внутрисосудистое ультразвуковое исследование (ВСУЗИ) — более точный метод диагностики коронарных артерий, чем ангиография, с высокой чувствительностью (90—100%) и специфичностью (99—100%). Кальцинированная бляшка при ВСУЗИ представляет собой эхогенную тень с акустическим затемнением, а степень кальциноза может быть оценена несколькими показателями. В соответствии с диапазоном кальцифицированного поражения по ВСУЗИ выделяют 4 класса: класс 1 (угол кальцинированного поражения от 0 до 90°), класс 2 (угол ККА от 91 до 180°), класс 3 (угол ККА от 181 до 270°) и класс 4 (угол ККА от 271 до 360°). Расположение кальция определяется как поверхностное (присутствует в интимальном слое), глубокое (присутствует в медиально-адвентициальном слое) и смешанное. Кальциевые депозиты оцениваются в самой толстой атеросклеротической бляшке [27].
Оптическая когерентная томография (ОКТ) является оптическим аналогом внутрисосудистого ультразвука; она также обладает высокой чувствительностью и специфичностью для идентификации ККА. Различие в физическом принципе действия двух данных методов заключается в том, что при ОКТ для исследования биологических тканей используется не акустическая волна, а излучение инфракрасного света с длиной волны около 1300 нм. Однако разрешение ОКТ (до 10—20 мкм) примерно в 10 раз выше, чем у ВСУЗИ (до 100—150 мкм), что позволяет дифференцировать интиму, медию и адвентицию. H. Yabushita и соавт. [28] при анализе данных ОКТ описали специфические особенности каждого типа атеросклеротической бляшки: фиброзная бляшка характеризуется однородной областью высокого сигнала с низким затуханием, кальцинированная — хорошо очерченной областью с низким уровнем сигнала и четкими границами и богатая липидами бляшка — областью с низким сигналом и диффузными границами. Несмотря на высокое разрешение, у ОКТ есть ряд недостатков, которые могут создать проблему при измерении площади кальцификации и визуализации глубоких сосудистых структур. Так, максимальная глубина проникновения сигнала составляет 1—2 мм (у ВСУЗИ — до 4—8 мм), а абсорбция гемоглобином и рассеивание на эритроцитах ведут к сильному затиханию сигнала [29].
Таким образом, сегодня в распоряжении клиницистов есть диагностические инструменты, позволяющие оценить кальциноз коронарных артерий и качественно, и количественно. Однако надо признать, что удобные и неинвазивные методы пригодны в большей степени для скрининга коронарной болезни. Для детальной же оценки, включающей протяженность кальциноза, вовлечение дистальных сегментов артерии, требуются дорогостоящая инвазивная методика и, возможно, сопоставление ее данных с данными, полученными интраоперационно.
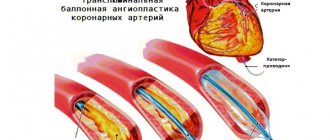
Чрескожное коронарное вмешательство
Коронарный кальциноз повышает вероятность развития осложнений ангиопластики и поэтому зачастую является причиной отказа от ее выполнения [30]. Давление, оказываемое на стенку сосуда при раздувании баллона, может оказаться неравномерным по причине различной степени выраженности кальциноза; это увеличивает риск диссекции, острой окклюзии сосуда, возможность последующего рестеноза и развития неблагоприятных сердечно-сосудистых событий [31]. Выраженный ККА создает сложности при доставке устройства, повышает риск эмболизации сосуда, что в свою очередь приводит к увеличению частоты перипроцедурного ИМ [32].
С внедрением голометаллических стентов (ГМС) ранняя и долгосрочная выживаемость улучшилась. Однако неполное раскрытие стента, асимметричное раскрытие, некорректная установка или смещение стента, наблюдавшиеся при выраженном ККА, повышали риск рестеноза и тромбоза стента [33].
Использование стентов с лекарственным покрытием (СЛП) оказалось более эффективным. Согласно результатам исследования TAXUS-IV, у пациентов с кальцинированными поражениями частота развития ишемии в бассейне целевого сосуда в течение 1 года была на 56% ниже при применении СЛП по сравнению с ГМС (5,1% против 11,9%, p
=0,09), однако у пациентов с некальцинированными коронарными артериями это различие оказалось существенно большим (на 75% ниже и 4,3% против 15,7%,
p
<0,0001) [3]. Аналогичные результаты описаны в метаанализе B. Zhang и соавт. (2015): применение СЛП значительно снижает необходимость повторных реваскуляризаций целевых сосудов по сравнению с ГМС у пациентов с ККА (8,5% против 16,0%; относительный риск: 0,50; 95% доверительный интервал: 0,38—0,65;
p
<0,00001) [34]. Однако существуют и исследования, сообщающие о сходных показателях тромбоза и рестеноза СЛП и ГМС у пациентов с ККА, с сопоставимыми показателями смертности и ИМ [2, 3].
Таким образом, при последовательном изучении результатов эндоваскулярного лечения больных ИБС с кальцинированными коронарными артериями показано, что наилучшие результаты получены при имплантации стентов с лекарственным покрытием. С другой стороны, проводилось сравнение результатов стентирования с таковыми у больных без кальциноза. Они свидетельствуют о более высокой частоте рестеноза и повторной реваскуляризации у пациентов с ККА [35].
Потенциальные факторы риска рестеноза и повторной реваскуляризации, такие как неполное раскрытие стента, повреждение лекарственного покрытия стента вследствие ККА, а также использование других устройств (в том числе ротационной атерэктомии), могут напрямую способствовать гиперплазии неоинтимы [36].
Режущие и надсекающие баллонные катетеры не удаляют кальций, а улучшают эластичность стенок артерий путем создания дискретных разрезов в атеросклеротической бляшке, что позволяет увеличить площадь работы на пораженных участках артерии и уменьшить сужение стента, предотвращая диссекцию сосудов. Показанием к режущему баллону является относительно короткое поражение (<20 мм). Для пролонгированных и циркулярных поражений использование таких баллонов не рекомендуется. Кроме того, давление в режущем баллоне не должно превышать 12 атм, чтобы избежать врезания лезвия баллона в стенку сосуда [37].
Ротационная атерэктомия в отличие от режущего баллона иссекает твердую ткань коронарного кальция с образованием мелких частиц (<10 мкм), не затрагивая мягкую эластичную ткань. Пациенты с ККА, подвергающиеся ротационной атерэктомии, имеют повышенный риск тромбоза, развития феномена «no-reflow» с увеличением риска перипроцедурного ИМ [38]. Однако применение ротационной атерэктомии признано клинически эффективным у пациентов с ККА [39]. В целях улучшения прогноза после воздействия рекомендуется имплантация СЛП. Существует ряд исследований, сообщающих о благоприятных долгосрочных результатах после имплантации СЛП с предшествующей ротационной атерэктомией [40].
Лазерная коронарная атерэктомия использует импульсную энергию эксимерного или гольмиевого лазера, генерирующую переходные волны высокой энергии; происходит фотоакустическое воздействие на резистентные атеросклеротические поражения. Несмотря на то что метод был введен более двух десятилетий назад, в силу его неопределенных результатов, а также ввиду появления СЛП лазерная ангиопластика потеряла практическое значение как самостоятельное вмешательство и ее использование ограничивается несколькими центрами. В некоторых исследованиях продемонстрированы потенциальные процедурные осложнения, такие как диссекция сосудов (особенно сосудов с поверхностным кальцием), перфорация, а также высокий риск рестеноза [41]. Тем не менее процедура может быть использована у пациентов с ККА с целью разрушения кальция перед имплантацией стента в случаях наличия риска неполного раскрытия стента [42].
Орбитальная атерэктомия, подобно ротационной, оказывает дифференциальное аблационное воздействие на твердые и мягкие поверхности, производя частицы размером <2 мкм при воздействии центробежной силы на стенку сосуда. Устройство позволяет операторам контролировать глубину аблации путем увеличения скорости вращения (от 60 000 до 120 000 об/мин). Как и ротационная, орбитальная атерэктомия улучшает эластичность стенок артерий для уменьшения процедурных осложнений и облегчения имплантации стента. Согласно данным, полученным J. Chambers и соавт., использование орбитальной атерэктомии при выраженном коронарном кальцинозе не только способствовало лучшей доставке стента, но также улучшало ранние и 30-дневные клинические исходы по сравнению с результатами ранее проведенных исследований у аналогичной когорты пациентов [43].
Таким образом, эволюция эндоваскулярной реваскуляризации и анализ ее результатов позволяют оптимистично смотреть на перспективы лечения больных с коронарной болезнью, однако изучение ближайших и отсроченных результатов показывает меньшую эффективность лечения в том случае, если коронарные артерии кальцинированы.
Операция коронарного шунтирования
Тот факт, что кальциноз коронарных артерий является предиктором худшего прогноза ЧКВ, заставляет клиницистов считать приоритетным методом лечения в этой ситуации хирургическую реваскуляризацию. Однако вопрос о прогностическом значении ККА для пациентов, перенесших КШ, остается неясным, и имеющиеся данные не позволяют сделать основательных выводов. Существует лишь несколько исследований, направленных на решение данного вопроса. Представляет интерес работа M. Castagna и соавт., высказавших суждение о более частом развитии кальцификации аутовенозных шунтов у пациентов с исходным кальцинозом нативных коронарных артерий [44].
В анализе K. Ertelt и соавт. сообщается о 755 пациентах с ОКС, которые были включены в исследование ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy Trial) со сроком наблюдения 1 год после проведенного КШ [45]. Авторами было обнаружено, что выраженное кальцинированное поражение КА являлось независимым предиктором основных неблагоприятных сердечно-сосудистых событий: при сравнении годичной смертности у пациентов с выраженным (n
=103), умеренным (
n
=249) и отсутствующим кальцинозом (
n
=403) она составила соответственно 11,8, 3,7 и 4,5%,
р
=0,006.
В аналогичное исследование C. Bourantas и соавт. (2015 г.) вошли 1545 пациентов (896 из реестра SYNTAX и 645 — из реестра SYNTAX CABG) для наблюдения в течение 5 лет после К.Ш. Сравнивались пациенты с выраженным кальцинозом (n
=548) и без выраженного кальциноза коронарных артерий (
n
=997). У пациентов с выраженным ККА наблюдалась более высокая смертность: 17,1% против 9,9%,
p
<0,001, однако частота неблагоприятных нефатальных сердечно-сосудистых событий в группах оказалась сходной (26,8% против 21,8%,
p
=0,057). Более высокая смертность в группе выраженного кальциноза частично была объяснена наличием более тяжелой сопутствующей патологии (почечная недостаточность, гипертония) и мультифокальным атеросклерозом [1]. Существенным ограничением исследования является тот факт, что характеристика кальциноза проводилась на основе ангиографических данных без использования МСКТ или ВСУЗИ.
Медикаментозное лечение
На сегодняшний день не существует общепринятого консервативного лечения ККА. Роль статинов в лечении пациентов с ККА не ясна. Согласно многочисленным исследованиям, терапия статинами не оказывает существенного влияния на ККА артерий [46]. Отдельные исследователи даже высказывают мнение, что статины способны усиливать процесс кальцификации [47]. Нерандомизированные исследования показывали регрессирование ККА при использовании блокаторов кальциевых каналов, гормональной терапии, а также препаратов, связывающих фосфаты [48, 49].
Отдельного упоминания в медикаментозной терапии заслуживает оценка влияния приема кальциевых добавок. На основании результатов крупного исследования EPIC-Heidelberg, в которое было включено 24 тыс. человек в возрасте от 35 до 64 лет, авторы утверждают, что употребление кальциевых добавок может достоверно увеличивать риск развития инфаркта миокарда [50]. По некоторым данным, риск инфаркта миокарда увеличивается при употреблении кальциевых добавок в дозе более 800 мг/сут [7]. Существуют и исследования, приведшие к противоположному выводу: употребление кальция в пищу не оказывает значительного влияния на кальциноз сосудов и сердечно-сосудистые события [51].
Когда назначается КТ сердца для исследования кальциевого индекса коронарных артерий?
Цель исследования – обнаружить наличие коронарного атеросклероза, определить его тяжесть и использовать полученные данные для прогноза течения заболевания. Таким образом, исследование назначается пациентам с подозрением на ишемическую болезнь сердца, даже в тех случаях, когда не имеется клинических симптомов. Наиболее актуально определение кальциевого индекса коронарных артерий лицам, имеющим факторы риска:
- высокие уровни холестерина крови,
- история сердечных приступов у близких родственников,
- диабет,
- высокое артериальное давление,
- курение,
- ожирение,
- малая физическая активность (гиподинамия).
Артефакты
1. При оценке данных индекса кальция нужно соблюдать осторожность, чтобы не включить обызвествления луковицы аорты у отверстий правой и левой венечных артерий. Обызвествления митрального клапана не должны приниматься за обызвествления ЛОА.
2. Артефакты от движений могут быть приемлемы при определении коронарного кальция, однако мешают при динамическом наблюдении, если требуется высокая воспроизводимость.
3. Шум в изображениях уменьшает точность выявления и количественной оценки коронарного кальция, а также снижает воспроизводимость таких измерений.
4. Артефакты, обусловленные пульсацией, можно использовать, чтобы определить движения структур сердца или крупных сосудов. Но пульсация является главной причиной неинформативных исследований венечных артерий.
5. Аритмия является главной причиной неоптимальных результатов при ЭЛКТ с проспективным запуском сканирования или при МКТ. Ретроспективная синхронизация может компенсировать изменения сердечного ритма, но экстрасистолы могут сопровождаться неполным или патологическим сокращением сердечной мышцы, что вызовет несинхронность с остальным массивом данных. Аритмия может быть причиной псевдостенозов венечных артерий или скрывать стенозы, которые иначе остались бы внутри сканируемого объема. Поэтому у таких пациентов не следует пытаться применять этот метод.
6. Артефакты, обусловленные дыхательными движениями, устраняются тренировкой и обучением пациента.
7. Артефакты, обусловленные высоким контрастом (полосовидные артефакты).
7. Личный объемный эффект.
8. Суперпозиция структур (трудности дифференцировки структур).
Как подготовиться к КТ коронарных артерий?
Никакой специальной подготовки к исследованию не требуется. Необходимо продолжить прием назначенных лекарств и избегать употребления кофе и курения в течение 4 часов перед исследованием.
На качество компьютерной томографии коронарных артерий могут повлиять ювелирные украшения (в том числе и для пирсинга), металлические заколки для волос, поэтому желательно оставить их дома. Обследуемого попросят так же снять слуховой аппарат и съемные зубные протезы.
Ишемическая болезнь сердца
У пациентов с хронической ишемией КТ позволяет выявить рубцы, истончение стенки желудочков, дискинетические сегменты стенки и аневризмы. Эти изменения могут быть обнаружены уже при обычной (не синхронизированной с ЭКГ) КТ, однако часто не оцениваются. Хотя были попытки исследования перфузии посредством КТ, направленные на определение жизнеспособности миокарда, для решения этой задачи в настоящее время более пригодны сцинтиграфия и МРТ [1, 5, 8].
КТ-морфология
Острый инфаркт ведет к ишемии, повреждению миокарда и, в конце концов, к образованию рубцов. При отсроченном сканировании (через 10–40 мин после введения контрастного средства) поврежденная ткань должна стать гиперденсивной вследствие повышенной задержки контрастного средства в интерстиции.
Образование субэндокардиальных рубцов можно оценить по кольцевидной зоне гиподенсивности в эндокардиальном слое желудочков. Субэндокардиальные, но чаще трансмуральные инфаркты ведут к локальному истончению стенки желудочков с регионарным нарушением движений стенки. В исходе могут образоваться аневризмы и тромбы.
Различные части миокарда можно отнести к определенным бассейнам коронарных сосудов, однако это недостаточно надежно в области основания сердца и зависит от того, к какой системе относится задняя нисходящая коронарная артерия (к правой коронарной артерии, левой коронарной артерии).
КТ-морфология аневризм сердца . Стенка истинных аневризм имеет вид выпячивания контура сердца, заметно локальное истончение, обнаруживается характерное парадоксальное движение в систоле. Изредка отмечается кольцевидное обызвествление в фиброзной стенке. Всегда имеется широкое сообщение с камерой сердца (шейка отсутствует).
Псевдоаневризмы сердца могут иметь шаровидную форму и шейку, которая меньше, чем истинный диаметр аневризмы. Они обычно располагаются по заднелатеральной и диафрагмальной стенкам левого желудочка. Благодаря задержке заполнения аневризмы интенсивность ее контрастирования может отличаться от интенсивности просвета желудочка.
Для визуализации тромбоза камер сердца предпочтительнее эхокардиография. КТ превосходит ее при выявлении тромбов в областях, трудных для доступа посредством трансторакальной ЭхоКГ.
Аортокоронарное венозное шунтирование
Аортокоронарное шунтирование посредством венозного трансплантата (АКВШ) обычно выполняется в средней трети восходящей аорты, хотя возможны также выше или ниже расположенные анастомозы (например, с брахиоцефальным стволом). Шунты левой венечной артерии прокладывают над легочным стволом.
Оценка трансплантатов внутренней грудной артерии с использованием левой или правой артерии затруднена вследствие множественных клипс, которые используют для окклюзии мелких боковых ветвей.
Роль КТ заключается в том, чтобы показать проходимость шунтов. Для этого не требуется синхронизация с ЭКГ. Оценка стенозов венозных трансплантатов при аортокоронарном шунтировании возможна, но очень трудна даже при использовании ЭЛКТ и многослойной КТ с синхронизацией.
КТ-морфология
Так как диаметр венозного шунта обычно равен 3–7 мм, АКВШ, как правило, визуализируется при КТ. Шунт не контрастируется при окклюзии, тогда как стенозированные шунты остаются полностью контрастируемыми. Стенозы чаще всего возникают в месте анастомозов. В стенке шунта со временем могут образовываться кальцификаты, не вызывающие окклюзии или стеноза. Узкая (шириной 1–5 мм) полоска мягкотканной плотности по ходу шунта означает хроническую окклюзию.
При шунтах с трансплантацией правой иди левой внутренних грудных артерий проходимость обычно обнаруживается, но просвет их очень маленький (1–4 мм). Надежно распознать стеноз пока еще невозможно.
Как проходит процедура КТ сердца для исследования кальциевого индекса коронарных артерий?
Во время исследования пациент лежит на спине на специальном столе. К его телу прикрепляются электроды для одновременной записи электрокардиограммы. Это необходимо для того, чтобы компьютерный томограф делал снимки только в промежутках между сокращениями сердца. после размещения пациента, стол быстро движется до достижения необходимого для начала исследования положения, а затем медленно перемещается позволяя аппарату делать снимки разных участков тела (в данном случае отделов сердца). Никаких ощущений КТ коронарных артерий не вызывает.
В процессе исследования пациента могут просить задерживать дыхание на 10-20 секунд.
Общая продолжительность исследования – около 10 минут. Врач-исследователь отсутствует в помещении во время исследования, однако всегда доступен для контакта через коммуникационное устройство.
Сколько стоит КТ коронарных артерий с определением кальциевого индекса?
Мы позвонили во все специализированные медицинские центры, выполняющие компьютерную томографию в Москве, которые показал Яндекс на первой странице поиска. В большинстве из них администраторы впервые слышали название метода. Однако мы нашли одну клинику, в которой КТ коронарных артерий с определение кальциевого индекса все же выполняют. Цена исследования от 3500 рублей (данные на ноябрь 2021 г.) Надеемся, что в ближайшем будущем исследование кальциевого индекса коронарных артерий станет доступно во всех центрах компьютерной томографии.
| В ближайшем будущем станет доступно точное определение риска сердечно-сосудистых катастроф путем простого анализа крови. |
Наш комментарий.
Исследование кальциевого коронарного индекса – важный инструмент, который позволяет уточнить риск сердечно-сосудистого заболевания и индивидуализировать лечебно-профилактические подходы. Целесообразно использовать данные кальциевого индекса вместе с определением риска по шкале SCORE.
Обсудить материал или задать вопросы на Facebook.
После процедуры
- Пациент может продолжать свою обычную жизнь и принимать привычную пищу
- Лечащий врач обсудит с пациентом результаты исследования.
Риски МСКТ
МСКТ — это процедура с низким риском. Иногда у пациентов бывают неблагоприятные реакции на контраст такие, как зуд или сыпь. Эти симптомы обычно проходят самостоятельно, без лечения. В некоторых случаях могут быть использованы антигистаминные препараты. Достаточно редко возникает тяжелая, опасная для жизни реакция – анафилактический шок, что требует экстренной помощи.
КТ-сканеры используют рентгеновские лучи. Для безопасности пациента доза радиации сведена к минимуму. Но при наличии беременности МСКТ не рекомендуется .