С момента внедрения операции аортокоронарного шунтирования (АКШ) медицина достигла больших успехов в лечении ишемической болезни сердца (ИБС). По мере накопления хирургического опыта стало очевидно, что кандидатами на хирургическое лечение становятся больные пожилого возраста с большим числом факторов риска, более тяжелыми формами ИБС, а также перенесшие ранее шунтирующие операции на сердце. Исследования показали, что приблизительно в 25% случаев диаметр коронарных сосудов недостаточен для эффективного шунтирования [1]. Более того, часть сосудов имеет диффузные атеросклеротические изменения, и они также не поддаются шунтированию. Не менее важной проблемой остается определение тактики лечения больных, подвергшихся множественным процедурам реваскуляризации миокарда. Вышеперечисленные проблемы заставили исследователей искать новые пути для адекватной реваскуляризации миокарда.
С началом активного внедрения прямых методов реваскуляризации миокарда не оставлялись попытки поиска новых методов непрямой реваскуляризации. Использование лазера для трансмиокардиальной лазерной реваскуляризации (ТМЛР) основано на особенностях миокардиального кровообращения. В ходе эволюции у млекопитающих и человека сохранились некоторые черты кровообращения рептилий и более примитивных существ. Кровоснабжение миокарда осуществляется не только посредством коронарных артерий (КА), но и через артериоламинарные каналы и миокардиальные синусоиды. Было также установлено, что в условиях стрессовых нагрузок происходит увеличение этих альтернативных путей [2].
Авторами разрабатывалась возможность поступления оксигенированной крови из полости левого желудочка в ишемизированный миокард с помощью создания искусственных трансмиокардиальных каналов методом акупунктуры [3, 4]. Использование лазера предоставило возможность избежать грубого механического воздействия на миокард при создании туннелей [5, 6].
Впервые об успешном клиническом применении трансмиокардиальной механической акупунктуры сообщил White в 1967 г. Работы S. Jacques 1969 г., посвященные использованию лазеров в сердечно-сосудистой хирургии, задали новый импульс исследованиям по данной тематике.
В 2000 г. К. Allen и соавт. сообщили о мультицентровом рандомизированном исследовании с использованием гольмиевого лазера, в котором также была показана безопасность и эффективность этих операций.
В мировой литературе, к сожалению, недостаточно исследований cочетанного проведения АКШ и ТМЛР, в которых трансмиокардиальная лазерная реваскуляризация была выполнена с помощью СО2-ла-зера, большинство представленных данных касается операций, в которых ТМЛР выполнялась с помощью гольмиевого лазера [7—9].
В данном исследовании мы оценили безопасность и эффективность трансмиокардиальной реваскуляризации в сочетании с аортокоронарным шунтированием у пациентов, не поддающихся полной реваскуляризации.
Материал и методы
В период с 2007 по 2013 г. на базе отделения кардиохирургии № 2 Ростовской областной клинической больницы (Ростов-на-Дону), выполнено более 5000 коронарных шунтирований, из них 60 пациентам выполнено АКШ в cочетании с ТМЛР. Информированное согласие было получено от каждого пациента. Критериями включения в исследование были диффузное поражение КА, атеросклеротическое изменение дистального русла или наличие мелких, неподходящих для шунтирования КА, сохранение в области операции жизнеспособного миокарда. Если имелась возможность прямой реваскуляризации хотя бы одной КА, выполняли АКШ, которое дополняли ТМЛР в тех зонах, которые не были доступны реваскуляризации. Критериями исключения были тяжелая хроническая обструктивная болезнь легких (объем форсированного выдоха за 1 с <55% от прогнозируемого значения); острый период инфаркта миокарда; тяжелые нарушения ритма; декомпенсированная сердечная недостаточность.
Исследуемую группу составили 52 мужчины и 8 женщин в возрасте от 46 лет до 81 года (средний возраст 65,9±7,3 года). Большинство больных (n
=44) имели стенокардию напряжения IV Ф.К. Общая сводная характеристика больных представлена в табл. 1.
Таблица 1. Общая характеристика больных Примечание. ФВ ЛЖ — фракция выброса левого желудочка, ИМ — инфаркт миокарда, ХСН — хроническая сердечная недостаточность.
Больным для объективизации состояния выполнялись коронароангиография, холтеровское мониторирование ЭКГ. Определение класса стенокардии проводилось согласно рекомендациям Канадского сердечно-сосудистого общества и модифицированного протокола Брюса. До хирургического лечения пациенты не в состоянии были выполнять нагрузочные пробы (тредмил-тест) из-за выраженной стенокардии. Для диагностики жизнеспособности миокарда проводили сцинтиграфию миокарда и ЭхоКГ. Все операции выполнялись стандартно: в условиях искусственного кровообращения и фармакохолодовой кардиоплегии раствором Кустодиол. Во всех случаях сначала выполнялось АКШ, затем ТМЛР — после наложения шунтов и восстановления кровотока в КА в условиях искусственного кровообращения (ИК). Во всех случаях лазерную реваскуляризацию выполняли с помощью отечественной ЭКГ-синхронизированной лазерной установки Перфокор. После расположения рукоятки манипулятора над поверхностью сердца подавали импульс, синхронизированный с ЭКГ пациента относительно зубца R. Пенетрация всей толщи миокарда при помощи 500 Вт СО2-лазера происходила за один импульс, что подтверждалось появлением пульсирующей струи крови из трансмиокардиального канала, а также данными чреспищеводной эхокардиографии в виде пузырьков газа в полости Л.Ж. При этом нарушений ритма не возникало, а кровотечение из канала останавливалось самостоятельно либо прижатием марлевым тупфером или салфеткой в течение 2 мин. В плевральную полость устанавливался активный дренаж, и грудную клетку ушивали по стандартной методике.
У всех пациентов оценивали показатели госпитальной, отдаленной и общей летальности, а также динамику таких клинических параметров, как ФК стенокардии, потребность в приеме нитроглицерина, толерантность к физическим нагрузкам, сократимость миокарда, ФВ ЛЖ, перфузия миокарда. Динамику качества жизни определяли по анкетам SF-36, при этом оценивали психоэмоциональное и физическое состояние больных в различные сроки после операции. Рассчитывали показатели выживаемости, свободы от возврата стенокардии и инфаркта миокарда в отдаленные сроки.
Пациенты находились под клиническим наблюдением в ближайшем послеоперационном периоде (в стационаре или 30 дней амбулаторно) и отдаленном периоде: через 3, 6 и 12 мес после операции и далее выборочно до 10 лет после операции (в среднем через 7,5±0,9 года). В каждом интервале у больных оценивались основные неблагоприятные сердечные события, класс стенокардии, ФВ ЛЖ и необходимость повторных реваскуляризаций.
В первые часы после операции проводился инвазивный контроль гемодинамики, мониторинг ЭКГ, газового состава крови, кислотно-щелочного состояния и биохимических показателей, включая ферменты-маркеры некроза миокарда. Анализ ЭКГ в первые часы после ТМЛР показал, что, несмотря на воздействие лазера на миокард, данных за повреждение миокарда или его ишемию не выявлено.
Основные техники восстановления кровообращения в сердце
Существует два варианта методик хирургической реваскуляризации миокарда. Первый подразумевает мини-инвазивное чрескожное коронарное вмешательство (ЧКВ), направленное на устранение основной причины нарушенного кровотока. Второй способ нацелен на создание дополнительных сосудистых соединений (шунтов) в обход пораженной зоны.
В случае с ЧКВ выполняют доступ непосредственно к венечным сосудам через введение тонкого катетера с проводником (диаметр до 6 мм) в бедренную или лучевую артерию. Контролируют перемещение провода с помощью рентгеновского метода визуализации с контрастным веществом.
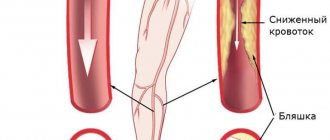
- Коронарная реваскуляризация миокарда с применением ангиопластики. При попадании в область стенозированного просвета тонкий катетер проводят через толщу атеросклеротической бляшки. В этот момент на конце электрода надувается специальный баллон под давлением до 20 атмосфер. Применение высокой силы расширяет просвет сосуда, после чего с баллона выпускается воздух, а катетер выводят.
- Стентирование подразумевает повторение предыдущей методики с одним отличием – на раздувающемся баллоне расположена цилиндрическая сетка – «стент» из специальных металлических сплавов, что препятствует тромбообразованию. После проведения баллонной ангиопластики развиваются рецидивы, частота которых снижается при использовании стентов.
Менее распространенные варианты внутрисосудистого вмешательства: лазерное выжигание или срезание атеросклеротической бляшки специальными инструментами.
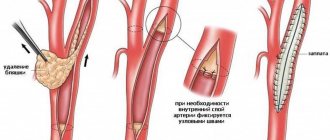
Второй вариант реваскуляризации подразумевает проведение открытой операции на сердце с применением аппарата искусственного кровообращения. В зависимости от используемого сосуда для создания «обходного» пути кровоснабжения различают такие варианты методики:
- аортокоронарное шунтирование (АКШ) – кровеносное русло пораженной венечной артерии соединяют с просветом аорты через дополнительный сосуд (чаще всего используют большую или малую подкожную вену нижней конечности);
- маммарокоронарное шунтирование – как источник кровоснабжения используют внутреннюю грудную артерию.
Результаты
Непосредственная летальность (в стационаре или в первые 30 дней) после совместного выполнения АКШ и ТМЛР составила 1,6% (1/60). Причина смерти вызвана полиорганной недостаточностью. По нашим данным, процент летальности оказался меньше по сравнению с данными, приведенными в литературе (1,6% против 6,3%).
Послеоперационные осложнения представлены в табл. 2.
Таблица 2. Послеоперационные осложнения (в стационаре или в течение 30 дней)
У 3 (5%) пациентов возникли нарушения ритма (фибрилляция предсердий), которые были купированы медикаментозно. Послеоперационный период у этих пациентов протекал без особенностей, и они выписались из стационара в установленные сроки.
Все пациенты были экстубированы в 1-е сутки после операции. Длительность пребывания пациентов в отделении реанимации составила 2,2±0,7 койко-дня. Применение внутриаортальной баллонной контрпульсации не потребовалось ни в одном случае. Общий срок госпитализации 11,1±2,9 койко-дня. Перед выпиской ФВ ЛЖ возросла с 48,8±4,97 до 54,9±4,08%.
Таким образом, анализ ближайшего послеоперационного периода показал, что ТМЛР достаточно безопасна для больного и не требует расширения стандартного объема интенсивной терапии в отделении реанимации.
Наблюдение в отдаленном периоде
Клиническое наблюдение пациентов в отдаленном периоде осуществлялось 3, 6 и 12 мес после операции и далее выборочно до 10 лет после операции (в среднем через 7,5±0,9 года). В каждом интервале больным проводилось клиническое и инструментальное обследование. Клинический статус пациента оценивался на основании динамики ФК стенокардии, тредмил-теста. Для контроля влияния на глобальную и сегментарную сократительную способность миокарда выполнялась трансторакальная эхокардиография.
Динамика ФК стенокардии у пациентов после совместного выполнения АКШ и ТМЛР представлена на рисунке.
Динамика функционального класса стенокардии до и после оперативного вмешательства.
Все пациенты поступали в клинику с исходно высоким ФК стенокардии. К 12-му месяцу после операции установлено резкое снижение ФК стенокардии. Эта тенденция была прослежена до 5 лет, далее отмечено некоторое увеличение ФК стенокардии, что потребовало увеличения приема нитратов.
У всех пациентов отмечено увеличение толерантности к физической нагрузке уже через 12 мес наблюдения.
В отдаленном периоде, в среднем через 7,5±0,9 года после оперативного лечения, 2 пациентам потребовалось лечение стенокардии (выполнена чрес-кожная транслюминальная коронарная ангиопластика), что связано с прогрессированием атеросклеротического процесса в венечных сосудах.
Выживаемость через 7,5±0,9 года составила 91,6% (n
=55).
Обсуждение
Трансмиокардиальная лазерная реваскуляризация получила одобрение для лечения пациентов с III и IV классами стенокардии в пяти кардиохирургических центрах США (госпиталь св. Луки в Милуоки, Нью-Йоркская пресвитерианская больница университета Колумбии и Корнелла, клиника Мейо, больница университета Дюка, Массачусетская больница), где проведены проспективные рандомизированные исследования. К выполнению первого этапа протокола был привлечен госпиталь св. Луки в Милуоки. Больные были подвергнуты комбинированной реваскуляризации миокарда — АКШ и лазерной реканализации с использованием гольмиевого лазера. Второй этап клинических испытаний предполагал использование ТМЛР в качестве как самостоятельной процедуры, так и в сочетании с АКШ. К этой работе были привлечены 4 других центра. После операции у больных оценивали частоту и интенсивность стенокардии, эпизоды нестабильной стенокардии, инфаркты миокарда и другие клинические показатели, такие как нагрузочные тесты, сцинтиграфия миокарда с таллием [10]. С учетом клинического успеха как изолированной ТМЛР, так и в сочетании с АКШ на VII ежегодной конференции кардиоторакальных хирургов в Барселоне (1993) ТМЛР получила окончательное признание как альтернативный метод реваскуляризации миокарда, третий после АКШ и чрескожной транслюминальной коронарной ангио-пластики. Общество торакальных хирургов США (STS) и Общество миниинвазивных хирургов (ISMICS) пришли к выводу, что очевидность эффекта применения сочетанных операций свидетельствует о правомочности их использования у данной тяжелой категории больных [11—13].
В 2000 г. результаты сочетанных операций у 20 больных, у которых ТМЛР выполнена с помощью гольмиевого лазера, представили G. Actis Dato и соавт. из кардиохирургического университета в Турине (Италия) [14]. В 2004 г. J. Van der Sloot и соавт. опубликовали рандомизированное исследование по применению XeCl-лазера [15]. В 2010 г. S. Pratali и соавт. опубликовали отдаленные результаты (до 12 лет) применения гольмиевого лазера [16]. Во всех этих работах показано временное (до 1 года) улучшение состояния больных с последующим возвратом стенокардии.
В России был проведен ряд исследований в научном центре сердечно-сосудистой хирургии им. А.Н. Ба-кулева, Новосибирском научно-исследовательском институте патологии кровообращения им. акад. Е.Н. Ме-шалкина [17] на тему хирургического лечения больных ИБС с помощью АКШ в сочетании с ТМЛР и без нее. Оценивали результаты применения СО2-лазера. Данные, полученные в обоих исследованиях, вполне сопоставимы с нашими: ФК стенокардии у пациентов после АКШ+ТМЛР достоверно снизился более чем на 2 класса во всех исследованиях. Также снизилась потребность в нитратах. В отдаленном периоде, до 10 лет, выявлено достоверное увеличение ФВ ЛЖ и улучшение качества жизни пациентов.
В мировой литературе оценке результатов совместного выполнения АКШ и ТМЛР уделено достаточно внимания, однако при этом авторы применяли разные лазеры: СО2-лазер, Ho: YAG, XeCl. Также в большинстве сообщений оценка результатов основана на малом количестве наблюдений. Это касается и систематических обзоров, и рандомизированных исследований, и метаанализов, и крупных нерандомизированных одноцентровых исследований. У каждой из таких работ имеются определенные недостатки. Например, в самых крупных из них [16—18] результаты сочетанных операций аортокоронарного шунтирования с трансмиокардиальной лазерной реваскуляризацией сравниваются с данными изолированного АКШ в группе больных с неосложненной ИБС без диффузного поражения КА либо подведены итоги в центрах, выполняющих небольшое количество операций.
O. Howard и соавт., применяя СО2-лазер, наблюдали уменьшение размера очага инфаркта миокарда, улучшение регионарной сократимости после ТМЛР. Они объясняют преимущества ТМЛР, которые были верифицированы гистологически. Эндокард, подвергшийся лазерной реваскуляризации у собак, также продемонстрировал сохранение функции миокарда во время острой ишемии, что было обусловлено улучшением перфузии через лазерные каналы.
Долгосрочные преимущества в отношении стенокардии и толерантности к физической нагрузке более сложно оценить после совместного выполнения АКШ и ТМЛР из-за сильного положительного влияния шунтирования. В нашем исследовании в отдаленном периоде состояние пациентов значительно улучшилось, ФК стенокардии снизился более чем на 2 класса у всех пациентов, увеличилась толерантность к физическим нагрузкам.
И все же механизм ТМЛР остается спорным, он может быть многофакторным. Убедительных теорий в настоящее время нет. Определенный вклад в улучшение состояния пациентов вносят функционирующие шунты. Клиническая эффективность ТМЛР требует дальнейших исследований.
Альтернативные методики хирургической реваскуляризации
Современная медицина располагает различными средствами минимально-инвазивной реваскуляризации. Они альтернативны по отношению к классическим хирургическим способам иссечения артерий (артериэктомия) – но отнюдь не являются методиками альтернативной медицины. Эти средства взяты на вооружение официальной медициной, которая сегодня уже практически не отдает предпочтений классическим средствам сосудистой хирургии.
Современные минимально-инвазивные средства принято называть эндоваскулярной хирургией. Ей и отданы предпочтения. Эндоваскулярная хирургия отвечает интересам пациентов: лечение менее болезненное, менее травматизирующее, послеоперационная реабилитация проходит быстрей. Вопрос лишь в том, располагает ли та или иная хирургическая клиника оборудованием для минимально-инвазивных эндоваскулярных операций и терапевтических действий, имеет ли ее персонал необходимый опыт.
Эндоваскулярные процедуры подразумевают применение сосудистых катетеров, подводимых по внутреннему просвету артерии не через внешний разрез, а через небольшие «проколы», выполняемые в местах наиболее мелкого залегания артерии (например, в паху). Насадки на катетерах позволяют не только цеплять тромб для его выведения наружу, но и расширять сосуд изнутри (баллонная дилятация), вживлять стент (сосудистый каркас, препятствующий его сужению).
Современная методика интервенционного тромболиза (химического разложения тромба) основана на катетерном введении разлагающих веществ, которыми обрабатывают тело тромба. При достаточно «удобном» положении места закупорки можно подавать вещества для тромболиза (стрептокиназа, урокиназа, препарат rt-PA) напрямую, в месте пунктирования артерии.
Тромбэктомия сразу же освобождает внутренний просвет артерии. Значит, сразу же восстанавливается и кровоток. Для химического разложения тромба требуется время. Поэтому тромболиз можно выполнять при неполной закупорке артерии. Или с одновременным шунтированием закупоренного участка (установлением временного обводного кровотока).