Отдышка, постоянная слабость, необъяснимые отёки, боли за грудиной – основание для кардиологического осмотра. Перечисленные явления могут указывать на опасность возникновения хронической сердечной недостаточности. Не стоит игнорировать первые лёгкие симптомы. Без соответствующей терапии состояние будет ухудшаться. В медицинских клиниках IMMA проводится терапевтический и кардиологический прием.
В наших клиниках вы можете:
- Получить консультацию врача — кардиолога;
- Снять ЭКГ и получить профессиональную расшифровку результатов;
- Пройти процедуру СМАД;
- Пройти холтеровское мониторирование;
- Воспользоваться другими услугами наших клиник.
Для уточнения подробностей и по любым вопросам обращайтесь по номеру, указанному на сайте
Застойная сердечная недостаточность – снижение сокращений сердечной мышцы. Данное патологическое состояние не является самостоятельной болезнью, это следствие различных нарушений сердечно-сосудистой системы.
Распространение сердечной недостаточности среди населения постоянно растёт, недуг считается социальной проблемой наряду с онкологией и СПИДом. Причины распространения разные: плохая экологическая обстановка, малоподвижный образ жизни, игнорирование правил здорового питания, вредные привычки. Невнимательное отношение к здоровью приводит к возникновению различных поражений кровеносной системы. Сердечная недостаточность является распространенным осложнением.
Введение
Сердце – орган, который работает всю жизнь без остановок. За 70 лет оно совершает около 3000000 сокращений. Чтобы выполнять такую колоссальную работу, ему нужны питание и кислород, которые поступают по сети коронарных артерий. Если в этой сети возникают нарушения, сердечная мышца начинает “голодать”, это приводит к неприятным ощущениям и представляет опасность для жизни.
В последние 100 лет из-за потребления в большом количестве сладкой и жирной пищи, фаст-фуда, уменьшения подвижности, курения и стресса возросла частота сердечно-сосудистых болезней.
В практике кардиолога приходится сталкиваться с гипоксией миокарда у пациентов. Большинство жалуются на сжимающую боль за грудиной. Врач осматривает, выявляет причины, назначает дополнительную диагностику и подбирает лечение: лекарственное, хирургическое или комплексное, в зависимости от степени развития гипоксии.
Этиология возникновения
На развитие болезни влияют несколько причин, сгруппированных вместе:
- Гипоксический. Для него характерна низкая концентрация кислорода в помещении, где находится человек.
- Сердечно-сосудистая система. Заболевание возникает в результате закупорки сосудов или в случае нарушения работы сердца из-за таких заболеваний, как инфаркт.
- Гистотоксичен. Это отравление токсичными химическими веществами, солями тяжелых металлов и другими химическими веществами. Против отравления происходит блокировка ферментов, отвечающих за распределение и поглощение кислорода.
- Механический. Это включает повреждение дыхательной системы, вызванное удушьем или травмой.
- Гематологический. Анемия, атеросклероз, курение, отравление углекислым газом способствуют развитию болезни. Все это приводит к гибели красных кровяных телец.
- Дыхательная система — пневмония, отек дыхательных путей.
- Физический. Гипоксия миокарда возникает на фоне перегрузок, вызванных необычными нагрузками во время тяжелой работы или занятий спортом, когда к сердцу не поступает необходимый кислород.
К косвенным факторам относятся:
- сахарный диабет;
- плохая диета;
- Аномалии в ЦНС;
- повышенный холестерин.
По статистике чаще всего диагностируется гипоксия сердечной мышцы у мужчин. В большинстве случаев в тканях левого желудочка наблюдается недостаток кислорода. Гипоксия правого желудочка диагностируется значительно реже.
Причины
- Ишемическая болезнь сердца. Частая причина сердечной гипоксии. В стенках сосудов сердца возникает атеросклеротическая бляшка, которая частично или полностью перекрывает просвет артерий. Орган не получает кислорода и питания, что ведет к гипоксии.
- Тромб. Образуется при разрыве атеросклеротических бляшек. Они закупоривают артерию и приводят к внезапной и тяжелой ишемии мышцы, грозящей инфарктом. Реже тромб попадает в сердце из других органов.
- Спазм артерий сердца. Временное сокращение мышц в стенке сосуда слегка уменьшает или перекрывает ток крови к органу. Это более редкая причина ишемии.
Человек сталкивается с неприятными проявлениями гипоксии при:
- сильном эмоциональном стрессе;
- неадекватной физической нагрузке;
- холодной температуре внешней среды.
Приходилось осматривать пациентов, которые жаловались на боли за грудиной, выходя на улицу зимой, при температуре -20ºС.
Знать возможные причины гипоксии важно, чтобы избежать появления тяжелых патологий сердца.
Факторы риска развития гипоксии миокарда
- Курение. Никотин повреждает внутреннюю стенку сосудов. В просвете образуется холестериновая бляшка, что приводит к замедлению кровотока. Эта вредная привычка увеличивает риск возникновения тромбов в коронарных сосудах. Учитывайте, что пассивное курение тоже несет в себе риски.
- В исследованиях показана связь между диабетом 1-го и 2-го и повышенным риском ишемии миокарда.
- Артериальная гипертензия. Повышенное давление в сосудах усугубляет атеросклероз. Зачастую гипертония наследуется. Если у родителей, бабушек или дедушек были подобные эпизоды, тщательно следите за своим состоянием и регулярно посещайте специалиста.
- Высокие уровни холестерина в крови, который является основным компонентом атеросклеротической бляшки. Повышение “плохой” фракции (липопротеины низкой плотности, ЛПНП) встречается при наследственных нарушениях обмена веществ или диеты с высоким содержанием холестерина и насыщенных жиров (фаст-фуд).
- Высокий уровень триглицеридов, других жиров в крови. Это фактор риск развития атеросклероза сосудов сердца.
- Ожирение. Приводит к развитию артериальной гипертензии, увеличивает шанс заболеть диабетом, повышает уровень «плохого» холестерина в крови и ведет к гипоксии миокарда.
- Окружность талии. Больше 89 см у женщин и 102 см у мужчин – признак повышенного риска болезни сердца.
- Недостаток физической активности. Отсутствие или малое количество этой составляющей здоровья доказано влияет на уровни холестерина и триглицеридов в крови. Рекомендованы аэробные упражнения (быстрая ходьба, бег, плавание) для снижения риска гипоксии миокарда и инфаркта. Спортивная активность снижает артериальную гипертензию.
Дополнительные профилактические меры
Первое и самое верное средство – регулярные пешие прогулки, свежий воздух благоприятно влияет на организм и обеспечит необходимое количество кислорода. Важно также, постоянно проветривать жилое помещение.
Привлекают в помощь и средства народной медицины, эффективными признаны настойки мокрицы или боярышника, а также березовый сок (около одного литра в день).
Непременно нужно поменять образ жизни: заменить малоподвижный на активные занятия спортом (пробежки, спортивная ходьба, поездки на велосипеде), избавиться от вредных привычек (в том числе и от пассивного курения).
Факт! Спокойствие и эмоциональное равновесие – это последний, но очень важный этап лечения и профилактики сердечной гипоксии!
Виды
- Ишемическая гипоксия (сердечная) – вызвана снижением или нарушением кровотока в артериях.
- Системная гипоксия (сердечная) возникает, когда в организм не поступает достаточного количества кислорода. Например, при нарушении проходимости дыхательных путей или в условиях высокогорья.
- Анемическая гипоксия – вариант, когда кислорода достаточно, но снижена способность крови его переносить. Например, при железодефицитной анемии. В таких ситуациях не требуется специального лечения гипоксии, помимо коррекции уровня железа необходимыми препаратами.
- Гистотоксическая гипоксия – вариант, когда при нормальном содержании кислорода крови и сохранной способности гемоглобина его переносить, нарушены функции клеток сердечной мышцы и кислород не используется. Например, при отравлении цианистым калием.
Профилактика болезни
Как правило, любое заболевание легче предотвратить. Это касается и гипоксии сердечной мышцы. Чтобы этого не случилось, важно соблюдать несколько простых рекомендаций:
- Регулярно гуляйте на свежем воздухе. Если есть возможность, раз в год отправляйтесь на море или в горы.
- Настройте свой образ жизни. Занимайтесь спортом и избегайте вредных привычек.
- Вы должны соблюдать правильную диету. Это может помочь предотвратить образование холестериновых бляшек.
- Прием народных средств — настоев и отваров трав.
Состояние человека — это главное, на что нужно обратить особое внимание. Отсутствие эмоционального напряжения, сбалансированная работа, своевременное лечение заболеваний — все это помогает сохранить здоровье и значительно продлить жизнь.
Родителей мальчиков-подростков часто интересует вопрос, пойдут ли они в армию с таким диагнозом. Однозначно ответить сложно. Если течение болезни не опасно для жизни, мальчика можно забрать. Однако вам нужно будет оценить его общее состояние здоровья.
При тяжелых формах мальчика, конечно, не пустят на службу, так как повышенные физические нагрузки могут только усугубить ситуацию.
Диагностика
Чтобы выявить гипоксию миокарда, врач проведет обследование. Вначале соберет анамнез, затем осмотрит вас.
После этого он порекомендует следующие диагностические мероприятия:
- Снятие кардиограммы (ЭКГ). На кожу накладываются специальные присоски и записывается электрическая активность сердца. Некоторые изменения на пленке, например, диффузные изменения в верхушечной области миокарда, указывают на нарушения кровотока (такие, как гипоксия левого желудочка).
- Эхокардиограмма (ЭхоКГ). Специальный УЗИ-аппарат устанавливают на грудную клетку, и врач получает видеоизображение сердца. С помощью метода выявляются участки диффузных изменений миокарда и нарушения сердечных сокращений.
- Сцинтиграфия (ядерное сканирование). Это самый информативный и дорогостоящий метод диагностики гипоксии сердца. Небольшое количество радиоактивного вещества вводят внутривенно. Оценивая степень насыщения миокарда изотопом, можно сделать вывод о глубине повреждений.
- Коронарная ангиография. Специальное красящее контрастное вещество вводят в сосуды сердца. С помощью рентген-аппарата получают серию снимков (ангиограмм), по которым анализируется кровоток в артериях и оцениваются признаки гипоксии миокарда.
- КТ-сканирование сердца. Оценивается наличие кальцификации – достоверного признака атеросклероза артерий. Состояние сосудов анализируется также с применением КТ-ангиографии.
- Стресс-тест. Вы идете по беговой дорожке в быстром темпе или крутите педали велотренажера, а аппараты фиксируют частоту дыхания, сердечные сокращения и уровень артериального давления. Сердце начинает биться чаще в ответ на физнагрузку и стрессовые условия. В результате появляется возможность выявить проблемы, которые в обычном состоянии не наблюдаются.
Проблема влияния гипоксии на сердечную мышцу, адаптации миокарда к ее воздействию, а также вызываемые ею последствия не утрачивает своей актуальности и продолжает оставаться предметом исследований на протяжении многих десятилетий [1—8]. Это обусловлено тем, что многие заболевания и состояния, возникающие как в терапевтической (хроническая обструктивная болезнь легких, апноэ во сне, ишемическая болезнь сердца и др.), так и в педиатрической практике (перинатальная гипоксия, врожденные пороки сердца и т.д.), сопровождаются ограничением поступления кислорода, что, с одной стороны, может привести к развитию заболеваний, а с другой — повышает устойчивость организма к последующим воздействиям кислорододефицита [1, 3, 9—15].
Особый интерес вызывает исследование распространенных патологических состояний перинатального периода — внутриутробной гипоксии плода и асфиксии новорожденного [14—20]. Среди их последствий, проявляющихся реакцией внутренних органов, поражение сердечно-сосудистой системы занимает 2-е место после патологии почек и, по мнению зарубежных исследователей, встречается в 25%, а по данным отечественных авторов — в 40—70% случаев развития кислорододефицита [16, 21]. При этом установлено, что возникающая в результате дефицита кислорода транзиторная ишемия миокарда связана с временным уменьшением или прекращением кровообращения в отдельных участках мышцы сердца, вызывающим снижение ее функциональной активности [17, 19]. Продолжительность таких преходящих периодов острой ишемии миокарда может колебаться от 10 до 25 мин в час и зависит от тяжести перенесенной гипоксии [17].
Общепризнано, что основной причиной возникновения ишемии миокарда у новорожденных является снижение энергообразования в миокардиальной клетке вследствие перинатальной «гипоксической травмы» и относительной коронарной недостаточности, которая обусловлена несоответствием имеющегося коронарного кровотока функциональным потребностям сердца, возникающим в результате высокой гемодинамической нагрузки на миокард желудочков в период послеродовой адаптации кровообращения [16, 17]. Развитие кислородного голодания приводит к возникновению тканевой гипоксии, обусловленной нарушением механизмов утилизации кислорода в клетках сердца, которые, как известно, в силу высокой функциональной нагрузки очень чувствительны к дефициту кислорода [22, 23].
Биоэнергетика миокарда в физиологических условиях. Особенности у новорожденных
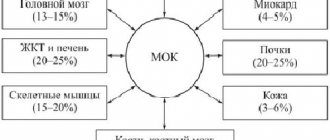
Сердечная мышца является самым кислородозависимым органом организма человека: потребление миокардом кислорода превышает средний уровень его потребления другими тканями организма человека в среднем в 25—36 раз [22]. Миокард, как плода, так и взрослого, потребляет примерно одинаковое количество кислорода в пересчете на 1 г ткани [22]. Известно, что сердце человека в состоянии покоя вырабатывает 65—104 кал/мин [24]. Такое энергообразование требует доставки 13—21 мл кислорода ежеминутно. Необходимое количество кислорода наряду с высоким коэффициентом его экстракции миокардом (до 12—15 мл О2 из 100 мл крови) доставляется благодаря интенсивному кровоснабжению сердца, что в условиях мышечного покоя составляет 75—85 мл на 100 г/мин (около 5% минутного объема крови) и при нагрузке на сердце может увеличиваться примерно в 3 раза (до 225—255 мл на 100 г/мин) [22]. Способность сердца обеспечивать кровоснабжение тканей организма адекватно их потребностям определяется уровнем миокардиального кровотока и комплексом биохимических явлений, которые начинаются с момента поступления окисляемых субстратов в клетки сердечной мышцы и заканчиваются взаимодействием ряда контрактильных протеинов, что ведет к сокращению миофибрилл [24, 25].
Сократительная функция сердца устойчиво поддерживается в течение всей жизни [22, 26]. Это происходит благодаря тесному сопряжению процесса сокращения с энергетическим обменом. Биоэнергетика миокарда в физиологических условиях определяется темпом окисления субстратов (прежде всего молочной и пировиноградной кислот) в цикле трикарбоновых кислот (Кребса), что обеспечивает выход36 моль аденозинтрифосфата (АТФ) на 1 моль глюкозы [24, 27]. Однако этот энергетический цикл в условиях дефицита кислорода нарушается, и молочная кислота не утилизируется. Еще один вариант энергообеспечения витальных функций миокарда, реализующийся в цикле Эмбдена-Мейергофа при адекватной доставке кислорода, играет лишь вспомогательную роль, т.к. в ходе окисления 1 моля глюкозы синтезируются лишь 2 молекулы АТФ [22]. Существует еще один путь —прямое окисление глюкозы (пентозный цикл Варбурга), который является высокоэкономичным и может давать достаточное количество энергии, ввиду того, что из одной молекулы глюкозы образуется около 117 молекул АТФ [22, 24].
Основными энергетическими субстратами для миокарда взрослых и детей более старшего возраста в условиях аэробного метаболизма служат преимущественно жирные кислоты (40—60%), удельный вес углеводов составляет лишь 35—45% [22]. Сердце же плода и новорожденного ребенка в качестве основного источника энергии использует глюкозу и основной продукт его метаболизма — молочную кислоту [16]. Энергетическая метаболизация миокардом жирных кислот, свойственная детям старшего возраста и взрослым, у них практическиотсутствует. Такой тип биоэнергетики обусловлен тем, что при метаболизации глюкозы эффективность преобразования энергии выше, чем жирных кислот: на 1 моль кислорода при ипользовании глюкозы синтезируется АТФ на 14% больше, чем при метаболизации жирных кислот [16, 22]. Помимо этих субстратов кардиомиоциты (КМ) могут использовать и другие метаболиты, циркулирующие в сосудистом русле (кетоновые тела, лактат, аминокислоты и т.д.), благодаря чему поддерживается устойчивый уровень деятельности сердечной мышцы в отличие от скелетных мышц, которые могут использовать только жирные кислоты или глюкозу. Примечательно, что аминокислоты покрывают лишь 5—7% всех энергозатрат КМ [22].
Соотношение потребления миокардом различных субстратов зависит от интенсивности механической работы миокарда, концентрации этих веществ и содержания кислорода в артериальной крови. Механическая активность сердечной мышцы линейно связана со скоростью поглощения кислорода миокардом, что в состоянии покоя составляет ежеминутно около 30 мкл О2на 1 г сырой ткани миокарда [28]. При повышении сократительной активности сердечной мышцы пропорционально увеличивается и потребление О2, которое может возрастать в десятки раз и достигать 300 мкл/мин на 1 г сырой ткани [29].
Скорость расхода энергии тесно связана со скоростью синтеза АТФ. Для поддержания насосной функции сердца человека в течение всей жизни организм вырабатывает ежесуточно около 36 кг АТФ [22]. Более 90% его образуется при окислительном фосфорилировании в митохондриях, при этом продукты окисления глюкозы и жирных кислот как бы сгорают в клетке, давая ей тепло и АТФ [30]. Из митохондрий АТФ поступает в цитоплазму и превращается в креатинфосфат (КФ). Его молекулы являются оптимальными для транспортировки к структурам, которые являются потребителями энергии. Здесь КФ снова превращается в АТФ. Именно АТФ и КФ представляют собой энергетические запасы КМ, которые непосредственно ими используются [24].
Согласно современным представлениям [22] энергия КМ расходуется на следющие процессы:
— сокращение в миофибриллах, где под влиянием повышенной концентрации Са2+ образуются актомиозиновые связи, обеспечивающие сокращение сердечной мышцы;
— работу кальциевого насоса в саркоплазматическом ретикулуме: эта структура способна выделять ионы кальция, активирующие миофибриллы, и поглощать их обратно против концентрационного градиента, на что нужна энергия АТФ, т.е. поддержка работы кальциевого насоса является энергозависимым процессом;
— работу мембранного натрий-калиевого насоса, транспортирующего ионы натрия наружу, а ионы калия внутрь клетки против концентрационного градиента, что также требует энергетических затрат;
— обеспечение функционирования специальных калиевых каналов (АТФ-зависимых калиевых каналов — КАТФ-каналов и Са2+-зависимых К+-каналов), которые, присоединяя молекулы АТФ, закрываются, что препятствует выходу ионов калия из этих каналов;
— обеспечение синтетических процессов.
Вся эта энергия используется в соответствии с суммарным количеством АТФазной активности, находящейся в клеточных органеллах. Миофибриллы, которые имеют наибольшую суммарную АТФазную активность, используют примерно 80% энергетических запасов, на ионный транспорт приходится еще 15% и на синтетические процессы — около 5% всей энергии, используемой КМ [22].
В энергетике сердца выделяют 3 фазы [22]:
Фаза образования энергии включает освобождение ионизированного кислорода — прежде всего из окисляемых углеводов, в минимальной степени из жирных кислот и аминокислот — в основном цикле трикарбоновых кислот и его окисление до воды при участии катализаторов транспорта электронов [23];
Фаза кумуляции и транспорта энергии связана с ее депонированием в форме энергии АТФ, образованием КФ и переносом макроэргической фосфатной связи на аденозиндифосфат (АДФ) миофибрилл;
Фаза использования энергии обусловлена трансформацией энергии, образованной при дефосфорилировании АТФ, в сокращение актомиозина и работу миофибрилл. В ходе клеточного метаболизма АТФ распадается до АДФ и аденозинмонофосфата (АМФ), которые, в свою очередь, в физиологических условиях рефосфорилируются в АТФ [22].
При этом все макроэргические фосфатные соединения находятся в попарном равновесии между собой [24]. Молекулярные механизмы, лежащие в основе сокращения, являются результатом строго детерминированного взаимодействия контрактильных мышечных белков актина и миозина, образующих соответственно тонкие и толстые нити миофибрилл, и регуляторных протеинов — тропомиозина и тропонина. В мышцах регуляторные белки связаны с актином. Акцептором кальция является кальцийсвязанный протеин — тропонин. При связывании кальция с последним конформационные изменения тропомиозина устраняют стерическую блокаду актиновых центров, и при взаимодействии актина с миозином образуются актинмиозиновые мостики, тянущая сила которых определяет сокращение мышц [24]. Фаза образования и кумуляции энергии проходит в митохондриях. Фаза утилизации (сопряжения и сокращения) реализуется в ретикулуме и миофибриллах.
Гликолитической энергопродукции принадлежит важная роль в поддержании основных процессов гомеостаза миокардиальной клетки, что обеспечивает функционирование кальциевого насоса ретикулума, транспорт макроэргов к контрактильным белкам за счет активации цитоплазматической креатинфосфокиназы, подготовку аминокислот для вовлечения в цикл трикарбоновых кислот, поддержку физиологической продолжительности потенциала действия КМ [28]. АТФ, образованному в процессе гликолиза, отводится важная роль в энергообеспечении физиологической продолжительности потенциала действия мембраны КМ [24]. Дефицит АТФ существенно повышает опасность развития фибрилляции желудочков, что получило подтверждение в условиях эксперимента. С гликолитической продукцией АТФ связан синтез КФ в цитоплазме [22, 28, 31].
Энергетический обмен гипоксически поврежденного миокарда
Существует множество определений термина «гипоксия». С позиции биоэнергетики гипоксия рассматривается как нарушение окислительных путей генерации в клетках, т.е. форма гипоэргоза [4]. Эта дефиниция была предложена С.Н. Эфуни и В.А. Шпектором для обозначения энергетической патологии клетки [32].
Доказано, что гипоксия, быстро нарушающая синтез АТФ в митохондриях и сопровождающаяся при этом снижением сократительной функции сердца, является первым по времени и основным по значению фактором развития ишемии, которая вызывает ряд глубоких нарушений в метаболизме кардиомиоцитов [24, 27].
В основе развития гипоксии лежит усиление несоответствия между снабжением кислорода клеток и тканей и резким ростом потребности в нем организма в результате интенсификации аэробного обмена на системном уровне, особенно у новорожденных [33, 34]. Для удовлетворения потребностей метаболизма в условиях недостаточного снабжения кислородом тканей развивается цепь биохимических и физиологических изменений, цель которых — обеспечить оптимальное функционирование и, по возможности, восстановление организма на исходном уровне по окончании периода кислородной недостаточности [7, 35].
В условиях ишемии прекращение доставки кислорода к миокарду мобилизует свободный (около 0,07 мл О2 на 100 г ткани) и остаточный кислород сердечной мышцы, главным образом связанный с миоглобином, содержание которого — около 0,5 г на 100 г ткани [23]. В физиологических условиях функция миоглобина как акцептора кислорода, заключается в обеспечении непрерывности поступления кислорода в митохондрии при резком снижении коронарного кровотока в период систолы. Однако это не решает проблему, так как этого количества кислорода достаточно для энергообеспечения лишь 6—7 сердечных сокращений [22]. При гипоксии происходит быстрое истощение резерва кислорода, связанного с гемоглобином и миоглобином, снижается уровень субстратов окисления в тканях, падает активность ферментов. Вследствие этого в митохондриях нарушаются процессы окислительного фосфорилирования, а также транспорт АТФ из митохондрий к местам его использования [23, 24]. Это приводит к снижению концентрации АТФ и КФ и накоплению продуктов метаболизма макроэргов. При этом скорость снижения концентрации КФ существенно больше, чем АТФ, что обусловлено быстрым расходом его на образование АТФ и нарушением транспорта из митохондрий [22, 23]. Характерно, что темп потерь КФ опережает скорость деградации АТФ. Представляет интерес, что в условиях ишемии сердечной мышцы отмечается повышение количества КФ в зоне, граничащей с участком ишемии, носящее компенсаторный характер [36].
Несмотря на усиление гликолитической энергопродукции, острая ишемия резко тормозит темп синтеза макроэргов, что ведет к нарушению энергообеспечения функций и гомеостаза ишемизированных КМ [22]. Одновременно с нарушением синтеза АТФ в митохондриях и накоплением восстановленных форм компонентов дыхательной цепи в ишемизированной ткани происходит мобилизация аварийных компенсаторных механизмов энергообеспечения, в частности, гликолитической продукции макроэргов [37].
При длительной и тяжелой гипоксии происходит переход метаболизма на анаэробный путь с увеличением утилизации различных субстратов и прекращение синтетических процессов, о чем свидетельствует интенсификация процессов перекисного окисления липидов (ПОЛ) [38—40]. Ранний переход от окислительного метаболизма к анаэробной продукции энергии обеспечивается активацией фосфорилазы и повышением транспорта глюкозы в ишемизированных клетках миокарда.
Однако усиление анаэробного гликолиза, которое можно рассматривать как компенсаторную реакцию, направленную на восполнение энергозатрат в условиях гипоксии, является неэффективным механизмом, поскольку это дает очень малый выход энергии: из одной молекулы глюкозы образуются только две молекулы АТФ [24].
Известно, что в начальной стадии ишемии наблюдается универсальная первичная реакция митохондрий — эффект «мягкого разобщения» [22]. В случае уменьшения напряжения кислорода в сердечной мышце ниже 3—5 мм рт.ст. тормозится не только окисление субстратов цикла трикарбоновых кислот, но и связанное с ним фосфорилирование, причем его скорость резко падает. При длительной ишемии снижается способность митохондрий КМ использовать NAD·H-зависимые субстраты [22, 41]. Накопление NAD·Н, лактата и протонов приводит к ингибированию ферментов гликолиза и нарушению энергообеспечения процессов поддержания гомеостаза в ишемизированных КМ. К концу 60-й минуты ишемии гликолиз тормозится полностью, содержание адениновых нуклеотидов при этом падает на 69%, а АТФ — на 94% [22]. В свою очередь транспорт и использование АТФ, который производится в цикле Эмбдена-Мейергофа вследствие торможения активности цитоплазматических изоформ КФ, блокирует падение рН менее 6,6 [23].
Снижение содержания окисленной формы никотинамидных коферментов является «ахиллесовой пятой» при гипоксии, потому что, выполняя функцию переносчиков водорода, NAD, NADP и их восстановленные формы участвуют в процессах клеточного дыхания, которые при дефиците кислорода нарушаются в первую очередь [22, 42—45]. Изменение соотношения окисленных и восстановленных их форм, в свою очередь, может служить одной из причин нарушений окислительно-восстановительных процессов в цикле трикарбоновых кислот и сопряженного с ним окислительного фосфорилирования, окисления жирных кислот и других путей обмена веществ, участвующих в адаптации организма к гипоксии [24]. Кроме того что АТФ служит непосредственным источником энергии для большинства клеточных метаболических процессов, он также регулирует активность многих ферментов. Достаточная внутриклеточная концентрация АТФ — необходимое условие для обеспечения клеточной функции и выживания, однако для метаболической регуляции не менее важно соотношение АТФ и других адениновых нуклеотидов («адениновый заряд энергии» или «потенциал фосфорилирования») [2].
При гипоксии снижается энергетический заряд, поскольку фосфорилирование АДФ в АТФ нарушено [46—49]. Это ведет к увеличению концентрации АМФ, который образуется из АДФ при участии аденилаткиназы. Другое следствие — снижение общего пула адениновых нуклеотидов вследствие стимуляции катаболизма нуклеотидов. Это происходит посредством участия АМФ-дезаминазы — фермента, активирующегося при снижении энергетического заряда. Продуктами этого нарушенного пути являются инозинмонофосфат (ИМФ), инозин, гипоксантин, ксантин и мочевая кислота. Альтернативным вариантом катаболизма АМФ является первичное дефосфорилирование аденозина в инозин. Значение этого пути заключается в том, что аденозин является сильнодействующим вазодилататором и, как было установлено, играет роль в защитной реакции миокарда на гипоксию [2, 50, 51]. Адениновые нуклеотиды и ИМФ остаются внутри клетки, тогда как пуриновые нуклеозиды (аденозин, инозин) и производные (гипоксантин, ксантин, мочевая кислота) выходят в экстрацелюлярное пространство [35]. Небольшое количество АМФ дефосфорилируется в аденозин, далее из миоцита поступает в эндотелиальную клетку, где необратимо метаболизируется до гипоксантина, который затем под действием ксантиндегидрогеназы превращается в мочевую кислоту и выводится почками [4].
В отличие от адениннуклеотидов аденозин может выходить из клетки и в обычных условиях. Его молекула как бы осуществляет обратную связь, с помощью которой клетка сама регулирует свое кровоснабжение. Если содержание АТФ уменьшается, то аденозин образуется в избыточном количестве и, диффундируя к артериолам, увеличивает капиллярный кровоток, вследствие чего КМ получает достаточное количество кислорода [41, 47]. В условиях ишемии эта молекула выступает как природный ингибитор адренорецепторов КМ, клетки становятся невосприимчивыми к симпатической стимуляции, что, несомненно, сохраняет их энергию, в результате чего увеличивается жизнеспособность клеток в неблагоприятных условиях [52].
По завершению гипоксии отношение концентрации нуклеотидов — быстро, а размеры их пулов — более медленно, возобновляются. На этой стадии аденозин и гипоксантин могут быть утилизированы для синтеза нуклеотидов («спасительный путь») при меньших энергетических затратах, чем синтез пуринов de novo [24].
Как известно, при активации гликолиза вследствие накопления недоокисленных продуктов образуется лактат и повышается концентрация ионов водорода [51, 53—55]. В аэробных условиях продукты метаболизма обычно используются в митохондриях, однако при выключении функции этих клеточных органелл в условиях ишемии недоокисленные продукты накапливаются. Таким образом, происходит смещение реакции среды КМ в кислую сторону, что приводит к развитию внутриклеточного ацидоза [56—59].
По данным литературы, снижение рН на 0,5—1,7 после 30-минутной ишемии вызывает падение механической функции сердца на 30—100% [22]. Доказано, что жесткий ацидоз (рН менее 6,6) является инициирующим фактором клеточной альтерации. В миокарде повышается концентрация свободного кальция, а наличие неорганического фосфата способствует его перемещению к митохондриям [24], активирует освобождение «миокардиальных» катехоламинов, повышает активность фосфолипаз, активирует кислые лизосомальные протеазы, индуцирует развитие так называемого пероксидного стресса (накопление Н2О2, стимуляция перекисного окисления липидов). Это еще более увеличивает энергетическую недостаточность сердечной мышцы, что приводит к необратимым изменениям в ишемизированном миокарде [42, 60—62].
Как известно, ацидоз подавляет АТФазную активность миозина [56]. Он вызывает нарушениезахвата Са2+саркоплазматическим ретикулумом [22]. Повышение концентрации протонов ухудшает взаимодействие Са2+ с тропонином и процесс его депонирования в саркоплазматическом ретикулуме [59]. Одновременно внутриклеточный ацидоз сопровождается деградацией миозина за счет диссоциации его легких цепей и диффузии их в кровь [22]. Увеличение концентрации Са2+ в сократительных белках приводит к тому, что отсоединение «головок» миозина от центров актина становится невозможным, нарушается процесс диастолического расслабления, развивается контрактура, характерная для гипоксии [33]. Ухудшению сократимости миокарда способствует и накопление фосфатов в клетке, образующегося в результате неконтролируемого распада АТФ до АДФ И АМФ. Накопление фосфатов наряду с ацидозом снижает чувствительность миофибрилл к ионам кальция.
Поскольку кислород является акцептором электронов на конечном этапе электроннотранспортной цепи, снижение содержания кислорода в митохондриях ниже «критического давления кислорода» (1—2 мм рт.ст.) приводит к замедлению скорости всего процесса. В результате этого начинает накапливаться АДФ, поскольку он больше не превращается в АТФ. НАДФ перестает реокисляться, и отношение НАД/НАДФ в митохондриях начинает снижаться [2].
Существовавшее ранее представление о митохондриях как о специализированных органеллах, контролирующих исключительно энергетический обмен, в настоящее время дополнено сведениями о них как об органеллах, содержащих факторы, определяющие судьбу клетки [8, 63, 64]. Доказано, что митохондрии ответственны за функционирование и регулирование большого числа сигнальных путей, которые обеспечивают не только митохондриальный биогенез и пролиферацию клеток, но и, наоборот, запрограммированную гибель клетки посредством ограничения окислительно-восстановительных реакций [8].
В настоящее время достаточно изученным из митохондриальных факторов, регулирующих метаболическую и функциональную активность клетки, является митохондриальный АТФ-зависимый калиевый канал (КАТФ-канал; ATP-sensitiveK+ channels). Установлено, что воздействие хронической гипоксии приводит к активации митохондриальных КАТФ-каналов в миокарде [65], которые вне гипоксии при наличии достаточного количества молекул АТФ закрыты. Если же количество молекул АТФ уменьшается, то калиевые каналы открываются и ионы калия выходят во внеклеточную среду. При этом, как известно, потери ионов калия приводят к тому, что КМ утрачивает способность к возбуждению.
Доказано, что умеренная хроническая гипоксия приводит к увеличению синтеза белка SUR2Aт (регуляторная субъединица КАТФ-канала) и возрастанию плотности этих каналов на мембранах кардиомиоцитов по механизму, который не зависит от HIF-1α (hypoxia inducible factor 1 alpha) [66, 67]. Последний, как известно, представляет собой субъединицу гетеродимерного белка HIF-1, причем, в отличие от его β-субъединицы, экспрессируемой постоянно, α-субъединица регулируется уровнем кислорода [68—70]. В состоянии кислорододефицита белковая молекула HIF-1α не гидроксилируется, остается стабильной, происходит их накопление. В последующем эти субъединицы (HIF-1α, HIF-1β) объединяются, и образовавшийся в результате этого транскрипционный белок HIF-1 в ядре клетки связывается с особыми последовательностями ДНК в генах, экспрессия которых индуцируется гипоксией [67, 68, 71].
Активация КАТФ-каналов в условиях хронической гипоксии приводит к увеличению устойчивости пор, регулирующих проницаемость митохондрий — МРТ-пор (mitochondrial transition pore). Открытие этих пор провоцирует набухание митохондрий, приводит к разобщению окислительного фосфорилирования и выходу из митохондрий цитохрома С и белка AIF (apoptosis-inducing factor) [72]. Именно эти вещества катализируют превращение неактивной прокаспазы-9 в активную каспазу-9; последняя, в свою очередь, активирует превращение прокаспазы-3 в каспазу-3, что в конечном итоге приводит к апоптозу [73].
МРТ-пора, ответственная за проницаемость митохондрий, модулируется еще одним К+-каналом: Са2+-зависимым К+-каналом митохондрий (BKCa Big-conductance Ca2+-activated K+ channel) [74—77]. Установлено, что открытие этих каналов сопровождается увеличением продукции O2-*.
Как известно, цитохромы дыхательной цепи митохондрий — это кислород-чувствительные ферменты и основные источники активных форм кислорода (АФК) в клетке [78, 79]. При развитии ишемии увеличение продукции АФК компонентами электронно-транспортной цепи возрастает лавинообразно [79, 80]. Примечательно, что наибольшее содержание АФК регистрируется в миокарде при длительной (более 30 мин) ишемии, характеризующейся очень низким уровнем кислорода в ткани миокарда [54, 79]. Предполагается, что гипоксия сопровождается увеличением количества восстановленных форм переносчиков дыхательной цепи (НАД, коэнзим Q и др.), подвергающиеся аутоокислению с образованием АФК даже при низких концентрациях кислорода [54].
Трудно недооценить роль АФК в развитии ишемии миокарда [78—81]. Установлено, что АФК выступают важным фактором ишемического повреждения миокарда [82—85] и аритмогенеза [86, 87].
Немаловажную роль в предотвращении нарушений микроциркуляции, развивающихся при ишемии, отводится состоятельности регулирующей системы «NO-синтаза (NOS) — оксид азота» [88—92]. Помимо вазомоторных эффектов радикала оксида азота (NO*) в настоящее время открыто множество его внутриклеточных функций. Установлено, что NO* может конкурентно ингибировать цитохромоксидазу, тем самым участвуя в регуляции выработки супероксидного радикала и перекиси водорода [55]. Оксид азота способен активировать митохондриальные АТФ-чувствительные К+-каналы, предупреждать образование MPT-пор и регулировать митохондриальный биогенез [93]. Оксид азота активирует растворимую гуанилатциклазу, что ведет к выработке цГМФ с последующей активацией протеинкиназы С и ее регуляторного каскада [90].
Метаболические расстройства, развивающиеся при ишемии, можно охарактеризовать как накопление ионов водорода и фосфата, а также увеличенный выход аденозина и ионов калия из клетки [89, 94—101]. Эти метаболические последствия ишемии фактически направлены на защиту клеточного метаболизма, ресурсов клеток от быстрого использования. По сути при глубокой ишемии клетки впадают в состояние гибернации, основная цель которой — обеспечить жизнеспособность клеток в ожидании возможного восстановления кровотока. По даннымS. Rahimtoola, давшего название этому феномену в 1984 г. [102]: «Гибернация миокарда — это тонкий механизм регуляции, адаптирующий функциональную активность миокарда к конкретным условиям кровоснабжения, т.е. это защитная реакция страдающего сердца». Быстрая реперфузия, т.е. восстановление кровотока к исходному уровню в таком гибернированном сердце, устраняет этот метаболический защитный механизм и способна возродить сократительную функцию миокарда [83]. По образному выражению L. Opie [29]: «Участки пораженного миокарда находятся как бы в уснувшем состоянии, но способны проснуться после восстановления кровотока». При этом степень и качество его восстановления зависят прежде всего от продолжительности ишемического периода. Восстановление энергетического метаболизма после кратковременной ишемии (не более 5 мин) происходит полностью. Более того, КМ приобретают повышенную резистентность к следующему ишемическому воздействию [3, 100, 101]. Однако, если кровоток восстанавливается после периода длительной ишемии, то сократительная функция сердца может возобновиться и в условиях неполного энергетического ресурса клетки. Для такого состояния в литературе используется термин «оглушенный» или реперфузионный миокард [99, 101, 102]. Основной проблемой этого состояния является продолжение повреждения внутриклеточных структур, которое в значительной степени обусловлено действием свободных радикалов кислорода, образующихся в большом количестве при реперфузии поврежденного участка, которая возвращает кислород в ишемизированные клетки [3, 85].
Причиной длительного снижения контрактильности миокарда принято считать реперфузионное повреждение [3, 101]. Миокард в стадии реперфузии, даже после кратковременной, обратимой ишемии выявляет длительное угнетение контрактильной функции, что является следствием ультраструктурных, метаболических, сосудистых, электрофизиологических и других нарушений [3, 84].
Исходя из этого следует различать понятие «спящий»/ «гибернирующий» (hibernating myocardium) и «оглушенный»/ «реперфузионный» (miocardial stunning) миокард. «Спящий» миокард возникает при хронической ишемии, «оглушенный» — в ходе реперфузии, после непостоянной ишемии (см. таблицу).
Основные дифференциально-диагностические отличия функционального состояния миокарда при гибернации и «оглушенности»
При «спящем» миокарде кровоток хронически снижен, при «оглушенном» — нормальный или почти нормальный [14]. Это наиболее важные различия. Функция левого желудочка в обоих случаях снижена. При «спящем» миокарде сохраняется соответствие между изменением его функции и нарушением кровотока, при «оглушенном» этого соответствия нет: функция левого желудочка и сократимость нарушены, развивается ишемическая дисфункция, в то же время кровоток отстается нормальным или почти нормальным [63, 99]. При «оглушенном» миокарде наблюдается спонтанное постепенное восстановление функции сердечной мышцы. Глубокое угнетение его функции при «спящем» миокарде продолжается неопределенно долго, и если коронарный кровоток не улучшается, то происходит прогрессирование изменений вплоть до некроза сердечной мышцы. Функция левого желудочка восстанавливается только при нормализации кровотока [14].
Таким образом, ишемия приводит к выраженным нарушениям процессов энергообразования и повреждению клеточных структур миокарда, особенно после возобновления поставки кислорода, т.е. реперфузии. Переключение на анаэробные метаболические пути приводит к тому, что запасы АТФ снижаются, т.к. последний превращается в АДФ и АМФ с ограниченной возможностью рефосфорилирования. При более тяжелом или более длительном дефиците кислорода поддержание достаточных уровней богатых энергией фосфатных соединений, особенно АТФ, становится невозможным. Большая часть энергозависимых процессов замедляется или прекращается. Это ведет к более глубоким нарушениям клеточной функции, неспособности поддерживать ионное равновесие и, в конечном итоге, к гибели клетки.
Авторы заявляют об отсутствии конфликта интересов.
Лечение
Принцип лечения гипоксии миокарда – улучшение кровотока в сердечной мышце. Врач подбирает лекарственную терапию, хирургическое вмешательство или комплексный подход в зависимости от тяжести состояния.
Схема терапии индивидуальна, поэтому не рекомендуется заниматься самолечением.
Медикаментозные средства
- «Аспирин». Средство, снижающее способность крови образовывать тромбы. Сокращает риск закупорки коронарной артерии. Применяется для профилактики острого инфаркта миокарда, инсульта, острых нарушений мозгового кровообращения, тромботических осложнений при хирургических операциях, при стенокардии.
- Бета-блокаторы. Расслабляют миокард, замедляют сердцебиение и снижают артериальное давление, что облегчает доступ крови к сердцу.
- Блокаторы кальциевых каналов. Расслабляют и расширяют сосуды, увеличивают кровоток, замедляют частоту сокращений сердца.
- Нитраты, например, «Нитроглицерин». Временно расширяют просвет сосудов, улучшают кровоток в артериях и венах сердца.
- Средства, снижающие уровень холестерина. Это статины, секвестранты желчных кислот, соединения никотиновой кислоты и фибраты.
Статины («Аторвастатин», «Флувастатин», «Ловастатин» и другие) снижают уровень “плохого” холестерина на 25-60% и повышают “хорошие” его фракции. Большинство современных руководств рекомендует статины как препараты выбора пациентам с любой формой атеросклероза, людям 40-75 лет с диабетом и высоким уровнем холестерина, без диабета с риском развития атеросклеротических поражений в течение 10 лет >7,5%.
- Ингибиторы ангиотензин-превращающего фермента (ИАПФ). Расслабляют сосуды и снижают давление. Чаще всего, назначают пациентам с артериальной гипертензией или диабетом, помимо гипоксии миокарда.
- «Ранолазин» («Ранекса»). Расслабляет сердечные артерии и уменьшает стенокардию.
Хирургические методы
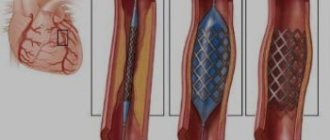
- Ангиопластика и стентирование. Катетер (тонкая длинная трубочка) вводится в суженый участок артерии. Небольшой баллон раздувают, чтобы расширить просвет. Затем вводят проволочную трубку (стент) для предотвращения повторного стеноза. Операция не открытая, выполняется через сосудистый доступ.
- Шунтирование коронарных артерий. Хирург берет сосуд из другой части тела, и создает дополнительный путь для крови в обход заблокированного участка кровяного русла. Операция показана при значительном сужении сосудов и тяжелой степени гипоксии.
Терапевтические мероприятия
Если диагностировано такое заболевание, как гипоксия миокарда, необходимо подобрать соответствующее лечение. С такой задачей способен справиться только опытный врач. Все действия должны быть направлены на устранение первопричины, спровоцировавшей развитие патологии.
- Насыщите воздух кислородом, подключите в тяжелом состоянии к аппарату искусственного дыхания легких;
- в случае анемии пациенту переливают железо и кровь;
- введение антидота при обнаружении токсического отравления;
- выведение токсинов и нормализация кислотно-щелочной среды;
- терапия легочных патологий;
- восстановление кровообращения и вязкости крови.
Медикаментозное лечение
С целью повышения устойчивости сердечной мышцы к кислородному голоданию используются препараты из группы антигипоксантов. Условно их делят на три типа:
- непосредственный;
- косвенный;
- смешанный.
Препараты первого типа помогают стимулировать энергетические процессы в тканях сердца. Это связано с тем, что их действие:
- Удаляет скопившиеся кислоты и шлаки;
- снимает ишемию;
- защищает коронарные сосуды;
- восстанавливает связь с центральной областью мозга.
К таким препаратам относятся:
- Неотон;
- Цитомак;
- Милдронат;
- Бетимил;
- Актовегин;
- Пирацетам.
Их можно использовать как в стационаре, так и амбулаторно. Уколы обычно назначают с переходом через некоторое время на таблетированную форму.
Непрямые лекарства помогают снизить потребление кислорода сердцем. При этом снижаются все обменные процессы. Подобные свойства отмечены в:
- снотворные и седативные средства;
- препараты, которые используются для обезболивания;
- некоторые блокаторы кальциевых каналов.
Благодаря этим препаратам пациент может пережить тяжелый период болезни.
В третью группу входят витамины (E, A, B, C) и микроэлементы (магний, селен и другие). Их назначают при хронической гипоксии.
Средства народной медицины
Лечение народными средствами дает положительные результаты только на начальной стадии заболевания.
- С целью нормализации работы кровеносной системы рекомендуется принимать настойку боярышника. Вы можете купить его в аптеке или приготовить самостоятельно.
- С целью устранения гипоксии тканей применяют отвар плодов шиповника или брусники. Он способствует быстрой регенерации тканей благодаря своим сильным антигипоксическим свойствам.
- Не менее эффективно действует березовый сок. Суточная доза должна составлять 500 мл.
Питание
Особое внимание следует уделять диете при наличии кислородного голодания. Обязательно соблюдение диеты, включающей такие продукты, как гранат, свиная печень, зеленые яблоки, различные злаки. Они помогают повысить уровень гемоглобина в крови.
Совет врача
Чтобы снизить вероятность развития болезней сердца врачи рекомендуют изменить образ жизни:
- Отказаться от курения. Обсудите с лечащим врачом стратегии прекращения, избегайте пассивного процесса.
- Улучшить сопутствующие состояния (диабет и артериальная гипертензия). Эти болезни увеличивают риск возникновения гипоксии миокарда.
- Перейти на здоровое питание. Снизьте количество насыщенных жиров и увеличьте содержание цельных злаков, фруктов и овощей в рационе. Контролируйте уровень холестерина в крови.
- Делать физические упражнения. Проконсультируйтесь со специалистом о безопасных для вас аэробных и силовых нагрузках для улучшения кровотока в сердце.
- Поддерживать вес в норме. Если у вас лишние килограммы, спросите у врача о подходящих способах снижения веса.
- Снизить стресс. Применяйте специальные техники для релаксации мышц и глубокого дыхания.
Регулярно посещайте врача для медосмотра. Основные факторы риска гипоксии миокарда (высокий холестерин, артериальное давление и диабет) протекают бессимптомно на начальных стадиях. Чем раньше выявляется патология и назначается лечение, тем выше продолжительность жизни и лучше здоровье сердца.
Чем угрожает состояние
При гипоксии миокарда увеличивается риск развития опасных для жизни осложнений.
- Инфаркт миокарда (сердечный приступ). При полном перекрытии кровотока в сосудах недостаток крови и кислорода вызывает приступ, а затем отмирание части мышцы. Это осложнение очень серьезно и может привести к летальному исходу.
Немедленно обратитесь к врачу при симптомах длительной или тяжелой боли в груди! Вызовите скорую помощь. Врач проведет диагностику и начнет лечение как можно раньше.
- Нарушения сердечного ритма (аритмии). Ведут к ослаблению сократительной функции и угрожают жизни, так как повышают риск инсульта.
- Сердечная недостаточность. Во время инфаркта гипоксия миокарда левого желудочка может повредить мышцу сердца и нарушить ее способность перекачивать кровь по телу. В этом случае орган не справляется с нагрузкой. Возникают отеки, одышка, возрастает риск смерти.
Острая форма
Наряду с хронической существует острая форма сердечной недостаточности. Причинами ее возникновения являются:
- инфаркт миокарда;
- обширный инсульт;
- пороки строения сердца, врожденные и приобретенные;
- гипертония.
Отличительной особенностью острой сердечно-сосудистой недостаточности является внезапность приступа, отсутствие перечисленных стадий развития. Состояние человека быстро ухудшается, летальный исход возможен в течение нескольких минут. О возникновении патологии свидетельствует резкое ухудшение состояние, удушье, сильный кашель с пеной или красной мокротой, посинение кожных покровов, холодный пот.
В подобных случаях первая помощь – это вызов скорой. Затем пострадавшего следует вывести на открытый воздух, расстегнуть воротник и другую тесную одежду. Лучшей позой считается сидячая, с опущенными ногами. Под язык следует дать таблетку нитроглицерина. Повторять приём каждые 10 минут до приезда скорой.
Важно! При острой сердечной недостаточности нельзя принимать лежачее положение.
Выводы
Гипоксия миокарда – основная причина смертности во всем мире. Она встречается у молодых и взрослых, мужчин, женщин, у людей с разными болезнями. Особо часто провоцируется ишемической болезнью сердца. Гипоксия повреждает мышцу и нарушает функцию перекачивания крови. Грозное последствие резкой и тяжелой блокады коронарных артерий – инфаркт. Другие осложнения: серьезные нарушения ритма, аритмии, и сердечная недостаточность.
Симптомы и лечение гипоксии миокарда – то, что должен знать каждый думающий о своем здоровье человек. Самый яркий симптом – стенокардия, сильная боль в груди. Она ощущается как тупая, сжимающая, тяжелая. Боль отдает в левую руку, лопатку, спину, шею, нижнюю челюсть. Боль появляется при сильном стрессе, физической нагрузке, и длится 1-5 минут.
В арсенале современных врачей есть методы диагностики и лечения с доказанной эффективностью. Цель терапии – восстановить приток крови к сердцу. Применяются лекарственные и хирургические способы: ангиопластика и стентирование коронарных артерий, шунтирование.
Клинический случай
В практике встречаются случаи, когда у пациентов с умеренной гипоксией миокарда нет явных симптомов. Такой вариант врачи называют “молчащей ишемией”.
Но чаще пациенты приходят с жалобами на тупую, сжимающую, тяжелую боль в груди, отдающую в левую руку, лопатку, челюсть, шею, или спину. Это стенокардия – появляющаяся при недостаточном поступлении крови к сердцу. Характерная особенность: когда врач просит описать характер ощущений, человек подносит к груди сжатый кулак. Именно эту симптоматику в старой литературе называли “сердечная жаба”.
Боль появляется часто при физической нагрузке и стрессе, длится 1-5 минут.
Развитие заболевания и основные признаки его проявления
Для данной патологии выделено несколько стадий развития, и это:
- легкая;
- умеренная;
- тяжелая;
- критическая (смертельная).
Для каждой стадии гипоксия миокарда симптомы и лечение отличается.
Самым первым признаком становится учащение сердцебиения (оно называется тахикардией). Это происходит за счет того, что сердце пытается таким образом нормализовать поступление кислорода в органы. Затем начинается снижение сократительной способности. Как результат — возникновение аритмии всего миокарда, которая может привести к фибрилляции желудочков.
Характерной симптоматикой для умеренной гипоксия миокарда является снижение работоспособности организма, общая утомляемость, сонливость, появление раздражительности, повышение потоотделения.
Следующий симптом гипоксии миокарда – скачок давления: вначале оно повышается, а затем происходит резкое его снижение. Такой перепад приводит к коллапсу не только работу сердца, а и дыхательную систему. В этом случае появляется одышка, тяжелое дыхание, сменяющееся цианозом (появлением синюшности тела). В итоге – организм меньше потребляет кислород из окружающей среды, дыхание становится реже и может прекратиться.
При критической стадии всех перечисленных симптомов может и не появиться, приступ случается молниеносно и приводит к остановке дыхания и сердца. Эта стадия – самая опасная.
Не стоит также забывать, что протекать гипоксия миокарда может в двух формах: острой (при которой на протяжении нескольких часов проявляются все признаки заболевания и могут закончиться летальным исходом) и хронической (при ней развитие заболевания длится несколько лет).



![Рис. 1. Функционирование глимфатической системы мозга (по [11]) Fig. 1. Glymphatic system functioning (according to [11])](https://expert35.ru/wp-content/uploads/ris-1-funkcionirovanie-glimfaticheskoj-sistemy-mozga-po-11-fig-1-330x140.jpg)