Терапевт-участковый
Аблязов
Иршат Равилевич
Стаж 21 год
Терапевт-участковый высшей категории. Член Российского научного медицинского общества терапевтов.
Записаться на прием
Тромбоцитопения — это отдельное заболевание либо симптом другой болезни, который характеризуется низким уровнем тромбоцитов (меньше 150 000 единиц в микролитре). Состояние сопровождается высокой кровоточивостью, а также медленной остановкой кровотечений из небольших сосудов.
Симптомы
К симптомам тромбоцитопении относятся:
- Пурпура. Так называют кровоизлияния в слизистые ткани или кожу. На деле это выглядит как красные пятна — чаще всего их можно заметить в местах сильного соприкосновения с одеждой. Пятна не болят, могут быть точечными или довольно обширными — в том числе и с кровоподтеками, синяками разных цветов (в зависимости от времени образования).
- Носовые кровотечения регулярного характера. Поскольку мелкие сосуды ослаблены, кровотечение может начаться из-за простуды, чихания, небольшой травмы. Ярко-красная кровь может вытекать в течение десяти и более минут, поэтому больной рискует потерять много крови.
- Кровоточивость десен, длительные кровотечения после удаления зубов. Механизм тот же: из-за слабых сосудов кровь не может быстро останавливаться при маленьких и больших повреждениях.
- Кровотечения внутренних органов. Например, встречается кровь в ЖКТ, когда кал становится окрашенным, или в мочеполовой системе — тогда окрашивается уже моча. Оба симптома очень тревожные и требуют немедленного обращения к специалистам.
- Слишком обильные и долгие менструации. Причем кровотечения могут наблюдаться и в другие дни цикла.
Все перечисленные симптомы могут указывать и на другие заболевания — как сопутствующие тромбоцитопении, так и самостоятельные. Осложняет ситуацию и то, что причин и механизмов развития этого состояния очень много. В медицине различают несколько видов такого заболевания.
Использованная литература
- Battinelli E. M., Markens B. A,. Italiano J. E. Release of angiogenesis regulatory proteins from platelet alpha granules: modulation of physiologic and pathologic angiogenesis Blood. 2011; 118(5): 1359–1369.
- Bourdon D. M., Mahanty S. K., Jacobson K. A., Boyer J. L., Harden T. K. (N)- methanocarba-2MeSADP (MRS2365) is a subtype-specific agonist that induces rapid desensitization of the P2Y1 receptor of human platelets/ J Thromb Haemost. 2006; 4(4): 861–868.
- Fisher M.., Vasilevko V., Cribbs D. H. Mixed Cerebrovascular Disease and the Future of Stroke Prevention. Transl Stroke Res. 2012; 3(1): 39–51.
Классификация тромбоцитопении
Расскажем о том, какие причины тромбоцитопении лежат в основе разных видов этой болезни.
Наследственные тромбоцитопении
В основе этих состояний находятся болезни генетического происхождения. Это могут быть аномалия Мея-Хегглина, синдром Бернара-Сулье, синдром Вискотта-Олдрича, TAR-синдром, а также врожденная амегакариоцитарная тромбоцитопения.
У каждой из этих болезней есть множество особенностей. Например, синдром Вискотта-Олдрича наблюдается исключительно у мальчиков и встречается в четырех-десяти случаях на один миллион. Синдром Бернара-Сулье может развиться только у малыша, который получил измененный ген от обоих родителей, а аномалия Мея-Хегглина может развиться в 50% случаев при условии, что только у одного родителя есть для этого предпосылки. Как правило, все перечисленные заболевания имеют среди симптомов не только низкий уровень тромбоцитов, но и еще ряд других патологических состояний, а потому требуют особенного лечения.
За что отвечают тромбоциты в организме
Место выработки тромбоцитов – костный мозг. Они производятся из больших мегакариоцитов. Тромбоциты по форме напоминают пластины, овальной или округлой формы. Диаметр кровяных телец составляет 2-4 мкм. Тромбоциты могут менять форму круга на форму сферическую, образуя на своей наружной мембране выросты, что возможно за счет наличия на их поверхности рецепторов, основу которых составляют гликопротеиновые комплексы. Этими выростами они соединяются друг с другом и с сосудистыми стенками в том месте, где имеется их повреждение. Фибриновые нити позволяют крепиться тромбоцитам к имеющимся дефектам, после чего эти клетки крови начинают выделять фермент под названием тромбостенин. Под его воздействием нити скручиваются и становятся плотнее.
Также тромбоциты вырабатывают ферменты, отвечающие за нормальную свертываемость крови, а также тромбоцитарный фибриноген, фактор роста тромбоцитов, пероксидазы, серотонин, иммунные комплексы и иные вещества, которые играют важную роль в нормальном функционировании организма.
Итак, тромбоциты необходимы человеку для обеспечения его жизнедеятельности, так как они принимают участие во многих важных процессах, среди которых:
- Образование сгустка крови, который необходим для остановки кровотечения в месте повреждения небольших сосудов.
- Поддержание сосудистого спазма.
- Питание сосудистой стенки.
- Выработка иммунных комплексов.
- Растворение сгустков крови.
Показатели уровня тромбоцитов на протяжении 24 часов могут колебаться в пределах не более 10% процентов от нормального уровня. Если у женщины менструация, то эти колебания составляют от 20 до 50%. Поэтому при постановке диагноза «тромбоцитопения» необходимо, чтобы уровень тромбоцитов был менее 100* 10 9 /л.
- Тромбоциты повышены у взрослого — о чем это говорит, и как их снизить?
У 80% людей с низким уровнем тромбоцитов в крови наблюдаются носовые кровотечения. Также на патологию указывают длительные менструации, повышенная кровоточивость десен.
Новый тромбоцит, в среднем, существует не более 10 дней. После этого он становится меньше. Если тромбоциты имеют размеры менее 7.0 fl, то у человека, либо в недавнем времени была удалена селезенка, либо он страдает от синдрома Вискотта-Олдрича. Эта болезнь сопровождается не только тромбоцитопенией, но также иммунодефицитом и кожной экземой. Поэтому во время проведения лабораторной диагностики необходимо учитывать средний размер кровяных пластинок. Этот показатель обозначается в результатах анализов как MPV. Его нормальные значения оставляют 7,4-10,4 fl.
Продуктивные тромбоцитопении
Их тоже вызывает огромный список причин и факторов самого разного происхождения. Все они связаны с тем, что в красном костном мозге нарушены процессы образования тромбоцитов.
Например, сюда можно отнести некоторые виды анемий, метастазы рака, острый лейкоз, прием цитостатических медикаментов. Есть даже такие факторы, как радиация или злоупотребление алкоголем.
Например, при остром лейкозе болезнь кровеносной системы обеспечивает мутацию стволовой клетки костного мозга. Из-за этого она делится и начинает вытеснять кроветворные клетки. В результате уменьшается количество не только тромбоцитов, но и лейкоцитов, эритроцитов, лимфоцитов. Такое состояние имеет свое название — панцитопения. То есть иммунная тромбоцитопения в данном случае является его частью.
Если речь о влиянии медикаментов, то чаще всего снижение уровня тромбоцитов вызывают препараты из таких групп:
- противодиабетические,
- противовоспалительные,
- антипсихотики,
- антитиреоидные,
- антибиотики,
- диуретики,
- противосудорожные.
Конечно, далеко не все лекарства и не во всех случаях способны вызвать такую реакцию, но это лишний повод задуматься о том, что никакие медикаменты не стоит назначать себе самостоятельно и пить без контроля лечащего врача.
Более того, есть еще и такой фактор, как повышенная чувствительность к некоторым медикаментам. Обычно он изначально определяется своеобразной генетической предрасположенностью, но встречается это довольно редко.
Когда мы говорим о радиации, то речь идет не только о пребывании человека в опасных зонах, но и о лечении лучевой терапией. При разрушении опухолей могут быть затронуты кроветворные клетки красного мозга, поэтому состояние, когда уровень тромбоцитов падает, может становиться побочным эффектом лечения онкологических заболеваний.
Развитие симптомов тромбоцитопении при злоупотреблении алкоголем чаще всего случается на фоне запоев и связано с высоким уровнем этилового спирта в крови. Он негативно и длительно воздействует на костный мозг и обычно вызывает временное понижение тромбоцитов. Если запои становятся частыми и слишком длительными, есть риск, что изменения будут необратимыми.
Причины
Тромбоциты представляют собой форменные элементы крови, безъядерные плоские пластинки размером от 1 до 2 мкм. Они образуются из мегакариоцитов (клеток-предшественников) в красном костном мозге.
Мегакариоциты — относительно большие клетки. Они имеют длинные отростки и почти полностью заполнены цитоплазмой. В ходе созревания крошечные фрагменты их отростков отделаются и поступают в кровоток. Это и есть тромбоциты. Согласно научным данным, из одной клетки-донора может образоваться от 2000 до 8000 тромбоцитов.
За развитие и рост мегакариоцитов отвечает тромбопоэтин — белковый гормон, образующийся в почках, печени и мышцах. С кровотоком он переносится в красный костный мозг, где обеспечивает образование мегакариоцитов и тромбоцитов. Чем больше становится тромбоцитов, тем сильнее тормозится процесс образования тромбопоэтина. Это позволяет поддерживать количество форменных элементов крови на одном уровне.
Если на любом из перечисленных этапов происходит сбой, количество тромбоцитов в периферической крови снижается. Развивается тромбоцитопения.
С учетом причин и механизма развития заболевание бывает разных форм:
- наследственная;
- продуктивная;
- разрушения;
- потребления;
- перераспределения;
- разведения.
Наследственные тромбоцитопении
Наследственная тромбоцитопения наблюдается при разных врожденных аномалиях. Ее причины — генетические мутации:
- Синдром Вискотта-Олдрича. Вызван мутациями, из-за которых в красном косном мозге образуются очень маленькие тромбоциты (менее 1 мкм в диаметре). Из-за аномальной структуры они быстро (за несколько часов) разрушаются в селезенке.
- Аномалия Мея-Хегглина. Очень редкая генетическая патология, по причине которой нарушается процесс отделения тромбоцитов от мегакариоцитов. Как результат, уменьшается число форменных элементов крови, но их размеры становятся гигантскими (6-7 мкм). Параллельно наблюдается нарушение образования лейкоцитов (лейкопения).
- Врожденная амегакариоцитарная тромбоцитопения. Обычно данная форма тромбоцитопении диагностируется у детей младенческого возраста. Она связана с нарушением продукции тромбоцитов костным мозгом.
- Синдром Бернара-Сулье. Тромбоцитопения у ребенка проявляется лишь, если он унаследовал дефектный ген и от мамы, и от папы. Болезнь заявляет о себе в раннем детском возрасте. Для нее характерно образование функционально несостоятельных гигантских тромбоцитов (6-8 мкм), не способных прикрепляться к поврежденным сосудистым стенкам и связываться друг с другом.
- TAR-синдром. Очень редкая причина врожденной тромбоцитопении, сочетающейся с отсутствием обеих лучевых костей.
Продуктивные тромбоцитопении
К группе продуктивных тромбоцитопений относятся патологии системы кроветворения, связанные с нарушением процесса образования тромбоцитов в красном костном мозге. Причины заболеваний:
- Острый лейкоз. Стволовые клетки мутируют, появляется большое количество их клонов, не способных выполнять специфические функции. Постепенно клоны вытесняют кроветворные из красного костного мозга. Уменьшается не только число тромбоцитов, но и количество лейкоцитов, лимфоцитов и эритроцитов.
- Миелодиспластический синдром. Костный мозг не может продуцировать достаточное количество здоровых клеток. Клетки кроветворения ускоренно размножаются, однако процессы их созревания нарушаются. В итоге образуется много функционально незрелых клеток (среди них тромбоциты), подвергающихся апоптозу (саморазрушению).
- Апластическая анемия (организм вырабатывает очень мало новых кровяных телец).
- Раковые метастазы. Опухолевые клетки на последних стадиях рака начинают покидать первичный очаг и разноситься по всему организму. Оседая на тканях и органах, они начинают активно размножаться. Это приводит к вытеснению кроветворных клеток из красного костного мозга.
- Миелофиброз. Стволовые клетки мутируют, костный мозг заменяется рубцовой тканью. Очаги кроветворения развиваются в печени и селезенке (размеры органов из-за этого сильно увеличиваются).
- Радиация. Ионизирующее излучение оказывает разрушающее действие на кроветворящие клетки красного костного мозга. Они начинают мутировать.
- Алкоголизм. Спирт угнетает процессы кроветворения в красном костном мозге, из-за чего снижается содержание в крови тромбоцитов, лейкоцитов и эритроцитов.
- Цитостатические медикаменты. Применяются для лечения опухолей. Они способны угнетать кроветворение в костном мозге, из-за чего уменьшается количество тромбоцитов.
- Аллергические реакции на определенные медицинские препараты (диуретики, антибиотики, антипсихотики, противосудорожные и противовоспалительные препараты, противодиабетические средства).
- Мегалобластные анемии. Развиваются при дефиците фолиевой кислоты и витамина В12.
Тромбоцитопения разрушения
Причина тромбоцитопении в данном случае — усиленное разрушение тромбоцитов в селезенке (может быть также в лимфатических узлах, сосудистом русле или печени). Патология наблюдается при:
- тромбоцитопении новорожденных;
- синдроме Эванса-Фишера;
- некоторых вирусных заболеваниях (вирусные тромбоцитопении);
- посттрансфузионной тромбоцитопении;
- приеме медикаментов (лекарственные тромбоцитопении);
- идиопатической тромбоцитопенической пурпуре.
Тромбоцитопения новорожденных
Возникает, если на поверхности детских тромбоцитов есть антигены, которых нет на материнских тромбоцитах. Антитела, вырабатываемые материнским организмом, поступают в кровоток новорожденного и разрушают его тромбоциты. Описанный процесс может длиться до 20 недели внутриутробного развития. В итоге ребенок может родиться с тромбоцитопенией.
Синдром Эванса-Фишера
Является следствием системных заболеваний — аутоиммунного гепатита, ревматоидного артрита, системной красной волчанки. Также синдром Эванса-Фишера может развиться на фоне относительного благополучия. Тогда говорят об идиопатической тромбоципении.
Вирусные тромбоципении
Попадая в организм, вирусы активно размножаются. На поверхности пораженных клеток образуются антитела, также изменяются собственные клеточные антигены. Пораженные клетки разрушаются в селезенке. Среди вирусов, способных вызвать тромбоципению — корь, краснуха, грипп, ветрянка.
Посттрансфузионная тромбоцитопения
Посттрансфузионные тромбоцитопении являются следствием переливания тромбоцитарной массы или крови. Для них характерно выраженное разрушение тромбоцитов в селезенке. Причина заболеваний состоит в попадании в организм во время переливания чужеродных тромбоцитов, к которым и начинают вырабатываться антитела.
Лекарственная тромбоцитопения
Некоторые лекарства могут связываться на поверхности кровяных клеток с антигенами. К образовавшимся комплексам вырабатываются антитела, из-за чего тромбоциты начинают разрушаться в селезенке. Среди «провоцирующих» препаратов — «Хинидин», «Мепробамат», «Хлорохин», «Ранитидин», «Гепарин», «Циметидин», «Гентамицин», «Ампициллин» и др.
Идиопатическая тромбоцитопеническая пурпура
Идиопатическая тромбоцитопеническая пурпура (она же аутоиммунная тромбоцитопения или эссенциальная тромбоцитопения) характеризуется резким снижением уровня тромбоцитов в периферической крови. При этом состав других кровяных элементов не нарушается.
Тромбоцитопении разрушения
Тут речь идет об активном разрушении тромбоцитов, которое обычно наблюдается в селезенке. Такие процессы тоже вызываются большим количеством факторов. Среди них прием отдельных лекарств, некоторые вирусы, синдром Фишера-Эванса и т. д.
Отдельного рассмотрения стоит идиопатическая тромбоцитопения. Это тот случай, когда установить причину даже при огромном числе возможных вариантов не представляется возможным. При этом врачи отмечают, что даже в такой ситуации наблюдается действие провоцирующих факторов. Например, проблема проявляется после бактериальных и вирусных инфекций, профилактических прививок, употребления ряда медикаментов, переохлаждения или длительного нахождения на солнце.
Встречается такое состояние и у новорожденных. Оно начинает формироваться еще в утробе матери, когда антитела в ее организме вызывают разрушение тромбоцитов у ребенка.
Синдром Фишера-Эванса также не является самостоятельной причиной, поскольку он сам — это следствие разных системных заболеваний. Такой синдром встречается при системной красной волчанке, ревматоидном артрите, но в ряде случаев может быть и самостоятельным отклонением. Что касается вирусов, то к понижению уровня тромбоцитов могут привести краснуха, ветряная оспа, корь, грипп. Иногда это реакция на вакцинацию, хоть такой механизм описывается довольно редко и почти не встречается.
Активация
Для выполнения своей основной функции — заделывания повреждения в стенке сосуда — тромбоциты должны перейти в активное состояние. Как и у большинства клеток нашего организма, этот процесс протекает по следующей схеме: сигнал — рецептор — внутриклеточный сигнал — усилитель — регулятор — ответ (рис. 3). Сигналом к активации служит появление в кровотоке агониста — специальной сигнальной молекулы, которая должна появляться только при необходимости и связываться со специфической молекулой, пронизывающей мембрану тромбоцита (рецептором). Агонист взаимодействует с одним «хвостом» рецептора, выступающим снаружи, и это приводит к изменению другого, со стороны цитозоля, где появляется следующая сигнальная молекула — вторичный мессенджер. Он запускает синтез еще нескольких мессенджеров, те, в свою очередь, — еще нескольких, и так сигнал распространяется в цитозоле и усиливается с помощью каскада внутриклеточных реакций, что в конечном итоге приводит к комплексному ответу тромбоцита. Важно, что в тромбоците существуют специальные регуляторные системы, модулирующие концентрации внутриклеточных мессенджеров на разных этапах активации, чтобы, например, не было реакции на следовые количества агониста.
Рис. 3.
Схема активации тромбоцита
Как же эта схема реализуется в нашем организме? В сосудах тромбоциты выталкиваются эритроцитами из основного потока и движутся вдоль стенок, проводя своего рода мониторинг их состояния. Одним из первых сигналов к активации тромбоцитов становится коллаген — основной белок соединительной ткани, обнажающийся при повреждении сосуда. Обнаружив коллаген, они связываются с ним через специальные рецепторы, одновременно активируясь и прочно прикрепляясь к месту повреждения. Взаимодействие тромбоцита с коллагеном и ведет к запуску упомянутого внутриклеточного сигнального каскада и появлению в цитозоле вторичного мессенджера — инозитолтрифосфата (ИФ3). Эта маленькая водорастворимая молекула способна быстро передвигаться в цитозоле и служит сигналом к выходу ионов кальция из внутриклеточных хранилищ. А повышение его внутриклеточной концентрации может приводить к разнообразным ответам тромбоцита: выплескиванию содержимого гранул (секреции), изменению формы, прикреплению к стенке сосуда (адгезии), скреплению с другими тромбоцитами (агрегации), появлению прокоагулянтной активности (рис. 4). После того, как кровеносная система уже распознала повреждение сосуда, в крови появляются еще три природных активатора тромбоцита — тромбин, АДФ и тромбоксан A2. Белок тромбин образуется из предшественника, протромбина, в плазме крови, но массово — уже на мембранах активированных тромбоцитов. При секреции их плотных гранул выбрасывается большое количество АДФ (маленькая молекула, выполняющая в клетках в основном энергетические функции), и гораздо меньше АДФ высвобождается из поврежденных клеток эндотелия, выстилающего внутреннюю поверхность сосудов. Из арахидоновой кислоты, находящейся в мембранах активированных тромбоцитов, синтезируется тромбоксан А2. Связывание этих трех активаторов со своими рецепторами на мембране тромбоцита приводит, как и в случае с коллагеном, к появлению ИФ3 в цитозоле и повышению в нем концентрации кальция (рис. 4). Таким образом, все три растворимых активатора и коллаген действуют по одному пути, однако вызывают разные тромбоцитарные ответы. Например, тромбоксан А2 провоцирует выброс плотных гранул, а АДФ — нет. Активация отдельно коллагеном или тромбином вызывает все перечисленные ответы одновременно, а совместно — приводит к появлению группы прокоагулянтных тромбоцитов и синтезу тромбина на их мембранах. Видимо, существуют еще недостаточно изученные различия в сигнализации, запускаемой разными агонистами. Чтобы случайная активация не превращала тромбоцит в настоящую «бомбу», несущуюся в кровотоке и запускающую всю систему свертывания, в организме неповрежденные клетки эндотелия постоянно выделяют простациклин и оксид азота, которые блокируют активацию клеток, препятствуя повышению в них концентрации кальция.
Рис. 4.
Схема основных путей активации тромбоцита и его ответных реакций:
АДФ
— аденозиндифосфат,
ИФ3
— инозитолтрифосфат,
ЭПР
— эндоплазматический ретикулум
Сигнализация — один из самых сложных и плохо изученных разделов в исследовании тромбоцитов. По устройству каждого рецептора и сигнального пути существует множество вопросов, и самый простой из них: зачем вообще столько активаторов?
Тромбоцитопении потребления
Тут механизм, следующий: тромбоциты по какой-то причине, начинают активироваться в сосудистом русле. В ответ на это красный костный мозг начинает их активно вырабатывать — и в результате его возможности потихоньку истощаются. После этого уровень красных клеток начинает падать.
Одна из причин тромбоцитопении потребления — ДВС-синдром. Он расшифровывается, как синдром диссеминированного внутрисосудистого свертывания. А развиваться может на фоне сильного разрушения тканей в процессе операций, ожогов, травм, из-за тяжелых инфекций, при химиотерапии, пересадке органов и т. д. То есть и здесь в основе множество причин, которые способны вызвать понижение уровня тромбоцитов в крови.
Введение
Принято считать, что диагностика и лечение тромбоцитопении (ТП) находятся в сфере профессиональной компетенции специалиста-гематолога. Вместе с тем к настоящему моменту накоплена масса данных, свидетельствующих о снижении числа тромбоцитов при различных патологических состояниях. Это объясняет необходимость более широкого обсуждения данной проблематики среди врачей различных клинических специальностей.
Общие положения
Термин «тромбоцитопения» обычно используют при уровне тромбоцитов ниже 100,0×109/л, хотя нормальным уровнем тромбоцитов принято считать таковой в пределах от 150,0×109/л до 450,0×109/л [1]. Поэтому ряд экспертов выделяют латентную ТП при уровне тромбоцитов от 100,0×109/л до 150,0×109/л [2]. Выделение латентной ТП, на наш взгляд, обоснованно с практической точки зрения. С одной стороны, такая клиническая ситуация требует динамического наблюдения за уровнем тромбоцитов независимо от причины, с другой – при числе тромбоцитов 100,0×109/л и более полностью обеспечивается гемостаз, что, как указывается в большинстве имеющихся руководств, безопасно в контексте риска развития кровотечений [3] и что позволяет проводить различные оперативные вмешательства, в т.ч. и родоразрешение, при указанном уровне тромбоцитов.
Более того, концентрация тромбоцитов от 100×109/л до 50×109/л, протекающая без спонтанного геморрагического синдрома, может также считаться безопасной. В случаях появления признаков кровоточивости при указанном числе тромбоцитов следует искать дополнительный фактор, провоцирующий геморрагический синдром, или учитывать наличие сосудистой патологии, например, у пациентов преклонного возраста. Существующие подходы указывают, что коррекцию ТП следует проводить при числе тромбоцитов от 50×109/л до 30×109/л только при наличии геморрагических проявлений. Критическим для развития опасных для жизни геморрагических проявлений является содержание тромбоцитов ниже 10,0×109/л. Пациенты с таким уровнем ТП нуждаются в безотлагательной терапии независимо от степени клинических проявлений геморрагического синдрома [3, 4].
Этиопатогенез ТП
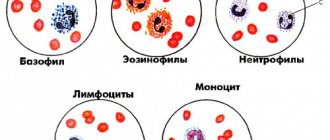
Говоря о ТП, следует подчеркнуть разнообразие приводящих к ней патогенетических механизмов и еще большее количество патологических состояний, при которых данные патогенетические механизмы реализуются [5]. Выделяют два основных механизма патогенеза ТП (табл. 1): нарушение образования тромбоцитов и повышенное их разрушение.
Диагностические алгоритмы при ТП
При выявлении у пациента ТП весьма важен детальный анализ истории заболевания, в частности установление предшествовавших развитию ТП факторов: бактериальная или вирусная инфекция, в т.ч. и вирусные гепатиты; вакцинация или применение лекарственных препаратов; пребывание в странах с риском заражения инфекционными заболеваниями (малярия, риккетсиоз, лихорадка Денге и др.); употребление алкогольных и хинин-содержащих напитков; варикозная болезнь, тромбозы, сердечно-сосудистая патология и ее терапия антикоагулянтами и дезагрегантами; наличие сопутствующих заболеваний, особенно аутоиммунных, инфекционных или опухолевых, протекающих с ТП, ДВС-синдромом; трансфузии; пересадка органов в анамнезе; беременность; наличие и длительность кровотечений после хирургических вмешательств.
В семейном анамнезе обязательно уточнить наличие болезни системы кроветворения у родственников.
При проведении объективного исследования следует активно выявлять такие симптомы, как гипо- или гипертермия, снижение массы тела, симптомы интоксикации, гепато- и спленомегалия, лимфаденопатия, патология молочных желез, сердца, вен нижних конечностей, а также врожденные аномалии. Все эти данные не специфичны.
Лабораторно-инструментальная диагностика включает несколько направлений. В клиническом анализе крови обязательны оптический подсчет числа тромбоцитов и оценка морфологии тромбоцитов (микроформы и гигантские тромбоциты), при этом следует помнить, что при наличии агрегатов тромбоцитов для исключения «ложной» ТП при использовании консерванта ЭДТА (этилендиаминтетраацетат кальция-натрия) необходим повторный анализ (используется пробирка с цитратом натрия). Всем пациентам проводится ультразвуковое исследование или компьютерная томография (КТ) органов брюшной полости и забрюшинного пространства, рентгенография или КТ органов грудной клетки, а также обследование для исключения онкологических заболеваний. Принимая во внимание, что идиопатическая тромбоцитопеническая пурпура (ИТП) – диагноз исключения, спектр используемых лабораторных тестов достаточно широк (табл. 2), по своей диагностической значимости их подразделяют на обязательные, потенциально полезные и тесты с недоказанной информативностью.
Принципы лечения ИТП
В лечении ИТП выделяют несколько линий терапии. На первом этапе используются гормоны (преднизолон, дексаметазон) и специфический иммуноглобулин. К терапии второй линии относят спленэктомию и стимуляторы тромбопоэза (миметики тромбопоэтина). Ритуксимаб и другие препараты с иммуносупрессивным действием (азатиоприн, циклофосфамид, циклоспорин А, винкристин, винбластин) рассматриваются как средство резерва (третья линия терапии) [4].
ТП в гастроэнтерологии
Принимая во внимание множественность причин ТП, необходимо проводить исключение заболеваний, которые могут в клинической картине иметь снижение уровня тромбоцитов; в практике врача-гастроэнтеролога это прежде всего H. pylori-ассоциированные заболевания и поражения печени различного генеза.
В 1998 г. А. Gasbarrini и соавт. опубликовали в журнале «Ланцет» статью «Regression of autoimmune thrombocytopenia after eradication of Helicobacter pylori», положившую начало новому направлению в изучении хеликобактериоза, сопутствующих с ним состояний, а также более тесному взаимодействию врачей двух клинических специальностей, а именно гатроэнтерологов и гематологов [6]. Ранее было показано, что аутоиммунные реакции посредством перекрестной мимикрии между антигенами системы Lewis эпителиальных клеток желудка и H. pylori могут играть определенную роль в хеликобактер-индуцированном повреждении слизистой оболочки; моноклональные анти-H. pylori-антитела вступают в реакции взаимодействия с тканями вне желудочно-кишечного тракта, а именно с эпителиоцитами протоков слюнных желез и почечных канальцев [7]; поликлональные анти-H. pylori-антитела взаимодействуют с капиллярами почечных клубочков, что может приводить к мембранозной нефропатии [8]. Опираясь на данные предшествовавших исследований, в частности на результаты наблюдений [9] о купировании проявлений болезни Шенлейн–Геноха после успешно проведенной эрадикационной терапии, А. Gasbarrini и соавт. предположили патофизиологическую связь между ИТП и хронической инфекцией H. pylori. Они описали повышение уровня тромбоцитов у всех 8 пациентов ИТП, получивших эрадикационную терапию, при этом уровень тромбоцитов у 3 человек, такой терапии не получавших, оставался неизменным.
К настоящему времени опубликована масса работ, систематических обзоров, исследовавших взаимосвязь ИТП и H. pylori, механизмы развития данной взаимосвязи, выявляющих предикторы положительного ответа на эрадикационную терапию.
Предложено несколько гипотез механизмов, с помощью которых H. pylori вызывает развитие ИТП. Считается, что образуются перекрестно-реактивные антитела, взаимодействующие как с компонентами H. pylori, так и с поверхностными антигенами тромбоцитов посредством молекулярной мимикрии. Итальянские ученые во главе с R. Scandellari показали, что заражение штаммами H. pylori, экспрессирующими CagA (cytotoxin-associated gene A), может быть причиной хронических случаев ИТП. По данным проведенного ими исследования, увеличение числа тромбоцитов после эрадикационной терапии наблюдалось у 43% пациентов после 6 месяцев наблюдения. Пациенты были сопоставимыми по всем основным клиническим признакам, за исключением одного: сывороточные антитела к CagA присутствовали у 83% пациентов, ответивших на терапию, и только у 12,5% не ответивших (p=0,026). Авторы пришли к выводу, что антибиотикотерапия H. pylori-инфекции может приводить к исчезновению иммунных перекрестно реагирующих антител и, следовательно, может рассматриваться как путь терапии пациентов с ИТП, особенно для тех лиц, у которых выявляются антитела к CagA [10]. Впоследствии, опираясь на данные, полученные R. Scandellari и соавт., а также принимая во внимание тот факт, что почти все CagA-положительные штаммы H. pylori также экспрессируют вакуолизирующий токсин, группа исследователей во главе с N. Figura предположили существование молекулярной мимикрии некоторых тромбоцитарных пептидов с вакуолизирующим цитотоксином А H. pylori. В частности, компонент тромбоцитов, связывающий домен рецептора 289 аминокислот для фактора фон Виллебранда (GP1b-тромбоцит), показал определенное структурное сходство с VacA- H. pylori [11]. M. Michel и соавт. [12] также исследовали гипотезу молекулярной мимикрии и обнаружили, что тромбоциты инфицированных H. pylori-пациентов ИТП, обладающие способностью реагировать с GPIIb/IIIa или GPIb, не могут распознавать антигены H. pylori. С другой стороны, T. Takahashi и соавт. [13] сообщили, что тромбоциты пациентов с ИТП, инфицированных H. pylori, «распознавали» CagA при реакции иммуноблоттинга, а тромбоциты пациентов, инфицированных H. pylori, но без ИТП – нет. Y. Bai и соавт. изучили перекрестное взаимодействие моноклонального антитела против уреазы В хеликобактера с поверхностным гликопротеином тромбоцитов GPIIb/IIIa и предположили, что иммунный ответ на UreB может участвовать в патогенезе ИТП [14]. Все эти данные свидетельствуют о том, что перекрестно реагирующие антитела против H. pylori могут присутствовать у пациентов с ИТП, но их патогенетическая роль до конца не ясна.
В качестве еще одного механизма рассматривается тот факт, что хроническая инфекция H. pylori может неспецифически воздействовать на иммунную систему хозяина, стимулируя приобретенные иммунные ответы через выработку Т- и В-аутоантител. Японские исследователи S. Yamanishi и соавт. [15] показали, что уреаза H. pylori способна инициировать аутоиммунные реакции путем активации В1-клеток, однако это не объясняет развития специфичного для гликопротеинов тромбоцитов при ИТП аутоиммунного ответа. Более того, в работе R. Pellicano и соавт. показано отсутствие различий в продукции неспецифических аутоантител (антинуклеарных, антимикросомальных, антигладкомышечных) при ИТП у лиц с H. pylori и без них [16].
M. Kuwana и соавт. [17] предложили модель «патогенной петли» (a «pathogenic loop» model): появление антитромбоцитарных аутоантител у больных ИТП. Речь идет о том, что макрофаги ретикулоэндотелиальной системы «захватывают» тромбоциты через Fcγ-рецепторы и «передают» тромбоцитарные антигены (гликопротеиды) на Т-клетки (CD4+), которые в свою очередь, будучи активированными, стимулируют В-клетки на выработку антитромбоцитарных антител, связывающихся в результате с циркулирующими тромбоцитами, тем самым замыкая «патогенную петлю». После успешной эрадикации H. pylori антитромбоцитарные антитела удаляются [18], следовательно, «патогенная петля» остановлена. M. Kuwana и соавт., проведя проспективное исследование, показали повышенную фагоцитарную способность и низкие уровни экспрессии ингибирующего FcγRIIB в циркулирующих моноцитах у пациентов ИТП, инфицированных H. pylori, у H. pylori-негативных пациентов подобные изменения не выявлены. В случае успешной эрадикации наблюдалось подавление фенотипа активированного моноцита, затем уменьшался уровень антитромбоцитарных аутоантител и возрастало число тромбоцитов. Таким образом, H. pylori могут модулировать баланс Fcγ-рецепторов моноцитов/макрофагов в пользу активации рецепторов Fcγ [17, 19].
Целый ряд работ демонстрирует попытки определить особенности ИТП, ассоциированной с H. pylori, сравнивая клинические данные взрослых пациентов с ИТП с инфекцией H. pylori или без нее. Пациенты с ИТП, инфицированные H. pylori, были значительно старше, чем неинфицированные [20], но это может объясняться тем, что распространенность инфекции H. pylori с возрастом увеличивается среди населения в целом. Во многих других исследованиях не выявили существенных различий в любых других демографических или клинических характеристиках, включая пол, число тромбоцитов или ответ на терапию. В нескольких исследованиях обнаружены различия в генетических факторах пациентов с ИТП с H. pylori или без них. Итальянские исследователи D. Veneri и соавт. [21] изучали аллели HLA-DRB1 и DQB1 пациентов с ИТП и обнаружили, что у H. pylori-положительных пациентов были более низкие частоты DRB1*03 и более высокие частоты DRB1*11, DRB1*14 и DQB1*03 по сравнению с H. pylori-негативными пациентами. Однако у японских пациентов с ИТП связи между инфекцией H. pylori и аллелями HLA-DRB1 или DQB1 не выявлено, но обнаружено, что полиморфизм генов в локусах для интерлейкина-1β (ИЛ-1β) ассоциировался с инфекцией H. pylori у пациентов с ИТП в возрасте до 50 лет [17, 22]. Различий в уровнях ИЛ-2, -4 или -6 между пациентами с ИТП с инфекцией H. pylori и без нее не выявлено [23]. Сывороточные уровни хемокинов, как правило, регулируемые Т-клетками, были значительно выше у пациентов с ИТП с инфекцией H. pylori, чем у пациентов без нее, однако схожее повышение имело место также у лиц, у которых была H. рylori-ассоциированная патология желудочно-кишечного тракта, но не было ИТП [24]. Таким образом, к настоящему моменту не идентифицированы демографические, клинические, генетические или иммунологические характеристики, уникальные для пациентов с ИТП, инфицированных H. pylori. Вероятно, это связано с тем, что есть по меньшей мере две отдельные подгруппы пациентов с ИТП, инфицированных H. pylori: пациентов с вторичной ИТП, причиной которой служит H. pylori, в этом случае данные пациенты реагируют на эрадикационную терапию, а также с первичной ИТП и «случайной» сопутствующей инфекцией H. pylori.
Факторы, прогнозирующие положительное влияние эрадикационной терапии на течение ИТП, а именно на возрастание числа тромбоцитов, достаточно широко исследованы. Наиболее часто выявляемый благоприятный предиктор – более короткий анамнез ИТП [20, 25, 26], но в других исследованиях этой связи не находят [27–29]. Некоторые исследователи сообщают о значительном положительном эффекте эрадикации H. pylori у пациентов с легкой ТП, но у пациентов с тяжелой ТП был отмечен слабый ответ на эрадикацию [30]. Такие клинические характеристики, как возраст менее 65 лет при диагностике ИТП [25], более высокий исходный уровень тромбоцитов [25], отсутствие предшествовавшей терапии кортикостероидами [27], отсутствие сопутствующей терапии кортикостероидами [31, 32] и отсутствие предшествовавшей терапии для ИТП [25], также рассматриваются как факторы, прогнозирующие положительную «реакцию» тромбоцитов на лечение, однако сведения об их достоверности еще более противоречивы. В нескольких исследованиях изучалась генетическая предрасположенность к реакции тромбоцитов на антихеликобактерную терапию; в частности, показана ассоциация между гаплотипами HLA-DQB1*03 и более высокой вероятностью положительного ответа тромбоцитов [21]. Установлено, что одиночные нуклеотидные полиморфизмы в генах фактора некроза опухоли β и ингибитора Fcγ-рецептора IIВ (FcγRIIB) полезны для прогнозирования реакции ТП на эрадикационную терапию [32, 33]. Обнаружено, что наличие антитромбоцитарно специфичных анти-GPIb аутоантител предсказывает устойчивость к эрадикационной терапии H. pylori [17]. Противоречивы сведения о влиянии антител к CagA на прогноз повышения уровня тромбоцитов: исследование, проведенное в Италии, показало, что пациенты с ИТП и антителами к CagA чаще, чем пациенты без них, положительно реагируют на эрадикационную терапию [10], но исследование, проведенное в Японии, этого наблюдения не подтвердило [26]. R. Sato и соавт. [34] произвели оценку потенциальной связи ответа тромбоцитов на эрадикацию H. pylori с данными фиброэзофагогастродуоденоскопии и результатами гистологического исследования биоптатов желудка: выраженное воспаление и признаки атрофии в теле желудка расценены как предикторы благоприятного результата. Таким образом, и генетический фон, и бактериальные факторы, регулирующие уровень воспалительного ответа на инфекцию H. pylori, могут использоваться в целях прогнозирования успешности эрадикационной терапии для лечения ТП.
Несмотря на внушающие оптимизм данные исследований, ряд ученых сомневаются в наличии причинно-следственной связи между ИТП и инфекцией H. pylori, и, соответственно, влиянии эрадикационной терапии на число тромбоцитов. Так, результаты работы, проведенной A.D. Samson и соавт. [35], говорят об отсутствии существенных различий между H. pylori-позитивными и H. pylori-негативными пациентами в отношении числа тромбоцитов. Исследователи из Малайзии [36] сообщили о низкой распространенности инфекции H. pylori у пациентов с ИТП и отсутствии какого-либо значительного эффекта эрадикации H. pylori на число тромбоцитов.
ТП является распространенным гематологическим расстройством у пациентов с хроническим заболеванием печени [2, 37]. Распространенность ТП варьируется в зависимости от ряда факторов, таких как популяция пациентов и степень тяжести основного заболевания печени, а степень ТП служит ранним прогностическим маркером (индекс APRI – Aspartate-aminotransferase-to-Platelet Ratio Index), позволяющим делать предварительную оценку по вопросу наличия выраженного фиброза печени, не прибегая к биопсии [38]. Встречаемость ТП среди пациентов с циррозом печени достигает 80% [39].
Генез ТП при заболеваниях печени мультифакториален. Патофизиология ТП при хроническом заболевании печени уже давно [40] связана с гипотезой гиперспленизма, когда портальная гипертензия вызывает объединение и секвестрование всех корпускулярных элементов крови, преимущественно тромбоцитов, в расширенной и перегруженной селезенке. Пересадка печени нормализует ТП и уменьшает гиперспленизм [41].
Нарушение образования тромбоцитов при заболеваниях печени также связано со снижением активности и уровня тромбопоэтина – основного цитокина, продуцирующегося печенью и оказывающего воздействие на все стадии дифференцировки мегакариоцитов и синтеза тромбоцитов.
Помимо влияния на гемопоэтические клетки существует предположение о связывании тромбопоэтина непосредственно с циркулирующими в сосудистом русле тромбоцитами, что приводит к повышению их функциональной активности [42]. Снижение тромбопоэтинсинтетической функции печени приводит к уменьшению тромбопоэза в костном мозге и, следовательно, к ТП в периферической крови. Восстановление адекватной тромбопоэтинной продукции после трансплантации печени приводит к скорейшему восстановлению производства тромбоцитов [43].
Подавление образования тромбоцитов в костном мозге может быть вызвано алкоголем, одним из частых этиологических факторов заболевания печени. Алкоголь-индуцированная ТП обусловлена прямым токсическим эффектом алкоголя на мегакариоциты, что приводит к снижению производства, времени выживания и функции тромбоцитов [44, 45]. Ряд лекарственных средств, используемых в терапии заболеваний печени (азатиоприн, β-лактамные антибиотики и фторхинолоны, интерферон), потенциально могут вызывать лекарственно-индуцированную ТП, оказывая как прямое миелосупрессивное действие, так и иммуноопосредованное разрушение тромбоцитов. До недавнего времени схемы лечения пациентов с HCV (Hepatitis C Virus) включали интерферон, частым побочным эффектом которого является дозозависимая ТП, интерферон-индуцированная миелотоксичность и цитопения становились частой причиной прекращения терапии [2, 46].
Еще одним доказанным патогенетическим механизмом развития ТП являются аутоиммунные нарушения. Среди пациентов с хроническими заболеваниями печени различной этиологии до 64% имеют антитромбоцитарные антитела, которые в основном направлены против комплекса гликопротеина IIb-IX [47]. Наиболее часто иммуно-опосредованная ТП встречается при HCV, бактериальных и лекарственных поражениях печени. Аутоиммунные заболевания печени (аутоиммунный гепатит и первичный билиарный холангит – ПБХ) часто ассоциируются с другими аутоиммунными состояниями. Около 50% пациентов с ПБХ страдают по меньшей мере одним дополнительным аутоиммунным заболеванием, которое может включать ИТП [48].
Некоторые этиологические факторы поражения печени имеют собственные механизмы, влияющие на уровень тромбоцитов. Так, было показано, что HCV-инфекция может приводить к появлению ТП у пациента до появления стадии цирроза и гиперспленизма. Более 20 лет назад появились работы, свидетельствующие об ассоциации HCV и ТП [49–51]. До 30% пациентов с ИТП без признаков прогрессирующего заболевания печени серопозитивные по HCV [52]. Хроническая инфекция HCV может приводить к ТП с помощью различных механизмов [53], один из которых – прямое подавление костномозгового кроветворения [54]. Пациенты с HCV демонстрируют депрессию тромбоцитов даже в отсутствие спленомегалии [55] и нормализации уровня тромбоцитов после успешного лечения инфекции [56]. Известно, что хроническая HCV-инфекция связана с множеством аутоиммунных нарушений, около 40% пациентов с HCV-инфекцией имеют по меньшей мере одно иммуноопосредованное внепеченочное проявление в течение их болезни [57, 58]. Снижение уровня тромбоцитов при HCV коррелирует с тяжестью заболевания и сопровождается увеличением титров антитромбоцитарных Ig [49, 55]. Кроме того, HCV может напрямую взаимодействовать с тромбоцитами для связывания мембран тромбоцитов через множественные рецепторы клеточной поверхности, что в конечном итоге приводит к фагоцитозу тромбоцитов с антителом и ускоренному разрушению тромбоцитов ретикулоэндотелиальной системой [59].
Связывание HCV с тромбоцитами также может индуцировать образование антигенов на поверхности тромбоцитов или изменять свойства гликопродеидной мембраны тромбоцитов, что способствует формированию аутоантител, таких как GPIIb/IIIa, и последующему развитию ТП [60]. Наконец, HCV тесно связан с криоглобулинемией, а криоглобулины могут играть роль в формировании иммунных комплексов и развитии ТП [61].
Заключение
ТП представляет собой сложное и многофакторное явление, нередко встречающееся в практике врача-гастроэнтеролога. Глубокое понимание патофизиологии ТП в зависимости от причины ее возникновения имеет решающее значение при выборе стратегий лечения. Информированность специалистов о механизмах развития ТП при заболеваниях пищеварительной системы будет способствовать повышению успешности терапии.
Тромбоцитопении перераспределения
Если очень просто объяснить этот механизм, то он выглядит так: на фоне каких-то причин у больного увеличивается селезенка. И если в обычных условиях она хранит до 30% тромбоцитов, то в увеличенном состоянии задерживает до 90% этих клеток. При этом система не видит, что тромбоцитов недостаточно, и не запускает компенсаторный механизм.
В основе механизма также лежат разные причины: цирроз печени, некоторые инфекции вроде туберкулеза, аутоиммунные болезни (системная красная волчанка), опухоли кровеносной системы, алкоголизм.
Причины возникновения тромбоцитопении
Среди разных причин, вызывающих это серьёзное заболевание, основными считаются:
Тромбоцитопения разведения
Это состояние обычно наблюдается у людей, которым делают большое количество переливаний разных жидкостей: например, плазмы, плазмозаменителей и др. В результате уровень тромбоцитов снижается из-за банального разведения крови.
Учитывая огромное количество причин, которыми может быть вызвана иммунная тромбоцитопения (а мы назвали далеко не все варианты), пациент с ее симптомами должен немедленно обратиться к врачу, который найдет суть проблемы и назначит эффективное лечение.
Диагностика
Поскольку причин очень много, назвать детально диагностические мероприятия не представляется возможным — все будет зависеть от конкретной ситуации. Но можно выделить основные составляющие диагностики:
- Общий анализ крови.
- Проверка времени кровотечения (анализ по Дьюку).
- Определение времени, за которое сворачивается кровь.
- Пункция красного костного мозга. Метод позволяет выявить количественные и качественные изменения клеток.
- Определение в крови антител.
- Исследование на предмет генетических заболеваний.
- УЗИ внутренних органов. Чаще всего сразу изучаются печень и селезенка, но этот список может быть очень большим.
- МРТ. Используется для исследования внутренних органов и сосудов.
Диагностика заболевания начинается с посещения врача-терапевта, который по опросу, первичным обследованиям и анализам уже назначает посещение других специалистов.
Когда нужно сдавать анализ Агрегация тромбоцитов с адреналином?
- Перед назначением препаратов, оказывающих влияние на систему свёртывания.
- Дифференциальная диагностика заболеваний, сопровождающихся патологическими кровотечениями.
- В рамках комплексной оценки тромбоцитарного звена гемостаза у пациентов перед (обширной) операцией, а также у беременных женщин с высоким риском развития акушерских осложнений.
- Определение резистентности к лекарственным средствам из группы антиагрегантов.
- Выявление наследственных и приобретенных тромбоцитопатий.
Лечение и степени тяжести
Лечение тромбоцитопении чаще всего сводится к выявлению первичного заболевания и его лечению, а также к устранению различных неприятных симптомов. В процессе также важно учесть, что степени тяжести тромбоцитопении бывают разными:
Легкая степень. Предполагает, что концентрация тромбоцитов составляет от 50 до 150 тыс. единиц в микролитре. Состояние капилляров обычно нормальное, кровотечения не развиваются. Обычно на этом этапе лечение не нужно — врачи рекомендуют подождать и последить за развитием состояния пациента.
Средняя степень. В данном случае концентрация составляет 20-50 тыс. единиц тромбоцитов в микролитре. При таком условии наблюдаются кровоточивость десен, носовые кровотечения. Если случаются травмы и ушибы, образовываются серьезные кровоизлияния в кожу. На этом этапе может назначаться медикаментозная терапия.
Тяжелая степень. Концентрация тромбоцитов ниже 20 тысяч, кровоизлияния спонтанные и сильные. При этом сам пациент может чувствовать себя вполне комфортно, не жалуется на плохое самочувствие, но анализы показывают, что ему требуется помощь.
Поскольку лечение тромбоцитопении требует максимально тщательной и детальной диагностики, важно выбрать современную клинику, в которой вам помогут. АО «Медицина» в Москве — как раз то место, где вы сможете получить квалифицированную помощь лучших специалистов. В клинике есть все необходимое и для обследования, и для лечения каждого пациента.
Лечение тромбоцитопении
Лечением тромбоцитопении занимается гематолог. Сначала оценивается состояние пациента, изучается, насколько выражен геморрагический синдром.
- При легкой степени тяжести (50 000-150 000 тромбоцитов в мкл крови) стенки капилляров находятся в нормальном состоянии, поэтому кровь не выходит из сосудистого русла. Сильные кровотечения не развиваются. Следовательно, решить проблему можно без лекарственных средств. Осуществляется выяснение причины заболевания. Врач придерживается выжидательной тактики. Госпитализация больного не производится.
- При средней степени тяжести (25 000-50 000 тромбоцитов в мкл крови) наблюдаются кровоизлияния в слизистую ротовой полости, носовые кровотечения. При незначительных ушибах образуются большие кровоподтеки. Если есть риск развития кровотечений (наличие язвы желудка, занятие профессиональным спортом и др.), проводится медикаментозная терапия. Больной может проходить лечение в домашних условиях.
- При тяжелой степени тяжести тромбоципении (менее 20 000 тромбоцитов в мкл крови) возникают спонтанные кровотечения в слизистые рта, кожу. Проявляется геморрагический синдром. Обязательно назначение комплексной медикаментозной терапии. Пациента госпитализируют.
Лечение тромбоцитопении с помощью лекарственных средств
Медикаментозное лечение при любой форме тромбоцитопении направлено на:
- прекращение кровотечений;
- устранение причины;
- лечение болезни, вызвавшей проблему.
Обычно больным назначаются препараты:
- «Преднизолон»;
- «Интраглобулин», «Имбиогам»;
- «Револейд»;
- «Винкристин»;
- «Этамзилат»;
- «Депо-провера»;
- витамин В12.
Немедикаментозные методы лечения тромбоцитопении
Лечение тромбоципении может осуществляться с помощью терапевтических и хирургическим мероприятий. Наиболее часто гематологи прибегают к:
- Трансфузионной терапии. Больному переливают донорскую кровь (плазму или тромбоциты).
- Удалению селезенки. Селезенка — основной источник антител при иммунной тромбоцитопении и основное место разрушения тромбоцитов, поэтому иногда прибегают к ее полному либо частичному удалению. У большинства пациентов после удаления селезенки при тромбоцитопении состояние нормализуется, исчезают клинические симптомы заболевания.
- Пересадке костного мозга. Сначала пациенту назначают большие дозы противоопухолевых лекарственных препаратов, которые угнетают иммунную систему. Это делается для того, чтобы предотвратить реакцию иммунитета на введение костного мозга донора, а также разрушить опухолевые клетки, если речь об опухоли системы кроветворения.
Лечение тромбоцитопении при беременности
Тромбоцитопения у беременных требует грамотного лечения. Обычно будущим мамам назначают короткие курсы глюкокортикостероидов («Дексаметазон», «Преднизолон»). В третьем триместре они ускоряют созревание легких плода, что делает возможным досрочное родоразрешение.
Если глюкокортикостероиды оказываются неэффективными, внутривенно вводится иммуноглобулин. За всю беременность его используют три-четыре раза, после еще раз сразу после родов. В неотложных ситуациях прибегают к переливанию тромбоцитарной массы.
Если все принятые меры не позволяют устранить симптомы заболевания, во втором триместре селезенку удаляют (особенно часто к операции прибегают, если диагностирована тяжелая степень гестационной тромбоцитопении в первом триместре). В идеале хирургическое вмешательство должно быть проведено лапароскопическим доступом.
Вопрос о родоразрешении всегда решается в индивидуальном порядке. Тромбоцитопения в родах может привести к сильному кровотечению, поэтому врачи тщательно взвешивают все «за» и «против». Менее травматичной для женского организма считается операция кесарева сечения.
Лечение тромбоцитопении народными средствами
Лечение тромбоцитопении проводится с помощью листьев крапивы, тысячелистника, земляники. Травы заваривают кипятком и пьют в охлажденном виде по 1/4 стакана 3-4 раза в день.
Хорошо зарекомендовало себя кунжутное масло при тромбоцитопении. Его следует принимать по столовой ложке 3 раза в день.