Системное артериальное давление (АД) зависит от сердечного выброса и периферического сосудистого сопротивления. На величину систолического АД преимущественное влияние оказывают ударный объем левого желудочка, максимальная скорость изгнания крови из него и эластичность аорты. Диастолическое АД обусловлено общим периферическим сосудистым сопротивлением и частотой сердечных сокращений. Пульсовое давление, рассчитанное как разница между систолическим и диастолическим АД, отражает эластичность магистральных артерий. Оно повышается при атеросклеротическом поражении артерий. Классификация уровней АД представлена в таблице 1.
В группе больных АГ с низким и средним риском сердечно–сосудистых заболеваний лечение начинают с изменения образа жизни: – отказ от курения; – отказ от злоупотребления алкоголем; – низкосолевая диета; – регулярные физические упражнения на свежем воздухе; – при ожирении – снижение массы тела не менее чем на 5 кг.
Сроки наблюдения при низком риске составляют 1–6 мес., при среднем риске – 3–6 мес. В группе пациентов с высоким и очень высоким риском медикаментозное лечение начинают немедленно. У молодых людей АД необходимо снижать до 130/85 мм рт.ст., у пожилых – до 140/90 мм рт.ст. Некоторым категориям пациентов требуется еще более выраженное уменьшение АД. Например, при сахарном диабете его следует снижать до 130/80 мм рт.ст., при заболеваниях почек с протеинурией – до 125/75 мм рт.ст.
Лекарственная терапия считается оптимальной, если гипотензивное действие продолжается в течение суток и сохраняется физиологический циркадный ритм АД. Важным критерием эффективности считают нормализацию утреннего АД, так как в утренние часы чаще возникают инсульт и инфаркт миокарда. В 8 ч утра гипотензивное действие препарата, принятого вечером, должно составлять не менее 50% от максимального эффекта. Еще более информативным показателем риска сердечно–сосудистых осложнений является увеличенное пульсовое давление. Необходимо снижать как диастолическое, так и систолическое АД. Повышенное систолическое АД в 2–4 раза больше, чем диастолическое, повышает риск развития мозгового инсульта, ишемической болезни сердца и сердечной недостаточности.
В настоящее время для лечения АГ препаратами выбора являются диуретики, b–адреноблокаторы, ингибиторы ангиотензинпревращающего фермента (иАПФ), блокаторы рецепторов ангиотензина II (БРА), антагонисты кальция, a1–адреноблокаторы, агонисты имидазолиновых рецепторов.
Основные принципы антигипертензивной терапии
Антигипертензивные средства назначают в малых дозах, затем на протяжении недель дозу титруют до эффективной. Подобная тактика обеспечивает возможность подойти к терапии АГ индивидуально в каждом конкретном случае, с учетом особенностей патогенеза и сопутствующей патологии.
– При недостаточной эффективности монотерапии целесообразно использование оптимальных комбинаций препаратов, обладающих разным механизмом действия. – После нормализации АД антигипертензивные средства принимают в поддерживающих дозах.
Классификация
Средства, уменьшающие стимулирующее влияние адренергической иннервации на сердечно–сосудистую систему: 1. Агонисты имидазолиновых I1–рецепторов 2. Центральные a2–адреномиметики 3. Блокаторы рецепторов: • a–адреноблокаторы; • b–адреноблокаторы; • a,b–адреноблокаторы.
Вазодилататоры: 1. Блокаторы кальциевых каналов 2. Активаторы калиевых каналов 3. Артериолярные вазодилататоры 4. Артериолярные и венозные вазодилататоры.
Диуретики (мочегонные средства).
Средства, влияющие на функции ангиотензина II: 1. Ингибиторы ангиотензинпревращающего фермента (иАПФ) 2. Блокаторы АТ1–рецепторов ангиотензина II 3. Ингибиторы вазопептидазы.
Сосудодвигательный центр продолговатого мозга регулирует АД при участии пресинаптических рецепторов – имидазолиновых I1–рецепторов и a2–адренорецепторов. Эти рецепторы, стабилизируя пресинаптическую мембрану, препятствуют выделению норадреналина к прессорным нейронам, что сопровождается снижением центрального симпатического тонуса и ростом тонуса блуждающего нерва. Основное значение в поддержании нормального АД имеют I1–рецепторы, локализованные в вентролатеральном ядрах продолговатого мозга; меньшую роль играют a2–рецепторы ядра солитарного тракта. Вероятный эндогенный лиганд имидазолиновых рецепторов – декарбоксилированный метаболит аргинина агмантин.
Агонисты имидазолиновых I1–рецепторов
Препараты, относящиеся к данной группе – моксонидин, рилменидин стимулируют имидазолиновые рецепторы, что приводит к торможению активности сосудодвигательного центра и симпато–адреналовой системы. Снижается периферическое сопротивление сосудов, сердечный выброс и как результат – АД.
Следует помнить, что агонисты имидазолиновых рецепторов могут усилить брадикардию и торможение атрио–вентрикулярной проводимости при их совместном использовании с b–адреноблокаторами.
Несмотря на то, что агонисты имидазолиновых рецепторов эффективно контролируют АД, терапевтические возможности этой группы препаратов (влияние на прогноз больных АГ, рациональное комбинирование с другими препаратами) требуют дальнейшего изучения.
a1–адреноблокаторы
Механизм антигипертензивного действия a1–адреноблокаторов (празозина, доксазозина) заключается в конкурентной блокаде a1–адренорецепторов гладкомышечных клеток сосудов, что препятствует избыточной стимуляции этих рецепторов катехоламинами. Происходит снижение периферического сопротивления сосудов и падение АД.
Важным свойством a1–адреноблокаторов является их благоприятное влияние на липидный профиль (повышение содержания антиатерогенных липопротеинов высокой плотности, снижение атерогенных липопротеинов низкой плотности и триглицеридов). При применении a1–адреноблокаторов высок риск развития гипотонии первой дозы, компенсаторной тахикардии, учащения мочеиспускания (a1–адренорецепторы подтипа А располагаются в простатической части уретры).
b–адреноблокаторы (ББ)
ББ нивелируют влияние симпато–адреналовой системы на сердце, что ведет к снижению частоты сердечных сокращений и сократимости, причем параметры кардиальной деятельности сохраняются на уровне, достаточном для обеспечения полноценной гемодинамики (при условии правильного подбора дозы).
Помимо этого, ББ уменьшают активность РААС, блокируя гиперактивность юкстагломерулярного аппарата почек, снабженного b1–адренорецепторами. В результате снижается синтез ренина, являющегося инициальным звеном РААС. Таким образом, ББ вносят вклад в редукцию общего количества ангиотензина II – мощнейшего вазопрессора. Резкая отмена ББ может привести к компенсаторному усилению синтеза ренина, что лежит в основе развития синдрома отмены, поэтому при терапии ББ необходимо добиться строгого приема этих препаратов больными.
Считается, что под влиянием ББ восстанавливается нормальная функция барорецепторного аппарата синокаротидной зоны, что вносит вклад в антигипертензивный эффект. Кардиоселективные b1–адреноблокаторы (бисопролол, метопролол, атенолол и др.) не редуцируют периферический кровоток, поскольку практически не влияют на b2–рецепторы, что важно при лечении лиц с облитерирующими заболеваниями артерий. В настоящее время в большинстве случаев именно им отдают предпочтение из–за более плохой переносимости неселективных ББ (высокий риск бронхоспазма, снижение мышечного кровотока). Кардиоселективные ББ незначительно влияют на углеводный и липидный обмен, что позволяет использовать их при сахарном диабете и распространенном атеросклерозе.
Наличие так называемой внутренней симпатомиметической активности (ацетобутол, оксипренолол, пиндолол и др.) говорит о меньшем влиянии на частоту сердечных сокращений в покое и о способности этих препаратов расширять просвет периферических артериол, способствуя увеличению объема сосудистого ложа и снижению АД.
Широкое применение нашли адреноблокаторы с дополнительными вазодилатирующими свойствами. Так, карведилол блокирует не только b1– и b2–рецепторы, но и a1–рецепторы периферического сосудистого русла, что аддитирует гипотензивное действие. Вазодилатирующий эффект небиволола обусловлен способностью этого препарата увеличивать количество оксида азота (NО) – мощного местного вазодилататора. Названные препараты используют у пациентов с периферическим атеросклерозом.
ББ при терапии АГ можно отдать предпочтение при сопутствующей синусовой тахикардии, ИБС, ХСН, наджелудочковых тахиаритмиях. Свойства ББ рационально использовать при наличии у больного гипертиреоза (купирование тахикардии), глаукомы (снижение продукции внутриглазной жидкости), мигрени (профилактика приступов), гипертрофической кардиомиопатии. При нарушении функции печени рационально назначение гидрофильных b–адреноблокаторов (атенолол, ацебутолол, бисопролол), которые выводятся из организма почками. В случае, если пациент является курильщиком, то дозы жирорастворимых ББ должны увеличиваться, поскольку у этой категории больных повышается активность ферментных систем печени. У больных с сопутствующей хронической почечной недостаточностью желательно использовать липофильные ББ (пиндолол, лабетолол, тимолол, метопролол, бетаксолол, талинолол и др.).
ВАЗОАКТИВНЫЕ ПРЕПАРАТЫ
На адренергические рецепторы межнейронных синапсов вазомоторных центров ствола действуют центральные антигипертензивные средства, которые снижают центральную симпатическую активацию и тем самым препятствуют повышению артериального давления (АД). К ним относят: агонисты a2-пресинаптических рецепторов — клонидин, метилдопу, гуанфацин; центральный симпатолитический препарат резерпин и другие препараты раувольфии (эти ВП действуют так же как и периферические симпатолитики). Основным показанием для применения этих средств является гипертоническая болезнь. Клонидин применяют также для межприступного лечения мигрени, купирования приливов в период менопаузы и сердечно-сосудистого компонента абстинентного синдрома. Кроме того, клонидин уменьшает гиперкинезы при генерализованном тике. Препараты центрального действия могут вызывать седативный эффект (вялость, гиподинамия, сонливость, особенно в начале лечения), при длительном применении возможны снижение памяти, либидо и нарушение эякуляции. Заложенность носа, сухость во рту отмечаются чаще только в начале лечения. Метилдопа как ложный предшественник допамина уменьшает его синтез, а резерпин как симпатолитик уменьшает его запасы, что может при длительном лечении усилить проявления паркинсонизма. При внезапной отмене клонидина особенно при сочетании его с b-блокаторами возможно развитие гипертонического криза. Ганглиоблокаторы
снижают АД, уменьшают ударный объем сердца и сопротивление периферических сосудов. Мозговой кровоток остается неизменным или несколько увеличивается, потому что цереброваскулярное сопротивление снижается больше, чем общее периферическое. В неврологической клинике ганглиоблокаторы применяют для контроля артериальной гипертензии у больных с кровоизлиянием в мозг, острой гипертонической энцефалопатией, в случае криза при хронической дисциркуляторной энцефалопатии. При разных типах вегетативно-сосудистой дистонии (ВСД) применение «мягких» (например, ганглерон) ганглиоблокаторов приводит к выравниванию нарушенного равновесия между симпатико- и парасимпатикотонией. Некоторые ганглиоблокаторы (гигроний, пентамин, бензогексоний) эффективны при отеке легкого. Побочное действие: наблюдаются ортостатические гипотензия, поэтому при парентеральном применении этих препаратов больные должны находиться 2-3 ч в постели. Возможны замедление моторики кишечника (редко паралитическая непроходимость кишечника), задержка мочеиспускания, мидриаз, нарушение аккомодации, дизартрия, дисфагия. Эти явления уменьшаются при назначении прозерина и карбахолина.
Периферические симпатолитики
(гуанетидин и др.) истощают запасы нарадреналина в терминалах нервно-гладкомышечного соединения, умеренно блокируют симпатические ганглии и стимулируют b2-рецепторы гладких мышц артерий. Гуанетидин снижает тонус сосудов мозга. Из-за высокого риска ортостатических осложнений применяется редко. Гуанетидин противопоказан при остром нарушении мозгового кровообращения (ОНМК), инфаркте миокарда, феохромоцитоме. Относительным противопоказанием к его применению служит хроническая дисциркуляторная энцефалопатия (ДЭП). Агонист a-рецепторов эрготамин оказывает выраженное вазотоническое действие как на артерии, так и на вены с исходно низким тонусом, уменьшает их кровенаполнение на 45%. Улучшению микроциркуляции способствует блокада патологического артериовенозного шунтирования. Наиболее часто эрготамин применяют для лечения больных, страдающих приступами мигрени. При передозировке эрготамина (более 8-10 мг/сут) развивается острый эрготизм: рвота, понос, парестезии, судороги. При длительном приеме препарата средней терапевтической дозе развивается хронический эрготизм с расстройством периферического кровообращения в связи со спазмом сосудов. Как редкое осложнение описывают ишемические некрозы мягких тканей пальцев стопы. Эрготамин противопоказан при гипертонической болезни, атеросклерозе, стенокардии, склерозе периферических артерий, заболеваниях печени и почек. Свойствами a-адренергического агониста обладает и дигидроэрготамин, однако он действует мягче, чем эрготамин.
a-Адренергические блокаторы
тормозят на разных уровнях передачу симпатической иннеравации по a-адренергическим системам, блокируют a-рецепторы гладких мышц артерий. В результате снижается тонус гладких мышц артерий, что приводит к уменьшению уровня АД, особенно в случае начальной гипертонии артерий. Показания: артериальная гипертензия и регионарная гипертония в русле органных артерий при ВСД, ДЭП и ОНМК. Оказывают регулирующее влияние на энергетический обмен в головном мозге. Побочное действие: головокружение, ортостатическая гипотензия, головная боль, общая слабость, сонливость, боли в области сердца, учащенное мочеиспускание. Наблюдаются обычно при индивидуальной передозировке, особенно в начале лечения («эффект первой дозы»), проходят при снижении дозы и отмене препарата.
b-Адренергические блокаторы
ингибирут b-рецепторы в ЦНС, нервных окончаниях, гладких мышцах сосудов и бронхов. Неселективные b-блокаторы взаимодействуют с b1- и b2-рецепторами, а кардиоселективные — с b1-рецепторами сердца. Препараты этой группы с высокой липофильностью (алпренолол, метопролол, окспренолол, пропранолол) хорошо проникают через гематоэнцефалический барьер, уменьшают беспокойство, возбуждение, страх, купируют сердечно-сосудистые и вегетативно-соматические расстройства, вызываемые стрессом, снижают АД, нормализуют показатели ЭЭГ. b-Блокаторы замедляют ритм сердца, уменьшают силу сокращений миокарда, снижают потребление кислорода миокардом, угнетают автоматизм предсердно-желудочкового узла и эктопические очаги возбуждения миокарда, повышают переносимость физической нагрузки. Они улучшают показатели тонуса и реактивности сосудов мозга. Эти препараты дают выраженный гипотензивный эффект при артериальной гипертензии гиперкинетического типа. Показаниями к применению b-адренергических блокаторов в неврологической клинике являются ВСД, в том числе симпатоадреналовые кризы, идиопатическая ортостатическая гипотония, мигрень, ДЭП с артериальной гипертензией. При лечении препаратами этой группы снижаются смертность больных со спонтанным субарахноидальным кровоизлиянием и ишемическим инсультом, частота рецидивов ишемического инсульта и осложняющего его инфаркта микарда. Оказывают седативное действие, купируют гемодинамические сдвиги, сопровождающие психоэмоциональный стресс, уменьшают дрожательный гиперкинез, вызванный волнением. Эффективны при лечении больных с абстинентным синдромом. Побочные явления: брадикардия, стенокардия, нарушение предсердно-желудочковой проводимости до полной блокады серца, левожелудочковая недостаточность и отек легких, кардиогенный или анафилактический шок. Неселективные препараты вызывают и усиливают бронхоспазм. При применении блокаторов с симпатомиметической активностью (окспренолол, пиндолол, алпренолол) такие осложнения встречаются реже. Расстройства функций нервной системы (бессонница, тревожные сновидения, галлюцинации или депрессия, мышеные боли или усталость) наблюдаются в 3-15% случаев. Возможно появление признаков миотонии и нарастание признаков миастении. Более редкие осложнения — фиброз легких и плевры, блефариты, конъюнктивиты, анорексия, гастралгия. Из-за частых осложнений прекращено применение практолола. Противопоказания к применению: выраженная сердечная недостаточность, брадикардия, нарушения синусового ритма, бронхиальная астма, перемежающаяся хромота; относительные противопоказания: умеренная сердечная недостаточность, обструктивные заболевания легких, депрессия, гипотиреоз, заболевания печени и почек, диабет (неселективные b-блокаторы пролонгируют эффект инсулина). При внезапном прекращении приема этих препаратов возможен синдром отмены: ухудшение коронарного кровоснабжения, боли в области сердца, аритмия, повышение АД. Свойствами a- и b-
блокаторов
обладает лабеталол, «гибридный» блокатор. Показания к его применению определяются комбинацией этих свойств. Установлена эффективность препарата при лечении синдрома «гипертензия-тахикардия», развивающегося после множественных комбинированных травм. Побочное действие связано с блокадой как a-рецепторов — ортостатические эпизоды, головокружение, шум в ушах, нарушение мочеиспукания и эякуляции (без снижения либидо, эрекции, с сохранением оргазма), так и b-рецепторов — бронхообструкция, перемежающаяся хромота, болезнь Рейно, депрессия с нарушением сна.
Антагонисты серотониновых рецепторов
(кетансерин, ритансерин), действующие преимущественно на ЦНС, применяют для лечения заболеваний с ангиоспазмами периферических артерий — болезни Рейно и перемежающейся хромоты. Ципрогептадин, пизотифен, инпразохром назначают для межприступного лечения мигрени. Ингибиторы ангиотензин-превращающего фермента (ИАПФ) тормозят образование прессорного пептида — ангиотензина II. ИАПФ применяют при всех видах артериальной гипертензии, особенно реноваскулярного генеза, застойной сердечно-сосудистой недостаточности, ангиоспастической форме болезни Рейно, ДЭП с артериальной гипертензией или застойной сердечной недостаточностью. При этих формах ИАПФ более эффективны, чем симпатолитики, действующие на симпатические окончания, a-блокаторы и антагонисты кальция. Комбинация ИАПФ с другими антигипертензивными средствами, в том числе с антагонистами кальция, b-блокаторами и диуретиками повышает их фармакотерапевтическую эффективность. Нестероидные противовоспалительные средства (НСПВС), особенно индометацин, снижают антигипертензивное действие ИАПФ. Однако следует отметить, что прием ацетилсалициловой кислоты в качестве антиагреганта (в дозе 100-300 мг) не влияет на эффективность ИАПФ.
Средства, действующие преимущественно на гладкие мышцы
сосудов в зависимости от влияния на ферментные системы: аденилатциклазу (АЦ), фосфодиэстеразу (ФДЭ) относят к разным фармакологическим классам. В практике именно эти средства преимущественно миотропного действия чаще и называют вазоактивными препаратами («спазмолитики», «сосудистые» миолитики).
Производные изохинолина
— папаверин и дротаверин — осуществляют свое действие путем активации АЦ и торможения ФДЭ в гладкомышечных клетках сосудов и оказывают умеренное ганглиоплегическое действие. Папаверин расширяет артерии и вены. Последнее может ухудшить венозный отток из полости черепа, что при исходно сниженном тонусе вен можно рассматривать как неблагоприятный эффект. Дротаверин же не снижает тонуса вен.
Производные викамина
(алкалоида растений семейства барвинка) — винпоцентин. Этот препарат в большей мере активирует АЦ и умеренно тормозит ФДЭ. Винпоцетин избирательно улучшает гемодинамику головного мозга и может рассматриваться как «оптимизатор» сосудистого тонуса, оказывая избирательное антиспастическое действие на сосуды головного мозга, либо восстанавливает тонус сосудов в случае его исходного снижения. Препарат нормализует реологические свойства крови и улучшает микроциркуляцию. Винпоцетин оказывает прямое нейрометаболическое церебропротективное действие, обладает антигипоксическим и противопароксизмальным эффектом. Важной особенностью винпоцетина является отсутствие влияния на показатели системной гемодинамики и отсутсвие синдрома «обкрадывания». Винпоцетин применяют как при начальных так и при выраженных формах цереброваскулярной недостаточности, при транзиторной ишемии головного мозга, при всех формах и стадиях инсульта (за исключением острой фазы геморрагического инсульта), вазовегетативных расстройствах (в том числе эндокринного генеза),. а также для профилактики судорожного синдрома у детей, перенесших черепно-мозговую травму.
Производные ксантина
— кофеин, теобрамин, теофиллин, эуфиллин, пентоксифилин — тоже можно рассматривать как «оптимизаторы» тонуса сосудов, но у них более отчетливо прослеживается венотонический эффект (улучшение оттока венозной крови из полости черепа). Кроме того, эти препараты активируют дыхание, увеличивают частоту сердечных сокращений (ЧСС), диурез. Эти ВП улучшают реологические свойства крови.
Антагонисты кальция
(блокаторы каналов Са2+) обладают способностью оказывать спазмолитическое, антигипертензивное, коронаролитическое действие. Группа фенилалкиламинов представлена верапамилом, фендилином, дифрилом. Группа дигидропиридинов включает нифедипин, форидон, никардипин, нитрендипин, исрадипин, нимодипин. Среди этих ВП можно выделить адалат в капсулах (жидкая лекарственная форма) и таблетках, который способен давать быстрый антигипертензивный эффект, и нимодипин, который в большей степени по сравнению с другими антагонистами Са2+ действует на мозговые артерии.
Периферические вазодилататоры
— гидралазин, натрия нитропруссид, милсидомин, миноксидил — оказывают выраженное периферическое спазмолитическое действие, снижают тонус вен, уменьшают венозный возврат к сердцу. В неврологической практике применяются редко.
Применение вазоактивных препаратов при лечении ВСД
ВП применяются на фоне соблюдения норм здорового образа жизни, лечения транквилизаторами или антидепрессантами. Больным с ВСД при стойких проявлениях системной гипертензии и гипертонии артерий назначают средства, тормозящие центральную симпатическую активацию (клофелин, метилдопа, резерпин), ганглиоблокаторы, a- и b-адренергические блокаторы. Для регуляции регионарного сосудистого тонуса применяют миотропные спазмолитики, препараты барвинка, дибазол, a-блокаторы, антагонисты кальция. При системной гипотензии и регионарной гипотонии назначают эрготамин и содержащие его препараты, другие симпатомиметики — эфедрин, фетанол, фенилэфрин (мезатон), а также анаболические и стероидные гормоны. В случае преимущественной гипотонии вен показаны препараты ксантинового ряда, барвинка, a-стимуляторы. При смешанных формах ВСД эффективны комбинированные препараты — беллатаминал, беллоид, белласпон. Во всех случаях оказываются полезными средства, улучшающие обменные процессы в ЦНС: аминалон, пиридитол, пирацетам, витаминотерапия (В1, В6, С, РР). Из средств нелекарственного лечения используют иглорефлексотерапию и разные методы физиотерапии.
Применение вазоактивных препаратов при лечении ДЭП
ДЭП — медленно прогрессирующая недостаточность кровоснабжения головного мозга, сопровождающаяся мелкоочаговыми изменениями мозговой ткани. Основными этиологическими факторами ДЭП являются гипертоническая болезнь и атеросклероз, системные заболевания сосудов, особенно поражающие дугу аорты и отходящие от нее магистральные сосуды головы. В подавляющем большинстве случаев прогрессирование ДЭП происходит при эпизодах декомпенсации мозгового кровообращения. При интенсивной терапии криза, связанного с повышением АД, выбор гипотензивных средств должен быть адекватным тяжести криза (отдается предпочтение быстродействующим средствам); не следует снижать АД ниже уровня, привычного для больного; необходимо выбрать способ введения лекарства, который обеспечивает быстрое, но плавное и контролируемое снижение АД (обычно внутривенное капельное вливание) и учесть возможный побочный эффект быстродействующих средств; максимально снизить риск развития осложнений. ВП выбирают в зависимости от типа церебральной ангиодистонии. При гипертонусе артерий назначают средства с преобладанием спазмолитического действия, при явлениях дистонии и гипотонии церебральных артерий и вен отдается предпочтение винпоцетину, эуфиллину, тренталу. Ишемический церебральный криз
у больных ДЭП на фоне атеросклероза развивается по типу недостаточности мозгового кровообращения. Она может явиться результатом снижения насосной функции сердца и снижения АД, повышения вязкости крови, повышения активности свертывающей системы. В этих случаях эффективно добавление к проводимой терапии небольших доз сердечных гликозидов (коргликон). При кризе на фоне гиперкоагуляции показано введение гепарина. Из антикоагулянтов непрямого действия отдают предпочтение тем, которые обнаруживают меньшую тенденцию к кумуляции: синкумар, пелентан, фенилин. При длительном (многомесячном) назначении ВП для лечения ДЭП вне обострения эффективные лекарства подбирают индивидуально. К сожалению, на практике это означает эмпирический подход (методом «проб и ошибок»). При наличии условий можно рекомендовать выбор индивидуально оптимального ВП с помощью острого фармакологического теста. Он заключается в последовательном введении 1 раз в сутки терапевтических доз каждого из тестируемых вазоактивных средств (скрининг). При этом после внутривенного введения лекарства наблюдают за состоянием больного и в течение 1 ч проводят синхронную регистрацию АД, пульса, РЭГ, ЭЭГ. Каждый из других тестируемых ВП вводят на следующие сутки. Для терапии выбирают препарат, который при острой пробе вызвал наиболее благоприятные сдвиги регистрируемых показателей. Такие исследования можно провести в кабинете функциональной диагностики. Фармакотерапия средствами индивидуального выбора повышает эффективность лечения и сокращает его сроки.
Применение вазоактивных препаратов при лечении ОНМК
В задачу настоящей статьи не входит подробное описание интенсивной терапии геморрагического и ишемического инсульта. Применение ВП в составе комбинированного лечения ОНМК, безусловно, не имеет решающего значения. Монотерапию ВП в острой стадии ОНМК нельзя считать адекватной, ВП должны сочетаться с другими средствами патогенетического лечения; в острой фазе ОНМК эффективным следует считать парентеральное введение ВП, в суточной программе интенсивной терапии их повторное введение должно осуществляться в зависимости от продолжительности действия однократной дозы (для большинства ВП 3 раза в сутки). В первые дни после отмены ОНМК в связи с утратой или снижением сосудистой реактивности введение ВП может не сопровождаться изменением клинического состояния, электрофизиологических показателей. Отсутствие этих признаков не свидетельствует о неэффективности ВП. Оценке активности ВП способствуют их введение в промежутках между введением других средств патогенетической терапии и динамическое наблюдение их влияния на состояние больного и синхронно регистрируемые АД, ЧСС, ЭКГ, РЭГ и ЭЭГ. В ходе выбора оптимального препарата в первые дни после ОНМК оправдан скрининг ВП; в острейшей стадии для получения более быстрого эффекта оправдано введение в вену ВП в единой капельной системе с кардиотоническими, противоотечными (дегидратирующими), гемореологическими препаратами, средствами для гемодилюции, антифибринолитиками и антикоагулянтами. При проведении комплексной интенсивной терапии следует избегать одновременного введения средств с противоположными фармакодинамическими свойствами, введения средств со сходным фармакодинамическим эффектом (из-за непредсказуемости потенцирующего действия) или несовместимых лекарственных средств (например, гепарин + кавинтон). Выявление «зоны полутени» на компьютерной или магнитно-резонансной томограмме (перифокального участка с перфузией мозга на дофункциональном уровне) служит основанием для продолжения интенсивной терапии ВП и другими средствами комбинированного патогенетического лечения. Таким образом, применение ВП в комплексной терапии инсульта следует считать не только оправданным, но и необходимым. При этом оценка их действия не должна ограничиваться выявлением только вазомоторного эффекта. Каждое из средств этого фармакологического класса обычно улучшает кровообращение и функциональную активность мозга, поскольку, хотя и в разной степени, ВП дают опосредованный (через улучшение кровообращения, защиту от ишемии) и прямой ноотропный эффект благодаря нормализации метаболизма пораженного мозга.
Литература:
1. Машковский М.Д. Лекарственные средства, в 2 частях, часть I — М.: Медицина, 1993 297-340, 369-370, 502-560. 2. Шток В.Н Лекарственные средства в ангионеврологии. — М.: Медицина, 1984; 303 с. 3. Шток В.Н. Фармакотерапия в неврологии. М.: Медицина, 1995; 10-28, 81-107. 4. Справочник Видаль. Лекарственные препараты в России. М.: АстраФармСервис, 1997.
Антагонисты кальция (блокаторы медленных кальциевых каналов)
Согласно классификации по В. Nаuler все антагонисты кальция (АК) делятся на 3 группы: производные дигидропиридинов (нифедипин, исрадипин, амлодипин и др.), бензотиазепинов (дилтиазем), фенилалкиламинов (верапамил). АК ограничивают поступление ионов Са2+ в клетку, снижая способность мышечного волокна развивать сокращение. Вследствие ограничения поступления ионов Са2+ в клетку развиваются 3 основных эффекта, в той или иной степени свойственных всем АК: снижение сократимости миокарда (отрицательный инотропный эффект), уменьшение тонуса гладкой мускулатуры артерий (вазодилатирующий эффект), изменение порога возбуждения кардиомиоцитов проводящей системы (характерно для пульс–урежающих АК – верапамила и дилтиазема). Известно, что дигидропиридиновые АК могут повышать частоту сердечных сокращений, особенно на начальном этапе лечения.
АК снижают тонус артериол, с чем в основном и связано их антигипертензивное действие. За счет этого параллельно увеличивается почечный кровоток, что обеспечивает небольшой натрийуретический эффект, дополняемый уменьшением образования альдостерона под воздействием АК. Блокирование ионов Са2+ на уровне тромбоцитов приводит к снижению их агрегационной готовности.
Будучи высоко активными средствами, АК обладают целым рядом преимуществ, который нередко называют «метаболической нейтральностью»: препараты группы не влияют на липидный, углеводный, минеральный и пуриновый обмен. Поскольку АК улучшают коронарный и церебральный кровоток, их применение обосновано при АГ с сопутствующей ИБС или цереброваскулярной недостаточностью.
Антагонисты кальция[править | править код]
При электрическом возбуждении клеточной мембраны кардиомиоцитов или гладкомышечных клеток происходят изменения ионных потоков, в том числе поступление кальция. Антагонисты кальция блокируют его поступление в клетку, при этом не влияя на приток натрия или отток калия. Эти препараты иначе называют блокаторами входа кальция или блокаторами кальциевых каналов. Антагонисты кальция по терапевтическому действию делятся на две группы: действующие на сердце и действующие на сосуды.
I. Производные дигидропиридина
. Дигидропиридины, например нифедипин, являются незаряженными гидрофобными веществами. Они расслабляют стенки артерий и в терапевтической дозе практически не влияют на функцию сердца (в эксперименте на изолированном сердце оказывают явное воздействие). Эти препараты называют вазоселективными антагонистами кальция. Расширение сосудов и снижение периферического сосудистого сопротивления приводят к понижению АД. Уменьшается постнагрузка на сердцеи потребление кислорода. Предупреждается развитие коронароспазма.
Показанием
для назначения нифедипина является не только профилактика, но и купирование приступов стенокардии.
Побочные эффекты
: сердцебиение (рефлекторная тахикардия из-за снижения АД), головные боли, а также отеки голеней.
Другие производные дигидропиридина обладают похожим действием и отличаются фармакокинетическим поведением (более медленное выведение) и более стабильной концентрацией в крови.
Нитрендипин, исрадипин и фелодипин применяют для лечения гипертонии. Никардипин и нисолдипин назначают при стенокардии. Нимодипин препятствует спазму сосудов после субарахноидального кровоизлияния. Амлодипин содержит протонированный азот в боковой цепи и поэтому может находиться в катионной форме (т. е. нести положительный заряд), что объясняет очень большое время его полувыведения (t1/2=40ч).
II. Верапамил и другие катионные амфифильные антагонисты кальция
. Верапамил при физиологическом значении pH имеет положительный заряд на атоме азота и представляет собой катионную амфифильную молекулу. Он оказывает действие не только на гладкие мышцы, но и на сердце. Поступление кальция обуславливает деполяризацию в синусовом узле сердца (электрическое возбуждение), в атриовентрикулярном узле (проведение возбуждения из предсердия в жулудочки), а также в кардиомиоцитах (электромеханическая работа). Поэтому верапамил обладает отрицательным хронотропным, дромотропным и инотропным действием.
Показания
. Верапамил является анти-аритмическим средством и показан при суправентрикулярных тахиаритмиях. При мерцании и трепетании предсердий он тормозит проведение импульса через АВ-узел и ослабляет сокращения желудочка. Верапамил также применяют для профилактики стенокардии и лечения гипертонии.
Побочное действие.
Рефлекторная тахикардия в результате воздействия на синусовый узел не наблюдается; частота сердечных сокращений не меняется или может иметь место тенденция к брадикардии. Может развиваться АВ-блокада или сердечная недостаточность. Больные часто жалуются на запоры, так как верапамил блокирует активность кишечника.
Галлопамип (метокси-производное верапамила) по структуре и действию очень похож на верапамил.
Дилтиазем (производное бензодиазепина) представляет собой катионное амфифильное соединение и оказывает аналогичное верапамилу действие.
Диуретики
Механизм антигипертензивного действия диуретиков связан со способностью препаратов уменьшать объем циркулирующей жидкости, прежде всего за счет снижения реабсорбции ионов натрия в почечных канальцах. В результате уменьшения нагрузки жидкостью снижается общее периферическое сопротивление сосудов и уровень АД. Гипотензивное действие диуретиков дополняется способностью этих препаратов уменьшать чувствительность стенки сосудов к естественным вазопрессорам (в том числе адреналину), в поддержании которой участвуют ионы натрия.
Наибольшее распространение в качестве антигипертензивных средств получили тиазидные и тиазидоподобные диуретики: гидрохлортиазид, хлорталидон, индапамид и др. Петлевые диуретики применяют лишь для купирования гипертонических кризов. Длительный прием любых диуретиков опасен развитием электролитного дисбаланса, поэтому при их назначении рекомендуется мониторинг содержания электролитов в плазме крови. При использовании тиазидных и тиазидоподобных диуретиков ежедневно в малых дозах риск осложнений терапии минимизируется без существенной потери необходимого гипотензивного действия.
Тиазидным и тиазидоподобным диуретикам можно отдать предпочтение при изолированной систолической АГ у лиц старшего возраста, при сопутствующей ХСН, женщинам с АГ в перименопаузальном периоде. Диуретиками удобно дополнять уже назначенные схемы лечения для достижения целевого уровня АД.
Газета «Новости медицины и фармации» 3-4(269-270) 2009
Многоцентровые исследования последних лет показали, что β-адреноблокаторы и диуретики (по отдельности или в комбинации) в лечении пациентов с артериальной гипертензией (АГ) приводят к увеличению риска возникновения новых случаев сахарного диабета.
Это положение отображено в новых европейских (2007) и национальных (2008) Рекомендациях по лечению АГ, в которых указано, что β-блокаторы не следует назначать больным с сопутствующим метаболическим синдромом. Исключение составляют лишь вазодилатирующие препараты — небиволол и карведилол.
Кроме того, как известно, у большинства больных с АГ повышено общее периферическое сосудистое сопротивление сосудов. Поэтому при прочих равных условиях для длительной терапии у большинства больных как с метаболическим синдромом, так и без него является предпочтительным применение препаратов с вазодилатирующими свойствами.
Механизмы сосудорасширяющего действия у β-блокаторов различны: 1) выраженная внутренняя симпатомиметическая активность (ВСА) (пиндолол и целипролол); 2) блокада a 1 -адренорецепторов (карведилол и лабетолол); 3) высвобождение из эндотелиальных клеток оксида азота, обладающего вазодилатирующими свойствами (небиволол); 4) стимуляция β3-адренорецепторов (небиволол).
Механизм сосудорасширяющего действия вазодилатирующих β-адреноблокаторов имеет клиническое значение. Принято считать, что вазодилатирующие β-адреноблокаторы с выраженной ВСА не оказывают кардиопротективного действия. Поэтому их применение менее предпочтительно или даже опасно у больных с высоким риском, например у больных с ХСН или больных, перенесших инфаркт миокарда.
Поскольку в лечении АГ преимущество традиционно отдается кардиоселективным β-блокаторам и препаратам без ВСА, небиволол сегодня следует рассматривать как препарат выбора в данном классе для большинства пациентов с повышенным артериальным давлением.
Установлено, что сосудорасширяющее действие суперселективного β-адреноблокатора небиволола связано с влиянием препарата на систему аргинин — цитруллин — оксид азота (NO) в эндотелии сосудов. Исследования на животных, здоровых лицах и больных с АГ показали, что небиволол увеличивает экспрессию гена, ответственного за синтез NO-синтетазы, что приводит к увеличению образования и высвобождения оксида азота из эндотелиальных клеток. Клеточные механизмы сосудорасширяющего действия небиволола пока еще полностью не изучены. Предполагается несколько механизмов, за счет которых реализуется клинически значимое увеличение синтеза NO в эндотелии сосудов: путем стимуляции β2- и β3-адренорецепторов сосудов, путем стимуляции серотониновых рецепторов типа 5-HT1A или путем взаимодействия с механизмами, опосредуемыми эстрогеновыми рецепторами. Небиволол как вещество с доказанными антиоксидантными свойствами, по-видимому, также уменьшает инактивацию оксида азота свободными радикалами. В результате уменьшения деградации оксида азота увеличивается его биодоступность.
Сверхселективный β1-адреноблокатор, каковым является небиволол, оказывает минимальное блокирующее воздействие на β2-адренорецепторы и умеренное стимулирующее на β3-адренорецепторы, опосредующие, в частности, эндотелийзависимую вазодилатацию (в том числе в кавернозных телах полового члена), а также липолиз и термогенез в бурой жировой ткани. В результате небиволол (в отличие от атенолола, метопролола, бисопролола и карведилола) не вызывает эректильной дисфункции у мужчин с АГ. Препарат не способствует увеличению массы тела, оказывает положительное влияние на показатели липидного и углеводного обмена. Поэтому он может считаться β2-адреноблокатором первого ряда для длительного лечения сексуально активных мужчин, а также больных с метаболическим синдромом и СД 2-го типа, не говоря уже о больных с хроническим обструктивным заболеванием легких или периферическим атеросклерозом.
Таким образом, небиволол обладает пятью очень важными с клинической точки зрения свойствами, которые выделяют его среди доступных в настоящее время β-адреноблокаторов:
1) сосудорасширяющим действием;
2) максимальной в классе β1-селективностью;
3) отсутствием ВСА;
4) высокой липофильностью;
5) положительным влиянием на показатели липидного и углеводного обмена.
Кроме того, небиволол обладает антиоксидантным действием и тормозит агрегацию тромбоцитов. Ни один другой β-адреноблокатор не обладает всеми вышеперечисленными свойствами одновременно. Эти свойства принципиально отличают небиволол от всех других кардиоселективных β-блокаторов, которые с 2007 года получили название традиционных.
Очевидно, все вышеупомянутые свойства препарата обусловили его успешный выход на рынок США в 2008 году и появление ряда восторженных публикаций в американской научной прессе.
В заключение следует отметить, что существует 16 потенциальных стереохимических изомеров небиволола. Молекула оригинального препарата Небилет состоит из 10 (по 5 право- и левовращающих) изомеров в строго определенных пропорциях. Именно с этой точки зрения становится понятным, почему всеми вышеописанными свойствами обладает только оригинальный препарат и почему в повседневной клинической практике на других препаратах небиволола зачастую не удается достичь клинической эффективности, сопоставимой с Небилетом.
Лекарственные средства, влияющие на ренин–ангиотензиновую систему
Ренин–ангиотензин–альдостероновая система (РААС) играет важную роль в регуляции АД, сердечной деятельности, водно–электролитного баланса. Ее активность возрастает при артериальной гипертензии, хронической сердечной недостаточности и диабетической нефропатии. При остром инфаркте миокарда активность РААС повышается уже в первые сутки, при осложненном течении инфаркта миокарда чрезмерная активация РААС сохраняется длительно после выписки больного из стационара. Высокая активность ренина и повышенное содержание ангиотензина II в крови являются показателями неблагоприятного прогноза у пациентов с сердечно–сосудистыми заболеваниями.
Для фармакологической блокады РААС используют иАПФ и непептидные антагонисты рецепторов ангиотензина II.
Сосудорасширяющие препараты (вазодилататоры)[править | править код]
Источник:
«Наглядная фармакология»
.
Автор
: X. Люльман. Пер. с нем.
Изд.
: М.: Мир, 2008 г.
Просвет сосудов регулирует распределение крови в сосудистом русле. Просвет вен определяет приток крови к сердцу, а, следовательно, сердечный выброс и минутный объем сердца (МОС). Периферическое сосудистое сопротивление определяется просветом артерий. Минутный объем сердца и периферическое сосудистое сопротивление определяют величину артериального давления.
На рис. А представлены важнейшие вазодилататоры, порядок их расположения приблизительно соответствует частоте применения. Перечисленные лекарства по-разному воздействуют на артериальное и венозное русла.
Применение
. Артериальные вазодилататоры: понижение АД при гипертонии, уменьшение силы и частоты сердечных сокращений при стенокардии, уменьшение постнагрузки на сердце при сердечной недостаточности. Венозные вазодилататоры: уменьшение преднагрузки на сердце при стенокардии или сердечной недостаточности. Практическое применение отдельных препаратов рассмотрено далее по группам лекарств.
Контррегуляция при падении АД вследствие вазодилатации (Б). В результате активации симпатикуса повышается частота сердечных сокращений (рефлекторная тахикардия) и, соответственно, повышается минутный объем сердца (МОС). Больной жалуется на учащенное сердцебиение. Активация ренин-ангиотензин-альдостероновой (РАА) системы приводит к увеличению объема крови (наблюдается удерживание жидкости, возможны отеки) и МОС.
Пути контррегуляции блокируются различными препаратами бета-блокаторами, ингибиторами АПФ, антагонистами ангиотензина II, диуретиками).
Механизм действия[править | править код]
Существует много путей воздействия на тонус гладких мышц.
Защита от сужения сосудов
: ингибиторы АПФ, антагонисты рецепторов ангиотензина, а-адреномиметики защищают от воздействия гуморальных медиаторов, таких как ангиотензин и (нор)адреналин. Бозентан (см. ниже) является антагонистом рецепторов эндотелина, который может высвобождаться из эндотелия как сильное сосудосуживающее вещество.
Замещение сосудорасширяющих средств
: аналоги простациклина (илопрост) или простагландина E1 (алпростадил) действуют на соответствующие рецепторы, органические нитраты замещают N0 в эндотелии.
Прямое влияние на клетки гладких мышц сосудов
: Антагонисты кальция, действуя на уровне каналов, активаторы калиевых каналов (диазоксид, минок, сидил) вызывают деполяризацию мембран и расслабление гладких мышц. Ингибиторы фосфодиэстеразы (ФДЭ) тормозят разрушение внутриклеточного цАМФ, что понижает тонус сосудов. Существует много изоферментов ФДЭ с различной локализацией и функцией.
Нарушение эрекции.
Зилденафил, варденафил, тардапафил являются ингибиторами фосфориэстеразы ФДЭ-5 и способствуют эрекции. При сексуальном возбуждении в пещеристом теле полового члена из нервных окончаний высвобождается N0, что вызывает образование цГМФ в гладких мышцах сосудов. цГМФ разрушается в пещеристом теле под действием важного для этой ткани фермента ФДЭ-5, что препятствует эрекции. Блокаторы ФДЭ-5 «консервируют» цГМФ.
Легочная гипертония
. Речь идет о сужении легочного сосудистого русла неизвестного генеза. Заболевание часто прогрессирует, протекаете перегрузкой правого желудочка сердца и почти не поддается лечению сосудорасширяющими средствами. Пример нового терапевтического средства — антагонист эндотелина бозентан. Апробируется также ингаляционное введение N0.
Ингибиторы ангиотензинпревращающего фермента
Ингибиторы АПФ – группа лекарственных средств, влияющих на многочисленные патологические звенья, приводящие к функциональным и структурным изменениям, которые лежат в основе различных заболеваний сердечно–сосудистой системы. Механизм действия иАПФ заключается в связывании ионов цинка в активном центре ангиотензинпревращающего фермента – ключевого фермента РААС и блокировании реакции перехода ангиотензина I в ангиотензин II, что снижает активность РААС как в системном кровотоке, так и на тканевом уровне (почки, миокард, головной мозг). Параллельно, благодаря ингибированию АПФ тормозится деградация брадикинина, что также способствует вазодилатации. В результате происходит системная артерио– и венодилатация, снижается пред– и постнагрузка на сердце, при наличии гипертрофии миокарда левого желудочка начинается процесс ее обратного развития (кардиопротекция). Похожий процесс наблюдается в мышечном слое артериальных сосудов (ангиопротекция). Ингибиторы АПФ тормозят пролиферацию мезангиальных клеток в почках, что используется в нефрологии (нефропротекция). Уменьшение продукции альдостерона ведет к снижению реабсорбции натрия и воды в проксимальных и дистальных канальцах нефронов.
Ингибиторам АПФ отдают предпочтение при наличии у больного АГ сопутствующей ХСН, постинфарктного кардиосклероза, сахарного диабета и его осложнений (в том числе нефропатии). Способность иАПФ восстанавливать функцию эндотелия используется при наличии у пациента дислипидемии и диффузных атеросклеротических поражений. При назначении иАПФ следует откорректировать дозу других антигипертензивных средств (особенно тиазидных диуретиков), если больной их принимает. Снижение АД на фоне иАПФ в большинстве случаев происходит плавно, в течение нескольких недель. Несмотря на то, что иАПФ в большинстве случаев достаточно хорошо переносятся, всегда следует помнить о возможности развития следующих побочных реакций, характерных для этой группы препаратов: сухой кашель, гиперкалиемия и нарушение функции почек, ангионевротический отек (на любом сроке лечения).
Ингибиторы АПФ противопоказаны при беременности ввиду опасности тератогений, одно– или двустороннем стенозе почечных артерий, стенозе устья аорты, митральном стенозе, обструктивном варианте гипертрофической кардиомиопатии.
Облитерирующий атеросклероз артерий нижних конечностей в настоящее время занимает третье место по частоте органной локализации после поражения коронарных артерий и артерий головного мозга. Увеличение числа больных ставит данную патологию в ряд острейших проблем современной медицины, приобретая социальную значимость [9].
Кроме распространенного поражения артерий нижних конечностей, на эффективность восстановления кровообращения в конечности после реконструктивных операций влияет степень поражения микроциркуляторного русла в ишемизированных тканях. Несостоятельность капиллярного кровообращения является одним из ведущих факторов в развитии грубых трофических нарушений у пациентов с данной нозологией [10].
Поскольку при облитерирующих заболеваниях артерий нижних конечностей к критической ишемии мягких тканей и, как следствие этого, к потере конечности могут привести как нарушение кровотока по магистральным сосудам, так и необратимые изменения в микроциркуляторном русле, то изучение микроциркуляции периферических тканей в настоящее время является наиболее актуальным. При этом особую важность приобретает исследование микроциркуляции при тяжелых формах хронической артериальной недостаточности нижних конечностей [11].
Цель работы — оценка резервных возможностей периферического микроциркуляторного кровотока (МЦК) у пациентов с мультифокальным атеросклерозом в зависимости от стадии ишемии нижних конечностей.
Материал и методы
В исследование включены 118 мужчин (средний возраст 60,8±0,9 года) с мультифокальным атеросклерозом, облитерирующим атеросклерозом артерий нижних конечностей, хронической ишемией нижних конечностей (ХИНК) IIБ—IV стадии по классификации Покровского—Фонтейна. Критерием исключения было наличие хронической венозной недостаточности, сахарного диабета.
Все больные были разделены на две группы: в 1-ю группу вошли 68 пациентов с ХИНК IIБ стадии, во 2-ю группу — 50 с ХИНК III—IV стадии. Средний возраст больных в 1-й группе составил 60,8±0,8 года, во 2-й группе 61,4±1,1 года. По возрасту и антропометрическим показателям группы были сопоставимы между собой.
У всех пациентов по данным ангиографии констатировано хирургически значимое поражение артерий нижних конечностей. Все пациенты поступили в ФГБУ ННИИПК им. акад. Е.Н. Мешалкина Минздравсоцразвития России на плановое хирургическое лечение в объеме прямой и непрямой реваскуляризации. До хирургического лечения больным была выполнена лазердопплеровская флоуметрия (ЛДФ) нижних конечностей с использованием функциональных проб, целью которой было определение функционального состояния МЦК в зависимости от стадии ишемии нижних конечностей.
До хирургического лечения пациентам также выполняли общий клинический анализ крови, биохимический анализ крови с определением липидного состава, реологический анализ крови (протромбиновый индекс — ПТИ, время свертывания крови).
Регистрацию периферического МЦК нижних конечностей производили до операции с использованием лазердопплеровского флоуметра (США) с набором поверхностных датчиков типа R (rite angle) в комплексе с персональным компьютером. Исследование микроциркуляции выполняли в положении пациента лежа при температуре окружающей среды 24 °С и физическом покое с предварительным отдыхом в течение 15 мин на подошвенной поверхности ногтевой фаланги I пальца стопы. При изучении показателей ЛДФ определяли среднее арифметическое значение показателя микроциркуляции и его средне-квадратичное отклонение (СКО). Поскольку ЛДФ-грамма представляет собой суперпозицию большого числа различных колебательных процессов, совершаемых эритроцитами в исследуемых тканях, то величина СКО является другой важной характеристикой состояния тканевого кровотока, определяющей вариабельность микроциркуляции. Показатель СКО рассчитывали в каждом отдельном случае с последующим его усреднением.
Для оценки функционального состояния, а также определения реактивности и резервов микроциркуляторного русла применяли функциональные пробы, представляющие искусственно вызванную нагрузку на сосуды: окклюзионная и дыхательная. Данные пробы отражают патофизиологические нарушения при заболеваниях сосудов нижних конечностей.
Окклюзионная проба позволяет оценить функциональные резервы капиллярного русла, реактивность гладких мышечных клеток прекапиллярного звена [2, 6]. Для проведения окклюзионной пробы на область голени накладывали манжетку от аппарата для измерения артериального давления, в течение 1 мин осуществляли регистрацию исходного уровня кровотока, затем создавали окклюзию путем нагнетания давления в манжете до уровня 200 мм рт.ст. в течение 3 мин. После прекращения окклюзии запись ЛДФ продолжалась до полного восстановления микроциркуляции до исходного уровня. С помощью окклюзионной пробы оценивали резерв капиллярного кровотока (РКК), который в процентном отношении от исходного уровня показывает прирост кровотока в фазу постокклюзионной гиперемии: (МЦКмакс — МЦКфон) ×100%/МЦК фон, где МЦКфон — исходная величина микроциркуляторного кровотока; МЦКмакс — максимальное значение микроциркуляторного кровотока, зарегистрированное в период постокклюзионой гиперемии. Параметр МЦКмакс, регистрируемый после трехминутной окклюзии, характеризует степень сохранности NO-синтазного механизма вазодилатации [15] и составляет в норме, по мнению разных авторов [2, 4], около 300%.
Рассчитывали также время достижения МЦКмакс (с) с момента снятия окклюзии. Данный параметр характеризует реактивность микрососудов прекапиллярного звена [2]. Согласно данным литературы [7], значения МЦКмакс у здоровых лиц достигаются в первые 25—40 с после прекращения окклюзии.
Дыхательная проба служит для оценки функции рефлекторной активности симпатических волокон, поскольку известно, что глубокий вдох сопровождается активацией сосудосуживающих эфферентных симпатических волокон и снижением перфузии [8]. При проведении дыхательной пробы регистрировали фоновую величину объемной скорости кровотока (МЦКфон) в течение 1 мин, затем, не прерывая запись, реакцию МЦК в ходе 15-секундной задержки дыхания на высоте глубокого вдоха, после чего испытуемый делал выдох и постепенно восстанавливал спокойное дыхание в течение 1 мин. Результаты оценивали по двум параметрам — исходному фону МЦК в покое и уровню снижения МЦК при дыхательной пробе по отношению к исходному фону, выраженную в процентах — ΔМЦК. Реактивность кровотока при дыхательной пробе оценивали по формуле: ΔМЦК = МЦКмин / МЦКфон × 100%, где МЦКмин — минимальная величина МЦК, зарегистрированная в период глубокого вдоха, а МЦКфон — исходная величина МЦК. По данным литературы [2], у здоровых людей уровень МЦК кожи подушечки I пальца нижней конечности на высоте вдоха по отношению к исходному фону должен составлять около 40%.
Статистическую обработку данных проводили с помощью программного пакета Statistica 6.0. Результаты представлены в виде средних значений и ошибки среднего. Для определения различий между группами использовали t-критерий Стьюдента, для проведения корреляционного анализа — коэффициент Пирсона. Различия считали статистически значимыми при p<0,05.
Результаты
При анализе состояния периферического МЦК выявлено, что на пораженной конечности у больных 2-й группы МЦКфон был статистически значимо ниже, чем в 1-й группе (p<0,05), и составил менее 5 мл/100 г/мин. Следует отметить, что среднее СКО, характеризующее вариабельность кровотока, было также статистически значимо ниже в этой же группе пациентов (см. таблицу).
Проведение функциональной пробы позволяет оценить состояние резервных возможностей периферического МЦК. После прекращения окклюзии в норме в течение 1-й минуты должна наблюдаться гиперемическая реакция, которая обусловлена способностью сосудов микроциркуляторного русла к дилатации в ответ на ишемический стимул. В нашем исследовании гиперемическая реакция на первой минуте после окклюзии сосудов в 1-й группе наблюдалась чаще (41%; p<0,05), чем во 2-й группой (24%). Максимальный МЦК был статистически значимо больше у пациентов этой же группы. При этом у пациентов обеих групп МЦКмакс регистрировался только на 2-й минуте восстановления кровотока (94,0±6,0 и 91,8±10,8 с соответственно; p>0,05). Показатели РКК в 1-й группе больных в среднем были выше, чем во 2-й группе (p>0,05).
Таким образом, наиболее низкий резерв вазодилатации микрососудов и показатель вариабельности кровотока отмечался у пациентов 2-й группы с ХИНК III—IV стадии, в этой же группе частота выявления постокклюзионной гиперемической реакции в 1-ю минуту был ниже, чем в 1-й группе больных с ХИНК 2Б стадии.
При анализе дыхательной пробы, отражающей рефлекторное увеличение нейрогенного компонента базального тонуса сосудов, выявлено, что у пациентов 1-й группы на высоте вдоха МЦК на пораженной конечности составлял 51,1±3,9% от исходного, а это характеризует умеренное снижение реактивности микрососудов на симпатический стимул. При этом в данной группе у 2 (3%) пациентов отмечена парадоксальная реакция, выражающаяся в повышении уровня МЦК на высоте вдоха.
Во 2-й группе парадоксальная реакция отмечалась у 11 (22%) больных, в результате чего средние значения МЦК на высоте вдоха составили 158,0±43,3% от исходного и были статистически значимо больше, чем в 1-й группе (см. рисунок).
Рисунок 1. Показатели микроциркуляторного кровотока (МЦК) при пробе с задержкой дыхания. Исходный фон МЦК взят за 100% (пунктирная линия); *— p<0,05 при межгрупповом сравнении.
В 1-ю минуту восстановления показатели МЦК в процентах от исходного фона в 1-й группе приближались к первоначальному уровню, в то время как во 2-й группе МЦК оставался выше исходного и статистически значимо отличался от такового в 1-й группе (p<0,05).
При сравнительном анализе биохимических показателей крови с определением липидного состава статистически значимых различий между группами не выявлено. При этом липидный статус пациентов обеих групп был нарушен: в 1-й и 2-й группах содержание триглицеридов составило соответственно 1,88±0,11 и 1,92±0,23 ммоль/л, липопротеидов низкой плотности — 3,75±0,23 и 3,51±0,17 ммоль/л, коэффициент атерогенности — 4,95±0,24 и 4,72±0,29 отн. ед.
При сравнении показателей общего клинического анализа крови выявлено, что во 2-й группе пациентов с ХИНК III—IV стадии среднее содержание тромбоцитов статистически значимо выше, чем в 1-й группе (285,9±15,3 и 241,8±10,7% соответственно; p<0,05). По остальным показателям общего клинического анализа крови статистически значимых различий не выявлено. При сравнении реологического статуса крови статистически значимых различий между группами не выявлено. Среднее значение ПТИ в 1-й и 2-й группах составило 89,8±2,2 и 90,1±1,5% соответственно, время свертывания крови — 5,0±0,1 и 4,8±0,1 мин соответственно.
Таким образом, у пациентов 1-й группы с ХИНК IIБ стадии отмечено умеренное снижение реактивности микрососудов на симпатический стимул. У больных 2-й группы с ХИНК III—IV стадии выявлено нарушение реактивности микроциркуляторного звена на дыхательную пробу в виде парадоксальной реакции венул и артериол.
При проведении корреляционного анализа в общей группе пациентов выявлено, что ПТИ имеет статистически значимую обратную корреляцию с РКК (r=–0,44), т.е. чем выше ПТИ, тем ниже резерв МЦК. Кроме того, выявлена статистически значимая прямая корреляция СКО с МЦКмакс (r=0,67), т.е. чем выше вариабельность микроциркуляции, тем выше способность микрососудов к дилатации в ответ на ишемический стимул.
Обсуждение
С помощью метода фотоплетизмографии изучали патогенез нарушений микроциркуляции у больных с ХИНК. В данных работах выявлено, что по мере прогрессирования заболевания давление на артериальном и венозном участке капилляра выравнивается и возникает капилляростаз, являющийся центральным патогенетическим звеном ХИНК, при этом регистрируется значительное снижение парциального давления кислорода [14]. В нашем исследовании приведенные нарушения в системе микроциркуляции выражаются в наиболее низкой объемной скорости периферического кровотока у больных с ХИНК III—IV стадии.
Однако нарушения микроциркуляции обусловлены не только поражением капиллярного русла, но и выраженными нарушениями гидродинамики крови. Снижается деформирующая способность эритроцитов. Их жесткость наряду с замедлением скорости тока крови приводит к динамической агрегации, что еще больше усугубляет ишемию ткани [3]. В нашей работе между пациентами с ХИНК IIБ и III—IV стадии не выявлено статистически значимых различий по показателям клинического анализа крови, кроме содержания тромбоцитов. При этом необходимо отметить, что тромбоциты первыми реагируют на разрыв атеросклеротической бляшки и составляют основу для формирования артериального тромба [5]. Это следует учитывать для профилактики осложнений атеросклероза.
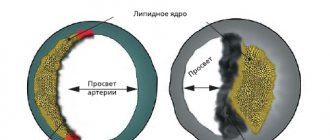
При хронических облитерирующих заболеваниях артерий нижних конечностей происходят морфофункциональные изменения микроциркуляции крови, включающие структурные изменения микрососудов. По мере прогрессирования ишемии происходят сужение просвета микрососудов, деформация венул, изменение формы капиллярных петель, усиление их извитости, усиливаются признаки неравномерности просвета капилляров [1]. В то же время неоспорим тот факт, что дисфункция эндотелия является первым звеном в развитии атеросклероза. Нарушение функции сосудистого эндотелия сопровождается изменениями в содержании эндотелинов, фактора Виллебранда, тканевого активатора плазминогена и оксида азота (NO). Наряду со снижением концентрации вазодилататоров отмечается увеличение уровня вазоконстрикторов и прокоагулянтов [12].
Как известно, реактивная постокклюзионная гиперемия служит защитной адаптивной реакцией, при которой происходит быстрое восстановление кровотока вслед за периодом его прекращения. Нарушение функции эндотелия совместно со структурными изменениями микроциркуляторного русла, а также изменения гидродинамики крови неизбежно приведут к снижению резервных возможностей МЦК. В нашем исследовании низкий вазодилататорный резерв отражался в слабо выраженной гиперемической реакции после прекращения окклюзии по данным МЦК в обеих группах пациентов. При этом у больных с ХИНК III—IV стадии гиперемическая реакция на 1-й минуте после окклюзии сосудов наблюдалась реже, чем в группе пациентов с ХИНК IIБ стадии. Максимальная объемная скорость МЦК была статистически значимо ниже у пациентов этой же группы, а время достижения МЦКмакс в обеих группах регистрировалось только на 2-й минуте восстановления кровотока.
СКО характеризует сохранность механизмов регуляции МЦК. Чем больше СКО, тем лучше функционируют механизмы модуляции тканевого кровотока: миогенный, нейрогенный, дыхательный, изменения давления [13].
В нашей работе СКО было ниже в группе больных с ХИНК III—IV стадии с исходно наиболее низкими показателями МЦК.
Известно, что величина снижения кровотока при проведении вазоконстрикторного дыхательного теста зависит от реакции сосуда на активацию адренергических волокон, которая обусловлена как влияниями симпатической иннервации, так и реактивностью сосудистой стенки [2]. При дыхательной пробе в группе пациентов с ХИНК IIБ стадии при исходном среднем МЦК в пределах 11 мл/100 г/мин выявлено умеренное снижение реактивности микрососудов на симпатический стимул. В группе пациентов с ХИНК III—IV стадии при наиболее низком исходном среднем МЦК — ниже 5 мл/100 г/мин зарегистрировано в 22% случаев увеличение МЦК на симпатический стимул (парадоксальная реакция), в результате чего среднее значение ΔМЦК превышало МЦКфон.
В данном случае мы можем говорить либо о нарушении вегетативной регуляции сосудистого тонуса на фоне спазма и структурных изменений микрососудов, либо о своего рода адаптационно-защитном механизме системы микроциркуляции в виде активации шунтирующего кровотока. В том и другом случае показано патогенетическое влияние атеросклероза на резервные возможности микроциркуляторного звена.
Таким образом, на основании полученных данных установлено, что по мере прогрессирования ишемии нижних конечностей (от IIБ стадии до III—IV стадии) происходит: 1) снижение исходных показателей периферической микроциркуляции; 2) снижение резервных возможностей периферического микроциркуляторного русла, что отражается в наиболее низкой постокклюзионной гиперемической реакции у пациентов с ХИНК III—IV стадии; 3) снижение вариабельности микроциркуляции и нарушение вегетативной регуляции сосудистого тонуса.
Блокаторы рецепторов ангиотензина II (БРА)
В конце 1980–х гг. было установлено, что в сердце, почках и легких только 15–25% ангиотензина II образуется под влиянием АПФ. Продукцию основного количества этого вазоактивного пептида катализируют другие ферменты – сериновые протеазы, тканевой активатор плазминогена, химазоподобный фермент CAGE (chymostatin–sensetive angiotensin I–generating enzyme), катепсин G и эластаза. В сердце функцию сериновой протеазы выполняет химаза. Наличие альтернативного пути образования ангиотензина II с помощью тканевой химазы, эндопептидаз и других энзимов, которые могут активироваться при использовании иАПФ, объясняет, почему при применении этих препаратов нельзя полностью блокировать образование ангиотензина II и почему у части больных артериальной гипертензией и сердечной недостаточностью иАПФ проявляют недостаточную терапевтическую эффективность. Более того, при применении и АПФ возможна активация альтернативных путей образования ангиотензина II. Это явилось основанием для создания группы соединений, блокирующих ангиотензиновые рецепторы 1 типа, через которые реализуются негативные эффекты ангиотензина II – вазоконстрикция, повышение секреции альдостерона, вазопрессина и адреналина.
Блокаторы АТ1–рецепторов ослабляют гемодинамические эффекты ангиотензина II независимо от того, каким путем он образовался, не активируют кининовую систему и продукцию окиси азота и простагландинов. Под их влиянием содержание альдостерона уменьшается слабее, чем при действии иАПФ, не изменяется активность ренина, количество брадикинина, простагландина Е2 (ПГЕ2), простациклина и ионов калия (табл. 2). Кроме того, блокаторы АТ1–рецепторов уменьшают продукцию фактора некроза опухоли–?, интерлейкина–6, молекул адгезии ICAM–1 и VCAM–1. Проникая через гематоэнцефалический барьер, они тормозят функцию сосудодвигательного центра как антагонисты пресинаптических АТ1–рецепторов, регулирующих выделение норадреналина. Блокаторы рецепторов ангиотензина II уменьшают систолическое и диастолическое АД на 50–70% на протяжении 24 ч (на следующий день после приема препаратов степень снижения АД составляет 60–75% от максимального эффекта). Стойкий гипотензивный эффект развивается через 3–4 нед. курсовой терапии. Эти препараты не изменяют нормальное АД (отсутствует гипотензивное действие брадикинина), снижают давление в легочной артерии и частоту сердечных сокращений, вызывают регресс гипертрофии и фиброза левого желудочка, тормозят гиперплазию и гипертрофию гладких мышц сосудов, улучшают почечный кровоток, оказывают натрийуретическое и нефропротективное действие.
БРА используются по тем же показаниям, что и иАПФ, обе эти группы являются взаимозаменяемыми.
Общепринятыми показаниями к назначению блокаторов рецепторов ангиотензина II являются: – эссенциальная артериальная гипертензия, реноваскулярная гипертензия и гипертензия, возникающая в результате применения циклоспорина после трансплантации почки; – хроническая сердечная недостаточность, обусловленная систолической дисфункцией левого желудочка (лишь в тех случаях, когда пациенты плохо переносят иАПФ); – диабетическая нефропатия (лечение и вторичная профилактика). При этих заболеваниях препараты улучшают качество жизни больных и отдаленный прогноз, предотвращают развитие сердечно–сосудистых осложнений, снижают летальность. При сердечной недостаточности у пациентов с нормальным или низким АД блокаторы рецепторов ангиотензина II меньше иАПФ вызывают артериальную гипотензию. Предполагается, что БРА имеют перспективу применения при остром инфаркте миокарда и для профилактики артериальной гипертензии у людей с повышенным нормальным АД (табл. 1), а также мозгового инсульта и рестеноза после баллонной ангиопластики.
БРА чаще использовали в случае наличия у больных непереносимости иАПФ, однако в настоящее время доказана способность БРА улучшать прогноз (снижать заболеваемость и смертность) больных АГ, ХСН и диабетической нефропатией, поэтому эти препараты можно использовать в качестве средств первого ряда.
Первым и наиболее известным непептидным блокатором рецепторов ангиотензина II является лозартан – производное имидазола. Одним из препаратов лозартана, представленных на российском рынке, является Вазотенз (компании Актавис). Лозартан блокирует АТ1–рецепторы в 3–10тыс. раз сильнее, чем АТ2–рецепторы, больше других препаратов этой группы блокирует рецепторы тромбоксана А2 тромбоцитов и гладких мышц, обладает уникальной способностью увеличивать почечную экскрецию мочевой кислоты. Биодоступность лозартана (Вазотенза) при приеме внутрь составляет всего 33%. В слизистой оболочке кишечника и печени он при участии изоферментов цитохрома Р–450 3А4 и 2С9 преобразуется в активный метаболит EXP–3174. Избирательное действие активного метаболита на АТ1–рецепторы в 30тыс. раз превышает влияние на АТ2–рецепторы, его гипотензивное действие в 20 раз сильнее, чем у лозартана. Лозартан является препаратом первого ряда при артериальной гипертензии у больных сахарным диабетом. Выпускаются и комбинированные препараты, содержащие лозартан и гидрохлортиазид. Производное лозартана ирбесартан окисляется изоферментом цитохрома Р–450 в недействующий метаболит, который выводится желчью в виде глюкуронида. Препарат негетероциклической структуры валсартан в 24000 раз сильнее связывается с АТ1–рецепторами, чем с АТ2–рецепторами. Выводится в неизменном виде, что снижает риск нежелательного взаимодействия с другими лекарственными средствами.
Блокаторы рецепторов ангиотензина II отличаются хорошей переносимостью. Иногда в процессе лечения возникают головная боль, головокружение, общая слабость, анемия. Сухой кашель возникает только у 3% больных. Благодаря длительному действию препаратов и их активных метаболитов после прекращения терапии не возникает синдром отдачи. Противопоказания к применению – тяжелая почечная и печеночная недостаточность, гиперкалиемия, обструкция желчевыводящих путей, нефрогенная анемия, второй и третий триместры беременности, грудное вскармливание.
Периферические вазодилататоры
Главная Медицинская энциклопедия Лекарственные препараты Сердечно-сосудистые лекарственные средства
Смотри также диазоксид, дибазол, дипрофен, миноксидил, непроссол (но-шпа, папаверина гидрохлорид, разделы «Нитраты и нитриты»; «Антагонисты ионов кальция».
АПРЕССИН (Apressinum)
Синонимы: Гидралазин, Гидралазина гидрохлорид, Анаспамин, Апрелазин, Апресолин, Апресин, Дезелазин, Дралзин, Эралазин, Гипофталин, Гомотон, Гидрапресс, Гипатол, Гиперазин, Идралазина, Иполина, Лопресс, Пропектин, Прессфол, Радинол, Ролазин, Солезорин и др.
Фармакологическое действие. Апрессин относится к группе периферических вазодилататоров (средств, расширяющих просвет сосудов). Он уменьшает сопротивление резистентных сосудов (артериол) и вызывает снижение артериального давления, нагрузку на миокард (сердечную мышцу), усиливает сердечный выброс.
К особенностям действия апрессина относится его способность, рефлекторно активируя симпатическую нервную систему, усиливать сердечный выброс и вызывать тахикардию (учащение сердцебиений), что может привести у больных, страдающих коронарной недостаточностью (несоответствием кровотока по сердечным артериям потребности сердца в кислороде), к усилению явлений стенокардии. Поэтому в последние годы апрессин сочетают с бета-адреноблокаторами (см. Пропранолол), уменьшающими циркуляторный гиперкинез (повышение тонуса сердечно-сосудистой системы), тахикардию.
Показания к применению. Комплексная терапия стенокардии, сердечной недостаточности. Наиболее показан больным с гипокинетическим или резистивным типом кровообращения (тенденцией к уменьшению насосной функции сердца и застою крови в органах). Эффективен также при лечении эклампсии (тяжелой форме позднего токсикоза беременных). Препарат усиливает почечный и мозговой кровоток.
Способ применения и дозы. Принимают апрессин внутрь после еды, начиная с дозы 0,01-0,025 г (10-25 мг) 2-4 раза в день, постепенно увеличивая до 0,1-0,2 г (100-200 мг) в день (в 4 приема).
Высшие дозы для взрослых внутрь: разовая — 0,1 г, суточная — 0,3 г.
Продолжительность лечения зависит от особенностей заболевания; обычно 1 курс продолжается 2-4 нед. В конце курса следует прерывать лечение не сразу, а постепенно, уменьшая дозу.
Побочное действие. Тахикардия, боль в области сердца, головокружение, головная боль, ортостатический коллапс (резкое падение артериального давления при переходе из горизонтального в вертикальное положение), тошнота, рвота, сыпь, отеки различной локализации, потливость, слезотечение, повышение температуры. При длительном приеме иногда развивается синдром, напоминающий системную красную волчанку.
Противопоказания. Выраженный атеросклероз.
Форма выпуска. Таблетки по 0,01 и по 0,025’г, покрытые оболочкой, в упаковке по 20 штук.
Условия хранения. Список Б. В хорошо укупоренной таре.
МОЛСИДОМИН (Molsidominum)
Синонимы: Корватон, Сиднофарм, Мориал, Мотазомин.
Фармакологическое действие. Является активным периферическим вазодилататором (средством, расширяющим сосуды). Он снижает тонус периферических емкостных сосудов (венул) и уменьшает венозный приток к сердцу. Под влиянием молсидомина понижается давление в легочной артерии, уменьшаются наполнение левого желудочка сердца и напряжение стенок миокарда (мышечной стенки левого желудочка сердца), а также ударный объем. Препарат улучшает коллатеральный кровоток (в обход пораженной артерии), уменьшает агрегацию (склеивание) тромбоцитов.
Вазодилататорное действие молсидомина, вероятно, в определенной мере обусловлено наличием в его молекуле группы NO, что говорит о наличие общих механизмов действия с нитратами и натрия нитропруссидом.
Действие сходно в основном с действием нитратов. Сравнительно с нитросорбидом эффект наступает несколько раньше, но общая продолжительность действия несколько меньше.
Показания к применению. Применяют молсидомин преимущественно как антиангинальное (противоишемическое) средство для профилактики приступов стенокардии. В этих случаях его принимают внутрь. Кроме того, молсидомин используют в комплексной терапии легочно-сердечной недостаточности. Для купирования (снятия) приступов стенокардии иногда назначают молсидомин сублингвально (под язык).
Способ применения и дозы. Внутрь принимают молсидомин по 1-2 мг (1/2-1 таблетка) 2-3-4 раза в день после еды.
Сублингвально назначают по ‘/2 таблетки.
При сублингвальном применении эффект наступает через 5-10 мин, при приеме внутрь — через 20 мин.
Побочное действие. При приеме препарата возможны головная боль и небольшое понижение артериального давления, проходящие при уменьшении дозы.
Противопоказания. Кардиогенный шок и тяжелая гипотензия (пониженное артериальное давление). При остром инфаркте миокарда препарат можно назначать только под строгим контролем врача. Не следует применять препарат в первые 3 мес. беременности.
Форма выпуска. Таблетки по 0,002 г (2 мг) в упаковке по 40 штук.
Условия хранения. Список Б. В защищенном от света месте.
НАТРИЯ НИТРОПРУССИД (Natriinitroprussidum)
Синонимы: Натрий нитропруссидовый, Нанипрус, Ниприд, Нипрутон, Гипотен, Нипрус.
Фармакологическое действие. Является высокоэффективным периферическим вазодилататором (средством, расширяющим сосуды). Расширяет артериолы и частично вены. При внутривенном введении оказывает быстрый, сильный и относительно непродолжительный гипотензивный (снижающий артериальное давление) эффект; уменьшает нагрузку на сердце и потребность миокарда (сердечной мышцы) в кислороде.
Показания к применению. Применяют натрия нитропруссид в комплексной терапии при острой сердечной недостаточности, особенно в случаях, резистентных (устойчивых) к обычным терапевтическим мероприятиям. Введение препарата быстро купирует (снимает) признаки сердечной астмы и угрожающего отека легких и улучшает показатели сердечной гемодинамики. Назначают также при хронической сердечной недостаточности, при гипертонических кризах (быстром и резком подъеме артериального давления), остром инфаркте миокарда, гипертонической энцефалопатии (заболевании головного мозга, связанном с нарушением его крообращения).
Способ применения и дозы. Препарат вводят внутривенно, при приеме внутрь гипотензивного действия не оказывает.
Раствор натрия нитропруссида готовят непосредственно перед применением. Сначала растворяют содержимое одной ампулы (25 или 50 мг) в 5 мл 5% раствора глюкозы, а затем разводят дополнительно в 1000; 500 или 250 мл 5% раствора глюкозы. При разведении 50 мг препарата в 500 мл раствора 1 мл содержит 100 мкг (при разведении в 250 или 1000 мл -соответственно 200 или 50 мкг).
Применение неразведенного раствора не допускается.
При инфузиях, продолжающихся до 3 ч, рекомендуются следующие дозы из расчета на 1 кг массы тела в минуту: начальные 0,3-1 мкг/кг в минуту, средняя 3 мкг/кг в минуту и максимальная у взрослых 8 мкг/кг в минуту. При контролируемой гипотензии (управляемом снижении артериального давления) во время хирургической операции под наркозом или на фоне приема антигипертензивных (снижающих артериальное давление) препаратов за 3-часовую инфузию препарат обычно достаточно ввести в суммарной дозе 1 мг/кг.
При введении со скоростью 3 мкг/кг в минуту артериальное давление обычно понижается до 60-70% от исходного уровня, т. е. на 30-40%. При долговременной инфузии (дни, недели) средняя скорость введения не должна превышать 2,5 мкг/кг в минуту, что соответствует 3,6 мг/кг в день. При этом необходимо постоянно следить за содержанием цианида в крови или плазме, концентрация которого не должна превышать в крови 100 мкг на 100 мл, а в плазме 8 мкг на 100 мл. Если инфузии продолжаются более 3 дней, следует контролировать также содержание тиоцианата, концентрация которого не должна превышать 6 мг в 100 мл сыворотки крови.
При тахифилаксии (быстром снижении лечебного эффекта при повторном применении препарата) к натрия нитропруссиду, когда гипотензивный эффект препарата ослабевает вследствие компенсаторной реакции организма (чаше это встречается у людей молодого возраста), максимальные дозы, указанные выше, превышать нельзя.
Скорость инфузии, т. е. дозу препарата, поступающую в кровь за единицу времени, определяют индивидуально при постоянном контроле уровня артериального давления.
Следует применять свежеприготовленные растворы. Сразу же после приготовления раствора и заполнения системы для капельного введения принимают меры к защите препарата от действия света, обертывая сосуд с раствором и прозрачные детали системы непрозрачной черной бумагой, пластиковой пленкой или металлической фольгой, приложенной к упаковке.
Натрия нитропруссид является высокоэффективным периферическим вазодилататором, но применять его надо с большой острожностью.
Раствор необходимо вводить под тщательным контролем артериального давления, систолическое давление («верхнее» давление — артериальное давление в фазу изгнания сердцем крови) должно снизиться не более чем до 100-110 мм рт.ст. При большой концентрации и быстром введении возможны быстрое понижение артериального давления, тахикардия (учащенные сердцебиения), рвота, головокружение, бессознательное состояние. Тогда дозу следует уменьшить (замедлить скорость введения) или полностью прекратить введение препарата.
Побочное действие. Головная боль, головокружение, тошнота, потеря сознания, выраженная гипотензия (понижение артериального давления), тахикардия.
Противопоказания. Кровоизлияние в мозг, нарушенный метаболизм цианидов, болезни почек, гипотиреоз
(заболевание щитовидной железы), беременность, детский и старческий возраст. С осторожностью — при повышенном внутричерепном давлении.
Форма выпуска. Натрия нитропруссид лиофилизированный (высушенный путем замораживания под вакуумом) в ампулах по 0,05 г.
Условия хранения. Список Б. В защищенном от света прохладном месте в запаянных ампулах из коричневого стекла.
| Версия для печати | Данная информация не является руководством к самостоятельному лечению. Необходима консультация врача. |
Ингибиторы вазопептидазы
Омапатрилат обладает свойством иАПФ и ингибитора вазопептидазы (нейтральная эндопептидаза эндотелия2). Блокада вазопептидазы препятствует протеолизу натрийуретических пептидов, брадикинина и адреномедуллина. Это обеспечивает выраженный гипотензивный эффект, улучшение почечного кровотока, повышение экскреции ионов натрия и воды, а также тормозит продукцию коллагена фибробластами сердца и сосудов. Выявлена клиническая эффективность омапатрилата при стенокардии и ХСН (снижение летальности, рост толерантности к физической нагрузке, улучшение функционального класса).