Антиангинальные препараты – это группа лекарственных средств, которые применяют для лечения ишемической болезни сердца – стенокардии и инфаркта миокарда.
Ишемическая болезнь сердца (ИБС) – это патологическое состояние, связанное с кислородным голоданием сердечной мышцы (миокарда) из-за недостаточного поступления крови к сосудам сердца.
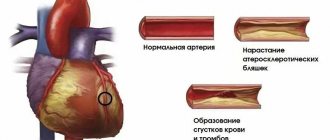
Хроническая ишемическая болезнь сердца проявляется стенокардией. Причинами стенокардии обычно является сужение просвета коронарных (сердечных) сосудов атеросклеротической бляшкой (стенокардия напряжения) или спазмом сосудов (вазоспастическая стенокардия).
Острая ишемическая болезнь сердца проявляется нестабильной стенокардией и инфарктом миокарда. Причиной острой ИБС является частичная или полная закупорка просвета сосудов тромбом.
Нестабильную стенокардию рассматривают как предынфарктное состояние. Чаще всего она переходит в острый инфаркт миокарда, однако в случае быстрого распознания и оказания помощи нестабильная стенокардия способна разрешиться вполне благополучно.
Сужение просвета коронарных сосудов приводит к снижению доставки крови (а вместе с кровью – кислорода и питательных веществ) к миокарду, что проявляется кислородным голоданием сердечной мышцы, болью при физической нагрузке или психоэмоциональном стрессе.
Полная же закупорка просвета коронарных сосудов приводит к резкому дефициту кислорода в питаемых этими сосудами участках сердца и, при отсутствии лечения, их гибели – некрозу.
Лекарственные препараты, применяемые при стенокардии, называют антиангинальными средствами (от старого латинского названия стенокардии: angina pectoris – грудная жаба).
Сложности при стратификации риска как фактор, затрудняющий выбор терапии
Хорошо известно, что степень интенсивности превентивной медикаментозной терапии пациентов с ишемической болезнью сердца (ИБС) должна напрямую определяться уровнем сердечно-сосудистого риска. К сожалению, несмотря на множество разработанных для этой цели шкал, оценка риска для больных ИБС без острого инфаркта миокарда (ОИМ) в анамнезе сегодня сильно затруднена. В большинстве случаев существующие шкалы занижают степень риска для пациентов группы высокого риска и завышают – в группе низкого риска [1].
Наиболее значимой практической сложностью здесь представляется невозможность получения реальной информации о степени стабильности атеросклеротических бляшек в коронарных сосудах пациента с ИБС, обладающей первостепенной прогностической ценностью. По всей видимости, крупные, но имеющие плотную фиброзную покрышку атеросклеротические бляшки разрываются реже, но при этом обусловливают выраженную клиническую симптоматику (в частности, ангинозные боли). В то же время при их разрыве и высвобождении внутрь сосуда огромного количества прокоагулянтного тканевого фактора вероятно развитие тромботической окклюзии крупного сосуда, клиническим эквивалентом которого служит обширный инфаркт миокарда с формированием зубца Q [2].
Небольшие бляшки реже приводят к значимому снижению коронарного кровотока, что определяет более редкие и менее интенсивные приступы ангинозной боли. Но при этом бляшки небольшого размера могут быть значительно менее стабильными, эрозии или разрывы их тонкой фиброзной покрышки могут приводить к развитию ОИМ, как правило, без формирования зубца Q (рис. 1). В качестве наглядного примера можно привести истории болезни пациентов с плохо компенсируемым сахарным диабетом 2 типа, в анамнезе часто имеющих несколько мелкоочаговых инфарктов и эпизодов нестабильной стенокардии.
По новым данным, при нестабильной стенокардии внутри коронарных артерий возможно формирование своеобразного динамического равновесия, при котором в течение достаточно длительного времени на поверхности интимы происходят небольшие надрывы или образуются эрозии интимы, но формирования тромба удается избежать за счет активации антитромботической системы. Использование методов прямой визуализации структуры атером in vivo, таких как оптическая когерентная томография/спектроскопия, позволяет выявить такие бляшки [3].
В рамках данной концепции несложно объяснить результаты исследования COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation), в котором стентирование коронарных артерий не приводило к улучшению прогноза, но значительно улучшало клиническую симптоматику. По всей вероятности, несмотря на то что ангинозные боли у данных пациентов были связаны с крупными, с успехом стентированными бляшками, прогноз в данном случае определялся мелкими нестабильными бляшками, стентирования которых, по понятным причинам, не выполнялось.
Сегодня оценка степени стабильности атеросклеротических бляшек и вмешательства, направленные на их стабилизацию, в т. ч. через “упрочнение” фиброзной покрышки, становятся новой парадигмой превентивной кардиологии. По сути, все традиционные шкалы, разработанные для больных ИБС, решают задачу оценки риска посредством анализа факторов, опосредованно характеризующих именно стабильность атером.
Основы лечения ишемической болезни сердца
Антиангинальные препараты используют как для купирования (устранения) приступа стенокардии, так и для профилактики возникновения приступов систематически.
Помимо антиангинальных препаратов в лечении стабильной и вазоспастической стенокардии применяют средства для лечения атеросклероза (антиатеросклеротические), профилактики тромбообразования (антиагреганты).
Для лечения нестабильной стенокардии и острого инфаркта миокарда применяют в первую очередь не антиангинальные средства, а фибринолитики (препараты, растворяющие тромбы) и антикоагулянты и антиагреганты (препараты, препятствующие повторному тромбообразованию).
Новые неинвазивные диагностические опции
Одним из основных направлений развития современной кардиологии является поиск минимально инвазивных методов прямой или косвенной оценки стабильности атеросклеротических бляшек, что позволит более точно предсказывать риск развития острого коронарного синдрома (ОКС). Их практическое применение представляется особенно важным при ведении пациентов со средним риском, выбор оптимального лечения которых часто затруднен. Сегодня на Западе с этой целью наиболее широко используется такой интегральный показатель масштаба поражения коронарного русла, как кальциевый индекс, который рассчитывается при проведении мультиспиральной компьютерной томографии (МСКТ) [4].
Другим подходом, который также может быть реализован при проведении МСКТ, служит оценка распределения плотности контраста в коронарном русле, что позволяет определять участки коронарных артерий с низким напряжением сдвига, где ожидаемо могут формироваться нестабильные атеромы [5].
Сегодня появляется все больше экспериментальных неинвазивных методик, призванных фокусно определять состояние атеросклеротических бляшек.
К ним относятся следующие методы диагностики:
• МР-визуализация с применением внутрисосудистых катушек и новых контрастов (например, ультрамалых частиц оксида железа, которые накапливаются макрофагами);
• совмещенные технологии МСКТ/МРТ (магнитно-резонансная томография), ПЭТ/КТ (позитронно-эмиссионная томография/компьютерная томография), КТ/сцинтиграфия;
• молекулярная лучевая диагностика (например, сцинтиграфия с 99Tc-аннексином 5, 99Tc-IL-2, с меченными тромбоцитами и липопротеидами низкой плотности).
Среди перспективных биохимических маркеров нестабильности атеросклеротических бляшек можно обозначить липопротеин-ассоциированную фосфолипазу А2, матриксную металлопротеиназу 9, растворимый лиганд CD40, неоптерин, а также широко доступный для практического определения высокочувствительный С-реактивный белок [6].
Лекция №19. Антиангинальные средства
АНТИАНГИНАЛЬНЫЕ СРЕДСТВА
Группа патологических состояний, связанных с коронарной недостаточностью, объединяется под термином «ишемическая болезнь сердца» (ИБС). Согласно рекомендации экспертов ВОЗ (1979), различают несколько классов (форм) ИБС. Среди этих форм существенное место занимает такая распространенная патология, как стенокардия (или грудная жаба), а также инфаркт миокарда. Латинское название грудной жабы — angina pectoris. В этой связи средства, применяемые при стенокардии, носят название — антиангинальных или антиангинозных.
Синдром стенокардии, классически описанный Геберденом в 1768 году, проявляется в виде приступообразных, кратковременных болей, чаще локализующихся за грудиной, с соответствующей иррадиацией в руку, возникающих после физической работы или в покое и купирующихся обычно в течение 1-10 минут. Вообще приступ, спонтанно проходящий, длится в течение 5-6 минут, во всяком случае не более 20-30 минут, так как далее участок миокарда, страдающий от ишемии, подвергается некрозу с образованием инфаркта.
В соответствии с классификацией ВОЗ выделяют две формы стенокардии :
I форма : ТИПИЧНАЯ форма стенокардии, когда наблюдаются склеротические изменения коронарных сосудов. В этом случае angina pectoris провоцируется физической, психической или холодовой нагрузками;
II форма: ВАРИАНТНАЯ форма стенокардии (или вазоспастическая форма, или стенокардия Принцметала), в последнее время все чаще встречается у молодых людей, без признаков склероза сосудов. Эта форма чаще всего связана с эмоциональным перенапряжением, но может возникать и в условиях покоя.
ПАТОФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ И ПРИЧИНЫ, ВЕДУЩИЕ К ВОЗНИКНОВЕНИЮ И РАЗВИТИЮ СТЕНОКАРДИИ
Основной причиной ишемии миокарда является несоответствие (дисбаланс) между потребностью миокарда в кислороде и его наличием, обеспечиваемым коронарным кровотоком. То есть одним из механизмов, обусловливающих возникновение приступа стенокардии, является нарушение доставки кислорода к миокарду из-за спазма коронарных сосудов.
Говоря о возникновении данного несоответствия, представляется возможным выделить три «слабых места» коронарного кровотока:
1. Коронарные артерии функционально являются концевыми и имеют очень мало коллатералей.
2. В покое сердечная мышца поглощает из крови максимальное количество кислорода (60-70%), и поэтому увеличение извлечения кислорода миокардом является задачей невыполнимой.
3. На коронарный кровоток влияют, в основном, два фактора :
— давление в аорте;
— резистентность коронарных сосудов. Кровь к миокарду левого желудочка поступает прерывисто, только в диастолу.
Несмотря на все эти условия, коронарный кровоток имеет большие возможности резерва — до 500%.
Таким образом, если по какой-либо причине повышение коронарного кровотока не способно удовлетворить увеличивающиеся потребности в кислороде, то развивается стенокардия.
В связи с двумя основными причинами возникновения стенокардии (нарушение доставки кислорода и усиление потребности миокарда в кислороде), существуют и два основных принципа фармакологической коррекции :
1. Расширение коронарных сосудов и повышение таким образом доставки кислорода.
2. Снижение работы сердечной мышцы и уменьшение таким образом потребности миокарда в кислороде.
При лечении больного, страдающего стенокардией, можно преследовать две цели :
1. Купировать (оборвать, обрезать, прекратить) приступ стенокардии.
2. Предупредить приступ стенокардии, что означает возможность хронического лечения больных. Такой вид терапии позволяет профилактировать развитие приступов и увеличить толерантность (устойчивость) к физической и эмоциональной нагрузкам.
КЛАССИФИКАЦИЯ АНТИАНГИНАЛЬНЫХ СРЕДСТВ
Для лечения больных с приступами стенокардии используется довольно широкий арсенал средств, обладающих антиангинальной активностью. Этих средств много, несколько десятков, однако, в настоящее время выделяют только три группы препаратов, завоевавшие признание специалистов.
I. Нитросодержащие препараты (или органические нитраты).
Ранее существовали препараты органических и неорганических нитритов (например, амилнитрит и натрия нитрит), то есть соединения азотистой кислоты, но в настоящее время они практически не используются.
II. Бета-адреноблокаторы.
III. Антагонисты кальция (блокаторы кальциевых каналов).
ОРГАНИЧЕСКИЕ НИТРАТЫ
Нитросодержащие препараты уже более 100 лет(Уильям Митчелл, 1879 год) с успехом применяются при лечении больных стенокардией. Классическим препаратом из этой группы является нитроглицерин (Nitroglycerinum) — самый известный и наиболее эффективный препарат данной группы лекарств.
Механизм действия связан с тем, что препарат обладает прямым миотропным действием на гладкую мускулатуру, особенно сосудов (в большей степени, вен, нежели артерий), находящихся в состоянии спазма. Под действием нитроглицерина наиболее значительно расширяются сосуды головного мозга, шеи, головы, то есть сосуды верхней части туловища, в том числе сердца. Преимущественное венодилатирующее влияние нитроглицерина ведет к изменению периферической гемодинамики : депонированию крови и снижению венозного возврата, то есть перераспределению крови. Это сопровождается уменьшением нагрузки на сердце (снижение преднагрузки) и способствует стойкому снижению использования энергии. Такое уменьшение венозного возврата крови к сердцу, вследствие действия на емкостные сосуды, сопровождается следующими эффектами :
— снижением давления в обоих предсердиях;
— снижением ударного объема;
— уменьшением напряжения стенки миокарда;
— уменьшением объема сердца;
— снижением АД;
— рефлекторной тахикардией.
Умеренная дилятация артериол, то есть снижение постнагрузки на сердце сопровождается :
— снижением АД;
— увеличением ударного объема.
Важным фактом является то, что нитроглицерин расширяет коронарные сосуды, особенно наиболее крупные. Нитроглицерин не просто расширяет коронарные сосуды, но и увеличивает количество коллатералей, повышая, тем самым, коллатеральный кровоток. Кроме того, уменьшение сопротивления в коронарных сосудах ведет к такому перераспределению кровотока, что число функционирующих коллатералей становится наиболее значимым в субэндокардиальном слое миокарда, а, как известно, именно в этом слое чаще всего развивается ишемия. С этой точки зрения нитроглицерин целесообразно использовать не только при типичной, но и при вазоспастической форме стенокардии.
Таким образом, снижение сопротивления в коронарных сосудах, особенно в эпикардиальных отделах миокарда, сопровождается:
— снятием спазма коронарных артерий;
— усилением коронарного кровотока.
В целом можно говорить о двояком механизме действия нитроглицерина:
1. Прямое расширение коронарных сосудов (увеличивается доставка кислорода к ишемизированному участку миокарда)
2. Происходит уменьшение пред- и постнагрузки на сердце (снижается потребность миокарда в кислороде).
Благодаря этим эффектам, восстанавливается равновесие между притоком кислорода к миокарду и его потреблением, таким образом устраняется ишемия.
Действие нитроглицерина как вазодилятатора связано с имитацией действия эндотелиального релаксирующего фактора (ЭРФ). Нитроглицерин обладает выраженной липофильностью, легко проникает в клетку и активирует фермент гуанилатциклазу (его растворимую фракцию). Это способвует повышению концентрации цГМФ. Накопление последнего в гладких мышцах ведет к их релаксации и расширению сосудов. Также известен тот факт, что эндотелий сосудов под действием некоторых БАВ (ацетилхолина, брадикинина) выделяет вещество, расширяющее сосуды — ЭРФ, который представляет собой оксид азота (NO). Источником данного фактора в организме является L-аргинин.
Нитроглицерин хорошо абсорбируется слизистыми оболочками ротовой полости и ЖКТ, а также кожей. Нитроглицерин особенно хорошо всасывается из подъязычной области. При сублингвальном приеме препарата максимальная концентрация его в крови достигается через 4 минуты после приема и начинает снижаться через 15 минут. Спустя 45 минут препарат полностью выводится из организма. Поэтому наиболее часто используемой лекарственной формой нитроглицерина (эталонным препаратом) являются таблетки под язык.
Действие таблеток под язык начинается спустя 1-2 минуты и продолжается в течение 10-30 минут.
Таблетки отечественного производства содержат 0, 5 мг действующего вещества. Таблетки очень нестабильны и их необходимо заменять свежими через каждые 2 месяца.
Для купирования приступа стенокардии обычно достаточно одной таблетки под язык.
Наряду с таблетками, выпускаются капсулы, содержащие 1% масляный раствор нитроглицерина. Капсулы могут содержать 0, 5 и 1, 0 мг нитроглицерна. После помещения капсулы под язык ее следует раздавить.
Существует также и довольно устаревшая лекарственная форма нитроглицерина — 1% спиртовый раствор. Эта форма требует от больного самостоятельного дозирования: 2-3 капли раствора наносят на или под язык (3-4 капли соответствует одной таблетке нитроглицерина под язык). Можно рекомендовать больным наносить капли спиртового раствора на кусочек сахара. Спиртовый раствор нитроглицерина входит в состав капель Вотчала.
В Западной Европе получили практическое применение аэрозоли с нитроглицерином (Nitroglycerini spray).
Показания к применению нитроглицерина :
1) Все перечисленные лекарственные формы, относясь к формам короткого действия, применяются для купирования приступов при всех типах стенокардии. В случае типичной стенокардии, когда приступы часто повторяются, нитроглицерин можно применять сублингвально и с целью профилактики возможного приступа, например, за 2-3 минуты перед выходом на улицу, особенно, в морозный день.
Интересен тот факт, что прием 25-30 доз нитроглицерина способствует развитию такой степени коллатерального кровообращения, что становится возможным предупреждение инфаркта.
2) Таблетки под язык можно применять при тромбозе сосудов сечатки (для уменьшения площади поражения).
3) При отсутствии других средств, нитроглицерин может применяться при спазме желчевыводящих путей, в качестве первой доврачебной помощи.
С 1974-82 года на западном рынке получили распространение трансдермальные лекарственные формы (мази, пластыри и диски различной конструкции с фиксированной дозой действующего вещества).
Выпускается 2%-ная нитроглицериновая мазь для натирания кожных покровов в области сердца. При этом нитроглицерин медленно всасывается, его действие начинается через 1 час и длится около 6 часов.
Пластыри, диски обеспечивают терапевтическую концентрацию препарата в крови в течение 24 часов, то есть оказывают пролонгированный эффект.
Наиболее распространены следующие трансдермальные системы (выпускаются в виде пластыря) :
— Нитродерм ТТС;
— Депонит;
— Нитра-диск и др.
Эти формы препарата показаны для профилактики приступов стенокардии (перед физическими нагрузками, у больных с ночными приступами стенокардии).
Кроме того, следует сказать о такой лекарственной форме нитроглицерина, как раствор для внутривенного применения (перлинганит, нитрожект). Используется только в условиях палаты интенсивного наблюдения для купирования ангинозного статуса у больных с острым инфарктом миокарда.
Побочные эффекты (при приеме вышеперечисленных лекарственных форм нитроглицерина) :
— сильная головная боль, связанная с параличом (резким расширением) сосудов головного мозга и сдавлением болевых рецепторов. Боли могут быть настолько интенсивными, что пациент может отказаться от приема препарата. Через 1-2 недели боли самостоятельно проходят. Для купирования болевого синдрома можно назначить препараты спорыньи (дигидроэрготамин, дигидроэрготоксин), анальгин, кофеин;
— резкое падение АД;
— слабость;
— рефлекторная тахикардия;
— повышение внутричерепного и внутриглазного давления;
— ощущение жара, покраснение лица и кожи верхней половины туловища.
В конце 60-х годов нашего столетия с помощью новых технологий, а именно, путем использования метода микрокапсулирования нитроглицерина, были созданы его препараты пролонгированного действия для перорального использования : Сустак (Югославия), Сустонит (Польша).
При поступлении в ЖКТ таблетки растворяются и постепенно выходящий из микрокапсул нитроглицерин начинает действовать. Поэтому эти таблетки показаны лишь для предупреждения приступов стенокардии. Действие сустака продолжается до 4-5 часов. Данные препараты выпускаются в виде двух форм:
— mite — содержит 2, 6 мг нитроглицерина;
— forte — содержит 6, 4 мг нитроглицерина.
Среди подобных препаратов: Нитрогранулонг (содержит 5, 2 мг нитроглицерина), Нитро-Мак Ретард, Нитроминт и др. Показание к применению — профилактика приступов стенокардии у больных с ИБС. С 1980 года широкое применение получили буккальные ( защечные ) лекарственные формы нитроглицерина — препараты сусадрин, сустабукал, нитробукал, нитрогард, сускард. Отечественной фармацевтической промышленностью выпускается препарат ТРИНИТРОЛОНГ (Trinitrolong; в виде тонких полимерных пластинок толщиной 1, 5-2 мм, содержащих 1, 0; 2, 0 или 4, 0 мг нитроглицерина). Пластинку тринитролонга помещают на строго определенное место — на слизистую верхней десны над клыками и малыми коренными зубами. Благодаря специальным адгезивным свойствам, пластинка мгновенно приклеивается к слизистой в ротовой полости. Далее начинается процесс равномерного постепенного рассасывания пластинки. По мере растворения нитроглицерин поступает прямо через слизистую в системный кровоток, минуя печень. При этом в плазме крови длительно поддерживается терапевтическая концентрация нитроглицерина. Действие тринитролонга начинается через несколько минут, а длится на протяжении нескольких часов.
Показания к применению:
— купирование приступов стенокардии;
— профилактика приступов стенокардии.
Существуют еще несколько препаратов органических нитратов, но с более медленным и продолжительным эффектом, чем у нитроглицерина, например, НИТРОСОРБИД (изосорбид динитрат, изомак-ретард, изокет, изодинит и др.; выпускается в виде таблеток для перорального применения по 5, 10, 20 мг). Начало действия — через 30-50 минут, эффект длится до 4-6 часов. Данный препарат используется только для предупреждения приступов стенокардии. Существуют и другие лекарственные формы данного препарата: растворы для внутривенного введения (изокет или изодинит для инфузий), аэрозоли для ингаляций (изокет аэрозоль, изоМак спрей), трансдермальные формы (изокет мазь, изоМак спрей ТД).
БЕТА-АДРЕНОБЛОКАТОРЫ
Данная группа средств в последние годы нашла широкое распространение для лечения целого ряда терапевтических заболеваний.
Различают неселективные бета-адреноблокаторы (тимолол, пропранолол, соталол, надолол, окспренолол, пиндолол и др. ) и селективные бета-1-адреноблокаторы (метопролол, атенолол, ацебутолол и др. ).
Терапевтическая активность этой группы препаратов при стенокардии обусловлена их способностью блокировать влияние симпатической нервной системы на сердце, что приводит к снижению его работы и уменьшению потребления миокардом кислорода.
АНАПРИЛИН (пропранолол, индерал, обзидан; таблетки по 0, 01 и 0, 04) — некардиоселективный бета-адреноблокатор без собственной симпатомиметической активности с непродолжительным действием. Анаприлин снижает все 4 функции сердца, прежде всего — сократимость миокарда. Максимально выраженный эффект наблюдается в течение 30-60 минут, терапевтический эффект, в связи с коротким периодом полувыведения (2, 5-3, 2 часа), длится 5-6 часов. Это означает что препарат следует принимать 4-5 раз в сутки. Анаприлин используют только для профилактики приступов стенокардии, исключительно при типичной ее форме, так как при вазоспастической форме стенокардии на фоне заблокированных бета-адренорецепторов, катехоламины будут усиливать спазм коронарных сосудов.
Побочные эффекты: снижение сократимости миокарда, брадикардия, АВ-блокады, бронхоспазм; тошнота, рвота, диарея, общая слабость, головокружение, иногда — аллергические реакции. Возможны явления депрессии. При одновременном применении сахароснижающих средств — опасность гипогликемии.
АНТАГОНИСТЫ КАЛЬЦИЯ (БЛОКАТОРЫ КАЛЬЦИЕВЫХ КАНАЛОВ)
Значение кальция в выполнении организмом жизненно важных функций огромно. Кальций необходим для регуляции процессов возбуждения и торможения как в гладкой, так и в скелетной мускулатуре. Поступая из внешней среды или из внутриклеточного депо под действием различных стимулов, кальций взаимодействует с кальций-связывающими белками цитоплазмы, выполняющими роль регуляторов.
Для сердца и сосудов значение кальция несколько различно, что связано с преобладанием (в сердце или сосудах) специфичных кальцийсвязывающих белков. В миокардиоцитах имеется особый белок — тропонин (лейотонин), а в гладких миоцитах сосудов — особый термостабильный кальций-зависимый белок кальмодулин. В зависимости от того, действуют ли они в большей степени на тропонин или кальмодулин, одни блокаторы кальциевых каналов в большей степени влияют на сердце, а другие — на сосуды. Например, такой антагонист кальция как ВЕРАПАМИЛ в большей степени действует на сердце (очень важным является его антиаритмическое действие).
Антиангинальный эффект препаратов этой группы связан как с прямым их действием на миокард, так и, прежде всего, с влиянием на периферическую гемодинамику. Антагонисты кальция блокируют его поступление в гладкомышечную клетку, таким образом уменьшая ее способность к сокращению. Действие этих средств на коронарные сосуды характеризуется как антиспастическое, в результате коронарный кровоток увеличивается, а вследствие действия на периферические сосуды — снижается АД. Благодаря этому снижается постнагрузка на сердце, улучшается кровоток в зоне ишемии. Эти препараты уменьшают механическую работу сердца и потребность миокарда в кислороде, увеличивают количество коллатералей. При их использовании у больных уменьшается частота и интенсивность приступов стенокардии, повышается толерантность к физическим нагрузкам.
Наиболее часто с этой целью применяют нифедипин (синонимы: фенигидин, коринфар, кордафен, кордипин и др.; таб. по 0, 01). Эффект наступает через 15-20 минут и продолжается 4-6 часов. Препарат уступает нитроглицерину по силе антиангинального эффекта.
В отличие от верапамила препарат обладает слабой антиаритмической активностью, сильно снижает диастолическое давление. Особенно хорошо расслабляет коронарные сосуды при вазоспастической стенокардии. Вообще при этой форме стенокардии антагонисты кальция предпочтительнее. Кроме нифедипина для хронического лечения стенокардии используют созданные в 80-х годах производные нифедипина второго поколения : исрадипин (син.: ломир).
Данная группа препаратов дает незначительное количество побочных эффектов: снижение АД, головные боли, мышечная слабость, тошнота, запоры. Непрерывный прием препаратов в течение 2-3 месяцев ведет к развитию толерантности.
При стенокардии с брадикардией, используют производное эфедрина — ОКСИФЕДРИН (ильдамен, МИОФЕДРИН; таблетки по 0, 016). Препарат обладает частичной агонистической активностью по отношению к бета-1-рецепторам сердца, оказывает непосредственное коронарорасширяющее действие, повышает сократительную способность миокарда без избыточного увеличения потребности в кислороде. Другой подобный препарат НОНАХЛАЗИН, отечественного производства, выпускается в таблетках по 0, 03 — производное фенотиазина. Препарат обладает положительным инотропным эффектом и снижает тонус коронарных артерий.
При лечении больных со стенокардией находит применение и такой препарат как дипиридамол (курантил)- производное пиримидина. Этот препарат действует на микроциркуляцию крови в мелких сосудах, препятствуя агрегации тромбоцитов, увеличивает число коллатералей и интенсивность коллатерального кровотока, однако, может вызвать симптом «обкрадывания», особенно при внутривенном введении у больных с выраженным коронарным атеросклерозом, так как препарат вызывает расширение тех сосудов, которые не поражены склерозом. С другой стороны, этот препарат показан больным, у которых есть стенокардия, а также вследствие различных причин повышена свертываемость крови.
Средства типа валидола имеют рефлекторный тип действия. В состав этого препарата входит ментол (25% раствор ментола в ментоловом эфире изовалериановой кислоты). Является слабым антиангинальным средством, оказывает седативное действие и умеренный рефлекторный сосудорасширяющий эффект. Показан при легких формах стенокардии.
Основные принципы фармакотерапии
ИБС – хроническое “доброкачественное” заболевание, в связи с чем основными задачами ее лечения служат уменьшение числа, продолжительности и тяжести приступов ангинозных болей и улучшение прогноза, который определяется риском развития таких сердечно-сосудистых осложнений, как ОИМ, жизнеугрожающие нарушения ритма и хроническая сердечная недостаточность (ХСН).
В настоящее время влияние на прогноз пациентов с ИБС доказано только для статинов, ингибиторов ангиотензинпревращающего фермента – иАПФ (рамиприла и периндоприла), антитромбоцитарных препаратов и β-адреноблокаторов (после перенесенного ОИМ). В данном обзоре мы сосредоточимся на терапии, способной в первую очередь облегчать состояние больных стенокардией напряжения.
Антиангинальная и антиишемическая терапия хронической ИБС
Бета-адреноблокаторы (БАБ) по праву считаются краеугольным камнем лечения ИБС. В отсутствие абсолютных противопоказаний селективные β1-адреноблокаторы в обязательном порядке следует назначать всем пациентам с ОИМ в анамнезе ввиду их способности повышать выживаемость таких пациентов и снижать частоту развития повторных ОИМ.
Кардиоселективные БАБ служат основным инструментом лечения стенокардии напряжения, и прибегать к антиангинальным препаратам других групп следует только после того, как потенциал БАБ максимально задействован [7].
Крайне важно добиваться целевых значений частоты сердечных сокращений (ЧСС, 55–60 ударов в минуту), без достижения которых антиангинальная терапия не может быть признана оптимальной. В том случае когда на фоне применения БАБ у пациента со стабильной стенокардией продолжают отмечаться приступы ангинозных болей, следует предпринять попытку снизить ЧСС до 50 ударов в минуту, если на этом фоне не развивается атриовентрикулярная (АВ)-блокада [7]. При этом измерять ЧСС следует утром до приема очередной дозы препарата.
Сегодня нередко можно встретить больных, принимающих большие дозы нитратов в связи с выраженной ангинозной болью, но не получающих оптимальной терапии БАБ.
В большинстве случаев это связано со следующими факторами:
• неоправданными опасениями в отношении развития побочных эффектов, которые редко встречаются (в первую очередь различных блокад и бронхообструктивного синдрома);
• желанием назначить низкую дозу БАБ в рамках комбинированной антиангинальной терапии (реальная эффективность которой может значительно уступать терапии БАБ в полной дозе);
• трудностями при сопоставлении дозировок различных БАБ (сегодня врачи часто используют бисопролол в дозе 10 мг, но избегают применения метопролола в дозах выше 150 мг/сут, в связи с чем пациенты, получающие метопролол, часто имеют более высокую ЧСС);
• сложностями, связанными с титрованием БАБ (особенно это относится к липофильному карведилолу, обладающему труднопредсказуемой зависимостью между дозировкой и эффективностью);
В случае непереносимости БАБ их можно заменить на блокаторы кальциевых каналов (БКК). Следует особо отметить, что ни в одном из контролируемых исследований БКК не было показано их влияния на выживаемость пациентов со стенокардией.
У пациентов с бронхиальной астмой препаратом выбора можно считать верапамил пролонгированного высвобождения, обладающий пульсурежающим эффектом. При этом следует помнить, что по сравнению с БАБ его применение пожилыми пациентами сопряжено с более высоким риском развития АВ-блокады II–III степеней. При появлении значимого замедления АВ-проведения на фоне применения верапамила оправданно проведение холтеровского мониторирования ЭКГ, в т. ч. для исключения АВ-блокады II степени в ночные часы.
Дигидроперидиновые БКК обладают более слабым антиангинальным эффектом, нежели недигидроперидиновые, но могут с успехом применяться пациентами с нарушениями проводимости. Ряд больных эти препараты могут приводить к развитию субэндокардиальной ишемии [7].
В случае наличия противопоказаний к назначению БАБ, в первую очередь при наличии блокады АВ-проведения ΙΙ степени или бронхиальной астмы, в качестве пульсурежающего препарата может использоваться ингибитор If-каналов ивабрадин. Антиангинальный эффект ивабрадина реализуется только за счет урежения ЧСС, ввиду чего он “по силе” уступает БАБ, обладающим многогранным механизмом антиишемического и кардиопротективного действий. Следует отметить, что в крупном клиническом исследовании, включившем более 10 тыс. пациентов с ИБС и ХСН, ивабрадин не показал влияния на сердечно-сосудистую смертность и частоту госпитализаций, обусловленных ОИМ и ХСН [8].
Классификация антиангинальных препаратов
В зависимости от механизма действия антиангинальные препараты классифицируют на:
- препараты, повышающие доставку кислорода к сердцу: ментол, валидол (ментол в ментиловом эфире изовалериановой кислоты), дипиридамол;
- препараты, понижающие потребность сердца в кислороде: β-адреноблокаторы (пропранолол, метопролол, атенолол, бетаксолол, бисопролол, небиволол, карведилол);
- брадикардитические средства (ивабрадин);
- органические нитраты и нитратоподобные средства – сиднонимины (нитроглицерин, изосорбида мононитрат, изосорбида динитрат, пентаэритритила тетранитрат, молсидомин);
Комбинированная антиангинальная терапия
Наличие жалоб на ангинозные боли пациентов с ИБС, получающих терапию первой линии, диктует необходимость подключения дополнительных антиишемических лекарственных средств. Алгоритм их применения представлен на рис. 2.
До инициации комбинированной антиангинальной терапии следует удостовериться, что целевая ЧСС достигнута с применением БАБ. В случае непереносимости БАБ, не связанной с наличием блокад, следует предпринять попытку назначения верапамила или дилтиазема в режиме монотерапии.
Добавление к БАБ препарата ивабрадин оправданно, только если ЧСС на фоне максимальной дозы БАБ (20 мг биспопролола или 400 мг метопролола) превышает 70 ударов в минуту либо если титрование дозы БАБ невозможно (например, в связи с хронической обструктивной болезнью легких или клинически выраженным атеросклерозом сосудов нижних конечностей). Применение ивабрадина совместно с малыми дозами БАБ с целью урежения ЧСС у больных, которые хорошо переносят БАБ, ввиду отсутствия доказательной базы следует отнести к нерациональным назначениям.
В том случае если на фоне целевой ЧСС больного продолжают беспокоить ангинозные боли, в качестве “второго” препарата оптимально назначать БКК [11], в ряде случаев можно также использовать длительно действующие нитраты/донаторы NO или никорандил.
Жалобы на наличие ангинозной боли у пациентов с ИБС, получающих терапию двумя антиангинальными препаратами, служат прямым показанием к проведению коронарографии с последующим решением вопроса о тактике реваскуляризации. В настоящее время ежедневная комбинированная терапия тремя и более антиангинальными препаратами может считаться оправданной только для тех пациентов, у которых по какой-либо причине проведение реваскуляризации невозможно.
Подбор и контроль антиангинальной терапии с помощью холтеровского мониторирования
Загрузить Слайдшоу
Автор: Тихоненко В. М.
PDF-файл
Ишемическая болезнь сердца (ИБС) остается основным заболеванием в структуре сердечно-сосудистой смертности. Хотя хирургические методы лечения ИБС в последнее время применяются все шире, подавляющее большинство больных лечатся консервативно. Эмпирически назначенная антиангинальная терапия далеко не всегда бывает эффективна у конкретного пациента. Для объективизации индивидуальной эффективности различных препаратов используется методика с применением парных велоэргометрических проб, однако, она не отражает эффективности препарата в условиях обычной жизнедеятельности пациента в течение дня и не дает достаточной информации о безопасности проводимой терапии.
Предлагаемая методика позволяет определить эффективный антиангинальный препарат при обычной деятельности больного, выявить побочные эффекты получаемых препаратов и, тем самым, дает возможность сделать назначаемую терапию безопасной для пациента.
Описание метода
Для определения исходной толерантности к физической нагрузке (ТФН) и выраженности ее спонтанных колебаний первоначально пациенту проводится холтеровское мониторирование в течение суток на фоне отмены антиангинальной терапии. Для купирования приступов стенокардии больной может принимать нитроглицерин. При невозможности полной отмены, целесообразно проведение исследования на фоне монотерапии антиангинальным препаратом, желательно длительного действия.
Во время исследования больной выполняет 4 или более физические нагрузки в виде подъемов по лестнице в определенное время дня: утром, после обеда, вечером и сразу после ночного сна. Рекомендуется проведение лестничных проб в 10, 13, 16, 19 часов и после подъема утром. Подъем по лестнице осуществляется в привычном для пациента, равномерном темпе, до появления любых жалоб (предвестники ангинозных болей, выраженная одышка, усталость, сердцебиение и пр.). В дневнике больной указывает время начала и окончания подъема, количество пройденных ступеней лестницы. Моменты начала и окончания подъема дополнительно отмечаются нажатием кнопки «действие» на мониторе.
Для оценки ТФН, зная вес пациента и количество пройденных ступеней, вычисляется объем выполненной работы (ОВР, кг х м) как произведение веса пациента (кг) на количество ступеней и на высоту ступени (м). Поскольку высота ступени обычно равна 0,15 метра:
ОВР = 0,15 х вес пациента х количество ступеней.
При возникновении ишемических изменений ЭКГ ранее окончания больным подъема по лестнице, например ввиду более позднего появления ангинозных болей, чем изменений ЭКГ, ТФН будет характеризовать пороговый ОВР – выполненный больным до развития ишемических изменений. Учитывая равномерный темп подъема по лестнице, в данном случае пороговый ОВР будет составлять часть общего ОВР, пропорциональную времени подъема до развития ишемических изменений ЭКГ.
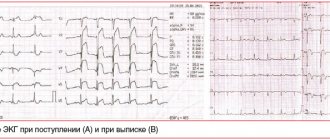
Программное обеспечение некоторых мониторных систем, например, «Кардиотехника-4000» (ИНКАРТ, Санкт-Петербург), при формировании заключения позволяет автоматически рассчитать не только общий и пороговый ОВР, но также мощность нагрузки, ЧСС до развития эпизода ишемии и пороговую ЧСС при его возникновении. При комбинированном мониторировании ЭКГ и АД дополнительно рассчитывается индекс «пульс х давление» (рис. 1).
Рис. 1. Данные суточного мониторирования: а — графики ЧСС, смещения сегмента ST, артериального давления и фрагменты ЭКГ до и в момент развития эпизода ишемии (стрелкой отмечен прием 10 мг нитросорбида) б — результаты лестничных нагрузок, проведенных до и через 2, 3, 5 и 8 часов после приема препарата, где пор.ЧСС — пороговая ЧСС, ИР — индекс Робинсона, ОВР — пороговый объем выполненной работы (на графике уменьшен в 10 раз).
Для оценки колебаний ТФН сравниваются пороговые ОВР при выполнении лестничных нагрузок в течение суток исследования без приема антиангинальной терапии. Определяется разница между максимальным и минимальным показателем, по которой в дальнейшем будет определяться увеличение порогового ОВР как критерий эффективности антиангинального препарата.
Для определения эффективности антиангинальных препаратов проводятся тестовые разовые приемы каждого препарата в средней дозе под контролем суточного ЭКГ-мониторирования по следующей схеме: пациент выполняет лестничную пробу до разового приема, затем через 2, 5 и 8 часов после приема препарата. Рекомендуемый режим: 10:00-10:30 – исходная лестничная проба, 11 часов – прием препарата, лестничные пробы в 13, 16, 19 часов.
Об эффективности препарата судят по увеличению порогового ОВР при лестничных нагрузках после его приема по сравнению с исходным пороговым ОВР при подъеме по лестнице до его приема утром. Препарат считается эффективным при увеличении порогового ОВР на величину, в два раза превышающую спонтанные колебания ОВР. Если на фоне приема препарата при нагрузке не развивается ишемии миокарда, то препарат можно считать высокоэффективным. О продолжительности эффекта можно судить по динамике порогового ОВР при лестничных нагрузках через 2, 5 и 8 часов от разового приема препарата.
При определении эффективного препарата по результатам пробного приема, он назначается в стандартном режиме в виде монотерапии, или, при необходимости, в составе комбинированной терапии. Через 3-5 дней курсового приема терапии проводится суточное мониторирование ЭКГ для контроля эффективности назначенного лечения с выполнением лестничных нагрузок и оценкой ТФН аналогично ранее проводимым исследованиям. В зависимости от результатов лечащим врачом принимается решение о необходимости усиления терапии или замене антиангинального препарата.
Для сокращения сроков подбора терапии и более быстрого определения эффективного антиангинального средства, рационально начинать тестирование с препарата, эффективность которого у данного пациента будет более вероятна. При его определении необходимо учитывать условия возникновения эпизодов ишемии миокарда. Поэтому во время сбора жалоб и анамнеза особое внимание уделяют наличию у больного утренней спазмофилии, стартовой стенокардии, холодовой зависимости, феномена «прохождения через боль», ангинозных приступов в покое, особенно в предутренние часы, колебаний переносимости физических нагрузок, свидетельствующих о наличии в генезе стенокардии динамического компонента коронарной обструкции. В случае выявления при сборе анамнеза признаков вазоспазма тестирование антиангинальных препаратов, следует начинать с блокаторов кальциевых каналов. Если у пациента отмечается развитие ангинозных болей при стабильном уровне физических нагрузок, что говорит о преобладании фиксированного компонента коронарного стеноза, наиболее вероятно, что более эффективными окажутся бета-блокаторы.
При первичном мониторировании могут быть получены данные, которые также помогут при выборе первого тестируемого препарата. При выраженных колебаниях порогового ОВР (более 50%), пороговой ЧСС (более 25 уд. в мин.), развитии ишемического смещения ST без предшествующего увеличения ЧСС, появлении эпизодов элевации ST вне зоны перенесенного инфаркта можно судить о преобладании вазоспастического компонента в генезе приступа и большей вероятности эффекта коронаролитиков. Для преобладания фиксированной обструкции характерны стабильные пороговые ОВР и ЧСС, четкая связь приступов с нагрузкой. У таких больных, как правило, более эффективны препараты, уменьшающие потребность миокарда в кислороде.
Также при анализе мониторограмм может быть получена дополнительная информация о пациенте, влияющая на выбор терапии: наличие нарушений ритма сердца, их количество, связь с эпизодами ишемии миокарда, исходная тахикардия или брадикардия. При комбинированном мониторировании дополнительно будут получены данные о суточном профиле АД, наличии артериальной гипер- или гипотензии, реакции АД на нагрузку. При пробных приемах антиангинальных препаратов, наряду с оценкой их эффективности будет возможно оценить их влияние на частоту сердечных сокращений, нарушения ритма сердца, состояние гемодинамики.
При проведении пробных приемов возможно обнаружение побочных действий препарата, которые не всегда ощущаются больным, и, соответственно, могут быть своевременно не выявлены. Наиболее часто встречаются нарушения проводимости при приеме бета-блокаторов или антагонистов кальция, значимые снижения АД, появление выраженного учащения или урежения ЧСС, увеличение количества эпизодов ишемии миокарда на фоне тахикардии, проаритмическое действие препаратов.
Таким образом, при применении данной методики, возможно выбрать не только эффективный для данного больного антиангинальный препарат, но также обладающий положительным влиянием на другие, имеющиеся у пациента проявления заболевания, и, что особенно важно, безопасный для применения у данного больного.
Результаты применения метода
Подбор терапии по описываемой методике был проведен у 20 больных ИБС, стенокардией напряжения II-III функционального класса, в возрасте от 41 до 64 лет (средний возраст 55 лет). У 7 больных ИБС сочеталась с гипертонической болезнью II стадии. На динамической ЭКГ при выполнении лестничных нагрузок у них регистрировалась депрессия сегмента ST-T более 1 мм от исходного уровня, в точке, отстоящей от точки j на 0.08 сек., и продолжавшаяся более 30 секунд. В большинстве случаев данные эпизоды смещения ST-T сопровождались болями ангинозного характера.
Для пробного приема использовались: изосорбида-динитрат (нитросорбид в дозе 20 мг внутрь), изосорбида-5-мононитрат пролонгированного действия (моночинкве-ретард 50 мг), бета-адреноблокатор (метопролол 50 мг), блокаторы кальциевых каналов производные дигидроперидина (адалат SL 20 мг) и производные фенилалкиламина (финоптин-ретард 100 мг).
У 5 больных (0,25) эффективными оказались все пять тестируемых препаратов, эффективность четырех препаратов наблюдалась у 9 пациентов (0,45), три препарата были эффективны у 3 больных (0,15), у 2-х больных (0,10) эффективными оказались два препарата из пяти, только один препарат оказался эффективным у 1-го пациента (0,05). Больных, у которых не наблюдалось бы эффекта ни одного препарата, не было. Распределение выраженного эффекта по количеству препаратов было следующим: выраженный эффект пяти препаратов наблюдался у 2-х человек (0,10), четырех препаратов – у 5 (0,25), трех – у 4-х пациентов (0,20), двух – у 5-ти (0,25) и одного препарата – у 4-х больных (0,20).
В целом в группе больных по результатам исследования наибольшая эффективность наблюдалась у метопролола. Через 2 часа после приема препарат оказался эффективным у 19 человек (0,95), у 16 из них (0,80) – высокоэффективным. Через 5 часов после приема эффект препарата наблюдался у 13 пациентов (0,65), у 7 (0,35). Через 8 часов препарат продолжал действовать у 9 больных (0,45), выраженный эффект сохранялся у 2 больных (0,10).
Следующим по эффективности в данной группе больных был изосорбида-5-мононитрат. Через 2 часа после его приема у 15 больных (0,75) – препарат был эффективным, у 11 (0,55) – высокоэффективным. Через 5 часов – эффект препарата сохранялся у 16 больных (0,80), у 10 пациентов (0,50) – выраженный. Через 8 часов – сохранение эффекта наблюдалось у 9 человек (0,45), у 6 (0,30) – выраженного.
Блокаторы кальциевых каналов (производные дигидроперидина и фенилалкиламина) демонстрировали сравнительно одинаковое по эффективности действие: через 2 часа финоптин-ретард и адалат оказывали антиангинальный эффект у 11 пациентов (0,55), выраженный эффект наблюдался у 9 человек (0,45). Через 5 часов действие адалата сохранялось также у 11 больных (0,55), выраженный эффект — у 7 (0,35), при приеме финоптина-ретард – несколько меньше — у 9 (0,45) и у 7 (0,35) соответственно. Интересно, что через 8 часов антиангинальное действие финоптина было отмечено у 4 пациентов (0,20), у 1 (0,05) – выраженное, а после приема адалата – всего лишь у 2 больных (0,10) и ни у кого из них не наблюдалось выраженного эффекта.
Эффективность нитросорбида через 2 часа после приема была отмечена у 12 пациентов (0,60), у 7 из них (0,35) она была выраженной. Через 5 часов эффект продолжал наблюдаться у 8 больных (0,40), выраженным оставался у 2 (10,0). Через 8 часов действие препарата сохранялось только у 2 человек (0,10), и ни у кого из них не было выраженного антиангинального эффекта.
Таким образом у всех больных удалось подобрать эффективный препарат, у большинства из них препарат оказывал антиангинальное действие более 5 часов, высокоэффективный препарат удалось назначить 16 больным (0,80). Большинство пациентов ранее принимали эмпирически подобранную терапию, у трети из них принимаемые ранее препараты оказались неэффективными. Препарат, оказывающий выраженный антиангинальный эффект, раньше принимали лишь 5 (0,25) больных.
При проведении пробных приемов препаратов были обнаружены следующие побочные действия, которые в дальнейшем не позволили применить данные медикаменты при длительной антиангинальной терапии. У одного больного при пробном приеме 50 мг метопролола на высоте действия препарата были зарегистрированы эпизоды синоатриальной блокады с длительностью пауз более 2 секунд, причем, при мониторировании на фоне отмены терапии данных за наличие у больного нарушений проводимости выявлено не было. Примечательно также, что субъективная переносимость бета-блокатора была хорошей, а динамика ангинозных болей — положительной. Очевидно, что в данном случае, несмотря на эффективность препарата, он не мог быть рекомендован для длительного приема в качестве антиангинального средства.
У нескольких больных, не имевших сопутствующей артериальной гипертензии, на фоне разовых приемов препаратов развивалось выраженное снижение систолического АД более чем на 30 мм рт.ст. (до уровня 90-95 мм рт.ст.), диастолического АД более чем на 20 мм рт.ст. (до 50-60 мм рт.ст.). У двух пациентов (0,10 от исследуемой группы) избыточное снижение АД наблюдалось на фоне приема адалата SL, у трех (0,15) на фоне приема метопролола. У четырех человек (0,20) подобная реакция АД наблюдалась после приема нитратов, у одного из них после приема нитросорбида при подъеме по лестнице на высоте нагрузки, сопровождавшейся ишемическими изменениями на ЭКГ, зарегистрировано снижение АД с 96/75 до 80/49 мм рт.ст.
У 5 пациентов (0,25) на фоне приема нитратов и адалата отмечалась выраженная рефлекторная тахикардия, что в ряде случаев приводило к снижению ТФН и увеличению числа эпизодов ишемии. Усугубление колебаний ТФН, ее снижение с появлением эпизодов ишемии миокарда в покое наблюдалось на фоне приема бета-блокатора у 2-х человек (0,10).
Подавляющее большинство из описанных осложнений больные субъективно не ощущали, в связи с чем их обнаружение без применения холтеровского мониторирования было бы невозможно. Таким образом, использование данной методики позволяет определить не только индивидуально эффективный, но и безопасный антиангинальный препарат для лечения больного стенокардией.
Литература
- Аронов Д.М. Лупанов В.П. МихееваТ.Г. Функциональные пробы в кардиологии// Кардиология.-1995.-Ш2.-с.55
- Бочкарева Е.В. Кокурина Е.В. Кондратьев В.В. Метелица В.И. Эффективность основных антиангинальных препаратов у больных со стенокардией в зависимости от наличия безболевых эпизодов ишемии миокарда //Кардиология -1998.-N2.-C.20-24
- Гасилин В.С.,Сидоренко Б.А. Стенокардия,- М: Медицина, 1985.-c.238
- ИльинаГ.В. Константинов В.О. Липовецкий Б.М. Плавинская СИ. Пробы с дозированной физической нагрузкой (на велоэргометре и тредмиле).-Метод, указан, по клинич. патофизиол. и функцион. Диагностике: под ред. Е.В.Майстраха и Б.М.Липовецкого.-Л, 1980.-c.25.
- Кобалава Ж.Д., Котовская Ю.В., Терещенко С.Н., Моисеев B.C. Клиническое значение суточного мониторирования артериального давления для выбора тактики лечения больных артериальной гипертонией. //Кардиология.-1997.-N9.-c.98-100.
- Кондратьев В.В., Кокурина Е.В., Бочкарева Е.В. Безболевая ишемия миокарда. Современное состояние проблемы и клинически значимые аспекты ее развития. I. Распространенность и прогностическая значимость безболевой ишемии миокарда. //Кардиология,- 1997.-N1.-C.72-75.
- Метелица В.И. Фармакотерапия стабильной стенокардии (обоснование для стандартного лечения). //Кардиология.-1997.-N10.-с.72-74.
- Тихоненко В.М., Гусаров Г.В. Определение вазоспастического генеза приступов стенокардии по данным су- точного мониторирования ЭКГ.//Кардиология.- 1989.-N: 1.-С.52-56.
Ведение пациентов с рефрактерной стенокардией при невозможности проведения реваскуляризации
Концепция рефрактерной стенокардии включает три следующих фактора:
1. Ишемию миокарда;
2. Ангинозную боль;
3. Невозможность проведения реваскуляризации [12].
“Неподходящими” кандидатами для проведения реваскуляризации обычно считаются такие категории пациентов [12]:
• больные вазоспастической стенокардией;
• пациенты с подозрением на микрососудистую дисфункцию (с объективными признаками ишемии миокарда в отсутствие значимых стенозов коронарных артерий или с нормально функционирующими шунтами);
• больные, обладающие небольшим объемом ишемизированного миокарда, при невозможности проведения ангиопластики (например, с гемодинамически значимым симптом-связанным дистальным однососудистым поражением), стратифицированные в группу низкого риска;
• пациенты с диффузным, “нитевидным” коронарным атеросклерозом (характерно поражение двух и более коронарных артерий, захватывающее дистальное русло с артериями < 1 мм в диаметре);
• лица с очень высоким периоперационным риском (ввиду тяжелых сочетанных заболеваний, часто к этой группе относятся пожилые люди с многососудистым поражением).
Необходимо подчеркнуть, что заключение о невозможности проведения реваскуляризации должно приниматься полидисциплинарной командой и этот статус может быть пересмотрен с учетом изменения состояния больного, возможности привлечения опытной хирургической бригады, способной оперировать пациентов высокого риска.
Далее мы рассмотрим препараты, которые могут использоваться в схемах “максимизированной” антиангинальной терапии таких пациентов.
Одним из высокоэффективных антиангинальных препаратов является никорандил – активатор АТФ-зависимых калиевых каналов плазматической и митохондриальных мембран с нитратоподобными свойствами. Обычно к никорандилу прибегают в случае непереносимости БАБ и БКК, но он может использоваться и в составе комбинированной терапии. В двойном слепом исследовании, включившем больных стабильной стенокардией, было показано, что никорандил приводил к значимому увеличению толерантности к физической нагрузке, времени до появления ангинозной боли и депрессии ST ≥ 1 мм [13]. В рандомизированном клиническом исследовании (РКИ) IONA, включившем более 5000 больных хронической ИБС, никорандил, назначенный в дозе 20 мг 2 раза в сутки, продемонстрировал превосходство над плацебо в плане влияния на частоту госпитализаций, что было расценено как снижение риска развития нестабильной стенокардии. Примерно в трети случаев в первые дни после приема никорандила может отмечаться головная боль [13], также существует риск развития толерантности к его действию.
Другим перспективным лекарственным средством является ранолазин, частично ингибирующий окисление жирных кислот и блокирующий поздние натриевые каналы (работающие в диастолу). Ранолазин способен нивелировать индуцированную ишемией натриевую и кальциевую “перегрузку” кардиомиоцитов, улучшая перфузию и диастолическую функцию миокарда. Кроме того, он обладает антиаритмическим действием и способен снижать уровень гликозилированного гемоглобина у пациентов с сочетанием ИБС и СД.
В нескольких рандомизированных двойных слепых исследованиях (MARISA, ERICA, CARISA) показано, что ранолазин снижает частоту эпизодов стенокардии, потребление нитратов и повышает толерантность к физической нагрузке без клинически выраженного влияния на ЧСС и АД [14]. При этом в исследовании MERLIN TIMI 36 (Metabolic Efficiency With Ranolazine for Less Ischemia in Non-ST Elevation Acute Coronary Syndromes), в рамках которого пациенты с ОКС наблюдались в течение года, ранолазин не показал влияния на риск развития ОИМ и сердечно-сосудистую смертность. При лечении стенокардии у лиц с микрососудистой дисфункцией возможно также использовать препараты с анальгетическими свойствами, такие как ингибитор фосфодиэстеразы аминофиллин, антидепрессант имипрамин. Можно также применять методы психотерапии и кардиореабилитации [15].
Среди нелекарственных методов, которые могут облегчать состояние ряда пациентов с рефрактерной стенокардией, можно указать усиленную наружную контрпульсацию, ударно-волновую терапию и электростимуляцию спинного мозга [16]. Такая инвазивная процедура, как трансмиокардиальная лазерная реваскуляризация, согласно мета-анализу 7 исследований (n = 1137), не может быть признанной эффективным методом лечения рефракторной стенокардии [17].
В настоящее время уточняется эффективность таких экспериментальных методик лечения резистентной стенокардии, как клеточная терапия и применение факторов роста, активирующих ангиогенез, в т. ч. гранулоцитарно-макрофагального колониестимулирующего фактора, способного “мобилизовать” стволовые клетки костного мозга для участия в ангиогенезе коронарного русла.
Особенности лечения ишемической болезни сердца
Для купирования приступов стенокардии чаще всего используют органические нитраты: нитроглицерин, изосорбида динитрат, а также антагонист кальция нифедипин и сосудорасширяющий препарат валидол – сублингвально (под язык). При таком пути введения эффект возникает очень быстро – в течение 1-3 минут.
Для профилактики приступов стенокардии внутрь (перорально) применяют β-адреноблокаторы, антагонисты кальция, ивабрадин, изосорбида мононитрат, изосорбида динитрат, пентаэритритила тетранитрат, молсидомин, а также кардиопротекторные средства (триметазидин, мельдоний).
Препараты β-адреноблокаторов и антагонистов кальция дополнительно снижают артериальное давление (антигипертензивное действие) и нормализуют сердечный ритм (антиаритмическое действие), поэтому показаны для лечения стенокардии у пациентов с гипертонической болезнью и/или аритмией.
Амиодарон оказывает выраженное антиаритмическое действие, поэтому его применяют при стенокардии на фоне нарушений сердечного ритма – аритмий.
К препаратам органических нитратов развивается толерантность (привыкание) – снижение их эффекта при длительном применении. Во избежание толерантности при приеме органических нитратов нужно делать перерывы в несколько дней или хотя бы на ночь. В случае развития привыкания следует отдать предпочтение препарату с нитратоподобным действием – молсидомину.
Метаболическая и антиоксидантная терапия
“Антиоксидантная терапия” гармонично вписывается в традиционные схемы лечения ИБС благодаря использованию таких препаратов, как статины, иАПФ, карведилол, обладающих выраженным антиоксидантным действием. При этом благоприятные антиишемические, кардиопротективные и антиатеросклеротические эффекты “чистых” антиоксидантов (биофлавоноидов, полифенолов, витаминов, глутатиона, эмоксипина, этилметилгидроксипиридина), показанные на различных биологических моделях, в настоящее время не были продемонстрированы ни в одном крупном клиническом исследовании. В нескольких проспективных плацебо-контролируемых РКИ были показаны нейтральные и даже негативные эффекты витаминов [18]. Недавно обнаружилось, что ряд экспериментов, в которых было показано положительное действие кверцетина, проведен с грубейшими нарушениями биомедицинской этики [19]. Таким образом, использование больными ИБС антиоксидантов, в т. ч. в составе БАД, не оправданно.
Метаболические препараты также имеют достаточно скудный доказательный базис. В связи с этим Европейское агентство по оценке лекарственных средств сократило спектр показаний к применению препарата триметазидин, который может использоваться лишь в качестве дополнительного антиангинального средства в случае непереносимости или недостаточной эффективности терапии первой линии [20]. В качестве сферы рационального применения триметазидина в составе комплекс ной антиангинальной терапии можно указать стенокардию, обусловленную микрососудистой дисфункцией.
В России при лечении пациентов с ИБС также применяется препарат мельдоний – аналог γ-бутиробетаина. Мельдоний ингибирует фермент γ-бутиробетаин-гидроксилазу, что приводит к замедлению биосинтеза карнитина и транспорта длинноцепочечных жирных кислот через митохондриальную мембрану in vitro (при этом β-окисление жирных кислот замедляется, происходит “переключение” внутриклеточного метаболизма на гликолиз). Обратным действием обладает препарат L-карнитин, ускоряющий транспорт длинноцепочечных жирных кислот в митохондрии, β-окисление которых значительно более выгодно энергетически, но и требует бoльших количеств кислорода. Вопрос о том, какая из данных стратегий может считаться оптимальной в условиях клинической практики, когда длительно существующая хроническая ишемия миокарда может смениться острой при развитии ОКС, остается открытым.
Современные подходы к антиангинальной терапии при ишемической болезни сердца: в фокусе сиднонимины
Гиппократ указывал, что «боль в области сердца, которая появляется с определенной частотой у старых людей, является предзнаменованием внезапной смерти». Бартолетти (1576–1630), Гарвей (1527–1658), Морганьи (1684–1771) описывали случаи возникновения у пожилых и старых людей сильных острых болей в левой половине грудной клетки, сопровождавшихся беспокойством, страхом, удушьем, обмороком во время приступа. Первое описание классической стенокардии принадлежит У. Гебердену (1772), который для ее обозначения в своем докладе Лондонскому Королевскому обществу впервые применил термин «angina pectoris» и подробно и точно охарактеризовал клиническую картину грудной жабы («геберденова грудная жаба»). Parry (1799) первым указал на связь стенокардии с изменением структуры сердца и поражением коронарных артерий. Он же первым высказал предположение, что ангинозная (стенокардитическая) боль возникает вследствие уменьшения снабжения сердца кровью. В 1909 г. на первом съезде российских терапевтов было дано классическое описание клинической картины инфаркта миокарда в основополагающем труде В.П. Образцова и Н.Д. Стражеско «К симптоматологии и диагностике тромбоза коронарных артерий». (Страже́ско Николай Дмитриевич – впоследствии видный советский терапевт, организатор науки, академик АН СССР и академии наук Украины, Герой Социалистического Труда). В настоящее время сердечно–сосудистые заболевания прочно удерживают 1–е место среди всех причин смертности в экономически развитых странах, являясь одной из наиболее распространенных патологий среди хронических неинфекционных заболеваний. Несмотря на это, начиная со второй половины XX в. странах Западной Европы и Северной Америки наблюдается устойчивое снижение смертности от сердечно–сосудистых заболеваний. Эта тенденция отмечается в последние годы и в странах Восточной Европы [1,2]. В Российской Федерации от сердечно–сосудистых заболеваний умирают более 1 млн человек, т.е. примерно 700 человек на 100 тыс. населения. ИБС часто развивается у трудоспособных, творчески активных лиц, существенно ограничивая их социальную и трудовую активность, усугубляя социально–экономические проблемы в обществе [1–4]. Основой снижения заболеваемости и смертности при ИБС является борьба с управляемыми факторами риска заболевания. Так, еще в классическом Фрамингемском исследовании, начатом в США в 1949 г., показано, что риск развития ИБС связан с повышенным артериальным давлением, высоким уровнем холестерина, курением, нарушением толерантности к глюкозе и гипертрофией левого желудочка (результаты Фрамингемского исследования см. на интернет–сайте Национального сердечного института США – www.nhlbi.nih.gov/about/framingham, 1998). 1. Немодифицируемые (неизменяемые) факторы риска (ФР) ИБС [5–7]: • возраст старше 50–60 лет; • пол (мужской); • отягощенная наследственность. 2. Модифицируемые (изменяемые) ФР [5–7]: • дислипидемии (повышенное содержание в крови холестерина, триглицеридов и атерогенных липопротеинов и/или снижение содержания антиатерогенных ЛВП); • артериальная гипертензия (АГ); • курение; • ожирение; • нарушения углеводного обмена (гипергликемия, сахарный диабет); • гиподинамия; • хронический стресс; • нерациональное питание; • гипергомоцистеинемия и др. Сочетание у одного человека нескольких факторов риска значительно повышает опасность заболевания ИБС и, как правило, отягощает ее течение. Фармакотерапия ИБС предусматривает обязательное проведение профилактических мероприятий, направленных на устранение модифицируемых факторов риска ИБС. Важная роль при этом отводится коррекции АГ, нормализации уровня глюкозы у больных с сахарным диабетом, отказу от курения, комплексной модификации диеты, борьбе с избыточным весом, физическим тренировкам [1–3]. Лечение стенокардии напряжения предусматривает использование различных групп лекарственных средств, воздействующих на те или иные звенья патогенеза ИБС [3]. Основным патогенетическим фактором ИБС является нарушение кровотока в коронарных артериях, приводящее к дисбалансу между перфузией и метаболическими потребностями миокарда. Потребность миокарда в кислороде определяется напряжением миокардиальной стенки, частотой сердечных сокращений и сократимостью миокарда и зависит от метаболических процессов, связанных в том числе и с трансмембранными токами ионов кальция, от объема желудочков сердца и от величины систолического АД. Сократимость зависит от характера органического поражения сердца. Снабжение сердечной мышцы кислородом напрямую связано с состоянием коронарного кровотока, а величина последнего зависит и от коронарного сопротивления, и от активности симпатической нервной системы, и от уровня перфузионного давления, и от гемореологических свойств крови, в частности от уровня агрегации тромбоцитов [3,8–11]. Основными целями лечения больных ИБС являются: улучшение качества жизни пациента за счет снижения частоты приступов стенокардии и других актуальных для больного симптомов; профилактика острого инфаркта миокарда; улучшение выживаемости. Препараты, используемые для лечения ИБС: • Антиангинальные средства: – донаторы оксида азота – нитраты (нитроглицерин, изосорбида динитрат, изосорбида–5–мононитрат); – сиднонимины (молсидомин (Сиднофарм)); – β–адреноблокаторы (атенолол, бисопролол, пропранолол и др.); – антагонисты кальция (верапамил, дилтиазем и др.). • Противоатеросклеротические (гиполипидемические) средства. • Антитромбоцитарные препараты (ацетилсалициловая кислота, клопидогрел). • Метаболические средства (триметазидин). Целью антиангинальной терапии при ИБС является уменьшение числа приступов стенокардии в течение суток вплоть до полного их устранения. Это дает возможность больному быть в повседневной жизни достаточно активным, не чувствовать жизненного дискомфорта в связи со многими ограничениями, предшествовавшими лечению. Подобные изменения физического и психологического статуса больного объективно приводят к существенному улучшению качества его жизни. Кроме того, во многих случаях симптоматическая терапия позволяет больному продолжать профессиональную деятельность, если она не сопряжена с тяжелым физическим трудом. Успешным антиангинальное лечение считается в случае полного или почти полного устранения приступов стенокардии и возвращения больного к нормальной активности (стенокардия не более I функционального класса – ФК, когда болевые приступы возникают только при значительных нагрузках) и при минимальных побочных эффектах терапии [13–15]. Нитраты. Препараты нитратов при «грудной жабе» применяются уже около полутора столетий. Нитроглицерин был открыт Асканио Собреро в 1847 г. в Турине. Собреро также первым обратил внимание на сильную головную боль, вызываемую при пробе на язык малых количеств нитроглицерина. В 1849 г. К. Геринг, исследуя на добровольцах фармакологическое действие нитроглицерина, подтвердил, что его применение достаточно закономерно вызывает головную боль. В 1851 г. Уильям Меррелл (William Murrell) впервые использовал нитроглицерин при стенокардии в 1876 г., хотя в то время нитроглицерин был занесен в Британскую фармакопею лишь как лекарственное средство от повышенного кровяного давления. Меррелл, врач–практик, работавший в двух лондонских госпиталях одновременно, экспериментально определил оптимальную дозировку из соотношения эффективности и безопасности: 1%–ный спиртовый раствор нитроглицерина по 3 капли с пол унцией воды трижды в сутки. В таком виде препарат действовал значительно дольше, нежели амилнитрит, и более мягко. Публикация Меррелла, подводившая итоги нескольких лет исследований сначала на себе, а потом на пациентах со стенокардией, вошла в золотой фонд медицины. Год спустя фармацевтом Уильямом Мартиндейлом (William Martindale) была разработана твердая форма препарата: 1/100 грана нитроглицерина в шоколаде – которая, помимо удобства в использовании, имела лучшую усвояемость. В 1882 г. в США известная фирма Parke, Davis & Co. стала производить нитроглицерин уже в пяти различных дозировках. Индустрия производства нитроглицерина пережила расцвет в 1900 г., при этом рабочие данных предприятий подвергались значительному воздействию паров органических нитратов. Результаты воздействия проявились в виде явлений привыкания к нитратам (о чем свидетельствовали симптомы «болезни понедельника», «Monday disease», исчезающие к концу недели) и синдрома отмены (воскресные сердечные приступы, «Sunday Heart Attacks»). Механизм антиангинального действия нитратов заключается в уменьшении потребности миокарда в кислороде, что обусловлено снижением напряжения стенки желудочков, систолического артериального давления и объема желудочков. Кроме того, антиангинальное действие реализуется путем улучшения снабжения миокарда кислородом: за счет увеличения коронарного кровотока, снижения коронарного сопротивления, уменьшения спазма коронарных артерий и увеличения коллатерального кровотока. Они обладают также ингибирующими адгезию и агрегацию тромбоцитов и, очевидно, антитромботическими свойствами. Антиагрегационные эффекты нитратов могут рассматриваться как важное дополнение их антиишемического действия [1,2,12,14,15]. Нитраты легко проникают через все слизистые оболочки, а также через кожу, поэтому они доступны в многочисленных лекарственных формах. Эти лекарственные формы можно подразделить на следующие (табл. 1) [2]: 1. Всасывающиеся через слизистую оболочку рта. К ним относятся: а) Классические таблетки нитроглицерина для приема под язык, так называемые буккальные (т.е. предназначенные для аппликации на слизистую оболочку щеки или десны) лекарственные формы нитроглицерина и изосорбита динитрата. б) Аэрозоли нитроглицерина и изосорбита динитрата, которые способны оказывать столь же быстрое действие, как и сублингвальные таблетки нитроглицерина (эффект начинается в течение 60–90 с), но значительно более удобны в применении. 2. Для приема внутрь. Это различные таблетки и капсулы изосорбита динитрата, изосорбита мононитрата и нитроглицерина. Таблетки могут быть обычными либо специальными, сделанными таким образом, чтобы продлить действие препарата. 3. Для накожного применения. Мази нитроглицерина и специальные наклейки (пластыри) нитроглицерина для аппликации на кожу. Такие пластыри рассчитаны на действие в течение 24 ч. 4. Для внутривенного введения. Ампулы с раствором нитроглицерина и изосорбита динитрата. β–адреноблокаторы. Препараты этой группы применяются в лечении больных ИБС на протяжении более сорока лет. β–блокаторы являются препаратами первого выбора для лечения стенокардии, особенно у больных, перенесших инфаркт миокарда, так как они оказывают быстрый антиангинальный эффект и к тому же приводят к уменьшению смертности и частоты повторного инфаркта при длительном применении [1–3,14–15]. β–адреноблокаторы вызывают антиангинальный эффект путем снижения потребности миокарда в кислороде (за счет урежения частоты сердечных сокращений – ЧСС, снижения АД и сократительной способности миокарда), увеличения доставки к миокарду кислорода (в силу усиления коллатерального кровотока, перераспределения его в пользу ишемизированных слоев миокарда – субэндокарда), антиаритмического и антиагрегационного действия, снижения накопления кальция в ишемизированных кардиомиоцитах. Блокаторы кальциевых каналов (антагонисты кальция). Основной точкой приложения препаратов данной группы на уровне клетки являются медленные кальциевые каналы, по которым ионы кальция переходят внутрь гладкомышечных клеток кровеносных сосудов и сердца. В присутствии ионов кальция происходит взаимодействие актина и миозина, обеспечивающих сократимость миокарда и гладких мышечных клеток. Кроме того, кальциевые каналы «задействованы» в генерации пейсмекерной активности клеток синусового узла и проведении импульса по атриовентрикулярному узлу. Установлено, что вазодилатирующий эффект, вызванный антагонистами кальция, осуществляется не только посредством прямого действия на гладкую мускулатуру сосудистой стенки, но и опосредованно – через потенцирование высвобождения NO эндотелием сосудов. Этот феномен был обнаружен у большинства дигидропиридинов и исрадипина, в меньшей степени – у нифедипина и негидропиридиновых препаратов. Для длительного лечения стенокардии из производных дигидропиридинов рекомендуется использовать только пролонгированные лекарственные формы или длительно действующие препараты антагонистов кальция. Блокаторы кальциевых каналов – мощные вазодилататоры, они снижают потребность миокарда в кислороде, расширяют коронарные артерии. Препараты могут применяться при вазоспастической стенокардии, сопутствующих обструктивных легочных заболеваниях [1–2,15] Любой практикующий врач хорошо знает о высокой эффективности нитратов при стенокардии. В то же время нитраты нередко вызывают различные побочные эффекты – головную боль (иногда непереносимую), тошноту, гиперемию лица, артериальную гипотензию, сердцебиение; при регулярном приеме возможно развитие толерантности к данной группе препаратов. Кроме того, установлено, что применение нитратов показано далеко не всем больным ИБС. Согласно результатам исследований ISIS–4 и GISSI–3 (58 050 и 19 394 пациентов соответственно) применение нитратов у пациентов с инфарктом миокарда не приводит к улучшению их прогноза. Более того, менее представительные, но более длительные исследования MSMI (1072 пациента) и MDPIT (1779 пациентов) продемонстрировали, что длительный прием нитратов после инфаркта миокарда приводит к существенному ухудшению прогноза у этих больных. В последние годы появилось еще одно обстоятельство, затрудняющее применение органических нитратов у мужчин, страдающих ИБС: они несовместимы с приемом ингибиторов фосфодиэстеразы 5–го типа (ФДЭ5), к которым относятся силденафил, тадалафил и варденафил, применяемые при часто сочетающейся с ИБС эректильной дисфункции [16]. В качестве серьезной альтернативы нитратам могут рассматриваться, пожалуй, только препараты из группы сиднониминов; первый и типичный представитель – Сиднофарм, один из широко применяемых препаратов молсидомина, его отличительной характеристикой является соотношение стоимость–эффективность. Молсидомин является антиангинальным средством из группы сиднониминов. Не являясь нитратом по химическому строению, Сиднофарм (молсидомин) оказывает схожее с ними действие, поскольку способен отщеплять молекулу оксида азота – NO; сиднонимины и нитраты в настоящее время нередко объединяют в группу антиангинальных препаратов – донаторов оксида азота. При попадании в организм молсидомин метаболизируется в печени, превращаясь в активное производное – SIN–1. Последний, попадая в кровь, активируется (SIN–1A), и от него отщепляется NO–группа, воздействующая на процесс активации гуанилатциклазы. В результате ГТФ превращается в цГМФ, что приводит к расслаблению клеток мышечной оболочки сосудов и вазодилатации. Таким образом, вазодилатирующий эффект Сиднофарма близок к эффекту эндотелиального расслабляющего фактора. В коронарной системе расширяются главным образом эпикардиальные артерии. В венозной системе молсидомин расширяет преимущественно мелкие и средние сосуды, что способствует депонированию крови в ней, уменьшает приток крови к сердцу и преднагрузку на сердце. В больших дозах молсидомин оказывает расширяющее действие на артерии и артериолы, что способствует снижению периферического сопротивления, АД и посленагрузки. В отличие от органических нитратов, активирующих гуанилатциклазу лишь после образования S–нитрозотиола, Сиднофарм стимулирует образование цГМФ без предварительного взаимодействия с SH–группами. Поскольку действие молсидомина не зависит от SH–групп, толерантность к нему не развивается, в то время как истощение SH–групп является причиной развития толерантности к нитратам. Снижается сопротивление коронарных артерий и на 20% увеличивается кровоток, что улучшает кровоснабжение ишемизированных участков миокарда. При этом не наблюдается феномена обкрадывания миокарда. Снижается агрегация тромбоцитов, уменьшается образование тромбоксана, подавляется адгезия тромбоцитов к сосудистой стенке, увеличивается синтез простагландина (простациклина), который ингибирует агрегацию тромбоцитов и оказывает сосудорасширяющее действие [2,3]. Гемодинамические эффекты SIN–1 включают уменьшение систолического и конечного диастолического давления в левом желудочке, ударного объема, среднего артериального давления и системного сосудистого сопротивления, увеличение частоты сердечных сокращений и диастолического коронарного кровотока [17]. Кроме того, SIN–1 ингибирует внутрикоронарную агрегацию тромбоцитов in vitro [18] и при внутрикоронарном введении [19], а также способствует высвобождению простациклина, также препятствующего тромбообразованию [20]. В то же время прием молсидомина внутрь в дозе 8 мг 3 раза/сут. значимо не влиял на реологию крови у пациентов с ИБС [21]. Возможно также, что метаболит молсидомина SIN–1C обладает иммуномодулирующими свойствами, что может благоприятно влиять на течение иммунных процессов в очаге некроза при инфаркте миокарда. При длительном использовании сиднониминов толерантность к ним или к нитратам не развивается [16,22]. Действие молсидомина проявляется через 15–20 мин., продолжительность действия – от 1 до 6 ч (в среднем 4 ч). Для профилактики приступов стенокардии таблетки по 2–4 мг принимают 2–3 раза/сут. после еды либо применяется форма пролонгированного действия – таблетка 8 мг (ретард) 1 раз/сут. В более тяжелых случаях можно применять таблетку по 4 мг (форте) 3 раза/сут. или по 8 мг (ретард) 2 раза/сут. Для купирования приступов стенокардии при плохой переносимости нитроглицерина можно принять сублингвально 1–2 мг молсидомина (1/2–1 таблетку по 2 мг). Биодоступность препарата при приеме внутрь составляет 44–59%, концентрация в плазме достигает максимума в течение 1–2 ч, дальнейший метаболизм с высвобождением оксида азота и образованием метаболитов идет быстро; период полувыведения (Т1/2) SIN–1 составляет 1–2 ч. Препарат не выделяется в неизмененном виде, 90% метаболитов выводятся из организма с мочой. В пожилом возрасте при печеночной и сердечной недостаточности эффект первого прохождения через печень уменьшается, а период полувыведения увеличивается [23]. При тяжелой печеночной недостаточности (увеличение бромсульфалеиновой пробы до 20–50%) отмечено замедление выведения и увеличение концентрации молсидомина в плазме крови. Препарат не кумулирует (в т.ч. у больных с почечной недостаточностью). Молсидомин расширяет периферические венозные сосуды, оказывает антиагрегантное, аналгезирующее и антиангинальное действие. Его венодилатирующая активность обусловлена выделением после ряда метаболических превращений оксида азота (NО), стимулирующего растворимую гуанилатциклазу, в связи с этим молсидомин рассматривается как донатор NО. В результате этого происходит накопление цГМФ, который способствует расслаблению гладких мышц стенки сосудов (в большей степени – вен). Снижение преднагрузки даже без прямого влияния на сократимость миокарда приводит к восстановлению нарушенного при ИБС соотношения между потребностью миокарда в кислороде и его поступлением (на 26% уменьшается потребность в кислороде). Препарат снимает спазм коронарных артерий, улучшает коллатеральное кровообращение, увеличивает переносимость нагрузок, уменьшает число приступов стенокардии при физической нагрузке, подавляет раннюю фазу агрегации тромбоцитов, снижает выделение и синтез серотонина, тромбоксана и других проагрегантов. У больных с хронической сердечной недостаточностью молсидомин, снижая преднагрузку, способствует уменьшению размеров камер сердца. Он снижает давление в легочной артерии, уменьшает наполнение левого желудочка и напряжение стенки миокарда, ударный объем крови. Клиническая эффективность молсидомина при ИБС оценена в ряде клинических исследований. В частности, Messin R. и соавт. [24] провели многоцентровое рандомизированное двойное слепое плацебо–контролируемое 6–недельное исследование эффективности обычной (4 мг) и ретардированной (8 мг) форм препарата у 90 больных стабильной стенокардией напряжения. На фоне терапии выявлены достоверные повышение толерантности к нагрузке и уменьшение депрессии сегмента ST во время нагрузочных проб, уменьшение частоты ангинозных приступов и потребности в нитроглицерине, причем пролонгированная форма оказалась несколько эффективнее. В 1997 г. во Франции было проведено исследование ACCORD, в котором изучалось влияние сиднониминов на просвет коронарных артерий и прогноз у 700 больных, перенесших баллонную транслюминальную ангиопластику . Препаратом сравнения был дилтиазем. В качестве первичной точки отслеживалась шестимесячная летальность в группах сравнения, вторичными точками были частота рестенозов и изменение просвета коронарных артерий при повторной коронарографии через полгода. В исследовании установлено, что линcидомин и молсидомин в большей степени увеличивают просвет коронарных артерий, уменьшают частоту рестенозов по сравнению с дилтиаземом, но не влияют на прогноз жизни коронарных больных. Этим данным отчасти противоречат результаты двойного слепого плацебо–контролируемого исследования, проведенного Wohrle J., Hoher M. и соавт. [25]. Исследование включало 166 пациентов после коронарной ангиопластики, получавших в течение 6 мес. молсидомин 8 мг/сут. или плацебо. На фоне фармакотерапии частота рестенозов оказалась такой же, как в группе плацебо, однако функциональный класс стенокардии заметно снижался. Наряду с нитратами, сиднонимины могут использоваться у больных сердечной недостаточностью. Так Spring A. и соавт. изучали динамику изменения фракции выброса у 30 пациентов с сердечной недостаточностью. На фоне базовой терапии (ингибиторы АПФ, диуретики, сердечные гликозиды) фракция выброса составляла 33,8%, а через 3 мес. после добавления к терапии молсидомина (6 мг/сут.) она значимо увеличилась (до 44,8%). Проведенное сравнение влияния 24–часовой инфузии молсидомина и изосорбида 5–мононитрата (IS–5–MN) на уровень давления в легочной артерии в рандомизированном двойном слепом плацебо–контролируемом перекрестном исследовании у 15 пациентов с NYHA II–III показало, что молсидомин в большей степени снижает давление в легочной артерии. Интересное наблюдение сделали Lee S.–D. и соавт. (2001), описавшие трех пациентов с неспецифическим аортоартериитом и легочной гипертензией, у которых ингаляция оксида азота эффективно снижала давление в легочной артерии и легочное сосудистое сопротивление. Молсидомин (в отличие от нифедипина) в дозе 4 мг оказывал такой же эффект, на длительное время снижая одышку, улучшая гемодинамические параметры и увеличивая толерантность к нагрузке. В последнее время появились также данные о возможности применения молсидомина при лечении первичной легочной гипертензии у новорожденных. Также одним из показаний для применения молсидомина может быть цирроз печени с явлениями портальной гипертензии. Известно, что применение нитратов и b–блокаторов позволяет уменьшить давление в системе воротной вены. Hori N. и соавт. в 1996 г. были опубликованы результаты экспериментального исследования на крысах, в ходе которого было показано, что молсидомин эффективнее, чем пропранолол, снижает давление в воротной вене у экспериментальных животных, а комбинация этих препаратов имеет полный аддитивный эффект. Полученные данные создают предпосылки для продолжения исследования эффективности молсидомина (Сиднофарма) при легочной и портальной гипертензии. Таким образом, Сиднофарм (молсидомин) может применяться при следующих клинических состояниях. – Стабильная стенокардия напряжения – при стенокардии напряжения II ФК препарат может применяться эпизодически в дозе 2–4 мг за 30–60 мин. до физической нагрузки (или иной ситуации, стереотипно вызывающей приступ стенокардии). При стенокардии напряжения III–IV ФК препарат может назначаться в суточной дозе 16 мг (4 мг 4 раза/сут.). – Острый коронарный синдром – применение Сиднофарма целесообразно в случаях непереносимости органических нитратов или быстрого развития толерантности к ним. Не следует применять Сиднофарм при наличии нестабильной гемодинамики. – Ранняя постинфарктная стенокардия – Сиднофарм не менее эффективно, чем органические нитраты, уменьшает количество приступов стенокардии в суточной дозе 16 мг (простая или ретардная формы). – Застойная сердечная недостаточность – Сиднофарм может использоваться как дополнение к стандартной терапии (иАПФ, диуретики, сердечные гликозиды, b–адреноблокаторы) в случаях ее недостаточной эффективности. Кроме того, Сиднофарм (молсидомин) может назначаться на ночь при развитии ночных приступов сердечной астмы. На фоне терапии молсидомином возможно развитие побочных явлений, включая артериальную гипотензию (особенно при одновременном приеме алкоголя), головную боль в начале лечения; редко наблюдаются головокружение, тошнота, аллергические реакции в виде кожных высыпаний, бронхоспазма. Возможны головная боль, замедление скорости психомоторных реакций, тошнота, потеря аппетита, диарея. Противопоказаниями к применению препарата являются кардиогенный шок; артериальная гипотония; глаукома (особенно закрытоугольная); I триместр беременности и период лактации; понижение центрального венозного давления; повышенная чувствительность к компонентам препарата. Одновременное применение Сиднофарма с сосудорасширяющими, антигипертензивными средствами и этанолом увеличивает выраженность гипотензивного эффекта. При одновременном применении Сиднофарма с ацетилсалициловой кислотой усиливается ее антиагрегантное действие. Таким образом, к преимуществам препарата относятся доказанная эффективность при ишемической болезни сердца, стенокардии напряжения и застойной сердечной недостаточности, лучшая по сравнению с нитратами переносимость и отсутствие толерантности к препарату при регулярном приеме в течение длительного времени. Все это определяет широкие перспективы применения в широкой клинической практике антиангинального препарата молсидомина (Сиднофарм), особенно в условиях роста заболеваемости сердечно–сосудистой патологией, роста резистентности к нитратам и зачастую их плохой переносимости.
Литература 1. Щукин Ю.В., Рябов А.Е. Хроническая ишемическая болезнь сердца в пожилом и старческом возрасте. Пособие для врачей. — Самара: Издательство «Волга–Бизнес», 2008. — 44 с. 2. Косарев В.В., Бабанов С.А. Клиническая фармакология лекарственных средств, применяемых при сердечно–сосудистых заболеваниях.–Самара.–«Офорт».–2010.–140с. 3. Косарев В.В., Бабанов С.А., Астахова А.В. Фармакология и лекарственная терапия. Под ред. В.К.Лепахина. М.: Эксмо, 2009. 4. Шальнова С.А., Деев А.Д., Оганов Р.Г. Факторы, влияющие на смертность от сердечно–сосудистых заболеваний в российской популяции. Кардиоваск. тер. и проф. 2005; 4 (1): 4–9. 5. Российские рекомендации «Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза». Секция атеросклероза ВНОК // Кардиоваскулярная терапия и профилактика.2004. № 2(приложение).36 с. 6. The Cholesterol and Recurrent Events Trail Investigators. The 14. effect of pravastatin on coronary events after myocardial infarction in patientd with average cholesterol levels. N Engl J Med 1998; 335: 1001–9. 7. Athyros 15. VG, Papageorgiou AA, Mercouris BR. The Greak Atorvastatin and acoranary heart disease Evaluation (GREECE) Study. Curr Med Res Opin 2002; 18: 220–8. 8. Serruys PW, de Feuter P, Macaya C et al. Intervention Prevention 16. Study (LIPID) Investigators. Fluvastatin for prevention of cardiac events following successful first percutaneous coronary intervention: a randomized controlled trail. JAMA 2002; 287: 3215–2. 9. Shepherd J, Cobbe SM, Ford I et 17. al., for the West of Scotland Coronary Prevention Study Group. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. N Engl J Med 1995; 333: 1301–7. 10. Downs JR, Clearfield M, Weis S et al., for the 18. AFCAPS/TexCAPS Research Group, (1998). Primary Prevention of Acute Coronary Events With Lovastatin in Men and Women With Average Cholesterol Levels: Results of AFCAPS/TexCAPS. JAMA 279: 1615–22. 11. Kleemann R., Kooistra T. HMG–CoA Reductase Inhibitors: Effects on Chronic Subacute Inflammation and Onset of Atherosclerosis Induced by Dietary Cholesterol. Curr Drug Targets Cardiovasc Haematol Disord. 2005 Dec;5(6):441–53. 12. Оганов Р. Г., Масленникова Г. Я. Сердечно–сосудистые заболевания в Российской Федерации во второй половине ХХ столетия: тенденции, возможные причины, перспективы. – Кардиология, 2000. – №6. – С. 4–8. 13. Ольбинская Л. И., Лазебник Л. Б. Донаторы оксида азота в кардиологии. – М., 1998. – 172 с. 14. Аронов Д.М., Лупанов В.П. Диагностика и лечение хронической ишемической болезни сердца. Качество жизни. Медицина. 2003; 2: 16–24. 15. Лупанов В.П. Стабильная стенокардия: тактика лечения и ведения больных в стационаре и амбулаторных условиях. Рус. мед. журн. 2003; 11 (9): 556–63. 16. Agvald P, Adding LC, Gustafsson LE, Persson MG. Nitric oxide generation, tachyphylaxis and cross–tachyphylaxis from nitrovasodilators in vivo. Eur J Pharmacol. 1999. 1999; 385(2–3):137–45. 17. Arkonac BM, Kersten JR, Wynsen JC, Nijhawan N, Warltier DC. Differential hemodynamic effects of the nitric oxide donor pirsidomine in comparison to SIN–1, nitroprusside, and nitroglycerin. Pharmacology. 1996; 52:92–100. 18. Darius H, Ahland B, Rucker W, Klaus W, Peskar BA, Schror K. The effects of molsidomine and its metabolite SIN–1 on coronary vessel tone, platelet aggregation, and eicosanoid formation in vitro: Inhibition of 12–HPETE biosynthesis. J Cardiovasc Pharmacol. 1984; 6:115–121. 19. Ovize M, Lorgeril M, Cathignol D, Delaye J, Renaud S. Inhibition of coronary artery thrombosis by SIN–1, a donor of nitric oxide. J Cardiovasc Pharmacol. 1990; 16:641–645. 20. Salvemini D, Currie MG, Mollace V. Nitric oxide–mediated cyclooxygenase activation: A key event in the antiplatelet effects of nitrovasodilators. J Clin Invest. 1996; 97:2562–2568. 21. Wohrle J, Nusser T, Hoffmeister A, Kestler HA, Grebe OC, Hoher M, Hombach V, Koenig W, Kochs M. . Dtsch Med Wochenschr. 2003; 128(24):1333–7. 22. Schror K, Forster S, Woditsch I. On–line measurement of nitric oxide release from organic nitrates in the intact coronary circulation. Naunyn–Schmiedeberg’s Arch Pharmacol. 1991, 344:240–246. 23. Rosenkranz B, Winkelmann BR, Parnham MJ. Clinical pharmacokinetics of molsidomine. Clin Pharmacokinet. 1996; 30(5):372–84. 24. Messin R, Karpov Y, Baikova N, Bruhwyler J, Monseu MJ, Guns C, Geczy J. Short– and long–term effects of molsidomine retard and molsidomine nonretard on exercise capacity and clinical status in patients with stable angina: a multicenter randomized double–blind crossover placebo–controlled trial. J Cardiovasc Pharmacol. 1998; 31(2):271–6. 25. Wohrle J, Hoher M, Nusser T, Hombach V, Kochs M. No effect of highly dosed nitric oxide donor molsidomine on the angiographic restenosis rate after percutaneous coronary angioplasty: a randomized, placebo controlled, double–blind trial. Can J Cardiol. 2003; 19(5):495–500. 26. Lee S.–D., Kim D.–S., Shim T.–S., Lim C.–M., Koh Y., Kim W.–S., Kim W.–D. Nitric Oxide and Molsidomine in the Management of Pulmonary Hypertension in Takayasu’s Arteritis. Chest, 2001; 119(1): 302 – 307.