Одной из функций сердца является сократимость — способность сокращаться под влиянием импульсов и выполнять функцию насоса. Элементарной сократительной единицей сердечного мышечного волокна (кардиомиоцит) является саркомер — участок миофибриллы, ограниченный с двух сторон темными линиями, так называемыми Z-линиями. Расстояние между Z-линиями зависит от степени сокращения или растяжения мышц и составляет от 1,6 до 2,2 мкм. Саркомер состоит из равномерно чередующихся светлых — анизотропных (А) и темных — изотропных (I) полос (дисков), придающих волокнам миокарда характерный исчерченный вид (рис. 1).
Рисунок 1. Равномерное чередование анизотропных дисков, участки очаговых субсегментарных контрактурных повреждений кардиомиоцитов при ЧМТ с быстрым темпом наступления смерти. Поляризационная микроскопия. Ув. 640. А-диски расположены в центре, образованы толстыми миозиновыми нитями. I-диски состоят из тонких нитей, содержащих актин, тропониновый комплекс (I, T, С), тропомиозин, титин и составляют половину ширины А-дисков [1—6].
Сокращение кардиомиоцитов является энергозависимым процессом, регулируется кальцием, аденозинтрифосфатом и сбалансированным содержанием калия, натрия, магния в миокарде [3, 7—12]. Сила сокращения сердечной мышцы зависит от ее исходной длины. Наиболее мощное сокращение саркомера наблюдают при длине 2,2 мкм. Именно при такой его длине расположение анизотропных и изотропных дисков по отношению друг к другу наиболее благоприятно для их взаимодействия, что обусловливает максимальную инотропную функцию миокарда (закон Франка—Старлинга) [4, 13—15].
Получены экспериментальные данные, что в сердечной мышце длина саркомера прямо пропорциональна длине мышцы. Если длина саркомера увеличивается до 3,65 мкм, то тонкие нити полностью выходят за пределы А-полосы и создаваемое напряжение падает до нуля. По мере уменьшения длины саркомера до 2,0—1,5 мкм I-диски сначала сужаются, а затем исчезают, в то время как ширина А-дисков остается постоянной. В этот момент Z-линии упираются в края А-полос и создаваемое напряжение приближается к нулю. В таких случаях возможны скручивание тонких нитей и их двойной перегиб. Одновременно снижается чувствительность тропонин-актинового комплекса к ионам кальция, а следовательно, и сила мышечного сокращения [16—18].
Оценку степени сокращения саркомера и его патоморфологических изменений целесообразно проводить с помощью поляризационной микроскопии. При смерти от различных причин отмечают следующие стереотипные самостоятельные типы острой патологии сердечных мышечных волокон: 1) контрактурный тип повреждения (сегментарные и субсегментарные контрактуры); 2) внутриклеточный миоцитолиз; 3) глыбчатый распад миофибрилл; 4) цитолиз; 5) релаксация; 6) трещины; 7) диссоциация [5, 19—21].
Для контрактурного типа повреждения кардиомиоцитов характерны избыточное сокращение миофибрилл и различная степень укорочения или исчезновение I-дисков. Сегментарные контрактуры захватывают всю мышечную клетку, а субсегментарные отличаются сокращением отдельных групп саркомеров. При сегментарных контрактурах I степени происходит незначительное сближение А-дисков, длина саркомеров сохраняется или несколько уменьшается, высота I-дисков не претерпевает изменений. Развитие контрактур II степени сопровождается укорочением саркомеров за счет уменьшения высоты I-дисков. Поперечная исчерченность кардиомиоцитов сохраняется. При контрактурах III степени I-диски полностью исчезают, А-диски сливаются в сплошной светящийся конгломерат, поперечная исчерченность сердечных мышечных волокон не различается [5, 19, 21—23].
Глыбчатый распад миофибрилл характеризуется распадом миофибрилл на глыбки в результате очагового мозаичного лизиса и контрактуры отдельных групп саркомеров. Внутриклеточный миоцитолиз проявляется дезагрегацией и лизисом миофибрилл на отдельном участке кардиомиоцита; перифокально участки мышечного волокна сохраняют поперечную исчерченность. Такая поляризационная микроскопическая картина получила название «вид ткани, изъеденной молью». Цитолиз выражается в том, что во внешне неизмененных мышечных клетках за счет разрушения I-дисков миофибрилл происходит постепенное исчезновение поперечной исчерченности [5, 19, 21, 22].
Релаксация кардиомиоцитов характеризуется увеличением высоты I-диска, при этом высота А-диска не меняется. Трещины сердечных мышечных волокон верифицируют по наличию тонких поперечных прямых или ступенчатых трещин по ходу сердечного мышечного волокна. Диссоциация кардиомиоцитов связана с расширением Z-полос. Контрактуры III степени, глыбчатый распад и внутриклеточный миоцитолиз считают необратимыми. Маркерами фибрилляции желудочков сердца являются участки трещин и диссоциации кардиомиоцитов. Морфологические проявления асистолии до настоящего времени не выявлены [19, 24—28].
В премортальном периоде нарушение сократительной способности миокарда сопровождается прогрессирующим снижением артериального давления. Несмотря на все разнообразие причин смерти, все они группируются в 4 типа терминальных состояний: мозговой, сердечный, легочный и смешанный. Дисбаланс электролитов в миокарде обусловливает его электрическую нестабильность. Прекращение сердечной деятельности наступает от фибрилляции желудочков сердца (98% всех случаев) или в виде асистолии [24, 26—31]. Рассмотрим некоторые причины смерти.
У погибших от изолированной черепно-мозговой травмы (ЧМТ), сопровождавшейся быстрым наступлением смерти вследствие повреждения ствола головного мозга, в поляризационной картине преобладает равномерное чередование анизотропных дисков в обоих желудочках сердца (см. рис.1)
, что соответствует физиологическому строению саркомера. При ЧМТ с непродолжительным премортальным периодом в миокарде левого и правого желудочка превалируют очаговые субсегментарные и сегментарные контрактуры кардиомиоцитов I степени
(рис. 2).
Рисунок 2. Контрактурные повреждения кардиомиоцитов I степени, очаговые субсегментарные контрактуры, трещины и диссоциация кардиомиоцитов при ЧМТ с переживанием. Поляризационная микроскопия. Ув. 500. Указанные изменения отражают минимальную степень гиперсокращения саркомеров. Независимо от темпа наступления смерти во всех случаях обнаруживали маркеры фибрилляции желудочков сердца, а показатели перикардиальной жидкости (концентрация глюкозы, натрия, калия, кальция и магния) указывали на отсутствие изменения углеводного и минерального обмена в миокарде [32—34]. Следовательно, у погибших по мозговому типу терминального состояния в случаях изолированной ЧМТ независимо от продолжительности премортального периода остановка сердца не связана с потерей сократительной способности миокарда. Она обусловлена нарушением его иннервации со стороны центральной нервной системы (ЦНС) с последующим возникновением фибрилляции желудочков сердца (фибрилляция желудочков центрального генеза).
У скончавшихся от острой ишемической болезни сердца (ИБС) при поляризационной микроскопии в левом желудочке сердца выявляли маркеры ишемического повреждения миокарда. В случаях острой коронарной недостаточности (ОКН) они представляли контрактурные повреждения кардиомиоцитов III степени (рис. 3),
Рисунок 3. Контрактурные повреждения кардиомиоцитов II—III степени, участки релаксации, трещины и диссоциация кардиомиоцитов при ОКН. Поляризационная микроскопия. Ув. 500. при остром инфаркте миокарда в донекротической стадии (ОИМДС) — сочетание контрактур III степени с зонами внутриклеточного миоцитолиза
(рис. 4)
Рисунок 4. Внутриклеточный миоцитолиз кардиомиоцитов при ОИМДС. Участки растворения миофибрилл имеют вид «ткани, изъеденной молью». Поляризационная микроскопия. Ув. 640. и глыбчатого распада миофибрилл [34—37]. Указанные изменения необратимы и связаны с полным исчезновением темных I-дисков в структуре саркомера вследствие распада тропонинового комплекса. Исследованию сердечных тропонинов при ИБС посвящено много научных работ [38—42], однако взаимосвязь между наличием сердечного тропонина I в перикардиальной жидкости и микроскопическими изменениями миокарда при острых формах ИБС была установлена [36].
Дополнительно, как при ОКН, так и при ОИМДС, в левом желудочке сердца обнаруживали зоны контрактурных изменений II степени и релаксации кардиомиоцитов, маркеры фибрилляции сердечных мышечных волокон.
В правом желудочке при обеих формах маркеры ишемического повреждения отсутствовали. Преобладали участки трещин и диссоциации кардиомиоцитов, а также контрактуры сердечных мышечных волокон I—II степени, очаговые субсегментарные контрактуры и релаксация саркомеров [34, 37, 43]. Феномен релаксации кардиомиоцитов как признак, сопутствующий ишемии миокарда, описан только для левого желудочка сердца [21, 25, 28, 45].
При ОКН распространение маркеров ишемического повреждения миокарда левого желудочка имеет «мозаичный» характер. Ишемический процесс поражает одновременно не менее трех его областей на различной глубине: в субэпикардиальных, субэндокардиальных и интрамуральных отделах. У умерших от ОИМДС появление маркеров ишемии носит очаговый характер и обычно ограничивается одной—двумя смежными областями левого желудочка. Преобладало трансмуральное поражение стенки миокарда, реже встречались субэндокардиальные или субэпикардиальные очаги. В правом желудочке зоны гиперсокращения и релаксации кардиомиоцитов локализовались в трех топографических областях, причем наиболее часто встречались в субэндокардиальных отделах миокарда. Менее часто они захватывали интрамуральные зоны, реже их наблюдали субэпикардиально [34, 37, 43].
Исследование перикардиальной жидкости при ОКН и ОИМДС установило дисбаланс электролитов с повышением содержания калия, кальция и магния, снижением концентрации натрия. У скончавшихся от ОКН нарушение углеводного обмена характеризовалось повышением содержания глюкозы, а при ОИМДС ее снижением. Отличие между острыми формами ИБС обусловлено длительностью ишемического периода [33, 34, 44].
Итак, при ОКН и ОИМДС нарушение углеводного обмена и электролитный дисбаланс обусловливают электрическую нестабильность миокарда. В левом желудочке сердца участки гиперсокращения (контрактуры II степени), распада саркомеров (контрактуры III степени, зоны внутриклеточного миоцитолиза и глыбчатого распада миофибрилл) чередуются с очагами релаксации (увеличение длины саркомеров) сердечных мышечных волокон, что обусловливает необратимую потерю его сократительной способности. В правом желудочке сердца зоны гиперсокращения (контрактуры сердечных мышечных волокон I—II степени, очаговые субсегментарные контрактуры) также сочетаются с релаксацией саркомеров кардиомиоцитов. Следствием указанных процессов является асинхронное сокращение миокарда левого и правого желудочков сердца.
Асинхронное сокращение миокарда на фоне его электрической нестабильности, по мнению ряда авторов [46—49], является причиной возникновения фибрилляции желудочков по механизму повторного входа возбуждения (re-entry). Принимая во внимание, что маркеры фибрилляции выявлены в обоих желудочках сердца одновременно, есть все основания считать, что участки потери сократительной способности миокарда как в зонах ишемического повреждения, так и в очагах релаксации кардиомиоцитов являются триггерными зонами возникновения фибрилляции желудочков [43].
Таким образом, при острых формах ИБС, которая характеризуется сердечным типом терминального состояния, остановка сердца связана с распадом структур саркомеров кардиомиоцитов и необратимой потерей его сократительной способности, что в конечном счете обусловливает возникновение фибрилляции желудочков сердца (фибрилляция желудочков кардиального генеза).
При пневмонии с помощью поляризационной микроскопии выявили маркеры фибрилляции — участки трещин и диссоциации кардиомиоцитов, а также сочетание контрактур I и II степени с релаксацией сердечных мышечных волокон в левом и правом желудочках сердца. Поляризационные изменения одновременно локализовались в передней, боковой и задней стенках левого желудочка, а также передней, боковой и задней стенках правого желудочка. Чаще других они захватывали субэндокардиальные отделы, реже интрамуральные и с наименьшей частотой встречались в субэпикардиальных зонах [34].
Исследование перикардиальной жидкости выявило нарушение углеводного (снижение концентрации глюкозы) и белкового (повышение содержания мочевины) обмена, дисбаланс электролитов (увеличение содержания магния и калия, снижение концентрации натрия) [33, 34]. Эти процессы вызваны нарушением вентиляционных, перфузионных и фильтрационных процессов в легких, нарушением проходимости дыхательных путей и гемодинамики малого круга кровообращения. Изменение газового состава крови со снижением концентрации в ней кислорода обусловливает гипоксию тканей и органов, нарушение деятельности дыхательного и сосудодвигательного центров продолговатого мозга. Повышение концентрации мочевины связано с катаболизмом белков в организме и ее усиленным синтезом в печени, а перикардиальная жидкость представляет собой ультрафильтрат крови и межклеточной жидкости [29, 31, 40—42, 50].
Таким образом, при пневмонии, которая характеризуется легочным типом терминального состояния, чередование зон гиперсокращения и релаксации саркомеров кардиомиоцитов (в разных топографических областях и на различной глубине стенки) обусловливает асинхронное сокращение миокарда левого и правого желудочков и последующее снижение сократительной способности сердца. Дисбаланс электролитов приводит к электрической нестабильности миокарда, а дисфункция дыхательного и сосудодвигательного центров продолговатого мозга вызывает нарушение его иннервации со стороны ЦНС. Следовательно, остановка сердца обусловлена фибрилляцией желудочков смешанного генеза.
У погибших от странгуляционной механической асфиксии (СМА) вследствие полного повешения с наложением петли на передней поверхности верхней трети шеи и заднебоковым расположением узла исследование микропрепаратов в поляризованном свете установило наличие распространенных субсегментарных контрактур в левом и правом желудочках сердца (рис. 5).
Рисунок 5. Распространенные субсегментарные контрактурные повреждения и зоны релаксации кардиомиоцитов при смерти от странгуляционной механической асфиксии. Поляризационная микроскопия. Ув. 640. В левом желудочке они чаще всего встречались в интрамуральных отделах, а в правом наиболее часто отмечались в субэндокардиальных зонах, реже в интрамуральных и еще реже в субэпикардиальных отделах. В обоих желудочках распространенные субсегментарные контрактуры чередовались с зонами релаксации сердечных мышечных волокон и маркерами фибрилляции желудочков. Исследование перикардиальной жидкости выявило повышение содержания глюкозы, калия, магния и кальция, снижение содержания натрия [32—34].
В настоящее время установлено, что при СМА вследствие полного повешения происходит резкое изменение газового состава крови со снижением в ней концентрации кислорода и накоплением углекислоты, токсичных недоокисленных продуктов метаболизма. Активация симпатико-адреналовой и гипофизарно-надпочечниковой систем, резкая гипоксия организма повышают автоматизм сердца, возбудимость и сократимость миокарда обоих желудочков, значительно увеличивая их потребность в кислороде. Раздражение рецепторов блуждающего нерва шеи угнетает образование импульсов в синоатриальном узле, снижает сократимость кардиомиоцитов. Итогом всех этих процессов является прогрессирующая гипоксия миокарда. Токсическое действие углекислоты и снижение парциального давления кислорода в крови действуют на сосудодвигательный центр продолговатого мозга. Смерть наступает по смешанному типу терминального состояния — мозговому и сердечному [30, 51—53].
Следовательно, в рассмотренных случаях смерти от СМА участки гиперсокращения и расслабления саркомеров кардиомиоцитов в разных топографических областях и на различной глубине стенки вызывают асинхронное сокращение миокарда левого и правого желудочков с последующим снижением сократительной способности сердца. Изменение углеводного обмена и дисбаланс электролитов приводят к электрической нестабильности миокарда. Резкая гипоксия способствует расстройству деятельности дыхательного и сосудодвигательного центров продолговатого мозга и дезорганизации его иннервации со стороны ЦНС. В связи с этим есть все основания считать, что остановка сердца обусловлена фибрилляцией желудочков смешанного генеза.
Таким образом, при изолированной ЧМТ прекращение сердечной деятельности происходит без потери его сократительной способности за счет нарушения иннервации со стороны ЦНС. При острых формах ИБС (ОКН и ОИМДС) потеря сократительной способности сердца обусловлена необратимым распадом сократительных структур саркомеров кардиомиоцитов левого желудочка, чередованием зон гиперсокращения и релаксации кардиомиоцитов правого желудочка с последующим асинхронным сокращением миокарда обоих желудочков. В случаях пневмонии и СМА (вследствие полного повешения с наложением петли на передней поверхности верхней трети шеи и заднебоковым расположением узла) снижение сократительной способности сердца обусловлено чередованием зон гиперсокращения и релаксации сердечных мышечных волокон с последующим возникновением асинхронного сокращения левого и правого желудочков сердца.
Приведенные данные получены с помощью дополнительного метода исследования — поляризационной микроскопии, которую необходимо широко внедрять в практическую деятельность бюро судебно-медицинской экспертизы. Результаты исследований необходимо использовать при решении вопросов судебно-медицинской экспертной практики.
Основы физиологии сердца
1.1. Краткий очерк морфологии сердца
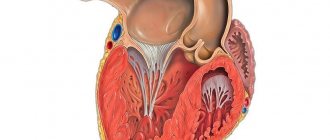
Сердце (рис. 1) является центральным органом системы кровообращения. Благодаря непрерывной сократительной деятельности сердечной мышцы осуществляется движение крови по сосудам и, следовательно, обеспечивается жизнедеятельность человека.
Сердце — полый мышечный орган, расположенный в грудной клетке, переднем средостении, так что его основание обращено к позвоночнику, а верхушка находится на уровне пятого левого межреберья книзу и внутрь от левого соска. Таким образом, продольная ось сердца проходит косо: справа и сверху вниз и влево. В результате сердце расположено в грудной клетке асимметрично: одна треть — вправо от срединной плоскости тела, а две трети — слева от нее. Асимметрия положения сердца проявляется также в том, что поверхность, обращенная кпереди, образуется главным образом стенкой правого желудочка и правого предсердия и лишь в малой степени передней стенкой левого желудочка. В клинической практике границы сердца определяются методами перкуссии или рентгеноскопии. Масса сердца взрослого человека составляет 0,40–0,46 % от массы тела (в среднем около 300 г).
Полость сердца человека подразделяется на четыре камеры: два предсердия и два желудочка. Левое предсердие и желудочек составляют вместе левое, или артериальное, сердце, перекачивающее артериальную кровь, а правое предсердие и желудочек — правое, или венозное, сердце, перекачивающее венозную кровь. Правое и левое предсердия отделены друг от друга перегородкой, также как правый и левый желудочки. Между правым предсердием и правым желудочком, равно как левым предсердием и левым желудочком, имеются предсердно-желудочковые отверстия, через которые кровь направляется в желудочки во время их сокращения.
Рис. 1.
Сердце млекопитающих:
а
— поперечный разрез: 1 — левое предсердие; 2 — ветви левой легочной вены; 3 — париетальный листок перикарда; 4 — полость перикарда; 5 — митральный клапан; 6 — эпикард (висцеральный листок перикарда); 7 — миокард; 8 — эндокард; 9 — левый желудочек; 10 — верхушка; 11 — межжелудочковая перегородка; 12 — правый желудочек; 13 — трехстворчатый клапан; 14 — правое предсердие;
б
— внутреннее строение: 1 — легочная артерия; 2 — легочные вены; 3 — левое предсердие; 4 — левый предсердножелудочковый (двустворчатый) клапан; 5 — клапан аорты; 6 — левый желудочек; 7 — межжелудочковая перегородка; 8 — правый желудочек; 9 — нижняя полая вена; 10 — правое предсердие; 11 — легочные вены; 12 — верхняя полая вена; 13 — аорта
Эти отверстия снабжены створчатыми клапанами: правое предсердно-желудочковое отверстие — трехстворчатым, или трикуспидальным, а левое предсердно-желудочковое отверстие — двустворчатым, или митральным. Во время расслабления желудочков створчатые клапаны открыты, тогда как во время сокращения желудочков эти клапаны закрывают предсердно-желудочковые отверстия, что препятствует обратному току крови из желудочков в предсердия.
От левого желудочка отходит аорта, по которой кровь устремляется в сосуды большого круга кровообращения, после чего по полым венам (верхней и нижней) возвращается в правое предсердие и далее в правый желудочек. Кроме того, в правое предсердие (через коронарный синус сердца) оттекает венозная кровь из тканей самого сердца. От правого желудочка отходит легочный ствол, по которому кровь поступает в малый круг кровообращения, а по четырем легочным венам возвращается в левое предсердие и левый желудочек.
Таким образом, движение крови осуществляется по двум последовательно соединенным в сердце кругам кровообращения. Количество крови, протекающее за единицу времени через большой и малый круги кровообращения, в норме одинаково.
Основными прогрессивными признаками в общем ходе эволюции сердца у млекопитающих и человека являются:
— полное разделение большого и малого (легочного) кругов кровообращения;
— более полное объединение синусовой области с собственным предсердием, что достигается редукцией, часто еще в раннем эмбриональном периоде, обоих синусных клапанов;
— вторичное увеличение синусовой области в объеме и изменение наклона впадающих полых вен при развитии на их устьях миокардных наслоений;
— развитие у человека в эмбриогенезе на основе задненижнего конца правого синусового клапана специальных образований: клапана каудальной полой вены (евстахиева), служащего для направления тока крови в овальное отверстие, и клапана венечного синуса (тебезиева);
— редукция левой краниальной полой вены и формирование венечного синуса, устье которого прикрывается или специальной заслонкой (крупные четвероногие), или особым клапаном (человек);
— более полное втягивание в левое предсердие устья первичной легочной вены и формирование четырех ее первичных устий; образование трех устий у четвероногих и вторичное расхождение в стороны задних легочных вен у антропоидов с формированием четырех стволов;
— концентрация внутри сердечной сумки сильных миокардных наслоений на коллекторных стволах легочных вен, формирующих специальные манжеты;
— заметная редукция ушек предсердий, особенно сильно выраженная на левом;
— стабилизация положения, формы и величины створок в предсердно-желудочковых клапанах: трех в правом и двух в левом в соответствии с условиями внутрисердечной гемодинамики;
— образование высокой и расширенной восходящей аорты при очень крутой ее дуге и формирование на границе второго излома с нисходящей аортой специфического порогообразного перешейка у человека. Данные особенности строения создают особые гемодинамические условия — своеобразную запруду с повышенным давлением — для направления потока крови вертикально к голове с крупным головным мозгом;
— тенденция у человека к смещению устьев обеих венечных артерий сердца из кармашков аортального клапана выше, непосредственно на начальную часть самой аорты (освобождение их от прикрытия полулунными створками), что создает условия для сохранения высокой величины коронарного кровотока в диастолу;
— формирование относительно крупного овального отверстия и относительно слабой проходимости артериального протока (при его ответвлении из самой конечной части легочной артерии) у антропоидов. Это позволяет быстрее переключать плацентарное кровообращение на постоянное;
— формирование у высших плацентарных в клапане овального отверстия во второй половине эмбриональной жизни особой, циркулярно расположенной сердечной мускулатуры, развитой особенно у антропоидов. Это позволяет регулировать у плода ток крови через овальное отверстие в зависимости от фаз сокращения предсердий. Прогрессивное развитие сердечной мускулатуры к рождению тем самым как бы предварительно разобщает функционально обе половины во время систолы;
— формирование на конце клапана овального отверстия во второй половине эмбриональной жизни у крупных форм млекопитающих особых эластичных сетевидных образований, помогающих закрытию при рождении овального отверстия;
— высвобождение основания сердца от облегающей его сердечной сумки с образованием серозных выростов у человека, что позволяет сердцу более свободно совершать свои движения.
Сердце окружено околосердечной сумкой, или перикардом
, который имеет два листка: внутренний (висцеральный) и наружный (париетальный). Между этими листками образуется щелевидная перикардиальная полость, выстланная мезотелием и содержащая небольшое количество серозной жидкости (в норме около 30–50 мл). Эта жидкость уменьшает взаимное трение листков перикарда при сокращениях сердца. Париетальный листок перикарда переходит в адвентицию крупных сосудов, а спереди прикрепляется к грудине. Висцеральный листок перикарда образует наружную оболочку сердца —
эпикард
.
Внутренняя оболочка сердца — эндокард
— выстилает полости сердца изнутри. Она образована соединительнотканными элементами, гладкомышечными клетками и эпителиальной тканью (эндотелием), покрывающей поверхность эндокарда, обращенную в полость сердца. Складки (дупликатуры) эндокарда образуют клапаны сердца. Между правым предсердием и правым желудочком располагается трехстворчатый, или трикуспидальный, клапан, а между левым предсердием и левым желудочком — двустворчатый, или митральный. В проксимальных отделах аорты и легочного ствола расположены полулунные клапаны, каждый из которых представляет собой три карманообразные складки, направленные свободными краями в просвет сосудов.
Основную массу сердца составляет его средняя оболочка — сердечная мышца, или миокард
, образованный целомической поперечнополосатой мышечной тканью. Миокард предсердий состоит из двух слоев: поверхностного, образованного циркулярными волокнами, который является общим для обоих предсердий, и внутреннего, образованного продольно расположенными волокнами, самостоятельными в каждом предсердии. Внутренний слой миокарда предсердий формирует вокруг устьев полых и легочных вен подобие сфинктеров, которые при сокращении предсердий почти полностью перекрывают просвет этих сосудов, препятствуя обратному току крови из предсердий в эти вены.
В желудочках миокард образован тремя слоями: поверхностным, средним и глубоким. Косо расположенные волокна поверхностно спускаются к верхушке сердца, где загибаются внутрь и переходят в глубокий продольный слой. Производными последнего являются сосочковые (папиллярные) мышцы, выступающие в просвет желудочков. От этих мышц отходят сухожильные нити (хорды), которые прикрепляются к атриовентрикулярным клапанам со стороны, обращенной в полость желудочков. При сокращении миокарда желудочков сокращаются и сосочковые мышцы. В результате сухожильные нити натягиваются и удерживают створчатые клапаны от прогибания в полость предсердий. Недостаточность этой функции, например генетически обусловленная, приводит к прогибанию (пролапсу) створок клапанов в полость предсердий во время сокращения желудочков и нарушению внутрисердечной гемодинамики.
Расположенный между поверхностным и глубоким средний слой миокарда образован циркулярными волокнами, самостоятельными для каждого желудочка. Толщина миокарда зависит от приходящейся на них нагрузки: стенки левых отделов сердца у взрослых толще стенок правых, а стенки желудочков толще стенок предсердий. Наибольшую толщину (10–15 мм) имеет стенка левого желудочка, который проталкивает кровь по сосудам большого круга кровообращения. Толщина стенок правого желудочка составляет 5–8 мм, толщина же стенок предсердий лишь около 2–3 мм. Однако при адаптации сердца к повышенной физической нагрузке, например у спортсменов, масса миокарда и толщина стенок сердца могут увеличиваться (рабочая гипертрофия миокарда).
Основным тканевым компонентом миокарда является мышечная ткань сердечного (целомического) типа. Волокна сердечной мышцы мельче волокон скелетной мускулатуры. Они имеют лентовидную форму (15–20 мкм ширины при толщине около 5 мкм) и разделены на отдельные клетки — кардиомиоциты. До 35,8 % от массы кардиомиоцитов составляют митохондрии — органоиды энергетического обмена. Кроме кардиомиоцитов в состав миокарда входят волокна соединительной ткани. Соединительнотканный каркас сердца связывает мышечные волокна между собой, а также с эндои эпикардом, влияя на механические характеристики сердечной мышцы — ее растяжимость и упругость.
Наряду с собственно миокардом в состав сердца входят две группы папиллярных (сосочковых) мышц, соединяющих внутреннюю поверхность миокарда со створками митрального и трикуспидального клапанов. В начале сокращения желудочков папиллярные мышцы тянут створки митрального или трикуспидального клапанов вниз, в полость желудочков. Удержание концов створок приводит к схлопыванию в первую очередь базальных участков створок и тем самым обеспечивает их герметичное смыкание. Поскольку папиллярные мышцы образованы такой же мышечной тканью, как и миокард, но анатомически обособлены от него, их часто используют как модельный объект для изучения биофизических закономерностей работы сердца.
В составе сердечной мышечной ткани выделяют несколько морфофункциональных разновидностей кардиомиоцитов:
1. Сократительные (типичные, рабочие) кардиомиоциты составляют 99 % массы миокарда. Они обеспечивают сократительную функцию сердца и содержат большое количество упорядоченных миофибрилл и митохондрий, имеют развитый саркоплазматический ретикулум и систему Т-трубочек.
Рис. 2.
Продольное расположение и поперечная исчерченность миофибрилл кардиомиоцитов
Для миофибрилл кардиомиоцитов, как и скелетных мышц, характерна картина продольного расположения и поперечной исчерченности, видимая под микроскопом с помощью поляризованного света (рис. 2).
В этих условиях различают светлые изотропные (I), или однородные, полосы, темные анизотропные (А), или неоднородные, полосы и поперечно расположенные им Z-полосы (нем. zwischenscheibe
— разделительные). Классической единицей продольного деления каждой миофибриллы кардиомиоцитов, как и в скелетной мышце, является саркомер, который содержит две половинки I-полосы и одну А-полосу. Границами же саркомера являются Z-полосы. Таким образом, в кардиомиоцитах, как и в скелетных мышцах, саркомер является функциональной единицей сократительного аппарата. Поскольку саркомеры в миофибрилле расположены последовательно, сокращение саркомеров вызывает сокращение миофибриллы и общее ее укорочение.
Миофибриллы, состоящие из белковых нитей — миофиламентов, — расположены в саркомере параллельно друг другу с высокой упорядоченностью и окружены мембранами цистерн саркоплазматического ретикулума, а также митохондриями. Различают два типа миофиламентов: толстые, образованные белком миозином, и тонкие, образованные другим белком — актином (рис. 2-1).
Молекула миозина состоит из длинной хвостовой части, суженной шейки и утолщенной головки. Каждая толстая нить содержит более 100 молекул миозина, собранных в пучок, в средней части которого находятся хвостовые частицы молекул, а на обоих концах — выступающие над поверхностью нити головки. Каждая тонкая нить состоит из двух линейных молекул актина, спирально скрученных друг с другом. В желобках между нитями актина уложены линейные молекулы белка тропомиозина (по две пары молекул на один шаг спирали актиновой нити). Вблизи соединений между двумя последовательными молекулами тропомиозина к актину прикрепляются глобулярные молекулы еще одного белка — тропонина, состоящего из трех субъединиц: I, T и С. Он принимает участие в процессах сопряжения возбуждения и сокращения рабочего миокарда.
Рис. 2-1.
Работа актомиозинового комплекса:
а
— тонкий филамент состоит из трех протеинов. Его основу составляет актин. В состоянии расслабления миозинчувствительный сайт молекулы актина заблокирован тропомиозином. Когда кальций присоединяется к тропонину, последний претерпевает конформационную перестройку, в результате которой становится возможным взаимодействие актина и миозина;
б
— присоединение головки миозина к актину;
в
— скольжение тонких и толстых филаментов относительно друг друга. В результате гидролиза молекулы АТФ образуются АДФ и неорганический фосфат Pi;
г
— присоединение новой молекулы АТФ к головке миозина
2. Проводящие (атипичные, специализированные) кардиомиоциты имеют слабо развитый сократительный аппарат и формируют проводящую систему сердца. Среди этого вида кардиомиоцитов различают Р-клетки и клетки Пуркинье:
а) округлые Р-клетки (англ. рale
— бледный) со светлой цитоплазмой, почти лишенной сократительных элементов, обладают способностью периодически генерировать электрические импульсы, обеспечивая (в норме) автоматию сердечной мышцы;
б) клетки Пуркинье имеют протяженную форму с большим диаметром и образуют волокна, осуществляя быстрое, незатухающее, своевременное и синхронное проведение возбуждения к сократительным кардиомиоцитам. Автоматия у клеток Пуркинье есть, но выражена в меньшей степени, чем у Р-клеток.
3. Переходные кардиомиоциты, или Т-клетки (англ. transitional
— переходный), располагаются между проводящими и сократительными кардиомиоцитами и имеют промежуточные цитологические характеристики. Эти клетки обеспечивают взаимодействие остальных типов кардиомиоцитов.
4. Секреторные кардиомиоциты располагаются преимущественно в предсердиях и выполняют эндокринную функцию. В частности, эти клетки секретируют во внутреннюю среду предсердный натрийуретический пептид — гормон, принимающий участие в регуляции водно-электролитного баланса и артериального давления.
Морфологически сердечная мышечная ткань, в отличие от скелетной, не имеет симпластического строения, однако отдельные кардиомиоциты и структурно, и функционально тесно связаны друг с другом посредством вставочных дисков, особенно хорошо выраженных между сократительными кардиомиоцитами. Механическую связь обеспечивают находящиеся в области вставочного диска десмосомы и интердигитации, а функциональное взаимодействие — щелевые контакты (англ. gap junctions
), или нексусы. В зоне щелевых контактов, которая занимает около 10–20 % площади вставочного диска, мембраны соседних клеток находятся на очень малом (около 2–3 нм) расстоянии друг от друга и пронизаны каналами, которые представляют собой сложные белковые комплексы (коннексоны) и проницаемы для ионов. Такое строение межклеточных контактов обеспечивает их низкое электрическое сопротивление и свободную передачу электрического сигнала от одной клетки к другой (по типу электрического синапса). Вставочные диски, расположенные на торцах клеток, соединяют кардиомиоциты «конец в конец», что приводит к образованию мышечных волокон, которые также связаны друг с другом посредством вставочных дисков.
Таким образом, кардиомиоциты объединены в непрерывную электрическую сеть — функциональный синцитий, что отличает миокард от скелетных мышц. Вследствие данных особенностей строения миокарда возбуждение, возникшее в одном кардиомиоците, с высокой скоростью передается на другие клетки и быстро охватывает миокард целиком. Однако при повреждающих воздействиях на сердце, например в условиях гипотермии, проницаемость каналов в области щелевых контактов резко снижается, что приводит к нарушениям проведения возбуждения в миокарде. Важно также отметить, что большая часть мышечных волокон предсердий и желудочков прикреплена к фиброзной ткани, которая разделяет камеры сердца и электрически изолирует их друг от друга. В результате возможно раздельное последовательное сокращение предсердий и желудочков.
Все клетки миокарда являются высоко дифференцированными и не обладают способностью к делению, поэтому в постэмбриональном периоде жизни человека мышечная ткань сердца не способна к регенерации и процессы рабочей гипертрофии миокарда развиваются за счет увеличения размеров и объема отдельных кардиомиоцитов, а не их общего количества (гиперплазии). В случае некроза участка миокарда (инфаркта), например при ишемической болезни сердца, поврежденный участок замещается соединительной тканью, что приводит к формированию рубца. Поэтому при лечении инфаркта миокарда перспективным является использование стволовых клеток. Указанные клетки при их введении непосредственно в миокард под влиянием клеточных факторов роста могут превращаться в кардиомиоциты и восполнять, таким образом, утраченную сократительную функцию участка миокарда. Однако широкое применение клеточных технологий в клинической практике требует наличия дорогостоящего высокотехнологичного оборудования и проведения дополнительных клинических исследований.