Введение
Одной из редко встречающихся и трудно диагностируемых, преимущественно врожденных, первичных кардиомиопатий является некомпактный, или губчатый, миокард левого желудочка, который проявляется гипертрофией миокарда левого желудочка, его чрезмерной трабекуляцией и образованием широких межтрабекулярных пространств вследствие нарушения внутриутробного процесса уплотнения миокарда. Диагностика некомпактного миокарда левого желудочка затруднена по причине отсутствия типичных клинических признаков заболевания и недостаточности знаний.
История выявления заболевания
Первые сведения о некомпактном миокарде левого желудочка относятся к 1932 году, когда S. Bellet при проведении аутопсии новорожденного с атрезией аорты и коронарно-желудочковой фистулой выявил губчатую структуру миокарда. В 60–70-х годах прошлого столетия в зарубежной литературе стали появляться публикации, где описывались изменения миокарда в виде повышенной трабекулярности в сочетании с различной патологией сердца: обструкцией выносящего тракта левого и правого желудочков, комбинированным цианотическим врожденным пороком сердца, дефектом межпредсердной перегородки, дефектом межжелудочковой перегородки, стенозом легочной артерии, аномалией коронарных артерий. Однако данная патология определяется как неизолированный некомпактный миокард желудочков.
Позднее было показано, что некомпактный миокард левого желудочка может также встречаться в сочетании с нейромышечными заболеваниями, такими как метаболическая миопатия, синдромы Barth, Ohtahara и другие. В литературе описаны случаи некомпактного миокарда при наследственных дефектах лицевого черепа — выступающий лоб, двустороннее косоглазие, микрогнатия, расщепление неба и др.
В 1984 году была описана изолированная патология в виде синусоиды в левом желудочке. Годом позднее авторами был описан случай диагностированной атипичной дилатационной кардиомиопатии у 21-летней пациентки, у которой в возрасте 15 лет была выявлена острая левожелудочковая недостаточность. Эхокардиографическое обследование выявило каналоподобные структуры в утолщенном и гипокинетическом миокарде левого желудочка; ангиография выявила «сотовую» структуру стенки левого желудочка. Через год те же авторы описали подобный клинический случай у 21-летнего студента при проведении аутопсии с выявленными выраженными синусоидами в гипертрофированном миокарде. В 1990 году были представлены результаты наблюдения 8 случаев некомпактного миокарда у детей. Несмотря на то, что количество публикаций о случаях некомпактного миокарда левого желудочка в доступных литературных источниках увеличивается, сведений об изолированном некомпактном миокарде у детей недостаточно [1, 5, 6, 8, 10].
Эпидемиология
Распространенность некомпактного миокарда левого желудочка составляет, по данным некоторых авторов, 0,05–0,24 %, других — 0,014–0,14 % в общей популяции. Можно предположить, что в связи с появлением новейших современных методов диагностики выявляемость, а следовательно, и распространенность данной патологии может увеличиться. Известно, что некомпактный миокард у пациентов мужского пола встречается чаще, чем у лиц женского пола, и составляет от 56 до 82 % [8, 9].
Авторы приводят ссылку на данные 2003 года об эпидемиологическом исследовании первичных кардиомиопатий у детей Австралии, где некомпактный миокард был выявлен в 9,2 % случаев от общего числа первичных кардиомиопатий и находился на третьем месте после дилатационной и гипертрофической кардиомиопатий [1].
Патогенез
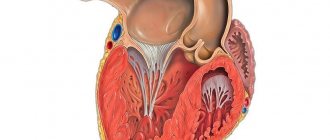
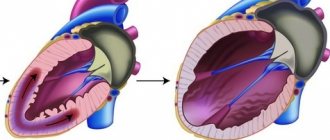
Нарушения в эмбриогенезе происходят на ранних стадиях. В норме к 26-му дню внутриутробного развития миокард представлен сложной губчатоподобной структурой из мышечных трабекул с множественными межтрабекулярными карманами — лакунами. Такое строение является необходимым условием нормального развития, поскольку в этом периоде еще не сформированы коронарные сосуды и юные кардиомиоциты вынуждены потреблять кислород непосредственно из камер сердца. К 31-му дню стенки сердца уплотняются, лакуны закрываются и частично участвуют в формировании коронарных сосудов. Если уплотнения миокардиальных волокон по какой-либо причине не происходит, в таком случае ребенок рождается с редкой аномалией — некомпактным (губчатым) миокардом. Основной признак этого заболевания — глубокие трабекулы в миокарде левого желудочка и межжелудочковой перегородке, что влечет за собой снижение систолической функции левого желудочка. Полное неуплотнение миокарда встречается у детей и обычно сочетается с другими врожденными аномалиями, чаще всего стенозами выносящего тракта правого и левого желудочков. Смертность среди детей с сочетанной патологией полного некомпактного миокарда очень высокая. Взрослые с изолированным губчатым миокардом обычно жалоб не предъявляют, данная патология может выявляться случайно при обследовании по причине иных состояний.
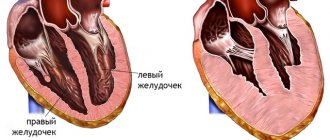
Установлено, что у здорового ребенка левый желудочек имеет до трех видимых трабекул и является менее трабекулярным по сравнению с правым желудочком. В случае внутриутробного нарушения эндомиокардиального морфогенеза происходят процессы дезорганизации уплотнения миокарда. В период эмбриогенеза углубления взаимодействуют с эндокардом желудочка и при дальнейшем уплотнении миокарда преобразуются в капилляры. Некомпактный миокард представлен наличием более трех глубоких межтрабекулярных углублений в гипертрофированных сегментах миокарда левого желудочка. Кроме того, желудочки часто бывают при этом гипокинетическими. Установлено, что глубокие межтрабекулярные выемки покрыты эпителием, что указывает на родство с эндокардом желудочка. В отличие от установленных нарушений в левом желудочке дифференцировать повышенную трабекулярность правого желудочка не представляется возможным, поскольку правый желудочек в норме имеет повышенную трабекулярность. Однако полностью этиопатогенетические механизмы развития заболевания до настоящего времени не изучены [1, 2, 9].
Изолированный губчатый миокард
Нарушения в эмбриогенезе происходят на ранних стадиях. В норме к 26-му дню внутриутробного развития миокард представлен сложной губчатоподобной структурой из мышечных трабекул с множественными межтрабекулярными карманами — лакунами. Такое строение является необходимым условием нормального развития, поскольку в этом периоде еще не сформированы коронарные сосуды, и юные кардиомиоциты вынуждены потреблять кислород непосредственно из камер сердца.
К 31-му дню стенки сердца уплотняются, лакуны закрываются и частично участвуют в формировании коронарных сосудов. Если уплотнения миокардиальных волокон по какой-либо причине не происходит, рождается ребенок с редкой аномалией — некомпактным (губчатым) миокардом. Полное неуплотнение миокарда встречается в педиатрической практике и, как правило, сочетается с другими врожденными аномалиями. Чаще всего это стенозы выносящего тракта правого и левого желудочков. Смертность среди таких больных очень высока. У взрослых пациентов изолированный губчатый миокард может не сопровождаться клиническими симптомами и обнаруживаться при обследованиях по другому поводу. Морфологически некомпактный миокард представлен большим количеством гипертрофированных трабекул с межтрабекулярными карманами. Рубчатость обусловлена глубокими инвагинациями, выстланными эндотелием и проникающими близко к эпикардиальной поверхности. Карманы имеют прямое сообщение с полостью левого желудочка, а с коронарной циркуляцией их связь отсутствует.
Такое строение миокарда наблюдается у некоторых позвоночных — рыб, рептилий, амфибий. Большинство исследователей сходится во мнении, что эхокардиография является ведущим методом в определении этой патологии. Более того, считается, что выявленных этим методом специфических изменений достаточно для постановки диагноза. Эхокардиографическими признаками губчатого миокарда являются: отсутствие других сердечных аномалий; утолщение миокарда левого желудочка с повышенной трабекуляризацией более одного сегмента стенки левого желудочка, двухслойность миокарда, толщина губчатого слоя в 2 раза больше толщины непораженного миокарда; обширные межтрабекулярные карманы, сообщающиеся с полостью левого желудочка.
Длительное время больной с изолированным губчатым миокардом может не предъявлять никаких жалоб. Описываются семейные случаи заболевания, есть упоминания о внезапной смерти или смерти в раннем детском возрасте у родственников. Часты желудочковые нарушения ритма, эмболические осложнения. Причины и электрофизиологические механизмы до сих пор неизвестны. Высказывались предположения, что неупорядоченное строение миокардиальных трабекул, изометрическое сокращение с увеличенным внутристеночным напряжением, ограничение коронарного кровоснабжения в участках с некомпактным миокардом могут быть предпосылками опасных для жизни аритмий.
При данной аномалии встречались признаки миокардиальной ишемии с изменениями конечной части желудочкового комплекса на электрокардиограмме. При ангиографии у таких больных определяются коронарные артерии, а при аутопсии — ишемические изменения в трабекулах и уплотненном миокарде.
Рядом исследователей проводилась оценка регионального миокардиального кровотока методом позитронной эмиссионной томографии. Было высказано мнение, что причиной ишемии служит дисфункция сосудов микроциркуляторного русла миокарда. Причем преобладающим местоположением некроза и фиброза являлся субэндокардиальный некомпактный слой, а не эпикардиальный уплотненный. При воздействии дипиридамола обнаруживалось ухудшение кровенаполнения как неуплотненного, так и уплотненного слоев, причем первого — существенно больше.
Генетические аспекты
В литературе имеются данные как о спорадических формах заболевания, так и о семейных случаях изолированного некомпактного миокарда левого желудочка. Изолированный некомпактный миокард левого желудочка — генетически гетерогенное заболевание. Авторами выделяются несколько типов синдрома некомпактного миокарда левого желудочка: тип 1 — наблюдается утолщение стенки левого желудочка и межжелудочковой перегородки без дилатации левого желудочка, тип 2 — наблюдается сочетание признаков некомпактного миокарда левого желудочка и дилатационной кардиомиопатии и Х-сцепленный тип.
1-й тип синдрома некомпактного миокарда левого желудочка наследуется по аутосомно-доминантному типу, в некоторых случаях является результатом новых мутаций. При этом типе наблюдается как изолированный синдром некомпактного миокарда левого желудочка, так и его сочетание с пороками сердца. Чаще всего встречаются дефекты межпредсердной перегородки, изолированный или множественные дефекты межжелудочковой перегородки, стеноз легочных артерий и другие пороки. Причиной этого заболевания являются мутации в гене дистробревина, который расположен в локусе 18q12.1-q12.2.
2-й тип наследуется по аутосомно-доминантному типу. Сочетания синдрома некомпактного миокарда левого желудочка с пороками сердца не отмечается. Ген, ответственный за это заболевание, до сих пор еще не известен, однако картирован локус 11р15, сцепленный с этим заболеванием. Поэтому прямая диагностика этого заболевания пока невозможна.
Х-сцепленный тип наследуется по Х-сцепленному рецессивному типу. Это редкое наследственное заболевание развивается в результате мутаций в гене G 4.5 (TAZ), который расположен на Х-хромосоме в области Xq28. Указанный ген кодирует белок таффазин, являющийся необходимым структурным компонентом мембран скелетной и сердечной мышц, а также принимает участие в морфогенезе миокарда. С этим геном связывают синдром Барта, другие Х-сцепленные инфантильные кардиомиопатии и Х-сцепленный фиброэластоз эндокарда. Хотя у взрослых пациентов данной мутации не выявлено, что может свидетельствовать о других причинах заболевания. Прямая ДНК-диагностика данного типа заболевания может подтвердить наличие заболевания. Женщины могут быть носительницами мутантного гена, они имеют 50% вероятность передать ген, несущий мутацию, сыновьям. Все дочери женщин-носительниц будут здоровы, но половина из них — также носительницами мутантного гена. Однако не у каждой матери, родившей мальчика с синдромом некомпактного миокарда левого желудочка, выявляется мутантный ген. Данный факт можно объяснить тем, что мутация у больного произошла впервые. Для выяснения носительства мутантного гена необходимо проведение молекулярно-генетических методов обследования [7].
Некомпактного левого желудочка синдром
Синдром некомпактного миокарда левого желудочка (left ventricular non-compaction, губчатый миокард) – один из редких видов кардиомиопатий. в соответствии с определением и классификацией кардиомиопатий ВОЗ (1995) относится к категории «неклассифицируемые кардиомиопатии». Заболевание является нарушением развития миокарда в процессе эмбрионального развития. Основной признак этого заболевания – глубокие трабекулы в миокарде левого желудочка и межжелудочковой перегородке, что влечет за собой снижение систолической функции левого желудочка. В части случаев в патологический процесс может вовлекаться миокард правого желудочка. Заболевание является клинически и генетически гетерогенным. Как правило, при этом заболевании наблюдается утолщение стенок межжелудочковой перегородки и левого желудочка без его дилатации. Сочетание дилятационной кардиомиопатии и признаков некомпактного миокарда левого желудочка может указывать за один из видов дилатационной кардиомиопатии (ДКМП, 1С, MIM: 601493), вызываемой мутациями в гене LDB3, который расположен в области 10q22.2-q23.3. Возможности ДНК-диагностики: В настоящее время поиск мутаций в гене LDB3 в ЦМГ не проводится, однако возможна ее разработка по запросу. Синдром НМЛЖ, тип 1 (MIM: #604169) наследуется по аутосомно-доминантному типу, часть случаев является результатом новых мутаций. При этом типе наблюдается как изолированный синдром НМЛЖ, так и его сочетание с пороками сердца. Чаще всего встречаются дефекты межпредсержной перегородки (ДМПП), изолированный или множественные дефекты межжелудочковой перегородки (ДМЖП), стеноз легочных артерий, однако описаны и некоторые другие виды пороков. Причиной этого заболевания являются мутации в гене дистробревина (DTNA), который расположен в локусе 18q12.1-q12.2. Возможности ДНК-диагностики: В настоящее время поиск мутаций в гене DTNA в ЦМГ не проводится, однако возможна ее разработка по запросу. Синдром НМЛЖ, тип 2 (MIM: #604169) наследуется по аутосомно-доминантному типу. При этом типе, как правило, не наблюдается сочетания НМЛЖ с пороками сердца. Ген, ответственный за это заболевание, в настоящее время неизвестен, однако картирован локус 11p15, сцепленный с этим заболеванием. Возможности ДНК-диагностики: В настоящее прямая ДНК-диагностика этого заболевания невозможна. Синдром НМЛЖ, Х-сцепленный тип (MIM: #300183) наследуется по Х-сцепленному рецессивному типу. Это редкое наследственное заболевание, развивается в результате мутаций в гене G4.5 (TAZ), расположенном на Х-хромосоме в области Xq28. Этот ген кодирует белок тафаззин, который является необходимым структурным компонентом мембран скелетной и сердечной мышц, принимает участие в морфогенезе миокарда. Возможности ДНК-диагностики: С 2006 года в ЦМГ проводится прямая ДНК-диагностика этого заболевания. Частота Частота синдрома некомпактного миокарда левого желудочка (НКЛЖ) неизвестна. Предполагается, что это заболевание встречается редко. Наследование: синдром НКЛЖ наследуется по Х-сцепленному рецессивному типу. Женщины могут являться носительницами мутантного гена, при этом у них есть 50% вероятность передать ген, несущий мутацию, сыновьям. Все дочери женщин-носительниц будут здоровы, но половина из них также будут носительницами мутантного гена. Важно помнить, что не каждая мать, у которой родился мальчик с синдромом НКЛЖ, является носительницей мутантного гена. Часть случаев этого заболевания является результатом мутаций, возникших впервые у больного. Вопрос о том, является или не является женщина носительницей заболевания, может быть решен только при помощи молекулярно-генетических методов. Клинические симптомы: основным симптомом этого заболевания являются глубокие трабекулы в миокарде левого желудочка сердца и/или межжелудочковой перегородке. Чаще всего патологический процесс локализуется в области верхушки сердца, нижней и боковой стенках левого желудочка. У части больных могут выявляться некоторые симптомы синдрома Барта (здесь должна быть ссылка на страничку с синдромом Барта). У части пациентов развиваются желудочковые нарушения ритма и проводимости. Описаны случаи формирования тромбов в области трабекул и тромбоэмболические осложнения. Лечение: Специфического лечения при синдроме НМЛЖ в настоящее время не существует. В ряде случаев возможно хирургическое лечение. Основную угрозу для здоровья и жизни больных представляет развитие и прогрессирование сердечной недостаточности. Необходима профилактика тромбоэмболических осложнений. Диагностика: Для диагностики синдрома НМЛЖ необходимо: — Эхографическое исследование сердца; — ЭКГ и холтеровское мониторирование; — поиск мутаций в гене TAZ молекулярно-генетическими методами у больных, а также диагностика гетерозиготного носительства у родственниц пациентов (исследование может быть выполнено в ЦМГ). Важно знать, что семьям, в которых наблюдались случаи синдрома НМЛЖ, рекомендуется медико-генетическое консультирование.
При проведении пренатальной (дородовой) ДНК-диагностики в отношении конкретного заболевания, имеет смысл на уже имеющемся плодном материале провести диагностику частых анеуплоидий (синдромы Дауна, Эдвардса, Шерешевского-Тернера и др), пункт 54.1. Актуальность данного исследования обусловлена высокой суммарной частотой анеуплоидий — около 1 на 300 новорожденных, и отсутствием необходимости повторного забора плодного материала.
Некомпактного левого желудочка синдром
Классификация
С 1995 года по предложению ВОЗ согласно классификации кардиомиопатий некомпактный миокард был отнесен в группу неклассифицируемых кардиомиопатий. В соответствии с классификацией кардиомиопатий, предложенной Американской ассоциацией сердца (АНА, 2006), некомпактный миокард левого желудочка относится к первичным генетическим кардиомиопатиям (неклассифицируемым кардиомиопатиям). С 2008 года Европейское общество кардиологов предложило классификацию известных и редких кардиомиопатий. В соответствии с указанной классификацией выделены две больших группы кардиомиопатий: семейная и несемейная. Семейная форма диагностируется при наличии заболевания более чем у одного члена семьи или если имеет место одинаковая генетическая мутация в случаях заболеваний в семье. Семейная форма кардиомиопатии чаще является моногенным заболеванием. Из врожденных несемейных кардиомиопатий в классификацию вошли только идиопатические. Приобретенные несемейные формы кардиомиопатий не вошли в указанную классификацию, поскольку приобретенные кардиомиопатии имеют существенные отличия в диагностике и лечении в связи с тем, что они являются осложнением заболевания, а не его клиническим признаком [3, 7–9].
Клинические признаки
Основными симптомами некомпактного миокарда являются проявления сердечной недостаточности, аритмии (желудочковая тахикардия, фибрилляция предсердий, синдром Вольфа — Паркинсона — Уайта), тромбоэмболии (эмболия легочной артерии, тромбы в желудочках сердца), особенно выраженные у пациентов со сниженной функцией левого желудочка. Кроме кардиологических симптомов, у детей часто наблюдался лицевой дисморфизм. У взрослых чаще всего отмечена полная блокада ножек пучка Гиса. Также у детей чаще, чем у взрослых, отмечался семейный тип заболевания. Постоянным признаком заболевания у детей и взрослых было наличие некомпактных сегментов миокарда. Тяжесть состояния пациентов обеих возрастных групп определялась степенью некомпактности миокарда [1–3, 8, 9].
Диагностика
Для диагностики некомпактного миокарда левого желудочка используют различные методы инструментального обследования: эхокардиографию, магнитно-резонансную томографию, реже — компьютерную томографию, позитронную эмиссионную томографию.
Для визуализации полости левого желудочка используется эхокардиография, чаще двухмерная, а также трехмерная. Особенно важным является использование эхокардиографии при проведении семейного скрининга с целью выявления пациентов при отсутствии жалоб и симптомов заболевания.
Главным эхокардиографическим признаком некомпактного миокарда является наличие повышенной трабекулярности левого желудочка. Однако повышенная трабекулярность может быть вариантом нормы, но при некомпактном миокарде наиболее часто ее можно определять между переднебоковой стенкой и межжелудочковой перегородкой. Для более точной диагностики некомпактного миокарда рекомендуется проведение нескольких эхокардиографических исследований, поскольку имеющаяся патологическая трабекулярность при получении плоских срезов может визуально сглаживаться. Также для дифференциальной диагностики рекомендовано использовать изображение с парастернальной короткой оси в конце систолы.
Существуют несколько вариантов критериев диагностики изолированного некомпактного миокарда левого желудочка.
Критерии диагностики изолированного некомпактного миокарда левого желудочка по T.K. Chin (1990): отсутствие каких-либо других сопутствующих структурных аномалий сердца; парастернальная проекция по длинной оси, субкостальная и верхушечная проекция; определение глубины выемок; измеренное в конце диастолы соотношение между расстояниями от поверхности эпикарда до начала выемок и от эпикарда до конца трабекул ≤ 0,5; повышенная трабекулярность и глубокие межтрабекулярные углубления.
Критерии диагностики изолированного некомпактного миокарда левого желудочка по R. Jenni (1999): отсутствие сопутствующих аномалий сердца, при визуализации на уровне парастернальной проекции по короткой оси и верхушечной проекции выявляется типичная двухслойная структура миокарда с тонким компактным внешним (эпикардиальным) слоем и более толстым некомпактным внутренним (эндокардиальным) слоем, который состоит из трабекулярной сетчатой структуры с глубокими до эндокарда углублениями (характерным является максимальное конечно-систолическое соотношение некомпактного эндокардиального слоя и компактного миокарда, составляющее 2); преобладает сегментарная локализация аномального миокарда (то есть некомпактный миокард доминирует на верхушке (около 80 %) и в средних отделах нижней и латеральной стенок желудочка); с помощью цветного допплера можно выявить глубокую перфузию межтрабекулярных углублений (в отличие от синусоидов миокарда межтрабекулярные углубления не сообщаются с коронарным кровотоком).
В 2006 году С. Lilje и соавторы предложили метод количественной оценки степени некомпактности миокарда в зависимости от значений указанного выше соотношения: величина соотношения 0,33–0,26 соответствует «мягкой» некомпактности, 0,25–0,2 — умеренной, меньше 0,2 — тяжелой. Данная величина признана прогностическим признаком дальнейшего развития заболевания и возникновения осложнений, поскольку она тесно коррелирует со степенью и скоростью развития сердечной недостаточности.
Авторы C. Stollbeger и J. Finsterer считают, что для постановки диагноза некомпактного миокарда левого желудочка необходимы следующие условия: наличие более трех трабекул, простирающихся от стенки левого желудочка в области верхушки до папиллярной мышцы и визуализирующихся хотя бы в одной позиции; перфузия межтрабекулярных пространств их желудочковой полости, зафиксированная при допплер-эхокардиографии.
Приведенные выше критерии диагностики изолированного некомпактного миокарда левого желудочка являются подтверждающими диагноз эхокардиографическими признаками.
Установлено, что чаще всего (около 80 %) поражены апикальный и средний сегменты нижней и боковой стенки левого желудочка.
Метод магнитно-резонансной томографии при диагностике изолированного некомпактного миокарда левого желудочка является наиболее информативным, особенно при использовании трехмерной визуализации. Реже используется метод компьютерной томографии. Оба указанных метода обладают высокой разрешающей способностью и признаны весьма перспективными в диагностике некомпактного миокарда левого желудочка, хотя в литературе результаты их применения описываются недостаточно [4–6, 8, 10].
Кардиомиопатия — симптомы и лечение
По современным представлениям стратегия лечения пациента определяется в процессе разделения больных на категории в зависимости от типа кардиомиопатии.
Все больные с выявленной кардиомиопатией, независимо от течения заболевания (в том числе и бессимптомные), нуждаются в динамическом наблюдении. Кратность наблюдения и объём обследований определяются индивидуально. В обязательный перечень входят стандартные анализы (клинический и биохимический анализ крови), ЭКГ, ЭХОКГ и холтеровское мониторирование ЭКГ.
Лечебная тактика зависит от множества факторов и подбирается индивидуально. При этом учитываются анатомические особенности — обструкция выносного тракта левого желудочка, растяжение полостей сердца, наличие клапанной патологи, стадия сердечной недостаточности и также сопутствующие заболевания. Необходимо выявлять факторы, повышающие риск внезапной смерти и жизнеугрожающих аритмий [15]
К общим мероприятиям относятся ограничение значительных физических нагрузок и исключение занятий спортом, которые могут вызывать дальнейшую нагрузку на миокард [9]. Но больным кардиомиопатией не требуется полное исключение физических нагрузок и соблюдение постельного режима [10]. Уровень нагрузок, их частота, интенсивность и длительность подбираются индивидуально. Показано исключить употребление алкоголя и табакокурение.
При дилатационной кардиомиопатии необходимо лечить причину развития растяжения полостей сердца, если это возможно. В медикаментозной терапии сердечной недостаточности применяют все стандартные группы лекарств:
- ингибиторы АПФ;
- блокаторы рецепторов ангиотензина II;
- бета-блокаторы;
- блокаторы рецепторов альдостерона;
- диуретики;
- дигоксин.
Для терапии тяжёлой сердечной недостаточности рекомендованы комбинированные препараты, содержащие сакубитрил и валсартан, а также имплантируемый кардиовертер-дефибриллятор и/или сердечная ресинхронизирующая терапия. Используют пероральные антикоагулянты у пациентов с нарушения ритма сердца [12].
В лечении обструктивной кардиомиопатии некоторые группы лекарств имеют ограничения (ингибиторы АПФ, блокаторы рецепторов ангиотензина II), но применяются бета-адреноблокаторы и блокаторы кальциевых каналов. При необходимости применяют антиаритмические препараты [13].
В лечении рестриктивной кардиомиопатии упор делается на лечение основного заболевания, вызвавшего изменения в сердце. Возможно применение диуретиков [14].
Помимо лекарств в ряде случаев прибегают к хирургическим методам лечения кардиомиопатии.
При гипертрофической кардиомиопатии применяется септальная миэктомия — иссечение миокарда, расположенного в основании межжелудочковой перегородки. Она может быть дополнена и вмешательством на изменённом митральном клапане: вальвулопластикой, протезированием митрального клапана и коррекцией кольца митрального клапана.
При тяжёлой обструктивной гипертрофической кардиомиопатии рассматривается проведение операции — иссечения части сердечной мышцы или более щадящая методика — чрескожная транслюминальная алкогольная абляция. При ней через катетер вводится до 3 мл 96 % спирта в зону максимальной гипертрофии миокарда и вызывается его инфаркт. Из-за этого мышца уменьшается в размере, исчезает препятствие (обструкция) току крови через митральное кольцо. Далее проводится установка кардиостимулятора для синхронизации работы всех отделов сердца. Эта процедура проводится кардиохирургами в специализированных отделениях.
Некоторым пациентам для профилактики аритмии устанавливается особый вид стимулятора работы сердца — дефибриллятор-кардиовертер, что в итоге продлевает им жизнь [2].
И безусловно в особо тяжёлых ситуациях для спасения жизни рассматривается возможность трансплантации сердца. Это уникальные операции, проводящиеся в специализированных центрах как в Российской Федерации, так и за рубежом. Ежегодно в РФ проводится менее 100 таких операции. Пациенту с пересаженным сердцем требуется пожизненное наблюдение в центре трансплантации и приём ряда мощных препаратов, влияющих на иммунную систему [11].
Лечение
Основа терапевтической тактики у больных с губчатым миокардом — профилактика и лечение сердечной недостаточности, нарушений сердечного ритма и тромбоэмболических осложнений (прием антикоагулянтов при нарушении функции левого желудочка). Асимптоматическим пациентам и пациентам, не имеющим аритмий и признаков дисфункции левого желудочка, лечение не назначается. Некоторым больным показана трансплантация сердца. Больным со злокачественными нарушениями ритма показана имплантация кардиовертера-дефибриллятора [1, 2, 7, 9].
Прогноз у больных с некомпактным миокардом левого желудочка зависит от объема пораженных сегментов, общей сократительной способности миокарда, времени возникновения и скорости нарастания симптомов сердечной недостаточности. По данным I. Jedlinsky и соавторов, смертность в течение 6 лет составила 50 %. Из 34 пациентов, наблюдавшихся в исследовании E. Oechslin и соавторов, на протяжении 44 месяцев умерли 12 больных, у 6 из которых была диагностирована внезапная сердечная смерть, у 4 — терминальная сердечная недостаточность, четырем пациентам проведена пересадка сердца, еще четырем установлен кардиовертер-дефибриллятор. Особенно неблагоприятный прогноз у пациентов с фракцией выброса менее 35 %. К факторам, указывающим на неблагоприятный прогноз заболевания, относят: большой конечно-диастолический размер левого желудочка, постоянную фибрилляцию предсердий, блокаду ножек пучка Гиса на электрокардиограмме.
При проведении патологоанатомических исследований установлено, что изолированный некомпактный миокард характеризуется наличием гипертрофированных сегментов стенки левого желудочка, которая состоит из некомпактного эндокардиального слоя, в котором отмечается повышенная трабекулярность, и тонкого эпикардиального компактного слоя. Глубокие межтрабекулярные выемки сообщаются с полостью левого желудочка, но не с коронарным кровотоком, в отличие от некомпактного миокарда, связанного с другими врожденными пороками сердца, когда межтрабекулярные углубления сообщаются с полостью левого желудочка и сосудами коронарного кровообращения (неизолированный миокард) [1, 2, 8, 10].
Патогенез и клиника
Патогенез складывается из сердечной недостаточности, синдрома нарушений ритма, тромбоэмболического синдрома.
Сердечная недостаточность выходит на ведущее место в клинике данного заболевания. Из-за нарушенной архитектоники строения миокарда происходит нарушение его сократительной способности. При тяжелой степени некомпактности клиническая картина данного синдрома наиболее выражена с преобладанием недостаточности по обоим кругам кровообращения и с выраженным снижением общей сократительной способности миокарда. Как правило, у некоторых пациентов клиника заболевания может манифестировать в результате запуска воспалительного процесса в миокарде, а в ряде случаев, при благоприятном течении, некомпактный миокард можно выявить впервые у лиц пожилого возраста. В клинической картине заболевания на первое место может выходить болевой синдром, который выражается приступами стенокардии. Это объясняется большей потребностью в кислороде некомпактного слоя миокарда, который не кровоснабжается основными ветвями коронарных артерий, а кровоснабжение его происходит непосредственно из полости левого желудочка.
Синдром нарушений ритма проявляется чаще всего желудочковыми нарушениями ритма — более чем в половине случаев (экстрасистолия, нередко и высоких градаций). В четверти случаев наблюдается фибрилляция предсердий. Также, вследствие эндомиокардиального фиброза с захватом проводящей системы сердца наблюдаются нарушения проводимости по типу АВ, СА-блокад.
Конечно же, нарушение глобальной систолической функции, наличие нарушений ритма сердца, а в частности фибрилляции предсердий, наличие глубоких лакун предрасполагает к образованию тромбов в полости левого желудочка, а отсюда и тромбоэмболических осложнений (кардиоэмболические инсульты, ТИА, мезентериальный тромбоз).
Клинический случай некомпактного миокарда левого желудочка у девочки 6 лет
Ребенок Меланья Б. родилась от первой беременности, протекавшей на фоне хронического пиелонефрита матери и хронической внутриутробной гипоксии плода, от первых срочных родов в сроке гестации 39 недель с массой тела 3700 г. В родах отмечена короткая пуповина. На 1-е сутки после рождения диагностирована родовая травма — ротационный подвывих первого шейного позвонка С1, клинически проявлялся признаками синдромов двигательных нарушений и вегетовисцеральных расстройств. При проведении нейросонографии выявлены УЗ-признаки перивентрикулярной ишемии I–II степени. В связи с наличием признаков постгипоксического синдрома дезадаптации сердечно-сосудистой системы девочке была проведена эхокардиография, при этом были выявлены эхо-признаки малой аномалии развития сердца — аномальная хорда левого желудочка, гипертрабекулярность левого и правого желудочков, разрастание папиллярных мышц, кардит.
Из роддома девочка была переведена в отделение патологии новорожденных. Дополнительно к перечисленным обследованиям предусмотрена эхокардиография на 12-е сутки жизни: камеры сердца не расширены, патологических шунтов не выявлено, хордальные особенности левого желудочка, систолодиастолическая функция левого желудочка не изменена. На электрокардиограмме — замедление атриовентрикулярной проводимости, диффузные изменения миокарда желудочков. После проведенного лечения девочка была выписана домой в возрасте 1 месяца с рекомендациями наблюдения у кардиолога, невропатолога, педиатра.
В дальнейшем состояние ребенка постепенно ухудшалось, нарастали явления сердечной недостаточности, в связи с чем девочка в возрасте 5 месяцев была госпитализирована в кардиоревматологическое отделение Луганской городской многопрофильной детской больницы № 1 с диагнозом: врожденный неревматический кардит тяжелой степени, декомпенсированный, нарушение кровообращения IIА степени, тимомегалия II степени, малая сердечная аномалия, синдром двигательных нарушений, перинатально обусловленный. При обследовании на электрокардиограмме — дилатация левого желудочка с систолической перегрузкой, диффузные изменения миокарда. На повторной электрокардиограмме через 4 дня — дилатация левого желудочка и левого предсердия с митральной вторичной недостаточностью IIБ степени, возможно, на фоне перенесенного миокардита, снижение систолодиастолической функции левого желудочка. На эхокардиограмме через 9 дней — умеренное расширение левых камер сердца, снижение сократимости миокарда левого желудочка, умеренная индивидуальная повышенная трабекулярность левого желудочка. Консультация кардиохирурга: порока сердца нет. В отделении ребенку впервые был назначен дигоксин. Из отделения девочка была выписана по настоянию родителей в возрасте 5 месяцев 13 дней.
В возрасте 8 месяцев состояние девочки ухудшилось, она снова была госпитализирована в кардиоревматологическое отделение с диагнозом: врожденный неревматический кардит, тяжелое течение. Стадия декомпенсации, нарушение кровообращения IIБ степени, относительная недостаточность митрального и трикуспидального клапанов, замедление статокинетической функции, рахит II степени, подострое течение, гипотрофия I степени, иммунодефицитное состояние. Через две недели девочка выписана домой с улучшением состояния.
В дальнейшем ребенок неоднократно был консультирован кардиологом, обследован, получал лечение. На электрокардиограмме в возрасте ребенка 9 месяцев выявлены признаки неполной блокады правой ножки пучка Гиса.
В возрасте 1 года 3 месяцев девочка была обследована и консультирована в условиях научно-практического медицинского центра детской кардиологии и кардиохирургии г. Киева, где был выставлен диагноз: кардиомиопатия, некомпактный миокард левого желудочка, выраженная митральная недостаточность, высокая легочная гипертензия. Были даны рекомендации по дальнейшей тактике обследования и лечения больной. В дальнейшем девочка регулярно обследовалась и получала лечение в указанном центре.
Магнитно-резонансная томография сердца без внутривенного контрастирования была проведена в возрасте 3 лет и 2 месяцев. На серии томограмм отмечается расширение полостей обоих желудочков (размер левого желудочка 5,6 x 3,6 x 3,6 см, правого — 4,4 x 2,25 см), значительно увеличено левое предсердие, наблюдается умеренная недостаточность атриовентрикулярных клапанов. Эндокард левого желудочка имеет открытую трабекулярную структуру с относительным истончением компактной субэпикардиальной части до 0,25 см. Диастолическое соотношение некомпактной и компактной части левого желудочка равно 1,25/0,25 см. Аналогичные структурные изменения миокарда определяются в правом желудочке. Фракция выброса левого желудочка — 27 %. Небольшое количество жидкости в полости перикарда. Генетически девочка не обследована.
В связи с ухудшением состояния девочка снова была направлена на лечение в возрасте 5 лет и 3 месяцев. Диагноз: некомпактный миокард левого желудочка. Выраженная недостаточность трикуспидального и митрального клапанов, дилатация левых отделов сердца, выраженная легочная гипертензия. На эхокардиограмме — левые отделы сердца расширены, сократимость миокарда удовлетворительная. Выраженная трабекулярность задней стенки левого желудочка, толщина компактной части 2,5 мм, некомпактной — 12 мм. Заключение: некомпактный миокард левого желудочка, недостаточность трикуспидального и митрального клапанов, дилатация левых отделов сердца, выраженная легочная гипертензия. Повторная эхокардиография через 10 дней лечения выявила: расширены левые отделы сердца, сократимость миокарда хорошая (положительная динамика на фоне лечения). Диастолические расстройства левого желудочка III типа (рестриктивный). Выраженная трабекулярность левого желудочка (некомпактный миокард). Жидкости в полости перикарда и плевральных полостях нет. В период лечения девочка получала добутамин, лазикс, аспаркам, дигоксин, берлиприл, панангин, верошпирон. Учитывая положительную динамику клинического состояния больной, консилиум врачей принял решение, что хирургическое лечение не показано, рекомендовано продолжать лечение амбулаторно. В настоящее время состояние девочки компенсированное.
Клинико-инструментальная характеристика некомпактного миокарда левого желудочка
УЗИ аппарат HM70A
Экспертный класс по доступной цене.
Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Введение
Некомпактный миокард левого желудочка (НМЛЖ) — генетически обусловленное поражение миокарда, манифестирующее сердечной недостаточностью (СН), нарушениями ритма, тромбоэмболиями и внезапной сердечной смертью. НМЛЖ ввиду своей редкости и отсутствия специфических жалоб, физикальных данных впервые как нозологическая единица был описан в 1984 г. R. Eng berding и F. Bender [1]. По данным эхокардиографического исследования у взрослых НМЛЖ выявляется редко — в среднем с частотой 0,014%, но у пациентов со снижением фракции выброса
Этиология
НМЛЖ наследственное заболевание с аутосомно-доминантным типом наследования. Первый из генов локализован на хромосоме Xq28, имеет отношение к функции митохондрий и регуляции уровня кардиолипина. Второй ген кодирует α-дистробревин — белок, участвующий в образовании дистрофин-ассоциированного гликопротеинового комплекса. Манифес тация изменений в сердце при НМЛЖ наблюдается уже во внутриутробный период. На 5-8-й неделе эмбрионального развития происходит нарушение формирования плотного миокарда от эпи- к эндокарду и от основания сердца к верхушке. В то же время формируется коронарное кровообращение, межтрабекулярные пространства уменьшаются до размеров капиллярных сосудов. Именно в этот период и закладывается основа некомпактного миокарда: 1 — толстый, некомпактный губчатый слой сердечной мышцы, сформированный трабекулами, имеющий недоразвитую сосудистую систему; 2 — тонкий слой нормального однородного миокарда, способного к нормальному сокращению. Заболевание может манифестировать в различном возрасте.
По морфологии различают 3 типа некомпактного миокарда:
- Лакунарный — некомпактный миокард представлен сетью хорошо визуализирующихся трабекул с широкими, глубокими лакунами.
- Губчатый — некомпактный миокард представлен чередованием множества мельчайших лакун (менее 1 мм) и трабекул, трудно различимых друг от друга.
- Смешанный — визуализируются трабекулы и лакунарные пространства, менее выраженные, чем при лакунарном типе.
Клинические проявления НМЛЖ неспецифичны и включают в себя: одышку, отеки, тромбоэмболию (4-24%) и тахиаритмию (в 47% случаев имеют место желудочковые тахиаритмии (у 40% больных это первое проявление заболевания)), суправентрикуярную тахикардию (44%), фибрилляцию предсердий (ФП) (25%), синдром WPW (15%). В связи с высокой частотой развития у таких пациентов тяжелых нарушений ритма — желудочковой тахикардии, внезапная смерть может быть первым проявлением заболевания.
Трабекулярность миокарда способствует формированию внутрижелудочковых тромбов, что объясняет высокую частоту тромбоэмболических осложнений (21-38%), клинически проявляющихся инсультом, транзиторными ишемическими атаками, тромбоэмболией легочной артерии и тромбозом мезентериальных сосудов.
Диагностика
В 2001 г. R. Jenni и соавт. [2] предложили диагностические критерии заболевания. Диагноз правомочен при наличии всех 4 критериев.
- Типичная двухслойная структура миокарда с тонким, компактным наружным (эпикардиальным) слоем и значительно утолщенным некомпактным внутренним (эндокардиальным) слоем (максимальное конечное систолическое соотношение некомпактного эндокардиального слоя и компактного миокарда >2 у взрослых и до 1,4 у детей).
- Документированный кровоток в глубоких межтрабекулярных щелях по данным цветовой допплерографии (в отличие от миокардиальных синусоидов межтрабекулярные пространства не сообщаются с коронарными сосудами).
- Доминирующая локализация некомпактного миокарда (>80%) в апикальной зоне и в средних отделах боковой и задней стенки ЛЖ.
- Отсутствие сопутствующих аномалий сердца.
C. Lilje и соавт. [3] в 2006 г. предложили количественные критерии для определения степени некомпактности миокарда по отношению слоя «плотного» истинного миокарда (Х) к толщине всей стенки сердца на уровне верхушки ЛЖ (Y): 0,33-0,26 — «мягкая» некомпактность; 0,25-0,2 — умеренная; меньше 0,2 — тяжелая.
Данная величина тесно коррелирует со степенью и скоростью развития СН и имеет прогностическое значение для дальнейшего развития заболевания и возникновения осложнений.
Дифференциальная диагностика
В исследованиях сообщается, что у многих пациентов диагноз был выставлен ошибочно: по убыванию частоты — ДКМП, ГКМП, фиброэластоз, миокардит, рестриктивная кардиомиопатия, перикардит и тромбоз полости ЛЖ.
Прогноз и предикторы неблагоприятного течения заболевания. Летальность в течение 6 лет составляет около 50%. У детей летальность около 17,1%. Предикторы неблагоприятного прогноза:
- Увеличенный конечный диастолический размер ЛЖ при первичной эхокардиографии у пациента.
- Хроническая СН III-IV ФК по NYHA.
- Постоянная форма ФП.
- Блокада ножек пучка Гиса.
Прогноз также ухудшает наличие желудочковых тахиаритмий, что нередко является причиной внезапной сердечной смерти у больных с некомпактным миокардом, которая может быть первым и единственным проявлением НМЛЖ.
Лечение
Специфической терапии НМЛЖ не существует. Проводят симптоматическое лечение застойной СН, нарушений ритма и профилактику тромбоэмболических осложнений. В терминальных стадиях возможна трансплантация сердца.
Клиническое наблюдение
Больной Г., 1962 года рождения, поступил в экстренном порядке в приемно-диагностическое отделение с жалобами на выраженную одышку, в том числе в покое, ортопноэ, увеличение живота, уменьшение количества мочи, отеки нижних конечностей, резкую слабость при незначительной физической нагрузке. Больным себя считает в течение последнего месяца, когда появилась субфебрильная температура, стала нарастать одышка при физической нагрузке и в горизонтальном положении, появились отеки на ногах, увеличился живот. Принимал антибиотики в течение 5 дней. Температура тела нормализовалась, но самочувствие не улучшалось.
При осмотре общее состояние тяжелое. Сознание ясное. Телосложения правильного. Питания удовлетворительного. Кожные покровы бледные. Склеры субиктеричны. Видимые слизистые оболочки цианотичные. Массивные отеки нижних конечностей. Пульс 102 уд/мин, ритмичный, низкого наполнения. АД 140/80 мм рт.ст. Набухание шейных вен. Цианоз лица в горизонтальном положении. Тоны глухие, систолический шум с максимумом в точке Боткина. Частота дыхания 19 в 1 мин. Живот увеличен за счет асцита. При поверхностной пальпации напряжен.
В анализе крови обращает на себя внимание: увеличение D-димера в 24 раза. Ультразвуковое исследование органов грудной и брюшной полостей: увеличение и диффузные изменения печени. Уве ли чение и диффузные изменения поджелудочной железы. Каликоэктазия и кисты паренхимы левой почки. Свободная жидкость в брюшной полости. Двусторонний гидроторакс. Компьютерная томография: косвенные признаки тромбоэмболии мелких ветвей легочной артерии. Признаки инфарктпневмонии SX правого и левого легкого.
По данным ЭКГ имели место: синусовая тахикардия с частотой 104 уд/мин. Увеличение левого и правого предсердия. Выраженные вольтажные критерии гипертрофии ЛЖ. Вторичные изменения в миокарде ЛЖ, связанные с гипертрофией ЛЖ. Неполная блокада левой ножки пучка Гиса (QRS 110 мс).
Эхокардиографическое исследование, выполненное на ультразвуковой системе EKO7 (компании Samsung Medison), установило значительное расширение аорты на уровне синусов Вальсальвы и восходящего отдела — 47/48 мм. Левое предсердие: переднезадний размер 50 мм. По длинной оси — 73 мм. Конечный диастолический размер ЛЖ — 75 мм, конечный систолический размер ЛЖ — 63 мм, фракция выброса ЛЖ — 33%. Правый желудочек (на уровне трикуспидального клапана) — 47 мм. Правое предсердие — 47 х 70 мм. Значительное расширение ствола легочной артерии (ЛА) — 41 мм. Расщепление листков перикарда за задней стенкой ЛЖ — 5 мм, за правым предсердием — до 6 мм. Митральная регургитация II степени. Трикуспидальная регургитация III степени. Аортальная регургитация II степени. Регургитация на клапане ЛА — II степени. Среднее гемодинамическое давление в ЛА (по трикуспидальной регургитации) — 46 мм рт.ст. Максимальное давление в ЛА — 72 мм рт.ст.
Стенка ЛЖ в средней и верхушечной области представляет собой 2 слоя: наружный, толщиной 5,5 мм, однородной структуры (компактный миокард) и внутренний, представленный широкими трабекулами, лакунами, доходящими до компактного слоя (по типу губчатой структуры). На всем протяжении лакун регистрируется кровоток. Толщина некомпактного слоя в средней части ЛЖ до 16 мм, в области верхушки до 29 мм. На сканограммах (рис. 1-4) при хорошем уровне ультразвуковой визуализации видны четкие признаки некомпактности миокарда ЛЖ. Таким образом, имеется типичная эхокардиографическая картина НМЛЖ. Данное клинико-эхокардиографическое описание представляет собой первое клиническое выявление и описание НМЛЖ в Приволжском федеральном округе.
Рис. 1.
Пятикамерная позиция при локации с верхушки.
Рис. 2.
Поперечная парастернальная позиция.
Рис. 3.
Некомпактная структура миокарда ЛЖ.
Рис. 4.
Некомпактная структура миокарда ЛЖ.
Выводы
- Выявление специфичных эхокардиографических признаков некомпактности позволяет точно установить диагноз НМЛЖ.
- Отсутствие у большинства практических врачей теоретических и практических навыков по выявлению НМЛЖ связано с низкой распространенностью в популяции и недостаточной информированностью (опыт выявления менее 20 лет).
- Владение клинико-диагностическими критериями НМЛЖ кардиологами и врачами ультразвуковой диагностики будет способствовать ранней диагностике и лечению пациентов с данным заболеванием.
- Необходим целенаправленный ЭхоКГскрининг родственников пациента для ранней диагностики и лечения.
Литература
- Engberding R., Bender F. Identification of a rare congenital anomaly of the myocardium by twodimentional echocardiography: persisstence of isolated myocardium sinysoids // Am J Cardiol. 1984; 53: 1733-1734.
- Jenni R., Oechslin E., Schneider J. et al. Echocardiographic and pathoanatomical characteristics of isolated left ventricular noncompaction: a step towards classification as a distinct cardiomyopathy// Heart. 2001; 86: 666-671.
- Lilje С., Razek V., James J. et al. Complications of non-compaction of the left ventricular myocardium in a paediatric population: a prospective study// Eur Heart J. 2006; 27 (15): 1855-1860.
УЗИ аппарат HM70A
Экспертный класс по доступной цене.
Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.