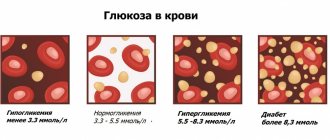
Особенности и преимущества вакутейнеров
Трехкомпонентная система для забора венозной крови состоит из:
- стерильной вакуумной пробирки с консервантом;
- двусторонней автоматической иглы для внутривенной инъекции;
- автоматического иглодержателя.
Преимущества систем с отрицательным давлением связаны с их конструктивными особенностями:
- безопасность, стерильность и гарантия целостности образца;
- минимизация микросгустков и гемолиза;
- соблюдение постоянного времени между забором и соединением с добавкой;
- точное соотношение образца и добавки;
- минимизация эффекта жгута.
Алгоритм взятия крови с помощью вакуумной системы
Методика забора венозной крови вакуумными пробирками аналогичен использованию шприца, при этом обеспечивает большую безопасность, оперативность и удобство. Взятие осуществляется быстро, что важно для гарантии точного результата исследования.
При заборе крови из периферической вены с помощью вакуумной системы потребуются:
- вакуумные пробирки;
- жгут;
- вата (ватные тампоны) или салфетки;
- антисептическое средство (медицинский спирт);
- бактерицидный пластырь;
- стерильный медицинский лоток;
- медицинская спецодежда (халат, очки, маска и перчатки).
Перед проведением процедуры необходимо оформить направление пациента, обработать руки специальным раствором, надеть защитную медицинскую одежду.
Техника забора крови из вены
- Подготовьте пробирки, соответствующие заявленным тестам или необходимым пациенту лабораторным исследованиям, иглу, держатель, спиртовые салфетки или ватный тампон, пластырь.
- Наложите пациенту жгут на рубашку или пеленку на 7-10 см выше места венепункции. Попросить пациента сжать кулак.
- Выберите место венепункции. Наиболее часто используются средняя локтевая и подкожные вены, однако можно пунктировать и менее крупные и полнокровные вены тыльной поверхности запястья и кисти.
- Возьмите иглу и снимите колпачок со стороны мембраны из резины. Вставьте иглу в держатель и завинчивайте до упора.
- Продезинфицируйте место венепункции марлевой салфеткой. Необходимо подождать до полного высыхания антисептического раствора.
- Снимите защитный колпачок с другой стороны. Введите вакуумную систему «держатель-игла» в вену в соответствии с алгоритмом обычного взятия крови с помощью шприца. Следите, чтобы игла находилась срезом вверх под углом 15º относительно поверхности кожи. Поскольку второй конец закрыт мембраной, кровь по игле не идет. Плавными и быстрыми движениями выполняют прокол кожи и стенки вены. Следует избегать глубокого погружения иглы.
- Вставьте пробирку до упора в держатель. В результате игла прокалывает мембрану и заглушку, формируется канал между вакуумной пробиркой и веной. Иглу нельзя двигать, когда начинает поступать кровь. Процесс продолжается пока не компенсируется вакуум в пробирке.
- Жгут необходимо снять или ослабить сразу же после начала поступления крови в вакутейнер. Убедитесь, что пациент разжал кулак.
- После остановки поступления крови пробирку извлекают из держателя. Мембрана приходит в исходное положение, ток крови по игле перекрывается. При необходимости к держателю можно подсоединять другие пробирки для забора нужного объема крови. Сразу же после заполнения пробирку нужно аккуратно перевернуть для смешивания пробы с наполнителем: пробирку без антикоагулянтов — 5-6 раз; пробирку с цитратом — 3-4 раза; пробирку с гепарином, ЭДТА и другими добавками — 8-10 раз.
- После заполнения последней пробирки отсоедините ее от держателя и выньте систему «держатель-игла» из вены. Для обеспечения безопасности следует снять иглу с держателя и поместить в специальный контейнер для утилизации.
- На место пункции прикладывается стерильная салфетка/ватный шарик, смоченный антисептиком, или наклеивается бактерицидный пластырь.
- Пробирки маркируются и помещаются в специальный контейнер для транспортировки в лабораторию.
Манипуляции на преаналитическом этапе лабораторных исследований — основной источник ошибок и некорректных результатов. По данным литературы, погрешности на преаналитическом этапе являются причиной более 60% недостоверных результатов. На собственно аналитическом этапе исследования вносится, по тем же данным, не более 20% ошибок; при этом некоторая их часть также обусловлена предшествующими нарушениями на преаналитическом этапе (рис. 1).
Рисунок 1. Число ошибок, выявленное на всех этапах лабораторных исследований, в %. M. Plebani and P. Carraro. 1348-1351 (1997).
Преаналитический этап начинается гораздо раньше, чем обычно описывается в учебных пособиях. Необходимо помнить, что любой лечебный процесс включает не только оценку диагностической ценности теста, но и необходимость назначения контролирующих, сопутствующих и дополнительных процедур и исследований. Поэтому назначение исследования и подготовку пациента к взятию биоматериала также следует рассматривать как составляющие преаналитического этапа.
Взятие биоматериала, транспортировка, хранение и пробоподготовка делятся на внелабораторную и лабораторную части. Основная задача этих этапов — обеспечение стабильности (сохранности) полученных биоматериалов и сведение к минимуму влияния различных факторов, изменяющих их качество.
Правильно проведенная преаналитическая подготовка — одно из основных условий точной лабораторной диагностики.
В настоящее время большинство клиник применяет вакуумный способ взятия венозной крови. Этот способ максимально удобен как для пациента, так и для медицинского персонала.
(Австрия) — один из ведущих производителей вакуумных систем для взятия биоматериала. Такие системы обеспечивают максимальную безопасность медицинского работника при взятии венозной крови благодаря тому, что полностью исключается контакт крови с окружающей средой. Однако даже при хорошем опыте работы с такими системами порой могут возникать проблемы.
Современные требования к получению биоматериала подробно описаны в Национальных Стандартах, однако, выполняя эти требования, медицинский персонал часто сталкивается с целым рядом сложностей:
1. Кровь не поступает в пробирку.
Возможно несколько причин этого, и для каждой из них существует свой способ решения:
2. При венепункции внезапно ток крови быстро прекращается, не наполнив пробирку.
В данном случае медицинский персонал должен обращать внимание на следующие возможные причины и знать пути решения проблемы:
3. Гемолиз в пробирке.
Гемолиз (повреждение эритроцитов во время взятия крови) — процесс повреждения эритроцитов, при котором гемоглобин выходит из них в окружающую среду. Кровь или взвесь эритроцитов превращается в прозрачную красную жидкость («лаковая кровь»). Гемолиз может сделать пробу непригодной для анализа. Основные причины и способы решения проблем следующие:
Подробнее остановимся на процедуре «прямого» переноса крови из шприца в вакуумную пробирку, когда пробку прокалывают иглой шприца, и кровь с усилием выдавливают поршнем. Данная процедура имеет ряд недостатков:
1. Перенос образца происходит под избыточным давлением, что приводит к вспениванию крови, гемолизу и денатурации белков.
Денатурация белков:
— искажает результаты, связанные с определением активности и концентрации всех белков и ферментов, активность которых напрямую зависит от сферической конфигурации молекулы белка;
— приводит к повышению мутности образца, что искажает результаты фотометрических методик;
гемолиз — основная причина отказа лаборатории принять образец к исследованию. Любая гемолитичная проба считается заведомо некорректной.
2. Перенос образца крови в пробирку с реагентами обусловливает необходимость точного дозирования, при выдавливании крови поршнем часто пробирка переполняется.
3. Манипуляции с открытой иглой несут риск ранения персонала контаминированной иглой.
Использование специального держателя для безопасного переноса крови из шприца в пробирку позволяет избежать этих проблем.
Держатель для переноса крови из шприца в пробирку из линии продукции VACUETTE предназначен для корректного переноса проб крови из шприцев. Конструкция держателя исключает риск травмы медицинского персонала и облегчает перенос крови без дополнительных манипуляций. Держатель соответствует рекомендациям H3-A5 CLSI (Институт клинических и лабораторных стандартов). Выполните следующие действия: наберите пробу крови в шприц, используя процедуру, принятую в Вашем медицинском учреждении (рис. 2, а),
Рисунок 2. Держатель для переноса крови из шприца в пробирку VACUETTE (а). Объяснение в тексте. вставьте пробирку в держатель для переноса крови из шприца в пробирку и надавите, чтобы игла держателя проколола пробку
(рис. 2, б),
Рисунок 2. Держатель для переноса крови из шприца в пробирку VACUETTE (б). Объяснение в тексте. как только проба перестанет поступать в пробирку, осторожно выньте пробирку из держателя, продолжая удерживать его другой рукой
(рис. 2, в).
Рисунок 2. Держатель для переноса крови из шприца в пробирку VACUETTE (в). Объяснение в тексте.
Кроме того, при исследовании ряда показателей возможны другие ошибки, связанные с невыполнением специальных требований к преаналитическому процессу для данного параметра.
1. Определенное время взятия крови. В некоторых случаях кровь необходимо брать в определенное время: при приеме некоторых лекарственных препаратов, натощак и/или вследствие суточных колебаний биологических параметров (циркадного ритма). Важно, чтобы взятие таких проб производилось в течение строго установленного промежутка времени. Следует дать необходимые указания персоналу, проводящему венепункции, чтобы он точно соблюдал эти правила.
Примеры исследований, при которых требуется взятие крови в определенный промежуток времени:
— исследования показателей, изменяющихся в течение суток (например, глюкоза, кортикостероиды и другие гормоны, железо сыворотки крови);
— мониторинг терапии (например, протромбиновое время, АЧТВ, концентрация салициловой кислоты, дигоксина и других лекарственных препаратов).
Во многих из перечисленных ситуаций необходимо точно записывать на бланке направления дозу препарата и время его последнего приема, а также время взятия крови.
2. Особенности взятия крови для отдельных исследований:
— определение содержания алкоголя в крови. При взятии пробы для определения содержания алкоголя в крови дезинфекцию места венепункции следует проводить не содержащим спирт веществом (например, мылом);
— образцы для культивирования крови. При взятии, транспортировке и хранении образцов для культивирования крови необходимо соблюдать определенные временные и температурные условия. Кроме того, существуют различия в объеме крови, необходимой для культивирования. Обычно на один анализ необходимо взять 10-20 мл крови взрослого и 1-2 мл крови новорожденного;
— микроэлементы. В линии продукции VACUETTE представлены специальные пробирки для определения концентрации микроэлементов.
3. Особенности взятия крови с помощью катетеров. Существует ряд систем, качество которых имеет большое значение при проведении лабораторной диагностики у пациентов в клиниках ургентных состояний. В первую очередь это касается катетеров и фистул.
Возможные ошибки
Постоянные катетеры обычно устанавливаются пациентам, находящимся в тяжелом состоянии, получающим массивную инфузионную терапию. Взятие проб крови из постоянных катетеров может привести к ошибочным результатам исследований из-за неполного промывания всей длины катетера. Это приводит к контаминации образца лекарственными средствами и/или разбавлению образца крови (рис.3).
Рисунок 3. Особенности взятия крови с помощью катетеров. Одноразовый держатель HOLDEX предназначен для использования с иглами-бабочками VACUETTE, иглами Луэра или катетерами.
Промывание катетеров
Перед взятием пробы нужно удалить из катетера достаточное количество крови, чтобы быть уверенным, что проба не разбавлена и не контаминирована. Объем удаляемой крови зависит от внутреннего объема конкретного катетера. Для исследования системы гемостаза кровь рекомендуется сливать в количестве не менее 6 объемов катетера (5-7 мл), для других исследований — не менее 2 мл.
Если пациенту в экстренной ситуации при неотложной терапии установлена игла-бабочка с металлической силиконизированной иглой для внутривенного введения лекарственных препаратов или для взятия крови, то ее можно оставлять в вене на срок от 36 до 48 ч. Иглы-бабочки системы VACUETTE (Австрия) предназначены для взятия венозной крови у детей и пациентов с труднодоступными венами для проведения быстрой и безболезненной венепункции. В линии продукции VACUETTE для взятия венозной крови есть как стандартные иглы-бабочки, так и иглы-бабочки SAFETY с механизмом защиты от укола иглой (рис. 4).
Рисунок 4. Иглы-бабочки системы VACUETTE (Австрия) для вакуумной системы взятия крови VACUETTE.
Инфузионная терапия
Если пациенту внутривенно вводятся растворы, по возможности не следует брать кровь из этой же руки. Показано, что кровь, взятая проксимальнее места внутривенной инфузии, разбавлена вводимым раствором. Кроме того, раствор может содержать исследуемый аналит. Результаты исследования крови в этом случае будут ошибочными. Необходимо найти место для взятия крови на другой руке. Иногда внутривенная инфузия может проводиться с обеих рук.
Удовлетворительные образцы могут быть получены при взятии крови дистальнее места внутривенной инфузии. Для этого рекомендуется следующее:
— отключить капельницу как минимум за 2 мин до венепункции;
— наложить жгут дистальнее места инфузии;
— выбрать вену, в которую не проводится инфузия;
— провести венепункцию.
На бланке направления должно быть отмечено, что этот образец брался из руки, в которую проводилась внутривенная инфузия.
Если вены недоступны, рекомендуется взять капиллярную кровь.
Из-за возможного возникновения ошибок при исследованиях следует избегать взятия крови из места внутривенной инфузии в течение первых 2 сут после ее отмены (рис. 5).
Рисунок 5. Подготовка вены к инфузионной терапии.
В заключение следует отметить, что в данной статье мы рассмотрели только некоторые вопросы, влияющие на преаналитический этап. Проблемы, связанные с преаналитическим этапом лабораторных исследований, не могут быть решены одним сотрудником и требуют совместных действий врачей, медицинских сестер и другого персонала лаборатории, участвующих в рабочем процессе лечебного учреждения. Надеемся, что рассмотренные выше ошибки, которые возникают при работе с вакуумными пробирками, и способы их решения, а также особенности взятия венозной крови позволят читателям произвести правильную оценку и повысить качество исследований.
Возможные ошибки при использовании вакуумных пробирок
| Проблема | Возможные причины | Решение |
| Кровь не поступает в пробирку после соединения с держателем | Игла не попала в вену | Во всех перечисленных случаях необходимо осторожно скорректировать положение иглы. Отсоединять пробирку от держателя не нужно, если нет необходимости вынуть иглу и-под кожи. |
| Кончик иглы уперся в венозную стенку | ||
| Вена проткнута насквозь | ||
| Кровь в пробирку поступила в меньшем количестве, чем необходимо для проведения анализа | Венозный сосуд спался из-за низкого давления | Необходимо отсоединить пробирку от держателя и подождать некоторое время, пока вена снова наполнится |
| Систему нужно заменить и выполнить процедуру заново | В пробирку попал воздух |
В вы можете заказать для лабораторий расходные материалы высокого качества. При заборе крови вакуумной системой придерживайтесь алгоритма. Это обеспечит безопасность процедуры и надежность результатов исследования.
Показания к процедуре
- Назначается для диагностики воспалительных болезней, инфекций, патологии крови.
- Относится к обязательному методу обследования во время ежегодных медицинских осмотров.
- Биохимия крови определяет основные биологические показатели (глюкоза, белки, электролиты, ферменты, липиды) и указывает на патологию печени, сердца, сосудов, развитие онкологии.
- Гормональный фон изучает уровень гормонов и функцию эндокринной, пищеварительной системы, обмена веществ.
- Иммунологический статус выясняет состояние клеточного и гуморального иммунитета, развитие аллергических реакций.