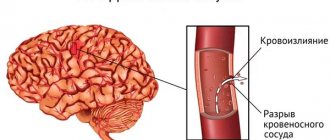
Геморрагический инсульт (ГИ) – клинический синдром, при котором происходит резкое развитие очаговой и/или общемозговой неврологической симптоматики по причине спонтанного кровоизлияния в вещество головного мозга или в подоболочечные участки. Патологический процесс запускают факторы нетравматического генеза. Этот вид кровоизлияния имеет самую высокую инвалидизирующую способность и сопряжен наивысшими рисками раннего смертельного исхода.
Факты статистики из достоверных источников
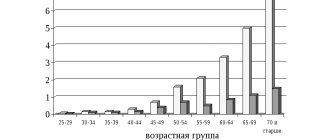
В общей структуре всех типов инсультов геморрагический занимает 10%-15%. Частота его распространения среди мирового населения составляет порядка 20 случаев на 100 тыс. человек. Специалисты, базируясь на ежегодную динамику, оповещают, что примерно через 50 лет все эти показатели увеличатся в два раза. Конкретно в Российской Федерации ежегодно диагностируют около 43000-44000 случаев ГИ. Что примечательно, приблизительно в 1,5 раза он чаще возникает у мужчин, однако летальность от его последствий преобладает у женщин.
Согласно клиническим наблюдениям, при данном диагнозе смерть наступает у 75% людей, которые находятся на ИВЛ, и у 25% людей, не нуждающихся в ней. Проведенные консолидированные исследования показали, что в среднем 30%-50% больных погибает в течение 1-го месяца с момента приступа геморрагии, причем 1/2 из них умирает уже в течение первых 2-х суток. Инвалидизация (из-за паралича лица и конечностей, афазии, слепоты, пр.) среди выживших пациентов достигает 75%, из них 10% остаются прикованными к постели. И лишь 25% больных спустя 6 месяцев независимы в повседневной жизни.
Патология представляет огромную социальную проблему, поскольку эпидемиологический пик приходится на трудоспособные годы – 40-60 лет. Геморрагические инсульты существенно «помолодели», сегодня они достаточно распространены даже среди молодежной группы людей (20-30 лет). Однозначно в категорию риска входят люди, страдающие артериальной гипертонией, так как в большинстве случаев подобного рода кровоизлияния случаются именно на почве хронически повышенного АД.
Первоочередной фактор, который влияет на прогноз исхода, – оперативность оказания адекватной медицинской помощи больному.
Инфаркт миокарда и геморрагический альвеолит при системной красной волчанке
есмотря на хорошо известные симптомы системной красной волчанки (СКВ), каждый случай этого заболевания уникален. Течение болезни характеризуется периодами обострений и ремиссий, возникающих на фоне приема лекарственных препаратов. Прекращение лечения, как правило, сопровождается обострением СКВ через разные промежутки времени. Заболевание может начинаться с поражения одного или нескольких органов или протекать молниеносно, заканчиваясь летально за короткий промежуток времени.
Главными причинами смерти в течение первого года после начала заболевания являются активность СКВ (поражение почек, центральной нервной системы – ЦНС) или присоединение инфекции. В дальнейшем смертельные исходы могут быть обусловлены кардиоваскулярными катастрофами, хронической почечной недостаточностью и злокачественными новообразованиями [1]. Применение глюкокортикостероидов позволяет снизить частоту смертельных исходов, развивающихся вследствие активности СКВ.
Мы приводим описание пациентки с СКВ, у которой активность заболевания явилась причиной развития синдрома диссеминированного внутрисосудистого свертывания (тромбогеморрагической стадии) и смертельного исхода в первый год после начала СКВ.
Больная К. 18 лет, поступила в стационар Института ревматологии РАМН в октябре 2003 г. с жалобами на геморрагические высыпания на коже, боли в правом локтевом, лучезапястном и пястно-фаланговых суставах правой кисти, припухлость этих суставов, выпадение волос, слабость, одышку при физической нагрузке.
Дебют заболевания в конце декабря 2002 г. характеризовался появлением на лице эритемы, развитием артрита мелких суставов кистей, субфебрильной температуры, резким снижением массы тела (за 2 мес. похудела на 6 кг). В январе 2003 г. была госпитализирована в ревматологическое отделение одной из больниц г. Москвы, где были выявлены изменения мочевого осадка (протеинурия, эритроцитурия и лейкоцитурия), анемия, повышение антител к ДНК и антинуклеарный фактор (АНФ, титры не известны), что позволило диагностировать СКВ. С момента установления диагноза постоянно получала преднизолон (ПЗ – 35 мг/сут.), а после консультации в Институте ревматологии (апрель 2003 г.) также плаквенил (400 мг/сут.). Несмотря на проводимую терапию, сохранялись изменения в анализах мочи (следовая протеинурия и микрогематурия) и иммунологические нарушения, в связи с чем был назначен циклофосфан – ЦФ (суммарно 1,2 г). Прекращение инъекций ЦФ и снижение дозы ПЗ до 20 мг/сут. спровоцировало обострение СКВ: в сентябре 2003 г. на коже голеней, а затем по всему телу появилась геморрагическая сыпь, во рту – болезненные афты, вновь рецидивировали артриты и артралгии, лихорадка, стала возрастать слабость. Эпизод резких болей в животе, тошнота, дегтеобразный стул возникли 30 сентября, отмечено снижение гемоглобина до 81 г/л. По месту жительства исключено развитие пищевой токсикоинфекции, проведена регидратационная терапия, после чего пациентка была направлена в Институт ревматологии. Краткая схема анамнеза представлена на рис. 1.
Провокаторы геморрагического инсульта
Пусковым механизмом появления ГИ могут послужить достаточно разнообразные факторы, оказывающие негативное воздействие на внутричерепную гемодинамику и состояние церебральных сосудов:
- стойкая артериальная гипертония (в 50% случаев);
- церебральная амилоидная ангиопатия (12%);
- оральный прием лекарств из спектра антикоагулянтов (10%);
- внутричерепные новообразования (8%);
- другие причины – артериовенозные и кавернозные мальформации, тромбозы синусов головного мозга, аневризмы, васкулиты интракраниальных сосудов и пр. (20%).
Многие из пациентов с геморрагическим ударом в анамнезе имеют сахарный диабет. Доказанный факт, что диабетики, как и гипертоники, входят в группу риска. При сахарном диабете с долгим сроком течения сосуды, включая церебральные, разрушаются из-за модификации химии крови с преобладанием глюкозы. Если на фоне повышенного сахара в крови есть склонность к постоянным повышениям АД, вероятность геморрагического инсульта возрастает в 2,5 раза.
Патогенетически геморрагический эффект может развиться вследствие разрыва сосуда (преобладающий механизм) или просачивания элементов крови в окружающие ткани мозга сквозь стенки капилляров из-за нарушенного их тонуса и проницаемости. Во втором варианте разрыва нет и как такового обильного кровоизлияния тоже. Просто мелкий сосуд пропускает кровь точечно. Но и мелкоточечные геморрагии, сливаясь, способны превратиться в весьма обширные очаги, с не меньшими роковыми последствиями, чем после разрыва артерии или вены.
Клинические проявления ГИ
Незадолго до приступа могут предшествовать предынсультные клинические симптомы-предвестники (не всегда), по которым можно заподозрить надвигающуюся опасность:
- покалывания, онемение одной лицевой половины;
- онемение пальцев рук или ног;
- внезапная слабость, головокружение, шум в голове;
- резкая болезненность в глазах, мушки, двоение, видение в красном цвете;
- внезапное пошатывание при ходьбе;
- беспричинная тахикардия;
- приступы гипергидроза;
- повышение артериального давления;
- необоснованное появление тошноты;
- заторможенность в общении и восприятии чужой речи;
- прилив крови к лицу, гипертермия.
Для мозгового удара с кровоизлиянием все же характерен мгновенный острый дебют без предвестников, который случается в процессе или почти сразу же после активной деятельности, стрессовой ситуации, волнения. О геморрагическом инсульте свидетельствуют классические симптомы, которые развиваются внезапно, они ярко выражены и бурно прогрессируют:
- резкая и сильная головная боль;
- неукротимая рвота;
- длительное угнетение сознания, кома;
- кровяное давление выше 220 мм.рт.ст.
Распространенными признаками состоявшегося шока также являются шумное дыхание, эпилептические припадки, отсутствие реакции зрачков на свет, спастический миоз. В зависимости от расположения очага может присутствовать поворот головы и обращение глазных яблок в направлении пораженного полушария или контрлатерально. Обнаружив признаки ГИ у пострадавшего, рядом находящийся человек обязан немедленно вызвать скорую помощь!
Остро развившаяся геморрагия приводит к тому, что кровь свободно поступает в определенные структуры мозга, пропитывая их и образуя полость с гематомой. Излитие крови длится несколько минут или часов, пока не образуется тромб. За небольшой отрезок времени гематома быстро увеличивается, оказывая на затронутые зоны механическое воздействие. Она растягивает, давит и смещает нервную ткань, вызывает ее отек и гибель, что ведет к интенсивному нарастанию неврологического дефицита (угнетению дыхания, выпадению чувствительности одной половины тела, речевым нарушениям, утрате зрения, парезу глотательных мышц и пр.).
По размерам кровяное скопление может быть небольшим (до 30 мл), средним (от 30 до 60 мл) и большим (более 60 мл). Объемы излившейся жидкости могут достигать и критических масштабов, вплоть до 100 мл. Клинические наблюдения показывают, что при внутричерепных кровоизлияниях, превышающих 60 мл, патология оканчивается смертью у 85% больных в течение 30 суток.
Геморрагический инсульт: реабилитация и лечение
Двигательное восстановление
Реабилитация двигательной функции также начинается уже на этапе стационарного лечения, после оказания первичной медицинской помощи. Конечности передвигают, чтобы улучшить в них кровообращение. Это помогает снизить тонус, предотвратить застойные явления и пневмонии. Положение конечностей пациента могут корректировать с помощью лонгеты или специальных грузов. Лежачих принято переворачивать каждые 2 часа, чтобы у них не появлялись пролежни.
Уже в первые дни после приступа можно заниматься пассивной гимнастикой, при которой родственник или медработник помогает человеку плавно двигать конечностями. Такие процедуры рекомендуются только, если пациент не испытывает болевых ощущений в процессе. Далее по мере улучшения состояния пациенту разрешается сначала сидеть в постели, а затем пробовать вставать. Перед тем, как начинать ходить, человек тренируется менять упор с ноги на ногу, возвращая ощущение своего положения в пространстве. Затем пациент учится передвигаться с помощью различных опор, ходунков, тростей.
Техники восстановления движения
Большую роль в реабилитации двигательной функции играет лечебная физкультура: для пациента разрабатывают упражнения на различные группы мышц, рекомендуются занятия на специальных тренажерах, применение устройств для снижения тонуса.
Очень полезен лечебный массаж. На первом этапе применяется поглаживание конечностей с повышенным тонусом, растирание мышц с пониженным. Для улучшения эффекта перед сеансом можно использовать теплую грелку. Массаж может иметь продолжительность от 5 до 20 минут, в зависимости от состояния пациента.
Среди методик физиотерапии хорошо себя зарекомендовали кислородные ванны, электрофорез сосудов шеи, электростимуляция ослабленных мышц.
Восстановление речи
Работу над возвращением речи пациента можно начать даже если после приступа прошло больше года. Говорить с пациентами после инсульта нужно медленно, четко произнося слова, не торопить с ответом, задавать вопросы, предполагающие односложные ответы.
Рекомендуется работа с логопедом, который поможет восстановить функциональность лицевых и ротовых мышц, могут быть полезны занятия перед зеркалом. Постепенно по мере наступления улучшений можно усложнять задания, стимулировать человека к построению более сложных фраз.
Восстановление дыхания, глотания
После поступления пациента в стационар его обычно кормят с помощью зонда, затем ему чаще всего приходится осваивать навык самостоятельного питания заново. Для упрощения реабилитации нужно правильно готовить пищу для пострадавшего от инсульта. Еда должна быть теплой, не слишком твердой или мягкой консистенции. Важно выбирать ароматные блюда, они способствуют продуцированию слюны.
Нельзя торопить пациентов во время прием пищи, обычно еда занимает у них не менее получаса. Важно помогать им держать посуду или ложку, мотивировать их. Сила глотательных мышц восстанавливается при регулярном повторении процесса питания.
Психологическое восстановление
Многие пациенты после геморрагического инсульта сталкиваются с депрессией, нарушениями когнитивных функций. Мышление помогает восстановить лекарственная терапия, курсы ноотропов и нейрометаболических препаратов.
Для корректировки психологического состояния рекомендуется работа с психологом. Хорошо себя зарекомендовали сеансы групповой и индивидуальной психотерапии. Огромное значение имеет поддержка родственников и друзей пациента, которая способна вернуть человеку уверенность в собственной востребованности и силе духа.
Куликова Анна Александровна, невролог
Типичная локализация кровоизлияний
Наиболее часто, а это порядка в 55% случаев, геморрагии происходят в путаментальной зоне. Путаментальное кровотечение образуется вследствие разрыва дегенерированных лентикулостриарных артерий, из-за чего кровь попадает в скорлупу мозга. Виновником патогенеза с такой локализацией обычно становится длительно существующая гипертония. В ряде случаев кровотечения путамента прорываются в желудочковую систему, что чревато тампонадой ЖС и острым окклюзионно-гидроцефальным кризом.
Следующей по распространенности локализацией является субкортикальная область (подкорковая). Субкортикальные ГИ наблюдаются в 17%-18% случаев. Как правило, ведущими источниками такого кровоизлияния являются разорвавшиеся АВМ и аневризмы на фоне повышенного давления. Подкорковые зоны, вовлеченные в геморрагический процесс, – лобная, теменная, затылочная или височная доля.
Третье по встречаемости место, где в 14%-15% случаев определяют геморрагию мозга, – это зрительный бугор, или таламус. Таламические геморрагии наступают по причине выхода крови из кровеносного сосуда вертебробазиллярного бассейна. Патогенез может быть связан с любым этиологическим фактором, однако, как всегда, достоверно чаще отмечена причастность гипертензивного синдрома.
На четвертом месте (7%) по частоте развития встречаются мостовые ГИ. Они концентрируются в задней части ствола мозга, то есть в варолиевом мосту. Через мост осуществляется связь коры с мозжечком, спинным мозгом и другими главнейшими элементами ЦНС. Этот отдел включает центры контроля над дыханием и сердцебиением. Поэтому мост – самая опасная локализация кровоизлияния, практически несопоставимая с жизнью.
Принципы диагностики заболевания
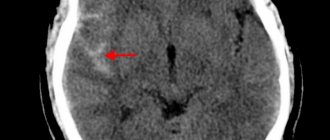
Золотым стандартом в установлении диагноза является метод компьютерной томографии (КТ). В раннем периоде после приступа (1-3 сутки) этот способ нейровизуализации наиболее информативен, чем МРТ. Свежий геморрагический материал, включающий 98% гемоглобина, на КТ отображается высокоплотным, хорошо очерченным, ярко-светлым включением на фоне более темной мозговой ткани. На основании компьютерной томограммы определяются зона эпицентра, объемы и форма образования, уровень поражения внутренней капсулы, степень дислокации мозговых структур, состояние ликворной системы.
С началом подострой фазы (через 3 суток) красные клетки гематомы по периферии разрушаются, в центре железосодержащий белок окисляется, очаг становится ниже по плотности. Поэтому наряду с КТ в сроки от 3 дней и позже обязательным является проведение МРТ. В подострой и хронической форме МР-сигнал, в отличие от КТ, лучше визуализирует гематому с производными окисления гемоглобина (метгемоглобином), переходящую в изоденсивную стадию. Ангиографические методы обследования применяются у пациентов с неопределенной причиной развития геморрагического инсульта. Ангиографию в первую очередь проводят лицам молодого возраста с нормальными показателями АД.
Для адекватного ведения пациентов после приступа внутримозгового кровоизлияния обязательно проводятся ЭКГ и рентген органов дыхания, берутся анализы на электролиты, ПТВ и АЧТВ.
Медицинская помощь в стационаре
Все больные на раннем этапе получают интенсивную терапевтическую помощь в нейрореанимационном стационаре. Первоначальные лечебные мероприятия направлены на:
- нормализацию микроциркуляции, гемореологических нарушений;
- купирование мозгового отека, лечение обструктивной гидроцефалии;
- коррекцию кровяного давления, температуры тела;
- функциональную регуляцию сердечно-сосудистой системы;
- поддержание водно-электролитного баланса;
- предупреждение возможных судорог;
- профилактику внечерепных последствий воспалительной и трофической природы (пневмонии, эмболии, отека легких, пиелонефрита, кахексии, ДВС-синдрома, эндокардита, пролежней, мышечной атрофии и др.);
- проведение респираторной поддержки (если больной в ней нуждается);
- устранение внутричерепной гипертензии при ГИ с дислокацией.
Геморрагический инфаркт легкого
Содержание:
Геморрагический инфаркт легкого возникает из-за эмболии или тромбоза легочных артерий. В результате этого образуется участок легочной ткани с нарушенным кровообращением (зона ишемии).
Особенность геморрагического инфаркта в том, что при нем участок ишемии оказывается пропитанным кровью, имеет четкие границы и темно-красную окраску. По внешнему виду такой инфаркт напоминает форму конуса, основание которого обращено к плевре. Соответственно, острие конуса обращено к корню легкого и на нем можно обнаружить тромб в одном из ответвлений легочной артерии.
Причины
Говоря про причины инфаркта легкого, можно выделить несколько основных моментов, приводящих к данному состоянию.
- Тромбоз периферических вен. Особенно часто отмечается тромбоз глубоких бедренных вен из-за слабого или замедленного кровообращения в них. При этом важно наличие и дополнительного условия – склонности к повышенной свертываемость крови у ослабленных больных, длительно находящихся на постельном режиме.
- Воспалительные тромбофлебиты. В эту группу относят и септические тромбофлебиты, возникающие при разнообразных общих и местных инфекциях, после травмы или хирургического вмешательства, при затянувшейся лихорадке в послеоперационном периоде и др.
- Тромбозы в сердце и тромбоэндокардиты.
Также стоит выделить и предрасполагающие факторы, при которых геморрагический инфаркт легкого развивается несколько чаще. Вот основные из них:
- Инфаркт миокарда;
- Застойная сердечная недостаточность;
- Ожирение;
- Нефротический синдром;
- Операции в нижних отделах брюшной полости, а также на тазовых органах;
- Беременность;
- Длительная неподвижность;
- Прием эстрогенов (оральных контрацептивов).
Клиника
Симптомы инфаркта легкого, как правило, выраженные и не заметить их довольно сложно. Сначала появляются болезненные ощущения подмышкой, в области лопатки или чувство сдавления в груди. Боль может усиливаться при кашле и дыхании. Также может отмечаться одышка. Одновременно с этим наблюдаются и сосудистые реакции – кожа становится бледной, появляется липкий холодный пот. Дыхание при этом становится частым и поверхностным, пульс слабым. Также при массивном инфаркте может отмечаться желтуха.
В самом начале развивающегося инфаркта кашель сухой, позже он сопровождается мокротой с кровянистыми выделениями, а еще через некоторое время мокрота становится темно-коричневой.
При обследовании крови выявляется умеренный лейкоцитоз.
Врач при прослушивании обнаруживает шум трения плевры, приглушенное дыхание и влажные крепитирующие хрипы. Также имеется укорочение перкуторного звука.
Может отмечаться накопление жидкости в плевральной полости, которое проявляет себя притуплением перкуторного звука в области поражения, ослаблением дыхания, выбуханием межреберий и голосовым дрожанием.
Для подтверждения диагноза и для того, чтобы назначить правильное лечение инфаркта легкого, требуется выполнить рентгенограмму грудной клетки. При данном заболевании будет отмечаться тень клиновидной формы в нижней или средней доли легкого (чаще всего поражается правое легкое).
Дифференциальная диагностика
При подозрении на инфаркт легкого врачу нередко приходится дифференцировать с инфарктом миокарда. В этом может помочь проведение ЭКГ. Но в некоторых случаях полученная при этом картина оказывается сходной. Например, инфаркт задней стенки левого желудочка может напоминать симптомы инфаркта легкого. Для постановки точного диагноза в этом случае больше внимания требуется уделить сбору анамнеза. В частности, имеющиеся недавно перенесенная операция, тромбофлебит, митральный порок будут говорить о возможном инфаркте легкого. Если же в анамнезе имеется артериальная гипертензия и приступы стенокардии, то велика вероятность инфаркта сердца.
Также следует отличать данное состояние от крупозной пневмонии, при которой первыми признаками является лихорадка и озноб, а боли в груди присоединяются позже. Для крупозной пневмонии характерна мокрота ржавого цвета и может отмечаться герпетическая сыпь.
Еще одним схожим состоянием является самопроизвольный пневмоторакс. Особенно похожи они на начальных этапах развития. Немного позже по рентгенологическим и клиническим признакам эти состояния отличаются.
Вовремя и правильно поставленный диагноз поможет исключить серьезные последствия инфаркта легкого.
Лечение
Лечение инфаркта легкого должно быть комплексным и начинаться как можно раньше.
В первую очередь требуется купировать болевой синдром. Для этого могут использоваться анальгетики – как ненаркотические (внутривенное введение раствора анальгина), так и наркотические (раствор морфина). Это поможет не только уменьшить боль, но и разгрузить малый круг кровообращения.
При имеющейся одышке показано проведение кислородотерапии.
Отдельно стоит сказать о назначение антикоагулянтов. Для успешного лечения и чтобы исключить последствия инфаркта легкого, назначать данные препараты требуется как можно раньше. Одним из таких препаратов является гепарин. Его внутривенное введение поможет приостановить тромботический процесс в ткани легкого.
При сниженном давлении для улучшения микроциркуляции может быть назначен реополиглюкин (внутривенно капельно). Он способен поднять давление и увеличить объем циркулирующей крови.
Вторым шагом в лечении инфаркта легкого являются мероприятия, направленные на недопущение развития инфекции. С этой целью могут назначаться пенициллины и сульфаниламиды.
Профилактика
Учитывая причины инфаркта легкого, можно говорить о мерах по профилактике:
- Во-первых, это по возможности раннее вставание после операций. Даже тяжело больным рекомендуется обеспечить необходимый минимум движений.
- Во-вторых, исключение без лишней необходимости приема лекарственных препаратов, которые повышают свертываемость крови.
- По возможности ограничение внутривенного введения лекарственных средств.
- При тромбозе вен нижних конечностей использование хирургического способа перевязки вен для того, чтобы избежать повторных эмболий.
Соблюдение вышеперечисленных мер поможет снизить вероятность развития тромбоза вен и риск развития инфаркта легкого.
Инфаркт
Инфаркт (латынь infarctus от infarcire набивать, наполнять, втискивать; синонимы дисциркуляторный некроз) — очаговый некроз органа, являющийся следствием внезапного нарушения местного кровообращения.
Термин «инфаркт» был предложен Р. Вирховом для обозначения омертвевшего участка ткани, инфильтрированного («инфарцированного») эритроцитами.
Непосредственной причиной развития Инфаркт является препятствие кровотоку, внезапно возникающее в соответствующем отрезке артерии. Предполагали, что Инфаркт развивается лишь в органах с так называемый концевыми артериями, не имеющими анастомозов. Однако в дальнейшем было установлено, что анастомозы между конечными ветвлениями артерий имеются во всех органах, хотя степень их выраженности неодинакова. Малый калибр сосудов, индивидуальные варианты ветвления и аномалии развития их, недостаточное количество сосудистых анастомозов, свойственные данному органу, являются предпосылками для возникновения Инфаркт в условиях общих расстройств кровообращения. Только закупорка крупных магистральных артерий может привести к омертвению ткани органа без предшествующих общих гемодинамических расстройств
При неполном закрытии просвета сосуда причиной развития Инфаркт является несоответствие потребности в питании функционально отягощённого органа и недостаточного кровоснабжения данного участка. Такое несоответствие может наблюдаться, например, при гипертонической болезни, пороках сердца и обусловлено не столько сужением сосудов, сколько потерей ими эластичности и их неспособностью к адаптационному расширению. Ишемия (смотри полный свод знаний) определённого участка органа с минимальным кровотоком может возникать также при резком падении артериальное давление. Развитие Инфаркт в этом случае является показателем недостаточности общего кровообращения (Инфаркт мозга, миокарда). Для развития Инфаркт сердечной мышцы продолжительность ишемии, по экспериментальным данным, составляет 20 минут, для образования Инфаркт мозговой ткани — достаточно 5—6 минут Макроскопически и микроскопически некроз ткани в зоне Инфаркт миокарда чётко выявляется на 2-е суток. На более ранней стадии (так называемый донекротический период) удаётся выявить нарушения микроциркуляции, очаги контрактурного сокращения сосудистых миоцитов или их лизис. Большое значение в механизме развития тканевых изменений при Инфаркт принадлежит гипоксии (смотри полный свод знаний). Нарушение окислительно-восстановительных процессов в тканях в связи с расстройством кровообращения ведёт к накоплению недоокисленных продуктов обмена, которые оказывают влияние на коллоиды тканей, стенки сосудов и приводят к их некрозу (смотри полный свод знаний).
Большое значение в развитии Инфаркт имеет внезапное сужение или закрытие сосудистого просвета, поэтому наиболее частой причиной Инфаркт является тромбоз (смотри полный свод знаний) и эмболия (смотри полный свод знаний), реже спазм (смотри полный свод знаний). В этих условиях коллатерали оказываются недостаточными, легко возникают дистонические явления и закупорка сосуда приводит к Инфаркт
Инфаркт чаще встречаются в сердце (смотри полный свод знаний), почках (смотри полный свод знаний), селезёнке (смотри полный свод знаний), лёгких (смотри полный свод знаний), головном мозге (смотри полный свод знаний), сетчатке (смотри полный свод знаний), кишечнике (смотри полный свод знаний). Инфаркт в почках, селезёнке, лёгких имеет клиновидную форму, что связано с их ангиоархитектоникой (магистральный тип сосудов, направляющихся от ворот к периферии), захватывает центральную часть ишемизированной области; при этом острие клина направлено в сторону препятствия кровотоку (места закупорки или резкого сужения сосуда), а широкая часть (основание) обращена на периферию органа. В мышце сердца Инфаркт имеет неправильную форму, захватывая послойно различные зоны миокарда, начиная от подэндокардиальных слоёв, что обусловлено рассыпным типом ветвления сосудов; в кишечнике Инфаркт резко отграничен, протяжённость его зависит от калибра закупоренной артерии.
На фоне общих и местных расстройств кровообращения в разных органах могут возникать небольшие, иногда микроскопических размеров, очаги некроза — микроинфаркты, характерные для миокарда и головного мозга. В возникновении их определённую роль могут играть перепады давления в мелких сосудах, а также несоответствие между повышенной потребностью в питании ткани и недостаточным кровотоком в условиях эмоциональной или физических нагрузки, а также метаболические нарушения, обусловленные гипоксией или ишемией.
Различают три вида Инфаркт: белый (ишемический, анемический), красный (геморрагический), белый с геморрагическим поясом.
Белые (ишемические) Инфаркт наблюдаются в почках, селезёнке, головном мозге, миокарде (цветной рисунок 1 и 3). Они треугольной формы, желтовато-белого цвета (отсюда название «белый»), довольно резко отграничены от окружающей ткани, плотной консистенции. Возникают в связи с полным прекращением тока крови в данном сосуде и его разветвлениях. Некроз в таких случаях всегда вначале носит характер сухого коагуляционного.
Красные (геморрагические) Инфаркт наблюдаются в лёгких (цветной таблица, страница 177, рисунок 2), в кишечнике, иногда в селезёнке и головном мозге; возникают, как правило, в условиях декомпенсации кровообращения и венозного застоя: в лёгких — при сердечной недостаточности различного происхождения, в селезёнке — при тромбозе её вены, в головном мозге — при тромбозе яремных вен или синусов твёрдой мозговой оболочки. При этом имеет место обратный ток венозной крови в зону Инфаркт, паралитическое расширение сосудов, повышение их проницаемости и пропитывание зоны Инфаркт кровью. Геморрагический Инфаркт треугольной формы, на разрезе темно-красного цвета, что определяет его название, довольно резко отграничен от окружающей ткани. Со временем Инфаркт бледнеет вследствие гемолиза эритроцитов
Белый Инфаркт с геморрагическим поясом — белого или светло-серого цвета с темно-красным ободком — наблюдается в сердце и селезёнке, иногда в почках. Зона кровоизлияния возникает в связи с тем, что рефлекторный спазм по периферии Инфаркт быстро сменяется паралитическим расширением и переполнением кровью капилляров с развитием явлений престаза, стаза (смотри полный свод знаний) и диапедезного кровоизлияния (смотри полный свод знаний Диапедез).
В отдельную группу следует выделить близкие к геморрагическим так называемый застойные, или венозные, Инфаркт, обусловленные закрытием просвета и прекращением оттока крови по сравнительно крупным венозным стволам или тромбозом большого количества мелких вен. Застой крови, отёк и массивные кровоизлияния создают условия, не совместимые
с жизнедеятельностью тканей,— возникает Инфаркт. Такие венозные застойные Инфаркт наблюдаются в кишечнике при тромбозе брыжеечных вен, в почках при нарастающем тромбозе почечных вен, в селезёнке при закупорке просвета селезёночной вены.
Одновременно или последовательно в различных органах могут возникать множественные Инфаркт разной локализации, формы и размеров Можно также наблюдать образование свежих очагов некроза по периферии более старых, организующихся Инфаркт, а также появление свежих некрозов в сохранившихся участках паренхимы в толще Инфаркт. Это может быть обусловлено прогрессированием нарушения кровообращения с захватом новых сосудистых ветвей, например, при распространении в их просвет тромба, ухудшением кровообращения в связи с падением кровяного давления или, как это бывает при инфаркте миокарда (смотри полный свод знаний), с внезапной неадекватной физических или эмоциональной нагрузкой. Этому предшествуют изменения на уровне внутриклеточных органелл и макромолекул — набухание и разрушение крист митохондрий, изменения ультраструктуры саркоплазматического ретикулума, накопление липопротеидных комплексов
Рис. 1. Разрез селезёнки: стрелками указаны белые (ишемические) инфаркты.
Рис. 2. Продольный разрез лёгкого с участками красного (геморрагического) инфаркта (указаны стрелками); справа внизу микропрепарат (стрелками указан поражённый участок, пропитанный кровью).
Рис. 3. Продольный разрез почки: стрелками указаны белые инфаркты; справа внизу микропрепарат (нижней стрелкой указан участок белого инфаркта, верхней — геморрагический пояс по периферии).
Гистохимически в зоне Инфаркт определяется снижение и исчезновение гликогена (в миокарде, печени, почках), снижение активности окислительно-восстановительных ферментов, уменьшение содержания ДНК и РНК, накопление нейтральных мукополисахаридов типа сиаловых кислот, нарушение ионного равновесия. После кратковременного рефлекторного сужения сосуды в зоне Инфаркт паралитически расширяются; по существу, в этой области (в сердце, лёгких) имеется не малокровие, а венозный застой с картиной стаза и мелкими кровоизлияниями. Некроз носит коагуляционный характер (почки, селезёнка, миокард) или с самого начала принимает характер влажного, колликвационного (в мозге). При микроскопическом исследовании Инфаркт структура органа нарушена, ядра не окрашиваются и все структурные элементы сливаются в однородную гомогенную массу (смотри полный свод знаний Некроз). По периферии Инфаркт всегда существует зона некробиоза, дистрофических изменений и реактивного воспаления. По клеточному составу воспалительной инфильтрации и пролиферативным реакциям стромы на границе Инфаркт можно судить о давности процесса. Небольшие Инфаркт (микроинфаркты) в течение 3—4 дней замещаются молодой соединительной тканью. В обширных Инфаркт некротические массы в центре очага могут сохраняться в течение недель и даже месяцев
Исход Инфаркт зависит от условий его образования, локализации и размеров При благоприятных условиях Инфаркт замещается грануляционной, а затем рубцовой тканью. В мозге на месте влажного некроза развивается киста. В некротические массы возможно отложение извести — петрификация Инфаркт. При наличии микробов Инфаркт может подвергнуться гнойному расплавлению. В рубцах на месте геморрагического Инфаркт обнаруживается пигмент гемосидерин.
Значение Инфаркт для организма в конечном итоге зависит от его локализации, размеров, функциональной значимости поражённых участков, регенераторных и адаптационных возможностей органа и тканей. Инфаркт миокарда и вещества мозга могут явиться причиной смерти или вызывать тяжёлые нарушения функций поражённого органа. Обширные Инфаркт вызывают интоксикацию организма продуктами тканевого распада: отмечаются повышение температуры, лихорадочное состояние, дистрофические изменения внутренних органов Всасывание денатурированных белков из очага поражения обусловливает аутоиммунную реакцию с образованием органоспецифических антител и плазматизацией лимфоидных образований.
Термином «инфаркт» обозначают также некрозы, развивающиеся в почках при пропитывании их мочекислыми солями (смотри полный свод знаний Мочекислый инфаркт) или желчными кислотами и гемоглобиногенными пигментами (смотри полный свод знаний Билирубиновый инфаркт).
Операция при гемморагическом инсульте
Вторым этапом лечебного процесса выступает нейрохирургическое вмешательство. Его целью является удаление жизнеугрожающей гематомы для повышения выживаемости и достижения максимально возможного удовлетворительного функционального исхода. Чем скорее проведут операцию, тем лучших прогнозов можно будет ожидать. Однако ранняя операция, как правило, предполагает выполнение хирургических манипуляций не раньше чем через 7-12 часов после инсульта. В ультра-раннем периоде она может привести к повторным кровотечениям.
В какой срок разумнее приступить к удалению сгустков крови, решается сугубо компетентными нейрохирургами. Отмечено, что к положительному эффекту могут приводить и операции, совершенные даже спустя 2-3 недели (включительно) после состоявшегося ГИ. Так что вопрос, когда прооперировать пациента, полностью берется под ответственность врача. Рассмотрим основополагающие методы операций, широко применяемые при геморрагических инсультах.
- Открытая декомпрессивная краниотомия показана при средних и крупных подкорковых, а также больших путаментальных и мозжечковых кровоизлияниях. К ней обращаются и при выраженном смещении и нарастающем отеке мозгового компонента, ухудшении неврологического статуса больного. Открытая операция выполняется под полной общей анестезией с применением микрохирургической оптики. Извлечение скопившегося сгустка реализуется через классический трепанационный доступ. Далее делается экономная энцефалотомия, затем патологический компонент отсасывается специальным прибором. Плотные скопления удаляются окончатым пинцетом. В конце операционное поле досконально промывается раствором хлорида натрия, выполняется тщательный гемостаз посредством коагуляции и антигеморрагических средств.
- Пункционно-аспирационная процедура рекомендуется при небольших геморрагиях таламического, путаментального, мозжечкового расположения. Способ заключается в создании маленького отверстия в черепной коробке, пункции гематомы с последующим освобождением мозга от ее жидкой массы посредством аспирации. Такая технология может быть реализована одним из двух миниинвазивных приемов: по принципу стереотаксической или нейроэндоскопической аспирации. Иногда их целесообразно сочетать с локальным фибринолизом. Фибринолиз подразумевает установку дренажа после пункции и аспирации в полость гематомы. Через дренаж в течение нескольких дней вводят фибринолитики для активации растворения (разжижжения) кровяного сгустка и выведения лизированных элементов крови.
Функции аппарата ЦНС, к сожалению, после геморрагических инсультов полностью восстановить невозможно. Но в любом случае, в интересах больного будет обращение в клинику, где работают врачи международного уровня по диагностике и хирургическому лечению внутримозговых поражений. Только так можно рассчитывать на организацию адекватного и безопасного хирургического обеспечения. Следовательно, минимизацию осложнений, более продуктивные результаты в восстановлении качества жизни.
Акцентируем, что идеальное исполнение операции в правильные сроки в 2-4 раза повышает процент выживаемости. Грамотный послеоперационный уход сокращает вероятность рецидива. Нельзя не предупредить, что повторный инсульт с кровоизлиянием у 99,99% пациентов приводит к летальному исходу.
В качестве рекомендации считаем важным сказать, что в уровне развития сферы нейрохирургии мозга на территории Европы Чехия показывает хорошие результаты. Чешские медцентры славятся безупречной репутацией и отличными показателями благополучного восстановления даже самых тяжелых пациентов. И это не все: в Чехии минимальные цены на нейрохирургическую помощь и одна из лучших послеоперационная реабилитация. Выбор медучреждения для прохождения оперативного вмешательства, безусловно, остается за пациентом и его родственниками.
Геморрагический инфаркт яичка как осложнение COVID-19 (SARS-CoV-2)
Деревянко Т.И., Придчин С.В.
Сведения об авторах:
- Деревянко Т.И. – д.м.н., профессор, зав. кафедрой урологии, детской урологии-андрологии, акушерства и гинекологии ФГБОУ ВО «Ставропольский государственный медицинский университет» МЗ РФ; Ставрополь, Россия; РИНЦ Author ID 310494
- Придчин С.В. – ассистент кафедры Урологии, детской урологии-андрологии, акушерства и гинекологии ФГБОУ ВО «Ставропольский государственный медицинский университет» МЗ РФ; Ставрополь, Россия;
ВВЕДЕНИЕ
Инфаркт яичка может наблюдаться у пациентов разного возраста. Взрослые пациенты с этим заболеванием составляют 7-10%, а дети – 20% в популяции больных с острой урологической патологией [1]. Это одна из урологических нозологий, входящая в группу заболеваний под названием «острая мошонка». Существует 2 вида инфаркта яичка: ишемический и геморрагический. По степени поражения органа он делится на сегментарный и тотальный. Ишемический инфаркт возникает в результате острого нарушения кровоснабжения яичка из тестикулярной артерии. Чаще всего это вызвано перекрутом семенного канатика или механической компрессией сосудов яичка. Геморрагический инфаркт, как правило, возникает в результате нарушения микроциркуляции или эмболизации артерий и артериол яичка и носит чаще всего сегментарный характер [2]. Предрасполагающими условиями для этого могут быть атеросклеротический процесс, при котором окклюзия артерии происходит из-за образовавшегося крупного холестеринового эмбола, а также микроангиопатии и часто как следствие сахарного диабета. Геморрагический инфаркт яичка также может возникать при остром гнойном орхоэпидидимите, когда нарушается кровообращение в системе тестикулярных вен [3]. Особенно тяжелый процесс возникает, если пациент страдает иммуносупрессивными заболеваниями, а также васкулитами и периартериитами.
Состояния, связанные с повышением свертываемости крови также создают условия для обструкции вен с последующим некрозом тканей в любом органе, в том числе и в яичках [4-6]. Известно, что COVID-19 (SARSCOV-2) вызывает патологическое повышение свертываемости крови в организме больного и наиболее опасным осложнением его является тромбообразование в различных кровеносных сосудах органов больного, что нередко является причиной острой ишемии этих органов и даже летального исхода пациентов с COVID-19 [7-15].
МАТЕРИАЛЫ И МЕТОДЫ
Мы наблюдали 3 клинических случая геморрагического инфаркта яичка у пациентов, страдавших COVID-19 (SARS-COV-2) и находившихся в специализированном COVID отделении городской больницы г. Пятигорск (Россия, Ставропольский край). Все 3 пациента были в возрасте от 67 до 88 лет и имели сопутствующую патологию со сторону сердечно-сосудистой системы в виде артериальной гипертонии, а также сахарный диабет 2 типа.
Приводим описание одного клинического случая, так как все они протекали по одному клиническому сценарию.
Клиническое наблюдение. Пациент В. 66 лет был госпитализирован в специализированное COVID отделение с диагнозом: Короновирусная инфекция, вызванная COVID19 (подтвержденная), среднетяжелая форма UO7.1, внебольничная двусторонняя долевая пневмония, острый респираторный дистресс-синдром, дыхательная недостаточность. Сопутствующие заболевания: атеросклеротический кардиосклероз, артериальная гипертония, сахарный диабет 2 типа. Пациент получал терапию по поводу основного заболевания (антибактериальную, антикоагулянтную терапию (Эноксапарин 40 мг 1 раз в день), противовоспалительную, дезинтоксикационную терапию), но на 9 сутки пребывания в стационаре у него появились жалобы на острую боль в левой половине мошонки, резкое ( в течение нескольких часов) увеличение в размерах левого яичка. В течение последующих суток, со слов больного, боль и объем яичка нарастали. У пациента во время пребывания в стационаре постоянно отмечалась фебрильная температура тела. Учитывая профиль отделения и специфичность ситуации, осмотр уролога состоялся только через 42 часа с момента возникновения жалоб.
Осмотр: левая половина мошонки увеличена в размерах, кожа ее имеет синюшный оттенок. Левое яичко увеличено в размерах в 2 раза, плотное, болезненное, не спаяно с окружающими тканями. Больной отмечает незначительное снижение интенсивности боли относительно ее дебюта. Общая и локальная гипертермия сохраняется.
Анамнез: заболеваниями почек, мочевыводящих путей и мужских гонад в течение жизни не страдал.
Инструментальное и лабораторное исследования: диафаноскопия выявила непроницаемость всей ткани яичка для светового луча. Ультразвуковое исследование (УЗИ) левого яичка выявило широкое клиновидное гипоэхогенное повреждение паренхимы яичка с признаками выраженной ишемии, занимающее почти всю его ткань. Данный результат свидетельствовал об остром нарушении кровообращения в левом яичке. В период пребывания в стационаре отмечалось нарастание симптоматики. При лабораторном исследовании крови отмечалось повышение числа лейкоцитов и показателей свертывающей системы крови, ускорение СОЭ и увеличение концентрации С-реактивного белка. Эти исследования выполнялись в динамике и отмечалась тенденция к их повышению в период пребывания в стационаре.
С целью дифференциальной диагностики между инфарктом и онкологическим заболеванием яичка были выполнены анализы на опухолевые маркеры АФП (Альфафетопротеин), В-ХГЧ (хорионический гонадотропин) и ЛДГ (лактатдегидрогеназа). Они были в норме, что указывало на отсутствия онкологического процесса в левом яичке. Дуплексное сканирование выявило признаки кровоизлияния и некроза и снижение степени пульсации левой яичковой артерии, что свидетельствовало о наличии инфаркта левого яичка. Все исследования были объективными показаниями к экстренной хирургической ревизии левого яичка.
Лечение. В экстренном порядке была выполнена хирургическая ревизия левого яичка. Оно было увеличено в размерах, багрово-синюшного оттенка, плотное со множественными участками кровоизлияний и некроза (рис. 1). Перекрута семенного канатика не отмечалось. Состояние яичка было оценено как сегментарный обширный геморрагический инфаркт паренхимы яичка. Была выполнена левосторонняя орхиэктомия.
Рис. 1. Операционный препарат, уделенное левое яичко с некротическими изменениями и кровоизлияниями всех тканей Fig. 1. Surgical preparation, left testicle with necrotic changes and hemorrhages of all tissues
При гистологическом исследовании операционного препарата (удаленное левое яичко) выявлено наличие некроза ткани яичка, измененных эритроцитов и экстравазации в тканях органа, что подтвердило диагноз геморрагического инфаркта яичка у данного пациента. Причиной этого с большой долей вероятности послужило основное заболевание – COVID-19 (SARS-COV-2), патологически повысившее свертывающие свойства крови пациента и вызвавшее острую локальную сосудистую катастрофу в левом яичке.
ОБСУЖДЕНИЕ
Два других пациента нашего клинического наблюдения, также находились в том же отделении по поводу заболевания COVID-19 (SARS-COV-2) и имели аналогичную клиническую картину геморрагического инфаркта яичка на 10 и 12 сутки основного заболевания. Им после предварительного обследования и хирургической ревизии яичка также в экстренном порядке была выполнена орхиэктомия. Все 3 пациента выздоровели.
В доступной литературе подобных случаев больше не описано.
ЗАКЛЮЧЕНИЕ
Геморрагический инфаркт яичка у больных COVID-19 в нашем клиническом наблюдении может рассматриваться как осложнение COVID-19 или как его клиническое проявление в органах репродуктивной системы мужчины.
ЛИТЕРАТУРА
- Нечипоренко Н.А., Нечипоренко А.Н. Неотложные состояния в урологии. Минск. Вышэйшая школа, 2012; 400 с. .
- Болотов Ю.Н., Минаев С.В. Острые заболевания яичка у детей. Практическое руковод- ство. М.: ИНФРА-М, 2018; 107 с. [Bolotov Yu.N., Minaev S.V. Acute testicular disease in children. A practical guide. M.: INFRA-M, 2018; 107 p. (In Russian)]. https://doi.org/10.12737/2899.
- Madaan S, Joniau S, Klockaerts K Costa M, Calleja R, Ball RY, Burgess N. Segmental testicular infarction. Conservative management is feasible and safe: part 2. Eur Urol 2008;53(3):656-8. https://doi.org/10.1016/j.eururo.2007.03.062.
- Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A novel coronavirus from patients with pneumonia in China, 2021. N Engl J Med 2020;382(8):727-733. https://doi.org/10.1056/ NEJMoa2001017.
- Ge H, Wang X, Yuan X, Xiao G, Wang C, Deng T, et al. The epidemiology and clinical information about COVID-19. Eur J Clin Microbiol Infect Dis. 2020;39(6):1011-1019. https://doi.org/10.1007/s10096-020-03874-z.
- Sifuentes-Rodríguez E, Palacios-Reyes D. COVID-19: the outbreak caused by a new coronavirus. Bol Med Hosp Infant Mex 2020;77(2):47-53. https://doi.org/10.24875/BMHIM.20000039.
- Baloch S, Baloch MA, Zheng T, Pei X. The Coronavirus Disease 2019 (COVID-19) Pandemic. Tohoku J Exp Med 2021 Apr;250(4):271-278. https://doi.org/10.1620/tjem.250.271.
- Steinberg E, Balakrishna A, Habboushe J, Shawl A, Lee J. Calculated Decisions: COVID-19 Calculators During Extreme Resource-Limited Situations. Emerg Med Pract 2020;22(4 Suppl):CD1- CD5.
- Малхасян В.А., Касян Г.Р., Ходырева Л.А., Колонтарев К.Б., Говоров А.В., Васильев А.О., Пушкарь Д.Ю. Оказание стационарнои помощи пациентам урологического профиля в ̆ условиях пандемии коронаровируснои инфекции ̆ COVID-19. Экспериментальная и клиническая урология 2020;(1):4-11. . https://doi.org/10.29188/2222- 8543-2020-12-1-4-1.
- Stensland KD, Morgan TM, Moinzadeh A, Lee CT, Briganti A, Catto J, Canes D. Considerations in the triage of urologic surgeries during the COVID-19 pandemic. Eur Urol 2020;77(6):663‐666. https://doi.org/10.1016/j.eururo.2020.03.027.
- Un contagio su dieci tra medici e infermieri, in trincea con mascherine inadatte e pochi tampon. [Электронный ресурс]. URL: https://www.ilsole24ore.com/art/ un-contagio-dieci-%0Amedicie infermieritrinceamascherine-inadattee-pochi-tamponi-ADqwiFF.
- EAU Robotic Urology Section (ERUS) guidelines during COVID-19 emergency. [Электрон- ный ресурс]. URL: https://uroweb.org/eau-robotic-urology-section-erus-guide-lines-during-c…, accessed on March 29, 2021.
- Ficarra V, Novara G, Abrate A, Bartoletti R, Crestani A, de Nunzio C, et al. Urology practice during COVID-19 pandemic. Minerva Urol Nefrol 2020; 72(3):369-375. https://doi.org/10.23736/ S03932249.20.03846-1.
- Hollander J, Car B. Virtually Perfect? Telemedicine for Covid-19. N Engl J Med 2020(382)1679- 168. https://doi.org/10.1056/NEJMp2003539.
- Moazzami B, Razavi-Khorasani N, Dooghaie Moghadam A, Farokhi E, Rezaei N. COVID-19 and telemedicine: immediate action required for maintaining healthcare providers well-being. J Clin Virol 2020(126):104345. [Электронный ресурс]. URL: https://www.arcgis.com/apps/opsdashboard/index.html#/bda7594740fd4029942. https://doi.org/10.1016/j.jcv.2020.10434513.
Журнал
Журнал «Экспериментальная и клиническая урология» Выпуск №2 за 2021 год
Комментарии
Для отправки комментариев необходимо войти или зарегистрироваться