По оценкам, врожденные пороки сердца встречаются примерно у 1% новорожденных.
Их развитие обычно обусловлено рядом сопутствующих генетических факторов и факторов окружающей среды. Врожденная сердечная недостаточность является относительно частой причиной смерти у новорожденных и младенцев. По данным около 50% детей с диагнозом порока сердца умирают до первого года жизни. Тем не менее, все существующие пороки сердца могут быть вылечены хирургическими процедурами.
Общие сведения о заболевании
Асфиксию диагностируют у 4-6% детей. Причем процент колеблется в зависимости от степени недоношенности плода. У малышей, которые рождаются до 36 недели, частота развития патологии достигает 9%, а у детей, родившихся после 37 недели – снижается до 1-2%.
Научные определения асфиксии новорожденного сводятся к тому, что ребенок не может самостоятельно дышать или совершает поверхностные судорожные дыхательные движения, которые не позволяют организму получить кислород в достаточном объеме. Авторы рассматривают асфиксию младенцев как удушье, при котором сохраняются другие признаки того, что плод жив: есть сердцебиение, пуповина пульсирует, мускулатура слабо, но сокращается.
К причинам развития асфиксии новорожденных относят комплекс факторов риска, которые нарушают кровообращение и функции дыхания плода в утробе и в процессе рождения. К наиболее распространенным причинам относятся:
- конфликт резусов крови мамы и ребенка;
- аномальное развитие плода;
- патологии нервной системы у малыша;
- нарушение кровообращения, болезни сердца у малыша;
- внутричерепная травма, которую малыш получил во время родового процесса;
- инфекции, влияющие на плод в утробе (хламидиоз, герпес, краснуха и др.);
- экстрагенитальные патологии матери (тиреотоксикоз, анемия, сахарный диабет);
- инфекционные болезни во втором и третьем триместрах;
- осложненные роды;
- недоношенная или переношенная беременность;
- вредные привычки матери (влияние на организм алкоголя, никотина, наркотиков);
- неполноценное питание в период беременностиИсточник: Асфиксия новорожденных. Жетписова Л.Б. WestKazakhstanMedicalJournal, 2011.
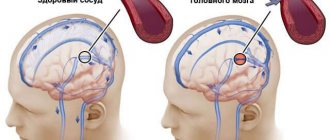
Наиболее частой причиной асфиксии является внутриутробная гипоксия, то есть нехватка малышу кислорода в утробе матери.
Какими бы ни были причины патологического состояния, оно вызывает у ребенка одинаковые процессы:
- нарушает обмен веществ и кровоциркуляцию;
- сгущает, повышает вязкость крови;
- наносится ущерб головному мозгу, печени, сердцу, надпочечникам;
- органы отекают, происходит излияние крови;
- происходят сбои в работе центральной нервной системы.
Чем дольше организм ощущает нехватку кислорода, тем более серьезной становится степень поражения тканей, органов и систем.
Типы врожденных пороков сердца
Врожденные пороки сердца чаще всего встречаются у недоношенных детей с низким весом при рождении. Непосредственные причины нарушений в конструкции этого органа до конца не выяснены. Сосуществование по меньшей мере нескольких генетических факторов и факторов окружающей среды оказывает большое влияние на возникновение пороков сердца. Риск их появления у ребенка увеличивается, когда:
- Женщина болела краснухой в первом триместре беременности.
- Беременная женщина курила сигареты, употребляла алкоголь или употребляла наркотики.
- Женщина с диабетом.
- У ребенка возникли хромосомные нарушения (включая синдром Дауна и синдром Тернера).
Пороки сердца могут поражать различные структуры этого органа, в том числе: клапаны, желудочки и кровеносные сосуды. Принимая это во внимание выделяется:
- Дефекты в отделах сердца.
- Аномальные отклонения в крупных артериях.
- Неправильный кровоток к сердцу.
- Частичный или тотальный стеноз клапанов и кровеносных сосудов.
Основные признаки и симптомы
Наиболее очевидным диагностическим признаком является расстройство дыхательных процессов. Именно оно в последующем приводит к нарушениям работы сердечно-сосудистой системы, ослаблению мышечного тонуса и рефлексов ребенка.
Клинические проявления умеренной асфиксии:
- вялость, слабость;
- сниженная двигательная активность;
- слабые реакции;
- угнетенные рефлексы;
- малоэмоциональный крик;
- тахикардия;
- аритмичное дыхание, иногда – с хрипами;
- кожа – синюшная, но может быстро порозоветь.
Состояние ребенка при этом считается среднетяжелым. В течение первых 2-3 дней жизни он находится в состоянии повышенной возбудимости, которое может сменяться синдромом угнетения, слабости, вялости. Проявляется состояние мелким тремором рук и ног, нарушенным сном, слабыми рефлексами.
При тяжелой асфиксии клиническая картина включает:
- отсутствие крика при рождении;
- рефлексы сильно угнетены или резко снижены;
- кожа синюшная, бледная, с «мраморным рисунком»;
- дыхание поверхностное, аритмичное и периодически отсутствующее;
- в легких прослушиваются хрипы;
- биение сердца слабое, глухое;
- судороги.
При благоприятном преодолении острой тяжелой асфиксии на 2-3 сутки нормализуется дыхание, восстанавливаются рефлексыИсточник: Гипоксия плода и асфиксия новорожденного. Кузнецов П.А., Козлов П.В. Лечебное дело, 2021. с. 9-15.
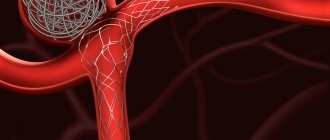
Сужение аорты
Стеноз аорты встречается примерно у 8% новорожденных с диагностированным пороком сердца. Учитывая расположение частичной окклюзии главной артерии, наблюдается сужение:
Субоклапан, который представляет собой сужение пути кровотока из левого желудочка, расположен под аортальным клапаном. Следствием этого недуга является перегрузка давлением, что приводит к гипертрофии желудочков. При этом пороке сердца выявлена: ишемическая болезнь сердца в раннем возрасте, тяжелые аритмии в первую очередь желудочковые, что может вызвать потерю сознания или обструктивный стеноз аорты обычно бессимптомный до подросткового возраста, когда есть боль в груди при частых обмороках. Сужение аорты, которое не диагностируется в нужное время, может привести к серьезным осложнениям, включая повреждение клапана.
Клапанный аортальный стеноз, для которого характерно частичное закрытие просвета основной артерии на уровне клапана. Этот дефект приводит к быстро прогрессирующей сердечной недостаточности, сопровождающейся отеком легких. По этой причине ребенку требуется немедленное хирургическое вмешательство.
Виды асфиксии новорожденных
Классификацию проводят по нескольким признакам. В первую очередь, в зависимости от времени развития патологического состояния выделяют:
- первичную, или внутриутробную асфиксию – развивается непосредственно в утробе матери;
- вторичную, или внеутробную асфиксию – возникает в первые часы жизни малыша.
В свою очередь, первичная асфиксия также делится на два подвида:
- антенатальную, или хроническую – развивается еще до начала родовой деятельности;
- интранатальную, или острую – возникает в период раскрытия матки и выхода плода.
Классификация асфиксии по шкале Апгар
Чтобы поставить оценку степени тяжести асфиксии новорожденного, используют шкалу Апгар. С ее помощью врач оценивает частоту пульса, дыхание, мышечный тонус, окрас кожи и рефлексы, после чего определяет степень тяжести патологического состояния.
Чтобы поставить оценку, каждый из пяти признаков врач оценивает в 0, 1 или 2 балла. Соответственно, максимальная и самая лучшая оценка – 10 баллов. Оценку определяют с учетом таких критериев:
| Признак | 0 баллов | 1 балл | 2 балла |
| Пульс, ударов в минуту | Нет | До 100 | От 100 и выше |
| Дыхание | Нет | Нерегулярное, слабое | Активное, ребенок кричит и плачет |
| Тонус мышц | Руки и ноги свисают | Слабое сгибание рук, ног | Активные движения |
| Рефлексы | Нет | Слабые | Присутствуют, хорошо выражены |
| Цвет кожи | Бледный, синюшный | Тело – розовое, руки и ноги — синюшные | Розовое тело, конечности |
Состояние оценивают на первой и пятой минутах жизни. Соответственно, ребенок получает две оценки: например, 8/10. Если оценка составляет 7 и ниже, состояние малыша оценивают дополнительно на 10-й, 15-й и 20-й минутах.
В зависимости от оценки по шкале Апгар, определяют степень асфиксии:
- 1-3 балла – тяжелая;
- 4-5 баллов – средняя;
- 6-7 баллов – легкая, или умеренная.
Оценка Апгар не отличается высокой степенью чувствительности. Поэтому если у ребенка присутствуют отклонения, для оценки асфиксии необходима дополнительная диагностика.
Симптомы
- Голубой или синюшный цвет кожи, губ, ушных раковин.
- Появление синюшной кожи при кормлении грудью, крике малыша.
- Побледнение кожи и похолодание конечностей (при «бледных пороках»).
- Шумы в сердце.
- Признаки сердечной недостаточности.
- Изменения на электрокардиограмме, рентгеновских снимках, при эхокардиографическом исследовании (УЗИ сердца).
Конечно, при таких симптомах обеспокоенные родители немедленно обращаются к врачу, и порок сердца диагностируется в первые месяцы жизни ребенка, либо при рождении во время сопутствующих первых осмотров. Небольшие дефекты проявляют себя иногда только необычными шумами в сердце при прослушивании во время регулярных осмотров у детского врача.
Даже имея врожденный порок сердца, некоторое время после рождения ребёнок может выглядеть внешне вполне здоровым в течение первых десяти лет жизни. Однако в дальнейшем порок сердца начинает проявлять себя: ребенок отстает в физическом развитии, появляется одышка при физических нагрузках, бледность или даже синюшность кожи.
Для установки истинного диагноза необходимо комплексное обследование сердца с применением современного высокотехнологичного оборудования.
Хирургическое лечение является наиболее эффективным, причём операции зачастую делают новорожденным и детям от первого года жизни. Чаще всего вопрос о хирургическом лечении ставится еще до рождения ребенка, если это касается «синих пороков». Поэтому в таких случаях роды должны протекать в роддомах при кардиохирургических больницах. Терапевтическое лечение необходимо, если сроки операции можно перенести на более поздний срок. Если вопрос касается «бледных пороков», то лечение будет зависеть от того, как будет себя вести порок по мере роста ребенка. Скорее всего, все лечение будет терапевтическим.
Диагностика
Диагностировать асфиксию в период вынашивания плода (первичную, или внутриутробную) позволяют:
- мониторинг сердечного ритма плода, который проводят в ходе кардиотокографии;
- анализ двигательной активности, дыхания и тонуса мышц плода, который проводят при ультразвуковом исследовании.
При вторичной, или внеутробной асфиксии постановка диагноза проводится с учетом наличия признаков патологического состояния, внешнего состояния младенца, степени тяжести проявления нехватки кислорода и дальнейших анализов, которые проводятся после выполнения алгоритма неотложной помощи ребенку.
Для диагностики используют:
- оценку по шкале Апгар;
- анализ крови из кожи головы, сосудов пуповины плода, в ходе которого определяют величину напряжения кислорода, напряжение углекислоты и кислотность крови.
В некоторых случаях также назначают ультразвуковое исследование головного мозга, с помощью которого определяют, насколько поражена центральная нервная система. Обследование также позволяет отличить гипоксическое повреждение нервной системы от травматического.
Диагностика приобретенных и врожденных пороков сердца
Основой диагностики как врожденных, так и приобретенных пороков сердца является эхокардиография (ЭХО сердца), которая представляет собой визуальный осмотр, позволяющий проводить неинвазивное исследование структур сердца – клапанов, камер, предсердий и кровеносных сосудов. Наиболее распространенным типом является трансторакальная эхокардиография. Противопоказанием для этого теста является ожирение (ИМТ более 35), хроническая обструктивная болезнь легких (ХОБЛ). Другим тестом, используемым в диагностике приобретенных и врожденных пороков сердца, является рентгенологическое исследование грудной клетки (рентген), благодаря которому можно точно определить местоположение, размеры и форму сердца. Важно отметить, что самое популярное кардиологическое обследование – электрокардиография (ЭКГ) не может быть основным обследованием на наличие подозрений на порок сердца.
Лечение
Клинические рекомендации при асфиксии предусматривают первоочередное предоставление первой помощи новорожденному. Это самый ответственный шаг, который при условии грамотного проведения снижает тяжесть последствий патологического состояния и риск развития осложнений. Ключевая цель реанимационных мероприятий при асфиксии – достичь максимально высокой оценки по шкале Апгар к 5-20 минутам жизни новорожденного.
Провести последовательную и эффективную реанимацию новорожденного, родившегося в асфиксии, позволяют этапы и принципы АВС-реанимацииИсточник: Проведение лечебной гипотермии у новорожденных, родившихся в асфиксии. К. Б. Жубанышева, З. Д. Бейсембаева, Р. А. Майкупова, Т. Ш. Мустафазаде. Наука о жизни и здоровье, 2021. с. 60-67:
- Принцип А («airway») – обеспечить свободную проходимость дыхательных путей на первом этапе реанимации. Для этого нужно создать правильное положение: запрокинуть голову, приспустить ее на 15 градусов. После этого – отсосать слизь, околоплодные воды из носа, рта, трахеи, нижних отделов дыхательных путей.
- Принцип B («breath») – создать вентиляцию, обеспечить дыхание. Для этого создают струйный кислородный поток – проводят искусственную вентиляцию легких с помощью реанимационного мешка. Если ребенок не кричит – добавляют тактильную стимуляцию: поглаживание вдоль спины, похлопывание по стопам.
- Принцип С («cordial») – восстановить работу сердца. В этом помогает непрямой массаж сердца. При необходимости – вводят адреналин, глюкозу, гидрокортизон и другие препараты. При этом нельзя прекращать вспомогательную вентиляцию из предыдущего этапа.
Уход за новорожденным ребенком, перенесшим асфиксию, проводится в условиях роддома. Малышей с легкой формой размещают в специальную палатку с высоким содержанием кислорода. При средней или тяжелой форме асфиксии младенцев размещают в кувез – специальный бокс, куда подается кислород. При необходимости проводят повторную очистку дыхательных путей, освобождают их от слизи.
Схему дальнейшего лечения, восстановления и ухода определяет лечащий врач. Общие рекомендации по уходу предусматривают:
- поддержание в норме температуры тела, артериального давления, сердечного ритма;
- создание максимального комфорта: оптимальной температуры окружающей среды, удобного положения;
- проведение дыхательной терапии;
- проведение инфузионной терапии – введение жидкости для восполнения потребностейИсточник: Протокол проведения лечебной гипотермии детям, родившимся в асфиксии. Ионов О.В., Балашова Е.Н., Киртбая А.Р., Антонов А.Г., Мирошник Е.В., Дегтярев Д.Н. Неонатология: Новости. Мнения. Обучение, 2014. с. 81-83.
В ходе реабилитации следить за состоянием ребенка помогает регулярный мониторинг:
- веса малыша (два раза в день);
- неврологического и соматического статуса;
- объема употребляемой жидкости;
- состава питания;
- основных жизненных показателей: пульса, артериального давления, сатурации, частоты дыхательных движений;
- лабораторных характеристик крови, мочи;
- рентгенограммы грудной клетки, брюшной полости;
- ультразвукового исследования брюшной полости;
- нейросонографии;
- электрокардиограммы, эхокардиограммы.
После выписки малыша нужно регулярно наблюдать у педиатра, невропатолога.
Коарктация аорты (КоАо) — врожденное сужение аорты, чаще всего расположенное тотчас дистальнее левой подключичной артерии рядом с артериальным протоком (артериальной связкой). Распространенность коарктации 0,2-0,6 на 1000 родившихся живыми, частота составляет 5-8% среди всех ВПС [1, 2]. Эта аномалия часто сочетается с другими пороками сердца: открытым артериальным протоком, двустворчатым аортальным клапаном, дефектом межжелудочковой перегородки (ДМЖП), аномалией митрального клапана как компонентом синдрома Шона и др. [3].
В 1903 г. L. Bonnet [4] предложил делить пациентов с коарктацией аорты на два типа — ювенильный и взрослый. Ювенильный позже стал известен как «предуктальная коарктация», а взрослый — как «постдуктальная» [5]. Важными факторами, определяющими гемодинамическую тяжесть, являются проходимость протока, диаметр дуги, степень обструкции в месте коарктации. Для оценки результатов используется классификация коарктации аорты, предложенная International Nomenclature and Database Conferences for Pediatric Cardiac Surgery: изолированная; с ДМЖП; с другими сложными аномалиями сердца, а также сочетание этих трех видов с гипоплазией истмуса и/или гипоплазией дуги [6].
Эмбриология
Существуют две независимые эмбриологические теории, объясняющие возникновение коарктации аорты: теория потока и теория дуктальной петли. Теория потока основана на гипотезе, что поток крови через сердечные камеры и магистральные сосуды в эмбриональном периоде часто определяет их размер к рождению [7]. При увеличении кровотока через правые отделы вследствие интракардиального шунта (ДМЖП) соответственно уменьшается поток крови через левые отделы и, следовательно, через перешеек. Аналогично при обструкции левых отделов (например, митральном или аортальном стенозе) снижается кровоток в восходящей аорте и перешейке. Таким образом, данная теория основывается на сниженном потоке через перешеек во внутриутробном периоде. Внутрисердечные дефекты, которые могут стать причиной коарктации по теории потока, клинически обычно ассоциируются у пациентов с коарктацией. Эти пороки включают ДМЖП, двустворчатый клапан аорты, врожденный стеноз аорты или митрального клапана [3]. P. Venugopalan и соавт. [8] в своих исследованиях доказали, что при коарктации аорты размер митрального клапана значительно меньше, чем в контрольной группе. Незначительные гемодинамические нарушения в эмбриональной циркуляции приводят к уменьшению потока через дугу аорты [9]. Роль лимба овального окна — это отклонение соответствующей порции крови от нижней полой вены в восходящую аорту. Раннее сужение овального окна или неправильный угол лимба может привести к различной степени гипоплазии левых структур сердца. Этим можно объяснить развитие синдрома Шона [10]. Подтверждением данной теории является тот факт, что при пороках с уменьшением кровотока через правые отделы (тетрада Фалло, легочный стеноз, трикуспидальная атрезия) почти никогда не встречается коарктация аорты [7].
Однако теория потока не очень убедительна при отсутствии очевидных внутрисердечных дефектов. В такой ситуации более приемлема теория «дуктальной петли». Более 100 лет назад J. Skoda [11] постулировал, что аномальное продвижение дуктальной ткани в аорту является существенным фактором в патогенезе коарктации аорты. Позже, при микроскопии, увидели, что циркулярный гребень, создающий обструкцию при коарктации, состоит из аналогичных клеток, найденных в артериальном протоке [12]. Сжимание и фиброз этой «дуктальной петли» во время закрытия протока приводят к сужению аорты и возникновению коарктации. Этим можно объяснить возникновение коарктации аорты при отсутствии сопутствующих внутрисердечных аномалий.
Другие исследователи выдвигают альтернативные идеи, которые также могут объяснять возникновение коарктации. A. Kappetein и соавт. [13] полагают, что в патогенезе коарктации аорты играет роль аномалия развития нейрального гребня. Не исключаются генетические факторы с учетом частой встречаемости коарктации у женщин с синдромом Тернера [14].
Патофизиология
Пациенты с коарктацией аорты делятся на две группы. Первая группа — это новорожденные с ювенильной коарктацией, у которых кровоснабжение нижней половины туловища зависит от открытого артериального протока (ОАП). Если заболевание вовремя не диагностировано (т.е. до закрытия протока), то у них развивается кардиогенный шок. В младенчестве коллатерали не развиты, и ишемия органов ниже места коарктации после закрытия ОАП приводит к развитию почечной недостаточности и ацидозу. Одновременно увеличенная постнагрузка на левый желудочек становится причиной острой застойной сердечной недостаточности. Дооперационное ведение таких пациентов облегчилось после начала применения простагландина Е1 (ПГЕ1), который открывает и удерживает в открытом состоянии артериальный проток. Инфузию простагландина впервые (1975 г.) стали успешно применять при лечении младенцев с критическими синими пороками (атрезия легочной артерии, транспозиция магистральных артерий) и позже (1979 г.) стали использовать у новорожденных с прерванной дугой аорты и ювенильной коарктацией [17]. Применение простагландина в сочетании с ИВЛ, инотропной поддержкой, введением бикарбоната улучшает сердечный выброс, купирует метаболический ацидоз и почечную недостаточность. Хирургическую коррекцию необходимо выполнять после стабилизации состояния пациента.
Другая группа — пациенты со «взрослым» типом коарктации. На первый взгляд, это «бессимптомные» пациенты, у которых случайно при обследовании выявляют артериальную гипертензию. Как правило, это дети старшей возрастной группы.
Диагностика
Диагностика коарктации у новорожденных остается значимой проблемой. Пренатально заподозрить порок практически невозможно. Трудность представляет своевременное установление точного диагноза и после рождения. При ювенильной коарктации широкий артериальный проток обеспечивает адекватный кровоток в нисходящую аорту — у таких пациентов на бедренных артериях будут определяться отчетливая пульсация и равное давление на руках и ногах, а по ЭхоКС в абдоминальной аорте регистрироваться магистральный кровоток. При сочетании с ДМЖП не будет разницы данных пульсоксиметрии между руками и ногами. При закрытии артериального протока стремительно развивается клиническая картина заболевания: кардиогенный шок, полиорганная недостаточность.
Новорожденные с критической «взрослой» коарктацией находятся в шоковом состоянии. При обследовании ребенок бледный, отмечаются тахипноэ и тахикардия. Пульсация на бедренных артериях отсутствует. Печень увеличена, гипотензия даже на руках. На рентгенограмме сердце расширено, имеются признаки застойной сердечной недостаточности. На ЭКГ перегрузка левых отделов.
В большинстве наблюдений диагностика основывается на данных двухмерной ЭхоКС с цветовой допплерографией [15, 16]. По ЭхоКС при «взрослом» типе коарктации определяется отсутствие магистрального кровотока в нисходящей аорте, в области истмуса видно сужение. При ювенильном типе отмечается широкий ОАП с потоком в нисходящую аорту. В абдоминальной аорте магистральный кровоток. Истмус и дуга аорты часто гипоплазированы. Обязательно измеряют размеры всех сегментов дуги аорты, а также обращают внимание на сопутствующие внутрисердечные аномалии. Этот момент особенно важен, так как может кардинально менять тактику дальнейшего хирургического лечения. У большинства новорожденных ЭхоКС достаточно для постановки диагноза. В дополнение к стандартному обследованию целесообразно выполнить неинвазивное исследование в виде компьютерной томографии с контрастным усилением сосудов [18, 19] (рис. 1).
Рисунок 1. Компьютерная томограмма новорожденного с коарктацией 3D-реконструкции.
В последние годы инвазивное исследование применяется крайне редко, однако если имеются сложные сопутствующие внутрисердечные аномалии, то после стабилизации cостояния пациента выполняется зондирование. Во время исследования оценивают органические изменения сосудов, гемодинамические параметры и внутрисердечную анатомию [9].
Показания к оперативному вмешательству и выбор его времени
Ювенильная коарктация у новорожденного с ее дуктусзависимой системной циркуляцией является абсолютным показанием к экстренному вмешательству. Однако если ребенок находится в критическом состоянии вследствие закрывающегося протока, операцию можно отсрочить с целью стабилизации состояния пациента в кратчайшие сроки. Интенсивная дооперационная терапия таких детей заключается в проведении инфузии ПГЕ1, симптоматической коррекции показателей гомеостаза. Наличие у младенца «взрослого» типа коарктации сопровождается явлениями застойной сердечной недостаточности, что также требует безотлагательного хирургического лечения.
Методы коррекции
Первая успешная коррекция коарктации была выполнена C. Crafoord и G. Nylin в Швеции в 1944 г. [20]. Резекция коарктации у младенца была ocyщecтвлeнa W. Mustard и соавт. в 1953 г. [21]. Их методика заключалась в создании прямого циркулярного анастомоза (рис. 2).
Рисунок 2. Простой циркулярный анастомоз конец в конец (схема). Начало в хирургическом лечении было положено, однако отдаленные результаты были неутешительными вследствие высокой частоты рецидива. Дальнейший путь развития хирургии в этой области сводился к разработке и усовершенствованию новых технологий анастомозирования, а именно к исключению циркулярного анастомоза и полному устранению патологической дуктальной ткани. В 1961 г. T. von Rueden и соавт. [22] предложили процедуру истмопластики по типу аортопластики синтетической заплатой с целью избежать формирования циркулярного анастомоза. J. Waldhusen и D. Nahrwold в 1966 г. [23] предложили оригинальную аортопластику лоскутом левой подключичной артерии (рис. 3).
Рисунок 3. Истмопластика лоскутом подключичной артерии (схема). Эта процедура устранила циркулярный анастомоз, но была не в состоянии устранить патологическую дуктальную ткань [24].
В 1977 г. J. Amato и соавт. [25] предложили резекцию коарктации с формированием расширенного анастомоза (рис. 4),
Рисунок 4. Резекция коарктации с формированием расширенного анастомоза конец в конец. в 1987 г. M. Elliott [26] усовершенствовал этот анастомоз для пациентов с гипоплазией дуги, назвав его радикально расширенным. Другие инновационные методы, которые были описаны M. Meier и соавт. [27] и J. De Mendonca и соавт. [28], включают пластику подключичным лоскутом с сохранением левой подключичной артерии, а также с использованием реверсивного подключичного лоскута [29].
Сочетание коарктации с другими аномалиями
До сих пор ведутся споры об этапности коррекции коарктации в сочетании с внутрисердечными аномалиями. Фактически последние исследования, сравнивающие оба подхода, демонстрируют преимущество одностадийного хирургического лечения (при условии, что коррекция бивентрикулярная) [30]. Недавно M. Kobayashi и соавт. [31] представили 10-летний опыт лечения 90 новорожденных с обструкцией дуги аорты и сопутствующими аномалиями. Общая летальность составила 4,4-7,8% в разных группах, выживаемость в течение 10 лет — 87%. На сегодняшний день показаниями к лечению в несколько этапов являются масса младенца менее 1500 г, тяжелая инфекция, внутричерепное кровоизлияние, полиорганная недостаточность и очень неблагоприятное анатомическое строение [32].
Коарктация в сочетании с гипоплазией дуги
У новорожденных с коарктацией аорты от 65 до 81% встречается гипоплазия дуги аорты [30, 33]. Чаще гипоплазия присутствует при сочетании коарктации с шунтовыми пороками или недоразвитием левосердечных структур, что подтверждает теорию потока в развитии коарктации [7].
Дуга условно делится на 3 сегмента: проксимальная (от брахицефального ствола до левой общей сонной артерии), дистальная часть (от левой общей сонной артерии до левой подключичной артерии) и истмус. Существует правило, по которому диаметр проксимальной части должен быть более 60% диаметра восходящей аорты, дистальная часть — более 50% и истмус — более 40%. Однако эти показатели считаются недостаточно точными, особенно если имеется гипоплазия и восходящей аорты. Описана формула, согласно которой дуга считается гипоплазированной, если поперечный ее диаметр в миллиметрах менее массы больного, выраженной в килограммах плюс 1 [34]. Оптимальным диагностическим критерием гипоплазии на сегодняшний день является определение отклонения от среднего значения (Z) [35]. Дуга является гипоплазированной при отклонении от стандартного значения -2Z и более. Нередкой формой гипоплазии является так называемый «бычий ствол», когда брахицефальный ствол и левая общая сонная артерия отходят единым стволом, являясь как бы продолжением восходящей аорты. Дистальный сегмент дуги представляет собой узкую и длинную боковую ветвь, переходящую в истмус. От дистальной дуги берет начало левая подключичная артерия.
Существуют различные мнения по поводу роста гипоплазированной дуги после коррекции. Некоторые авторы полагают, что дуга будет развиваться после простой резекции коарктации с формированием циркулярного анастомоза конец в конец [35], частота рекоарктации в их исследовании составляет 12,5%. Однако имеются данные о 81% рекоарктации у пациентов с гипоплазией дуги после создания циркулярного анастомоза [36]. Такие данные вызывают сомнения относительно развития дуги в послеоперационном периоде, поэтому предложены методики, устраняющие гипоплазию дуги при отсутствии надежды на ее последующее развитие: радикально расширенный анастомоз конец в конец [26], пластика реверсивным лоскутом подключичной артерии [29]. Некоторые авторы также склонны полагать, что лучшие отдаленные результаты достигаются при реконструкции дуги в условиях искусственного кровообращения при остановке кровообращения [37].
Коарктации аорты и гипоплазия левосердечных структур
Коарктация аорты часто сочетается с недоразвитием различных структур левого сердца, включая митральный и аортальный клапаны [38]. Когда эти структуры гипоплазированы и находятся на грани поддержания системного кровотока, трудно определить оптимальную стратегию дальнейшего лечения. Если левый желудочек слишком мал для поддержания системного кровообращения, следует идти по пути унивентрикулярной коррекции или трансплантации, исключая возможность двужелудочковой коррекции. Несколько исследований показали, что бивентрикулярная коррекция возможна при отклонениях митрального и аортального клапанов более -2Z. Однако эти исследования сосредоточились на раннем выживании [39, 40]. Исследование
M. Puchalski и соавт. [41] показало, что после коррекции KoAo у новорожденных в сочетании с гипоплазией левосердечных структур в динамике отмечаются развитие структур левого сердца, а также блестящий клинический результат. Несмотря на изначальную аннулярную гипоплазию, потребность в интервенционном вмешательстве по поводу митрального или аортального/субаортального стеноза редка.
Коарктация аорты у новорожденных массой менее 2 кг
Недоношенность и малая масса младенцев с коарктацией не являются противопоказаниями к оперативному лечению. Существует мнение, что у таких пациентов высок риск летального исхода и развития рекоарктации [47]. Ранее сообщалось о высокой частоте госпитальной летальности (до 20%) при малой массе детей с КоАо [30]. Однако прогресс в интенсивной терапии, совершенствование хирургической техники определяют неплохие результаты в последнее время. E. Bacha и соавт. [48] представили результаты лечения 18 пациентов массой менее 2 кг с критической коарктацией. Госпитальная летальность составила 5,5%. Анализ результатов лечения коарктации у таких пациентов показал отсутствие корреляции между развитием рекоарктации и массой пациента на момент операции. По мнению многих авторитетных специалистов, в развитии рекоарктации существенную роль играет остаточная дуктальная ткань [49].
Рекоарктация
Несмотря на множество разработанных методик, проблема резидуальной коарктации и рекоарктации актуальна. Среди распространенных методов коррекции можно отметить: резекцию с формированием циркулярного анастомоза, аортопластику заплатой, аортопластику подключичным лоскутом и резекцию с созданием расширенного анастомоза. Наиболее широко используемый из этих методов — техника аортопластики подключичным лоскутом [23]. От резекции с формированием циркулярного анастомоза у новорожденных многие центры уже давно отказались из-за высокого показателя рекоарктации, доходящего, по некоторым сообщениям, до 85% [42]. Аортопластика заплатой также имеет высокий риск рекоарктации у новорожденных. Общество хирургов врожденных пороков сердца сообщало о 21% частоте рекоарктации среди 38 пациентов в возрасте до 1 мес, оперированных по методике аортопластики заплатой [43]. Существует несколько недостатков аортопластики подключичным лоскутом, особенно по сравнению с техникой расширенного анастомоза. Это ухудшенное кровоснабжение левой конечности, оставление дуктальной ткани, которая позже посредством шпоры приведет к рекоарктации, а также невозможность выкроить лоскут достаточной длины для обхождения гребня дуктальной ткани и сохранения часто встречающейся тубулярной гипоплазии дуги. Были сообщения о гангрене верхней конечности после пересечения подключичной артерии [44]. Поскольку коарктационный гребень не резецируется, быстрый рост оставшейся дуктальной ткани, состояние которой нельзя адекватно оценить во время операции, может стать причиной рецидива после пластики подключичным лоскутом [45]. Частота рекоарктации после пластики подключичным лоскутом колеблется от 12 до 42% [43, 46, 47]. Несколько центров представили свои результаты использования методики расширенного анастомоза, показывающие более низкую частоту рекоарктации — от 0 до 23%.
Интервенционная терапия
Роль баллонной дилатации ограничена узким спектром заболеваний этой области: рекоарктация, коарктация в виде мембраны у младенцев, находящихся в критическом состоянии, коарктационный синдром, который у новорожденных не встречается.
Неинвазивный манометрический градиент между руками и ногами более 20 мм рт.ст. считается рекоарктацией и является показанием к повторному вмешательству. Анализ статей, представляющих результаты коррекции коарктации у новорожденных, при возникновении рекоарктации свидетельствует об успешном применении баллонной дилатации без летальных исходов и осложнений [46, 50].
Таким образом, несмотря на значимый накопленный мировой опыт по данной проблеме, остается ряд дискутабельных вопросов: оптимальный метод коррекции, особенно в сочетании с гипоплазией дуги аорты; проблема рекоарктации и пути ее устранения — баллонная дилатация или повторное хирургическое вмешательство. До сих пор нет единого мнения о преимуществе одно- или двухэтапной коррекции при сочетании коарктации с другими внутрисердечными аномалиями. Детские кардиохирурги, как правило, не меняют стереотипов при условии неплохих собственных результатов лечения. Ответ на эти вопросы возможен после мультицентрового анализа накопленных отдаленных результатов при использовании различных подходов к решению этих проблем.
Последствия и осложнения
Патология довольно опасна и относится к самым частым причинами детской смертности. Насколько благоприятным окажется прогноз – зависит от тяжести состояния малыша, показателя Apgar. Если оценка возрастает, прогноз считается благоприятнымИсточник: Современные методы лечения асфиксии новорожденных. Чередникова Е.Н., Шерстнев Д.Г. Бюллетень медицинских интернет-конференций, 2021. с.824.
Однако при тяжелом течении патологии на протяжении первого года жизни развиваются серьезные осложнения. К ранним последствиям, которые могут появиться в первые несколько суток после реанимации, относят:
- остановку дыхания (самое частое и опасное осложнение);
- сбой пульса;
- судороги;
- отек мозга;
- нарушение работы мочевыделительной, пищеварительной систем.
К более поздним нарушениям относят такие диагнозы:
- синдром повышенной возбудимости (гипервозбудимость);
- повышенное внутримозговое давление (гипертензионный синдром);
- поражения центральной нервной системы (перинатальная энцефалопатия);
- сбои в работе эндокринных и вегетососудистых систем (гипоталамические нарушения).
При своевременном и грамотном врачебном вмешательстве, а также при условии качественного восстановительного периода асфиксия новорожденных в будущем может не иметь опасных последствий. Легкие формы асфиксии почти не влияют на ребенка, после болезни его дальнейшее развитие будет проходить так же, как у других малышей.
Профилактика асфиксии новорожденных
Профилактикой патологического состояния должна заниматься будущая мать в период беременности. Для этого следует:
- посещать плановые гинекологические консультации;
- придерживаться рекомендаций акушера-гинеколога;
- обязательно принимать комплексы витаминов, если их назначает врач;
- наблюдать за состоянием плода и плаценты в ходе плановых УЗИ;
- любые заболевания лечить только под контролем врача, не заниматься самолечением;
- соблюдать режим дня, не нагружать организм;
- избавиться от вредных привычек;
- гулять на свежем воздухе.
В акушерстве уделяется значительное внимание разработке результативных профилактических способов, которые позволяют снизить риск асфиксии при родах и в течение первых дней жизни младенца.
Источники:
- Современные методы лечения асфиксии новорожденных. Чередникова Е.Н., Шерстнев Д.Г. Бюллетень медицинских интернет-конференций, 2016. с.824
- Протокол проведения лечебной гипотермии детям, родившимся в асфиксии. Ионов О.В., Балашова Е.Н., Киртбая А.Р., Антонов А.Г., Мирошник Е.В., Дегтярев Д.Н. Неонатология: Новости. Мнения. Обучение, 2014. с. 81-83
- Проведение лечебной гипотермии у новорожденных, родившихся в асфиксии. К. Б. Жубанышева, З. Д. Бейсембаева, Р. А. Майкупова, Т. Ш. Мустафазаде. Наука о жизни и здоровье, 2021. с. 60-67
- Асфиксия новорожденных. Жетписова Л.Б. WestKazakhstanMedicalJournal, 2011
- Гипоксия плода и асфиксия новорожденного. Кузнецов П.А., Козлов П.В. Лечебное дело, 2021. с. 9-15
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Цены
| Наименование услуги (прайс неполный) | Цена |
| Онлайн-мнение педиатра (АКЦИЯ) | 0 руб. |
| Прием (осмотр, консультация) врача-педиатра первичный, лечебно-диагностический, амбулаторный | 1750 руб. |
| Консультация (интерпретация) с анализами из сторонних организаций | 2250 руб. |
| Назначение схемы лечения (на срок до 1 месяца) | 1800 руб. |
| Консультация кандидата медицинских наук | 2500 руб. |