Хронический миелолейкоз — это злокачественное заболевание крови, при котором происходит избыточное образование и нарушение созревания гранулоцитов в костном мозге. Уникальной особенностью данного вида лейкоза является наличие в опухолевых клеток специфического маркера — филадельфийской хромосомы. Она образуется в результате транслокации t(9;22), при которой один фрагмент 22 хромосомы меняется местами с фрагментом девятой хромосомы. В итоге образуется химерный ген, который нарушает процесс деления и созревания клеток миелоидного ряда.
- Причины развития хронического миелолейкоза
- Патогенез хронического миелолейкоза
- Стадии хронического миелолейкоза
- Симптомы и признаки хронического миелолейкоза
- Диагностика хронического миелолейкоза
- Лечение хронического миелолейкоза
- Прогноз и профилактика хронического миелолейкоза
Патогенез хронического миелолейкоза
Филадельфийская хромосома является результатом взаимной транслокации между 9 и 22 хромосомами. При этом онкоген ABL из 9 хромосомы переносится на 22 хромосому и присоединяется к гену BCR. В результате образуется гибридный BCR-ABL ген, который регулирует синтез особого онкогенного белка — тирозинкиназы bcr-abl. Этот онкопротеин нарушает процесс клеточного деления, защищает опухолевые клетки от запрограммированной гибели (апоптоза) и нарушает их сцепление со стромой костного мозга, благодаря чему недозревшие клетки выходят в кровяное русло.
Чаще всего хронический миелолейкоз развивается в результате мутации в плюрипотентной гемопоэтической стволовой клетке, которая располагается в костном мозге, но есть случаи, когда первичный очаг находится в печени или селезенке.
При хроническом миелолейкозе в основном преобладает патология гранулоцитарного ростка, но могут страдать все линии гемопоэза — эритроцитарный росток, моноциты и др. Здоровые стволовые клетки сохраняются и могут давать начало новому кроветворению после проведения химиотерапии.
Общие характеристики
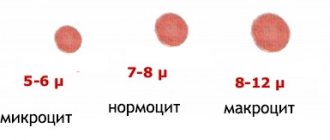
Миелоциты – это зрелые клетки, величина которых варьируется от 12 до 30 мкм.
Они обладают ядром, которое может быть:
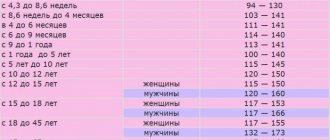
- Клинический анализ крови: от светового микроскопа к гематологическим анализаторам
- овальным;
- почковидным;
- круглым.
В качестве ядра выступают нейтрофилы, и располагается оно в подавляющем большинстве случаев эксцентрически. Помимо этого, оно обладает способностью приобретать красно-фиолетовый оттенок, что обуславливается его созреванием.
В случае развития в организме какого-либо заболевания, на борьбу с ним выходят зрелые лейкоциты. Однако, чем сложнее патология или чем дольше она протекает, тем больше молодых клеток вынуждена использовать иммунная система. При полном истощении запаса лейкоцитов в борьбу с недугом вступают миелоциты.
Именно этим обуславливается их появление в крови, чего при нормальном положении вещей происходить не должно, поскольку они формируются и в последующем локализуются только в костном мозге.
Всего существует 3 вида таких компонентов, отчего клиницисты выделяют:
- эозинофильный миелоцит – обладает слабобазофильной протоплазмой, состоящей из большого количества розовато-красных крупных зерен;
- базофильный – характеризуется присутствием оксифильной протоплазмы, окрашенной в фиолетовый цвет;
- нейтрофильный миелоцит – считается более зрелой клеткой, нежели предыдущая разновидность – включает в себя протоплазму розового оттенка.
Появление в крови таких веществ всегда свидетельствует о протекании заболевания в организме. Это означает, что норма – это полное отсутствие миелоцитов в крови.
Тем не менее в костном мозге человека может насчитываться миелоцитов:
- нейтрофильных – от 5 до 10%;
- базофильных – от 0.2 до 1%;
- эозинофильных – от 0.5 до 2%.
Клиницисты не считают такую концентрацию патологией.
Миелоциты
Стадии хронического миелолейкоза
В течении хронического миелолейкоза выделяют 4 стадии, которые отражают прогрессирование патологии. При этом заболевание может быть выявлено на любой из них.
Хроническая или доклиническая стадия — не имеет клинических симптомов, диагноз можно заподозрить по общему анализу крови, который пациенты могут сдавать либо в рамках диспансеризации, либо по поводу диагностики другого заболевания. В большинстве случаев хронический миелолейкоз выявляется именно на этой стадии.
Фаза акселерации, или стадия прогрессирования. В этот период нарастает количество опухолевых гранулоцитарных клеток, появляются различные симптомы, например, слабость или боли в костях. Объективно отмечается увеличение количества бластов в крови или костном мозге до 15-29%, увеличивается количество базофилов (более 20%), обнаруживается тромбоцитопения или тромбоцитоз (более 1000×10 9 ).
Бластный криз — это фаза, во время которой происходит резкое увеличение количества бластных клеток (больше 30%) и болезнь по своему течению напоминает агрессивный острый лейкоз.
Пациент при этом находится в тяжелом состоянии. Отмечается повышение температуры, упорные инфекции, кровотечения, лейкозные поражения кожи. На этой стадии лейкоз с трудом поддается терапии.
Фазу хронического миелолейкоза обязательно оценивают при постановке диагноза и далее перепроверяют при прогрессировании патологии и необходимости смены лечения.
Публикации в СМИ
Острый лейкоз — злокачественное заболевание кроветворной системы; морфологический субстрат — бластные клетки. Частота. 13,2 случаев на 100 000 населения среди мужчин и 7,7 случаев на 100 000 населения среди женщин.
КЛАССИФИКАЦИЯ FAB классификация (франко американо британская) основана на морфологии лейкемических клеток (строение ядра, соотношение размеров ядра и цитоплазмы) • Острый миелобластный (нелимфобластный) лейкоз (ОМЛ) •• М0 — без созревания клеток, миелогенная дифференцировка доказывается только иммунологически •• М1 — без созревания клеток •• М2 — ОМЛ с дифференцировкой клеток, •• М3 — промиелоцитарный •• М4 — миеломоноцитарный •• М5 — монобластный лейкоз •• М6 — эритролейкоз •• М7 — мегакариобластный лейкоз • Острый лимфобластный лейкоз (ОЛЛ): •• L1 — без дифференцировки клеток (морфологически гомогенные клетки) •• L2 — с дифференцировкой клеток (морфологически гетерогенная популяция клеток) •• L3 — беркеттоподобные лейкозы • Недифференцируемый лейкоз — к этой категории относят лейкозы, клетки которых невозможно идентифицировать как миелобластные или лимфобластные (ни химическими, ни иммунологическими методами) • Миелопоэтическая дисплазия •• Рефрактерная анемия без бластоза (в костном мозге бласты и промиелоциты <10%) •• Рефрактерная анемия с бластозом (в костном мозге бласты и промиелоциты 10 30%) •• Рефрактерная анемия с избытком бластов в трансформации •• Хронический миеломоноцитарный лейкоз.
REAL классификация (Revised Europian American classification of Lymphoid neoplasms), пересмотренная (Европейско Американская) классификация лимфоидных гемобластозов • Пре B клеточные опухоли •• Пре B лимфобластный лейкоз/лимфома • Пре T клеточные опухоли •• Пре T лимфобластный лейкоз/лимфома • Опухоли периферических B клеток •• хронический лимфолейкоз/лимфома из малых лимфоцитов •• Лимфоплазмоцитарная лимфома •• Лимфома из плащевых клеток •• Фолликулярная лимфома •• Лимфома из клеток краевой зоны •• Волосато клеточный лейкоз •• Плазмоцитома/миелома плазмоцитарная •• Диффузная лимфома из больших лимфоцитов•• Лимфома Беркетта • Опухоли периферических T клеток и NK клеток •• T клеточный хронический лимфолейкоз •• Лейкоз из крупных зернистых лимфоцитов •• Грибовидный микоз и синдром Сезари T клеточная лимфома •• Ангиоиммунобластическая T клеточная лимфома •• Ангиоцентрическая лимфома (лимфома из NK и T клеток) •• Кишечная T клеточная лимфома •• Лейкоз/лимфома T клеточная взрослых •• Анапластическая крупноклеточная лимфома
Варианты ОМЛ (классификация ВОЗ, 1999) • ОМЛ с t(8;21)(q22;q22) • ОМЛ с t(15;17) (q22;q11 12) • Острый миеломонобластный лейкоз • ОМЛ с патологической костномозговой эозинофилией (inv(16)(p13q22) или t(16;16) (p13;q11) • ОМЛ с 11q23 (MLL) дефектами • Острый эритроидный лейкоз • Острый мегакариоцитарный лейкоз • Острый базофильный лейкоз • Острый панмиелоз с миелофиброзом • Острые бифенотипические лейкозы • ОМЛ с мультилинейной дисплазией • Вторичный ОМЛ.
Иммуногистохимическое исследование (определение клеточного фенотипа) необходимо для уточнения иммунологического варианта лейкоза, влияющего на схему лечения и клинический прогноз
• Острый лимфобластный лейкоз (247640, , мутация соматических клеток) — 85% всех случаев, составляет до 90% всех лейкозов детского возраста У взрослых развивается достаточно редко. Цитохимические реакции: положительная на терминальную дезоксинуклеотидил трансферазу; отрицательные на миелопероксидозу, гликоген. Использование маркёров клеточной мембраны позволило выделить подвиды •• В-клеточные — 75% всех случаев •• С отсутствием розеткообразования •• Т-клеточые •• Другие варианты (редко). Дифференциальная диагностика подвидов важна для прогноза, т.к. Т-клеточные варианты плохо поддаются лечению.
• Острый миелобластный лейкоз чаще возникают у взрослых, подтип зависит от уровня дифференцировки клеток. В большинстве случаев клон миелобластов исходит из стволовых кроветворных клеток, способных к множественной дифференцировке в колониеобразующие единицы гранулоцитов, эритроцитов, макрофагов или мегакариоцитов, поэтому у большинства больных злокачественные клоны не имеют признаков лимфоидных или эритроидных ростков •• ОМЛ наблюдают наиболее часто; имеет четыре варианта (М0 — М3) •• М0 и М1 — острый лейкоз без дифференцировки клеток •• М2 — острый с дифференцировкой клеток •• М3 — промиелоцитарный лейкоз, характеризуется наличием аномальных промиелоцитов с гигантскими гранулами; часто сочетается с ДВС, обусловленным тромбопластическим эффектом гранул, что подвергает сомнению целесообразность применения гепарина при терапии. Прогноз при М3 менее благоприятен, чем при М0–М1 •• Миеломонобластный и монобластный лейкозы (соответственно М4 и М5) характеризуются преобладанием неэритроидных клеток типа монобластов. М4 и М5 составляют 5–10% всех случаев ОМЛ. Частый признак — образование внекостномозговых очагов кроветворения в печени, селезёнке, дёснах и коже, гиперлейкоцитоз, превышающий 50–100109/л. Чувствительность к терапии и выживаемость ниже, чем при других вариантах острых миелобластных лейкозов •• Эритролейкоз (М6). Вариант острого миелобластного лейкоза, сопровождающийся усиленной пролиферацией эритроидных предшественников; характерно наличие аномальных бластных ядросодержащих эритроцитов. Эффективность лечения эритролейкоза сходна с результатами терапии других подтипов или несколько ниже •• Мегакариобластный лейкоз (М7) — редкий вариант, сочетающийся с фиброзом костного мозга (острый миелосклероз). Плохо поддаётся терапии. Прогноз неблагоприятный. Патогенез обусловлен пролиферацией опухолевых клеток в костном мозге и их метастазированием в различные органы. Угнетение нормального кроветворения связано с двумя основными факторами: • повреждение и вытеснение нормального ростка кроветворения низкодифференцированными лейкемическими клетками • выработка бластными клетками ингибиторов, подавляющих рост нормальных кроветворных клеток.
Стадии острого лейкоза • Первично-активная фаза • Ремиссия (при лечении) — полная клинико-гематологическая •• Содержание бластов в костном мозге менее 5% при нормальной клеточности •• В клинической картине отсутствует пролиферативный синдром • Рецидив (ранний и поздний) •• Изолированный костномозговой — содержание бластов в костном мозге более 25% •• Внекостномозговой ••• Нейролейкоз (неврологическая симптоматика, цитоз более 10 клеток, бласты в ликворе) ••• Тестикулярный (увеличение размеров одного или двух яичек, наличие бластов подтверждено цитологическим и гистологическим исследованиями) •• Смешанный • Терминальная фаза (при отсутствии лечения и резистентность к проводимой терапии)
Клиническая картина острых лейкозов определяется степенью инфильтрации костного мозга бластными клетками и угнетения ростков кроветворения • Угнетение костномозгового кроветворения •• Анемический синдром (миелофтизная анемия) •• Геморрагический синдром (вследствие тромбоцитопении отмечают кожные геморрагии — петехии, экхимозы; кровотечения из слизистых оболочек — носовые кровотечения, внутренние кровотечения) •• Инфекции (нарушение функции лейкоцитов) • Лимфопролиферативный синдром •• Гепатоспленомегалия •• Увеличение лимфатических узлов • Гиперпластический синдром •• Боли в костях •• Поражения кожи (лейкемиды), мозговых оболочек (нейролейкоз) и внутренних органов • Интоксикационный синдром •• Снижение массы тела •• Лихорадка •• Гипергидроз •• Выраженная слабость.
Диагноз острого лейкоза подтверждают наличием бластов в костном мозге. Для идентификации подтипа лейкоза применяют гистохимические, иммунологические и цитогенетические методы исследования.
Лабораторные исследования • В периферической крови уровень лейкоцитов может варьировать от выраженной лейкопении (ниже 2,0109/л) до гиперлейкоцитоза; анемия, тромбоцитопения; наличие бластных клеток вплоть до тотального бластоза • Гиперурикемия вследствие ускоренного жизненного цикла клеток • Гипофибриногенемия и повышение содержания продуктов разрушения фибрина вследствие сопутствующего ДВС. Влияние ЛС. ГК не следует назначать до постановки окончательного диагноза. Высокая чувствительность к преднизолону бластных клеток приводит к их разрушению и трансформации, затрудняющим диагностику. Лечение комплексное; цель — достижение полной ремиссии. В настоящее время в гематологических центрах используют различные протоколы химиотерапии, основанные на принципах полихимиотерапии и интенсификации лечения.
• Химиотерапия состоит из нескольких этапов •• Индукция ремиссии ••• При ОЛЛ — одна из схем: комбинации винкристина в/в еженедельно, преднизолона внутрь ежедневно, даунорубицина и аспарагиназы в течение 1–2 мес непрерывно ••• При ОМЛ — сочетание цитарабина в/в капельно или п/к, даунорубицина в/в, иногда в сочетании с тиогуанином. Более интенсивная постиндукционная химиотерапия, уничтожающая оставшиеся лейкозные клетки, увеличивает длительность ремиссии •• Консолидация ремиссии: продолжение системной химиотерапии и профилактика нейролейкоза при ОЛЛ (эндолюмбальное введение метотрексата при ОЛЛ в сочетании с лучевой терапией на головной мозг с захватом спинного мозга [C1–C2]) •• Поддерживающая терапия: периодические курсы реиндукции ремиссии.
• При ОМЛ М3 проводят лечение препаратами ретиноевой кислоты (третиноин). • Трансплантация костного мозга — метод выбора при острых миелобластных лейкозах и при рецидивах всех острых лейкозов. Главное условие для проведения трансплантации — полная клинико-гематологическая ремиссия (содержание бластов в костном мозге менее 5%, отсутствие абсолютного лимфоцитоза). Перед операцией можно провести химиотерапию в сверхвысоких дозах, изолированно или в сочетании с лучевой терапией (с целью полного уничтожения лейкозных клеток) •• Оптимальный донор — однояйцовый близнец или сибс; чаще используют доноров с 35%-совпадением по Аг HLA. При отсутствии совместимых доноров используют аутотрансплантацию костного мозга, взятого в период ремиссии •• Главное осложнение — реакция трансплантат против хозяина. Развивается вследствие пересадки Т-лимфоцитов донора, распознающих Аг реципиента как чужеродные и вызывающих иммунную реакцию против них. Острая реакция развивается в течение 20–100 дней после трансплантации, отсроченная — через 6–12 мес ••• Основные органы-мишени — кожа (дерматит), ЖКТ (диарея) и печень (токсический гепатит) ••• Лечение длительное, обычно ограничено назначением комбинаций преднизолона, циклоспорина и малых доз азатиоприна •• На течение посттрансплантационного периода влияют также подготовительные схемы лечения, развитие интерстициальной пневмонии, отторжение трансплантата (редко).
• Заместительная терапия •• Трансфузия эритроцитарной массы для поддержание уровня Hb не ниже 100 г/л. Условия трансфузий: неродственный донор, использование лейкоцитарных фильтров •• Трансфузия свежей тромбоцитарной массы (снижает риск кровотечений). Показания: содержание тромбоцитов менее 20109/л; геморрагический синдром при содержании тромбоцитов менее 50109/л.
• Профилактика инфекций — главное условие выживания пациентов с нейтропенией, возникшей вследствие химиотерапии •• Полная изоляция пациента •• Строгий санитарно-дезинфекционный режим — частые влажные уборки (до 4–5 р/сут), проветривание и кварцевание палат; использование одноразового инструментария, стерильной одежды медицинского персонала •• Профилактическое применение антибиотиков, противогрибковых и противовирусных препаратов (при содержании сегментоядерных нейтрофилов менее 0,5109/л показана профилактика пневмоцистной пневмонии) ••• При повышении температуры тела проводят клиническое и бактериологическое исследования и немедленно начинают лечение комбинациями бактерицидных антибиотиков широкого спектра действия: цефалоспоринов, аминогликозидов и полусинтетических пенициллинов ••• При вторичных подъёмах температуры тела, возникших после лечения антибиотиками широкого спектра действия, эмпирически применяют противогрибковые средства (амфотерицин В) •• Для профилактики и лечения нейтропении можно назначить колониестимулирующие факторы (например, молграмостим).
Прогноз • Прогноз у детей с острым лимфолейкозом хороший: у 95% и более наступает полная ремиссия. У 70–80% больных проявлений болезни нет в течение 5 лет, их считают излечившимися. При возникновении рецидива в большинстве случаев можно достичь второй полной ремиссии. Больные со второй ремиссией — кандидаты на трансплантацию костного мозга с вероятностью долговременного выживания 35–65% • Прогноз у больных острым миелобластным лейкозом неблагоприятный. 75% больных, получающих адекватное лечение с использованием современных химиотерапевтических схем, достигают полной ремиссии, 25% больных погибают (длительность ремиссии — 12–18 мес). Есть сообщения об излечении в 20% случаев при продолжении интенсивной терапии после ремиссии. Прогноз при М3-варианте ОМЛ улучшается при лечении препаратами ретиноевой кислоты. Больным моложе 30 лет после достижения первой полной ремиссии можно проводить трансплантацию костного мозга. У 50% молодых больных, подвергшихся аллогенной трансплантации, развивается длительная ремиссия. Обнадёживающие результаты получены и при пересадках аутологичного костного мозга.
Возрастные особенности • Дети •• 80% всех острых лейкозов — ОЛЛ •• Неблагоприятные прогностические факторы при ОЛЛ ••• Возраст ребёнка младше 1 года и старше 10 лет ••• Мужской пол ••• Т-клеточный вариант ОЛЛ ••• Содержание лейкоцитов в момент диагностики более 20109/л ••• Отсутствие клинико-гематологической ремиссии на фоне проводимой индукции •• Прогноз и течение. 80% выхода в клинико-гематологическую ремиссию. 5-летняя выживаемость — 40–50%.
• Пожилые. Снижена толерантность к аллогенному костному мозгу. Максимальный возраст для трансплантации — 50 лет. Аутологичную трансплантацию можно проводить пациентам старше 50 лет при отсутствии органных поражений и общем соматическом благополучии.
Сокращения • МДС — миелодиспластический синдром • ОЛЛ — острый лимфобластный лейкоз • ОМЛ — острый миелобластный лейкоз.
МКБ-10 • C91.0 Острый лимфобластный лейкоз • C92 Миелоидный лейкоз [миелолейкоз] •• C93.0 Острый моноцитарный лейкоз
Симптомы и признаки хронического миелолейкоза
Симптоматика хронического миелолейкоза характеризуется многообразием клинических проявлений и зависит от агрессивности течения и стадии заболевания. В целом может иметься несколько синдромов:
- Синдром опухолевой интоксикации. Проявляется неадекватной текущему состоянию слабостью, потерей веса, снижением аппетита. Может быть повышение температуры, повышенная потливость, зуд кожи, боли в костях.
- Синдром опухолевой пролиферации. Развивается при активном увеличении количества злокачественных клеток, инфильтрирующих печень и селезенку. При этом пациенты отмечают боль и тяжесть в левом боку.
- Анемический синдром — развивается при снижении количества эритроцитов и уровня гемоглобина. Проявляется слабостью, одышкой, повышенной утомляемостью при рутинных физических нагрузках. Может наблюдаться снижение давления, бледность кожи и слизистых, головокружение, тахикардия.
- Нарушения со стороны кровесвертывающей системы — тромбозы и геморрагии (кровотечения). Причиной тромбозов чаще всего оказывается тромбоцитоз (повышение уровня тромбоцитов выше 1000×10 9 /л). При этом могут возникать тромбофлебиты, инфаркты, инсульты. Геморрагические проявления характеризуются увеличением времени кровотечения после травмы, а также образованием петехиальной геморрагической сыпи. Развиваются они на фоне критического снижения уровня тромбоцитов.
Диагностика хронического миелолейкоза
В большинстве случаев хронический миелолейкоз является случайной находкой, которая обнаруживается при обследовании по другому поводу. Заподозрить его можно по общему анализу крови, в частности по увеличению количества лейкоцитов и преобладанию в формуле гранулоцитарного ростка кроветворения. При этом может увеличиваться не только количество нейтрофилов, но и базофилов с эозинофилами. Может быть умеренная анемия или отклонения в количестве тромбоцитов.
Если врач подозревает хронический миелолейкоз, пациента направляют на дальнейшее обследование — пункцию и биопсию костного мозга. Для подтверждения диагноза необходимо проводить стандартное цитогенетическое исследование костного мозга на предмет наличия филадельфийской хромосомы. Исследуется не менее 20 метафаз. При невозможности проведения цитогенетики, прибегают к флюоресцентной in situ гибридизации, с помощью которой выявляют химерный ген. Также определяется экспрессия химерного гена в клетках периферической крови посредством ПЦР. Если типичный транскрипт не обнаруживается, а при этом есть клинико-гематологические признаки хронического миелолейкоза, показано определение более редких мутаций — BCR-ABLp190, р230.
В фазе бластного криза проводят иммунофенотипирование бластных клеток, цитологическое и биохимическое исследование спинномозговой жидкости. При обнаружении хронического миелолейкоза в фазе активации или бластного криза, поиск филадельфийской хромосомы может осуществляться посредством секвенирования генетического материала клеток крови.
Лечение хронического миелолейкоза
На начальном этапе, до получения цитогенетического подтверждения диагноза (как мы уже знаем, хронический миелолейкоз выставляется при наличии филадельфийской хромосомы), назначается симптоматическая терапия гидроксимочевиной. Ее целью является снижение общего уровня лейкоцитов и тромбоцитов. При непереносимости препарата или недостаточном снижении уровня тромбоцитов может применяться анагрелид. Если имеются признаки лейкостаза (энцефалопатия, зрительные нарушения, нарушения работы почек), проводится лейкаферез.
После цитогенетического подтверждения диагноза, назначается специфическая противоопухолевая терапия. Главными препаратами являются ингибиторы тирозинкиназ (ИТК). Дозировка подбирается в зависимости от уровня лейкоцитов. На начальном этапе для профилактики синдрома лизиса опухоли необходима усиленная гидратация (дополнительное введение жидкости в объеме 2-2,5 л/м 2 , если нет противопоказаний со стороны сердечно-сосудистой системы) и назначение аллопуринола.
Целью специфического лечения хронического миелолейкоза является подавление опухолевого клона клеток, снижение риска прогрессирования патологии и продление жизни пациента до значений, сопоставимых с общепопуляционными показателями. С внедрением в практику ИТК эти задачи стали вполне выполнимы и не только позволили повысить общую выживаемость таких больных в несколько раз, но и оказаться от пожизненного приема препаратов и перехода под динамическое наблюдение у пациентов с хорошим молекулярным ответом опухоли.
В настоящее время согласно принятым протоколам лечения, ИТК должны назначаться всем больным с впервые выявленным хроническим миелолейкозом. В основе механизма их действия лежит блокада АТФ-связывающего кармана патологической молекулы BCR-ABL, что лишает этот белок тирозинкиназной активности, которая стимулирует избыточное деление опухолевых клеток. При постоянном приеме ИТК, опухолевый клон подвергается редукции, что дает возможность восстановлению нормального кроветворения.
В России для терапии первой линии зарегистрированы следующие препараты из группы ИТК:
- иматиниб,
- нилотиниб,
- дазатиниб.
Иматиниб
Иматиниб обладает избирательной активностью в отношении BCR-ABL тирозинкиназы и некоторых других тирозинкиназ. Назначается длительными курсами и должен приниматься ежедневно. Первоначальная дозировка составляет 400 мг в сутки при хронической фазе миелолейкоза, и 600 мг/сут при фазе акселерации или бластном кризе. Дозировка не зависит от роста, пола и массы тела пациента. Препарат выпускается в таблетированной форме или капсулах. Может применяться в амбулаторных условиях. При неудовлетворительном результате терапии, дозировка может быть увеличена, при развитии токсических осложнений — снижена.
Нилотиниб
Нилотиниб — высокоселективный ингибитор BCR-ABL тирозинкиназы. Был разработан на основе молекулы иматиниба и модифицирван для увеличения сродства к BCR-ABL тирозинкиназой. Выпускается в капсулах. Дозировка при терапии хронической фазы составляет 600 мг/сут, при терапии фазы акселерации — 800 мг/сут. Препарат принимают 2 раза в сутки с интервалом в 12 часов строго натощак, поскольку еда увеличивает биодоступность препарата, что повышает его концентрацию в плазме и может спровоцировать развитие токсических осложнений. При недостаточном терапевтическом эффекте в лечении хронической фазы, возможно увеличение дозировки до 800 мг/сутки. При развитии осложнений, дозу снижают.
Дазатиниб
Дазатиниб обладает активностью ко многим тирозинкиназам, в том числе и к мутантной BCR-ABL. Проникает через гематоэнцефалический барьер. Выпускается в формах для перорального применения. Рекомендуемая дозировка составляет 100 мг/сутки для хронической фазы и 140 мг/сут для фазы акселерации и бластного криза. При недостаточной эффективности терапии хронической фазы возможно увеличение дозировки до 140 мг/сут. При развитии токсических осложнений ее снижают до 80 мг/сутки.
Босутиниб
Босутиниб — относительно новый препарат, в России зарегистрирован в 2014 году и применяется для терапии второй и последующих линий при непереносимости или неэффективности вышеперечисленных препаратов. Стандартная суточная доза составляет 500 мг, при необходимости может быть увеличена до 600 мг.
Выбор препарата первой линии проводится индивидуально для каждого пациента. При этом учитывается фаза лейкоза, чувствительность опухолевого клона с отдельными мутациями, профиль токсичности каждого препарата и наличие у пациента сопутствующих заболеваний.
Определение спектра мутаций проводится при манифестации патологии с фазу акселерации или бластного криза, либо при неэффективности терапии выбранным препаратом и необходимости смены препарата, поскольку здесь есть вероятность возникновения резистентных клонов. Например, мутации F317L/V, T315A, V299L обуславливают низкую чувствительность к дазатинибу, поэтому его меняют на нилотиниб. Мутации Y253H, E255K/V, F359V/C, наоборот, делают опухолевые клетки резистентными к нилотинибу, поэтому таким пациентам показан дазатиниб.
Мутации E255K/V, G250E, V299L обуславливают устойчивость к босутинибу. Наличие мутации Т3151 определяет устойчивость ко всем видам ИТК, поэтому таким пациентам рекомендуется аллогенная трансплантация гемопоэтических стволовых клеток. Также возможен вариант терапии понатинибом, но он пока не зарегистрирован в России.
Эффект терапии первой линии может быть отнесен к одной из трех групп:
- Оптимальный ответ. Это хороший результат, который позволяет надеяться на длительный период безрецидивной выживаемости (7-8 и более лет). Критерием достижения оптимального ответа является полный гематологический ответ в течение 3 месяцев, полный цитогенетический ответ в течение 6 месяцев и большой молекулярный ответ в течение 12-18 месяцев.
- Предупреждение. При наличии предупредительных факторов требуется тщательный мониторинг состояния больного и готовность к смене режима лечения. Факторами предупреждения является группа высокого риска хронического миелолейкоза, увеличение более, чем в 10 раз уровня транскрипции мутантного гена, наличие дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой.
- Неудача терапии. Сюда относят прогрессирование заболевания, возникновение новыхмутаций, появление дополнительных хромосомных аномалий в клетках с филадельфийской хромосомой. Требуется смена терапии.
Другие методы лечения хронического миелолейкоза
Трансплантация донорских стволовых клеток показана пациентам с неэффективностью терапии второй линии и пациентам с мутацией T315I. Пациентам с непереносимостью ИТК и невозможностью проведения трансплантации возможно лечение с помощью гидроксимочевины, интерферонов и цитостатиков.
Страница 1 из 5
Острые лейкозы – это самые опасные и стремительные болезни крови. При острых лейкозах происходит поломка на уровне самых молодых клеток крови, клеток-предшественников, клеток-бластов, которые являются одним из подвидов белых кровных телец, лейкоцитов. Слово бласт происходит от слова blastos, что по-гречески означает «росток, зародыш, побег». Бласты – это быстро растущие клетки. Здоровая бластная клетка со временем развивается в какую-либо полезную клетку крови. В норме число бластов не превышает 1% от всех клеток костного мозга. В кровь они почти никогда не выходят. Если человеку срочно понадобилось большое число каких-нибудь клеток крови (например, лейкоцитов при тяжелой инфекции), то бластов организм может вырабатывать и больше, но все же их относительное число редко превышает 10%.
Бласты, которые размножаются при остром лейкозе, другие. Их можно сравнить с хулиганами-тунеядцами в человеческом обществе, потому что они не работают, питаются запасами организма и вместо собственного развития в полезные клетки быстро плодят себе подобных. Лейкозные бласты вытесняют здоровые клетки крови из их дома внутри костей и поселяются там сами. Из-за этого нарушается процесс обновления нормальной крови, начинается ее дефицит: быстро снижается гемоглобин, тромбоциты, здоровые лейкоциты. Пациент начинает слабеть, могут появиться самопроизвольные кровотечения и высокая температура. В анализе крови врач видит снижение гемоглобина и тромбоцитов и резкое повышение лейкоцитов за счет опухолевых клеток-бластов. Больше всего опухолевых клеток в костном мозге.
Принципиально врачи выделяют два типа бластов: лимфобласты и миелобласты. В зависимости от типа бластов и лейкозы бывают лимфобластные и миелобластные (нелимфобластные). Это зависит от того, в начале какого из двух путей развития клетки крови произошла авария.
В норме из здоровых лимфобластов (клеток-предщественников) образуются высокоспециализированные клетки иммунной системы В- и Т- лимфоциты. Задачи В- и Т-клеток можно сравнить с задачами войск специального назначения, которые действуют точно и эффективно. Из миелобластов в дальнейшем получаются остальные виды клеток: красные кровяные тельца, тромбоциты, гранулоциты. Красные кровяные тельца (эритроциты) – переносят кислород, тромбоциты отвечают за свертывание крови, если мы, например, поранились. Гранулоциты – «общевойсковая» часть иммунной системы, они действуют более массированными ударами.
Если произошла поломка, то нормальные клетки не созревают, а бласты остаются недоразвитыми. По внешнему виду бласта, а также с помощью проточной цитометрии можно определить, какая клетка могла бы из него получиться. Это важно для выбора лечения и понимания, насколько успешным будет лечение. Вид клеток-предшественников врачи обозначают в диагнозе, например: острый В-лимфобластный лейкоз (лейкоз из клеток-предшественников В-лимфоцитов), острый монобластный лейкоз (лейкоз из клеток-предшественников моноцитов) и т.д.
Диагноз «острый лейкоз» ставят, если выясняют, что бластов в костном мозге пациента более 20%. Чтобы понять, какой именно лейкоз у больного, делают проточную цитометрию бластов.
Острые лейкозы бывают очень разные. Лейкоз, например, может появиться «на ровном месте», то есть у человека, у которого никогда не было никаких болезней страшнее насморка. Такими лейкозами обычно болеют дети и молодые люди. У людей старшего возраста острые лейкозы, как правило, вторичны. Это значит, что в результате каких-то причин (химиотерапия по поводу других болезней, облучение или отравление некоторыми химическими веществами) может нарушиться кроветворение, то есть появляется так называемый миелодиспластический синдром (мы уже описывали его в других разделах нашего сайта). Последней ступенью миелодиспластического синдрома является вторичный острый лейкоз. Первичные лейкозы более агрессивны, чем вторичные, но все лейкозы лечат по единым принципам. Чтобы полностью вылечить пациента, часто необходимо сделать пересадку донорских стволовых клеток крови.
О некоторых типах острых лейкозов мы расскажем в этой главе:
- острый миелобластный лейкоз;
- острый лимфобластный лейкоз;
- миелоидная саркома;
- острые лейкозы смешанного фенотипа.
- Вперёд
Прогноз и профилактика хронического миелолейкоза
Специфических методов профилактики не существует, поскольку неизвестны причины, из-за которых образуются мутации, вызывающие хронический миелолейкоз. Что касается прогноза, то здесь все зависит от возраста больного, ответа на лечение и возможности проведения аллогенной трансплантации. В целом ситуация довольно благоприятная и позволяет надеяться на продолжительность жизни, сопоставимую с общепопуляционными показателями. У некоторых больных возможно достижение стойкой ремиссии и отказ от пожизненного приема ИТК с регулярным динамическим наблюдением.
В клинике «Евроонко» лечение миелолейкоза соответствует всем современным лечебным протоколам. В сложных случаях, решение принимает консилиум специалистов, а при достижении ремиссии, мы особое внимание уделяем регулярному наблюдению пациента, что также позволяет улучшать результаты лечения.
Запись на консультацию круглосуточно
+7+7+78