Норильская межрайонная детская больница
А.И. Лобанов, О.Г. Лобанова
В статье рассмотрены проблемы геморрагической болезни новорожденных с поздним дебютом. В настоящее время в роддомах профилактика геморрагической болезни проводится не всем новорожденным. Проведен клинический анализ 9 случаев болезни. Опасной особенностью позднего проявления геморрагической болезни (после месяца жизни) является развитие массивных внутричерепных кровоизлияний на фоне повышенной кровоточивости. Для позднего возникновения геморрагии вследствие дефицита витамина К характерно сочетание трех факторов: отсутствие профилактики геморрагической болезни, грудное вскармливание ребенка и транзиторный холестаз.
В практике детского реаниматолога нетравматические внутричерепные кровоизлияния у детей первых месяцев жизни встречаются достаточно редко. Установить истинную причину кровоизлияния не всегда возможно. Вместе с тем известно, что одной из причин развития внутричерепных кровоизлияний у детей первых месяцев жизни является поздняя геморрагическая болезнь новорожденных (ГБН). Предвидеть развитие позднего дебюта болезни невозможно, поэтому профилактика ГБН на этапе родильного дома чрезвычайно важна.
Предшествует развитию ГБН у новорожденных, особенно тех, кто находится на естественном вскармливании, дефицит витамина К: в гепатоците нарушается гамма-карбоксилирование витамин К-зависимых факторов свертывания крови. В результате не подвергавшиеся карбоксилированию факторы утрачивают способность участвовать в процессе свертывания крови. Иммунологически они обнаруживаются в крови в нормальном количестве, в виде некарбоксилированных и нефункционирующих молекул, обозначаемых в литературе аббревиатурой PIVKA {Protein-Induced by Vitamin К Absence) [1].
Эти неполноценные факторы свертывания не способны качественно влиять на процессы коагуляции крови, что приводит к развитию ГБН. Наиболее опасное проявление этой патологии — внутричерепное кровоизлияние, возникающее на фоне общей кровоточивости (кожных геморрагии, желудочно-кишечных кровотечений).
За период с 2004 по 2008 гг. в отделение реанимации ГКБ № 4 г. Ижевска были госпитализированы 9 детей с нетравматическими внутричерепными кровоизлияниями. Возраст пациентов составлял от 1 до 2,5 мес жизни. Шестеро детей госпитализированы из дома и трое — из стационаров города.
Анамнез
При сборе анамнеза было выяснено, что все дети — от практически нормально протекавшей беременности, срочных родов, находившиеся на естественном вскармливании. В роддоме всем новорожденным была проведена вакцинация от гепатита В и БЦЖ. Профилактическое введение менадиона натрия (Викасол) новорожденным не проводилось. На 5-7 сут все дети были выписаны домой. В дальнейшем 2 ребенка были привиты от гепатита В дважды.
Клиника дебюта
Начало заболевания протекало практически одинаково у всех детей. За 1-2 дня до возникновения внутричерепного кровоизлияния на коже или слизистой ротовой полости появлялись геморрагические элементы (табл. 1).
Единичные глубокие экхимозы диаметром от 5 до 20 мм обнаруживались родителями чаще на конечностях, реже — на туловище. Мелкие множественные кровоизлияния на слизистой ротовой полости выявлялись уже при осмотре в реанимации. У одного больного ребенка была обнаружена кровь в стуле и отмечалась длительная кровоточивость из места инъекции при повторной вакцинации от гепатита В. При консультации хирургом патологии не выявлено.
У всех больных внутричерепное кровоизлияние манифестировало внезапным, болезненным, но недлительным плачем. У 8 детей сразу появилась постоянная и упорная рвота, в двух случаях — с примесью крови. Рвота не отмечалась только у одного ребенка. Вначале дети проявляли периодическое беспокойство, начинали стонать, отказывались от кормления, затем становились апатичными и безучастными к окружающему. У 7 детей отмечались тонические судороги. Нарастала резкая бледность кожи. Кратковременная субфебрильная температура сменялась гипотермией.
Практически все дети были очень поздно госпитализированы: время, проведенное дома от момента возникновения кровоизлияния до госпитализации, составляло от одних суток и более. При поступлении в реанимационное отделение 8 детей находились в крайне тяжелом состоянии. У всех определялась декомпенсация легочной вентиляции, расстройства системного кровообращения, очаговая и общемозговая неврологическая симптоматика, нарушения коагуляционного гемостаза. В 6 случаях у поступивших было редкое, аритмичное дыхание или его полное отсутствие. В 2 случаях дыхательные нарушения были только в виде выраженного тахипное (частота дыхания — в пределах 100/мин).
У всех пациентов отмечалась резкая бледность кожи и слизистых с цианотичным оттенком, а также кровоточивость из мест инъекций. У 2 детей наблюдались признаки невыраженного легочного и желудочного кровотечения, в виде геморрагического отделяемого из эндотрахеальной трубки и желудочного зонда. У 8 детей при поступлении сохранялся легкий желтушный оттенок кожи. Дефицит объема циркулирующей крови составлял от 30 до 39% от нормы (норма ОЦК у детей первых месяцев жизни — 85 мл/кг; ОЦКфакт = масса тела/весовая часть ОЦК по гематокриту в таблице). Артериальное давление колебалось от 80/40 до 110/72 мм рт. ст. В 7 случаях у детей отмечалась тахикардия с глухостью сердечных тонов. В неврологическом статусе у 6 детей наблюдались нарушения центральной регуляции дыхания. Патологические формы дыхания в виде выраженного брадипноэ или апноэ у этих детей развились еще до момента госпитализации и продолжали прогрессировать до полной утраты автоматического дыхания. Стволовые рефлексы со слизистых (роговицы, глотки, трахеи) не вызывались. Отмечалась резкая сухость и отек слизистых ротовой полости, склер. Отсутствовал окулоцефалический рефлекс. Выявлялся фиксированный, двусторонний, паралитический мидриаз, диффузная мышечная атония.
У всех детей большой родничок был выбухающим, плотным на ощупь, с отсутствием пульсации. Отмечалась резкая гипотермия кожи головы. У 5 детей отмечались приступы горметонии (периодическое тоническое напряжение мышц конечностей и туловища, возникающее на фоне мышечной атонии спонтанно или под влиянием раздражителей, длящееся не более 10 с). В данном случае появление горметонии связано с повреждением ствола на уровне среднего мозга и моста вследствие транстенториального вклинения, когда происходит функциональное разобщение ствола и полушарий большого мозга. По мере углубления комы приступы горметонии прекращались. Таким образом, у всех 6 больных была констатирована кома 3 степени (запредельная). Все больные, поступившие в отделение реанимации в состоянии запредельной комы, погибли.
У двоих детей при поступлении в реанимацию была констатирована кома 1-2 степени. Отмечались тонические судороги, преходящие симптомы поражения III, VI, VII пары черепно-мозговых нервов, тахипноэ. Большой родничок был плотным, выбухающим, но с сохранением пульсации. Реакция зрачков на свет, стволовые рефлексы со слизистых (роговицы, глотки, трахеи), окулоцефалический рефлекс — оставались сохранными. У одного больного в неврологическом статусе — признаки умеренно выраженной внутричерепной гипертензии.
Лабораторное обследование
В анализах периферической крови у большинства больных отмечалось значительное снижение уровня гемоглобина (табл. 2).
У всех пациентов время свертывания крови (по Моравицу) было резко удлинено. Протромбиновый индекс определялся только у одного больного и был снижен. Количество тромбоцитов было нормальным или повышенным, и имело тенденцию к еще большему повышению в течение суток. Нормальные показатели фибриногена отмечались у 4 больных, у остальных фибриноген не определялся. Прямой билирубин оставался повышенным у 8 детей, печеночные ферменты незначительно повышены — у 1. Диагностика
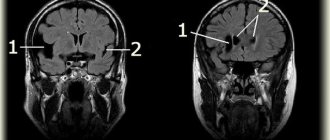
У всех детей были выявлены субарахноидальные кровоизлияния. В 8 случаях кровоизлияния были массивными. Диагностика внутричерепных кровоизлияний осуществлялась на основании анамнеза, клинических данных и ультразвуковых исследований. Проведение нейровизуальных методов исследования (КТ, МРТ головного мозга) у подавляющего большинства пациентов было невозможно из-за крайне тяжелого состояния больных. У 3 пациентов после стихания кровоточивости, когда не была запредельно выражена внутричерепная гипертензия (необратимый отек мозга), кровоизлияние подтверждалось люмбальной пункцией (через сутки). Ликвор чаще вытекал под низким или нормальным давлением, красно-бурого цвета. При его центрифугировании выявлялась резкая ксантохромия; при микроскопии обнаруживались в большом количестве измененные (гемолизированные) эритроциты. При биохимическом исследовании ликвора определялись низ¬кий уровень глюкозы и высокие цифры белка, молочной кислоты (лактата). Терапия
8 детей находились на искусственной вентиляции легких. Всем проводилась коррекция ОЦК, нарушений гемостаза и метаболизма, а также противосудорожная и нейропротекторная терапия. Купирование кровоточивости начиналось с введения через зонд 10 мг Викасола, однократной трансфузии свежезамороженной плазмы в объеме 15 мл/кг. С прекращением кровоточивости (обычно через 10-12 ч) продолжалось дальнейшее введение менадиона натрия (внутримышечно) для создания депо по 5 мг/сут в течение 2-3 дней. 8 пациентам вследствие развития постгеморрагической анемии проводилось переливание эритроцитарной массы. В дальнейшем ни у одного из больных кровоточивости не было. Результаты аутопсии
На аутопсии у погибших детей были обнаружены массивные субарахноидальные кровоизлияния; в 2 случаях с наличием крови еще и в субдуральном пространстве и в 1 случае — в желудочковой системе мозга. В 2 случаях мозг был в состоянии некроза. Кроме этого, у всех погибших детей обнаружены изменения в печени, чаще всего в виде неспецифического реактивного гепатита с внеклеточным холестазом и начальным фиброзом портальных трактов.
Обсуждение
Входе проведения клинического наблюдения было отмечено, что всех детей, поступивших в отделение реанимации с генерализованной кровоточивостью, объединяет ряд общих факторов и клинических особенностей, характерных для возникновения позднего дебюта ГБН. Основной фактор — отсутствие профилактики ГБН. Частота развития позднего дебюта ГБН без профилактики витамином К, по некоторым данным, составляет 5-20 случаев на 100 тыс. новорожденных [2]. Никому из 9 детей, поступивших в отделение реанимации с генерализованной кровоточивостью, в роддоме не проводили профилактику ГБН введением менадиона натрия.
Второй фактор — грудное вскармливание. Все наблюдаемые дети были доношенными, находились исключительно на грудном вскармливании. В физиологических условиях витамин К (К± или филлохинон) поступает в организм ребенка с пищей (грудное молоко) и дополнительно синтезируется в кишечнике в виде витамина К2 или менахинона. Но синтез витамина К2 в кишечнике происходит преимущественно Bacteroides fragilis и некоторым Escherichia coli — флорой, которая заселяется при искусственном вскармливании.
При естественном вскармливании кишечник заселяется Bifidobacterium, Lactobacillus и Clostridium — флорой, практически неспособной синтезировать витамин К2 [3]. Третий фактор — явления транзиторного холестаза. Они отмечались в 8 случаях. Естественный витамин К всасывается в тонкой кишке при обязательном наличии в ней желчи и жира. Уменьшение тока желчи приводит к мальабсорбции жиров и жирорастворимых витаминов, увеличивая еще больший дефицит витамина К. Новорожденные из-за незрелости экскреторной функции печени особенно предрасположены к холестазу [4].
У 8 из 9 детей, поступивших в реанимацию в возрасте старше 1 месяца жизни, уровень прямого билирубина еще оставался повышенным (от 12 до 27 ммоль/л), что свидетельствует о транзиторной, функциональной и экскреторной недостаточности печени. Из клинических особенностей, характерных для позднего дебюта ГБН, следует отметить: во-первых, развитие массивных внутричерепных кровоизлияний в сочетании с кожными геморрагиями и кровоточивостью из желудочно-кишечного тракта. Во-вторых — отсутствие у наблюдаемых детей в начале заболевания тяжелой патологии с высоким риском развития ДВС-синдрома.
Практически накануне развития поздней ГБН все дети были осмотрены участковыми педиатрами. В-третьих — позднюю госпитализацию этих детей в отделение реанимации. Причиной поздней госпитализации наблюдаемых детей стало то обстоятельство, что повышение внутричерепного давления у детей первых месяцев жизни протекает более медленно в связи с тем, что череп ребенка (до заращения черепных швов и закрытия родничков) остается временно податливым и приспосабливается к возникшим условиям. При попадании крови в подоболочечное пространство мозга угрожаемая симптоматика отсрочена на некоторое время, поэтому родители слишком поздно обратились за медицинской помощью.
В-четвертых — изменения в периферической крови и ликворе. Эти изменения являются приспособительными реакциями саногенетической направленности. Они вызваны кровью, излившейся в подоболочечное пространство, и продуктами ее распада. Поэтому у наблюдаемых детей возникало реактивное повышение температуры тела, отмечались изменения периферической крови в виде лейкоцитоза и сдвига лейкоцитарной формулы влево. Поступление самой крови и продуктов ее распада в ликворное пространство вызывало реактивно выраженный плеоцитоз и гиперпротеинрахию. Эти изменения также носят защитную (саногенетическую) направленность и исчезают по мере очищения ликвора от крови к концу 2-3 нед.
Продукты распада крови обладают выраженной токсичностью (оксигемоглобин, серотонин, билирубин и др.) и дополнительно вызывают резкую церебральную ишемию, приводя к инфаркту мозга. И, наконец, еще одной особенностью поздней ГБН является гипокоагуляционная направленность результатов доступных тестов оценки гемостаза и их стабилизация на фоне введения витамина К (Викасол).
Основой лабораторной диагностики ГБН является определение протромбинового времени и индекса, отражающих суммарно уровень (трех из четырех) зависимых от витамина К факторов свертывания (II, VII, X) (табл. 3).
При ГБН содержание тромбоцитов и тромбиновое время должны быть нормальными [5]. У 8 наблюдаемых детей протромбиновый индекс не определялся, а у 1 был снижен. Ни в одном из наблюдений не выявлено снижения числа тромбоцитов, напротив, в ответ на длительное кровотечение в 7 случаях развился компенсаторный тромбоцитоз. Это обстоятельство исключает вовлеченность тромбоцитов в патологические реакции потребления, связанные с ДВС-синдромом.
При отсутствии клинических признаков ДВС-синдрома у более половины больных при поступлении фибриноген не определялся. Это обусловлено рядом причин, таких как снижение белково-синтетической функции печени при развитии критического состояния, влияние гиповолемии, гипоксии, ацидоза. При классической форме ГБН, возникающей у новорожденных в родильном доме, в отличие от ее поздней формы, не возникает внутричерепных кровоизлияний, такой остроты и декомпенсации витальных функций.
Заключение
На основании проведенного клинического наблюдения можно заключить, что возникновению поздней ГБН подвержены доношенные новорожденные, у которых стало возможным сочетание таких факторов, как отсутствие профилактического введения менадиона натрия, грудное вскармливание и транзиторный холестаз. У новорожденных при предполагаемом грудном вскармливании профилактика ГБН особенно актуальна.
СПИСОК ЛИТЕРАТУРЫ 1. Баркаган 3. С. Введение в клиническую гемостазиологию. — М.: Ньюдиамед-АО, 1998. — С. 21-23. 2. Долгов В. В., Свирин П. В. Лабораторная диагностика нарушений гемостаза. — М.: Триада, 2005. — 213 с. 3. Гусель В. А., Маркова И. В. Справочник педиатра по клинической фармакологии. — Ленинград, 1989. — С. 161-163. 4. Шабалов Н. П. Неонатология. Том 2. — СПб., 1996. — С. 95. 5. Баркаган 3. С. Геморрагические заболевания и синдромы. — М.: Медицина, 1988. — 498 с.
Читать статью на сайте www.evrika.ru
Поздняя геморрагическая болезнь новорожденного (клинический разбор)
Несвоевременная нозологическая верификация геморрагического синдрома нередко обусловлена недооценкой анамнестических данных, некорректной трактовкой клинических проявлений, а также ошибками интерпретации результатов лабораторного обследования [1–4]. Кроме этого, в ряде случаев причиной поздно установленного диагноза является терминологическая путаница, в результате которой у практикующего врача-педиатра может сложиться ошибочное представление о возрастных ограничениях для определенных видов геморрагических нарушений. Так, общепризнанный термин «геморрагическая болезнь плода и новорожденного» (код Р53 по МКБ-10) с формальных позиций должен применяться только в тех случаях, когда витамин-К-дефицитная коагулопатия выявляется в перинатальный период. В то же время доказано, что дефицит витамина К в организме ребенка клинически может манифестировать не только в период новорожденности, но и в последующие недели и даже месяцы жизни [5–9]. В этих случаях говорят о «поздней геморрагической болезни новорожденного». Однако корректность данного термина вызывает обоснованные сомнения, поскольку он применяется для обозначения геморрагического синдрома, проявившегося в постнеонатальный период. Ошибочная привязка дефицита витамина К только к периоду новорожденности создает предпосылки для игнорирования этих состояний при поиске причин геморрагических нарушений у детей в возрасте старше 1 мес. Недооценка роли витамин-К-дефицитных состояний в генезе геморрагического синдрома в постнеонатальном периоде может стать причиной поздней диагностики и риска развития серьезных осложнений. В качестве примера поздней верификации витамин-К-зависимой коагулопатии приводим собственное клиническое наблюдение. Девочка в возрасте 1 мес. 11 дней с диагнозом «Гастродуоденальный рефлюкс? Эзофагит?» направлена участковым врачом-педиатром на госпитализацию в связи с частыми срыгиваниями и появлением прожилок коричневатого цвета в рвотных массах. Из анамнеза известно: девочка от соматически здоровой женщины 26 лет. От первой беременности, протекавшей с токсикозом в I триместре. Роды 1-е, самостоятельные на 38 нед., физиологические. Масса тела при рождении – 3100 г, рост – 51 см. Оценка по шкале Апгар – 8–9 баллов. К груди приложена сразу после рождения. Грудь взяла активно. С 3-х сут жизни отмечена иктеричность кожных покровов, что было расценено как проявление физиологической желтухи. В родильном доме вакцинирована против туберкулеза и гепатита В. Выписана из родильного дома на 4-е сут в удовлетворительном состоянии. Девочка с рождения на грудном вскармливании в свободном режиме. Прибавка массы тела за первый месяц жизни составила 1100 г. На фоне грудного вскармливания с первых дней жизни отмечались необильные срыгивания после кормления, расцененные как проявления младенческой регургитации, терапия не проводилась. В течение 3 нед. у ребенка сохранялась желтушность кожных покровов с постепенным угасанием. За 1 нед. до госпитализации срыгивания участились. При поступлении в отделение состояние ребенка средней тяжести. Умеренно выраженная вялость. Кожные покровы бледные. На левом плече и в области левой груди плотноватые подкожные узелки до 1,0 и 0,5 см в диаметре соответственно (со слов матери – «из-за застежек-клипсов на распашонке»). Слизистые влажные, чистые. Тоны сердца звучные, ритмичные, нежный систолический шум на верхушке. В легких дыхание пуэрильное. Живот мягкий, доступен глубокой пальпации. Печень +1,0 см. Стул самостоятельный, кашицеобразный, с небольшой примесью слизи. Мочеиспускание свободное. Очаговая и менингеальная симптоматика отсутствует. В рефлюктате – скудные прожилки крови. При поступлении проведены исследования клинического и биохимического анализов крови, общего анализа мочи, УЗИ внутренних органов с дополнительной оценкой функционального состояния гастроэзофагеальной области (водно-сифонная проба). При этом была выявлены легкая нормохромная, нормоцитарная анемия: HGB 106 г/л, RBC 3,4х1012, MCV 81 фл, MCH 26,1 пг, ЦП 0,93, умеренно выраженный тромбоцитоз: 612х109. В биохимическом анализе крови отмечены незначительная гипербилирубинемия (общий билирубин – 30 мкмоль/л, прямой – 7 мкмоль/л) и умеренное повышение ЛДГ (1020 ед./л). Данные УЗИ внутренних органов свидетельствовали об отсутствии гастроэзофагеального рефлюкса, халазии и пилоростеноза. В течение 1 сут пребывания ребенка в отделении обратили внимание на продолжающееся кровотечение из мест забора крови для исследований. Учитывая сохраняющийся геморрагический синдром (кровотечение из мест инъекций, прожилки крови в рвотных массах) ребенку были проведены (сito!) клинический анализ крови с ретикулоцитами, нейросонография и коагулограмма. Одновременно детально проанализировали анамнез и клинические данные, что позволило дополнительно выявить следующее: – отсутствие геморрагических заболеваний в семье; – в период беременности и после родов (данный временной период изучали, учитывая вскармливание ребенка исключительно грудным молоком) мать не получала лекарственные препараты, которые могли бы повлиять на гемостаз; – менадиона натрия бисульфит ребенку в роддоме не вводился; – прожилки крови в рефлюктате появились еще за 1 нед. до госпитализации; – четко ограниченное изменение цвета кожи (по типу «синячков») до 0,5 и 1,0 см в диаметре над «узелками» в области соска грудной железы слева и левого плеча. При пальпации указанного опухолевидного образования в области левой грудной железы обнаружено геморрагическое отделяемое из соска. После оттока геморрагического отделяемого «узелок» перестал пальпироваться, но ограниченная синева кожи в этом месте сохранилась. Все это позволило рассматривать выявленные «узелки» как подкожные гематомы, которые мама трактовала как проявление травматизации кожи застежками-клипсами детской одежды. С учетом продолжающегося кровотечения и появившихся клинических признаков анемизации сразу после забора крови была начата неотложная посиндромная терапия: в/в введение менадиона натрия бисульфита (1 мг/кг), свежезамороженной плазмы (СЗП) (20 мл/кг), наложена давящая повязка на места инъекций с гемостатической губкой. Анализ результатов проведенного (сito!) обследования позволил выявить изменения в клиническом анализе крови в виде появления гипохромной гиперрегенераторной анемии средней тяжести (Нв – 88 г/л, эритроциты – 3,2х1012, цветной показатель – 0,83, ретикулоциты – 5,3%), сохраняющийся тромбоцитоз (621х109) и нормальный уровень длительности кровотечения (по Дуке – 2 мин). При этом по данным коагулограммы обращало на себя внимание отсутствие коагуляции по внутреннему (активированное частичное тромбопластиновое время (АЧТВ) – нет сгустка) и внешнему (протромбиновый индекс – нет сгустка) путям свертывания при нормальных уровне фибриногена (3,81 г/л) и конечном этапе свертывания (тромбиновое время (ТВ) – 15,1 с) (табл. 1). Данные нейросонографии позволили исключить интракраниальные геморрагические изменения. Полученные результаты лабораторного обследования позволили диагностировать нарушение плазменного гемостаза по типу витамин-К-зависимой коагулопатии. В пользу этого свидетельствовали: – отсутствие нарушений первичного гемостаза (не было выявлено ни тромбоцитопении, ни пролонгации кровотечения по Дуке); – наличие нарушений только тех звеньев вторичного гемостаза, функциональная активность которых определяется витамином К. Так, имела место выраженная гипокоагуляция по внутреннему и внешнему путям свертывания, в то время как фибриноген и ТВ оставались в пределах нормы. Таким образом, данные анамнеза, клиническая картина и результаты обследования позволили верифицировать позднюю геморрагическую болезнь новорожденного, что определило необходимость продолжить терапию менадиона натрием бисульфитом еще в течение последующих 3 дней. При этом следует подчеркнуть, что геморрагический синдром у ребенка был купирован после введения СЗП, в то время как полная нормализация показателей коагулограммы произошла только после окончания курса лечения менадиона натрием бисульфитом (табл. 1). С учетом того, что дефицит витамина К в организме ребенка мог быть обусловлен не только алиментарным фактором (исключительно вскармливание материнским молоком, характеризующееся низким содержанием витамина К), но и его недостаточным синтезом эндогенной микрофлорой кишечника, а также нарушением его утилизации в кишечнике, были проведены дополнительные обследования. Клинических и лабораторных признаков холестаза и мальабсорбции выявлено не было. Это позволило в качестве основных провоцирующих факторов развития витамин-К-зависимой коагулопатии у данного пациента рассматривать отсутствие профилактического введения менадиона натрия бисульфита в раннем неонатальном периоде и исключительно грудное вскармливание. Заключительный диагноз: основной – «Поздняя геморрагическая болезнь новорожденного»; осложнения – «Постгеморрагическая анемия средней тяжести»; сопутствующий – «Младенческая регургитация». Амбулаторно рекомендовано продолжение грудного вскармливания при соблюдении мамой рациональной диеты для кормящих женщин и ежедневном приеме поливитаминных препаратов. С целью коррекции анемии назначен полимальтозный комплекс 3-валентного железа (5 мг/кг/сут по элементарному железу) для приема в течение 1 мес. с последующим контролем показателей клинического анализа крови.
Представленный клинический случай свидетельствует о необходимости настороженности врача-педиатра к любым, даже самым минимальным, геморрагическим проявлениям, особенно у детей раннего возраста. При этом замена широко используемого термина «поздняя геморрагическая болезнь новорожденного» на «витамин-К-зависимую коагулопатию» позволит избежать ошибочной привязки витамин-К-дефицитных состояний исключительно к неонатальному периоду. Включение указанного патологического состояния в перечень возможных причин геморрагического синдрома у детей независимо от их возраста позволит своевременно верифицировать диагноз и назначить адекватную терапию.
Литература 1. Баркаган Л.З. Нарушения гемостаза у детей. М., 1993. 2. Nelson Textbook of Pediatrics, 19th Edition /R.M. Kliegman, B.M. Stanton, J. St. Geme, N. Schor, R.E. Behrman. New York, London: Elsevier Inc., 2014. 3. Детские болезни / под ред. Н.П. Шабалова / 6-е изд. СПб.: Питер, 2009. 4. Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. М.: Триада, 2005. 5. Шабалов Н.П. Геморрагические расстройства у новорожденных / В кн.: Неонатология. В 2-х тт. / 3-е изд., испр. и доп. М.: МЕДпресс-информ, 2004. Т. 2. С. 208–223. 6. Неонатология. Национальное руководство. Крат. изд-е / под ред. Н.Н. Володина. М.: ГЭОТАР-медиа, 2013. 7. Takahashi D., Takahashi Y., Itoh S. et al. Late vitamin K deficiency bleeding in an infant born at a maternity hospital // Pediatr Int. 2014 Jun. Vol. 56 (3). Р. 436. 8. Van Winckel M., De Bruyne R., van de Velde S., van Biervliet S. Vitamin K an update for the paediatrician // Eur J Pediatr. 2009 Feb. Vol. 168 (2). Р. 127–134. 9. Hubbard D., Tobias J.D. Intracerebral hemorrhage due to hemorrhagic disease of the newborn and failure to administer vitamin K at birth // South. Med. J. 2006. Vol. 99 (11). Р. 1216–1220.
Витамин К-дефицитный геморрагический синдром у новорожденных и детей первых месяцев жизни
- Нароган Марина Викторовна
- Карпова Анна Львовна
- Строева Лариса Емельяновна
Резюме
Статья посвящена геморрагической болезни новорожденных (ГрБН). Приводятся данные по биологической роли витамина К и его метаболизма у новорожденных. Представлены частота развития, причины и клинические симптомы ранней, классической и поздней формы болезни. На основании обзора отечественных и зарубежных публикаций рассмотрены вопросы лабораторной диагностики, профилактики и лечения ГрБН. Учитывая опасность развития жизнеугрожающих кровотечений, сделан акцент на необходимости максимального охвата новорожденных профилактическим введением витамина К в соответствии с Клиническими рекомендациями по диагностике и лечению геморрагической болезни новорожденных, разработанными МОО «Ассоциация неонатологов» (2015). Описан клинический случай развития поздней формы ГрБН у ребенка, который находился на исключительно грудном вскармливании и не получил витамин К в целях профилактики после рождения.
Ключевые слова:геморрагическая болезнь новорожденных, витамин Кдефицитный геморрагический синдром, новорожденные, витамин К
Неонатология: новости, мнения, обучение. 2015. № 3. С. 74-82.
Геморрагическая болезнь новорожденных (ГрБН) (код МКБ-10 — Р53), или витамин К-дефицитный геморрагический синдром, — заболевание, проявляющееся повышенной кровоточивостью у новорожденных и детей первых месяцев жизни вследствие недостаточности факторов свертывания крови (II, VII, IX, X), активность которых зависит от витамина К.
Термин «геморрагическая болезнь новорожденных» появился в 1894 г. (Townsend, 1894) для обозначения кровотечений у новорожденных, не связанных с травматическим воздействием или гемофилией. Позднее было показано, что причиной многих таких кровотечений является дефицит витамина К, в связи с чем более точным термином стал считаться «витамин К-дефицитное кровотечение» [«vitamin K deficiency bleeding» (VKDB)] [1].
Биологическая роль витамина К и его метаболизм у новорожденных
Биологическая роль витамина К состоит в активировании гамма-карбоксилирования остатков глутаминовой кислоты в протромбине (фактор II), проконвертине (фактор VII), антигемофильном глобулине В (фактор IX) и факторе Стюарта-Прауэра (фактор Х), а также в антипротеазах плазмы С и S, играющих важную роль в антисвертывающей системе.
При недостатке витамина К в печени происходит синтез неактивных декарбоксилированных форм К-зависимых факторов, неспособных связывать ионы кальция и полноценно участвовать в свертывании крови (PIVKA — protein induced by vitamin K absence or antagonism) [2-4]. В исследованиях обычно используется определение уровня PIVKA-II — декарбоксилированной формы протромбина.
В 1929 г. датский биохимик H. Dam выделил жирорастворимый витамин, который в 1935 г. назвали витамином К, однако до настоящего времени пути метаболизма витамина К до конца не изучены.
Основным источником обеспечения организма является витамин К растительного происхождения, который называют витамином К1, или филлохиноном. Он поступает с продуктами питания — зелеными овощами, растительными маслами, молочными продуктами. Другая форма витамина К — витамин К2, или менахинон, — бактериального происхождения. Витамин К2 в основном синтезируется кишечной микрофлорой. Роль витамина К2 изучена очень мало. Наибольшее его количество находится внутри бактериальных мембран и, возможно, всасывается плохо. Считается, что витамин К2 не имеет большого значения для организма. Известно, что депонирование витамина К происходит в форме менахинона-4 (МК-4) в поджелудочной железе, слюнных железах, головном мозге. В настоящее время ведутся исследования по изучению путей метаболизма различных форм витамина К. Одним из путей преобразования витаминов К1 и К2 в депонированную форму является их метаболизирование в кишечнике в промежуточное вещество — менадион (витамин К3). Затем из циркулирующего в крови менадиона во внепеченочных тканях синтезируется депонированная форма менахинон-4 [4-7].
Все новорожденные имеют относительный дефицит витамина К. Перенос витамина К1 через плаценту крайне ограничен. Материнско-плодовый градиент для витамина К1 составляет 30:1, вследствие чего концентрация витамина К в крови плода и запасы его к моменту рождения крайне малы. Уровень витамина К1 в крови пуповины варьирует от очень низкого (<2 мг/мл) до неопределяемого. Витамин К2 в печени у новорожденных практически не обнаруживается или встречается в крайне низких количествах. Эта форма витамина начинает накапливаться постепенно в течение первых месяцев жизни. Возможно, у детей, находящихся на грудном вскармливании, витамин К2 накапливается медленнее, так как преобладающая у них микрофлора кишечника (Bifidumbacterium
,
Lactobacillus
) не синтезирует витамин К2.
Бактерии, которые продуцируют витамин К2, — Bacteroides fragilis
,
E.coli
, более распространены у детей, получающих искусственные молочные смеси [1, 4, 8].
В то же время у 10-52% новорожденных в пуповинной крови определяется повышенный уровень PIVKA-II, свидетельствующий о дефиците витамина К, а к 3-5-му дню жизни высокий уровень PIVKA-II обнаруживается у 50-60% детей, находящихся на грудном вскармливании и не получивших профилактического введения витамина К [4, 9, 10]. Таким образом, для новорожденных единственным источником витамина К является его экзогенное поступление: с женским молоком, искусственной питательной смесью или в виде лекарственного препарата.
Известно, что ГрБН чаще развивается у детей, находящихся на грудном вскармливании, так как содержание витамина К1 в грудном молоке гораздо ниже, чем в искусственных молочных смесях, составляя обычно <10 мкг/л [4]. Тогда как в искусственных молочных смесях для доношенных детей содержится около 50 мкг/л витамина К, а в смесях для недоношенных — до 60-100 мкг/л.
Классификация геморрагической болезни новорожденных
Выделяют 3 формы ГрБН в зависимости от возраста манифестации симптомов: раннюю
,
классическую и позднюю
.
В основе развития кровоточивости при всех формах болезни лежит дефицит витамина К. Однако факторы риска и причины развития симптомов при разных формах отличаются.
Ранняя форма ГрБН
Изучена недостаточно. Встречается редко. Манифестирует в течение первых 24 ч жизни ребенка.
Как правило, причиной развития ранней формы ГрБН является прием матерью во время беременности препаратов, нарушающих метаболизм витамина К, таких как антикоагулянты непрямого действия (варфарин, фениндион), противосудорожные средства (барбитураты, карбамазепин, фенитоин), противотуберкулезные препараты (изониазид, рифампицин).
Частота заболеваемости этой формой у детей, чьи матери получали данные препараты во время беременности без добавок витамина К, достигает 6-12% [1, 11]. В целом же частота ранней формы ГрБН, по данным 6-летнего наблюдения в Швейцарии с 2005 по 2011 г., составила 0,22 на 100 тыс. [12].
При ранней форме возможно появление кровотечений любой локализации, в том числе в головной мозг. Характерны кровотечения, ассоциированные с родовыми травмами [9, 13]. Считается, что эта форма болезни обычно не может быть предупреждена путем профилактического назначения витамина К после родов [1, 14].
Классическая форма ГрБН
Проявляется кровоточивостью на 2-7-е сутки жизни.
Помимо вышеуказанных причин, обусловливающих дефицит витамина К у плода и новорожденного, в развитии этой формы выделяют еще 2 важные причины: 1) отсутствие профилактического применения витамина К сразу после рождения и 2) недостаточное поступление молока.
Характерны желудочно-кишечные кровотечения, кожные геморрагии, кровотечения из мест инъекций/инвазий, из пупочной ранки и из носа. Внутричерепные кровоизлияния менее типичны [2, 9, 15].
Предполагаемая частота классической формы ГрБН без профилактического применения витамина К составляет 0,25-1,5%. Профилактическое введение витамина К сразу после рождения ребенка позволяет практически устранить эту форму ГрБН [1, 12].
Поздняя форма ГрБН
Диагностируется в случаях развития симптомов кровоточивости в период с 8-го дня до 6 мес жизни, хотя, как правило, манифестация приходится на возраст 2-12 нед [1, 2, 9, 14, 16].
Можно выделить 3 основные группы детей, которые имеют риск развития поздней формы ГрБН.
Первую группу составляют дети с дефицитом поступления витамина К: находящиеся на исключительно грудном вскармливании и не получившие профилактику витамином К после рождения [12, 14, 17].
Во 2-ю группу входят дети с нарушением всасывания витамина К в желудочно-кишечном тракте. Это состояние наблюдается при холестатических заболеваниях и болезнях кишечника, сопровождающихся мальабсорбцией (диарея более 1 нед, муковисцидоз, синдром короткой кишки, целиакия) [1, 18, 19].
К 3-й группе относятся дети, получающие длительное парентеральное питание при неадекватном снабжении витамином К.
Особенностью клинической картины поздней формы ГрБН является развитие внутричерепных кровоизлияний с частотой от 30 до 75%, которые в 30-50% случаев ведут к инвалидизации или летальному исходу [1, 11, 20-22].
У части детей за некоторое время до кровоизлияния в мозг (от дня до недели) наблюдаются малые «предупреждающие» геморрагии [16, 17, 23, 24].
Без профилактического применения витамина К сразу после рождения ребенка частота поздней формы ГрБН находится в пределах 5-20 на 100 тыс. новорожденных. Внутримышечное профилактическое назначение витамина К способно значительно снизить частоту поздней формы, практически исключая возможность ее развития у детей, не имеющих синдрома холестаза и мальабсорбции [1, 12, 25, 26] В Швейцарии 6-летнее наблюдение за развитием ГрБН с 2005 по 2011 г. в условиях трехкратного перорального профилактического приема водорастворимой формы витамина
К (2 мг в 1-й, 4-й день и в 4 нед) показало, что частота поздней формы составляет 0,87 на 100 тыс., при этом все случаи позднего кровотечения появлялись у детей, находящихся на грудном вскармливании и имеющих холестатические заболевания. Развитие классической формы не зарегистрировано [12].
Лабораторные признаки ГрБН
Лабораторными признаками ГрБН прежде всего являются изменения протромбиновых тестов: удлинение протромбинового времени (ПВ), снижение протромбинового индекса (ПТИ), повышение международного нормализованного отношения (МНО). Характерно значительное изменение протромбиновых тестов — в 4 раза и более. В более тяжелых случаях присоединяется удлинение активированного частичного тромбопластинового времени (АЧТВ) [11, 23, 27, 28].
Уровни фибриногена, тромбоцитов, тромбинового времени, как правило, не изменяется. Однако при массивных кровотечениях и критических состояниях и эти показатели могут становиться патологическими, что чаще наблюдается при поздней форме ГрБН.
Диагноз подтверждается нормализацией протромбиновых тестов и прекращением кровотечения после введения витамина К [15, 17, 20, 27]. По данным отечественных авторов, комплексное лечение поздней формы ГрБН (введение менадиона и свежезамороженной плазмы) приводит к нормализации протромбиновых тестов в пределах от 6-8 до 18-24 ч [17, 24].
При оценке коагулограммы необходимо учитывать, что нормативные значения показателей гемостаза у новорожденных и детей первых месяцев жизни отличаются от референсных значений взрослых и подвержены существенным изменениям сразу после рождения. А у недоношенных детей имеются свои особенности гемостаза в зависимости от гестационного возраста, характеризующиеся значительным размахом значений. Для новорожденных и недоношенных детей характерна гипокоагуляционная направленность плазменно-коагуляционного звена гемостаза на фоне повышения внутрисосудистого свертывания крови и активности фибринолиза [повышение уровня продуктов деградации фибрина (ПДФ) и D-димеров] [28-34].
Абсолютные значения показателей гемостаза зависят от реагента и анализатора, поэтому в каждой лаборатории рекомендуется определять собственные референсные значения для новорожденных и недоношенных детей в соответствии с используемой методикой [34, 35].
Определение витамина К не представляет собой диагностической ценности вследствие его низкой концентрации у новорожденных [11].
Уровень PIVKA-II может помочь в диагностике скрытого дефицита витамина К, однако он не отнесен к основным диагностическим маркерам ГрБН на практике и в основном применяется в научных работах [4, 9].
Лечение ГрБН
Строится на принципах остановки кровотечения и ликвидации дефицита витамина К.
Любому ребенку с подозрением на ГрБН незамедлительно должен быть введен витамин К, не дожидаясь лабораторного подтверждения. В РФ препаратом витамина К является менадиона натрия бисульфит (викасол) — водорастворимый синтетический аналог витамина К3. Необходимо учитывать, что его действие начинается через 8-24 ч.
В случае продолжающихся и жизнеугрожающих кровотечений показано введение свежезамороженной плазмы [2, 9, 36]. Вместо плазмы возможно использование концентрированного препарата протромбинового комплекса [2, 9, 37]. Назначение его должно быть мониторировано из-за риска тромбоэмболических осложнений [38].
Профилактика ГрБН
Профилактика ГрБН является приоритетной задачей неонатальной и педиатрической службы.
Для повышения концентрации витамина К в организме беременной и в грудном молоке женщине рекомендуется диета с использованием продуктов, богатых витамином К1, а также прием поливитаминных комплексов [4, 13, 15].
Беременным женщинам, которые принимают во время беременности препараты, нарушающие метаболизм витамина К, рекомендуется дополнительный прием витамина К: в III триместре в дозе 5 мг/сут или за 2 нед до родов в дозе 20 мг/сут [1, 14]. Однако все эти мероприятия не считаются достаточными для полноценной профилактики всех форм ГрБН.
Учитывая физиологию свертывающей системы и метаболизма витамина К у новорожденных, в развитых странах принято профилактическое введение препарата витамина К всем новорожденным, при этом с 1960-х гг. используются только препараты витамина К1. Проведенные до этого времени исследования показали, что препарат менадиона обладает окисляющим действием на фетальный гемоглобин, приводя к гемолизу, образованию метгемоглобина и телец Гейнца в эритроцитах, что связывают с нарушением метаболизма глютатиона на фоне недостаточной антиоксидантной защиты у новорожденных и, особенно, у недоношенных детей. Токсическое влияние менадиона было выявлено при использовании высоких доз (более 10 мг) [4, 15, 39, 40].
Профилактическое применение препаратов витамина К1 показало свою эффективность в многочисленных исследованиях. Считается, что однократного парентерального введения витамина К1 после рождения ребенка достаточно для профилактики классической и поздней формы ГрБН у детей, не имеющих симптомов холестаза и мальабсорбции. В некоторых странах с той же целью применяется энтеральная дотация витамина К1, однако в этих случаях необходим прием нескольких доз витамина К1 внутрь по определенным схемам. При наличии синдрома холестаза или мальабсорбции ребенку потребуются дополнительные введения витамина К [1, 11, 16, 20, 27, 41, 42].
Учитывая отсутствие в настоящее время зарегистрированного в РФ препарата витамина К1, для профилактики витамин К-дефицитного геморрагического синдрома в нашей стране используется внутримышечное введение 1% раствора менадиона натрия бисульфита, который вводится в первые часы после рождения. При хирургических вмешательствах у новорожденных с возможным сильным паренхиматозным кровотечением, а также у детей с синдромом холестаза или мальабсорбции необходимо дополнительное введение витамина К (см. рисунок).
Эффективность применения менадиона можно считать доказанной для профилактики классической формы ГрБН у доношенных детей, так как во многих проведенных исследованиях были получены идентичные результаты: введение менадиона внутримышечно (в том числе в дозе 1 мг) приводило к существенному повышению ПТИ, снижению АЧТВ, ПВ, уровня PIVKA-II, уменьшению частоты кровотечений, при этом токсических влияний не зарегистрировано [27, 29, 43, 44].
Высокая частота внутричерепных кровоизлияний при поздней форме геморрагической болезни у детей, находящихся исключительно на грудном вскармливании, делает профилактику данной формы особенно актуальной. Многочисленные зарубежные исследования показали эффективность однократного парентерального введения витамина К1 сразу после рождения ребенка для профилактики данной формы болезни. Исследований эффективности препарата менадиона для профилактики поздней формы ГрБН в современной литературе практически нет, что в определенной степени объясняется произошедшей в 1960-х гг. во многих странах заменой его на препарат витамина К1. Тем не менее в отечественной литературе имеются немногочисленные публикации, свидетельствующие о том, что встречаемые случаи поздней формы ГрБН развивались у детей на исключительно грудном вскармливании, не получивших профилактическое введение препарата менадиона в родильном доме.
В одной из публикаций представлен анализ 9 случаев поздней геморрагической болезни, сопровождавшейся внутричерепными кровоизлияниями. Заболевание развилось у детей в возрасте от 1 мес до 2 мес 20 дней, находившихся на грудном вскармливании и не имевших серьезной соматической патологии. Неблагоприятно заболевание закончилось у 7 (78%) пациентов: летальный исход наступил у 6 детей, инвалидизация — у 1. Авторы стараются привлечь внимание к тому, что никто из пациентов не получил профилактического введения витамина К в родильном доме [17].
В другом обзоре представлен анализ 34 случаев поздней ГрБН с развившимися внутричерепными кровоизлияниями.
Заболевание манифестировало с 3-й по 8-ю неделю. Все дети находились на грудном вскармливании и не получили профилактического ведения витамина К [24].
Клинический случай поздней формы ГрБН
Мальчик Д
. родился от 3-й беременности (1-я — замершая, 2-я — роды в срок, ребенок здоров), протекавшей без особенностей, от 2-х родов на 39-й неделе с массой тела 2820 г, ростом 50 см. Оценка по шкале Апгар составила 9/10 баллов. К груди приложен в родильном зале. Вакцинирован БЦЖ и вакциной против гепатита В в родильном доме. Профилактически витамин К не вводился. Из родильного дома выписан домой в удовлетворительном состоянии с уровнем билирубина 200 мкмоль/л. Находился на грудном вскармливании. За первый месяц прибавил в массе 500 г.
На 2-3-й неделях жизни отмечалась небольшая пупочная кровоточивость, лечения не получал. В возрасте 27 дней наблюдалось легкое сукровичное отделяемое из носа и геморрагическая корочка в носу. На следующий день в возрасте 28 дней мама заметила у ребенка небольшую гематому на спине под лопаткой размером около 1,5 см. Утром на 29-е сутки жизни отмечалась однократная рвота, ребенок плохо сосал, был беспокоен, поджимал ножки. Дежурный врач поликлиники диагностировал кишечную колику.
К вечеру ребенок стал вялый, бледный, наблюдалась рвота фонтаном. Утром на 30-й день жизни, в связи с прогрессирующим ухудшением состояния, был госпитализирован с диагнозом: затянувшаяся желтуха, кишечная колика, гидроцефальный синдром.
При поступлении в стационар. Состояние крайне тяжелое. Температура тела 38 оС. Ребенок практически не реа- гировал на осмотр. Наблюдались поза декортикации, выраженная гиперестезия, раздраженный монотонный крик, выбухание большого родничка, анизокория справа, кожа была бледно-иктеричного цвета, на спине — гематома диаметром 1,8-2,0 см, подкожно-жировой слой истончен, отмечалась тахикардия. По другим органам — без видимых отклонений.
Данные обследования
В клиническом анализе крови: Hb 99 г/л, эритроциты 2,71Ч1012/л, тромбоциты 165Ч109/л. В биохимическом анализе крови: общий белок 57 г/л, общий билирубин 227 мкмоль/л, прямой 16,1 мкмоль/л, глюкоза 5,1 ммоль/л, АЛТ 12 ЕД/л, АСТ 13,4 ЕД/л.
Коагулограмма.
Заключение: гипокоагуляция, связанная с дефицитом К-зависимых факторов свертывания крови (см. таблицу).
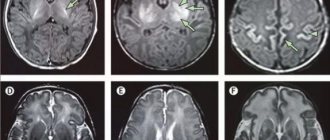
На основании анамнеза, клинической картины и дополнительного обследования был установлен диагноз «ГрБН (витамин К-дефицитное кровотечение), поздняя форма.
Внутрижелудочковое кровоизлияние III степени». Постгеморрагическая анемия.
По поводу основного диагноза проводилось лечение: викасол 1 мг/кг 1 р/сут в течение 3 дней, дицинон, двукратное переливание свежезамороженной плазмы, трансфузия эритроцитарной массы.
На фоне лечения через 1 сут после поступления показатели коагулограммы нормализовались (см. таблицу).
Через 1 мес в связи с развитием окклюзионной тетравентрикулярной гидроцефалии ребенок был переведен в нейрохирургический стационар, где ему проведено вентрикулоперитонеальное шунтирование.
Заключение
ГрБН — серьезное заболевание, которое может привести к летальному исходу или инвалидизации, особенно в случае развития его поздней формы. Необходимо учитывать, что формирование тяжелых внутричерепных кровоизлияний при поздней форме ГрБН можно предотвратить, проводя своевременную профилактику.
Накопленный опыт убеждает в необходимости профилактического назначения препаратов витамина К всем новорожденным в первые часы после рождения и сохранения настороженности в отношении поздней формы ГрБН.
В связи с этим в 2015 г. МОО «Ассоциация неонатологов» были разработаны клинические рекомендации по диагно- стике и лечению ГрБН. Также была предложена схема профилактики ГрБН [36]. К сожалению, в Российской Федерации 100-процентная рутинная профилактика ГрБН трудноосуществима, так как гемолитическая болезнь у новорожденного является официальным противопоказанием для назначения единственного зарегистрированного в нашей стране препарата витамина К — менадиона; его назначение в этой группе детей возможно только при наличии серьезных аргументов (см. рисунок).
Профилактика поздней формы ГрБН должна предусматривать введение витамина К в родильном доме и сохранение настороженности в отношении данного заболевания у детей первого полугодия жизни из групп высокого риска: находящихся на грудном вскармливании, имеющих синдром холестаза и синдром мальабсорбции. В связи с этим появление геморрагий у детей первых месяцев жизни требует немедленной дифференциальной диагностики и исключения витамин К-дефицитных кровотечений.
К таким предупреждающим геморрагиям относятся:
✧ носовые кровотечения;
✧ кровотечения из пупочной ранки;
✧ петехии и экхимозы на коже или слизистых оболочках;
✧ межмышечные гематомы или кровотечения из мест инвазивных вмешательств (инъекции, вакцинации, места забора крови, обрезание, операции).
При подозрении на развитие ГрБН показано незамедлительное введение препарата менадиона во избежание развития жизнеугрожающих кровотечений.
После регистрации в России препарата витамина К1 клинические рекомендации по профилактике и лечению витамин К-дефицитных кровотечений у детей будут пересмотрены и будет рекомендовано использование препаратов витамина К1.
ЛИТЕРАТУРА
1. NHMRC (National Health and Medical Research Council) (2010). Joint statement and recommendations on Vitamin K administration to newborn infants to prevent vitamin K deficiency bleeding in infancy — October 2010 (the Joint Statement). Commonwealth of Australia.www.ag.gov.au/cca. ISBN Online: 1864965053.
2. Неонатология. Национальное руководство. Краткое издание / под ред. акад. РАМН Н.Н. Володина. М.: ГЭОТАР-Медиа, 2013. 896 с.
3. Joshi A., Jaiswal J.P. Deep vein thrombosis in protein S deficiency // J. Nepal. Med. Assoc. 2010. Vol. 49. P. 56-58.
4. Greer F.R. Controversies in neonatal nutrition: macronutrients and micronutrients. In: Gastroenterology and nutrition: neonatology question and controversies. 2nd ed. by Neu J. Philadelphia: Elsevier saunders, 2012. P. 129-155.
5. Card D. J., Gorska R. et al. Vitamin K metabolism: Current knowledge and future research // Mol. Nutr. Food Res. 2014. Vol. 58. P. 1590-1600.
6. Thijssen K.H.W., Vervoort L.M.T. et al. Menadione is a metabolite of oral vitamin // Br. J. Nutr. 2006. Vol. 95. P. 260-266.
7. Sharer M.J., Newman P. Recent trends in the metabolism and cell biology of vitamin K with special reference to vitamin K cycling and MK-4 biosynthesis // J. Lipid Res. 2014. Vol. 55, N 3. P. 345-362.
8. Thureen P.J., Hay W.W. Neonatal Nutrition and Metabolism. 2th Ed. Jr. Cambridge University Press. 2006.
9. Gomella T.L. Neonatology: Management, Procedures, On-Call Problems, Diseases, and Drugs. McGraw-Hill. 2013.
10. von Kries R., Kreppel S., Becker A., Tangermann R., Gobel U. Acarboxyprothrombin concentration (corrected) after oral prophylactic vitamin K // Arch. Dis. Child. 1987. Vol. 62. P. 938-940.
11. Nimavat D.J. Hemorrhagic Disease of Newborn. Updated: Sep 26, 2014. https://emedicine.medscape.com/article/974489-overview.
12. Laubscher B., Banziger O., Schubiger G., the Swiss Paediatric Surveillance Unit (SPSU). Prevention of vitamin K deficiency bleeding with three oral mixed micellar phylloquinone doses: results of a 6-year (2005-2011) surveillance in Switzerland // Eur. J. Pediatr. 2013. Vol. 172. P. 357-360.
13. Shearer M.J. Vitamin K deficiency bleeding (VKDB) in early infancy // Blood. Rev. 2009. Vol. 23. P. 49-59.
14. Burke C.W. Vitamin K Deficiency Bleeding // J. Pediatr Health Care. 2013. Vol. 27, N 3. P. 215-221.
15. Шабалов Н.П. Неонатология. 5-е изд., испр. и доп., в 2 т. М.: МЕДпресс-информ, 2009. 1504 с. (in Russian)
16. Schulte R., Jordan L.C., Morad A., Naftel R.P., Wellons J.C., Sidonio R. Rise in late onset vitamin K deficiency bleeding in young infants because of omission or refusal of prophylaxis at Birth // Pediatric Neurology. 2014. Vol. 50. P. 564-568.
17. Лобанов А.И., Лобанова О.Г. Геморрагическая болезнь новорожденных с поздним дебютом. Вопросы современной педиатрии. 2011. № 1. С. 167-171.
18. Feldman A.G., Sokol R.J. Neonatal cholestasis // Neoreviews. 2013. Vol. 14, N 2. e63.
19. van Hasselt P.M., de KoningT.J., KvistN. et al. Prevention of Vitamin K Deficiency Bleeding in Breastfed Infants: Lessons From the Dutch and Danish Biliary Atresia Registries. Pediatrics. 2008. Vol. 121, N 4. e857- e863.
20. Notes from the field: late vitamin K deficiency bleeding in infants whose parents declined vitamin K prophylaxis // Tennessee. MMWR Morb Mortal Wkly Rep. 2013. Vol. 15, N 62 (45). P. 901-902.
21. Volpe J.J. Neurology of the Newborn. 5th ed. Philadelphia: Elsevier, 2008. 1094 p.
22. Volpe J.J. Intracranial Hemorrhage in Early Infancyd Renewed Importance of Vitamin K Deficiency // Pediatric Neurology. 2014. Vol. 50. P. 545-6.
23. Урсуленко Е.В., Мартынович Н.Н., Толмачева О.П., Ованесян С.В. Случай поздней геморрагической болезни у ребенка 6 недель, осложнившейся развитием острого нарушения мозгового кровообращения и гемотораксом // Сибирский медицинский журнал. 2012. № 2. С. 114-118.
24. Ляпин А.П., Касаткина Т.П., Рубин А.Н. и др. Внутричерепные ровоизлияния как проявление поздней геморрагической болезни новоожденных // Педиатрия, 2013. № 2. С. 38-42.
25. Cornelissen M., Von Kries R., Schubiger G., Loughnan PM. Prevention of vitamin K deficiency bleeding: efficacy of different multiple oral dose schedules of vitamin K // Eur. J. Pediatr. 1997. Vol. 156, N 2. P. 126-130.
26. Von Kries R. Oral versus intramuscular phytomenadione: Safety and efficacy compared // Drug Safety. 1999. Vol. 21, N 1. P. 1-6.
27. Wariyar U., Hilton S., Pagan J., Tin W., Hey E. Six years’ experience of prophylactic oral vitamin K // Arch. Dis. Child Fetal Neonatal. 2000. Vol. 82, N 1. F64-F68.
28. Puckett R.M., Offringa M. Prophylactic vitamin K for vitamin K deficiency bleeding in neonates // Cochrane Database of Systematic Reviews. 2000. Is. 4, N CD002776.
29. Чупрова А.В. Система неонатального гомеостаза в норме и при патологии (научный обзор) // Бюлл. СО РАМН. 2005. № 4 (118). С. 13-19.
30. Шабалов Н.П., Иванов Д.О. Шабалова Н.Н. Гемостаз в динамике первой недели жизни как отражение механизмов адаптации к внеутробной жизни новорожденного // Педиатрия. 2000. N 3. С. 84-91.
31. Andrew M., Paes B., Milner R., et al. Development of the human coagulation system in the full-term infant // Blood. 1987. Vol. 70. P. 165-172.
32. Andrew M., Paes B., Milner R. et al. Development of the human coagulation system in the healthy premature infant // Blood. 1988. Vol. 72. P. 1651-1657.
33. Mitsiakos G., Papaioannou G. et al. Haemostatic profile of fullterm, healthy, small for gestational age neonates // Thrombosis Research. 2009. Vol. 124. P. 288-291.
34. Motta M., Russo F.G. Developmental haemostasis in moderate and late preterm infants // Ital. J. Pediatr. 2014. 40 (Suppl 2): A38.
35. Дорофеева Е.И., Демихов В.Г. и др. Особенности гемостаза у новорожденных детей // Тромбоз, гемостаз и реология. 2013. № 1 (53). C. 44-47.
36. Monagle P., Massicotte P. Developmental haemostasis: Secondary haemostasis // Seminars in Fetal & Neonatal Medicine. 2011. Vol. 16. P. 294-300.
37. Дегтярев Д.Н., Карпова А.Л., Мебелова И.И., Нароган М.В. и др. Проект клинических рекомендаций по диагностике и лечению геморрагической болезни новорожденных // Неонатология, 2015. № 2. С. 75-86.
38. Красталева И.М., Шишко Г.А. и др. Проблемы лечения геморрагической болезни у новорожденных // Медицинские новости. 2014. № 9 (240). С. 60-62.
39. Alarcon P., Werner E., Christensen R.D. Neonatal hematology pathogenesis, diagnosis, and Management of Hematologic Problems 2nd Edition // Cambridge University Press. 2013.
40. Report of Committe on Nutrition: vitamin K compounds and the water-soluble analogues // pediatrics. 1961. Vol. 28. P. 501-507.
41. Shahal Y., Zmora E., Katz M., Mazor D., Meyerstein N. Effect of vitamin K on neonatal erythrocytes // Biol. Neonate. 1992. Vol. 62. N 6. P. 373-8.
42. Ipema H.J. Use of oral vitamin K for prevention of late vitamin K deficiency bleeding in neonates when injectable vitamin K is not available // Ann. Pharmacother. 2012. Vol. 46. P. 879-883.
43. Takahashi D., Shirahata A., Itoh S., Takahashi Y. et al. Vitamin K prophylaxis and late vitamin K deficiency bleeding in infants: Fifth nationwide survey in Japan // Pediatric. International. 2011. Vol. 53. P. 897-901.
44. Chawla D., Deorari A.K., Saxena R., Paul V.K. et al. Vitamin K1 versus vitamin K3 for prevention of subclinical vitamin deficiency: a randomized controlled trial // Indian. Pediatr. 2007. Vol. 44, N 11. P. 817-822.
45. Dyggve H.V., Dam H., Sondergaard E. Comparison of the action of vitamin K1 with that of synkavit in the newborn // Acta Paediatrica. 1954. Vol. 43. N 1. P. 27-31.
Геморрагическая болезнь новорожденных (ГБН) – это заболевание детей неонатального периода, проявляющееся повышенной кровоточивостью вследствие недостаточности факторов свертывания крови, активность которых зависит от содержания витамина К в организме. Геморрагическую болезнь впервые описал в 1893 г. Chartes Townsend. Первоначально термин применяли для того, чтобы отличить геморрагические состояния, наблюдаемые только в период новорожденности (преимущественно 1-я неделя), от геморрагических состояний, продолжающихся всю жизнь, таких как гемофилия [13].
Поздняя ГБН – заболевание детей первых 512 нед жизни вследствие алиментарного дефицита витамина К. Недостаточное поступление этого витамина с грудным молоком и различные сопутствующие заболевания ребенка способствуют нарушению синтеза в его организме «коагулологически» активных факторов свертывания крови, что в ряде случаев приводит к геморрагическим осложнениям, в том числе и кровоизлияниям в головной мозг.
Позднюю ГБН впервые идентифицировали в 70-х годах прошлого века. В различных странах врачи-педиатры обращали внимание на то, что у детей, находящихся на грудном вскармливании (обычно в первые 3 мес жизни), многие заболевания чаще осложняются повышенной кровоточивостью, чем у младенцев, находящихся на искусственном вскармливании. Частота поздней ГБН составляет от 4 до 10 случаев на 10 000 новорожденных (в Англии 1:1200, Японии 1:1700, Таиланде 3:1200) [10].
Среди сопутствующих состояний или заболеваний в период новорожденности, на фоне которых наиболее часто нарушается пассаж витамина К в организме ребенка, выделяют: нарушение бактериальной колонизации желудочного тракта, особенно вследствие длительного приема антибактериальных препаратов матерью или ребенком, ферментопатии, синдром мальабсорбции. Нарушению поступления в системный кровоток младенца витамина К и его метаболизма способствуют перенесенная гипоксия, недоношенность и незрелость младенца, состояния, приведшие к нарушению печеночного кровотока, последствия внутриутробной инфекции, гепатиты, билиарная атрезия с исходом в цирроз печени, гепатоцеллюлярные заболевания [11, 12] .
Цель настоящего исследования: изучить особенности клинических и лабораторных проявлений нарушений свертывания крови, определить способы профилактики и лечения детей с поздней ГБН.
Проведен ретроспективный анализ историй болезни 29 детей, поступивших для лечения в РНПЦ детской онкологии, гематологии и иммунологии Минздрава Республики Беларусь в 20012012 гг. по поводу поздней ГБН. Возраст новорожденных составил 415 нед, масса тела 4,14,9 кг. Проанализировали результаты общеклинических, биохимических и коагулогических исследований.
После введения концентрата неактивированных факторов протромбинового комплекса кровотечение у всех детей было остановлено в течение 1560 мин. Препаратом выбора для коррекции нарушений свертывания крови является концентрат неактивированных витамин K-зависимых факторов свертывания (II, VII, IX и X в комплексе с протеином С и протеином S).
Внедрение в практическое здравоохранение мероприятий по профилактике алиментарного дефицита витамина К путем приема кормящей матерью поливитаминных комплексов, содержащих витамин К, позволит избежать развития поздней геморрагической болезни с последующей инвалидизацией новорожденных за счет предотвращения геморрагических осложнений.
ЛИТЕРАТУРА 1. Greenberg C. S., Orthner C. L. // Wintrobes Clinical Hematology. Philadelphia, 1997. Vol. 1. P. 685-764. 2. Hougie C., Barrow E. M., Graham J. B. // J. Clin. Invest. 1957. Vol. 6, № 3. P. 485-496. 3. Reverdiau-Moalic P., Delahousse B., Body G., et al. // Blood. 1996. Vol. 88. P. 900-906. 4. Dam H. // Nature. 1935. Vol. 135. P. 652. 5. Кухта В. К., Морозкина Т. С., Олецкий Э. И., Таганович А. Д. Биологическая химия: Учебник / Под ред. А. Д. Тагановича. Минск, М., 2008. 6. Sutor A. // Thromb. Haemost. 1999. Vol. 81, № 3. P. 456-461. 7. Widdershoven J., van Munster P., de Abreu R., et al. // Clin. Chem. Nov. 1987. Vol. 33, № 11. P. 2074-2078. 8. Andrew M., Vegh P., Johnston M., et al. // Blood. 1992. Vol. 80, № 8. P. 1998-2005. 9. Practical Hemostasis and Thrombosis / Ed. D. OShaughnessy, M. Makris, D. Lillicrap. Blackwell Publishing, 2005. 10. Pichler E., Pichler L. // Wien Med. Wochenschr. 2008. Bd. 158. S. 385-395. 11. Andrew M., Paes B., Milner R., et al. // Blood. 1987. Vol. 70, № 1. P. 165-170. 12. Ланцковский Ф. Детская онкология и гематология. М., 2005. 13. Booth S. L., Suttie J. W. // J. Nutr. 1998. Vol. 128, № 5. P. 785-788. 14. Godier A., Susen S., Samama C. M. // J. Thromb. Haemost. 2010. Vol. 8. P. 2592-2595. 15. Румянцев А. Г., Масчан А. А., Самочатова Е. В. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. M., 2006. 16. Porretti L. // Blood Transfus. 2012. Vol. 10. P. 351-359. 17. Land W. G. // Transfus. Med. Hemother. 2013. Vol. 40. P. 313. 18. Beckers E. A. M. // Transfusion. 2011. Vol. 51. P. 1278-1283. 19. Honickel M., Rieg A., Rossaint R., et al. // Thromb. Haemost. 2011. Vol. 106, № 4. P. 724-733.
Поступила 28.11.13.
Адрес для корреспонденции: Дмитриев Вячеслав Васильевич. Республиканский научно-практический центр детскойонкологии, гематологии и иммунологии. 223053, Минский р-н, д. Боровляны, ул. Фрунзенская, 43; сл. тел. (8-017) 265-42-22.
Ключевые слова:
диагностика, лечение, новорожденные, поздняя геморрагическая болезнь, профилактика, свертывание крови
Автор(ы):
Дмитриев В. В., Дмитриев Е. В.
Медучреждение: «РНПЦ детской онкологии, гематологии и иммунологии Минздрава Республики Беларусь»