Церебральная амилоидная ангиопатия
Амилоидная ангиопатия — заболевание мелких артериол с отложением белка (амилоида) в стенке сосуда, что снижает эластичность и повышает ломкость сосудов. При этом образуются микрогеморрагии, которые уверенно диагностируются на Т2*. Кроме того, это проявляется в виде внутримозговых кровоизлияний с образованием гематом в субкортикальных участка (лобарные гематомы), в отличии от «типичных» гематом, возникающих при геморрагическом инсульте на фоне гипертонической болезни с расположением гематом в базальных ядрах. Данное заболевание встречается в основном у лиц пожилого и старческого возраста.
Рис.1 Церебральная амилоидная ангиопатия с наличием мелких геморрагий в полушариях мозга (белые стрелки), а так же следов перенесенного кровоизлияния и лобарной гематомы в левой теменной доле (жёлтые стрелки).
Рис.2 Сгусток крови в левой теменной доле, образованный кровоизлиянием на фоне амилоидной ангиопатии (рис.2а). Мелкие петехеальные кровоизлияния в веществе мозга, хорошо дифференцируемые на ИП GRE (рис.2b), Внутримозговая острая лобарная гематома в теменной доле справа на КТ (рис.2с).
Болезнь Бинсвангера
Субкортикальная гипертоническая атеросклеротическая лейкоэнцефалопатия (болезни Бинсвангера) — поражение белого вещества головного мозга с распространенным глиозом на фоне длительно протекающего спазма артерий в силу гипертонической болезни, церебральной атеросклероза с хронической недостаточностью мозгового кровообращения, частыми гипертоническими кризами, сопровождающееся энцефалопатией и инсультными симптомами.
Рис.3 Диффузно распространенные обширные двусторонние относительно симметричные участки глиоза, расположенные в полуовальных центрах, имеющие гиперинтенсивный МР-сигнал по Т2 и Flair (рис.3а, рис.3b), а так же гиподенсными зонами на КТ (рис.3с).
Причины и распространенность патологической извитости
Патологическая извитость развивается всегда из-за удлинения внутренней сонной артерии, которая вынуждено складывается в изгибы или даже петли. Избыточная длина внутренней сонной артерии часто закладывается еще в период эмбрионального развития, то есть извитость артерии чаще всего врожденная. С возрастом может происходить дальнейшее закручивание избыточной сонной артерии в петлю. По мнению некоторых исследователей патологическая извитость может являться причиной неврологических и интеллектуальных проблем у детей дошкольного и младшего школьного возраста.
Удлинение внутренней сонной артерии может развиваться и в результате запущенной гипертонической болезни, когда постоянно повышенное артериальное давление вызывает изменение стенки артерии и ее изгибы. Такая извитость редко влияет на мозговую гемодинамику и чаще является феноменом, случайно выявляемым при УЗИ магистральных артерий.
Патологическая извитость сонных артерий была выявлена у 16% пациентов, умерших от ишемического инсульта, более 23% детей, перенесших ишемический инсульт имели патологическую извитость. При обследовании пациентов, проходивших лечение по поводу нарушений мозгового кровобращения, патологическая извитость при ультразвуковом ангиосканировании была выявлена у 12% . Различные нарушения хода внутренних сонных артерий, по данным патологоанатомических исследований были выявлены у 40% людей.
Дисциркуляторная энцефалопатия
Сосудистая энцефалопатия (микроангиопатия, хроническая недостаточность мозгового кровообращения) — появление очагов глиоза МРТ и КТ, признаков клинической энцефалопатии, вызванных атеросклерозом мозговых артерий, нарушением обмена жиров и углеводов, а так же провоцируемая курением и артериальной гипертонией.
Рис.4 Очаги глиоза в белом веществе, расположенные в полуовальных центрах и субкортикально, имеющие повышенный МР-сигнал по Т2 и Flair на МРТ (рис.4а и рис.4b), а так же сниженную плотность на КТ (рис.4с).
Методы лечения в Инновационном сосудистом центре
Сосудистые хирургии нашей клиники имеют значительный опыт уникальных операций на сонных артериях при патологической извитости. Основной проблемой для хирургического лечение является определение четких показаний к оперативному лечению. В нашей клинике разработан четкий диагностический протокол, позволяющий определить клиническое значение той или иной извитости и степень ее влияния на мозговой кровоток. Опыт успешных операций нашей клиники при патологической извитости превышает 200 случаев.
Стеноз мозговых артерий
Рис.6 Сужение просвета артерий, видимое по выпадению МР-сигнала от проекции участка артерии за счет снижения скорости кровотока на фоне стеноза. Стеноз участка левой позвоночной артерии (стрелка на рис.6а), стеноз изгиба супраклиноидного сегмента правой внутренней сонной артерии (стрелки и пунктирная линия на рис.6b), а так же стеноз сегмента основной артерии и множественные участки стеноза задних мозговых артерий (стрелки на рис.6с).
Симптомы
Как уже говорилось ранее, на ранних стадиях признаки гипоплазии могут вовсе отсутствовать. Развитие патологического процесса может длиться годами и только при сужении артериального просвета до определенной величины появится какая-то симптоматика.
Парадокс заключается в том, что при полном отсутствии проявлений патологии на ранних стадиях, вступление болезни в так называемую активную фазу, сопровождается богатейшей клинической картиной. Однако у каждого больного при сужении позвоночной артерии (правой или левой) симптоматика проявляется совершенно по-разному:
- Головные боли разного характера и специфики. Болезненные ощущения могут быть периодическими или постоянными, усиливаться после интенсивных физических нагрузок или проявляться в покое. При гипоплазии артерии головного мозга боли также отличаются по интенсивности, от сильных, которые приходится купировать анальгетиками, до слабых, которые многие переносят без лекарств. Что же касается специфики, в большинстве случаев речь идет о тупых и ноющих болях, однако, они могут быть и острыми, колющими.
- Беспричинные головокружения свидетельствуют о нарушениях мозгового кровообращения. Этот клинический признак является вторым по частоте проявлений и также носит разный характер. В одних случаях головокружения не связаны с физическими нагрузками, эмоциональным состоянием и прочими факторами, они просто возникают учащенно и проходят также бесследно, как появились. В иных случаях головокружения начинаются после смены положения тела, каких-либо нагрузок, стрессов и прочего.
- Часто гипоплазия правой позвоночной артерии сопровождается эмоциональными нарушениями. За человеком замечаются учащенные и резкие перемены настроения, угнетенность, которая может длиться до 2–3 дня, затем исчезать без следа, постоянная вялость, состояния апатии и даже депрессивные состояния.
- Если же говорить о гипоплазии левой позвоночной артерии, этой форме патологического процесса чаще присущи перепады артериального давления. Да, при правосторонней гипоплазии они тоже присутствуют в клинической картине, но в данном случае отмечаются чаще.
- Патология отражается на организме пациента состоянием сонливости, усталости, ощущением разбитости. Люди с гипоплазией плохо высыпаются даже при полноценном крепком восьмичасовом сне, пребывают в вялом состоянии, часто зевают.
- Патология может сопровождаться нарушениями, затрагивающими вестибулярный аппарат. В таком случае среди клинических признаков также присутствуют головокружения, но они становятся более интенсивными, к ним присоединяются тошнота, излишняя потливость, изменение цвета кожных покровов (бледность или наоборот, покраснение лица). Ярчайшими признаками поражения вестибулярного аппарата и прогрессирования данной патологии будут нарушения координации. Появляется потеря равновесия, походка становится неуверенной, человека шатает из стороны в сторону, все движения становятся нечеткими, может развиться потеря в пространстве.
Со временем симптомы усугубляются, тяжелые формы гипоплазии позвоночной артерии сопровождаются поражениями нервной системы. С одной стороны, это выражается в онемении отдельных участков тела (чаще конечностей), с другой, зрительными галлюцинациями. В некоторых случаях даже происходит частичный паралич.
Девиации и изгибы мозговых артерий
Девиации и изгибы часто встречаются в экстракраниальных брахиоцефальных и позвоночных артериях у пожилых пациентов. Они могут быть пологими С-образными, S-образными, иметь причудливую петлеобразную или спиралеобразную форму (койлинг), а так же изгиб под острым углом (кинкинг). Такие изгибы артерий формируются на фоне врожденной увеличенной длины артерии, при артеросклеротических изменениях, артериальной гипертонии и изменениях шейного отдела позвоночника на фоне дегенеративных изменений или иных патологических состояниях, приводящих к уменьшению высоты шеи. Изгибы сонных артерий провоцируют снижение скорости кровотока, формируют турбулентность потока крови и могут приводить к отложению холестерина с формированием атеросклеротических бляшек и повреждению интимы с расслоением (диссекцией).
Рис.8 Выраженные двусторонние S-образные изгибы внутренних сонных артерий на Т2 в корональном срезе (стрелки на рис.8а). Ангиография более чётко демонстрирует наличие изгиба под острым углом (кинкинг) экстракраниального сегмента левой внутренней сонной артерии (стрелка на рис.8b). с-образный изгиб левой позвоночной артерии (стрелка на рис.8с).
Причины
Гипоплазия, то есть аномалия развития тканей или органа, которая в данном случае касается позвоночных артерий, как уже говорилось ранее, является врождённой патологией. Это значит, основная причина недоразвития артерии заключается в проблемах на эмбриональных стадиях. В то же время можно выделить ряд факторов, которые способствуют тому, что гипоплазия позвоночной артерии возникнет у новорожденного и проявится в определенном возрасте:
- Перенесенные матерью инфекционные заболевания во время беременности.
- Воздействие радиационного или ионизирующего облучения на плод.
- Механические травмы, среди которых удары, ушибы и другие повреждения брюшной полости в момент вынашивания ребенка.
- Сужение артерии у новорожденного может быть спровоцировано генетической предрасположенность, например, если в анамнезе семьи фигурируют патологии сосудистого характера.
- Токсический фактор – если во время беременности женщина курила, злоупотребляла алкоголем, работала на химическом предприятии, длительное время принимала какие-либо сильнодействующие препараты, высока вероятность того, гипоплазия может быть связана с каждым из этих факторов.
Венозная ангиома
Венозная дисплазия (ангиома) — врожденная сосудистая мальформация в виде увеличенной расширенной вены, впадающей в конвекситальную вену или в субэпендимарную вену, которая в веществе мозга распадается на множественные мелкие венулы (имеет вид «головы медузы»), хорошо накапливает контраст и часто располагается в субкортикальных, паравентрикулярных отделах, базальных ядрах, а так же мозжечке.
Рис.9 Венозная ангиома в базальных ядрах справа в виде гиперденсвного внутримозгового сосуда на КТ (рис.9а), гиперинтенсивной полосы на Т2 (рис.9b) и накапливающая контраст на Т1 после внутривенного усиления (рис.9с).
Рис.10 Слабо гиперденсный очаг на аксиальном КТ срезе – венозная ангиома (стрелка на рис.10а) и гиперденсная полоса на корональном срезе (стрелка на рис.10b), накапливающая контраст после внутривенного усиления с демонстраницей её связи с внутренней мозговой и большой веной мозга (стрелки на рис.10с).
Варикоз (аневризма) вены Галлена
Варикозное расширение большой вены мозга (вены Галлена) – врожденная сосудистая мальформация, сочетающаяся часто с другими сосудистыми аномалиями, например расширением прямого синуса. Название аневризма не вполне подходит для данной патологии, так как в контексте вены более приемлема трактовка варикозного расширения.
Рис.11 На МРТ варикозное расширение (аневризма) вены Галлена имеет пониженный МР-сигнал на Т2 и сниженный или изоинтенсивный по Т1 (стрелки на рис.11а и рис.11b). Контрастное усиление так же характерно с заполнением контрастом полости расширенного участка (стрелка на рис.11с).
Кавернозная ангиома
Кавернозная ангиома (кавернома) – очаг или образование сосудистой природы, врожденного происхождения (аномалия развития), имеющий вид области, окруженной кольцом гемосидерина и состоящей из полостей (каверн), заполненных плазмой крови. Каверномы могут быть разными размерами от мелких до гигантских, располагаются в любом участке головного мозга, а так же в спинном мозге. Кроме того, могут быть множественные каверномы. Осложнения не часты, в основном это кровоизлияния или кровотечения.
Рис.12 Мелкая кавернома (образование с ободком гипоиннтенсивного гемосидерина и гиперинтенсивным центром на Т2) в белом веществе правой лобной доли (стрелка на рис.12а). В базальных ядрах справа имеется гетерогенная область слабо гиперденсной структуры на КТ (стрелка на рис.12b). Повышенной чувствительностью к кавернозным ангиомам обладает ИП GRE (Т2*) или SWI / SWAN за счет значительной восприимчивости к дериватам гемосидерина (стрелка на рис.12с).
Мнение специалиста, нейрохирурга Андрея Александровича Зуева:
Некоторое время назад каверномы все старались удалять, но годы спустя доказали, что риск операции при этом образовании и риски естественного течения заболевания примерно равнозначны. Теперь показанием к операции являются только эпилептогенные каверномы и каверномы с высоким риском кровотечения. Операция, в большинстве случаев, простая, если кавернома не локализуется в стволе мозга или в функционально значимой зоне.
Рис.13 Кавернома в спинном мозге с характерными признаками (стрелка на рис.13а). Нативный (безконтрастный) вид каверномы на Т1 с мелкоточечными участками повышенного МР-сигнала (рис.13b), слабо накапливающей контраст после в/в усиления (рис.13с).
Всё о лечении гипоплазии позвоночных артерий
Большинство заболеваний, поражающих головной мозг, имеют сосудистую природу. Гипоплазия – не исключение. Это врождённая патология, затрагивающая внутричерепное кровоснабжение. Сущность заболевания, его симптомы, диагностика и лечение – вот предмет исследования данной статьи.
Большинство заболеваний, поражающих головной мозг, имеют сосудистую природу. Гипоплазия – не исключение. Это врождённая патология, затрагивающая внутричерепное кровоснабжение. Сущность заболевания, его симптомы, диагностика и лечение – вот предмет исследования данной статьи.
Диагностика
Выявить гипоплазию на ранних стадиях ее развития чрезвычайно сложно из-за отсутствия характерных симптомов и проявлений. Существует три основных метода диагностики сужения просвета позвоночных артерий, которые включают:
- Ультразвуковое исследование сосудов головы и шеи. В ходе проведения процедуры изображение артерии фиксируется с помощью аппарата УЗИ, после чего проводится анализ типа, интенсивности и диаметра кровотока (серьезным дефектом считается сужение диаметра сосудов до 2-х мм и меньше).
- Томография головы и шеи. Посредством компьютерных и магнитно-резонансных томографов оценивается состояние сосудов, заполненных специальным контрастным веществом.
- Ангиография. Рентгенографическое исследование, которое выявляет аномалии в строении сосудов и позвоночных артерий.
Кроме того, для диагностики сопутствующих заболеваний, которые могут повлиять на течение гипоплазии (например, патологии позвонков шейного отдела), врач может назначить дополнительные исследования.
- Гипоплазия левой позвоночной артерии: что это такое, причины и особенности лечения
На стадии ярко выраженных клинических симптомов гипоплазии правой или левой позвоночной артерии назначается консервативное лечение сосудорасширяющими препаратами – они устраняют неприятные явления и улучшают качество жизни пациента. В случаях, когда имеется риск образования тромбов, показан прием антикоагулянтов (медикаментов, разжижающих кровь).
Когда диагностируется гипоплазия позвоночной артерии
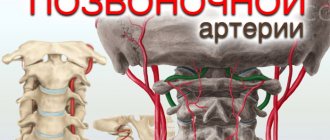
Именно в интракраниальном сегменте чаще всего наблюдается патологическое сужение позвоночных артерий. Диаметр этих магистральных сосудов неравномерен по всей длине и колеблется от самой малой величины — 2 мм, до просвета величиной в 4.5 мм. Нормальный диаметр ПА обычно лежит в пределах от 3.5 до 4 мм.
Гипоплазией позвоночной артерии считается ее критическое сужение до двух миллиметров. Также возможен врожденный обрыв или полное отсутствие одной из ветвей — такая патология называется аплазией.
- Неправильное положение плода в утробе матери, из-за чего он подвергается нежелательному механическому воздействию.
- Вынашивание беременности в негативных условиях, отрицательно сказывающихся на развитии эмбриона: употребление матерью алкоголя, наркотиков, курение;
- нахождение будущей роженицы во вредной среде (работа на химическом производстве, проживание на загазованной или радиоактивной территории );
- инфекционные патологии, травмы, прием лекарств, интоксикации, отравления в период беременности.
Синдром Барре-Льеу
Классический признак нарушения питания затылочной доли мозга. Дает головную боль, тошноту, редко рвоту.
Также снижается ориентация в пространстве, обнаруживается патологическая усталость и утомляемость.
Бессонница, депрессивный настрой, постоянно подавленное состояние, апатичность и нежелание что-либо делать.
Гипоплазия позвоночной артерии: что это такое?
Одной из самых распространенных патологий позвоночных артерий является их гипоплазия, то есть недоразвитость. Проявляется эта аномалия значительным сужением просвета сосуда (он становится менее 2 мм). Левая позвоночная артерия поражается чаще, чем правая. Возникает гипоплазия внутриутробно – это врожденная патология. Спровоцировать появление рассматриваемой болезни могут различные факторы:
- Вредные привычки будущей мамы.
- Употребление женщиной опасных лекарств на ранних сроках беременности.
- Внутриутробное инфицирование эмбриона.
- Влияние на беременную радиации.
Стоит также отметить, что довольно часто гипоплазия обнаруживается у детей, которые не имеют в анамнезе ни одного из перечисленных факторов.
Методики лечения
Для лечения гипоплазии позвоночных артерий применяются методы консервативной терапии и оперативное лечение.
Для лечения гипоплазии позвоночных артерий применяются методы консервативной терапии и оперативное лечение.
- Что такое гипоплазия правой или левой позвоночных артерий, как лечить это заболевание?
Диагностика гипоплазии позвоночной артерии головного мозга
При гипоплазии позвоночной артерии головного мозга присутствуют типичные клинические симптомы, которые являются прямым показанием для назначения ряда клинических исследований. Обычно диагностика включает в себя:
- рентгенографический снимок шейного отдела позвоночника;
- МРТ структур головного мозга;
- дуплексное сканирование церебральных кровеносных сосудов;
- ангиография с введением контрастного вещества.
Стоит обратить внимание на следующие негативные проявления болезни:
Анатомические варианты мозговых артерий
Анатомические варианты хода мозговых артерий и строения виллизиева круга обусловлены вариантным разнообразием и проявлением особенностей строения. Наиболее частые варианты могут быть в виде неразвитости (аплазии) или недоразвитости (гипоплазии) какой-либо артерии, а так же появлением добавочной (сверхкомплектной) артерии и вариантами слияния артерий. В данном случае аномалия развития и анатомический вариант нормы разделять может быть затруднительно. Некоторые варианты и аномалии представлены ниже.
Рис.14 Гипоплазия проксимального сегмента (А1) правой передней мозговой артерии (стрелка на рис.14а), при которой оба дистальных сегмента (А2) ПМА являются продолжением как бы проксимальной левой ПМА из бассейна левой внутренней сонной артерии, такой вариант называется – неполной передней трифуркацией левой внутренней сонной артерии. Апоплазия проксимального сегмента (А1) правой ПМА (стрелка и пунктир на рис.14b), при которой оба дистальных сегмента (А2) ПМА являются продолжением только проксимальной (А1) левой ПМА из бассейна левой ВСА, такой вариант называется – полная передняя трифуркация левой ВСА. На рис.11с отмечается выраженная асимметрия диаметра позвоночных артерий (S>D) – гипоплазия правой позвоночной артерии (стрелка на рис.14с).
Рис.15 Левая задняя мозговая артерия является полным продолжением левой задней соединительной артерии из бассейна левой ВСА, при полной аплазии проксимального сегмента (Р1) левой задней мозговой артерии (ЗМА) – анатомический вариант виллизиева круга в виде так называемой задней трифуркации левой внутренней сонной артерии (стрелки на рис.15а). Двусторонняя гипоплазия позвоночных артерий, преимущественно выраженная слева (стрелки на рис.15b). Фенестрация основной артерии в виде наличия «окна» с локальным непродолжительным удвоением основной артерии или преждевременным слиянием основных артерий с последующим расщеплением (стрелка на рис.15с).
Рис.16 Имеется односторонняя аплазия левой задней соединительной артерии (пунктир на рис.16а), при нормально развитой противопроложной ЗСА и передней соединительной артерии (ПСА) (стрелки на рис.16а). Двусторонняя гипоплазия проксимальных отделов задних мозговых артерий (P1) (стрелки на рис.16b) с неполной двусторонней задней трифуркацией ЗМА, а так же гипоплазии левой позвоночной артерии (пунктир на рис.16b). Отсутствие слияния левой позвоночной артерии (стрелка на рис.16с) с правой ПА, при этом лПА так и остаётся отдельным сосудом, полностью переходя в левую заднюю нижнюю мозжечковую артерию.
Рис.17 Односторонняя гипоплазия проксимального сегмента (Р1) левой ЗМА (стрелка на рис.17а) с наличием неполной (частичной) задней трифуркацией левой ВСА. Имеется добавочная передняя мозговая артерия (посткоммуникатный семгент – Р2), отходящая от середины передней соединительной артерии (ПСА) (стрелка на рис.17b). Гипоплазированная права ПА полностью переходит в правую заднюю нижнюю мозжечковую артерию (стрелка на рис.17с), без слияния с левой ПА, которая при этом гиперплазирована и целиком продолжается в основную артерию, без чёткой анатомической границы разделения между ПА и ОА.
Международный неврологический журнал 3 (57) 2013
Цель: оценить роль аномалий церебральных артерий (ЦА) в развитии церебрального ишемического инсульта (ЦИИ) у пациентов молодого возраста.
Материалы и методы исследования. Обследовано 143 пациента с диагностированным ЦИИ, среди которых у 67 (46,9 %) выявлены аномалии ЦА (мужчин — 29, женщин — 38), возраст больных — от 19 до 50 лет (средний возраст — 37,7 ± 1,2 года). Всем пациентам выполняли комплексное обследование, включающее клинико-неврологическое, клинико-лабораторное и клинико-инструментальное исследования.
Результаты. У 46,9 % пациентов, вошедших в исследование, по данным МРТ головного мозга в режиме ангиографии были выявлены аномалии ЦА. Аномалии интрацеребральных артерий (ИЦА) диагностированы у 38 (56,7 %), аномалии прецеребральных артерий (ПЦА) — у 53 (79,1 %) больных с ЦИИ и их комбинация — у 38 (56,7 %) пациентов. Церебральное кровообращение оценивалось при помощи транскраниального дуплексного сканирования сосудов основания головного мозга и ультразвуковой допплерографии сосудов шеи.
У всех пациентов с аномалиями ИЦА и ПЦА выявлено снижение коллатерального кровотока головного мозга. Наиболее значимые гемодинамические изменения обнаружены у пациентов с аплазией задней соединительной артерии (ЗСА), гипоплазиями передней и задней мозговых артерий (ЗМА) и в вариантах сочетания их с задней трифуркацией левой внутренней сонной артерии (ВСА). Патологическая извитость ВСА выявлена у 42 (79,2 %) пациентов: одной — у 29 (69 %), обеих ВСА — у 14 (33,3 %), S-образная извитость — у 31 (73,8 %), петлеобразная — у 11 (26,2 %), гипоплазия обеих позвоночных артерий (ПА) — у 24 (57,1 %), аплазия одной ПА — у 7 (16,7 %) больных. Извитость ВСА считалась патологической, если в месте максимальной ангуляции зарегистрированы локальные нарушения гемодинамики в виде турбуленции и расширения допплеровского спектра частот. Гипоперфузия обнаружена у 37 (55,2 %) пациентов: с аплазией ЗСА — у 7 (16,7 %), одной ПА — у 7 (16,7 %), гипоплазией ЗМА — у 23 (62,1 %) больных.
Выводы. Выявлена высокая частота встречаемости аномалий ЦА у 46,9 % лиц молодого возраста, перенесших ЦИИ. Среди аномалий ИЦА наиболее часто (в 56,7 % случаев) встречалось разобщение виллизиева круга — вследствие отсутствия одной или обеих соединительных артерий. При обследовании ПЦА установлено их поражение в 79,1 % случаев — патологическая извитость ВСА. При проведении ультразвуковых методов исследования выявлено снижение скорости кровотока, асимметрия кровотока по ЦА и гиперперфузия по патологически извитым и гипоплазированным сосудам, что свидетельствует о наличии фокальной гипоперфузии в участках с неадекватной циркуляцией и дефицита коллатерального кровотока на границе бассейнов кровоснабжения головного мозга.
Анатомические варианты вен мозга
Рис.19 Снижение кровотока по верхнему сагиттальному синусу за счет его гипоплазии (рис.19а). Аплазия правого поперечного синуса (пунктирная линия на рис.19b) с компенсаторно избыточно развитыми затылочным и правым каменистым синусами (стрелки на рис.19). Высокое расположение луковицы ярёмной вены с расположением её выше уровня foramen lacerum, при котором оно создаёт асимметричную картинку и формирует ложное впечатление наличия образования (стрелка на рис.19с).
Нейроваскулярный конфликт
Нейроваскулярный конфликт – патологическое взаимодействие артерии и нерва, наиболее часто проявляющееся в области мостомозжечкового угла в виде нарушения анатомического взаимоотношения между VII или/и VIII парой черепных нервов и ПА или ветвью ОА. При этом может не быть дислокации нерва артерией или иначе – дислокация артерией нерва не всегда клинически проявляется неврологической сиптоматикой.
Рис.21 ПА дислоцирована (белая стрелка на рис.21а) и натягивает левый преддверно-улитковый нерв (чёрная стрелка на рис.21а). МРА демонстрирует дислокацию ПА влево (стрелка на рис.21b). Близкое расположение артерии и нерва в области правого мостомозжечкового угла (ММУ) (стрелка на рис.21с).
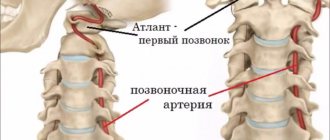
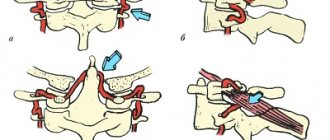
Вопросы профилактики и лечения остеохондроза (ОСХ) позвоночника получает все особую весомость из-за прогрессирования числа пациентов во всех странах мира, существенным удельным весом его в структуре заболеваемости, нетрудоспособности и инвалидности популяции.Одним из ведущих клинических симптомов ОСХ шейного отдела позво- ночника (ШОП) представляется синдром позвоночной артерии (ПА), который может иметь множество патогенетических механизмов формирования. В МКБ-10 имеется несколько диагнозов, определяющих поражение вертебрально-базилярного бассейна (ВББ): М 47.0 – синдром компрессии ПА при спондилезе; М 53.0 – задний шейный симпатический синдром; G 45.0 – синдром вертебрально-базилярной артериальной системы. Темы диагностики и лечения синдрома ПА в последние годы притягивают все больший интерес врачей многих специальностей: неврологов, нейрохирургов, вертебрологов, ангиохирургов, терапевтов, врачей общей практики, мануальных терапевтов, физиотерапевтов. Анатомия ПА. С целью представления патогенеза формирования синдрома ПА нуж- но иметь понятия об анатомии данного сосуда. ПА кровоснабжает большую зону: сегменты спинного мозга от С1 до Th3, включая (верхний медуллярный артериальный бассейн), внутреннее ухо, стволовые структуры головного мозга (ГМ), затылочные доли, медиобазальные области височных долей, мозжечок, дорзальные отделы гипоталамической области. От звездчатого ганглия, сформированного симпатическими центрами С3 –Th1 сегментов спинного мозга, выходит позвоночный нерв (задний шейный симпатикус или нерв Франка). Он проникает в канал поперечных отростков, обвивая своими веточками ПА. Дополнительно, от позвоночного нерва отходят ветви, принимающие участие в формировании нерва Люшка. Данный нерв иннервирует капсульно-связочный аппарат ШОП, надкостницу позвонков и заднюю часть межпозвонковых дисков (МПД). Большая доля экстракраниального отрезка ПА проходит в мобильном костном канале, сформированном поперечными отростками позвонков. Причем медиальная стенка ПА прилегает к унковертебральному суставу, а задняя граничит с верхним суставным отростком. На уровне С1-С2 ПА покрыта лишь мягкими тканями, в основном нижней косой мышцей головы. Этиология и патогенез. Некоторые клиницисты разъясняют клиническую картину синдрома ПА при ОСХ ШОП компрессией данного сосуда костными разрастаниями позвонков. Данная теория основана на множественных случаях травматического повреждения ПА или их перевязки, после которых следовали ОНМК в ВББ. Тем не менее, дальнейшими экспериментальными и клиническими исследованиями было показано, что компрессия одной ПА не может вызвать недостаточность в ВББ. Лишь при врожденной или приобретенной патологии ПА (аплазии, аномальной узости, атеросклероз, компрессия остеофитами, гемодинамически значимые стенотические поражения в области устьев ПА, окклюзия одной из ПА, синдром позвоночно-подключичного обкрадывания и т. д.) может проявиться клиническая недостаточность компримированной ПА. Ведущим механизмом формирования компрессионного синдрома ПА представляется экстраваскулярный отек из-за механического сдавления, что ведет к нарушению венозного кровотока. Сдавление вен в костном канале поперечных отростков ШОП случается раньше артериальной, а сформировавшийся от компрессии вен в костном канале венозный отток усугубляет компрессию ПА. Длительная ирритация симпатического сплетения хорошо исследована при ОСХ ШОП. Патологическое раздражение этого сплетения при ОСХ ШОП вызывает спазм сосудов системы ПА, что клинически проявляется дисфункцией кровоснабжаемых ими отделов ГМ. Ирритативный тип синдрома ПА в основном фиксируется у молодых больных, у которых отсутствует сочетанная патология ВББ.
Этиологические причины синдрома ПА возможно разделить на 3 вида:
- Окклюзирующая патология ПА (атеросклероз, тромбозы, эмболии, артерииты).
- Деформация ПА (патологическая извитость и деформации).
- Экстравазальная компрессия ПА (сдавление костными аномалиями, ребрами, мышцами, грыжами МПД, остеофитами и суставными отростками шейных позвонков, рубцами, опухолями и пр.).
По данным различных исследователей, на ПА могут приводить механическое воздействие:
1) костные разрастания унковертебральных суставов в 55,9% случаев;
2) костные разрастания дугоотросчатых суставов (ДОС) при спондилоартрозе — 6,0%;
3) передне-верхний угол суставного отростка при подвывихах при разгибании (по Ковачу) в ШОП — 25,0%;
4) передняя лестничная мышца при комбинации скаленус-синдрома с латеральным отхожде- нием устья ПА — 7,1%;
5) боковая грыжа МПД, вышедшая через унковертебральную щель — 6,0%;
6) компрессия в области атланта (аномалии Клиппеля–Фейля, Киммерли, платибазия);
Клиническая картина. Синдром ПА клинически отражается пароксизмальными цефалгиями (по типу мигрени), головокружениями, атаксией, тошнотой и/или рвотой, зрительными и слуховыми расстройствами, эпизодами drоpp-attаck, синкопальными и гипоталамическими приступами. Зрительные нарушения представляются в следующем: затемнение в глазах, чувство песка, искр и другие выражения фотопсии, легкие перемены тонуса сосудов глазного дна (фиксируются у каждого 4-5 больного). Снижение памяти более патогномонично для лиц с выраженными органическими изменениями. Примерно у 60,0% лиц регистрируется связанность синдрома от определенных движений или положений ШОП, сопровождающихся нарастанием компрессии ПА. Огромную значимость в формировании клинической картины синдрома ПА имеет также сопутствующая патология, такая как атеросклероз брахиоцефальных артерий и ГМ, артериальная гипертензия, ИБС и т. д. Диагноз синдром ПА выставляется лицам, содержащим определенный спектр жалоб и клинических синдромов, которые возможно связать с ОСХ или аномалиями ШОП. Клинические варианты синдрома ПА:
Синдром Барре — Льеу (задний шейный симпатический синдром). В большинстве эпизодах этот синдром обуславливается артрозом унковертебральных суставов и подвывихами по Ковачу в ШОП. Болевой синдром сопряжен с более ранним развитием ОСХ и патологической подвижностью в ШОП. Характеризуется цефалгиями в шейно-затылочной области с распространением в переднюю часть головы (по типу «снятия шлема»). Цефалгия сочетается с вегетативными, кохлеовестибулярными и зрительными нарушениями.
Базилярная мигрень. Отличается зрительными расстройствами с двух сторон, в сочетании с головокружением, атаксией, дизартрией, шумом в ушах. На высоте пароксизмы формируется интенсивная боль в затылочной области, сочетающаяся с рвотой и в некоторых инцидентах потерей сознания.
Вестибуло-атактический синдром. Превалируют головокружение, чувство неустойчивости тела, затемнение в глазах, нарушение равновесия с тошнотой и рвотой. Симптоматика прогрессирует при движении в ШОП.
Кохлеовестибулярный синдром. Представляется шумом в ушах или затылке, парестезиями, тугоухостью, снижением восприятия шепота, изменениями на аудиограмме. Эти расстройства в основном сочетаются с периодическими несистемными головокружениями (чувство неустойчивости и пошатывания) или системными головокружениями.
Офтальмический синдром. Зрительные расстройства характеризуются пароксизмальной фотопсией, мерцательной скотомой, утомляемостью и снижением зрения при чтении и иной зрительной нагрузке. Могут фиксироваться признаки конъюнктивита: боли и чувство инородного тела в глазах, покраснение конъюнктивы, слезотечение. Также регистрируются случаи приступообразного выпадения полей зрения, часто связанны с положением в ШОП.
Синдром вегетативных нарушений. Чаще фиксируются следующие вегетативные симптомы: чувство жара, озноба, похолодания конечностей, гипергидроза, изменениями дермографизма. Могут встречаться гортанно-глоточные расстройства, а также периодические нарушения сна и бодрствования.
Приступы dropp-attack. Эпизод непредвиденного падения сопряжен с ишемией каудальных отделов ствола ГМ и мозжечка и представляется в виде тетраплегии при внезапном разгибании в ШОП с стремительным восстановлением двигательной функции.
Транзиторные ишемические атаки.
Синдром Унтерхарншайдта (синкопальный вертеброгенный синдром). Он представляет ОНМК в ретикулярной формации ствола ГМ, отличается кратковременным выключением сознания при быстром движении в ШОП или продолжительном вынужденном ее положении.
Диагностика. Для идентификации вертеброгенного синдрома ПА нужно присутствие 3-х клинико-диагностических критериев:
1.Клиническая картина (присутствие одного из девяти вышеописанных клинических вариантов или их комбинация).
2.Присутствие изменений, диагностированных при выполнении МРТ или КТ в комбинации с функциональной спондилографией ШОП (спондилез в области унковертебральных суставов, артроз ДОС, подвывих суставных отростков, нестабильность и гипермобильность в ШОП, боковые грыжи МПД, аномалии костного ложа ПА, краниовертебрального перехода и др.).
3.Присутствие изменений, диагностированных при выполнении дуплексного сканирования ПА и/или при осуществлении допплерографии с использованием функциональных проб с ротацией, флексией и экстензией в ШОП (компрессия ПА, асимметрии линейной скорости тока крови в ПА, вазоспастические реакции в ПА и базиллярной артериях, гиперреактивность на функциональные пробы, изменение диаметра ПА).
Лечение. Консервативное лечение включает в себя: мануальную терапию, массаж, иглорефлексотерапию, физиотерапию, санаторно-курортное лечение. По современным пониманиям, нейропротекция представляет собой комплекс медикаментозной терапии, обращенный на компенсацию развивающегося энергетического дефицита нейронов, протекцию их от влияния повреждающих факторов, активацию процессов нейрорегенерации, коррекцию тока крови в ГМ. При синдроме ПА нейропротекция представляется одним из наиболее продуктивных методов профилактики хронической ишемии ГМ, выражающийся в виде недостаточности в ВББ. Назначение нейропротекторов содействует предупреждению формирования расстройств метаболизма ГМ у лиц с повышенным риском его ишемии, особенно при уменьшении цереброваскулярного резерва. Ведущую ценность нейропротекция получает у лиц с симптомными стадиями синдрома ПА — ОНМК, транзиторными ишемическими атаками, синкопальным вертеброгенным синдромом, приступами dropp-attack.
Правила медикаментозного лечения синдрома ПА:
1.Препараты, действующие на венозный отток: полусинтетический диосмин (детралекс, флебодиа), троксерутин, гинко-билоба.
2.Нестероидные противовоспалительные препараты: нимесулид, лорноксикам, целекоксиб, целебрекс.
3.Препараты, нормализующие кровоток в ПА: пентоксифиллин, винкамин, винпоцетин, циннаризин, нимодипин, ницерголин, cермион, инстенон.
4.Холинергические препараты: цитиколин, цераксон, рекогнан, глиатилин.
5.Комплексные нейропротекторные препараты: цитофлавин, актовегин, церебролизин, пирацетам, мексидол
6.Метаболическая терапия: цитофлавин, милдронат, тиотриазолин, триметазидин
7.Симптоматическая терапия — миорелаксанты: толперизон, спазмолитики: дротаверин, гистаминоподобные: бетагистин, антимигренозные: суматриптан.
Комплексное консервативное лечение заключает в себя ортопедические воздействия на источник патологии (вытяжение ШОП, иммобилизация ШОП, мануальная терапия и др.); новокаиновые блокады спастически сокращенных и болезненных мышц ШОП; физиотерапевтические и бальнеологические методы.
Поэтому в лечении больных с синдромом ПА наряду с традиционной консервативной терапией должны быть применены пункционные методы воздействия: блокады ПА, звездчатого узла, нижней косой мышцы головы, дерецепции МПД и ДОС.
Новокаиновая блокада симпатического сплетения ПА является как диагностической, так и лечебной. Курс включает в себя 4-5 блокад с интервалом через день. Техника блокады следующая: пациента укладывали на спину с валиком под плечи. Указательным пальцем левой руки отодвигают сонную артерию латерально, проникая между ней и срединными органами шеи. Идентифицируют сонный бугорок поперечного отростка С6. После прокалывания кожи иглой упираются в указанный бугорок, далее, соскальзывая с него, проваливаются иглой через межпоперечную мышцу, т. е. в канал ПА. Аспирационной пробой убеждаются в отсутствии повреждения сосуда. Затем вводят 3 -5 мл 2% раствора новокаина. После выполнения манипуляции пациент должен 20 минут лежать на спине, чтобы анестетик не распространился по периневральным пространствам до звездчатого узла.
Вместе с тем, при патологической импульсации из пораженного ДОС происходит стойкий или прерывистый спазм ПА. Основное преимущество химической денервации ДОС перед более локальными воздействиями (лазерной вапоризацией, холодно-плазменной кобляцией, высокочастотной деструкцией) заключается в том, что спиртоновокаиновый раствор выключает вокруг ДОС большее количество ноцицептивных вегетативных структур, включая ветви нерва Люшка, которые представляют основную роль в формировании рефлекторных синдромов фасет-синдрома ШОП.
Первыми малоинвазивными методами стали хемонуклеолиз, дерецепция МПД и перкутанная нуклеотомия. Хемонуклеолиз и дерецепция МПД приводят к развитию фиброза пульпозного ядра МПД с созданием условий для анкилозирования позвоночнодвигательного сегмента на различных стадиях его дистрофического поражения. Развитие фиброза МПД ограничивает амплитуду движений в оперированном сегменте, при этом не исключается тот минимальный объем движений, который не приводит к возникновению локальной перегрузки расположенных рядом позвоночно-двигательных сегментов. Процесс перестройки МПД после хемонуклеолиза длителен и занимает 1,5-2 года, что может привести к развитию рецидива заболевания.
При вертеброгенном синдроме ПА выполняют следующие операции:
- декомпрессивно-стабилизирующие — ункусэктомия с вентральным межтеловым спондилодезом;
- декомпрессивно-пластические — чрездисковая декомпрессия ПА;
- декомпрессивные — внедисковая ункусэктомия и артериолиз, резекция аномальных колец С1 позвонка, резекция шейного ребра и артериолиз и др.;
- стабилизирующие операции при динамической компрессии ПА;
- лазерная вапоризация МПД при рефлекторном синдроме ПА и протрузии МПД.
Отличительной особенностью оперативного лечения лиц с синдромом ПА определена частым комбинациями вертеброгенного поражения ПА с их атеросклеротической или врожденной патологией (32,0% пациентов), а также с окклюзирующими и стенозирующими поражениями сонных артерий (26,7-28,0%). Это говорит о необходимости прецизионного предоперационного обследования данных лиц и комплексного лечения. У больных с сочетанными поражениями ПА и сонных артерий первым этапом выполняют реконструкцию каротидного бассейна.
Реконструкцию V1 ПА целесообразно применить при интактных дистальных сегментах (V2-4). При идентификации атеросклеротического поражений ПА в V1 сегменте производят следующие реконструктивные операции:
- транспозиция ПА во внутреннюю сонную артерию;
- транспозиция ПА в общую сонную артерию;
- транспозиция ПА в подключичную артерию;
- транспозиция ПА в щитошейный ствол;
- модифицированная транспозиция (реплантация) устья ПА;
- эндартерэктомия и ангиопластика ПА;
- артериолиз и десимпатизация ПА.
Показания к реконструкции ПА в V3 сегмента:
1)стеноз или окклюзия V1 и V2 сегментов ПА при незамкнутости Виллизиева круга;
2)экстравазальная компрессия V2 сегмента ПА при незамкнутости Виллизиева круга;
3)предстоящая реконструкция на V1 сегменте ПА или сонно-подключичный анастомоз;
4)перелом стента или выраженный рестеноз (при невозможности повторного стентирования) после стентирования V1 сегмента ПА.
Доступ к V3 сегменту ПА (между поперечными отростками С1-2) имеет несколько преимуществ: расположение ПА на данном участке наиболее поверхностно, возможность выполнить диссекцию ПА без костной резекции на пролонгированном расстоянии и венозное сплетение на этом участке менее выражено, чем в других.
При атеросклеротическом поражении ПА в V3 сегменте производят следующие реконструктивные операции:
- транспозиция ПА во внутреннюю сонную артерию;
- общесонно-дистальнопозвоночное шунтирование;
- наружносонно-дистальнопозвоночное шунтирование;
- внутреннесонно-дистальнопозвоночное шунтирование;
- наружносонно-дистальнопозвоночный анастомоз;
- затылочно-дистальнопозвоночный анастомоз;
- подключично-дистальнопозвоночное шунтирование.
Заключение. Клиника синдрома ПА не всегда имеет классическую картину, а наиболее стабильные признаки — цефалгия, головокружение и шум в ушах. Продуктивность лечения синдрома ПА неразрывно связана со своевременной диагностикой данного заболевания. Необходимо комплексное воздействие на возможные патогенетические механизмы формирования синдрома ПА. Консервативное лечение лиц с синдромом ПА позволяет снизить тяжесть и частоту возникновения клинических симптомов. Малоинвазивные методы лечения синдрома ПА должны занять достойное место в арсенале вертебролога, нейрохирурга и невролога. Следует также шире применять реконструктивные операции на ПА при атеросклеротическом поражении в условиях специализированных отделений (сосудистой хирургии и нейрохирургии). Также необходима более широкая информированность врачей первичного звена о данном заболевании и способах его диагностики и лечения.
Пахионовы грануляции
Рис.22 Пахионова грануляция в просвете поперечного синуса справа (стрелка на рис.22а), которая может симулировать тромб, однако в отличие от него грануляция имеет гиперинтенсивный МР-сигнал по Т2. Следы от наличия расширенных пахионовых грануляция на внутренней пластинке и в диплоэ затылочной кости на КТ в костном окне (стрелки на рис.22b) и мозговом окне (стрелка на рис.22с).
Субарахноидальное кровоизлияние
Нетравматическое субарахноидальное кровоизлияние возникает в большинстве случаев по причине разрыва аневризмы мозговой артерии, реже из-за кровотечения из сосудистой мальформации или АВ-фистулы.
Нетравматическое субарахноидальное кровоизлияние на фоне разрыва аневризмы
Рис.23 Разрыв аневризмы передней мозговой-передней соединительной артерии (ПМА-ПСА), локализованный по наличию небольшой гематомы в области разрыва аневризмы (жёлтая стрелка на рис.23) с наличием массивного кровоизлияния в субарахноидальном пространстве (Фишер IV) (белые стрелки на рис.23а). Кровь при САК дифференцируется в субарахноидальном пространстве САП и внутри полостей желудочков (стрелки на рис.23b и рис.23с).
Книга «Опухоли мозга. КТ- и МРТ-диагностика» ознакомиться, посмотреть / заказать
Автор: врач-рентгенолог, к.м.н. Власов Евгений Александрович
Полная или частичная перепечатка данной статьи, разрешается при установке активной гиперссылки на первоисточник
- вы потеряли описание вашего МРТ или КТ,
- врача не устроило описание вашего МРТ или КТ
- вы сомненеваетесь в выводах по результатам вашего МРТ,
Вы можете заказать пересмотр вашего МРТ или КТ с подробной расшифровкой здесь:
Классификация вариантов артерий и вариантов артериального круга большого мозга человека
Характеристика строения артерий головного мозга человека известна давно. По сути, Т. Уиллис (1664), описав впервые типичный артериальный анастомоз, начал научную летопись вариантов строения и топографии артерий головного мозга человека. С XIX в. характеристика вариантов строения артериального русла головного мозга стала носить системный характер, и многочисленные авторы стали рассматривать Виллизиев круг не только как состоящий из отдельных артерий анастомоз, но как единый артериальный круг большого мозга.
Анастомозы артериального круга большого мозга (АКБМ) чаще наблюдаются в головном мозге ребенка, с возрастом число их сокращается. Варианты строения АКБМ сводятся к трем основным группам: 1) разомкнутые варианты круга – переднего и заднего его полуколец; 2) варианты нетипичного начала мозговых артерий; 3) варианты с асимметричным диаметром сосудов правой и левой частей круга. При этом важно помнить, что определение артерий в качестве варианта или аномалии зависит в т. ч. от визуализационных возможностей. Выделяют типы ветвления внутренней сонной артерии (ВСА): фетальный, переходной, передняя трифуркация, задняя трифуркация. Наибольшее значение при операциях имеют следующие варианты строения АКБМ: частичная и полная передняя трифуркация ВСА; частичная и полная задняя трифуркация ВСА; частичная и полная квадрифуркация ВСА; аплазия задней соединительной артерии (ЗСА).
Классическое анатомическое или «типичное» строение артериального русла головного мозга человека достаточно четко отражено в «Международной анатомической терминологии». К значительным попыткам классификации вариантов строения и топографии артериального русла головного мозга с учетом отдельных артерий из известных классических и современных литературных источников и доступных интернет-ресурсов, пожалуй, можно отнести лишь классификацию Р.М. Беленькой (1979). Однако с учетом накопленных за последние 40 лет знаний необходим обновленный подход к оценке и трактовке вариантов строения и топографии как отдельных артерий, так и артериального русла головного мозга в целом. В этой связи мы предлагаем к рассмотрению классификацию, с одной стороны, разграничивающую более простые и более сложные варианты строения и топографии, а с другой – более системно характеризующую морфологию артериального русла головного мозга.
Итак, варианты строения и топографии артериального русла головного мозга человека достаточно многочисленны и многообразны. Само понятие «вариант строения и топографии артериального русла головного мозга» объединяет как отличные от общепринятых представлений особенности строения или/и топографии одного сосуда, так и особенности строения или/и топографии двух и более сосудов одновременно. С целью разграничения вариантов по степени сложности мы считаем целесообразным введение элементарного понятия «феномен строения и топографии артерии головного мозга». С нашей точки зрения, под «феноменом строения и топографии артерии головного мозга» следует понимать отличные от общепринятых представлений особенности строения или топографии одного сосуда, иногда – двух (при участии обеих арте рий в субстрате феномена). Наличие одного или сочетание двух и более феноменов формируют собственно «вариант строения и топографии артериального руслаголовного мозга».
Все варианты артерий головного мозга человека, найденные нами в доступной литературе, мы универсализировали в следующие совокупности:
- варианты строения и топографии отдельных артерий головного мозга (рассмотрены варианты строения и топографии каждой артерии в отдельности);
- варианты строения и топографии передней части артериального круга большого мозга (рассмотрены варианты строения и топографии двух и более артерий передней части артериального круга большого мозга);
- варианты строения и топографии задней части артериального круга большого мозга (рассмотрены варианты строения и топографии двух и более артерий задней части артериального круга большого мозга и внутричерепных частей позвоночных артерий);
- варианты артериального круга большого мозга в целом.
Согласно полученным нами данным магнитно-резонансной ангиографии (МРА), типичное строение артериального русла головного мозга выявлено у 166 (51,6 %) из 322 практически здоровых лиц, а варианты строения и топографии отдельных артерий головного мозга, передней части артериального круга большого мозга, задней части артериального круга большого мозга и артериального круга большого мозга в целом выявлены у 156 (48,4 %) из 322 практически здоровых лиц.
По данным МРА головного мозга, из феноменов строения и топографии ВСА верифицирована гипоплазия ВСА у 2 (1,3 %) пациентов из 156 практически здоровых человек. Верифицированы следующие феномены строения и топографии передних мозговых артерий (ПМА): передняя трифуркация ВСА у 3 (1,9 %), гипоплазия ПМА у 2 (1,3 %), а также сочетание двух феноменов строения и топографии ПМА: изгиб обеих ПМА у 3 (1,9 %) человек. Феномены строения и топографии передней соединительной артерии верифицированы не были. Феномены строения и топографии средней мозговой артерии верифицированы не были. Из феноменов строения и ЗСА верифицированы гипоплазия однойили обеих ЗСА у 7 (4,4 %) пациентов. Верифицированы следующие феномены строения и топографии задних мозговых артерий (ЗМА): задняя трифуркация ВСА у 8 (5,1 %) пациентов, девиация ЗМА у 1 (0,6 %) пациента, гипоплазия ЗМА у 1 (0,6 %) пациента, а также сочетание двух феноменов строения и топографии ЗМА: задняя трифуркация ВСА и изогнутость ЗМА у 10 (6,3 %) пациентов, задняя трифуркация обеих ВСА частичная и полная у 3 (1,9 %) пациентов, изгибы обеих ЗМА у 1 (0,6 %) пациента. Выявлены следующие феномены строения и топографии базилярной артерии (БА): девиация БА у 7 (4,5 %) пациентов, изгиб БА у 5 (3,2 %) пациентов, извитость БА у 3 (1,9 %) пациентов, удвоение (неслияние) БА у 3 (1,9 %) пациентов, раздвоение БА у 1 (0,6 %) пациента, а также сочетание двух феноменов строения и топографии базилярной артерии: девиация БА и изгиб БА у 7 человек (2,1 %) из 156 практически здоровых человек. Верифицированы следующие феномены строения и топографии внутричерепных частей позвоночных артерий (ВЧПА): гипоплазия одной из ВЧПА у 17 человек (10,9 %), избыточная извитость одной из ВЧПА у 1 (0,6 %) пациента, S-образная ВЧПА у 1 (0,6 %) пациента, а также сочетание двух феноменов строения и топографии ВЧПА: извитость и гипоплазия одной ВЧПА у 4 (2,7 %) пациентов,гипоплазия обеих ВЧПА у 2 (1,3 %) пациентов, извитость обеих ВЧПА у 9 (5,8 %) пациентов, а также сочетание четырех феноменов строения и топографии ВЧПА выявлено у 3 (1,9 %) человек: гипоплазия и извитость обеих ВЧПА.
Нами верифицированы следующие варианты строения и топографии передней части АКБМ из 156 практически здоровых человек:
- гипоплазия обеих ВСА и гипоплазия ЗСА у 2 (1,3 %) пациентов;
- гипоплазия обеих ЗСА и гипоплазия ПМА у 1 (0,6 %) пациента;
- передняя трифуркация ВСА, извитость и гипоплазия обеих СМА, гипоплазия базилярной артерии.
Верифицированы варианты задней части АКБМ из 156 практически здоровых человек:
- гипоплазия одной ЗМА и изгиб БА у 1 (0,6 %) пациента;
- гипоплазия одной ВЧПА и гипоплазия одной ЗМА у 2 (1,3 %) пациентов;
- гипоплазия обеих ВЧПА и гипоплазия ЗМА у 1 (0,6 %) пациента;
- гипоплазия обеих ЗМА и девиация БА у 2 (1,3 %) пациентов.
Верифицированы варианты АКБМ в целом:
- гипоплазия ПМА и гипоплазия обеих ЗМА у 3 (1,8 %) пациентов;
- передняя трифуркация внутренней сонной артерии и изогнутость задней мозговой артерии у 2 (1,3 %) пациентов;
- девиация ЗМА и гипоплазия ЗСА у 3 (1,9 %) пациентов;
- гипоплазия обеих ЗСА и девиация БА у 1 (0,6 %) пациента;
- задняя трифуркация обеих ВСА и гипоплазия обеих ВЧПА у 2 (1,3 %) человек;
- гипоплазия обеих ЗМА и гипоплазия ВЧПА с одной стороны у 2 (1,3 %) человек;
- задняя трифуркация ВСА и гипоплазия ВЧПА на одной стороне у 1 (0,6 %) пациента;
- задняя трифуркацияобеих ВСА и изгиб БА у 6 (3,9 %) пациентов;
- гипоплазия обеих ЗСА и гипоплазия БА у 3 (1,9 %) пациентов;
- гипоплазия обеих ЗСА и гипоплазия обеих ВЧПА у 2 (1,3 %) пациентов;
- задняя трифуркация ВСА и гипоплазия обеих ВЧПА у 2 (1,3 %) пациентов;
- гипоплазия ПМА и гипоплазия ВЧПА у 5 (3,2 %) пациентов;
- гипоплазия ПМА и девиация БА у 4 (2,6 %) пациентов;
- гипоплазия ПМА и извитость обеих ВЧПА у 4 (2,6 %) пациентов;
- передняя трифуркация ВСА, задняя трифуркация ВСА и S-образная БА у 3 (1,9 %) пациентов;
- гипоплазия обеих ЗСА и девиация обеих ВЧПА у 1 (0,6 %) пациента;
- гипоплазия ЗСА и S-образная БА у 2 (1,3 %) пациентов
Таким образом, среди вариантов АКБМ верифицировано 24 феномена строения и топографии артерий головного мозга, сочетание которых и обусловило 49 вариантов артерий головного мозга. Все выявленные феномены строения и топографии артериального русла головного мозга, совокупность которых позволяет систематизировать и уточнить количество вариантов строения в тесной взаимосвязи друг с другом, создают критическую необходимость отражения их в классификационной схеме.
- Варианты строения, топографии и ответвления отдельных артерий головного мозга (рассмотрены ва- рианты каждой артерии в отдельности).
- Варианты строения и топографии артериально- го круга большого мозга (рассмотрены варианты двух и более АКБМ и ВЧПА):
- варианты строения и топографии передней части АКБМ;
- варианты строения и топографии задней части АКБМ и варианты внутричерепных частей по- звоночных артерий;
- варианты строения и топографии артери- ального круга большого мозга в целом и варианты внутричерепных частей позвоночных артерий.
- Атипичные и аномальные (в т. ч. т. н. персисти- рующие эмбриональные анастомозы) артерии как вари- анты строения и топографии артериального русла го- ловного мозга.
- Примечания:
- вариант строения и топографии представлен одним феноменом или совокупностью) феноменов строения и топографии артерии или артерий;
- перечень вероятных феноменов строения и топографии артерии или артерий (указан феномен как единое событие):
- аплазия – отсутствие артерии;
- гипоплазия – резкое уменьшение диаметра артерии;
- гиперплазия – резкое увеличение диаметра артерии;
- изгиб, изогнутость, извитость, девиация, S-образная артерия – изменение типичного (общепризнанного) хода или направления артерии;
- удлинение;
- укорочение;
- удвоение – неслияние соединяющихся артерий;
- слияние парных артерий в общий ствол;
- островковое строение – разделение артерии на ограниченном участке;
- плексиформное строение – разделение артерии на продолжительном участке;
- передняя трифуркация ВСА – отхождение обеих ПМА от одной ВСА;
- задняя трифуркация ВСА частичная – равенство по диаметру задней соединительной артерии и задней мозговой артерии одной стороны;
- задняя трифуркация ВСА полная – превосходство по диаметру ЗСА над проксимальным отрезком ЗМА одной стороны.