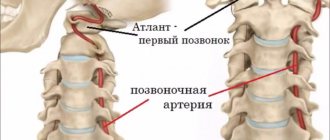
Система кровообращения в организме человека довольно сложна – в теле имеется огромное количество сосудов различной длины и размеров. Для удобства всю систему подразделяют на несколько кругов. Например, Виллизиев круг обеспечивает полноценное кровообращение во всех отделах мозга человека. В его структуру входят и артерии, проходящие в определенном месте через позвоночный столб. И при ряде нарушений может развиться такое заболевание, как гипоплазия левой/правой позвоночной артерии. Что это такое, лечится ли и как выявить данную патологию?
Гипоплазия левой/правой позвоночной артерии — что это такое?
Что это за патология?
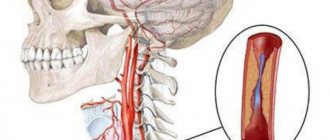
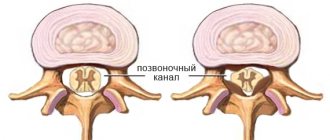
Чтобы понять, что же такое гипоплазия артерий позвоночного столба, требуется немного изучить саму систему кровоснабжения в этой части тела и головного мозга. В последний кровь поступает как раз за счет позвоночных артерий, а также внутренних сонных. Каждый сосуд отвечает за доставку крови к определенной части мозга. Позвоночные артерии соединены между собой, и если произойдет такая ситуация, что одна из них окажется перекрытой, то питать мозг будет другая, компенсируя потери.
Кровообращение головного мозга
Сами позвоночные артерии отходят от подключичной артерии и достигают головы человека, где происходит их разделение на более мелкие сосуды. Находятся они внутри позвоночного канала шейного отдела и по мере прохождения его совершают несколько изгибов.
Общие сведения о гипоплазии
В норме артерии одинаковые, но при определенном стечении обстоятельств одна из них – левая или правая – может иметь определенные нарушения, из-за чего и возникает гипоплазия. Это недоразвитие артерии или же сужение ее диаметра до 2 и менее миллиметров.
Гипоплазия одной из позвоночных артерий способно привести к нарушению кровообращения, вследствие чего возникает дисфункция работы сердца, остальной системы кровоснабжения, нарушается работа вестибулярного аппарата и т. д.
Одной из причин патологии может быть остеохондроз
Гипоплазия позвоночной артерии может быть:
- правосторонней;
- левосторонней;
- двухсторонней.
На заметку! Как правило, гипоплазия – заболевание врожденное. Но бывает и так, что патология развивается позже из-за влияния определенных факторов. Таким образом, гипоплазию артерий можно разделить на врожденную и приобретенную. Чаще всего патология поражает правую артерию – она встречается у каждого десятого человека согласно статистике. Это связано с тем, что длина правой артерии обычно несколько больше, чем левой.
Гипоплазия правой позвоночной артерии
Медицинские интернет-конференции
О.А. Фомкина – ГБОУ ВПО Саратовский ГМУ им. В.И. Разумовского Минздрава России, ассистент кафедры анатомии человека, кандидат медицинских наук; В.Н. Николенко – ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России, проректор по научной и инновационной деятельности, профессор кафедры анатомии человека, директор НИИ молекулярной медицины, профессор, доктор медицинских наук; Ю.А. Гладилин – ГБОУ ВПО Саратовский государственный университет им. В.И. Разумовского Минздрава России, доцент кафедры анатомии человека, доктор медицинских наук.
Введение. Изменчивость как общебиологическое явление не теряет своей актуальности и заслуживает внимания многих ученых [1, 2]. Изменчивость показывает пластичность живых систем и связана с реализацией адаптивной стратегии природной популяции. Изучение изменчивости позволяет судить о взаимодействии генотипа с факторами среды в процессе онтогенеза [3].
Отвечая запросам клинической медицины, в настоящее время, требуются детальные сведения не столько о типичном строении или средней анатомической норме органа, сколько обо всем спектре индивидуальной, типовой и сочетанной его изменчивости [2]. Это касается и артериальных сосудов головного мозга.
Предметом настоящего исследования является задняя соединительная артерия (ЗСА). Являясь ветвью мозгового отдела внутренней сонной артерии, она участвует в формировании артериального (Виллизиева) круга мозга. Доказано, что кровь по этой артерии может течь в обоих направлениях [4]. В связи с этим, ЗСА принадлежит важная роль в осуществлении компенсаторного коллатерального кровотока между системами внутренних сонных и позвоночных артерий.
Строение задних соединительных артерий очень варьирует. По сравнению с другими артериями головного мозга они имеют малый диаметр и практически точечный просвет [5-7].
Цель исследования: определить варианты задней соединительной артерии (ЗСА) взрослых людей в зависимости от индивидуальной и сочетанной изменчивости ее морфометрических параметров.
Материалы и методы. Материалом исследования послужили ЗСА, полученные при аутопсии 115 трупов людей в возрасте от 21 до 84 лет, умерших по причинам, не связанным с острой или хронической цереброваскулярной патологией. Всего исследовано 230 образцов артерий. Для изучения морфологии артерии производили поперечные миллиметровые срезы с помощью бритвы. Затем срезы помещали в чашку Петри с физиологическим раствором и под микроскопом с точностью до 0,01 мм измеряли наружный диаметр и толщину стенки артерии. Диаметр просвета артерии представлен в исследовании как разность наружного диаметра и удвоенной толщины стенки артерии.
Полученные данные обрабатывали вариационно-статистическим методом с использованием пакета прикладных программ «Statistica-6» и Microsoft Exsel Windows-XP., Для проверки наличия нормального распределения использовали Тест Колмогорова-Смирнова. Распределение параметров в изученной выборке не отличалось от нормального. В связи с этим для всех параметров определяли минимальное и максимальное значения, среднюю арифметическую (М), ошибку средней арифметической (m), среднее квадратическое отклонение (s), коэффициент вариации (Cv). Для оценки достоверности различий между рядами вариант использовали параметрический критерий (критерий Стьюдента) При этом различия считали достоверными при 95%-м пороге вероятности (р<0,05). При изучении индивидуальной изменчивости, как и большинство исследователей, занимающихся вопросами диапазона анатомической нормы, за среднюю величину признака мы принимали интервал варьирования М±σ. Так как обнаружены статистически значимые половые различия длины, толщины стенки и диаметра просвета ЗСА [6], варианты изменчивости по этим параметрам были рассчитаны отдельно для мужчин и женщин.
Результаты. Средние величины морфометрических параметров ЗСА (230 образцов) без учета пола, возраста и полушария большого мозга составили: 1) длина 12,26±0,19 мм (А=5,30-20,10 мм; s=2,89 мм; Сv=23,6%); 2) наружный диаметр – 1,33±0,02 мм (А=0,80-2,10 мм; s=0,26 мм; Сv=19,2%); 3) толщина стенки – 0,23±0,01 мм (А=0,12-0,40 мм; s=0,06 мм; Сv=26,2%); 4) диаметр просвета – 0,88±0,02 мм (А=0,46-1,46 мм; s=0,25 мм; Сv=28,0%).
Значительная изменчивость морфометрических параметров ЗСА позволила выделить группы вариантов их значений (табл. 1).
По длине ЗСА подразделились на: короткие – длина менее 9,89 мм у мужчин и менее 8,80 мм у женщин; средние по длине – с длиной от 9,90 до 15,72 мм у мужчин и от 8,81 до 11,51 у женщин; длинные – с длинной более 15,73 мм у мужчин и более 11,52 мм у женщин. Средний возраст субъектов с короткими ЗСА был в 1,2 раза больше, чем у людей с длинными артериями – соответственно 51,3±2,9 года и 43,0±2,6 года (р=0,039). Количественное соотношение мужчин и женщин в группе субъектов с короткими артериями – 39,5 и 60,5%; в группе субъектов с длинными артериями – 71,9 и 28,1%.
Исходя из величины наружного диаметра, ЗСА бывают: тонкими – диаметр менее 1,06 мм; среднего диаметра (среднеширокие) – диаметр колеблется в пределах от 1,07 до 1,59 мм и широкими – с диаметром более 1,60 мм. Субъекты с широкими ЗСА были в среднем в 1,2 раза старше людей с тонкими артериями – соответственно 55,0±3,0 года и 45,5±2,1 года (р=0,011). Количественное соотношение мужчин и женщин в группе субъектов с тонкими артериями – 59,0 и 41,0%; в группе субъектов с широкими артериями представительство мужчин и женщин одинаковое – по 50%.
По толщине стенки ЗСА подразделились на: тонкостенные – толщина стенки менее 0,17 мм у мужчин и менее 0,14 мм у женщин; средние по толщине – с толщиной стенки от 0,18 до 0,30 мм у мужчин и от 0,15 до 0,25 мм у женщин; толстостенные – с толщиной стенки более 0,31 мм у мужчин и более 0,26 мм у женщин. Средний возраст субъектов с толстостенными ЗСА был в 1,7 раза больше, чем у людей с тонкостенными артериями – соответственно 69,2±2,3 года и 40,7±2,5 года (р=1·10-6). Количественное соотношение мужчин и женщин в группе субъектов с тонкостенными артериями – 25,7 и 74,3%; в группе исследованных с толстостенными артериями – 78,9 и 21,1%.
В зависимости от величины диаметра просвета, нами выделены ЗСА: с узким просветом – диаметр просвета менее 0,58 мм у мужчин и менее 0,68 мм у женщин; со средним просветом – диаметр просвета, варьирует от 0,59 до 1,07 мм у мужчин и от 0,69 до 1,19 мм у женщин; с широким просветом – диаметр просвета превышает 1,08 мм у мужчин и 1,20 мм у женщин. Возраст субъектов с узким и широким просветом ЗСА существенно не различался – соответственно 51,2±2,5 года и 45,6±3,1 года (р=0,163). Количественное соотношение мужчин и женщин в группе исследуемых с узким просветом ЗСА – 75,6 и 24,4%; в группе исследованных с широким просветом ЗСА – 43,6% и 56,4%.
Отмечено, что примерно 71,9% всех тонких ЗСА обладали узким, а 28,2% – средним по величине просветом. При этом тонкие ЗСА в 23,1% случаев имели тонкую, в 5,2% случаев толстую и в 71,8% случаев среднюю толщину стенки (табл. 2).
Среднеширокие артерии в 87,1% случаев характеризовались средним по величине диаметром просвета; в 7,7% случаев такие ЗСА имели узкий, а в 5,2% широкий диаметр просвета. Среднеширокие артерии, как правило, обладали средней по величине толщиной стенки (67,1% наблюдений); тонко- и толстостенные ЗСА также встречались в этой группе – соответственно в 12,9 и 20% случаев.
Широкие ЗСА в 86,1% имели широкий и в 13,9% случаев средний диаметр просвета. При этом в 13,9% случаев они являлись тонко- или толстостенными, а в остальных 72,2% характеризовались средней по толщине стенкой.
Сочетанная изменчивость морфометрических параметров ЗСА позволила выделить 18 ее типов. Наиболее часто встречаются среднеширокие ЗСА со средней величиной толщины стенки и средним просветом (43,0%). К редким типам (частота встречаемости менее 1%) относят тонкие ЗСА (со средней толщиной стенки и диаметром просвета, с тонкой стенкой и узким просветом, толстой стенкой и узким просветом, толстой стенкой и средним просветом); ЗСА со средним наружным диаметром, толстой стенкой и широким просветом; широкие ЗСА с толстой стенкой и средним просветом (рис. 1). Тонкостенные ЗСА на нашем материале никогда не обладали широким диаметром просвета.
Рис. 1.Частота встречаемости типов ЗСА,% (НД – наружный диаметр, ТС – толщина стенки, ДП – диаметр просвета): 1 – средние по НД, ТС и ДП; 2 – тонкие со средней ТС и узким ДП; 3 – широкие со средней ТС и широким ДП; 4 – средние по НД, с толстой стенкой и средним ДП; 5 – средние по НД с тонкой стенкой и средним ДП; 6 – тонкие с тонкой стенкой и средним ДП; 7 – средние по НД с толстой стенкой и узким ДП; 8 – средние по НД, с тонкой стенкой и широким ДП; 9 – средние по НД, ТС с узким ДП; 10 – широкие с тонкой стенкой и широким ДП; 11 – широкие со средней толщиной стенки и средним ДП; 12 – широкие с толстой стенкой и широким ДП; 13 – тонкие со средней ТС и средним просветом; 14 – средние по НД, с толстой стенкой и широким ДП; 15 – тонкие с тонкой стенкой и узким ДП; 16 – тонкие с толстой стенкой и узким ДП; 17 – тонкие с толстой стенкой и средним ДП; 18 – широкие с толстой стенкой и средним ДП.
Обсуждение. Подавляющее большинство работ, затрагивающих ЗСА, посвящено вариантам ее развития: аплазия, гипоплазия, наличие сосудистой сети на месте артерии и пр. [5, 8, 9]. Сведения, посвященные индивидуально-типологической изменчивости морфометрических параметров ЗСА нами представлены впервые.
В результате проведенного исследования выявлено, что морфологические параметры ЗСА (длина, наружный и внутренний диаметр, толщина стенки) характеризуются значительной индивидуальной изменчивостью. Коэффициент вариации изученных параметров варьирует от 19,2% (наружный диаметр) до 28,0% (диаметр просвета). По каждому из параметров нами выделены 3 группы артерий: I – с величиной признака меньше средней (<�М-σ); II – со средней величиной признака (М±σ); III – с величиной признака больше средней (>М+σ). Четкой закономерности по преобладанию в крайних группах изменчивости (I и II группах) мужчин или женщин не обнаружено. Так, среди субъектов с короткими, тонкостенными артериями и артериями с широким просветом – преобладают женщины, а среди субъектов с длинными, тонкими, толстостенными артериями и артериями с узким просветом преобладают мужчины. В группе исследованных с широкими ЗСА процентное представительство мужчин и женщин одинаковое.
Средний возраст субъектов, ЗСА которых по величине их наружного диаметра, толщины стенки и диаметра просвета относятся к III группе, статистически достоверно в 1,2-1,7 раза больше, чем у людей с ЗМА, относящихся к I группе изменчивости. Средний возраст мужчин и женщин с короткими ЗСА (I группа), наоборот, в 1,2 раза больше, чем у людей с длинными ЗСА (III группа). Возраст субъектов с ЗСА, имеющих узкий или широкий просветы, существенно не различался.
Заключение. Таким образом, анализ индивидуальной изменчивости длины, наружного и внутреннего диаметров и толщины стенки ЗСА позволил выделить по каждому из параметров 3 группы вариантов артерий: со средней величиной признака, с величиной признака меньше и больше средней. Сочетанная изменчивость морфометрических параметров ЗСА позволила выделить 18 ее типов.
Полученные данные дополнят и упорядочат имеющиеся сведения о размерных характеристиках ЗСА, что имеет значение для лучшего понимания исследуемой области нейроморфологии, а также может быть полезно при моделировании кровотока в артериальном круге мозга.
Причины развития
Так как гипоплазия обычно является врожденным заболеванием, то основные причины, вызывающие ее, связанны с неправильным протеканием беременности. Спровоцировать развитие патологии могут:
- травмы и падения будущей матери;
- употребление ряда лекарственных препаратов, влияющих на развитие эмбриона;
- употребление алкоголя и курение беременной женщиной;
- инфекционные заболевания;
- отравления;
- наследственный фактор.
Курение при беременности
Внимание! Эти факторы могут спровоцировать появление гипоплазии, но это не значит, что они обязательно приведут к ее развитию. В определенных случаях дети рождаются, уже имея гипоплазию, но видимых причин для ее появления нет.
Симптоматика
Гипоплазию артерий выявить не так просто, как кажется. Протекает заболевание обычно бессимптомно, и даже при наличии некоторых признаков их могут принять за симптомы совершенно других заболеваний – например, варикоза, ВСД или остеохондроза.
На заметку! Если у человека имеется гипоплазия, но чувствует он себя хорошо, это значит, что компенсация кровотока за счет других сосудов является достаточной для питания мозга.
Симптомы проявляются не сразу
Именно поэтому первые симптомы гипоплазии могут проявиться только в результате возрастных изменений. Это связано с ухудшением состояния всей системы сосудов, развитием атеросклероза.
Таблица. Симптомы гипоплазии.
| Группа | Симптомы |
| Локальные | При пальпации в месте нахождения позвоночной артерии (между 1 и 2 позвонками шейного отдела) человек испытывает головную боль. Болевой синдром напоминает прострелы или пульсацию. |
| Вертебальные | Боли в области затылка или шеи, обычно пульсирующие или простреливающие, чувствующиеся особенно четко во время поворота головы, в ночное время суток или утром после сна. |
| Признаки, связанные с ухудшением кровоснабжения или работой нервной системы | Повышение давления, расстройства слуха и зрения, мигрени, головокружения, нарушение координации, походки, чувствительности. Также человек может оказаться дезориентирован в пространстве, особенно часто этот эффект наблюдается при совершении резких движений. Головокружения могут привести к обмороку. Некоторые больные жалуются на слабость, чувствительность к переменам погоды, проблемы со сном. |
Аневризма коммуникантного отдела внутренней сонной артерии
Пациент Т., 30 лет, при поступлении в отделение предъявлял жалобы на боль в правом глазу, в правой лобно-височной области, птоз правого верхнего века, двоение в глазах, больше при взгляде влево.
Из анамнеза известно: Около 2 недель назад отметил появление головной боли в правой половине головы, затем появление боли в правом глазу. Обращался к офтальмологу, назначались глазные капли — без эффекта. Выполнено МРТ головного мозга: МРТ-данных за наличие объемных образований головного мозга не получено. УЗДГ экстракраниальных сосудов: Гемодинамически значимые нарушения кровотока на экстракраниальном уровне не зарегистрированы. Признаки повышенного периферического сопротивления в каротидном бассейне. Асимметрия кровотока в ПА. Исследование вызванных потенциалов: лицевые и тройничные (1 ветвь с обеих сторон) нервы не поражены. Обращался к неврологу, назначено ксефокам, напроксен, мильгамма, финлепсин, пикамилон, на фоне которых боль в глазу уменьшилась, однако отмечал тошноту, головокружение. Через 7 дней после появления болевого синдрома отметил присоединение двоения в глазах. Обратился к неврологу поликлиники, направлен на экстренную госпитализацию в КБ №1.
При обследовании:
Лабораторные показатели без особенностей.
ЭКГ: Синусовый ритм с ЧСС 65 в мин. Нормальное положение ЭОС. Особенности внутрижелудочковой проводимости.
КТ органов грудной клетки: Единичные кальцинаты в правом легком. Киста передне-верхнего средостения.
МРТ головного мозга и области орбит, с внутривенным контрастированием: Патологических изменений головного мозга и области орбит не выявлено.
Зрительные вызванные потенциалы (на шахматный паттерн): выявляется нарушение проведения зрительной афферентации в кору на прехиазмальном уровне справа с аксональным типом повреждения.
УЗИ глазного яблока (правый глаз): УЗ-картина может соответствовать наличию ретробульбарного неврита.
Исследование щитовидной железы и регионарных лимфоузлов: УЗ-признаки фокальных изменений обеих долей щитовидной железы.
Цветовое дуплексное сканирование внечерепных отделов брахиоцефальных артерий: 1. Гемодинамически значимых препятствий кровотоку и вариантов строения внечерепных отделов брахиоцефальных артерий не выявлено.
Осмотрен офтальмологом: Фоновая ретинопатия и ретинальные сосудистые изменения. Лагофтальм правого глаза.
Таким образом, пациенту исключены объемное образование, демиелинизирующее заболевание, взяты антитела к ацетилхолину для исключения миастении (отрицательные).
Получал внутривенно капельно тиоктацид, трентал, дексазон, внутримышечно ксефокам, мильгамма, внутрь омез.
На фоне лечения (12 дней) сохраняется полуптоз справа, двоение в глазах, больше влево, тяжесть в правой половине головы. Переведен для дальнейшего лечения в наше отделение.
Анамнез жизни не отягощен.
При осмотре: в соматическом статусе без особенностей.
В неврологическом статусе: В сознании, контактен, ориентирован. Речь не изменена. Менингеальных знаков нет. ЧМН: Глазные щели DS. Фотореакции: живая слева, справа почти отсутствует. Движения глазных яблок слева в полном объеме, справа ограничены вверх и влево. Диплопия при взгляде влево и вверх. Птоз правого верхнего века. Нарушений чувствительности на лице нет. Лицо симметричное. Нистагма нет. Слух не нарушен. Глоточный рефлекс сохранён. Глотание, фонация не нарушены. Язык по средней линии. Двигательная сфера: Парезов нет. Сухожильные рефлексы живые, S=D. Патологических стопных знаков не выявляется. В позе Ромберга устойчив. ПНП выполняет удовлетворительно с 2-х сторон. Чувствительность не нарушена. Симптомов натяжения нет.
Учитывая наличие пареза глазодвигательного нерва справа и выраженного болевого синдрома локально в правой лобно-височной области, в плане дообследования запланировано проведение МР-ангиографии и МР-венографии для исключения аневризмы головного мозга, тромбоза кавернозного синуса.
При МР-ангиографии: картина мелкой мешотчатой аневризмы в области отхождения правой задней соединительной артерии от средней мозговой. Экстракраниальные изгибы обеих ВСА. Выраженная асимметрия поперечных синусов.
Консультирован сосудистым хирургом. Проведена ангиография брахиоцефальных артерий: в коммуникантном отделе правой внутренней сонной артерии визуализируется мешотчатая аневризма 6,5х4,2 мм, неправильной формы, с широкой шейкой. Задняя соединительная артерия отходит от шейки аневризмы.
Для дальнейшего лечения переведен в отделение ОНМК для проведения эндоваскулярного вмешательства. Выполнена эндоваскулярная эмболизация аневризмы задней соединительной артерии с применением спиралей.
Послеоперационный период протекал без особенностей. Выписка на 6 сутки. Регрессировал цефалгический синдром, значительно уменьшились глазодвигательные нарушения, глазные щели D=S, фотореакции: живая слева, справа немного снижена, движения глазных яблок в полном объеме, диплопия при взгляде вверх, полуптоз справа.
При контрольной КТ головного мозга через 3 месяца: Эндоваскулярная эмболизация аневризмы задней соединительной артерии с применением спиралей от 21.11.18 г. Патологических изменений в веществе головного мозга не выявлено. В неврологическом статусе полностью регрессировали глазодвигательные нарушения и птоз.
При осмотре через 6 месяцев в неврологическом статусе без глазодвигательных, очаговых нарушений. При контрольной ангиографии: ВСА – проходима, без значимых сужений. Состояние после эндоваскулярной эмболизации аневризмы коммуникантного отдела ВСА. Отмечает полное отсутствие головных болей, которые часто беспокоили пациента в течение нескольких лет. Пациент полностью трудоспособен, вернулся в профессию.
Отличия правосторонней и левосторонней гипоплазии
Серьезных отличий как по симптоматике, так и по характеру заболевания у право- и левосторонней гипоплазии нет. Главная разница заключается в том, что каждая из артерий снабжает определенную часть мозга кровью. Таким образом, у пациента могут быть разные осложнения и последствия течения заболевания.
При гипоплазии с правой стороны главная неприятность – сопутствующие заболевания, при которых данная патология является своеобразным катализатором. Например, это может быть атеросклероз, который сам по себе способен сужать сосуды и тем самым приводить к дополнительным проблемам с кровообращением.
Атеросклероз
На заметку! При правосторонней гипоплазии больные чаще, чем в других случаях, жалуются на сильную чувствительность к переменам погоды.
При гипоплазии с левой стороны симптомы могут проявляться еще дольше, чем при правосторонней форме патологии. Самый главный признак развития заболевания – боли в области шеи. Но если других симптомов нет, то обычно такой болевой синдром считают признаком других заболеваний и диагноз поставить крайне сложно. А колебания артериального давления при такой форме вторичны.
Как протекает гипоплазия левой позвоночной артерии
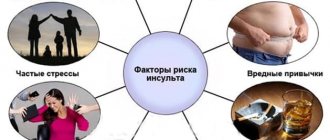
В результате многочисленных эпидемиологических исследований были установлены основные факторы, ведущие к развитию цереброваскулярной патологии от начальных признаков недостаточности мозгового кровообращения до инсульта [2-5, 9]. В природе встречаются млекопитающие, у которых единственным источником кровоснабжения головного мозга являются позвоночные артерии (ПА): белки, зайцы, морские свинки. Патология ПА, в том числе и гипоплазия, в определенных условиях может способствовать или быть непосредственной причиной как хронических, так и острых форм нарушения мозгового кровообращения.
Гипоплазия ПА — это уменьшение внутреннего диаметра артерии менее 2 мм. Однако единой договоренности в отношении диаметра сосуда нет, и в некоторых работах признаком гипоплазии ПА считалось уменьшение наружного диаметра ПА менее 3 мм, что встречалось в 6% случаев при обследовании 50 здоровых людей [11]. В другой работе среди больных с различными вариантами синдрома ПА, по данным ультразвукового дуплексного и триплексного сканирования, гипоплазия одной из ПА была выявлена в 23,9% случаев [6]. По данным А.В. Комяхова и М.В. Жуковой [7], у больных с односторонней аномалией Киммерле гипоплазия ПА выявлялась в 43% случаев, а у больных с двусторонней аномалией Киммерле — в 73%. Измерение диаметра проводится в сегменте V2, поскольку остальные сегменты ПА менее удобны, подвержены риску атеросклеротических стенозов за счет непрямолинейного хода, а также в других сегментах возможны погрешности в измерении [15, 14]. Контралатеральную гипоплазированной ПА принято называть доминантной артерией [12, 14].
При посмертном рентгеновском ангиографическом исследовании брахицефальных артерий у детей разных возрастов удалось установить, что достаточно интенсивный рост ПА происходит в возрасте с 5 до 7 лет и с 7 до 9 лет. Основная артерия является наиболее стабильным сегментом задних отделов артериального круга в анализируемый период роста — от 1-го года жизни до 9 лет. Задние мозговые артерии растут стабильно и равномерно без четких скачкообразных тенденций. Рост задних соединительных артерий стабилизируется в возрасте 5-9 лет. Диаметр ПА в возрасте до 5 лет остается примерно стабильный — 1,1-2,0 мм [10].
В литературе гипоплазию ПА рассматривают как проявление недифференцированной дисплазии соединительной ткани, однако отсутствуют данные о ее частоте у людей с наследственной патологией соединительной ткани. Различные сведения о распространенности гипоплазии ПА, по данным литературы, связаны с используемыми методами визуализации. Так, при магнитно-резонансной ангиографии (МРА) с использованием томографа Siemens 1,5 Тл с болюсным внутривенным введением 10 мг магневиста и последующей компьютерной обработкой, односторонняя гипоплазия ПА с внутренним диаметром менее или равном 2 мм определялась у 106 (35,2%) человек из исследованных 306 здоровых людей и у 3,4% встречалась двусторонняя гипоплазия ПА [15]. По данным ультразвукового дуплексного сканирования ПА на ультразвуковом сканере Sonus 5500, при измерении в межпозвонковом промежутке С5-С6, из 407 здоровых людей гипоплазия ПА с внутренним диаметром менее или равном 2 мм встречалась в 15,8% случаев (7,8% — правая ПА и 8% — левая) [13].
Отсутствие признаков вертебрально-базилярной недостаточности среди пациентов с гипоплазией ПА позволяет рассматривать ее как вариант нормального строения и ведет к недооценке роли влияния ее в развитии инсульта. С другой стороны, у пациентов с передним и задним циркулярным ишемическим инсультом гипоплазия ипсилатеральной ПА определялась в 27,1 и 45,6% случаев соответственно, позволяя авторам сделать вывод, что гипоплазия ПА является независимым фактором риска инсульта в бассейне задней нижней мозжечковой артерии на ипсилатеральной стороне [15]. Н.С. Алексеевой установлено, что стеноз ПА 70% и более является критическим для развития инфаркта мозжечка [1]. Отмечена также высокая частота распространения у лиц с гипоплазией ПА дистальных атеросклеротических стенозов в интракраниальном сегменте в сравнении с людьми без гипоплазии ПА (p
<0,001) [15]. По данным исследования J. Park и соавт. [15], 89,1% пациентов с гипоплазией ПА и развившимся ишемическим инсультом в бассейне задней нижней мозжечковой артерии имели атеросклеротический стеноз или окклюзию. Гипоплазия ПА у пациентов с церебральным атеросклерозом приводит к декомпенсации церебральной гемодинамики и способствует развитию ишемического инсульта при степенях стеноза сонных артерий более низких, чем у пациентов без гипоплазии позвоночной артерии [8].
Материал и методы
На базе кафедры неврологии и медицинской генетики с курсом нейрохирургии Ярославской государственной медицинской академии обследованы 1549 больных с хроническими нарушениями мозгового кровообращения (ХНМК) и 87 пациентов, перенесших острые нарушения мозгового кровообращения (ОНМК).
Исследование сосудов проводилось на ультразвуковом сканере Philips En Visor, в дуплексном и триплексном режимах сканирования. У всех пациентов определялись проходимость сосудов, состояние сосудистой стенки, показатели кровотока (систолическая и диастолическая скорости, индекс резистентности), состояние просвета сосудов, исследовались устье ПА, отхождение от подключичной артерии и вхождение ПА в позвоночный канал.
Результаты
Среди 1549 пациентов с ХНМК патология ПА наблюдалась у 369 (23,8%) человек. Гипоплазия ПА диагностирована у 55 (3,5%) больных — у 37 (67%) женщин и 18 (33%) мужчин. Минимальный диаметр артерии составлял 1,3 мм. Гипоплазия ПА определялась у пациентов разного возраста с симптомами вертебрально-базилярной недостаточности. В возрасте до 30 лет — у 5 (9,0%) мужчин и 2 (3,6%) женщин; в возрасте от 30 до 50 лет — у 6 (10,9%) мужчин и 25 (45,4%) женщин; старше 50 лет — у 7 (12,7%) мужчин и 10 (18,2%) женщин. Чаще наблюдалась гипоплазия правой ПА — 39 (70%) случаев и реже — левой ПА — 16 (30%) случаев. При исследовании кровоток по основной артерии в 12 (21%) наблюдениях был ниже нормы на 10-30% (норма — более 40 см/с), в остальных 43 (79%) случаях кровоток снижался при проведении ротационной пробы. В 16 (29%) случаях было отмечено сочетание гипоплазии ПА с патологической деформацией обеих внутренних сонных артерий, преимущественно S- и/или Z-образной.
Анализ результатов обследования 25 пациентов с гипоплазией ПА показал асимметричный венозный отток по позвоночному венозному сплетению во всех случаях. В подавляющем большинстве случаев ускоренный венозный отток регистрировался на стороне гипоплазии ПА. У 8 пациентов он был представлен ускоренным полифазным с множественными ретроградными забросами, «свистящим», у 5 пациентов преимущественно монофазным, ускоренным, «дующим». У 12 человек кровоток в сегменте V2 ускорен не был, но регистрировалось значимое ускорение в сегменте V1 и прямом венозном синусе. При проведении пробы с 2-минутной гипервентиляцией происходило заметное ускорение кровотока по позвоночному венозному сплетению на 40-50%, после гипервентиляции кровоток плавно снижался.
Среди 87 обследованных с ОНМК в возрасте от 17 до 45 лет (средний возраст — 35,4 года) гипоплазия ПА отмечалась у 16 (18,4%) пациентов (6 мужчин и 10 женщин): у 12 (75%) больных — правой ПА и у 4 (25%) больных — левой ПА. Инсульт у 10 (62,5%) пациентов развивался в вертебрально-базилярном бассейне и у 6 (37,5%) пациентов — в каротидном бассейне. В анамнезе у 3 больных имелись указания на ранее перенесенные ОНМК. Среди факторов риска артериальная гипертензия была у 5 (31,3%) пациентов и пролапс митрального клапана — у 6 (37,5%). Следует отметить, что в данной группе гипоплазия ПА чаще регистрировалась у пациентов с синдромом недифференцированной дисплазии соединительной ткани (НДСТ), чем у больных без фенотипических проявлений этого синдрома (27,9 и 6,8% соответственно). При этом зависимости от тяжести синдрома НДСТ и частоты гипоплазии ПА выявлено не было. Гипоплазия ПА у 3 больных сочеталась с деформацией внутренних сонных артерий (ВСА) и/или ПА, у 4 пациентов — с извитостью ВСА и/или ПА. У 2 пациентов из данной группы одновременно с гипоплазией ПА выявлялось атеросклеротическое поражение общих сонных артерий (ОСА) со стенозами 20-30%. Среди больных с ОНМК с учетом этиологического подтипа ишемического инсульта, согласно критериям TOAST, гипоплазия ПА выявлялась при атеротромботическом варианте — в 2 случаях, кардиоэмболическом — в 2, лакунарном — 2, в 3 случаях — при инсульте с другой известной причиной и у 7 пациентов при инсульте неизвестной этиологии.
Таким образом, высокая частота выявленных ангиодисплазий у лиц молодого возраста с инсультами и их преобладание у пациентов с синдромом НДСТ является, вероятно, одним из проявлений этого синдрома и может быть как результатом наследственной формы поражения соединительной ткани, так и следствием приобретенного генеза в результате влияния разнообразных неблагоприятных факторов на плод в период его внутриутробного развития, что приводит к дефекту формирования соединительнотканного каркаса сосудистой стенки. Гипоплазия ПА, изолированно или в сочетании с патологическими деформациями и/или извитостями ВСА, может быть одним из факторов риска развития нарушения кровообращения в вертебрально-базилярной системе.
Возможные последствия
Опасность гипоплазии заключается, в первую очередь, в повышении риска инсульта из-за того, что кровоснабжение мозга ухудшено. Если верить статистическим данным, то около 30% инсультов связаны как раз с нарушением кровообращения в этой области. Заболевание способно спровоцировать проблемы со слухом, зрением, работой вестибулярного аппарата. Но в целом последствия данной патологии абсолютно непредсказуемы. В любом случае, заболевание ухудшает качество жизни, но само по себе не является смертельным.
Инсульт и его последствия
На самом деле, прогноз при наличии данного заболевания будет зависеть во многом от того, насколько недоразвита пораженная артерия, в каком состоянии находится организм человека, от наличия ряда определенных патологий и т. д. В целом, прогноз считается условно благоприятным. Но при наличии определенных факторов риска важно обязательно принять ряд профилактических мер. Иногда приходится делать и операцию.
Ишемический инсульт в бассейне задних мозговых артерий: проблемы диагностики, лечения
И.А. ХАСАНОВ, Э.И. БОГДАНОВ
Республиканская клиническая больница МЗ РТ, г. Казань
Казанский государственный медицинский университет
Хасанов Ильдар Акрамович
врач неврологического отделения для больных с острыми нарушениями мозгового кровообращения
420064, г. Казань, ул. Оренбургский Тракт, д. 138, тел. (843) 237-35-47, e-mail
В статье в свете современных данных рассматриваются проблемы диагностики и лечения ишемических инсультов в бассейне задних мозговых артерий (ЗМА) с учетом особенностей их этиологии, клинической картины и данных нейровизуализации.Парные задние мозговые артерии, формирующиеся путем бифуркации базилярной артерии и являющиеся ее терминальными ветвями, служат основными источниками кровоснабжения верхней части среднего мозга, таламусов и задне-нижних частей полушарий головного мозга, включая затылочные доли, медиобазальные отделы височных долей и нижнемедиальные отделы темени.Ишемические инсульты в бассейне задних мозговых артерий составляют, по разным данным, от 5-10 до 25% случаев всех ишемических инсультов.Наиболее частой причиной изолированных инфарктов в бассейне ЗМА является эмболическая окклюзия ЗМА и ее ветвей, которая имеет место примерно в 82% случаев.В 9% случаев в ЗМА выявляется тромбоз in situ, еще в 9% случаев причиной инсульта служат вазоконстрикция, связанная с мигренью, и коагулопатии.Очень редкой причиной инфаркта в данном бассейне может быть и артериальная диссекция, затрагивающая ЗМА.Наиболее частыми и характерными признаками инфарктов в бассейне ЗМА являются зрительные нарушения (гомонимная гемианопсия), центральный парез лицевого нерва, головная боль, нарушения чувствительности, афатические нарушения, гемипарез и ниглект.
Ключевые слова:
ишемический инсульт, инфаркт мозга, задняя мозговая артерия, нейровизуализация, тромболитическая терапия
I.A. KHASANOV, E.I. BOGDANOV
Kazan State Medical University
Republican Clinical Hospital of the Ministry of Health of the Republic of Tatarstan, Kazan
Ishemic stroke in a system of posterior cerebral arteries: problems of diagnosis and treatment
In the article on the basis of present knowledge are considered the problems of diagnosis and treatment of ishemic strokes in a system of posterior cerebral arteries (PCA) taking into account their causation, clinical presentation and neuroimaging data.Paired posterior cerebral arteries, which are shaped by basilar artery bifurcation and are its terminal branches, are the main sources of blood supply of the upside of midbrain, thalamus and back and bottom parts of cerebral hemispheres, including occipital lobes, mediobasal branches of temporal lobes and lower medial crown branches.Ishemic strokes in a system of posterior cerebral arteries amount to 5-10% or up to 25% of all ishemic strokes.The most common cause of isolated heart attacks
in a system of PCAistheembolic occlusionof PCAand its branches, which occurs in about 82% of cases.In 9% of cases in PCAisrevealed thrombosis, inother9% of cases the cause of stroke are vasoconstriction associated with migraine, and coagulopathy.A very seldom reason for a heart attack in this system can be artery dissection which affects PCA.The most frequent and characteristic features of heart attacks in a system of PCA are visual impairments (equilateral hemianopsia), central paresis of facial nerve, headache, sensation disorders, aphatic disorders, hemiparesis and neglect.
Key words:
ischemic stroke, cerebrovascular accident, posterior cerebral artery, neuroimaging, thrombolytic therapy.
Ишемические инсульты в бассейне задних мозговых артерий (ЗМА) составляют, по разным данным, от 5-10 до 25% случаев всех ишемических инсультов [1-4]. Они могут явиться причиной целого ряда клинических симптомов, далеко не всегда своевременно и адекватно распознающихся самими пациентами, их родственниками и врачами, ведь остро возникший грубый моторный дефицит, с которым обычно ассоциируется инсульт, в этом случае может быть невыраженным или вовсе отсутствовать. Отсрочка в своевременной диагностике или некорректный диагноз ставят под сомнение возможность проведения больному адекватной терапии (прежде всего тромболизиса), что в свою очередь не может не влиять на исход болезни [5]. Большую роль в постановке диагноза играет возможность использования нейровизуализации, правильный выбор метода и грамотная интерпретация результатов [2]. Видится важным представление и анализ особенностей клинической картины, нейровизуализации и лечения ишемических инсультов в бассейне задних мозговых артерий в свете современных данных.
Наиболее частой причиной изолированных инфарктов в бассейне ЗМА является эмболическая окклюзия ЗМА и ее ветвей, которая имеет место в 82% случаев. При этом кардиогенный генез наблюдается в 41% случаев, в то время как артерио-артериальная эмболия из позвоночных и базилярной артерий — лишь в 32% случаев. У 10% пациентов источник эмболии установить не удается. В 9% случаев в ЗМА выявляется тромбоз in situ. Вазоконстрикция, связанная с мигренью, и коагулопатии являются причинами инфаркта мозга в 9% случаев [6]. Если изолированные инфаркты в бассейне ЗМА в большинстве случаев имеют кардиоэмболическую природу, то вовлечение ствола мозга и/или мозжечка в сочетании с инфарктом в бассейне ЗМА наиболее часто связано с атеросклеротическим поражением сосудов вертебробазилярного бассейна [7, 8]. Очень редкой причиной инфаркта в данном бассейне может быть и артериальная диссекция, затрагивающая ЗМА [9]. Вне зависимости от причины инфаркта обычно он лишь частично захватывает бассейн ЗМА [10, 11].
Парные задние мозговые артерии, формирующиеся путем бифуркации основной артерии и являющиеся ее терминальными ветвями, служат основными источниками кровоснабжения верхней части среднего мозга, таламусов и задне-нижних частей полушарий головного мозга, включая затылочные доли, медиобазальные отделы височных долей и нижнемедиальные отделы темени [10, 12, 13].
На ранних стадиях развития организма человека задняя мозговая артерия представляет собой ветвь внутренней сонной артерии (ВСА) и кровоснабжается из системы каротид, при этом задняя соединительная артерия (ЗСА) исполняет роль ее проксимального сегмента. В последующем кровь в задние мозговые артерии начинает поступать из основной артерии, а ЗСА, являясь ветвью внутренней сонной артерии, становится наиболее значимым анастомозом между каротидным и вертебробазилярным бассейнами. По разным данным, от 17 до 30% взрослых людей имеют фетальный (эмбриональный) тип строения ЗМА, при котором ВСА в течение всей жизни остается основным источником кровоснабжения ЗМА. Фетальный тип строения ЗМА в большинстве случаев наблюдается унилатерально, при этом противоположная ЗМА обычно начинается от асимметрично расположенной, изогнутой базилярной артерии. В случаях, когда обе задние мозговые артерии являются ветвями внутренних сонных артерий, как правило, наблюдаются хорошо развитые крупные задние соединительные артерии, а верхний сегмент базилярной артерии бывает короче, чем обычно (базилярная артерия заканчивается отходящими от нее двумя верхними мозжечковыми артериями). Примерно в 8% случаев обе ЗМА исходят из одной и той же ВСА [7, 8, 12, 14, 15].
ЗСА впадает в ЗМА примерно на 10 мм дистальнее места бифуркации базилярной артерии. Каждую ЗМА условно можно разделить на 3 части: предкоммуникационная часть, или Р1-сегмент по Фишеру, — участок ЗМА проксимальнее места впадения в нее ЗСА, посткоммуникационная часть, или Р2-сегмент, расположенный дистальнее места впадения ЗСА в ЗМА, и конечная (корковая) часть, отдающая ветви к соответствующим областям коры головного мозга [12, 16]. От предкоммуникационной части отходят парамедианная мезенцефалическая, задняя таламоперфорирующая и медиальная задняя хороидальная артерии, участвующие преимущественно в кровоснабжении вентролатеральных ядер таламуса и медиального коленчатого тела. Левая и правая задние таламоперфорирующие артерии могут отходить от общего ствола, называемого артерией Першерона; подобный вариант строения обычно встречается в сочетании с односторонней гипоплазией Р1-сегмента и фетальным строением ЗМА. Ветвями посткоммуникационной части являются педункулярные перфорантные, таламо-геникулятная и латеральная задняя хороидальная артерии, кровоснабжающие латеральное коленчатое тело, дорсомедиальные ядра и подушку таламуса, часть среднего мозга и латеральную стенку бокового желудочка [2, 12, 17]. Основными корковыми ветвями ЗМА являются передняя и задняя височные, теменно-височная и шпорная артерии [10]. Границы водораздела бассейнов средней и задней мозговых артерий значительно колеблются. Обычно границей бассейна ЗМА служит сильвиева борозда, но иногда средняя мозговая артерия кровоснабжает и наружные отделы затылочной доли вплоть до затылочного полюса. При этом ЗМА всегда снабжает кровью участки коры головного мозга в области шпорной борозды, а зрительная лучистость в ряде случаев получает кровь из средней мозговой артерии, соответственно, гомонимная гемианопсия не всегда подразумевает инфаркт в бассейне ЗМА [12].
При ишемических инсультах в бассейне ЗМА в зависимости от локализации окклюзии сосуда, а также от состояния коллатерального кровоснабжения в клинической картине могут выявляться симптомы поражения среднего мозга, таламусов и полушарий головного мозга. В целом до 2/3 всех инфарктов в бассейне ЗМА являются корковыми, таламусы вовлекаются лишь в 20-30% случаев, а средний мозг менее чем в 10% случаев [7, 18, 19]. Соответственно наиболее частым вариантом ишемического инсульта в бассейне ЗМА является изолированный инфаркт полушарий большого мозга, в первую очередь затылочных долей, реже встречается сочетанное поражение таламусов и мозговых полушарий, в небольшом проценте случаев — изолированный инфаркт таламуса и, наконец, комбинация поражения среднего мозга, таламуса и/или гемисфер является наиболее редким вариантом [2].
Иногда наблюдается билатеральное поражение областей мозга, кровоснабжаемых из ЗМА. Это имеет место в первую очередь при синдроме верхушки базилярной артерии (top of the basilar syndrome), который представляет собой эмболическую окклюзию дистального отдела основной артерии и характеризуется угнетением сознания, зрительными нарушениями, глазодвигательными и поведенческими расстройствами, часто без моторной дисфункции [2].
По данным ряда авторов, наиболее частыми и характерными признаками инфарктов в бассейне ЗМА являются зрительные нарушения (до 95% случаев), гомонимная гемианопсия (66,7% случаев), центральный парез лицевого нерва (52% случаев), головная боль, преимущественно в затылочной области (50 случаев), нарушения чувствительности (40% случаев), афатические нарушения (38% случаев), гемипарез (18% случаев) и ниглект (10% случаев). Пациенты обычно имеют комбинацию симптомов [2, 7, 8, 11].
Гомонимная гемианопсия возникает с контрлатеральной стороны при инфарктах в зонах кровоснабжения полушарных ветвей ЗМА вследствие поражения стриарной коры, зрительной лучистости или латерального коленчатого тела. В отсутствие вовлеченности затылочного полюса макулярное зрение остается сохранным. Дефект полей зрения может ограничиваться лишь одним квадрантом. Верхнеквадрантная гемианопсия возникает при инфаркте стриарной коры ниже шпорной борозды или нижней части зрительной лучистости в височно-затылочной области. Нижнеквадрантная гемианопсия — следствие поражения стриарной коры выше шпорной борозды или верхней части зрительной лучистости в теменно-затылочной области. Окклюзия шпорной борозды также может быть ассоциирована с болями в ипсилатеральном глазу. Нарушения зрения могут иметь и более сложный характер, особенно при двустороннем поражении затылочных долей, включая зрительные галлюцинации, зрительную и цветовую агнозию, прозопагнозию (агнозия на знакомые лица), синдром отрицания слепоты (синдром Антона), дефицит зрительного внимания и оптико-моторную агнозию (синдром Балинта). Часто нарушения зрения сопровождаются афферентными нарушениями в виде парестезий, расстройств глубокой, болевой и температурной чувствительности. Последние указывают на вовлечение таламуса, теменной доли либо ствола мозга (вследствие окклюзии проксимальных отделов вертебробазилярного бассейна) [2, 8, 10, 20].
Нейропсихологические нарушения, ассоциированные с инфарктами в ЗМА, значительно варьируют и присутствуют более чем в 30% случаях. Инсульт в бассейне мозолистых ветвей левой ЗМА у правшей, затрагивающий затылочную долю и валик мозолистого тела, проявляется алексией без аграфии, иногда цветовой, предметной или фотографической аномией. Правополушарные инфаркты в бассейне ЗМА нередко вызывают контрлатеральный геминиглект. При обширных инфарктах с вовлечением медиальных отделов левой височной доли или двусторонних мезотемпоральных инфарктах развивается амнезия. Также при моно- или билатеральном мезотемпоральном инфаркте может развиться ажитированный делирий. Обширные инфаркты в бассейне левой задней височной артерии клинически могут проявляться аномией и/или сенсорной афазией. Таламические инфаркты в зонах кровоснабжения пенетрирующих ветвей ЗМА могут вызывать афазию (при заинтересованности левой подушки), акинетический мутизм, глобальную амнезию и синдром Дежерина – Русси (расстройства всех видов чувствительности, грубые дизестезии и/или таламическая боль и вазомоторные нарушения в контрлатеральной половине тела, сочетающиеся с обычно преходящим гемипарезом, хореоатетозом и/или баллизмом). Также инфаркты в бассейне ЗМА могут быть ассоциированы с дискалькулией, пространственной и временной дезориентацией. [6, 12, 21, 22].
Билатеральные таламические инфаркты нередко связаны с глубокой комой. Так, окклюзия артерии Першерона вызывает развитие двусторонних инфарктов в интраламинарных ядрах таламусов, что приводит к тяжелому нарушению сознания [2, 12].
Гемипарез при инфарктах в бассейне ЗМА встречается лишь у 1/5 больных, чаще является легким и преходящим и обычно ассоциирован с вовлечением в патологический процесс ножек мозга [23, 24]. Описаны случаи инфарктов в бассейне ЗМА, когда у больных выявлялся гемипарез без вовлечения ножек мозга. У этих пациентов имело место поражение дистальных отделов ЗМА, в первую очередь заинтересованность таламо-геникулятной, латеральной и медиальной задних хороидальных артерий [23, 25]. Предполагается, что гемипарез при инфарктах в бассейне задних хороидальных артерий может быть связан с поражением кортико-бульбарных и кортико-спинальных трактов, даже при отсутствии видимого поражения внутренней капсулы или среднего мозга по данным нейровизуализации [23]. Существуют мнения, что развитие гемипареза связано со сдавлением внутренней капсулы отечной тканью таламуса [12].
Инфаркты в бассейне ЗМА имитируют инфаркты в каротидном бассейне у 17,8% пациентов [24], особенно при сочетанном поражении поверхностных и глубоких ветвей ЗМА, которое наблюдается приблизительно в 38% случаев [7, 19, 26]. Дифференциальная диагностика бывает затруднена вследствие наличествующих афатических нарушений, ниглекта, сенсорного дефицита, а также обычно легкого и преходящего гемипареза, возникающего вследствие вовлечения пирамидных трактов. Кроме того, нарушения памяти и другие остро возникшие нейропсихологические нарушения могут существенно осложнять обследование таких пациентов [2, 18, 19].
Среди других состояний, нередко клинически имитирующих инфаркты в бассейне ЗМА, следует выделить некоторые инфекционные заболевания (в первую очередь токсоплазмоз), синдром задней обратимой лейкоэнцефалопатии, неопластические поражения, как первичные, так и метастатические, и таламические инфаркты, вызванные тромбозом глубоких мозговых вен [2, 27]. Зачастую при постановке диагноза определяющую роль играют методы нейровизуализации.
Основными требованиями к нейровизуализации в острейшем периоде ишемического инсульта являются быстрота проведения исследования и информативность полученных данных. Главными задачами, стоящими перед врачом при использовании этих методов, являются исключение неишемической причины симптомов у пациента, определение локализации и размеров ишемических очагов и наличия жизнеспособной мозговой ткани, определение состояния церебральных сосудов, выявление отека мозга и смещения срединных структур, а также наличия геморрагического пропитывания ишемических очагов. Эти данные должны помочь в скорейшем определении тактики лечения пациента — возможности проведения внутривенного или внутриартериального тромболизиса, механического удаления бляшки, операции по декомпрессии головного мозга [28, 29].
Компьютерная томография (КТ) обычно не выявляет ишемические изменения в паренхиме мозга в течение первых нескольких часов от начала инсульта, времени, наиболее важном для начала терапии, а иногда даже и в более поздние сроки заболевания. Особенно затруднительна визуализация задних отделов мозга вследствие артефактов, обусловленных костями черепа. Однако при инсультах в бассейне ЗМА, как и при инсультах в бассейне средней мозговой артерии, в ряде случаев КТ может показывать гиперинтенсивный сигнал от самой ЗМА, что является наиболее ранним признаком инсульта в ее бассейне и выявляется в 70% случаях в течение первых 90 минут от начала заболевания и в 15% случаях в сроки от 12 до 24 часов. Данный признак появляется за счет визуализации кальцифицированного эмбола или атеротромбоза in situ. На стандартной КТ плоскость срезов параллельна орбито-меатальной линии (линии, соединяющей наружный угол глаза с наружным слуховым проходом и далее идущей к первому шейному позвонку). Исходя из хода СМА ее просвет обычно визуализируется на одном срезе, что позволяет легко выявить гиперденсную СМА, особенно при наличии атрофических изменений мозга. Ход ЗМА более сложен. Обычно проксимальный ее сегмент восходит латерально вокруг ножек мозга и, достигая обводной цистерны, идет горизонтально внутрь к височной доле, в непосредственной близости от намета мозжечка. Циркулярная часть (Р1- и Р2-сегменты) заканчивается в квадригеминальной цистерне, где начинается кортикальная часть ЗМА. Только Р2-сегмент идет параллельно срезу внутри обводной цистерны и, соответственно, гиперденсность, при ее наличии, наиболее вероятно может быть обнаружена в этой области. Впоследствии КТ-признаки ишемических изменений проявляются в виде участков гипоинтенсивности в паренхиме головного мозга [2, 3, 30].
Магнитно-резонансная томография (МРТ) позволяет более точно определить наличие и характер ишемических изменений в головном мозге при инсульте. Получение диффузионно-взвешенных изображений (DWI) позволяет выявлять ранние ишемические изменения, часто в течение часа от начала симптомов, и определять локализацию и распространенность очагов более точно, чем КТ [2]. Совместное использование режимов DWI, ADC и FLAIR позволяет дифференцировать острые, подострые и хронические ишемические изменения в паренхиме мозга, а также отличать цитотоксический отек мозга, наблюдающийся при ишемическом инсульте, от вазогенного отека при синдроме задней обратимой лейкоэнцефалопатии и гипертонической энцефалопатии [2, 27, 31, 32].
В неинвазивной диагностике стено-окклюзивного поражения крупных экстра- и интракраниальных артерий немалую роль играет КТ ангиография (КТА). Эта методика позволяет выявить степень стеноза, морфологию бляшки, а также наличие артериальной диссекции как при поражениях сосудов вертебробазилярного, так и каротидного бассейнов. Кроме того, оцениваются анатомические особенности коллатералей и вариантов циркуляции ЗМА [2, 33, 34]. Дополнительную информацию о сосудистой анатомии можно получить с помощью МР ангиографии с контрастированием, которая в сочетании с КТА позволяет оперировать данными, которые раньше можно было получить только с помощью классической ангиографии. Кроме того, эти методы имеют значение в оценке эффективности тромболитической терапии в случае артериальной реканализации [2].
В настоящее время тромболитическая терапия ишемического инсульта может применяться при поражении артерий как каротидного, так и вертебробазилярного бассейнов. Тем не менее все существующие на сегодняшний день руководства по проведению тромболизиса ориентированы в первую очередь на сосудистую катастрофу в каротидном бассейне, в первую очередь средней мозговой артерии; это связано прежде всего с наличием у таких пациентов явного неврологического дефицита в виде грубых парезов и нарушений чувствительности. Типичный функциональный дефицит у больного с инфарктом в бассейне ЗМА в острейшем периоде не всегда расценивается врачом как инвалидизирующий. Оценка неврологического дефицита по шкале инсульта национального института здоровья (NIHSS), являющаяся одним из критериев отбора пациентов для тромболитической терапии, обычно не в состоянии в полной мере отразить тяжесть состояния больного с инфарктом в вертебробазилярном бассейне [7]. По отношению к изолированному дефекту зрительных полей при остром инфаркте в бассейне ЗМА вообще не существует каких-либо рекомендаций [2]. Поэтому тромболитическая терапия у больных с инфарктами в бассейне ЗМА используется недостаточно широко. Тем не менее, учитывая, что гемипарез в ряде случаев является значительной клинической составляющей инфарктов в бассейне ЗМА, таким пациентам при отсутствии противопоказаний обоснованно проводится системный и/или внутриартериальный тромболизис [35].
При сравнении профилей эффективности и безопасности внутривенного тромболизиса, проводимого в течение первых трех часов от появления симптомов, у пациентов с инфарктами в каротидном бассейне и инфарктами в бассейне ЗМА значимой разницы в безопасности и исходе лечения обнаружено не было [7]. При этом, по данным ряда авторов, при проведении внутривенной тромболитической терапии при ишемических поражениях в вертебробазилярном бассейне, и в частности ЗМА, возможно расширение терапевтического окна до 6,5-7 часов и даже больше по сравнению с 4,5 часами при инфарктах в каротидном бассейне [36, 37].
Проведение внутриартериального тромболизиса при окклюзии средней мозговой артерии рекомендуется в течение не позднее 6 часов от начала симптомов, при окклюзии основной артерии — не позднее 12 часов [28]. При этом на сегодняшний день не существует четких рекомендаций по временным пределам при проведении внутриартериального тромболизиса у пациентов с поражением ЗМА [15]. N. Meier и соавт. (2011) описали 9 случаев внутриартериального тромболизиса у пациентов с окклюзией ЗМА в течение первых 6 часов от начала заболевания. Через 3 месяца после лечения функциональная независимость (по модифицированной шкале Ренкина 0-2 балла) была выявлена у 67% пациентов, что соотносится с аналогичными данными по каротидному бассейну [15].
Установленный на ранних сроках диагноз ишемического инсульта в бассейне ЗМА позволяет врачу своевременно определить тактику лечения пациента и рассмотреть при отсутствии противопоказаний возможность проведения тромболитической терапии, что, несомненно, делает прогноз для больного более благоприятным.
ЛИТЕРАТУРА
1. Brandt T., Steinke W., Thie A., Pessin M.S., Caplan L.R. Posterior cerebral artery territory infarcts: clinical features, infarct topography, causes and outcome. Multicenter results and a review of the literature // Cerebrovasc. Dis. — 2000. — Vol. 10. — P. 170–182.
2. Finelli P. Neuroimaging in acute Posterior Cerebral Artery Infarction // The Neurologist. — 2008. — Vol. 14. — P. 170-180.
3. Krings T., Noelchen D., Mull M. et al. The hyperdense posterior cerebral artery sign // Stroke. — 2006. — Vol. 37. — P. 399-403.
4. Hill M.D. Posterior cerebral artery stroke // e-medicine, 2005.
5. Хасанов И.А. Особенности инфарктов в бассейне задних мозговых артерий // Неврологический вестник. — 2012. — Т. XLIV, вып. 3. — С. 69-74.
6. Caplan L. Posterior Circulation Ischemia: Then, Now, and Tomorrow: The Thomas Willis Lecture-2000 // Stroke. — 2000. — Vol. 31. — P. 2011-2023.
7. Breuer L., Huttner H.B., Jentsch K. et al. Intravenous Thrombolysis in Posterior Cerebral Artery Infarctions // Cerebrovasc Dis. — 2011. — Vol. 31. — P. 448-454.
8. Caplan L., Bogousslavsky J. Posterior cerebral artery syndromes // Cerebrovascular Disease: Pathology, Diagnosis and Management. — 1998. — P. 1028.
9. Caplan L., Estol C., Massaro A. Dissection of the posterior cerebral arteries // Arch Neurol. — 2005. — Vol. 62. — P. 1138-1143.
10. Бразис П. Топическая диагностика в клинической неврологии / П. Бразис, Д. Мэсдью, Х. Биллер — М.: МЕДпресс-информ, 2009. — 736 с.
11. Caplan L. Posterior Circulation disease: Clinical Findings, Diagnosis and Management / Boston, MA: Butterworth-Heinemann, 1996. — 533 p.
12. Бер М. Топический диагноз в неврологии по Петеру Дуусу / М. Бер, М. Фрот-шер. — М.: Практическая медицина, 2009. — 468 с.
13. Tatu L., Moulin T., Bogousslavsky J. et al. Arterial territories of the human brain // Neurology. — 1998. — Vol. 50 — P. 1699-1708.
14. de Monye C., Dippel D.W., Siepman T.A. et al. Is a fetal origin of the posterior cerebral artery a risk factor for TIA or ischemic stroke? A study with 16-multidetector-row CT angiography // J. Neurol. — 2008. — Vol. 255 — P. 239-245.
15. Meier N., Fischer U., Schroth G. Outcome after thrombolysis for acute isolated posterior cerebral artery occlusion // Cerebrovasc. Dis. — 2011. — Vol. 328. — P. 79-88.
16. Phan T., Fong A., Donnan G. et al. Digital map of posterior cerebral artery infarcts associated with posterior cerebral artery trunk and branch occlusion // Stroke. — 2007. — Vol. 38. — P.1805-1811.
17. Chaves C.J. Posterior cerebral artery. Stroke syndromes. 2nd edition / Chaves C.J., Caplan L.R. Cambridge, New York: Cambridge University Press. — 2001. — 747 p.
18. Cals N., Devuyst G., Afsar N. et al. Pure superficial posterior cerebral artery territory infarction in the Lausanne Stroke Registry // J. Neurol. — 2002. — Vol. 249. — P. 855-861.
19. Kumral E., Bayulkem G., Atac C., Alper Y. Spectrum of superficial posterior cerebral artery territory infarcts // Eur. J. Neurol. — 2004. — Vol. 11. — P. 237-246.
20. Ng Y.S., Stein J., Salles S.S. et al. Clinical characteristics and rehabilitation outcomes of patients with posterior cerebral artery stroke // Arch. Phys. Med. Rahabil. — 2005. — Vol. 86. — P. 2138-43.
21. Brandt T., Thie A., Caplan L. et al. Infarkte in Versorgungsgebiet der A. cerebri Posterior // Nervenarzt. — 1995. — Vol. 66. — P. 267-274.
22. Savitz S.I., Caplan L.R. Vertebrobasilar disease // N. Engl. J. Med. — 2005. — Vol. 352. — P. 2618-26.
23. Finelli P. Magnetic Resonance Correlate of Hemiparesis in Posterior Cerebral Artery Infarction // Journal of Stroke and Cerebrovascular Disease. — 2008. — Vol. 17. — P. 378-381.
24. Maulaz A.B., Bezerra D.C., Bogousslavsky J. Posterior cerebral artery infarction from middle cerebral artery infarction // Arch. Neurol. — 2005. — Vol. 62. — P. 938-941.
25. Neau J.-P., Bogousslavsky J. The syndrome of posterior choroidal artery territory infarction // Ann. Neurol. — 1996. — Vol. 39. — P. 779-788.
26. Lee E., Kang D.W., Kwon S.U., Kim J.S. Posterior cerebral artery infarction: diffusion-weighted MRI analysis of 205 patients // Cerebrovasc. Dis. — 2009. — Vol. 28. — P. 298-305.
27. Богданов Э.И., Хасанов И.А., Мамедов Х.И. и др. Cиндром задней обратимой лейкоэнцефалопатии у больных с преэклампсией и эклампсией // Неврологиче-ский журнал. — 2011. — № 5. — С. 35-40.
28. Adams H., Del Zoppo G., Alberts M. et al. Guidelines for the early management of adults with ischemic stroke // Stroke. — 2007. — Vol. 38. — P. 1655-1711.
29. Wahlgren N., Ahmed N., Davalos A. et al. Thrombolysis with alteplase for acute ischemic stroke & the Safe implementation of thrombolysis in stroke — monitoring study (SITS-MOST): an observational study // Lancet. — 2007. — Vol. 369. — P. 275-282.
30. Berge E., Nakstad P.H., Sandset P.M. Large middle cerebral artery infarctions and the hyperdense middle cerebral artery sign in patients with atrial fibrillation // Acta Radiol. — 2001. — Vol. 42. — P. 261-268.
31. Covarrubias D.J., Leutmer P.H., Caumpeau N.G. Posterior reversible leukoencephalopathy syndrome: prognostic utility of quantitative diffusion-weighted MR image // AJNR Am J. Neuroradiol. — 2002. — Vol. 23, N 6. — P. 1038-1048.
32. Garg R. Posterior leukoencephalopathy syndrome // Postgrad. Med. J. — 2001. — Vol. 77, N 903. — P. 24-28.
33. Choi C., Lee D., Lee J. et al. Detection of intracranial atherosclerotic steno-occlusive disease with 3D time-of-flight magnetic resonance angiography with sensitivity encoding at 3T // AJNR Am J. Neuroradiol. — 2007. — Vol. 28. — P. 439-446.
34. Lev M., Farkas J., Rodrigues V. et al. CT angiography in the rapid triage of patients with hyperacute stroke to intraarterial thrombolysis: accuracy in the detection of large vessel thrombus // J Comput Assist Tomogr. — 2001. — Vol. 25. — P. 520-528.
35. Ntaios G., Spengos K., Vemmou A. M. et al. Long-term outcome in posterior cerebral artery stroke // European Journal of Neurology. — 2011. — P. 156-162.
36. Forster A., Gass A., Kern R. et al. MR Imaging-Guided Intravenous Thrombolysis in Posterior Cerebral Artery Stroke // AJNR Am J. Neuroradiol. — 2011. — Vol. 32. — P. 419-421.
37. Montavont A., Nighoghossian N., Derex. L et al. Intravenous r-TPA in vertebrobasilar acute infarcts // Neurology. — 2004. — Vol. 62. — P. 1854-1856.
Диагностика
Диагностировать гипоплазию нелегко как раз из-за слабой симптоматики. Лечением патологии занимается невропатолог, к которому на прием и необходимо приходить. Обычно обращение происходит после появления первых признаков – лучше не медлить, так как мозг явно испытывает проблемы с кровоснабжением, иначе симптомов бы и не было.
Особенности диагностики
Сначала врач опрашивает пациента, узнает, на что тот жалуется, после этого осматривает больного. Далее понадобится сдать ряд анализов и пройти некоторые исследования, чтобы появилась возможность поставить точный диагноз.
Врачи используют следующие методы исследований для подтверждения диагноза.
- УЗИ сосудов шеи и головы. За счет такого исследования есть возможность уточнить диаметр артерии и интенсивность кровотока. Если артерия имеет диаметр менее 2 мм, то это уже считается патологией. Нормальный диаметр артерии позвоночного столба – 3,6-3,8 мм.
- Компьютерная томография головного мозга и шеи. Исследование дает возможность оценить состояние сосудов за счет использования специального вещества-контраста.
- Ангиография. Это исследование с использованием рентгеновских лучей и специальных контрастирующих препаратов. Дает возможность обнаружить аномалию строения сосудов.
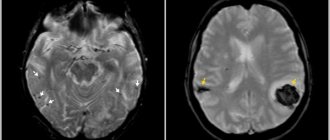
Снимок МРТ
Мозолистое тело и пограничное расстройство личности
CC ( corpus callosum ) содержит от 200 до 800 миллионов волокон, которые грубо организованы топографическим способом. Волокна малого диаметра, которые чаще встречаются в колене и сплениуме СС, соединяют префронтальные и височно -теменные области головного мозга, тогда как волокна большого диаметра, которые являются более распространенными в мозге и перешеек мозолистого тела , соединяют зрительные, слуховые и соматосенсорные области. Таким образом, СС вовлечено в интеграцию информации между полушариями, которая необходима для эффективной координации когнитивных процессов, эмоций и поведения. Обнаружено, что нарушенная взаимосвязь между полушариями связана с когнитивными, эмоциональными и поведенческими расстройствами, в том числе с тяжелыми, такими как, например, суицидальное поведение.
Структурные изменения мозолистого тела весьма распространены среди психических расстройств, которые характеризуются значительным дефицитом в регулировании эмоций и за импульсами , что , например , встречается при биполярном расстройстве (BD); или расстройстве дефицита внимания / гиперактивности (ADHD). Пограничное расстройство личности (BPD) имеет общие черты с BD.
Структурные изменения мозолистого тела (corpus callosum — СС), основного участка белого вещества, связывающего функционально области головного мозга двух полушарий, связаны с эмоциональной нестабильностью, импульсивностью и суицидальным поведением при различных психических расстройствах. Выявлена положительная корреляция между суицидальным поведением при пограничном расстройстве личности и фракционной анизотропией (FA) в сплениуме и колене CC и отрицательная корреляция между суицидальным поведением больных пограничным расстройством личности и средней диффузностью (MD) в сплениуме CC.
В литературе указывается о целесообразности использования DTI для исследования структурной целостности CC, основного участка белого вещества, связывающего функционально области мозга в двух полушариях. Структурные изменения в колене и сплениуме СС, по-видимому, объясняют суицидальное поведение при различных расстройствах, по-видимому, из-за общих, а не беспорядочно-дефицитных нарушений регуляции эмоций и нарушении контроля за импульсами. Тем не менее, пациенты, склонные к суицидальному поведению, не только демонстрируют дефицит в регулировании эмоций и импульсном контроле, но также и дефицит при решении проблем.
Как жить с гипоплазией?
Шаг 1. Требуется отказаться от употребления некачественных или вредных продуктов питания.
Откажитесь от вредных продуктов
Шаг 2. Нужно употреблять в пищу только качественные и натуральные продукты. В первую очередь, важно помнить о том, что жиры должны быть полезными. В противном случае кровеносная система сильно страдает.
Питайтесь качественными продуктами
Шаг 3. Рекомендуется есть как можно больше клетчатки. Ее много в брокколи, рисе, цельнозерновом хлебе и т. д.
Употребляйте больше клетчатки
Шаг 4. Важно пить много чистой воды или воды с антиоксидантами – например, лимоном.
Пейте воду с антиоксидантами
Шаг 5. Рекомендуется равномерно распределять рабочее время и время отдыха и обязательно ввести в свою жизнь физическую нагрузку.
Не забывайте о физических нагрузках
Атлетический пояс
Шаг 6. Следует отказаться от курения.
Бросьте курить
Шаг 7. Необходимо оградить себя от стрессов и как можно чаще проводить время весело и в приятной компании.