Анализы и диагностика
Для выявления истинной причины изменений в миокарде рекомендуется пройти полное обследование, которое включает:
- Общий анализ и биохимический анализ крови. По результатам можно будет говорить о наличии воспалительного процесса в организме, работе почечной системы и почек, уровне холестерина, который формирует бляшки в коронарных артериях.
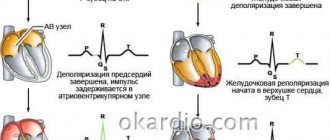
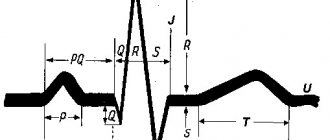
- ЭКГ. Характерные изменения при проведении обследования позволяют определиться с дальнейшей тактикой обследования. В некоторых случаях рекомендуется провести ЭКГ с нагрузкой, либо организовать суточный мониторинг ЭКГ.
- ЭхоКГ. Ультразвуковое исследование сердца позволяет оценить состояние клапанного аппарата сердца, выявить зоны повреждения, оценить насосную функцию сердца.
- Сцинтиграфия миокарда. Радиоизотопный метод исследования показывает участки накопления специального вещества для выявления участков поражения, определения их характера.
Изменения миокарда на ЭКГ позволяют определиться с дальнейшей тактикой обследования пациента для установки точного диагноза и подбора правильной терапии.
Лечение
При выявлении острого коронарного синдрома на ЭКГ, который свидетельствует об остром поражении миокарда в результате некроза мышцы, пациента экстренно госпитализируют в кардиологическое отделение с возможностью проведения коронароангиографии и определения дальнейшей тактики лечения.
При выявлении диффузных и дистрофических изменений проводится лечение основного заболевания, которое их могло спровоцировать. Дополнительно проводится метаболическая терапия, направленная на улучшение питания миокарда для его скорейшее восстановление.
Причины
Дистрофические изменения миокарда
Такие изменения на ЭКГ формируются при недостаточном питании кардиомиоцитов, что неизбежно ведёт к снижению сократительной способности левого желудочка. Диффузно-дистрофические изменения в миокарде наблюдается при:
- патологии эндокринной системы: сахарный диабет, дисфункция надпочечников, нарушения в работе щитовидной железы;
- патологии почечной системы и печени: избыточное количество токсических продуктов обмена негативно влияет на работу сердца;
- хронически протекающих заболеваниях инфекционного генеза: изменения могут наблюдаться при туберкулёзе, гриппе, малярии и т.д.;
- хронической железодефицитной анемии: постоянное кислородное голодание сказывается на работе кардиомиоцитов;
- при несбелансированном питании, при витаминодефиците в рационе;
- при чрезмерных нервных и физических перегрузках;
- при лихорадке и сопутствующем обезвоживании;
- при отравлении алкоголем, медикаментами либо химическими компонентами.
Метаболические изменения в миокарде
Что это такое? Характерные неспецифические изменения на ЭКГ формируются в результате нарушений внутриклеточных обменных процессов, связанных с ионами калия и натрия.
Метаболические изменения связаны с дистрофией сердечной мышцы и проявляются при:
- ишемии миокарда, которая отражается на кардиограмме в виде отклонений зубца Т. Меняется его полярность и форма в соответствующих повреждённых участкам отведениях;
- инфаркте миокарда: на ЭКГ меняется расположение сегмента ST, которые располагается либо выше, либо ниже изолинии;
- отмирании, некрозе миокарда, для которого свойственно появление аномального зубца Q.
Рубцовые изменения
Участки рубцовой ткани формируются на месте бывшего воспалительного процесса, некроза, в результате которого нормальные, здоровые кардиомиоциты потеряли свою сократительную способность, и произошло их замещение соединительной тканью, которая не обладает эластичностью. Рубцовые изменения очагового характера на ЭКГ говорят о перенесённом в прошлом инфаркте миокарда.
- Для нижней стенки левого желудочка характерны изменения в отведениях: II, III и a VF (говорит о повреждении правой, реже левой огибающей коронарной артерии).
- Для передне перегородочной области характерны изменения в отведениях: V1 и V2 (повреждена левая нисходящая септальная ветвь), либо V2-V4 (вовлечена левая нисходящая коронарная артерия, либо её ветви).
- Для переднее-латеральной области характерны изменения в отведениях: I, aVL, V4-V6 (повреждена огибающая артерия либо левая нисходящая).
- Для переднего распространённого инфаркта характерны изменения в отведениях: I, aVL, V1-V6 (повреждена левая нисходящая коронарная ветвь).
Умеренные изменения миокарда воспалительного характера
Характерные изменения наблюдаются при миокардите, при котором снижается вольтаж зубцов во всех отведениях, и регистрируются нарушения ритма. Умеренные изменения левого желудочка могут возникнуть после:
- сыпного тифа, дифтерии;
- ревматизма, после стрептококковой инфекции (тонзиллит, ангина, скарлатина);
- инфекции, вызванной вирусом Коксаки, краснухи, гриппа, кори;
- обострения аутоиммунного заболевания (системная красная волчанка, склеродермия).
Бурая атрофия миокарда
Так называют макропрепарат при гистологическом исследовании. Характерные патологические изменения в миокарде формируются в результате длительного недостатка кровоснабжения, что наблюдается при истощающих заболеваниях, кахексии, злоупотреблении лекарственными препаратами, повышенных физических нагрузках, а также в старости. В кардиомиоцитах происходит отложение специфического пигмента старения – липофусцина. Его гранулы являются продуктом нарушенного метаболизма в клетках сердечной мышцы, ослабленных недостаточным питанием и кровоснабжением.
В начале эры хирургического лечения ишемической болезни сердца основным показанием к реконструкции левого желудочка являлась аневризма его стенки. Позже появились понятия «ишемическая кардиомиопатия» и «ишемическая застойная сердечная недостаточность», при которых стали выполнять реконструкцию левого желудочка (ЛЖ). Традиционно оценку размеров и топографии аневризмы ЛЖ выполняли с помощью рентгеноконтрастной вентрикулографии. Затем стали использовать радиоизотопные, ультразвуковые методы, магнитно-резонансную и компьютерную томографии.
В 2009 г. были опубликованы результаты исследования STICH [1], которые противоречили подобной тактике. Среди прочих выводов этой работы имелся следующий: «Мы согласны с тем, что некоторым больным реконструкция ЛЖ позволяет значительно улучшить их функциональное состояние и показатели внутрисердечной гемодинамики, однако результаты нашего исследования не позволяют определить эту группу больных».
В общем виде претензии оппонентов к исследованию STICH можно изложить словами G. Buckberg, С. Athanasuleas: «Математическая модель, основанная на некорректной базе клинических данных, ведет к ошибкам в клинических заключениях» [2]. Претензиями оппонентов по вопросу о выборе критериев реконструкции ЛЖ у больных с постинфарктной сердечной недостаточностью стали следующие: 1) недифференцированный отбор больных для такого исследования; 2) неадекватный выбор методов оценки жизнеспособного миокарда и размеров ЛЖ. Еще при планировании исследования STICH G. Buckberg [3] призывал уделить особое внимание оценке жизнеспособного миокарда в этой работе. J. Ghali и соавт. [4] отмечают отсутствие информации о больших, дискинетических аневризмах [4]. М. Antunes и соавт. [5] подчеркивали, что 5-летняя выживаемость у больных с большими аневризмами без хирургической реконструкции ЛЖ колеблется от 47 до 70%. С. Athanasuleas и соавт. [8] отмечают, что при выполнении хирургической реконструкции ЛЖ отсутствуют данные о жизнеспособности, подтверждающие региональный некроз миокарда, а у 13% больных инфаркта миокарда не было и в анамнезе. Только в 50% случаев отмечены акинезия или дискинезия. По мнению С. Athanasuleas и соавт. [8], достойные доверия исследования призывают использовать оценку конечного систолического объема методом магнитно-резонансной томографии (МРТ). Однако в исследовании STICH [7] эти измерения выполнили методом эхокардиографии (ЭхоКГ) и только у 38% больных. У пациентов в исследовании STICH, которым наряду с аортокоронарным шунтированием (АКШ) выполнялась хирургическая реконструкция ЛЖ, наблюдалось снижение индексированного конечного систолического объема на 19% по сравнению с 40% снижением этого же показателя в большинстве исследований, в которых производилась хирургическая реконструкция [8—10]. С. Athanasuleas и соавт. [8—10] замечают, что результаты обследования больных, подвергнутых хирургической реконструкции ЛЖ в исследовании STICH, не сравнимы с результатами международной базы данных, состоящей из 5000 пациентов, у которых региональный некроз миокарда составил 35% и более, индексированный к площади поверхности тела конечный систолический объем ЛЖ был не менее 60 мл/м2, а фракция выброса (ФВ) ЛЖ — 35% и менее.
Сам протокол STICH, пишет С. Athanasuleas, не соответствует методическим рекомендациям для таких исследований прежде всего из-за неправильного отбора пациентов. Функция ЛЖ и течение хронической сердечной недостаточности улучшаются в тех случаях, когда удается значительно уменьшить систолический объем ЛЖ в результате кардиохирургической операции, поэтому надежные исследования хирургической реконструкции желудочка обусловливают необходимость отбора пациентов с некрозом не менее 35% передней стенки, верифицированного с помощью томосцинтиграфии, с индексированным конечным систолическим объемом, равным хотя бы 60 мл/м2 и его уменьшением в результате операции на 30%. [7]. Именно увеличение объема ЛЖ, а не снижение ФВ становится важным прогностическим фактором смертности [11]. Реконструкция ЛЖ удаляет рубец, который вызывает перерастяжение контралатеральной компенсаторно функционирующей мышцы [12], и позволяет восстановить размеры ЛЖ. Суть проблемы застойной сердечной недостаточности ишемической природы заключается в резко возросшем кислородном запросе миокарда, оставшегося жизнеспособным в ЛЖ [13]. Если фиброз занимает 20—25% поверхности ЛЖ, степень укорочения, требуемая от оставшегося функционирующего миокарда, превышает физиологический лимит [14]. Таким образом, определение размеров зоны кардиосклероза должно было бы стать неотъемлемой частью исследования STICH, тем более если хирург решил выполнять реконструкцию желудочка.
После реваскуляризации уменьшение размеров полости ЛЖ происходит за счет зон миокарда, включающих субэндокардиальные изменения толщиной до половины стенки желудочка. Более глубокое субэндокардиальное повреждение не всегда приводит к реальному восстановлению функции стенки желудочка, тем более если речь идет о трансмуральном повреждении с зоной сплошного некроза [15]. При вентрикулотомии у больных сердечной недостаточностью решающее прогностическое значение оценки степени и размеров кардиофиброза было отмечено еще в 1998 г. [16], а позднее подтверждено в эксперименте [17].
Отвечая критикам, авторы STICH пишут, что в исследовании у некоторых больных использовали МРТ, у других — томосцинтиграфию, синхронизированную с ЭКГ, и у всех остальных пациентов — ЭхоКГ [18]. У пациентов, которым выполняли более одного исследования, результаты были сопоставимы. Авторы ссылаются на современные публикации, где подтверждается использование ультразвукового метода для оценки геометрии и функции ЛЖ до и после его реконструкции. М. Donato и соавт. [19] также использовали ЭхоКГ для оценки объемов и ФВ ЛЖ до и после его реконструкции.
Однако оценка размеров рубца и собственно степени рубцовых изменений стенки не доступна и при проведении ЭхоКГ с добутаминовой пробой. Дифференцировать «содержимое» стенки ЛЖ позволяют только сцинтиграфия миокарда и МРТ. Если МРТ позволяет наиболее точно оценить топографию и размеры зоны кардиосклероза, то сцинтиграфия дает возможность оценить распределение перфузии и количество миокарда, оставшегося жизнеспособным. Поскольку этими двумя методами оценивают все же «две стороны» хоть и «одной медали», возможны реальные различия в толковании полученных результатов.
Мы решили сравнить исходные заключения визуализирующих методов о наличии передней аневризмы ЛЖ с видом выполненных кардиохирургических вмешательств за период с 2010 по 2011 г. в центре им. акад. В.И. Шумакова. Выделили результаты исследования лишь тех больных (всего более 200), кому перфузионная томосцинтиграфия, синхронизированная с ЭКГ (ПТС с ЭКГ), была выполнена не только до, но и после операции. Всем этим больным была одновременно выполнена ЭхоКГ, многим выполнена рентгеноконтрастная вентрикулография и МРТ миокарда с введением контрастного вещества. Результаты разделили на группы в зависимости от размеров трансмурального рубца, рассчитанного по результатам ПТС с ЭКГ. Были сформированы следующие группы:
1-я группа — больные, у которых размер трансмурального рубца ≥30% миокарда (табл. 1).
Всем больным этой группы была выполнена резекция аневризмы в сочетании с АКШ;
2-я группа — больные, у которых размер трансмурального рубца ≤30% (табл. 2).
Всем больным этой группы выполнена либо аневризмография, либо (2 случая) резекция верхушечных аневризм в сочетании с АКШ;
3-я группа — больные, которым было выполнено только АКШ (табл. 3).
Из таблиц видно, что наиболее полное совпадение заключений различных методов о наличии аневризмы передней стенки ЛЖ наблюдается у больных с размером трансмурального рубца, занимающего более 30% площади всего ЛЖ.
По мере уменьшения размеров рубца и включения в состав рубцовой стенки живого миокарда (фиброзно-мышечные изменения) снижается и частота совпадений заключений разных методов о наличии аневризмы. Различия заключений в группе больных, которым было выполнено только АКШ без какой-либо реконструкции ЛЖ, становятся максимальными.
Приводим пример такого различия.
Больная В., 65 лет. Дата поступления:17.01.11.
Клинический диагноз: ИБС. Стенокардия напряжения. III ФК. Постинфарктный кардиосклероз (1995, 2005). Хроническая фиброзно-мышечная аневризма ЛЖ. Гипертоническая болезнь III стадии. Недостаточность кровообращения 1-й степени. Цереброваскулярная болезнь. Дисциркуляторная энцефалопатия 1—2-й степени. Тревожно-депрессивный синдром. Аутоиммунный тиреоидит, субклинический гипотиреоз. Хронический гастрит.
Жалобы при поступлении: на дискомфорт за грудиной, боли в левом плече, чувство кома в горле при небольших физических и психоэмоциональных нагрузках, купирующиеся при прекращении нагрузки, повышение артериального давления до 200/110 мм рт.ст.
Анамнез заболевания: долгие годы (с 35-летнего возраста) страдает артериальной гипертензией до 200/110 мм рт.ст. Антигипертензивная терапия симптоматическая. В 1995 г. перенесла острый инфаркт миокарда задней стенки, в 2005 г. — инфаркт миокарда передней стенки, после чего появились и стали прогрессировать указанные жалобы. В декабре 2010 г. находилась на обследовании с диагнозом нестабильная стенокардия, была проведена коронарография, при которой выявлено многососудистое стенотическое поражение коронарных артерий, рекомендовано хирургическое лечение.
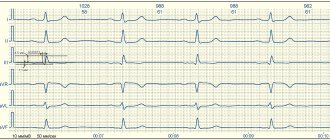
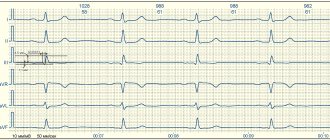
ЭКГ: ритм синусовый, частота сердечных сокращений 56 уд/мин (рис. 1).
Рисунок 1. Электрокардиограмма больной В. Рубцовые изменения по переднеперегородочной области с переходом на верхушку. Снижение кровоснабжения по переднеперегородочной и верхушечной области ЛЖ.
ЭхоКГ: аорта 2,7 см, левое предсердие 4,0 см, правый желудочек 2,5 см, межжелудочковая перегородка 1,4 см, толщина задней стенки ЛЖ 1,25 см, конечный диастолический размер ЛЖ 5,0 см, конечный систолический размер 2,7 см, ударный объем 88 мл, конечный диастолический объем 115 мл, конечный систолический объем 27 мл, ФВ 63%. Отмечается акинезия нижней трети межжелудочковой перегородки, верхушки. Нельзя исключить наличие тромба в области верхушки. Аортальный и митральный клапаны атеросклеротически уплотнены. Среднее расчетное давление в легочной артерии 28 мм рт.ст.
Коронарография: правый тип коронарного кровоснабжения. Отмечаются диффузные изменения в виде неровности контуров, извитости дистального русла. Ствол левой коронарной артерии — стеноз 2-й степени в дистальной трети. Передняя межжелудочковая артерия — окклюзия в проксимальной трети с ретроградным заполнением по межартериальным анастомозам. Огибающая ветвь представлена крупной ветвью тупого края — стеноз 2—3-й степени в устье. Правая коронарная артерия — стеноз 3-й степени в устье, критический стеноз в средней трети, стеноз 3-й степени в дистальной трети.
Перфузионная томосцинтиграфия миокарда: визуализируется миокард неувеличенного ЛЖ с глубоким точечным снижением перфузии на верхушке с распространением умеренной гипоперфузии на переднюю стенку. Нарушение диастолической функции. Акинезия с явлениями парадоксальной пульсации в зоне снижения перфузии. ФВ ЛЖ 46%. Признаки субэндокардиальных изменений и ишемии миокарда по передневерхушечной области с максимумом на верхушке.
МРТ сердца — признаки фиброзно-мышечной аневризмы ЛЖ переднесептально-верхушечной локализации. Тромбов в полости ЛЖ не выявлено. ФВ 50%, конечный диастолический объем 109 мл, конечный систолический объем 54 мл, ударный объем 55 мл.
На изображениях МРТ видна обширная зона белесоватого включения индикатора в области переднеперегородочной стенки — зона кардиосклероза (см. рис. 2, а и далее на цв. вклейке).
Рисунок 2. Изображения миокарда левого желудочка, полученные у больной В. А — магнитно-резонансная томограмма; Б, В — перфузионная томосцинтиграмма, синхронизированная с электрокардиографией (Б — до операции, В — после операции). Срезы представлены в идентичных проекциях. Зоны кардиосклероза и жизнеспособного миокарда указаны стрелками. Внизу — шкала оценки жизнеспособности миокарда по перфузионным сцинтиграммам. В этом же месте на срезах ПТС с ЭКГ видно снижение перфузии, однако оставшегося миокарда достаточно, чтобы считать эту стенку жизнеспособной (рис. 2, б). Подтверждением этому заключению являются изображения этих же срезов после реваскуляризации (рис. 2, в).
24.01.11 больной произведена операция: маммарокоронарный анастомоз с передней межжелудочковой ветвью с эндартерэктомией, аутовенозное АКШ правой коронарной артерии и ветви тупого края, Y-образное шунтирование диагональной ветви в условиях искусственного кровообращения и фармакохолодовой кардиоплегии. Послеоперационный период протекал гладко, без осложнений. 01.02.11 больная выписана в удовлетворительном состоянии.
Количественная оценка наблюдаемых после операции изменений представлена на рис. 3.
Рисунок 3. Количественная оценка динамики перфузии миокарда после его реваскуляризации у больной В. А — до васкуляризации; Б — после реваскуляризации. Представлены срединные срезы в трех стандартных плоскостях, стандартная трехмерная карта перфузии миокарда левого желудочка («бычий глаз») с количественной оценкой по 17 сегментам и трехмерным изображением желудочка. После реваскуляризации отмечено отчетливое уменьшение глубины и распространенности нарушений перфузии в передней стенке ЛЖ, сопровождающиеся ростом ФВ ЛЖ.
Поэтому ответ диагноста всегда зависит от того, как сформулирован вопрос клинициста. Однако вопрос может быть сформулирован по-разному. Демонстрацией несоответствия между вопросом и результатами может служить следующий пример.
Клинический случай 2.
Пациентка К., 52 лет, находилась на лечении с 02.02.10 по 01.03.10.
Диагноз при поступлении: ИБС. Нестабильная стенокардия. Постинфарктный кардиосклероз (2005). Фиброзно-мышечная аневризма ЛЖ. Гипертоническая болезнь III стадии. Хронический бронхит. Хронический гастрит.
Жалобы при поступлении: на жгучие, давящие боли за грудиной с иррадиацией в левое плечо и левую половину грудной клетки, дискомфорт в области сердца, приступы удушья при физической нагрузке, сердцебиение, проходящие в покое, повышение АД до 220/140 мм рт.ст.
Анамнез заболевания: с 40-летнего возраста — артериальная гипертензия до 220/140 мм рт.ст. при рабочем АД 150/90 мм рт.ст. С 2004 г. появились приступы стенокардии при физической нагрузке. Неоднократно госпитализировалась в стационар. Острый инфаркт миокарда в 2005 г. В сентябре 2009 г., по данным обследования, выявлена аневризма ЛЖ, ФВ 45%. Постоянно принимает аккупро, гипотиазид, конкор, тромбоАсс. Амбулаторное и стационарное лечение без эффекта. Поступила в ФНЦ ТиИО им. акад. В.И. Шумакова для проведения коронарографии и решения вопроса о дальнейшей тактике лечения.
ЭКГ: синусовая брадикардия, частота сердечных сокращений 55 уд/мин. Субэндокардиальные очаговые изменения миокарда по задней и передневерхушечной области с признаками аневризмы.
ЭхоКГ: аорта 2,6 см, левое предсердие 5,1 см, правый желудочек 2,8 см, межжелудочковая перегородка 1,8 см, толщина задней стенки левого желудочка 1,4 см, конечный диастолический объем 228 мл, конечный систолический объем 130 мл, ударный объем 98 мл, ФВ 44%. Диастолическая функция нарушена по первому типу. Акинезия передневерхушечного и переднеперегородочного сегментов, гипокинезия нижней трети межжелудочковой перегородки, заднебазального сегментов. Нельзя исключить наличие пристеночного верхушечного тромба. Клапанный аппарат без особенностей. Жидкости в полости перикарда нет. Среднее расчетное давление в легочной артерии 27 мм рт.ст.
Коронарография: правый тип коронарного кровоснабжения. Отмечаются диффузные изменения в виде неровности контуров, извитости дистального русла, замедления пассажа контрастного вещества. Ствол левой коронарной артерии: стенотическое поражение не выявлено. Передняя межжелудочковая артерия: протяженный стеноз 2-й степени в проксимальной трети. Диагональная ветвь: стеноз 3-й степени в устье. Огибающая ветвь — стеноз 3-й степени в проксимальной трети, стеноз 2-й степени в средней трети. Правая коронарная артерия: стеноз 3-й степени в проксимальной трети.
Перфузионная томосцинтиграфия миокарда, синхронизированная с ЭКГ (рис. 4, а):
Рисунок 4. Исследование перфузии миокарда левого желудочка у больной К. А — до операции; Б — после операции пликации аневризмы левого желудочка. Стрелками указан дефект перфузии в области верхушки левого желудочка. отчетливо визуализируется миокард неувеличенного ЛЖ (конечный диастолический объем 180 мл) с умеренным снижением перфузии по заднебоковой стенке ЛЖ. Уровень снижения перфузии умеренный (менее 50%). Перфузия передней стенки удовлетворительная, умеренное снижение перфузии верхушечно-перегородочного сегмента. Отмечаются гипокинезия и снижение систолического утолщения по переднеперегородочной области. Можно предполагать умеренное очаговое изменение по заднебоковой стенке и верхушечных отделах межжелудочковой перегородки. Весь миокард потенциально жизнеспособен. Данных, подтверждающих аневризму ЛЖ, не получено.
МРТ сердца: гипертрофия миокарда ЛЖ. Данных, подтверждающих аневризму ЛЖ и тромб в полости ЛЖ, не получено.
Рентгенография органов грудной клетки: легочные поля без патологических затемнений. Корни расширены, структурные. Синусы свободные. Диафрагма подвижная. Сердце расширено влево.
12.02.10 больной выполнена операция: пликация аневризмы ЛЖ, маммарокоронарный анастомоз с передней межжелудочковой артерией, АКШ правой коронарной артерии, ветви тупого края и диагональной ветви в условиях искусственного кровообращения. Послеоперационный период протекал достаточно гладко. Послеоперационные швы без признаков воспаления, заживали первичным натяжением, консолидация грудины удовлетворительная. В относительно удовлетворительном состоянии пациентка выписана под наблюдение кардиолога по месту жительства.
Казалось бы, оба метода, способные дифференцировать содержимое стенки ЛЖ, сказали «нет» аневризме ЛЖ. Более того, результаты МРТ исключили наличие тромба внутри желудочка. Но хирурги увидели «западение» стенки и сделали ее пликацию.
А что же изменилось на изображениях миокарда? Видно, что исходно миокард абсолютно сохранен (см. рис. 4, а). После пликации сохранного миокарда перфузия на верхушке ухудшается, возникает дефект перфузии (указано стрелкой) (см. рис. 4, б).
Случай 2 иллюстрирует другую мысль оппонента STICH, G. Buckberg [20]: «Хирург не может знать, когда следует выполнять реконструкцию без точной информации о жизнеспособности и объемах».
Из 1212 больных в исследовании STICH жизнеспособность миокарда оценили только у 774 пациентов [21]. Основным методом оценки жизнеспособности была ЭхоКГ с добутамином. Однако этот метод не позволяет определить размеры трансмурального рубца. В 1996 г. R. Medrano и соавт. [22], исследуя эксплантированные при трансплантации сердца, сравнили результаты предоперационной ЭхоКГ и томосцинтиграфии для оценки размеров и толщины рубцовых зон. Оказалось, что 40% (!) зон акинеза и дискинеза содержали неизмененный миокард. В этом свете критерий отбора на резекцию миокарда, использованный авторами STICH: «…пациентов, у которых находили акинез или дискинез передней стенки левого желудочка рассматривали как нуждающихся в реконструкции желудочка…», выглядит более чем сомнительным. Томосцинтиграфия, напротив, позволяла точно диагностировать и оценивать размеры очагов кардиосклероза, что подтвердили результаты микроскопии [22]. Необходимо напомнить, что даже после полной реваскуляризации далеко не весь миокард сразу восстанавливает свою функцию. Иногда для этого требуются месяцы и даже годы [23]. В исследовании [24], где сравнивали оценку кардиосклероза методом ЭхоКГ с добутамином и перфузионной сцинтиграфии, было показано, что сократительный резерв может быть нарушен и в отсутствие значимого кардиосклероза, тогда как при значительном кардиосклерозе утолщение стенки может сохраняться. Следовательно, высока вероятность того, что результаты STICH могли быть искажены, например случаями резекции жизнеспособного миокарда.
Формулируя диагноз больных, которым выполняли реконструкцию ЛЖ, авторы STICH используют термин «ишемическая застойная сердечная недостаточность». Но этот диагноз клинический и не может быть показанием к реконструкции ЛЖ. В современных руководствах по кардиохирургии также понятие об аневризме левого желудочка стали заменять «постинфарктным ремоделированием» [25]. В большей степени инструментальное «постинфарктное ремоделирование» понятие очень широкое и также не может быть показанием к реконструкции ЛЖ. Вместе с исчезновением понятия «аневризма ЛЖ» исчезло и четкое обоснование показаний к реконструкции ЛЖ, основанное на объеме и глубине повреждения миокарда. В результате любое выбухание стенки становится поводом для реконструкции желудочка. Зачем тогда говорить о жизнеспособности?
Упрощению представлений о жизнеспособном миокарде способствовало появление множества методов, визуализирующих миокард, что требует грамотности со стороны клиницистов, принимающих решение о тактике лечения [25]. Собственно МРТ, несмотря на самое высокое разрешение изображений, визуализирует стенку миокарда без дифференцировки ее содержимого. При дополнительном использовании контрастного вещества (гадолиний), которое включается в зоны сформировавшегося кардиосклероза, появляется возможность визуализации рубцов. В сохранные кардиомиоциты гадолиний не включается и, следовательно, не в состоянии показать их метаболизм. Включаются в метаболизм кардиомиоцитов и, следовательно, показывают степень сохранности, жизнеспособности и уровень перфузии миокарда именно радионуклидные агенты. Конечно, МРТ с гадолинием может визуализировать такие маленькие очаги кардиосклероза, которые не визуализируются при сцинтиграфии. Но что это означает с практической точки зрения? С практической точки зрения это означает, что «живого» миокарда в этой стенке несравнимо больше, чем участков кардиосклероза. Такой миокард необходимо реваскуляризировать, но ни в коем случае не «реконструировать». Поэтому, проигрывая в точности определения зон кардиосклероза, сцинтиграфия может оказаться чувствительнее в оценке миокарда, оставшегося жизнеспособным [26, 27].
К чему же привели замены представлений о постинфарктной аневризме и упрощения в показаниях к реконструкции дисфункциональной стенки ЛЖ? К заключению авторов STICH [1]: «мы согласны с тем, что некоторым больным реконструкция левого желудочка позволяет значительно улучшить их функциональное состояние и показатели внутрисердечной гемодинамики, однако результаты нашего исследования не позволяют определить эту группу больных». Соответственно этим выводам, можно лишь «поздравить» кардиохирургов с тем, что ныне не существует показаний к хирургической реконструкции ЛЖ. Документ доказательной медицины показывает, что хирургическая реконструкция ЛЖ у больных ИБС не эффективна.
Замены и упрощения привели к парадоксальным результатам и выводам. Недостаточное внимание инструментальным критериям, в частности, к оценке жизнеспособности миокарда при планировании реконструкции ЛЖ и сомнения в воспроизводимости результатов STICH не вызывают доверия результатам даже самой современной статистики. Соответственно, нет доверия и выводам, сделанным авторами STICH.
Дистрофические нарушения
Эти изменения миокарда левого желудочка провоцирует недостаток полезных веществ, без которых сердечная мышца не будет нормально функционировать. В медицине подобное состояние обозначают как кардиодистрофию, а появляется оно вследствие таких факторов:
- сбои в функционировании почек и печени, ведь именно эти органы отвечают за обменные процессы;
- сахарный диабет;
- недуги эндокринной системы;
- потрясения, затронувшие ЦНС;
- серьезные нагрузки;
- низкий уровень гемоглобина;
- инфекционные патологии хронического характера;
- интоксикация;
- неправильное питание, провоцирующее авитаминоз;
- частое употребление спиртосодержащих напитков.
- длительный прием препаратов.
- Особенности ЭКГ при инфаркте миокарда ‒ проведение процедуры и признаки болезни
Часто данное состояние выявляют у подростков во время сдачи экзаменов, когда они умственно перенапрягаются. А вот у маленьких детей изменения в миокарде считаются нормой, и все потому, что обменные процессы еще не совершенны. Также люди преклонного возраста могут страдать от подобных изменений, ведь в их организме метаболические процессы замедляются.
Описание патологии
Изменение миокарда левого желудочка может спровоцировать различные заболевания или же нарушения обменных процессов в сердечной мышце. Умеренные нарушения функционирования сердца могут быть диффузными или очаговыми. Первый тип характеризуется сбоем миоцитов левого желудочка, в результате чего они неправильно сокращаются. То есть, по этим клеткам неправильно проводится электрический импульс.
Второй тип – это очаговые изменения. При этом на стенке левого желудочка образуются рубцы. Они состоят из соединительной ткани, которая не способна проводить электрические импульсы.
Умеренные нарушения метаболического типа могут сами собой прийти в норму, но если такие сбои происходят часто, то миокард не может восстановиться.
Патогенез
Изменения на ЭКГ это не заболевание, а лишь проявление каких-то патологических процессов, происходящих в миокарде. При сдвигах биохимической активности в клетках сердца меняется их сократительная способность, что отражается на кардиограмме при регистрации проведения импульсов. Функция кардиомиоцита может нарушаться при воспалительных процессах, например, при миокардитах. Приём некоторых лекарственных средств также отражается на работе сердечной мышцы.
Длительное течение сахарного диабета может постепенно привести к атеросклерозу. Поражаются не только крупные сосуды, но и коронарные артерии, которые питают миокард. При воспалительной патологии в ЖКТ нарушается всасываемость питательных веществ, что также негативно сказывается на обменных процессах в кардиомиоцитах.
Симптомы
Умеренные и незначительные изменения на ЭКГ могут никак клинически себя не проявлять и быть находкой на кардиограмме при проведении плановых медосмотров и диспансеризации. При выраженных изменениях проявляется особая симптоматика:
- загрудинные боли давящего, жгучего характера, свидетельствующие о приступе стенокардии;
- отёчность нижних конечностей, одышка при минимальной физической нагрузке говорят о прогрессировании сердечной недостаточности;
- ощущение перебоев в работе сердца, аритмии;
- быстрая утомляемость, бледность кожных покровов;
- липкий пот;
- тремор рук, потеря веса в короткие сроки.
Существует ли опасность при изменениях в миокарде
Умеренные изменения в миокарде – достаточно распространенная патология, постепенно поражающая здоровые клетки сердечной мышцы. Медики утверждают, что это ведет к развитию и прогрессированию сердечной недостаточности. Рассмотрим, стоит ли проявлять беспокойство при диагностировании подобной патологии, что же это такое: умеренные нарушения в миокарде.
Такие изменения не всегда могут представлять опасность. Особенно если это не проявляется ярко выраженными симптомами. Часто патология обнаруживается во время очередного врачебного осмотра. Если человек не ощущает никаких проблем со стороны работы сердца, то, скорее всего, проявлять беспокойство не стоит. Поводом для визита к кардиологу должны стать:
- боли в области сердца;
- нарушения сердечного ритма;
- одышка;
- повышенное или пониженное давление;
- слабость, сонливость.
Симптомы
Довольно часто данные изменения протекают бессимптомно по нескольку лет, или же проявляются незначительно.
Одним из самых распространенных признаков наличия патологических перемен в сердечной мышце является стенокардия. Так как когда стенка левого желудочка утолщается, происходит сжатие сосудов, которые питают мышцу.
Мерцательная аритмия и фибрилляция желудочков могут быть причинами развития изменений миокарда, а также и быть их следствием.
Еще одним симптомом возникновения изменений миокарда является «замирание сердца». При этом человек ощущает, что сердце несколько секунд не бьется. В результате он может потерять сознание.
Дополнительно могут возникать такие признаки:
- стойкое повышение артериального давления, частые его перепады;
- головная боль;
- боль в области сердца;
- слабость, быстрая утомляемость;
- нарушения сна.
Диффузные изменения
Что такое «изменения миокарда левого желудочка диффузного типа»? Данный вид является наиболее распространенным. При этом поражен не только левый желудочек, но и весь миокард, так как диффузные изменения характеризуются именно равномерным поражением.
Диффузные нарушения проявляются как при умеренных патологических процессах, так и при острых ситуациях, как например, инфаркт миокарда. В последнем случае есть и перемены в структуре тканей, и нарушение обменных процессов. Диффузные изменения – это скопление в левом желудочке миоцитов, которые, под влиянием определенных факторов, изменились, и не проводят импульсы.
При диффузных нарушениях миокарда левого желудочка, к общей симптоматике добавляется еще отечность ног, тахикардия, и даже скопление жидкости в легких.
Диффузные изменения миокарда левого желудочка могут спровоцировать ухудшение процесса кровообращения, гипоксии миокарда и возникновению некротических очагов. Самым опасным последствием этих нарушений является инфаркт миокарда.
Этиология
Причины прогрессирования дистрофии миокарда довольно разнообразны. Они разделяются на факторы, которые непосредственно влияют на работу сердца и причины, которые не влияют на орган напрямую (действуют через внешние факторы).
К первой группе причин относятся:
- снижение усвояемости кислорода сердцем;
- повышенный уровень кальция в желудочках сердца;
- поражение миокарда жировыми клетками;
- уничтожение болезнетворными бактериями структуры органа;
- сокращение работоспособных клеток в сердце, по причине воздействия других болезнетворных процессов.
Вторая группа включает в себя:
- воздействие гормонов на мышечный слой сердца;
- всевозможные острые отравления организма (наркотическими веществами, спиртными напитками, никотином, медицинскими препаратами);
- влияние на организм большой дозы облучения;
- продолжительные стрессы, депрессии, апатия;
- большая физическая нагрузка приводит к обнаружению такого заболевания у спортсменов;
- неправильное питание, которое, в большинстве своём состоит из очень жирных и солёных блюд;
- аномальная работа органов эндокринной и пищеварительной систем.
Дисфункция и лечение левого желудочка
Систолической дисфункцией левого желудочка называют снижение его способности выбрасывать кровь в аорту из своей полости. Это является наиболее частой причиной развития сердечной недостаточности. Систолическую дисфункцию, как правило, вызывает падение сократимости, приводящее к снижению его ударного объема.
Диастолической дисфункцией левого желудочка называют падение его способности перекачивать в свою полость кровь из системы легочной артерии (иначе – обеспечивать диастолическое наполнение). Диастолическая дисфункция может привести к развитию легочных вторичных венозной и артериальной гипертензии, которые проявляются как:
- Кашель;
- Одышка;
- Пароксизмальное ночное диспноэ.