В последнее время болезни сердца все чаще выявляются в детском возрасте. Наиболее распространенной патологией сердечной мышцы у детей является кардиопатия — заболевание неинфекционного происхождения, проявляющееся в изменениях тканей сердца. Как проявляется и лечится кардиопатия у детей?
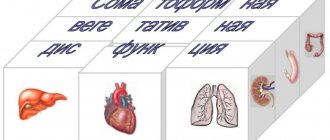
Классификация кардиопатии
Кардиопатию диагностируют у детей разного возраста. Чаще всего это заболевание выявляют в первые 2 недели жизни новорожденного, в 7 – 9 лет и в подростковом возрасте. Такая закономерность объясняется тем, что в первые дни жизни ребенка тщательно обследуют. Особое внимание уделяется тем детям, которые имеют плохую наследственность или предпосылки к врожденным патологиям. К 7-9 годам ребенок становится достаточно взрослым, чтобы уметь объяснить, что его беспокоит, а выявление заболевания у подростков обусловлено резким подъемом гормональной активности, которая приводит к первому или вторичному обострению скрытых патологий. Виды кардиопатии описаны в таблице.
| Признак классификации | Вид | Описание |
| Период обнаружения патологии | Врожденная | Появляется вследствие внутриутробных нарушений развития или генетической предрасположенности |
| Приобретенная | Возникает как следствие негативного воздействия на организм различных факторов (болезней, стрессов, физических нагрузок) | |
| Причины заболевания | Функциональная | Проявляется при систематическом физическом напряжении и стрессах, с которыми детский организм не может справиться. |
| Вторичная | Является следствием перенесенных заболеваний острого и хронического характера. | |
| Изменения в сердечной мышце | Дилатационная | Выражается в растяжении мышц левого желудочка. Стенки сердца на изменяются в толщине, но вследствие патологии снижаются скорость движения крови и эластичность сердечных тканей. |
| Диспластическая | В некоторых местах мышечная ткань заменяется соединительной, поэтому сердце не может нормально расслабляться. Причины появления патологии у детей неизвестны. | |
| Гипертрофическая | Стенки желудочков сердца утолщаются, объем сердечной камеры уменьшается. Это затрудняет вливание и выход крови из сердца. |
Журнал «Здоровье ребенка» 2(5) 2007
Дилатационная кардиомиопатия (ДКМП) — тяжелое заболевание, которое характеризуется снижением сократительной функции миокарда, обусловленной первичным внутренним дефектом поврежденных кардиомиоцитов, кардиомегалией за счет выраженной дилатации полостей сердца, особенно левого желудочка [20]. Это сопровождается прогрессирующей хронической сердечной недостаточностью, часто рефрактерной к проводимой терапии [6, 16, 20]. Заболевание характеризуется тяжелым течением, часто приводит к инвалидности и сопряжено с высоким риском смертельного исхода [6, 20]. Заболеваемость ДКМП, по данным различных авторов, значительно разнится, что обусловлено, вероятно, различием методических подходов, применяемых методов исследования, отсутствием специфических критериев диагностики [1]. Однако в последнее десятилетие многие авторы отмечают увеличение частоты ДКМП у детей [29]. Только в Донецкой области в течение 5 лет под нашим наблюдением находятся 28 детей c ДКМП в возрасте от 2 до 18 лет.
Хроническая сердечная недостаточность при идиопатической ДКМП и при других заболеваниях сердца — сложный синдром, в патогенезе которого существенную роль играет нейроэндокринная активация катехоламинов, натрийуретических пептидов и компонентов системы ренин-ангиотензина. В последние годы внимание исследователей привлечено к изучению роли целого ряда других пептидов: эндотелинов, нейропептида Y и цитокинов, хромогранина А и др. Установлено, что при сердечной недостаточности у больных ДКМП изменена экспрессия генов многих классов, что ведет к изменению организации цитоскелета и миофибрилл, нарушению передачи сигналов, обмена протеинов и энергетики в миокарде [32].
У большинства детей трудно определить дебют заболевания, поскольку часто отмечается длительное, почти бессимптомное его течение. У ряда больных наблюдается нарастающая слабость, отставание в приросте массы тела и/или физическом развитии [20], отмечается склонность к обморокам, синкопальным состояниям, рецидивирующим пневмониям. Иногда единственным признаком заболевания являются изменения на ЭКГ в виде нарушения внутрижелудочковой и атриовентрикулярной проводимости, экстрасистолии. Важной особенностью ДКМП является склонность к образованию тромбов во всех полостях сердца, чаще в левом желудочке, с последующими тромбоэмболическими осложнениями [1, 20]. Однако частота их значительно меньше, чем во взрослой популяции.
При осмотре отмечаются выраженная бледность кожи, тахикардия, ортопноэ. Пульс слабого наполнения, часто аритмичен, наблюдается снижение систолического и пульсового артериального давления. Верхушечный толчок ослаблен, разлитой, иногда выражены сердечный толчок и прекардиальная пульсация. Границы сердца смещены во все стороны, особенно влево, I тон ослаблен и приглушен, умеренный акцент II тона, II тон иногда раздвоен над легочной артерией. При декомпенсации выслушивается ритм галопа и патологический III тон. На верхушке сердца и в V точке часто выслушивается систолический шум относительной митральной недостаточности, обусловленной расширением кольца митрального клапана, а также несмыканием створок митрального клапана из-за их оттягивания вместе с подклапанным аппаратом внутрь при значительной дилатации полости левого желудочка. Часто присутствуют признаки левожелудочковой недостаточности, застой крови в малом круге кровообращения, затем присоединяется декомпенсация правого желудочка [1, 20].
Отсутствие специфических критериев затрудняет раннюю диагностику ДКМП, а частая манифестация заболевания на фоне ОРВИ или пневмонии еще более усложняет ее выявление [16, 20].
На электрокардиограмме регистрируются изменения, характерные для тяжелых метаболических и дистрофических изменений в миокарде. Часто наблюдаются признаки умеренной гипертрофии левого желудочка, реже — обоих желудочков и перегрузки левого предсердия [1]. Наряду с этим может регистрироваться низкий вольтаж комплексов QRS в стандартных отведениях, что позволило японским исследователям разработать один из ЭКГ-критериев ДКМП: отношение амплитуды зубца RV6 к максимальной амплитуде зубца R (Rmax) в одном из стандартных отведений (RV6/Rmax > 3) [20]. У детей с ДКМП могут выявляться различные нарушения сердечного ритма: от политопной и полиморфной экстрасистолии до приступов мерцательной аритмии и неустойчивой желудочковой тахикардии [20]. Нарушения проводимости проявляются в блокадах ветвей предсердно-желудочкового пучка, чаще передне-верхней ветви, что сопровождается резким отклонением электрической оси сердца влево, или в атриовентрикулярной блокаде I–II степени. Развитие блокады левой ножки пучка Гиса связывают с частым обнаружением фиброзных очагов в субэндокардиальном слое миокарда в месте прохождения левой ножки пучка Гиса [28]. Частота ее обнаружения коррелирует с выраженностью дилатации левого желудочка и степенью сердечной недостаточности и является плохим прогностическим признаком [28]. Характерны изменения фазы реполяризации в виде депрессии сегмента ST, уплощения или инверсии зубцов Т в левых отведениях без какой-либо положительной динамики в зависимости от проводимой терапии [16, 20, 28].
На рентгенограмме грудной клетки ребенка с ДКМП отмечается усиление легочного рисунка за счет венозного полнокровия, а у 1/3 больных — умеренные признаки легочной гипертензии. Форма сердца чаще шаровидная, митральная или трапециевидная, увеличение кардиоторакального индекса — более 60–65 %. В боковых и косых проекциях обнаруживается увеличение всех полостей сердца с преимущественной дилатацией левого желудочка и предсердия [20, 35].
При эхокардиографическом (ЭхоКГ) исследовании отмечается резкое расширение полостей сердца, особенно левого желудочка. В редких случаях поражается преимущественно правый желудочек [6]. Дилатация полостей сердца зачастую приводит к развитию относительной недостаточности атриовентрикулярных клапанов, дисфункции папиллярных мышц. Важным эхокардиографическим показателем, характерным для ДКМП, является значительное снижение фракции выброса левого желудочка, которое может уменьшаться у детей с ДКМП до 50–30 % (при норме 65–70 %), что свидетельствует о полной неэффективности компенсаторного механизма Франка — Старлинга и резком снижении сократимости миокарда [6]. В случае ДКМП имеются яркие диагностические признаки заболевания сердца: левый желудочек имеет сферическую форму, обычно расширены все камеры сердца, толщина стенки левого желудочка нормальная или уменьшенная, в систолу все сегменты левого желудочка сокращаются, хотя возможны случаи обнаружения рубцовых изменений миокарда [16]. Увеличение правых отделов сердца может быть как первичным из-за вовлечения правого желудочка, так и следствием развивающейся легочной гипертензии. В то же время сердечный выброс может быть близок к нормальным значениям из-за нередко наблюдаемой синусовой тахикардии и большого конечно-диастолического объема, обеспечивающего достаточные значения ударного объема даже при низкой фракции выброса [17, 25]. При исследовании в допплеровском режиме примерно у одной трети больных выявляются левожелудочковые тромбы в области верхушки, иногда в правом желудочке и в предсердиях [16, 25]. Важным прогностическим фактором является состояние сократительной способности левого желудочка и гемодинамики малого круга кровообращения (давление в легочной артерии, правом предсердии и конечное диастолическое давление в правом желудочке).
При эндомиокардиальной биопсии выявляется распространенная (свыше 30 %) необратимая альтерация миокарда с заместительным склерозом или относительно малой выраженностью компенсаторной гипертрофии и отсутствием экссудативных и пролиферативных проявлений активности воспалительной реакции, атрофия свыше 50 % жизнеспособных клеток сократительного миокарда при относительно непродолжительной давности заболевания. Характерны универсальное поражение ядерного аппарата клеток, диффузное отложение депозитов солей кальция в матриксе митохондрий, распространенные разрывы нексусов в различных участках миокарда [28].
При коронаровентрикулографии в случае ДКМП часто выявляются грубые изменения сегментарной сократимости, ее гетерогенность, отсутствие гиперконтракции, значительное увеличение функциональных объемов ЛЖ, резкое снижение его гемодинамической производительности с возможностью тромбообразования, отчетливое ухудшение диастолической функции. Наблюдается типичное для синдрома малого выброса значительное уменьшение разницы между систолическим и диастолическим объемом левого желудочка [10, 20]. У детей с ДКМП имеются нарушения функционального состояния тромбоцитов в виде повышения содержания в них Са2+ и их агрегации. Аутоиммунные реакции при ДКМП характеризуются высоким титром циркулирующих антител к сократительным (актину, миозину миокарда желудочков, предсердий и скелетных мышц) и регуляторным белкам (тропонину и тропомиозину) [24].
Как биохимический маркер повреждения миокарда можно выявить повышение активности кардиоспецифического изофермента МВ-фракции креатинфосфокиназы. Заболевание характеризуется рецидивирующим прогредиентным течением с периодическим усилением сердечной недостаточности [20, 23]. В настоящее время установлено, что при сердечной недостаточности снижается экспрессия гена NO-синтетазы и, как следствие, снижается содержание эндомиокардиальной окиси азота, что, в свою очередь, приводит к нарушению диастолической функции левого желудочка. Возможно, инактивация оксида азота происходит в связи с повышенным окислительным стрессом и формированием свободных окисных радикалов [32]. Определение концентрации в плазме крови эндотелина-1 помогает установить диагноз сердечной недостаточности на ранних стадиях заболевания, а концентрация церебрального натрийуретического пептида в крови является предиктором риска летального исхода у больных ДКМП [32].
По преимущественной локализации поражения в мышце в настоящее время выделяют шесть клинических вариантов ДКМП:
— I вариант — с изолированным поражением левого желудочка;
— II вариант — с поражением левого предсердия и левого желудочка;
— III вариант — с преимущественным изменением правых отделов сердца;
— IV вариант — с дилатацией обоих желудочков;
— V вариант — с дилатацией всех четырех камер сердца;
— VI вариант — со значительной дилатацией обоих предсердий при наличии минимальных изменений морфофункционального состояния желудочков сердца.
Проведенные длительные катамнестические наблюдения свидетельствуют о необходимости различать ДКМП с медленным, быстро прогрессирующим и благоприятным течением [25]. Темпы прогрессирования заболевания определяются не столько характером проводимой терапии, сколько тяжестью патологического процесса в сердечной мышце.
Поскольку в большинстве случаев установить причину заболевания не удается, лечение направлено на борьбу с сердечной недостаточностью и низким сердечным выбросом, предотвращение осложнений [28]. Терапия тяжелого инвалидизирующего заболевания в условиях стационара должна не только подбираться с целью достижения непосредственного улучшения состояния, но и закладывать основу дальнейшего амбулаторного лечения. Специалисты госпитального этапа формулируют выработанные для данного конкретного больного принципы его амбулаторного ведения [28]. В свою очередь, амбулаторное лечение должно обеспечить преемственность адекватно подобранного лечения не формальным сохранением ранее назначенных средств и их дозировок, а постоянным активным мониторингом состояния больного, соответствующей коррекцией терапии, регулярным лабораторным контролем и своевременностью консультаций. Чрезвычайно важно достичь взаимопонимания врача и больного при решении возникающих проблем. Важно оказывать психологическую поддержку больному и его родственникам. Врач должен избегать необдуманного резкого перехода от одного препарата к другому, не убедившись в возможных изъянах дозирования, режима приема, в отсутствии возможности неучтенного лекарственного взаимодействия. Пациента нужно обязательно предупредить о необходимости категорически избегать неадекватных физических нагрузок, аккуратно следовать намеченной терапии. Следует объяснить больному важность ограничения потребления соли, животных жиров, предупредить о его действиях при появлении возможных побочных эффектов препаратов. Соблюдение внешне столь очевидных принципов лечения сердечной недостаточности особенно важно у больных ДКМП, поскольку их выполнение реально помогает продлить жизнь [28]. При застойной сердечной декомпенсации ограничивают прием соли и жидкости. При избыточной массе тела проводят коррекцию калорийности рациона питания в основном за счет углеводов, а при наличии белково-витаминной недостаточности, анемии в рацион включают белки, витамины. При аритмическом синдроме рацион обогащают продуктами, содержащими соли калия и магния (изюм, курага, чернослив, бананы, финики, орехи, гречка и др.) [20].
Основные усилия в терапии направляются на снижение активности ренин-ангиотензин-альдостероновой системы с помощью ингибиторов АПФ. Можно использовать любой из препаратов данной группы, но шире других в настоящее время используется эналаприл [15]. Дозировка всегда индивидуальна (0,1–0,4 мг/кг/сут.), в два приема под контролем АД. Каптоприл назначается в негипотензивных дозах 0,5 мг/кг/сут. и требует трехкратного приема. При приеме каптоприла не следует назначать препараты калия и калийсберегающие диуретики. Выбор конкретного препарата определяется переносимостью, реакцией артериального давления, побочными эффектами [14, 20, 28]. Появление мерцания предсердий существенно ухудшает гемодинамику больных с ДКМП. При мерцательной аритмии для регулирования частоты пульса и ликвидации тахисистолии необходимо подобрать сердечные гликозиды в дозе, обеспечивающей оптимальную частоту желудочкового ответа [20]. Необходимы они и при синусовом ритме сердца, хотя рассчитывать при этом на существенный инотропный эффект, что ранее рассматривалось как основной фактор в действии гликозидов, не приходится. Сердечные гликозиды изначально используют в поддерживающих дозах, так как больные с ДКМП очень чувствительны к ним. Их назначают по 5 дней в неделю длительно. При утяжелении застойной сердечной недостаточности можно назначать синтетический стимулятор β1-рецепторов допамин или его аналог добутамин [30] в виде кратковременных курсов (по 3 суток) внутривенных инфузий из расчета 2–5 мкг/кг/мин для усиления инотропизма миокарда. Использование катехоламинов оказывает более мощный, чем применение гликозидов, кардиотонический эффект, однако превышение дозировок может вызвать тахиаритмии и артериальную гипотензию [20].
Важное место в лечении детей с ДКМП занимает применение малых доз β-блокаторов. В настоящее время эта группа препаратов рассматривается не только как средство контроля частоты сердечных сокращений, профилактики нарушений ритма, но и как важный стабилизатор нейрогуморальной регуляции, претерпевающей существенные изменения на фоне сердечной недостаточности при ДКМП. Однако лечение β-блокаторами следует начинать только после стабилизации состояния больного на фоне терапии ингибиторами АПФ, диуретиками и гликозидами. Начинают лечение с минимальных доз, медленно увеличивая их через каждые 1–2 недели и доводя до желаемых доз (метод титрования). Эффект применения β-блокаторов выявляется не ранее чем через 3 месяца от начала лечения и увеличивается по мере пролонгации курса терапии. Метопролол назначают детям старше 12 лет в начальной дозе 5 мг/сут. в 2 приема. В случае хорошей переносимости дозу можно увеличивать, наблюдая, не нарастают ли признаки сердечной недостаточности [20]. Наиболее эффективными при лечении застойной сердечной недостаточности на фоне ДКМП являются препараты 3-й генерации (карведиол и др.), обладающие вазодилатирующим действием. Перспективно применение препарата карведилол — β-α-блокатора, обладающего уникальным для этой группы положительным антиоксидантным влиянием на миокард. Его назначают в начальной дозе 6,25 мг/сут. в 2 приема, увеличивая дозу до 50 мг/сут. Бисопролол назначают детям старше 12 лет в дозе 0,625 мг в сутки, увеличивая дозу до 2,5 мг/сут. [20].
Как и при лечении сердечной недостаточности, вызванной другими заболеваниями, традиционно применяют диуретики с постоянным контролем уровня калия и магния в крови, величиной показателей минутного объема кровообращения, ФВ и АД [20, 28].
При ведении детей с ДКМП большое значение придается средствам профилактики нарушений ритма и тромбоэмболических осложнений. При выборе антиаритмических препаратов следует помнить, что они не должны угнетать сократительную функцию ослабленного миокарда и усугублять нарушения проводимости [18]. Поэтому в настоящее время при лечении нарушений ритма у больных ДКМП предпочтение отдается препаратам третьего класса современной классификации антиаритмических средств — амиодарону и соталолу [40]. Амиодарон при приступе пароксизмальной тахикардии лучше вводить внутривенно капельно в 150–200 мл 5% раствора глюкозы из расчета 5 мг/кг массы тела 1 раз в сутки, переходя после получения эффекта на пероральный прием по 10 мг/кг/сут. В сочетании с соталолом (40 мг/сут. в 2–3 приема) он оказывает не только лечебное, но и профилактическое действие [34].
Высокая вероятность тромбообразования определяет необходимость применения антикоагулянтов. Современный контроль эффекта дозировок антикоагулянтов следует проводить по показателям коагулограммы, например поддерживать международное нормализованное отношение в пределах 2,0–3,0. Варфарин назначают детям старшего возраста, начиная с 2,5–5 мг/сут. в течение 3 дней, а затем корригируют дозу по протромбиновому времени, которое должно превышать норму в 1,5–2 раза (для обеспечения терапевтического антикоагулянтного эффекта). Фенилин принимают в дозе 1 мг/кг/сут. в 2 приема. Протромбиновое время определяют до начала лечения, через 2–3 дня терапии и в последующем 1–2 раза в неделю [20, 28].
Препарат коэнзим Q10, восполняя дефицит этого кофермента, нормализует синтез АТФ в кардиомиоцитах, улучшает течение энергетических процессов в митохондриях, обладает антиоксидантным действием, блокируя перекисное окисление липидов [20]. Препарат назначают детям школьного возраста в виде убихинона по 1–2 капсулы в день, курс лечения — 4–6 недель [20].
В настоящее время представляются перспективными различные направления хирургической коррекции сердечной недостаточности при ДКМП, в частности физиологическая двухкамерная электрокардиостимуляция (ЭКС) сердца в DDD-режиме. Электроды имплантируемого электрокардиостимулятора располагают в правом предсердии и в области верхушки правого желудочка. ЭКС проводят больным ДКМП с выраженной сердечной недостаточностью, сохраненным синусовым ритмом при отсутствии брадикардии. Электрокардиостимуляцию осуществляют с индивидуально подобранной оптимальной атриовентрикулярной задержкой (интервалом), равной около 100 мс, обеспечивающей меньшим, чем в норме, промежуток времени между сокращением предсердий и желудочков. Это, вероятно, снижает степень митральной и трикуспидальной регургитации, сохраняет кинетическую энергию объема крови, выбрасываемой предсердиями, увеличивает эффективность механизма Франка — Старлинга, что сопровождается увеличением фракции выброса, улучшением самочувствия больных и их толерантности к физическим нагрузкам [20, 34].
Еще одним направлением в лечении ХСН, основанным на улучшении насосной функции сердца, является электрофизиологический метод, получивший название ресинхронизации работы сердца (РРС), заключающийся в имплантации трехкамерного электрокардиостимулятора, который может быть оснащен функцией кардиовертера-дефибриллятора. Для этого используется схема трехкамерной стимуляции сердца, когда один электрод находится в правом предсердии, второй — в левом, а третий (через коронарный синус) — в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атриовентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции). Механизмы улучшения состояния при ресинхронизирующей терапии достигаются путем:
— улучшения систолической функции (увеличения фракции выброса);
— координации сокращения левого желудочка;
— укорочения времени сокращения левого желудочка;
— улучшения диастолической функции;
— удлинения времени наполнения левого желудочка;
— уменьшения митральной регургитации;
— возможного ремоделирования желудочков сердца.
Постановка имплантируемого кардиовертера-дефибриллятора необходима больным с ХСН и опасными для жизни желудочковыми нарушениями ритма сердца (IV и V градации по Lown — Wolff). Специальных исследований для пациентов с ХСН пока не проводилось, однако у больных, перенесших ранее острый инфаркт миокарда, эта процедура позволяет достоверно улучшать прогноз в сравнении с антиаритмической терапией [32].
В терминальной стадии развития, когда медикаментозная поддержка становится недостаточной для продления жизни больного, остается лишь хирургический путь лечения, что существенно улучшает прогноз жизни по сравнению с неоперированными больными [20, 22].
Показаниями к хирургической коррекции ДКМП являются: 1) тяжелая сердечная недостаточность IV функционального класса по NYHA; 2) выраженность сопутствующих аритмического и тромбоэмболического синдромов; 3) отсутствие эффекта от всех длительно проводимых современных методов интенсивной медикаментозной терапии; 4) неблагоприятный прогноз на ближайший год жизни [36].
Паллиативные операции кардиомиопластики и вентрикулопластики являются как бы мостом к последующей радикальной операции по трансплантации сердца (у больных, ожидающих донорское сердце) или проводятся больным, которым радикальная операция трансплантации противопоказана в силу ряда причин (наличие тяжелых сопутствующих заболеваний, почечной или печеночной недостаточности, неконтролируемых инфекций и т.д.) [22, 36, 42].
Метод кардиомиопластики заключается в мобилизации широчайшей мышцы спины (при сохранении ее кровоснабжения), перемещении ее в средостение и «окутывании» этой мышцей обоих желудочков. При этом трансплантат скелетной мышцы покрывает около 70 % обоих желудочков и фиксируется к миокарду и перикарду. Трансплантат широкой мышцы спины предварительно «тренируют» с помощью программируемой кардиосинхронизируемой электростимуляции. Электронейростимуляция мышечного трансплантата с помощью подшитых электродов синхронизируется по зубцу R кардиосигнала с сокращениями самого сердца, что сопровождается улучшением систолического опорожнения желудочков и эластической поддержкой дилатированного сердца в диастолу. Это приводит также к обратному развитию ремоделирования желудочков за счет уменьшения напряжения стенок и изменения диастолической функции [20].
Вентрикулопластика, или операция Батиста, заключается в редукции объема левого желудочка путем иссечения значительного участка его боковой стенки в сочетании с протезированием митрального клапана с помощью аннулопластики. В результате операции увеличиваются эффективный ударный объем крови и фракция выброса левого желудочка [15].
В последние годы начато внедрение метода вспомогательного кровообращения, получившего в России наименование «искусственный левый желудочек» (ИЛЖ). Суть его заключается в том, что на работающем сердце в верхушку ЛЖ вшивается отводящая магистраль, соединенная с перекачивающим устройством, отправляющим кровь через вторую магистраль в аорту. В итоге сердце работает в «щадящем» режиме, так как параллельно с ЛЖ пациента дополнительно работает искусственный насос. Этот метод был предложен для пациентов с критическим ухудшением гемодинамики, ожидающих донора для трансплантации сердца. Однако, учитывая, что в ряде случаев донорского сердца приходилось ждать долго, у некоторых пациентов ИЛЖ работал длительно в течение нескольких недель и даже месяцев. При этом было установлено, что в некоторых случаях «отдохнувший» левый желудочек больного постепенно восстанавливал свою пропульсивную способность. Это привело к смене концепции от «моста к пересадке» к «мосту к выздоровлению». Появилась идея использовать длительную (на несколько месяцев) постановку ИЛЖ в качестве методики лечения пациентов с критической ХСН. В настоящее время наиболее популярны три типа устройств: роторный насос Heart Mate, мембранный насос Toratec и высокоскоростная турбина Jarvic 2000. Обычно эти устройства помещаются в брюшной полости поддиафрагмально и соединяются с наружными источниками питания, которые становятся все меньше размером и требуют все более редкой зарядки [32].
Механические методы лечения ХСН на сегодняшний день сводятся, по сути, к использованию ограничительной наружной эластической сетки, ограничивающей дилатацию сердца. Первые клинические наблюдения показали безопасность этой процедуры, но до ее широкого внедрения в практику должны быть проведены тщательные клинические исследования [32].
Трансплантация сердца является радикальным, наиболее апробированным и эффективным методом хирургической коррекции ДКМП в случаях тяжелой сердечной недостаточности, рефрактерной к проводимой медикаментозной терапии. В крупнейших кардиохирургических центрах мира по числу выполненных трансплантаций сердца больные с дилатационной кардиомиопатией занимают второе место после пациентов с ишемической кардиомиопатией и составляют более 50 % реципиентов. Однако трансплантация сердца сопряжена с определенными медицинскими и социальными проблемами, в частности с психологической устойчивостью реципиента, наличием донорских сердец, реакцией отторжения трансплантата, стенозирующим поражением венечных артерий аллографта, последствиями мощной послеоперационной иммуносупрессивной терапии (злокачественные опухоли, неконтролируемые инфекции, токсическое поражение многих органов и др.), а также с высокой финансовой стоимостью всех проводимых хирургических и терапевтических мероприятий [20].
Несмотря на значительную клиническую вариабельность течения заболевания, его прогноз у детей, как правило, неблагоприятен [24]. Это обусловлено развитием рефрактерной к терапии застойной сердечной недостаточности, угрожающих жизни аритмий и часто — тромбоэмболических осложнений. Зарубежными авторами предлагается использовать повышение уровня L-карнитина в плазме крови и моче в качестве маркера тяжести застойной сердечной недостаточности при ДКМП как отражающего степень повреждения миокарда и нарушение функции левого желудочка.
Определение резервов сократительной способности миокарда у пациентов с застойной сердечной недостаточностью имеет важное клиническое значение. Это, с одной стороны, во многом определяет прогноз, а с другой стороны, необходимо для определения показаний к трансплантации сердца, срочности ее проведения, целесообразности ведения больных до трансплантации на консервативной терапии или с использованием механических средств поддержки кровообращения. Стресс-эхокардиография с нагрузкой добутамином используется для определения резервов сократительной способности левого желудочка сердца. Определяется фракция изгнания и шарообразность левого желудочка до и на пике нагрузки с добутамином. Увеличение фракции изгнания и пиковой систолической скорости после нагрузки добутамином является наиболее оптимальным предиктором возможного улучшения функции левого желудочка сердца. Представляет интерес появление нового неинвазивного показателя, позволяющего оценить систолическую и диастолическую дисфункцию, а также прогнозировать исход у пациентов с ДКМП, — Tei-index. Параметры для его расчета определяют при допплеровской эхокардиографии. Tei-index = (IRT – – ICT)/ET, где IRT — время изоволюмической релаксации, ICT — время изоволюмического сокращения и ЕТ — период изгнания. При значении Tei-index более 1,14 риск летального исхода резко повышается. Теi-index не зависит от частоты сердечных сокращений, артериального давления, изменения геометрии левого желудочка и степени митральной регургитации [32].
Причиной смерти пациентов с ДКМП часто являются жизнеугрожающие нарушения ритма сердца. Поздние потенциалы на сигнал-усредненных электрокардиограммах и наличие в анамнезе эпизодов желудочковых тахиаритмий являются предикторами нарушения ритма и повышенного риска сердечной смерти у больных ДКМП [32].
У детей с поражением левых отделов сердца представляется возможной стабилизация состояния больных в случаях постоянного лечения. При комбинированном поражении желудочков или всех камер сердца ДКМП имеет злокачественное течение, сопровождаясь развитием рефрактерной к проводимой терапии застойной сердечной недостаточности, развитием жизнеугрожающих аритмий и тромбоэмболий, что обусловливает высокую летальность [20]. У детей раннего возраста при упорном и длительном лечении часто наступает значительное улучшение гемодинамики, а в ряде случаев отмечается полная нормализация морфофункционального состояния сердца [41].
Таким образом, дилатационная кардиомиопатия является тяжелым заболеванием с прогрессирующим развитием сердечной недостаточности, снижением качества жизни и частой инвалидизацией больных, неблагоприятным прогнозом, возможностью осложнений в виде синкопальных состояний и внезапной сердечной смерти. Несмотря на неудовлетворенность существующей эффективностью проводимых в настоящее время лечебных воздействий, поиск новых путей оптимизации ведения данного контингента больных продолжается и вселяет надежду на улучшение прогноза при обсуждаемой патологии.
Симптомы патологии у детей
В младенческом возрасте заметить сердечные нарушения тяжело. Малыши не могут объяснить, что причиняет им дискомфорт. Заподозрить кардиопатию у младенца можно по таким симптомам:
- при сильном плаче синеет область носогубного треугольника;
- сбивается ритм дыхания;
- малыш быстро утомляется.
У детей старшего возраста наблюдается более обширная симптоматика. При кардиопатии дети часто жалуются на боли в районе сердца или груди. Также заболевание сопровождается:
- высокой утомляемостью;
- одышкой;
- головокружениями и обмороками;
- бледностью кожных покровов;
- повышенной потливостью.
Проявление симптоматики обусловлено тем, что вследствие неправильной работы сердца нарушается доставка крови к другим органам. При некоторых видах заболевания самочувствие ухудшается даже при такой физической нагрузке, которую здоровый ребенок не ощущает.
Дилатационная форма кардиопатии при отсутствии своевременного лечения приводит к появлению выпуклости в районе сердца. Это происходит из-за того, что сердечная мышца значительно расширяется и вызывает смещение близлежащих тканей.
Наиболее ярким признаком функциональной кардиопатии является нарушение сердечного ритма. Если не снижаются физические нагрузки, она приводит к значительному ухудшению состояния сердца.
Вторичная кардиопатия сопровождается теми же симптомами, которые присущи основному заболеванию. В связи с этим, вторичную кардиопатию сложно распознать.
Характеристика заболевания
Основная функция сердечной мышцы заключается в ритмичном сокращении, что обеспечивает выталкивание крови по сосудам и наполнение полостей органа. Такая способность обеспечивается благодаря кардиомиоцитам. Непрерывное их функционирование поддерживает обмен веществ на необходимом для работы уровне.
Под действием неблагоприятных факторов, со временем представленные процессы нарушаются. Это проявляется формированием структурных изменений, что заканчивается ослаблением сократительной способности.
Методы диагностики
При подозрении на кардиопатию у ребенка врач проводит внимательный осмотр и опрашивает родителей о наличии симптоматики. Первичный осмотр делает педиатр, но более тщательная диагностика проводится под контролем кардиолога.
Детская кардиология использует следующие методы для диагностики сердечных патологий:
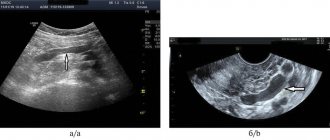
- Эхокардиография. Исследование заключается в обследовании грудной клетки при использовании ультразвукового аппарата. С его помощью специалист определяет параметры сердечной мышцы и его структурных элементов. Другое наименование процедуры – УЗИ сердца. Процедура позволяет выявить диспластическую патологию без применения других методов.
- ЭКГ. Электрокардиограмма регистрирует электрические сигналы, образующиеся при работе сердца. Аппарат фиксирует частоту сердечных сокращений, описывает физическое состояние сердца, указывает на наличие аритмичных движений.
- Фонокардиография. Этот метод является дополнением к УЗИ и ЭКГ. Он позволяет зафиксировать шумы, которые появляются при работе сердечной мышцы.
Дополнительно ребенку могут назначить анализы крови на определение генетических отклонений. В некоторых случаях нужно определить причину возникновения патологии. Для этого ему дают направление на общий анализ крови, КТ, МРТ.
Попробуем разобраться. Начнем по порядку
Беспокоиться? Нет уж, давайте вначале сходим к детскому кардиологу. Педиатр даст Вам направление, а в нем – ряд совершенно непонятных терминов и сокращений. Попытаемся их расшифровать.
- Функциональная кардиопатия (ФКП) или ФИС – функциональные изменения сердца – является одним из наиболее часто встречающихся диагнозов в детской кардиологии. Использование этого термина не всегда оправданно. По сути дела, ФИС называют любой набор минимальных отклонений от нормы (по результатам клинического осмотра, ЭКГ, ЭхоКГ и т.д.), которые нельзя объединить в какой-либо другой, более серьезный, диагноз.
- ФСШ – функциональный систолический шум – в данном случае слово «функциональный» означает «не обусловленный каким-либо серьезным заболеванием», что чаще всего и встречается в педиатрической практике.
«Сердечный доктор» – специалист по болезням сердца и сосудов – осмотрит Вашего малыша. Спросит – нет ли каких специфических жалоб – как ест ребенок, не устает ли при сосании, не синеет ли, нет ли у него приступов одышки, как прибавляет в весе. Если чадо подросло и уже умеет говорить – нет ли болей в области сердца, сердцебиения, головокружений. Не было ли обмороков.
Поглядит внимательно – нет ли цианоза (синюшности), одышки, деформации грудной клетки, кончиков пальцев и ногтей, отеков, патологической пульсации сосудов. Проперкутирует (постучит) – не расширены ли границы сердца. Пропальпирует (прощупает) периферические сосуды, область сердца, печень и селезенку. Внимательно выслушает сердце – как и где шумит, каковы при этом сердечные тоны, куда проводится шум, нет ли каких-то сопутствующих звуков, посчитает частоту дыхания и пульса. И, скорее всего, скажет, что у Вашего малыша нет признаков недостаточности кровообращения (или нарушений гемодинамики, или сердечной недостаточности, что, в общем, почти одно и то же). Это значит, что в данный момент сердечко ребенка справляется со своей работой хорошо. Ура? Ура. Но расставаться с доктором еще рано. Скорее всего, он порекомендует провести необходимые дополнительные исследования. Зачем? А чтобы определить, откуда взялся этот шум, как наблюдать за ребенком, чего опасаться и в каком случае начинать лечить.
Прогноз
При развитии диспластической кардиопатии прогноз чаще неблагоприятный. Это связано с появлением сложностей при установлении диагноза. У большинства пациентов на ранней стадии обнаружить заболевание практически невозможно. Некоторые больные не предъявляют жалоб в течение всего периода прогрессирования кардиопатии (бессимптомная форма). Установление диагноза у них возможно только после присоединения осложнений.
К моменту выявления патологии, в большинстве случаев длительно протекает сердечно-сосудистая недостаточность. После подтверждения диагноза выживаемость таких пациентов в 30% случаев не превышает 5 лет. Если удалось добиться пересадки сердца, то показатель увеличивается до 10 лет.
В детском и взрослом возрасте при раннем установлении диагноза удается стабилизировать состояние и добиться отсутствия проявлений патологии. Для поддержания качества жизни все пациенты должны наблюдаться у кардиолога, самостоятельно контролировать свое самочувствие и принимать постоянно препараты по назначенной схеме.
Осложнения
Малая аномалия развития сердца (кардиопатия) опасна не только своими проявлениями, но и осложнениями. Они способны сформироваться при несвоевременном установлении диагноза и отсутствии лечения. При дисплатической кардиопатии возможны следующие последствия:
- стенокардия;
- ишемическая болезнь сердца;
- артериальная гипертензия;
- перикардит;
- отек легких;
- аритмия;
- тромбоз;
- хроническая сердечная недостаточность.
Наиболее распространенным осложнением считается аритмия. Она появляется практически у 10% от всего числа заболевших детей. Кардиопатия приводит к нарушению нормальной проводимости электрических импульсов в кардиомиоцитах. В результате сердечные сокращения становятся нерегулярными. Чаще всего отмечается ускорение количества ударов в минуту.
При расширении желудочков, когда заболевание протекает длительно, кровь в полостях застаивается. Создаются условия для формирования сгустков.
Наибольшую опасность представляют тромбы, которые попадают в кровоток (эмболы) и со временем они могут проникнуть в сосуды узкого диаметра. Такая особенность характерна для легочной и мозговой ткани. Закупорка просвета в них приведет к тробоэмболии.