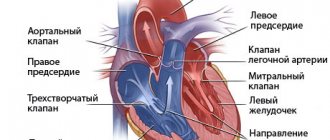
Сердечный выброс — это понятие, используемое в медицине, которое относится к количеству крови, выбрасываемой сердцем за одну минуту. Технически, он рассчитывается как произведение частоты сердечных сокращений на ударный объем.
Увеличение частоты сердечных сокращений является компенсаторным механизмом увеличения снабжения тканей кислородом.
Факторы, которые влияют на систолический объем — это объем крови, выталкиваемый сердцем в аорту во время периода сокращения, это преднагрузка, постнагрузка и сократительная функция.
Сегодня существует ряд методов, которые позволяют нам получать измерения сердечного выброса очень эффективным и неинвазивным способом. Техника Фика, которая использовалась ранее, была заменена более современными методами.
Анализ пульсовой волны привел к получению непрерывного и минимально инвазивного измерения сердечного выброса. Другие методы, такие как биоремедиация, допплерография или эхокардиография, позволяют нам получать измерения сердечного выброса неинвазивным, быстрым и надежным способом.
Укрепление сердечной мышцы
Digitalis является одним из самых старых препаратов, которые все еще используются, главным образом, в качестве производного, известного как дигоксин (ланоксин). Мышцы желудочков сокращаются, чтобы вывести кровь из сердца. Дигоксин увеличивает силу и быстроту этого сокращения. Это также может помочь контролировать аномальные сердечные ритмы, которые уменьшают EF. Другие препараты аналогичным образом увеличивают действие накачки, таких как милринон (Примакор) и добутамин (Добутрекс). Эти препараты обычно не рекомендуются для сердечной недостаточности и зарезервированы для строго контролируемого лечения острой сердечной недостаточности, которая устойчива к другим методам лечения.
Поговорите с вашим лечащим врачом об улучшении вашего EF.
Ваш врач может помочь вам составить реалистичный план. То, что работает для другого человека, может не подойти вам. Спросите своего врача или другого поставщика медицинских услуг о его или ее рекомендациях и примите поддержку и поддержку членов семьи или друзей, которые могут помочь вам в достижении ваших целей.
Прежде чем принять решение о следующих шагах, сначала обсудите следующие вопросы со своим врачом:
- Какой у меня EF?
- Почему у меня низкий EF и как это влияет на мое здоровье?
- Какие изменения образа жизни или лекарства могут мне помочь? Есть ли что-то, что я должен избегать /> Лечить любые известные причины сердечной недостаточности.
Выясните, связана ли ваша сердечная недостаточность с основной причиной. С сердечной недостаточностью связано несколько факторов риска, таких как высокое кровяное давление или гипертония, диабет и метаболический синдром. Управляя этими условиями, вы можете помочь сердечной недостаточности и фракции выброса улучшить.
Знай свой план и следуй ему внимательно. Если вам прописали лекарства от сердечной недостаточности, диабета, высокого кровяного давления или другой основной причины, прием назначенных вами лекарств также может улучшить фракцию выброса. Со временем, когда лекарства работают, ваше сердце может восстановиться, укрепиться и работать лучше.
Актуальность проблемы
В последние 20 лет заболеваемость сердечной недостаточностью среди европейцев уменьшается. Но увеличивается число заболевших в средних и старших группах населения из-за роста продолжительности жизни.
По данным европейских исследований (проведение ЭХОКГ), было обнаружено снижение фракции выброса у половины пациентов с симптомной сердечной недостаточностью и у половины асимптомных пациентов.
Пациенты, имеющие сердечную недостаточность, менее трудоспособны, у них снижено качество жизни и ее длительность.
Лечение этих пациентов является наиболее дорогим и для них, и для государства. Поэтому остается актуальным поиск путей профилактики возникновения, ранней диагностики и эффективного лечения болезней сердца.
Проведенные в последние десятилетия исследования доказали эффективность ряда групп препаратов для улучшения прогноза, снижения смертности пациентов с низкой сердечной фракцией:
- ингибиторы аденозинпревращающего фермента («Эналаприл»);
- антагонисты ангиотензина П («Валсартан»);
- бета-блокаторы («Карведилол»);
- блокаторы альдостерона («Спиронолактон»);
- диуретики («Торасемид»);
- «Дигоксин».
Сердечная недостаточность с восстановленной фракцией выброса: критерии диагноза и стратегии терапии
Действующие рекомендации по диагностике и лечению сердечной недостаточности (СН) выделяют три ее варианта в зависимости от фракции выброса: СН со сниженной фракцией выброса (<40%), СН с промежуточной фракцией выброса (40-49%) и СН с сохраненной фракцией выброса (≥50%). Однако очевидно, что у существенной части пациентов фракция выброса по мере течения заболевания может меняться. Причем это изменение нередко происходит не в сторону ее уменьшения, а, напротив, – в сторону увеличения. Так, по данным наблюдательных исследований от 10 до 40% пациентов переходит из категории СН с низкой фракцией выброса в категорию СН с промежуточной/сохраненной фракцией выброса. Различные руководства практически не обсуждают ведение таких пациентов, в связи с чем экспертный совет JACC подготовили документ, освещающий проблему СН с восстановленной фракцией выброса.
Отмечается, что основанием для выпуска этого документа стало обсуждающееся выше практически полное отсутствие сведений о тактике ведения таких пациентов в стандартных рекомендациях по СН, а также попытка обратить внимание на проблему СН с восстановленной фракцией выброса.
Говоря о диагностике СН с восстановленной фракцией выброса, эксперты отметили, что рабочим определением должно быть наличие трех критериев:
1. Сведения о снижении фракции выброса <40% в анамнезе;
2. Абсолютное улучшение фракции выброса ≥10%;
3. Значение фракции выброса при повторном измерении >40%.
Именно такие критерии использовались в подавляющем большинстве исследований СН с восстановленной фракцией выброса.
Учитывая отсутствие сведений об эффектах долгосрочной отмены терапии у таких пациентов, а также данных исследования TRED-HF, продемонстрировавшего ухудшения течения СН даже после восстановления фракции выброса при отмене терапии у пациентов с дилатационной кардиомиопатией, подчеркивается, что все больные с СН и восстановленной фракцией выброса должны продолжать прием обозначенной в рекомендациях для пациентов с СН и низкой фракцией выброса терапии.
Что касается ведения таких пациентов, то, как отмечают авторы, следует помнить, что несмотря на восстановленную фракцию выброса такие пациенты имеют повышенный риск развития сердечно-сосудистых осложнений. Кроме того, не исключено и снижение фракции выброса вновь. В связи с чем каждые 6 месяцев рекомендовано выполнение эхокардиографии, в том числе с оценкой деформации левого желудочка, каждые 6-12 месяцев – электрокардиографии (ЭКГ), а также исследование концентрации мозговых натрийуретических пептидов. В том случае, если есть основания предполагать наличие повышенного риска развития нарушений ритма сердца (например, при транстиретиновом амилоидозе), каждые 1-2 года рекомендовано выполнение холтеровского мониторирования ЭКГ. Обсуждается, что после года клинически стабильной СН с восстановленной фракцией выброса можно рассмотреть выполнение ЯМР-томографии в том случае, если она не выполнялась во время СН с низкой фракцией выброса.
Источник:
Wilcox JE, et al. J Am Coll Cardiol. 2021 Aug 11;76(6):719-734.
Снижение сопротивления сосудов кровеносным сосудом
Артерии также имеют мышцы. Чем больше они сокращаются, тем меньше канал, через который течет кровь, и тем больше напряжение на сердечной мышце. Ангиотензин, природный гормон, является очень мощным констриктором кровеносных сосудов. Препараты, которые ингибируют образование ангиотензина или блокируют его способность связываться с кровеносным сосудом, помогают расслабить мышцы сосудов и являются основой Руководства Общества сердечной недостаточности Америки. Примеры включают каптоприл (Capoten), эналаприл (Vasotec), валсартан (Diovan) и лозартан (Cozaar). Из-за этой релаксации сердце может вывести больше крови за такт, улучшая EF. Комбинация препаратов гидралазина и изосорбида (Bidil) может быть эффективной у пациентов, которые устойчивы к — или не переносят — ингибиторы ангиотензина.
Каких результатов я могу ожидать?
Хотя отдельные результаты могут отличаться, усилия по улучшению фракции выброса вашего сердца могут иметь дополнительные положительные результаты. Вы также можете обнаружить, что чувствуете себя лучше и испытываете меньше симптомов. Инвестиции, которые вы делаете, чтобы помочь себе выздороветь, — это ваш лучший способ взять под контроль свое здоровье.
Общайтесь с другими в нашей сети поддержки, где люди каждый день ободряют друг друга для достижения лучшего здоровья.
По материалам сайта: www.heart.org
Расслабление сердечной мышцы
В ответ на снижение EF организм высвобождает такие вещества, как адреналин, которые увеличивают скорость и силу сокращения желудочков. В то время как временные эффективные, хронические возвышения этих соединений вызывают усиление сердечной мышцы и уменьшают ее движение. Бета-блокаторы — это препараты, которые противодействуют этим действиям, уменьшают напряжение в стенке сердца и улучшают способность к сокращению. Три из них рекомендуются карведилол (Coreg), метопролол сукцинат (Toprol XL) и бисопролол (Zebeta).Бета-блокаторы чаще всего используются в комбинации с ингибиторами ангиотензина.
Мышечный насос
Движение крови по венам обеспечивается рядом факторов: работой сердца, клапанным аппаратом вен, «мышечным насосом» и др.Вены верхних и нижних конечностей снабжены клапанами, а глубокие вены окружены мышцами. При физической
нагрузке мышцы действуют как насосы, оказывая давление на вены снаружи. Чем чаще и активнее движения, например при ходьбе, тем эффективнее «насосное действие» мышц. Правда, сокращение мышц, пережимая сосуды, затрудняет кровоток. Но если сокращения носят перемежающийся характер, то уменьшение кровотока во время фазы сокращения эффективно компенсируется за счет кислорода, связанного с миоглобином. Поэтому во время ритмичной нагрузки, возникающей при беге, ходьбе на лыжах, езде на велосипеде, кровоснабжение мышц конечностей намного увеличивается. Сокращение мышц брюшного пресса ведет к вытеснению значительного количества крови из сосудов печени, кишечника и селезенки, увеличивая приток крови к сердцу и тем самым влияя на сердечный выброс.
При сокращении мышц вены в них сжимаются, что немедленно приводит к увеличению притока крови к правому желудочку (мышечному насосу). Увеличение оттока венозной крови из мышц нижних конечностей способствует быстрому заполнению сердца и, кроме того, повышает давление перфузии в нижних конечностях за счет снижения давления в венах голени и ступни.
Активация мышечного насоса сопровождается изменениями в посткапиллярных сосудах (в основном в венах) системного кровообращения.
Физические упражнения вызывают рефлекторное увеличение напряжения стенок венозных сосудов как в работающих, так и в неработающих конечностях. Это напряжение сохраняется в течение всей нагрузки и пропорционально степени ее тяжести.
Пациенты с функционально единственным желудочком сердца после операции Фонтена. Лекция для врачей
Лекция для врачей «Пациенты с функционально единственным желудочком сердца после операции Фонтена». Лекцию для врачей проводит детский кардиолог Frank Cetta, Jr., M.D. (США)
Дополнительный материал
Операция Фонтена: критерии выполнения, показания и противопоказания, факторы риска
М.В. Спринджук, младший научный сотрудник Республиканский научно-практический , Минск, Беларусь
Операция Фонтена применяется для паллиативного оперативного лечения цианотических пороков с 1971 г. Фундаментальная основа разработки этого хирургического вмешательства была заложена в начале 40-х гг. XX в.
Рис. 1. Выполнение шва анастомоза между верхней полой веной и правой легочной артерией
Рис. 2. Операция Фонтена, выполненная с экстракардиальным кондуитом; 1 — правая легочная артерия; 2 — аорта; 3 — верхняя полая вена; 4 — кондуит; 5 — культя легочного ствола; 6 — нижняя полая вена
Принципы кровообращения Фонтена. Чтобы представить кровообращение Фонтена, нужно исключить из нормальной циркуляции правый желудочек (в случае исправленной трикуспидальной атрезии), который в норме нагнетает кровь в легкие. Уникальность операции в том, что создаются гемодинамические условия эффективного функционирования легочного круга кровообращения в присутствии исправленного врожденного анатомического дефекта.
Энергия для продвижения крови в легкие при кровообращении Фонтена — это прежде всего результат насосной функции левого желудочка и сокращения правого предсердия. Кровь, получив от желудочка толчок, проходя по системным сосудам, возвращается в правое предсердие и течет в легкие. Раньше считалось, что для успешного результата операции Фонтена необходима достаточно разработанная камера правого предсердия, которая в основном встречается у сравнительно взрослых больных. В самом деле, длительная перегрузка этой камеры приводит к увеличению ее емкости, гипертрофии стенок и, как показывает опыт, в таком случае правое предсердие успешно выполняет функцию правого желудочка. Однако расширение предсердия способствует развитию аритмий и тромбозов с последующей эмболией.
Известно, что сопротивление сосуда замедляет и в конечном счете останавливает ток жидкости, вот почему для успешного результата операции нужно учитывать гемодинамические характеристики пациента. Например, если легочные сосуды толстостенные, с узким просветом, они окажут значительное сопротивление легочному кровотоку, который будет не осуществим без дополнительной силы.
Условия эффективного осуществления операции Фонтена. Существует несколько вариантов критериев операции Фонтена. Наиболее используемыми являются критерии С. van Doorn и M.R. de Leval, впоследствии уточненные [10]:
| Оригинальные критерии | Пересмотренный вариант |
| 1. Минимальный возраст — 4 года | Минимальный возраст — менее 4 лет. Наименьший и оптимальный возраст для выполнения операции Фонтена неизвестен |
| 2. Синусовый ритм | Желателен синусовый ритм |
| 3. Нормальный дренаж полых вен | Желателен нормальный дренаж полых вен |
| 4. Правое предсердие нормального объема | Маленькое правое предсердие — противопоказание для операции латерального тоннеля Фонтена |
| 5. Среднее давление легочной артерии — менее 15 мм рт. ст. | Среднее давление легочной артерии — менее 15 мм рт. ст. |
| 6. Легочное альвеолярное сопротивление — менее 4 ед./м2 | Легочное альвеолярное сопротивление — менее 4 ед./м2 |
| 7. Отношение диаметров легочной артерии и аорты — более 0,75 | Адекватные размеры легочного сосудистого русла, может быть полезным применение индексов МcСoon и Nacato |
| 8. Нормальная вентрикулярная функция (фракция выброса более 0,6) | Сохраненные вентрикулярные систолическая и диастолическая функции |
| 9. Компетентный левый атриовентрикулярный клапан | Компетентный левый атриовентрикулярный клапан |
| 10. Отсутствие нарушающих эффектов предыдущих шунтов | Отсутствие нарушающих эффектов предыдущих шунтов |
Распространены также критерии А. А. Choussаt (1977), хотя они мало отличаются от предыдущих [9]:
1) возрастные границы — более 4 и менее 15 лет;
2) нормальный синусовый ритм;
3) нормальный венозный возврат;
4) нормальный объем правого предсердия;
5) среднее давление легочной артерии — менее 15 мм рт. ст.;
6) легочное артериолярное сопротивление — менее 4 ед. Вуда на 1 м2 площади поверхности тела;
7) соотношение диаметров легочной артерии и аорты — более 0,75;
 фракция выброса левого желудочка — более 0,60;
фракция выброса левого желудочка — более 0,60;
9) компетентный митральный клапан;
10) отсутствие искажения легочных артерий.
Показания и противопоказания для операции Фонтена
Изначально эта операция была предложена для использования в случае отсутствия правого предсердно-желудочкового соединения, в настоящее время применяется в связи с расширением показаний для оперативного лечения многих сложных сердечных мальформаций с только одним хорошо развитым желудочком. Такие пороки включают правую или левую атриовентрикулярную клапанную атрезию, двуприточный желудочек, легочную атрезию с интактной вентрикулярной перегородкой, гипопластический правый или левый желудочек с дефектами межжелудочковой перегородки, с наличием или без вышерасположенного атриовентрикулярного клапана, отдельные случаи двойного отхождения магистральных сосудов от одного желудочка.
Выполнение операции Фонтена имеет только несколько абсолютных противопоказаний:
легочное сосудистое сопротивление — более 4 ед. Вуда на 1 м2;
тяжелая гипоплазия легочных артерий;
тяжелая диастолическая дисфункция левого желудочка.
Возраст, при котором выполняется операция, значительно снизился — в некоторых клинических центрах эта операция выполняется в возрасте 2 лет и даже раньше у пациентов с подходящей анатомией и физиологией. Преимущество выполнения операции Фонтена в раннем возрасте — это повышение оксигенации, что позволяет улучшить соматический рост и исходы неврологического развития. Операция также снижает объемную нагрузку на единственный желудочек.
Считается, что операция должна выполняться после того, как ребенок начинает ходить или, по меньшей мере, ползать, с целью использования влияния мышечного сокращения на венозный возврат. Наличие дооперационного синусового ритма не является обязательным условием для успешного исхода операции, однако необходимо обеспечение темпа в непосредственном послеоперационном периоде. Аномальный венозный возврат не является абсолютным противопоказанием для выполнения операции, он считается совместимым с кровообращением Фонтена. Оценка вентрикулярной функции является трудной процедурой по причине неоднородной геометрии многих единственных желудочков. Магнитно-резонансное изображение позволяет осуществить точное измерение вентрикулярных объемов выброса и фракций регургитации, но до сих пор не ясно, имеется ли польза этих объемных определений как предсказательных факторов исхода после операции Фонтена.
Наличие регургитации атриовентрикулярных клапанов может быть следствием перегрузки объемом единственного желудочка, если пациент имеет системно-легочной шунт; регургитация может улучшиться, когда нагрузка объемом будет удалена.
Имеются сообщения о неплохой переносимости регургитации атриовентрикулярных клапанов после операции Фонтена. Тем не менее современная тактика предполагает агрессивные попытки коррекции или уменьшения атриовентрикулярной клапанной регургитации, насколько это возможно [7, 10—14].
В исследовании S. Ovrutski с соавт. [15] конечно-диастолическое системное вентрикулярное давление (КДСВД) более 10 мм рт. ст. и среднее давление в легочной артерии (СДЛА) выше 15 мм рт. ст. являются факторами риска. Однако авторы считают, что КДСВД, равное 12 мм рт. ст., и СДЛА, равное 17 мм рт. ст., являются приемлемыми показателями для выполнения операции Фонтена при адекватной функции желудочков.
Типы операции. Безусловно, целесообразность, тип операции и время ее выполнения должны определяться для каждого случая индивидуально, с учетом тех фактов,что двух одинаковых сердец и анатомии проводящей системы не бывает и каждый пациент имеет уникальные гемодинамические показатели, возможности адаптации к патологии и резервные силы перенести операцию.
Анализ литературных источников позволяет сделать несколько выводов, касающихся выбора типа операций исправления единственных желудочков различных форм. Во-первых, для несбалансированного (асимметричного) атриовентрикулярного канала операцией выбора является бивентрикулярная коррекция, или так называемая полуторажелудочковая модификация операции Фонтена с применением двунаправленного анастомоза Гленна, чтобы снизить количество крови, проходящей через относительно маленький правый желудочек и трикуспидальный клапан (другими словами, «разгрузить» его). Одножелудочковая коррекция необходима только в редких случаях, когда имеется значительная обструкция выходного отдела правого желудочка или маленький вентрикулярный компонент, а также у пациентов со значительным дисбалансом (асимметрией) общего атриовентрикулярного клапана над левым желудочком (severe unbalancing of the common AV limiting right ventricular flow), с целью ограничения притока крови к правому желудочку. Гипотетическими преимуществами полуторажелудочковой коррекции для несбалансированного (асимметричного) атриовентрикулярного клапана являются:
1) возможность избежания высоких системных давлений;
2) антеградный, пульсирующий кровоток, направляющийся к легочным артериям, инициирует потенциальный рост легочных артерий;
3) сниженный риск долгосрочных осложнений физиологии кровообращения Фонтена — непереносимости физических упражнений, предсердных аритмий и белково-дефицитной энтеропатии [16—18].
Диагноз трикуспидальной атрезии (как и митральной атрезии, и синдрома гипоплазии левых отделов сердца) является однозначным показанием к операции кавапульмонального анастомоза, причем анамнез выполнения предшествующих операций ассоциируется с более высокими показателями осложнений. Даже выполнение модификаций операции Фонтена с созданием полного кавапульмонального анастомоза после операций верхнего кавапульмонального анастомоза (геми-Фонтена и двунаправленного шунта Гленна) может увеличить частоту таких проблем, как аритмии, тромбоэмболии, плевральная транссудация, белково-дефицитная энтеропатия и обструктивный бронхит, центральные и периферические неврологические осложнения.
Yueh-Tze Lan с соавт. [19] сообщили о лучших отдаленных результатах у пациентов с единственным желудочком при наличии двойного входа (двуприточным желудочком), чем в случае трикуспидальной атрезии с транспозицией магистральных сосудов. Поздние аритмии и необходимость в пейсмейкере были выявлены как независимые факторы риска смерти. Обструкция системного выходного отдела, когда она распознается и исправляется рано, не имеет влияния на долгосрочные показатели выживаемости. Защита сосудистого русла натурально встречающимся легочным или подлегочным стенозом, а также выполненная посредством бандирования легочной артерии, ассоциировалась с лучшей выживаемостью.
Анатомическим диагнозом, для которого в литературе указан наилучший естественный (без хирургического вмешательства — операции Фонтена или альтернативного вмешательства — операции разделения [рис. 3]) исход, является единственный желудочек с двойным входом (double-inlet single ventricle), другими словами, двуприточный. Очевидно, что это должно учитываться перед направлением взрослого пациента на операцию Фонтена, для которой установлена в 65—85% случаев 10-летняя выживаемость, а риск послеоперационной смертности может достигать 30% и более.
Для клинически тяжелой аномалии Эбштейна вариантом операции одножелудочковой коррекции (как и для асимметричного атриовентрикулярного клапана) служит полуторажелудочковая коррекция. При этой патологии считается, что главными преимуществами включения гипоплазированного (легочного) желудочка для частичной поддержки легочного кровообращения являются:
1) возможность увеличить сердечный выброс;
2) адаптация к физическим упражнениям;
3) поддержание пульсирующего потока в легочной циркуляции;
4) гибкость в ответ на повышенное легочное сопротивление;
5) циркуляция при низких уровнях давления в системе нижней полой вены;
6) возможность гипоплазированного комплекса правых отделов сердца адекватно справляться со сниженной преднагрузкой
Рис. 3. Операция разделения (septation procedure) [20, 21]: 1 — легочный ствол; 2 — бульбовентрикулярное отверстие; 3 — трикуспидальный клапан; 4 — заплата
J.M. Stulak с соавт. [22] сообщают, что операция «один с половиной» применяется в тех случаях, когда правый желудочек считается неспособным поддерживать легочную циркуляцию. Исследователи считают, что полуторажелудочковая коррекция может служить альтернативой для пациентов с тяжелой аномалией Эбштейна и плохой функцией правого желудочка, которые могут подвергаться высокому риску при выполнении стандартного хирургического лечения. Помимо снижения нагрузки, по мнению исследователей, выполнение операции представляет преднагрузку для левого желудочка.
В случае оперативного лечения легочной атрезии, встречающейся в составе комплексных пороков, судя по литературным источникам, трудно однозначно судить об успехе одножелудочковой коррекции. H. Leonard с соавт. [23] сообщили об обследовании 57 из 129 родившихся с легочной атрезией в 1980—1995 гг. Авторы пришли к выводу, что результаты лечения неутешительны и пациенты, перенесшие бивентрикулярную коррекцию (см. рис. 3), имели лучшие показатели переносимости физической нагрузки, чем те, кто подвергся одножелудочковым операциям. Исследователи также сообщают о высоком уровне внезапной смерти у пациентов с легочной атрезией, которая составила 29/1000 пациентов лет. Однако D.D. Mair с соавт. [24], исследуя 860 операций Фонтена с 1973 по 1994 гг., пришли к заключению, что пациенты с легочной атрезией и интактной межжелудочковой перегородкой не могут быть кандидатами на традиционную бивентрикулярную операцию, если трикуспидальный клапан составляет по меньшей мере 70% от ожидаемого размера. У пациентов с его размерами в диапазоне 50—70% может быть выполнима лишь бивентрикулярная коррекция с двунаправленным анастомозом Гленна. У пациентов с размерами трикуспидального клапана и правого желудочка менее ожидаемых операция Фонтена обеспечивает «окончательную паллиацию» (definitive palliation), а ранние и поздние результаты этого подхода обнадеживают.
Экстракардиальный, внесердечный кондуит является в плане показаний гибкой операцией и может выполняться практически при всех анатомических ситуациях. Они включают случаи, при которых другие подходы могут быть трудными (например, у пациентов с синдромом гетеротаксии и аномалиями системного и легочного венозных дренажей).
По сравнению с ранее применявшимися методиками операции Фонтена частота плевральной транссудации после операций экстракардиального обхода правых отделов сердца существенно выше. Причина этого окончательно не ясна — возможно, это связано с отсутствием фенестрации, позволяющей разгрузить малый круг кровообращения, который не до конца адаптировался к возросшему кровотоку. Тем не менее исследователи не считают необходимым выполнять фенестрацию всем пациентам, так как с явлениями гидроторакса удается справиться, а наличие артериальной гипоксемии не улучшит состояния пациента и может потребовать в дальнейшем процедуры закрытия фенестрации. Кроме того, в этой группе практически не встречаются такие грозные осложнения, как острая сердечная недостаточность и тахиаритмии, для избежания которых выполнялась фенестрация при операции тотального кавапульмонального анастомоза [25].
Заключение. C момента разработки операции Фонтена показания к ее выполнению расширились в связи с созданием новых модификаций и изучением послеоперационных эффектов. Идеальная операция Фонтена еще не создана, хотя близкой к таковой является модификация C. Marcelletti. Нет однозначного мнения, с учетом индивидуальных гемодинамических показателей пациента и вариаций операций, является ли целесообразным выполнение фенестрации у больных, переносящих операцию Фонтена экстракардиальным кондуитом. Судя по литературе, предпочтительнее как можно более раннее вмешательство.
Анализ литературных данных позволяет говорить о перспективности дальнейшей разработки операции разделения единственного желудочка, а также указывает пути усовершенствования и других операций.
Литература
1. Бокерия Л.А., Подзолков В.П., Глянцев С.П., Кокшенев И.В. Операция кавапульмонального анастомоза. Часть 2. От воплощения к ее совершенствованию. Детские болезни сердца и сосудов 2005; 5: 7—13.
2. Baum C.V. Pediatric cardiac surgery: historical appreciation. Pediatric Anesthesia 2006 May: 1—12.
3. Bjork V.G. Fifty years of cardiac and pulmonary surgery. Scand J Thoracic Surgery Supplement 1998; 8: 142—149.
4. Galankin N.K. Cavapulmonary anastomosis. M: Medyt- sina; 1968; 350 p.
5. Vishnevsky A.A., Galankin N.K., Krymski L.D. Tetralogy of Fallot. M: Medytsina; 1969: 225 p.
6. Keirle A., Helmsworth J.A., Kaplan S., Ogden A. Experi¬ence with fnastomosis of superior vena cava to pulmonary artery glenn procedure. Circulation 1963 April; 24: 753—760.
7. Kirklin’s J., Barrat-B’s. Cardiac surgery. Wiley & Sons; 2005; 2583 p.
8. Robicsek F., Watts L.T. A prelude to Fontan. Pediatr Car-diol 2007; 28(6): 422—425.
9. Wilkinson J.L. The Fontan simulation. Results, late Follow-up and management. Heart Views 2004; 4(4): 73—78.
10. Van Doorn C.A., de Leval M.R. The lateral tunnel Fontan. Oper Tech in Thorac and Cardiovasc Surg 2006; 11(2): 105—122.
11. Bradley S.M. Extracardiac Fontan procedure. Oper Tech in Thorac and Cardiovasc Surg 2006; 3(5): 123—140.
12. De Leval M.R. The Fontan circulation: a challenge to Wil-liam Harvey? Nature Clinical Practice Cardiovascular Med-icine 2005; 2: 202—208.
13. Hosein Riad B.M., Andrew J.B. Clarke, Simon P. McGuirk et al. Factors influencing early and late outcome following the Fontan procedure in the current era. The «Two Commandments»? Eur J Cardiothorac Surg 2007; 31; 344—353.
14. Uemura H, Yagihara T., Kawashima Y, Yamamoto F., Nishigaki K, Matsuki O, Okada K, Kamiya T., Ander¬son R.H. What factors affect ventricular performance after a Fontan-type operation? J Thorac Cardiovasc Surg 1995; 110(2): 405—415.
15. Ovrutski S., Alexi-Meskishvili, Ewert P., Nurnberg J.-H., Hetzer R., Lange P.E. Early and medium-term results after modified Fontan operation in adults. Eur J Cardiothorac Surg 2003; 23: 311—316.
16. Cohen M.S., Spray T.S. Surgical management of unbal-anced atrioventricular canal defect. Semin Thorac Cardiovasc Surg Pediatr Card Surg Ann 2007; 8: 135—144.
17. Corno A.F., Chassot P.G., Payot M., Sekarski N., Tozzi P., von Segesser L.K. Ebstein’s anomaly: one and a half ven-tricular repair. Swiss Med Wkly 2002; 132: 485—488.
18. Mitchell M.E., Litwin S.B., Tweddell J.S. Complex atrioven-tricular canal. Semin Thorac Cardiovasc Surg Pediatr Card Surg Ann 2007; 10: 32—41.
19. Yueh-Tze Lan, Ruey-Kang Chang, Hillel Laks, MD. Out¬come of patients with double-inlet left ventricle or tricuspid atresia with transposed great arteries. J Am Coll Cardiol 2004; 43: 113—119.
20. CTS files. Cardiac Surgery files; 2007.
21. https://www.perfusionkorea.org/kosect/chd/singleventricle.php
22. Stulak J.M., Dearani J.A., Danielson G.K. Surgical man-agement of Ebstein’s anomaly. Semin Thorac Cardiovasc Surg Pediatr Card Surg Annu 2007; 10: 105—111.
23. Leonard H., Derrick G., O’Sullivan J., Wren C. Natural and unnatural history of pulmonary atresia. Heart 2000; 84(5): 499—503.
24. Mair D.D., Puga F.J., Danielson G.K. The Fontan pro¬cedure for tricuspid atresia: early and late results of a 25-year experience with 216 patients. J Am Coll Cardiol 2001; 37(3): 933—939.
25. Подзолков В.П., Чиаурели М.Р., Зеленикин М.М и др. Непосредственные и среднеотдаленные результаты операции Фонтена в модификации экстракардиального кондуита. Грудная и сердечно-сосудистая хирургия 2005; 4: 10—13.