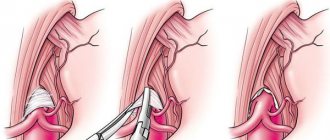
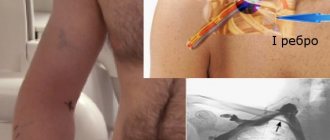
Синдром компрессии чревного ствола (СКЧС) — это редкое заболевание, являющееся одной из причин хронической абдоминальной ишемии [1]. Сдавление чревного ствола срединной дугообразной связкой диафрагмы возникает в процессе онтогенеза. В 1965 г. американский врач J. Dunbar впервые описал данный синдром, который в последующем стал называться его именем [2]. Диагностика и лечение СКЧС являются сложной задачей для хирурга, так как наличие экстравазальной компрессии, выявленной инструментальными методами исследования, зачастую не соответствует клинической картине и жалобам пациента. Причины, по которым у одних пациентов кровообращение в бассейне чревного ствола полностью компенсируется за счет коллатерального кровотока, а у других развивается ишемия, до конца не изучены [3]. Клиническое определение СКЧС можно сформулировать следующим образом: экстравазальная компрессия чревного ствола, подтвержденная инструментальными методами исследования, сопровождающаяся клинической симптоматикой абдоминальной ишемии, которую нельзя связать с каким-либо другим заболеванием. Симптоматика данного заболевания разнообразна: хроническая абдоминальная боль, возникающая или усиливающаяся после приема пищи, может сопровождаться диспептическими явлениями, нейровегетативными расстройствами, депрессивным астено-ипохондрическим синдромом.
Многие годы при СКЧС методом выбора было рассечение срединной дугообразной связки диафрагмы с использованием верхнесрединной лапаротомии или даже торакофренолюмботомии, что сопровождалось тяжелым течением послеоперационного периода с большим числом осложнений, связанных с травматичностью доступа [4]. С началом эры эндоскопической хирургии стали появляться первые сообщения о лапароскопической декомпрессии чревного ствола [5].
Однако с момента внедрения данного метода в хирургическую практику по сей день открытыми остаются вопросы о показаниях и противопоказаниях к данной операции, технике оперативного вмешательства, интраоперационной оценке эффективности декомпрессии, а также оценке результатов лечения в раннем и отдаленном послеоперационных периодах.
Цель нашего исследования — усовершенствование техники операции и оценка значения интраоперационного лапароскопического ультразвукового исследования (УЗИ), а также оценка и поиски путей улучшения ближайших и отдаленных результатов лапароскопической декомпрессии чревного ствола на основании собственного опыта.
Кратко о методе лечения
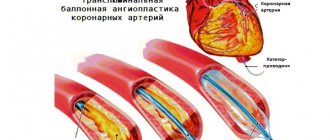
Ангиопластика и стентирование чревного ствола и брыжеечных артерий применяется для лечения синдрома хронического нарушения кишечного кровообращения (angina abdomenalis) или при экстренной операции по поводу острого нарушения кровообращения кишечника (мезентериального тромбоза).
Нарушения кишечного кровообращения достаточно редко диагностируются без прицельного акцента на определенных жалобах и часто устанавливаются опытным клиницистом только после исключения других причин болей в животе.
Раньше при выявлении сужений чревного ствола или брыжеечных артерий хирурги придерживались консервативной выжидательной тактики, так как открытые операции на этих артериях очень сложны и тяжело переносятся пациентами. Сейчас, благодаря развитию эндоваскулярных технологий, стало возможно малотравматичное устранение проблем с висцеральными артериями.
Зачем делать стентирование чревного ствола и брыжеечной артерии
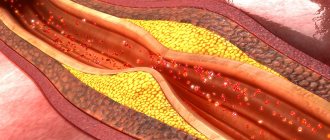
Внутри брюшной полости располагаются органы, которые отвечают за пищеварительные процессы. Они обильно снабжаются кровью крупными сосудами – чревным стволом, верхней и нижней брыжеечной и почечными артериями. Нарушение кровотока в этих артериях затрудняет работу внутренних органов и ухудшает их функциональность. Это нарушение может возникнуть резко, например при закупорке тромбом сосуда, или развиться в хронической форме, когда поступление крови к органу сохраняется, но заметно снижается.
Острое нарушение кровообращения требует немедленного оперативного вмешательства, так как чревато летальным исходом. Хронические формы ухудшают качество жизни человека, вызывают другие заболевания внутренних органов, и также требуют проведения операции.
Преимущества лечения в ИСЦ
При патологии чревного ствола и верхней брыжеечной артерии наши рентгенхирурги могут выполнить ангиопластику и стентирование сужений этих значимых артерий. Чаще всего используется доступ через плечевую или лучевую артерию.
При наличии тромбоза мезентериальной артерии или чревного ствола в нашей клинике выполняются операции тромбэктомии с помощью специального зонда Rotarex или селективный тромболизис. После восстановления кровотока мы выполняем ангиопластику и стентирование.
Результаты
Средняя продолжительность операции составила 102±20 мин. Интраоперационная кровопотеря в каждом случае не превышала 50 мл. Техническая выполнимость была достигнута во всех случаях независимо от варианта доступа к чревному стволу. Конверсий, интраоперационных осложнений, а также осложнений в раннем послеоперационном периоде не было ни в одном из 21 случая. Длительность пребывания в стационаре составила 5,8±0,6 дня.
Отдаленные результаты в сроки от 1 года до 12 лет после операции прослежены у 17 из 21 пациента. По данным ультразвукового дуплексного сканирования средняя степень сужения чревного ствола до операции составляла 72,5%, в раннем послеоперационном периоде уменьшилась до 42,5%, а в отдаленном периоде снизилась еще до 33% (рис. 5).
Рис. 5. Степень сужения чревного ствола по данным УЗИ до операции и в послеоперационном периоде.
Изменение гемодинамических показателей скорости кровотока в чревном стволе после операции также представляется значимым. Так, до операции средняя пиковая систолическая скорость кровотока в чревном стволе (Vs) составляла 312 см/с, а ускорение пиковой систолической скорости кровотока в фазе глубокого выдоха по сравнению с фазой глубокого вдоха (Vs выд — Vs вдох) составляло 144,5 см/с. В раннем послеоперационном периоде данные показатели снизились до 193,3 см/с и 54 см/с соответственно. В отдаленном послеоперационном периоде пиковая систолическая скорость кровотока в чревном стволе (Vs) составила 172 см/с, а ускорение пиковой систолической скорости кровотока (Vs выд — Vs вдох) снизилось еще до 43,5 см/с (рис. 6).
Рис. 6. Гемодинамические показатели кровотока до и после оперативного вмешательства.
В нашем исследовании интраоперационное лапароскопическое УЗИ выполнялось во всех случаях декомпрессии чревного ствола, что позволило, помимо определения анатомии чревного ствола, объективно оценить адекватность декомпрессии и соответственно получить хорошие клинические результаты (рис. 7).
Рис. 7. Интраоперационное ультразвуковое сканирование позволяет оценить эффективность декомпрессии.
Однако 2 пациентам из 21 понадобилось выполнение повторного оперативного вмешательства. В первом случае повторное оперативное вмешательство потребовалось вследствие неполного восстановления кровотока по чревному стволу после лапароскопической декомпрессии. Операция была проведена из открытого доступа через год после выполнения лапароскопической декомпрессии, с положительным эффектом. Этот случай был первым опытом выполнения лапароскопической декомпрессии чревного ствола в Институте хирургии им. А.В. Вишневского. Таким образом, необходимость повторной операции может быть связана с неполноценной декомпрессией в процессе становления методики.
Во втором наблюдении лапароскопическая декомпрессия чревного ствола была выполнена с выраженным положительным эффектом, что подтверждалось данными ультразвукового исследования в раннем и отдаленном послеоперационных периодах. В связи с сохранением у пациентки жалоб и наличием инструментально подтвержденного гемодинамически значимого сдавления чревного ствола было принято решение о повторной лапароскопической декомпрессии. Повторная лапароскопическая декомпрессия была выполнена успешно, кровоток был полностью восстановлен: по данным ультразвукового исследования в раннем послеоперационном периоде кровоток в чревном стволе носил ламинарный характер, линейная скорость кровотока составила 180 см/с. Однако жалобы на боли в животе у пациентки сохранялись. В данном случае речь, вероятно, идет о психосоматическом расстройстве.
Основными критериями эффективности оперативного вмешательства мы считаем послеоперационное улучшение гемодинамических показателей кровотока в чревном стволе (выход этих показателей из диапазона гемодинамической значимости) в сочетании с купированием симптоматики и улучшением качества жизни больного.
Эффективность выполненного вмешательства в отдаленном послеоперационном периоде оценивалась клинически, по данным послеоперационного инструментального обследования, а также с помощью анкетирования по системе оценки качества жизни SF-36. По опроснику SF-36 17 из 21 пациента были анкетированы дважды: в предоперационном периоде и через год после выполнения вмешательства. Перед операцией среднее значение физического компонента здоровья составило 38 баллов, психологического — 31 балл, интенсивность боли составила 28,7 балла. В послеоперационном периоде исследуемые критерии были оценены большим количеством баллов, что свидетельствовало о повышении качества жизни и снижении интенсивности боли: физический компонент здоровья составил 41,5 балла, психологический — 35,8 балла, критерий интенсивности боли составил 40,2 балла (рис. 8).
Рис. 8. Оценка качества жизни по данным опросника SF-36.
Показания и противопоказания к методу лечения
Показания:
Стеноз чревного ствола более 60% с синдромом хронической абдоминальной ишемии
Стеноз верхней брыжеечной артерии более 60% (симптомы сосудистой недостаточности кишечника не являются обязательным показанием, достаточно факта стеноза)
Этап эндоваскулярного лечения острой мезентериальной непроходимости (мезентериальный тромбоз)
Противопоказания:
- Аллергия на йод
- Аневризма торакоабдоминальной аорты (без операции по поводу аневризмы)
- Стадия некроза кишки при мезентериальном тромбозе
Диагностика
Мезентериальный тромбоз: причины, симптомы, лечение
Диагностика должна основываться на физических и инструментальных методах обследования. При осмотре необходимо измерить пульс. Стеноз сердца будет характеризоваться медленной его скоростью и малым значением.
https://youtube.com/watch?v=BbfNG4gqp_s
https://youtube.com/watch?v=BbfNG4gqp_s
К физическим методам относится аускультация и пальпация. Аускультативный признак этого заболевания – выслушивание систолического шума, слушать нужно над дугой аорты и митральным клапаном, отмечается снижение двух тонов. Пальпация – важная клиническая методика. Наблюдается изменение локализации верхушечного толчка, его систолическое дрожание. Перкуссия показывает смещение левой сердечной артерии влево и вниз.
Пациенты с такой патологией имеют бледный цвет кожных покровов, нередко – синеватый цвет конечностей тела. Нередко живот будет отечный, как и нижние конечности.
К инструментальным методам обследования относят:
- эхокардиография (ЭхоКГ);
- электрокардиограмма (ЭКГ);
- ультразвуковое исследование (УЗИ);
- рентгенографическое обследование;
- катетеризация сердца.
На электрокардиограмме выявляют степень гипертрофии левого желудочка и смещение оси сердца влево. При рентгенологическом исследовании отмечается расширение сердца. Ставят диагноз артериальной легочной гипертензии. При эхокардиографии исследуют фиброзное клапанно-подклапанное образование, которое является утолщенным, гипертрофированную сердечную перегородку.
Подготовка к лечению
Стандартное обследование перед операцией:
- Клинические анализы крови и мочи, биохимический анализ крови.
- Коагулограмма, агрегация тромбоцитов
- Гастроскопия (исследование желудка)
- Рентгенография легких
- ЭКГ
- ЭХО кардиография
- УЗИ органов брюшной полости, аорты и артерий конечностей
- Мультиспиральная компьютерная томография с контрастом аорты и ее ветвей
Перед операцией необходимо воздерживаться от приема пищи за 8 часов и жидкости за 2 часа. Других мероприятий по подготовке не требуется.
Как проходит метод лечения
Операция проводится под местной анестезией в области доступа. Возможно доступ будет на бедре или в области локтевого сгиба. Операционное поле обрабатывается антисептиком и закрывается стерильными простынями.
Хирург выполняет местную анестезию места прокола, после чего проводится пункция артерии специальной иглой и установка короткой трубочки — интрадюссера.
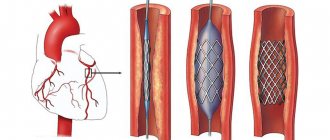
Через интрадюссер проводится вся дальнейшая работа с сосудами. Специальный проводник заводится в брюшную аорту, затем по нему проводится катетер, через который выполняется контрастное исследование чревного ствола и брыжеечной артерии. Этот этап называется селективной ангиографией. Она является окончательным методом диагностики. Если сужения артерий подтверждаются, то проводник заводится ниже места сужения. По проводнику проводится баллон со стентом. Раскрытием этого баллона устраняется сужение артерии, а стент укрепляет артериальную стенку.
После имплантации стента обязательно проводится контрольная ангиография, чтобы исключить возможные осложнения. Катетер и интродюссер извлекаются из места доступа, а кровотечение останавливается прижатием или с использованием специального сшивающего устройства «Ангиосил».
| На главную |
(Новости лучевой диагностики 2000 1: 8-11)
Хронические нарушения висцерального кровообращения.
Филиппович Н. С.
Белорусский институт усовершенствования врачей.
Хронические нарушения висцерального кровообращения — это заболевание, для которого характерны ишемические расстройства кровообращения органов брюшной полости, вызванные нарушениями проходимости висцеральных артерий вследствии экстра — или интравазальных причин (А. В. Покровский, 1979). Так как заболевание проявляется приступом болей в животе в момент наибольшей функциональной активности органов пищеварения, некоторые авторы для обозначения этого заболевания применяют термин “angina abdominalis”. Механизм происхождения болей идентичен стенокардии напряжения и связан с недостатком притока оксигенированной крови к активно функционирующему органу вследствие нарушения кровотока по артериям.
История изучения патологии висцеральных артерий началась в 1843 году, когда Tiedeman на вскрытии выявил бессимптомную окклюзию верхней брыжеечной артерии. Частота заболевния до сих пор не определена. По данным патологоанатомических исследований поражение чревных артерий наблюдается в 20-45% случаев, верхней брыжеечной артерии в среднем в 30% (Dewgan C. , et . al).
Различают острую и хроническую формы ишемической болезни кишечника. Острая ИБК является особой главой неотложной хирургии. Количество больных ХИБК по мере изучения заболевания, прогрессирующе увеличивается, а истинное число лиц с данной патологией значительно больше, чем выявляется в клинической практике. Это объясняется многообразием клинических проявлений, сложностью диагностики, незнанием некоторых особенностей. Учитывая, что болеют данным заболеванием лица трудоспособного возраста, становится понятной необходимость изучения вопросов диагностики и лечения абдоминального клинического синдрома и огромная социальная значимость проблемы .
В общей системе гемоциркуляции мезентериальный кровоток играет значительную роль. Количество крови в кишечнике взрослого человека составляет от 30 до 40% всей циркулирующей крови, кровообращение кишок обеспечивается сосудами бассейна верхней и нижней брыжеечных артерий и вен, чревной артерии.
Основными причинами хронического нарушения висцерального кровообращения являются внутрисосудистые стеноз и окклюзия и внесосудистая компрессия висцеральных артерий. На первом месте среди внутрисосудистых факторов стоит атеросклеротическое поражение висцеральных артерий, на втором месте — аорто-артериит.
Экстравазальные факторы, вызывающие сдавление мезентеральных артерий: серповидная связка диафрагмы, ее медиальная ножка, ганглии солнечного сплетения, опухоли и др. При этом экстравазальному сдавлению чаще всего подвергается чревный ствол.
Иногда компрессия возникает при высоком отхождении чревного ствола от аорты, в других случаях при низком прикреплении диафрагмы с нормальным уровнем отхождения артерии. Кроме того, перегиб чревной артерии может произойти в результате ее низкого отхождения от аорты.
Патологическая анатомия.
Магистральные висцеральные артерии образуют широкую сеть коллатеральных сосудов. Наиболее важное клиническое значение имеют следующие коллатеральные связи. Между чревной и верхнебрыжеечными артериями существуют анастомозы, образованные наддвенадцатиперстной и позадидвенадцатиперстной артериями из коллектора чревной артерии и передними и задними веточками нижней панкреато-дуоденальной артерии — ветви верхней брыжеечной артерии. В области головки поджелудочной железы эти ветви образуют так называемые переднюю и заднюю панкреато-дуоденальные аркады — или малую дугу. Верхняя и нижняя брыжеечные артерии связаны между собой широким артериальным мостом — большой дугой — дугой Риолана, образованной посредством средней ободочной и левой ободочной артерий. Нижняя ободочная артерия в свою очередь связана с внутренней половой артерией (Рис. 1
)
Кроме перечисленных анастомозов существует широкая сеть мелких коллатералей. Сосудистые анастомозы приобретают исключительно важное значение при нарушении проходимости основных висцеральных артериальных стволов. Они обеспечивают функционально полный коллатеральный кровоток, способный предохранить часть органа или весь орган от ишемических повреждений. Эти обычно малого калибра артериальные анастомозы в условиях непроходимости магистральных артерий превращаются в мощные коллатеральные пути. При стенозе или окклюзии чревной артерии важнейший коллатеральный кровток осуществляется через панкреатодуоденальные аркады. Кровоток начинается от выходящих из верхней брыжеечной артерии панкреатодуоденальных артерий, которые через заднюю или переднюю панкреатодуоденальную аркаду соединяются с желудочно-дуоденальной артерией, а дальше — через общую печеночную артерию — с чревной артерией.
При частичной или полной окклюзией верхней брыжеечной артерии функционирует тот же коллатеральный круг, только в противоположном направлении, и одновременно включается дуга Риолана.
Однако часто коллатеральный кровоток развивается недостаточно и множество факторов — возраст, характер патологического процесса, анатомические вариации и др. могут влиять на приспособительные возможности в условиях ишемии, поэтому часто наблюдается выраженная клиника и при изолированном поражении одной из висцеральных ветвей.
При анализе причин нарушения висцерального кровотока наблюдается следующая закономерность: причиной изолированного поражения чревной артерии чаще всего является экстравазальная компрессия, верхняя брыжеечная артерия несколько чаще поражается при неспецифическом аорто-артериите. Нижняя брыжеечная, как правило, страдает при атеросклерозе.
Патогенез
заболевания отличается многообразием функциональных и морфологических нарушений, сложными гемодинамическими и нервно-рефлекторными взаимоотношениями.
В начальных стадиях заболевния ограничение притока крови к органам пищеварительного тракта компенсируется с помощью системных коллатералей. В дальнейшем под воздействием хронической ишемии происходят дистрофические изменения железистого аппарата, дегенеративные процессы в функциональных элементах органов пищеварения и замена их менее дифференцированной соединительной тканью. Нарушения абсорбции в кишечнике ишемического генеза характеризуются недостаточным перевариванием всех компонентов пищевых продуктов, особенно жира. Длительная хроническая ишемия мышечного слоя кишечной стенки приводит к нарушению перистальтики. Артериальная недостаточность и гипоксия кишечной стенки приводит к ослаблению перистальтики, что клинически выражается метеоризмом запором. Заболевание определяется триадой симптомов: 1) приступообразными болями в животе, развивающимися после приема пищи на высоте пищеварения; 2) дисфункцией кишечника; 3) прогрессивным похуданием. У 78% больных со стенозом чревного ствола выслушивается систолический шум в эпигастральной области, при поражении верхней брыжеечной артерии он слышен в 50%. Для проявления данных симптомов нужно, чтобы две из трех главных висцеральных артерий были стенозированы более чем на 50%.
При наличии всего вышеперечисленного симптомокомплекса, а также при условии наличия систолического шума и негативных результатов исследований сердечно-сосудистой системы и желудочно-кишечного тракта, отсутствии эффекта от лечения, больному необходимо произвести рентгеноконтрастное исследование висцеральных сосудов.
Диагностические мероприятия
включают общеклинические и специальные. Из общеклинических следует обратить внимание на тщательный сбор анамнеза, жалоб, указание больного на безуспешное консервативное лечение, выявление характерного систолического шума, выслушиваемого над устьями суженых висцеральных артерий. С помощью лабораторных методов исследования можно выявить нарушение функции пищеварения (при копрологическом исследовании выявляются непереваренные мышечные волокна, нейтральный жир, большое количество клетчатки).
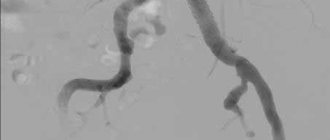
Наличие ведущих признаков ХИБК является прямым показанием для проведения рентгеноконтрастной ангиографии брюшной части аорты и ее висцеральных ветвей. Применяются методы: 1. Брюшная аортография в сагиттальной и фронтальных плоскостях, 2. Селективная ангиография висцеральных артерий.
Рентгенологические (ангиографические) признаки делятся на две группы: прямые и косвенные. Прямыми являются видимые непосредственно на артограмме деформация, стеноз и окклюзия: (Рис. 2, 3
) тени начального отдела артериального ствола в виде песочных часов, чрезмерное приближение (придавливание) чревной артерии к верхней брыжеечной артерии и наличие острого угла между чревной артерией и аортой. К указанным признакам относятся также обрыв или отсутствие контрастированных артерий на аортограмме при их полной окклюзии. Прямые признаки лучше выявляются в боковой или одной из косых проекций, также могут быть четко определены при селективной ангиографии. Прямые ангиографические признаки позволяют непосредственно определить локализацию, степень и протяженность поражения, а также наиболее вероятную его причину. Так, для атеросклероза характерны локализация процесса в устьях висцеральных артерий, обширность распространения, нечеткость контуров пораженной артерии, одновременное вовлечение в процесс брюшной части аорты. При неспецифическом аорто-артериите чаще поражаются аорта и чревная артерия, затем верхняя брыжеечная. В зоне поражения контуры сосуда четкие, циркулярно сужены. Для внесосудистой компрессии чревного ствола характерны приближение чревного ствола к верхней брыжеечной артерии, образование острого угла между чревным стволом и аортой, наличие деформаций артерий в виде песочных часов.
| Рис. 1. Схема коллатеральных путей при синдроме брюшной ангины. | |
| Рис. 2. Стеноз чревного ствола. Атеросклеротическое поражение. Боковая ангиограмма. |
К косвенным признакам относятся: 1. Наличие четко выраженных и расширенных коллатералей между бассейнами чревного ствола и верхней брыжеечной артерии. 2. Симптом ретроградного контрастирования артериального ствола. (Рис. 4
) 3. Постстенотическое расширение артериального ствола. 4. Отсутствие ретроградного заброса контрастного вещества в аорту при селективной катетеризации стенозированной висцеральной артерии.
| Рис. 3. Селективная целиакография. Стеноз чревного ствола, селезеночной артерии. Постстенотическое расширение общей печеночной артерии. Атеросклеротическое поражение. | |
| Рис. 4. Селективная верхняя мезентерикография. Ретроградное контрастирование чревного ствола, печеночных артерий через «малую дугу». |
В настоящее время изучается возможность использования при данных состояниях дуплексной допплерографии (ДДГ) и цветной допплерографии (ЦДГ). Иногда существуют ограничения из-за газа, перекрывающего кишечник, и трудности в получении изображения нижней брыжеечной артерии; обычные исследования редко позволяют ставить диагноз ишемии мезентериальных сосудов. Допплерография для изучения местного нарушения кровотока чревного ствола и ВБА проводятся натощак (12 ч без приема пищи). Регистрируемые при этом нарушения могут быть следующими: изменения формы волны, скорости или направления кровотока, повышение турбулентности, указывающее на стеноз. Самые крупные стенозы встречаются в проксимальных сегментах сосудов. Нормальная форма волны в проксимальном чревном стволе имеет высокорезистентную структуру с низким диастолическим потоком. Более дистально форма волны становится низкорезистентной с непрерывным диастолическим потоком. В ВБА в норме имеется турбулентный поток. Натощак выявляется высокорезистентная структура с минимальным диастолическим потоком. После приема пищи наблюдается низкорезистентная структура с широкими систолическими пиками, увеличением систолической и диастолической скорости и непрерывным диастолическим потоком. При наличии значительных стенозов у пациентов натощак выявляется повышение максимальной систолической скорости потока через зону сужения со значительным спектральным расширением, постстенозной турбулентностью и относительно выраженным диастолическим потоком. При ЦДГ виден поток с высокой скоростью (Рис. 5, 6
). Большинство специалистов предпочитает повторять исследование через 45 мин после приема пациентами стандартного завтрака, поскольку у большинства больных натощак наблюдается нормальный поток, и для выявления патологии необходимы провокационные тесты. При значительном стенозе у пациентов после приема пищи выявляются изменения в ВБА. Характеристики потока в чревном стволе заметно не изменяются даже у здоровых пациентов.
.
| Рис. 5. УЗ-изображение атеросклеротической бляшки в устье чревного ствола. ТС-чревный ствол, АО-аорта. | |
| Рис. 6. Спектрограмма кровотока, зарегистрированная на участке стеноза чревного ствола (турбулентный кровоток). |
В последнее время для выявления изменений со стороны висцеральных артерий с успехом используется КТ и МРТ. (Рис. 7
).
При обычном рентгенологическом исследовании желудочно-кишечного тракта могут быть выявлены некоторые неспецифические изменения, в частности медленный пассаж бария в желудке и кишечнике, повышенное содержание газа в кишечнике. Кроме того, наблюдаются симптомы хронической ишемии кишечника в виде различной величины дефектов наполнения из-за отека слизистой оболочки, которые исчезают при повторном исследовании; щелевидные участки просветления вследствие сегментарных спазмов ишемизированной кишки и сегментарные стенозы кишечника. В толстой кишке исчезают гаустры, замедляется опорожнение.
Дифференциальная диагностика
проводится с опухолью желудка, печени, поджелудочной железы (при экстравазальном сдавлении сосудов), хроническим панкреатитом, язвенной болезнью, аневризмой брюшной аорты.
| Рис. 7. КТ-томограмма. Атеросклероз брюшной аорты. Кальцинированная бляшка в устье чревного ствола. | |
Возможные осложнения при лечении
Осложнения самой операции:
- Разрыв суженной артерии с кровотечением — требует экстренной открытой операции или установки специального покрытого стента (стент-графта). К счастью, встречается очень редко.
- Тромбоз реконструированной артерии — редкое осложнение, встречается при повышенной свертываемости крови. Если проводится предоперационная подготовка с использованием антитромбоцитарной подготовки, то риск минимальный. Если тромбоз наблюдается во время вмешательства, то выполняется тромбэктомия или тромболизис (введение препаратов рассасывающих тромб). Если признаки нарушения кишечного кровообращения наблюдаются после операции, то пациент повторно берется в операционную и проводится удаление тромбов с помощью ротарекса или специальных аспирационных катетеров.
Осложнения сосудистого доступа:
- Гематома в области пункции
- Тромбоз артерии в области пункции
- Повреждение нервов в области пункции
Эти осложнения встречаются крайне редко и легко устраняются при своевременном выявлении.
Дополнительная информация, влияющая на течение и исход заболевания
Обследования, используемые для подтверждения ишемии при СКЧС
Наиболее информативна тонометрия, основанная на измерении рCO2 слизистой.
Измерение внутрипросветного рCO2 выполняют назогастральным и назоеюнальным катетером, подключенным к капнографу.
Появление и увеличение градиента рCO2 возникает при снижении кровотока ниже 50% от исходного потока и его последующего резкого изменения.
Наилучшая диагностика ХМИ — тонометрия на фоне функциональной нагрузки или пищевой пробы:
- чувствительность 76%
- специфичность 92%.
Недостатки тонометрии:
- сложность и дороговизна технологии,
- дискомфорт во время исследования,
- длительность исследования,
- ошибки при нарушении технологии измерения,
- капнографы не выпускаются и не обслуживаются.
Хирургическое лечение
После операции:
- симптомы СКЧС (боль) купируются у 83-88% пациентов при наблюдении до 30 дней;
- после сосудистой реконструкции симптомы регрессируют почти у 100%;
- через 5 лет асимптомных пациентов после декомпрессии 69%, после реконструкции 83%;
- через 10 лет асимптомных после декомпрессии 53%, после реконструкции 76%.
Предикторы плохого прогноза:
- атипичный болевой синдром с периодами ремиссии,
- анамнез астеноневротического состояния,
- психическое заболевание,
- злоупотребление алкоголем,
- возраст старше 60 лет,
- потеря в весе менее 20 фунтов (9 кг),
- рвота и боль, возникающая без провоцирующих факторов.
Астеноневротическая или психическая девиация:
- у 28% взрослых с СКЧС,
- у 43% детей с СКЧС,
- требует обязательного выполнения спланхникганглионэктомии,
- расширенный психиатрический/психологический анализ пациентов с СКЧС перед и после операции.
Программа наблюдения после метода лечения
Наблюдение за результатами ангиопластики и стентирования висцеральных артерий осуществляется с помощью УЗИ контроля через 3 месяца, а затем ежегодно.
Через год после вмешательства желательно выполнить мультиспиральную компьютерную томографию с контрастированием брюшной аорты и ее ветвей.
После лечения пациенту назначаются антитромботические препараты. Чаще всего это аспирин и клопидогрель (плавикс). Прием этих препаратов нужно осуществлять постоянно, обязательно ставя в известность врачей перед выполнением каких-либо других вмешательств.