Зачем делать стентирование чревного ствола и брыжеечной артерии
Внутри брюшной полости располагаются органы, которые отвечают за пищеварительные процессы. Они обильно снабжаются кровью крупными сосудами – чревным стволом, верхней и нижней брыжеечной и почечными артериями. Нарушение кровотока в этих артериях затрудняет работу внутренних органов и ухудшает их функциональность. Это нарушение может возникнуть резко, например при закупорке тромбом сосуда, или развиться в хронической форме, когда поступление крови к органу сохраняется, но заметно снижается.
Острое нарушение кровообращения требует немедленного оперативного вмешательства, так как чревато летальным исходом. Хронические формы ухудшают качество жизни человека, вызывают другие заболевания внутренних органов, и также требуют проведения операции.
Стеноз чревного ствола (синдром Данбара) — симптомы и лечение
Лечение стеноза бывает консервативным и оперативным. Первый вариант возможен в стадии компенсации и субкомпенсации. Он направлен на купирование симптомов. Если консервативная терапия оказалась неэффективной, пациенту назначают оперативное лечение.
Консервативная терапия
Консервативное лечение не влияет на основную причину болезни. Оно сугубо симптоматическое или направлено на сопутствующие заболевания: ГПОД или желчнокаменную болезнь.
В качестве симптоматического лечения используют различные лекарства:
- гастропротекторы — защищают и восстанавливают слизистую оболочку желудка;
- обволакивающие препараты — используют с той же целью непосредственно перед приёмом пищи;
- прокинетики — положительно влияют на моторику желудка, назначают при тошноте во время еды или гастроэзофагеальном рефлюксе (ГЭРБ);
- спазмолитики — воздействуют на гладкую мускулатуру, снижая болевой синдром;
- нестероидные противовоспалительные препараты (НПВП) — используются для обезболивания.
Следующий важный момент консервативного лечения — щадящая диета. Важно исключить из рациона острую, жирную и жареную пищу. Чтобы снизить нагрузку на желудок, рекомендуется питаться дробно, небольшими порциями. Также важно избегать стрессов и чрезмерной физической нагрузки. Всё это помогает снизить интенсивность боли после еды.
Некоторые клиники в комплексное лечение включают психотерапию и иглорефлексотерапию [16]. У последнего метода лечения нет безоговорочно доказательной базы, но многие практикующие врачи отмечают его эффективность в комплексной терапии.
Если консервативное лечение не помогает, встаёт вопрос о проведении операции.
Оперативное лечение
Чтобы выяснить, нужна ли пациенту операция, врач должен определить клиническую стадию болезни, выраженность симптомов, частоту их появления и оценить результаты обследования: УЗДС или КТ-ангиографии.
Затем нужно выбрать метод оперативного лечения:
- отрытая или лапароскопическая декомпрессия чревного ствола [7];
- реконструктивная операция;
- эндоваскулярная хирургия;
- гибридное оперативное лечение.
Отрытая операция — самый частый способ хирургического лечения. Чтобы добраться до чревного ствола, доктор рассекает брюшную стенку, а затем — давящие на него структуры: срединную дугообразную связку диафрагмы и ткани чревного сплетения.
Эта операция эффективна, но довольно травматична. После вмешательства организм восстанавливается примерно три месяца. Могут образоваться вентральные грыжи, при которых внутренние органы смещаются кнаружи. Иногда стеноз развивался повторно [17].
Лапароскопическая декомпрессия чревного ствола по технике выполнения принципиально не отличается от открытой операции. Разница — в менее травматичном (малоинвазивном) доступе и удобном отображении зоны вмешательства, которая видна всей операционной бригаде.
Боль в ране после такой операции менее выражена, пациент быстрее восстанавливается: в среднем 4–5 дней он находится в стационаре под наблюдением врача, а через 3–4 недели возвращается к обычной жизни и привычным нагрузкам.
Об успешной лапаросокпической декомпрессии чревного ствола первым сообщил американский хирург S. Roayaie в 2000 году [19]. С тех пор эту методику осваивают многие хирурги, но пока она не смогла «вытеснить» открытую декомпрессию. Это связано с техническими трудностями во время операции и приверженности пожилых хирургов к традиционной, более привычной методике.
Реконструктивные операции рекомендуются при выраженных изменениях, которые не позволяют освободить чревный ствол от сдавливающих тканей. Они выполняются сосудистыми хирургами в специализированных центрах. Врачи делают пластику чревного ствола или заменяют его трансплантатом — искусственным или естественным, т. е. другим сосудом. Эти операции выполняются открытым способом и переносятся пациентом так же, как и открытая декомпрессия чревного ствола.
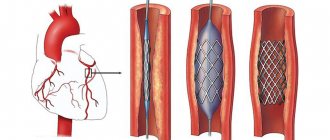
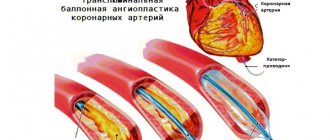
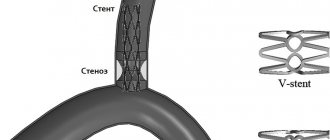
Эндоваскулярная операция рекомендуется пациентам старше 60 лет, артерии которых сужены атеросклеротическими бляшками. Чревный ствол расширяют с помощью баллонного дилататора или стента [18]. Оба варианта можно выполнить только после предварительной хирургической декомпрессии [12].
Хотя эндоваскулярные операции являются самым малоинвазивным способом лечения, они сопровождаются определёнными рисками: деформацией, переломом, миграцией стентов или тромбозом стентированной артерии.
Гибридное (комбинированное) лечение проводится, если чревный ствол сужен как изнутри, так и снаружи. Оно заключается в одномоментном или поэтапном выполнении двух методов лечения: декомпрессии чревного ствола и установки стента [18].
После эндоваскулярных и реконструктивных операций нужно наблюдаться у сосудистого хирурга и постоянно принимать препараты, разжижающие кровь. Схемы приёма зависят от проведённой операции. Эти обязательные меры помогут избежать повторного стеноза.
Подготовка к стентированию чревного ствола и брыжеечной артерии
Врач может назначить пациенту комплекс исследований, в том числе:
- общий анализ и биохимические показатели мочи и крови, оценку показателей свертываемости;
- видеогастроскопию;
- рентген легких;
- электрокардиограмму;
- УЗИ сердца;
- УЗИ брюшной полости;
- мультиспиральную КТ аорты.
Непосредственно перед операцией нужно воздержаться от приема пищи (за 8 часов до вмешательства). За два часа до операции нельзя принимать даже жидкость.
Синдром компрессии чревного ствола (СКЧС) — это редкое заболевание, обусловленное экстравазальным сдавлением чревного ствола срединной дугообразной связкой диафрагмы. Такое заболевание является одной из причин хронической абдоминальной ишемии [1, 2]. В основе СКЧС лежит нарушение взаимоотношений анатомических структур. В 1965 г. американский врач J. Dunbar [3] впервые описал этот синдром, который в последующем стал называться его именем [3]. В норме чревный ствол отходит от аорты ниже поясничной части диафрагмы, что исключает его компрессию. В случае высокого отхождения этого сосуда от брюшной аорты или низкого расположения поясничной части диафрагмы, или сочетания этих анатомических отклонений в процессе онтогенеза формируется компрессия чревного ствола. На основании клинико-генеалогического исследования группа ученых под руководством Л.В. Поташова установила, что анатомический вариант строения, при котором возможно развитие данного синдрома, имеет врожденный характер и передается по аутосомно-доминантному типу наследования [4]. По мнению А.В. Покровского, при экстравазальной компрессии чревного ствола «постоянная травма артерии приводит к ее рубцовому стенозу», что обусловливает неуклонно прогрессирующее течение процесса. Механизм происхождения боли в животе схож с таковыми при стенокардии напряжения и связан с недостатком притока крови к активно функционирующим органам брюшной полости вследствие нарушения кровотока по чревному стволу [1].
При СКЧС имеются сложности как для диагностики, так и для лечения. Сложность заключается в том, что наличие экстравазальной компрессии, выявленной по данным инструментальных методов исследования, зачастую не соответствует клинической картине и жалобам пациентов. По данным литературы, у 10—24% населения в той или иной степени имеется сдавление чревного ствола срединной дугообразной связкой диафрагмы [5, 6]. У большинства этих людей нет никаких клинических проявлений этого состояния, так как вследствие длительного врожденного характера таких изменений кровообращение компенсировано за счет коллатерального кровотока. Лишь у 1% больных наблюдается клиническая симптоматика [5]. Причины, по которым у одних пациентов кровообращение в бассейне чревного ствола полностью компенсируется за счет коллатерального кровотока, а у других развивается ишемия, до конца не изучены. Возможно, у пациентов молодого возраста клиническая симптоматика проявляется вследствие завершения формирования мышечно-сухожильного каркаса диафрагмы, происходящего к 20—25 годам [7]. У пациентов пожилого возраста блок коллатерального кровотока с высокой долей вероятности может быть следствием атеросклеротического поражения в бассейне верхней брыжеечной артерии [1].
Чревный ствол, верхняя и нижняя брыжеечные артерии соединяются между собой врожденными коллатеральными анастомозами, образуя единый сосудистый путь кровотока, по которому в зависимости от этапа пищеварения и потребностей в кровоснабжении конкретного органа кровь может двигаться как в каудальном, так и в краниальном направлении [1, 8]. За счет этого обеднение кровотока при СКЧС зачастую достигает пика после приема пищи и провоцируется снижением кровотока и последующей ишемией [1]. При ишемии в первую очередь страдают ткани слизистой оболочки желудочно-кишечного тракта, что приводит к органическим и морфологическим изменениям органов в виде дистрофии, атрофии, эрозий и изъязвлений [9].
По мнению некоторых авторов, природа абдоминальных болей при СКЧС может иметь нейрогенный характер. Так, еще в 1963 г. P. Harjola [10] сообщил о нарушении проходимости чревного ствола, вызванном его сдавлением нейроганглионарной тканью чревного сплетения и сопровождающемся клинической картиной angina abdominalis. Сторонники этой теории считают, что механическое раздражение ткани чревного сплетения вследствие ее сдавления между чревным стволом и срединной дугообразной связкой диафрагмы, усиливающееся в процессе пищеварения за счет увеличения артериальной пульсации (так называемый «водяной молоток»), является причиной эпигастральной боли у пациентов [4]. Однако уверенной доказательной базы у этой теории нет. Также существует мнение, что ишемическая боль при этом заболевании связана с нейрогенным спазмом периферических артерий [1, 4].
Таким образом, патофизиологические аспекты данного заболевания до сих пор вызывают множество вопросов. В связи с этим и по техническим аспектам оперативного вмешательства у разных авторов имеются разногласия. Так, некоторые авторы считают необходимым иссечение нервных ганглиев в процессе декомпрессии чревного ствола. S. Thoolen и соавт. [11] отмечают, что в развитии клинических проявлений, свойственных синдрому Данбара, большую роль играет нейрогенный фактор. Авторы обращают внимание на то, что купирование проявлений СКЧС может быть достигнуто скорее иссечением чревных ганглиев, чем восстановлением кровотока по магистральному сосуду. До сих пор единодушия в этом вопросе не достигнуто. На данный момент нет четких представлений о том, в каком объеме необходимо удалять нервные ганглии и даже нужно ли их удалять вообще [4, 11].
Ключевым вопросом при наличии СКЧС является определение показаний к оперативному вмешательству. Выявление пациентов, у которых именно компрессия чревного ствола обусловливает клинические признаки заболевания — непростая задача. Так, для постановки диагноза необходимо наличие соответствующей клинической картины в сочетании с характерными изменениями по данным инструментальных методов исследования (УЗДС, КТ-ангиографии). Согласно руководству по лечению и диагностике заболеваний периферических сосудов Европейского общества кардиологов, первоначальным диагностическим тестом должна быть УЗДС брюшной аорты, чревного ствола и верхней брыжеечной артерии. Важнейшим методом диагностики СКЧС является КТ-ангиография. Катетерная рентгеноконтрастная ангиография применяется исключительно для эндоваскулярной ангиопластики и стентирования [12].
Симптоматика может быть разнообразной: хроническая абдоминальная боль, возникающая или усиливающаяся после приема пищи, в некоторых наблюдениях сопровождающаяся диспепсическими явлениями (тошнотой, рвотой, метеоризмом, диареей, потерей в массе тела), нейровегетативными расстройствами (сердцебиением, потоотделением), депрессивным астеноипохондрическим синдромом. Очень часто при экстравазальной компрессии чревного ствола клиническая симптоматика не связана с хронической абдоминальной ишемией, а обусловлена другими, ранее не диагностированными заболеваниями (хроническим панкреатитом, язвой, гастритом, опухолью желудочно-кишечного тракта и т. д.).
Важным этапом в дифференциальной диагностике СКЧС является исключение у пациентов, имеющих по данным инструментальных методов исследования экстравазальное сдавление чревного ствола, заболеваний психиатрического профиля. Так, в Орловском государственном медицинском университете в ходе предоперационной подготовки были обследованы 74 пациента с наличием СКЧС, из них у 47 (63,5±4,9%) диагностированы различные психические расстройства (астенодепрессивный, астенический, ипохондрический, тревожно-депрессивный синдромы, эпилепсия) [13].
Таким образом, на основании всего изложенного выше можно сформулировать клиническое определение СКЧС следующим образом: экстравазальная компрессия чревного ствола, подтвержденная инструментальными методами исследования, сопровождающаяся клинической симптоматикой абдоминальной ишемии, которую нельзя связать с каким-либо другим заболеванием.
Существуют ультразвуковые критерии экстравазальной компрессии чревного ствола: его углообразная деформация в краниальном направлении при исследовании в В-режиме с элайзинг-эффектом в режиме цветового допплеровского картирования, увеличение пиковой систолической скорости кровотока в чревном стволе в фазе глубокого выдоха не менее чем на 80% по сравнению с фазой глубокого вдоха, а также снижение пиковой систолической скорости кровотока, индексов периферического сопротивления и «удлинение акселерации» в селезеночной артерии [14, 15]. При артериальных стенозах, как правило, принято считать уменьшение просвета сосуда менее чем на 50% гемодинамически незначимым. Стеноз более 50% по диаметру расценивают как гемодинамически значимый [14]. Однако при повышении системного артериального давления, особенно пульсового, признаки локальной гемодинамической значимости поражения сосуда могут проявляться и при меньшей степени стеноза.
По мнению А.И. Канаева [16], компрессию чревного ствола можно считать гемодинамически значимой при степени сужения просвета сосуда более 50%, пиковой систолической скорости кровотока более 2 м/c и градиенте артериального давления в чревном стволе более 15 мм рт.ст. на максимальном выдохе. Для обнаружения СКЧС рекомендуется выполнять УЗДС на выдохе, вдохе, а также в вертикальном положении тела и при этом учитывать полученные результаты исследования как диагностически значимые в оценке стеноза и расстройств регионарной гемодинамики в чревном стволе [4].
Неоднозначен вопрос корреляции гемодинамической значимости экстравазальной компрессии чревного ствола по данным инструментальных методов исследования и клинических проявлений СКЧС. Нередко клиническая симптоматика при наличии гемодинамически значимой компрессии чревного ствола отсутствует, в то время как при гемодинамически незначимых изменениях кровотока может наблюдаться клиническая картина СКЧС.
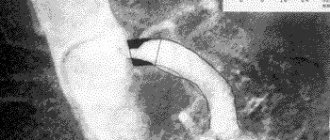
При выполнении КТ-ангиографии характерным для экстравазальной компрессии чревного ствола является симптом «рыболовного крючка», что позволяет провести дифференциальную диагностику с другой причиной стеноза чревного ствола — атеросклеротическим поражением [6].
Чрезвычайно важным остается и вопрос оценки результатов лечения пациентов. Существует мнение, что с учетом врожденного характера СКЧС оперировать таких пациентов нецелесообразно [17]. Однако имеющийся опыт лечения демонстрирует, что эффективность оперативного вмешательства у пациентов с клинической картиной СКЧС в сочетании с гемодинамически значимым стенозом достаточно высока. Так, по данным ретроспективного анализа, проведенного в одной из клиник Орла, из 261 пациента, перенесшего открытую декомпрессию чревного ствола, отличные результаты оперативного лечения наблюдаются у 2/3, хорошие (значительное улучшение) — еще у 1/5. Эти результаты оставались стабильными в течение длительного периода наблюдения [13]. В настоящее время в научном сообществе превалирует мнение, что показанием к хирургическому лечению таких пациентов является гемодинамически значимый стеноз чревного ствола по данным инструментальных методов исследования в сочетании с клинической картиной хронической абдоминальной ишемии [18].
В свою очередь в пользу хирургической тактики свидетельствует исследование группы ученых Католического университета г. Лилль под руководством E. Ducasse, в котором указано на то, что у 80% пациентов с компрессией чревного ствола обнаруживается аневризматическая трансформация артерий бассейна брюшного отдела аорты. При этом поражались преимущественно артерии системы панкреатодуоденальной аркады, желудочно-сальниковая артерия и чревный ствол; развитие осложнений, связанных с наличием аневризм, отмечалось в 3—18% наблюдений. Опасность заключается в том, что подобное состояние протекает бессимптомно вплоть до разрыва аневризмы с соответствующим риском летального исхода [19].
Многие годы при выявлении нарушений кровотока по чревному стволу методом выбора была коррекция этого состояния путем рассечения срединной дугообразной связки диафрагмы с использованием верхнесрединной лапаротомии или даже торакофренолюмботомии, что сопровождалось непростым течением послеоперационного периода из-за травматичности доступа. По мнению ряда авторов, проведение декомпрессии чревного ствола с использованием верхнесрединной лапаротомии является наиболее надежным и относительно мало травматичным методом [4]. Послеоперационная летальность при этом менее 1% [1]. Также открытый доступ позволяет провести тщательную ревизию органов брюшной полости и в случае необходимости выполнить симультанную операцию [20].
С развитием лапароскопической хирургии появились первые сообщения о лапароскопических вмешательствах при декомпрессии чревного ствола. Так, впервые о такой операции сообщили в 2000 г. S. Roayale и соавт. из Mount Sinai-New York University Medical Center [21]. Также имеется несколько подобных сообщений —A. Carbonell и соавт. [22] и L. Dordoni и соавт. [23], в которых отмечены отличные результаты в сроки от 3 до 7 мес после операций. J. Jimenez и соавт. [18] в своей работе собрали 7 клинических серий, в которые включен 121 пациент после выполнения лапароскопической декомпрессии чревного ствола, в том числе с клиническим улучшением у 116. Лапароскопический доступ представляется более предпочтительным по сравнению с открытым в связи с низкой частотой послеоперационных осложнений и быстротой восстановления, однако отмечается наличие высокого риска конверсии (9,1%) при серьезных технических сложностях, таких как кровотечение (7,4%) и пневмоторакс (2,5%) [18]. Несмотря на множество сообщений, описывающих в основном единичные наблюдения с положительными отзывами о результатах лапароскопической декомпрессии чревного ствола, на данный момент еще не накоплено большого опыта использования этой методики.
В России первая такая операция была проведена в 2005 г. в Институте хирургии им. А.В. Вишневского, к настоящему времени выполнено 40 лапароскопических декомпрессий чревного ствола.
N. Jaik и соавт. [24] описали первый опыт выполнения робот-ассистированной декомпрессии чревного ствола, с тех пор было опубликовано 9 работ. В результатах говорится об одном случае конверсии в открытый доступ из-за повреждения аорты. По данным S. Thoolen и соавт. [11], преимуществами применения роботических технологий при синдроме сдавления чревного ствола являются повышение «ловкости» оперирования и наличие трехмерного изображения, что, как представляется авторам, существенно улучшает условия работы в области чревного ствола, особенно при имеющихся фиброзных сращениях и трудно различимых структурах, находящихся на передней стенке магистральных сосудов.
После накопления в течение 20 лет ошибок и неудач при изолированных эндоваскулярных вмешательствах в 1980 г. впервые были опубликованы результаты успешного применения гибридного доступа с использованием хирургического и эндоваскулярного методов для лечения пациентов с синдромом хронической абдоминальной ишемии [25]. По данным L. Reiley и соавт. [26], пациенты, которым выполнена только декомпрессия чревного ствола, чаще были склонны к рецидиву боли (44%), чем больные, которым дополнительно проводили эндоваскулярный этап реваскуляризации методом стентирования.
Баллонная дилатация и стентирование в качестве единственного метода лечения не рекомендуются при СКЧС, так как срединная дугообразная связка, являясь чрезвычайно плотной анатомической структурой, препятствует адекватной дилатации чревного ствола [20]. Согласно данным литературы, изолированное использование эндоваскулярных методов лечения при СКЧС даже с применением стентирования сопряжено с высокой частотой неудач [27]. Использование эндоваскулярных стентов с целью дилатации чревного ствола, по мнению ряда хирургов, не оправдано, так как в некоторых наблюдениях стенты ломаются при дыхании. Несмотря на это, в некоторых ситуациях эндоваскулярные вмешательства могут быть очень эффективны, например при аневризме висцеральных артерий. Это осложнение чаще развивается в системе гастродуоденальной аркады («малой дуги Риолана»), также может появляться в чревном стволе в виде постстенотической дилатации и в желудочно-сальниковой артерии, причиной ее развития является повышение коллатерального кровотока на фоне СКЧС [27].
Одним из обсуждаемых является вопрос о необходимости выполнения интраоперационного ультразвукового контроля. Так, ряд хирургов не выполняют этот этап операции в связи с тем, что не имеют в своем арсенале соответствующей аппаратуры и не владеют данной методикой. Хирурги, владеющие данной методикой, считают интраоперационное УЗИ необходимым для обеспечения благоприятного технического и клинического результата декомпрессии [1, 21]. Интраоперационный ультразвуковой контроль позволяет быстрее выйти на чревный ствол, что особенно актуально в ситуации анатомической аномалии расположения сосудов целикомезентериального бассейна, встречающейся в 45% наблюдений [28, 29], а также при выраженном абдоминальном ожирении. Для определения анатомии оперируемой области можно ориентироваться по данным КТ-ангиографии, которую необходимо выполнять всем пациентам в предоперационном периоде. Однако быстрее всего определить сосудистую анатомию и устье чревного ствола можно именно с помощью интраоперационного УЗИ. Полагают, что интраабдоминальное УЗИ чревного ствола и верхней брыжеечной артерии во время операции менее подвержено ошибкам из-за технических трудностей, позволяет измерить более точно диаметр сосуда, скорость кровотока в нем и оценить адекватность декомпрессии чревного ствола [30]. Оценка степени восстановления просвета чревного ствола в процессе декомпресии во время операции позволяет дать убедительный прогноз. Известно, что окончательное восстановление просвета чревного ствола после декомпрессии происходит постепенно в послеоперационном периоде. Полного восстановления просвета, как правило, не происходит вообще, что связано с врожденным характером аномалии и изменением стенки самого чревного ствола в ходе формирования организма на протяжении всей жизни человека. Учитывая, что формирование каркаса диафрагмы и развитие сосудов у детей еще не завершены, мы можем ожидать более убедительные результаты декомпрессии чревного ствола именно у пациентов детского возраста.
Таким образом, на данный момент каждый пациент с синдромом компрессии чревного ствола остается сложным для клинициста. Важнейшим вопросом в обследовании и лечении таких пациентов остается определение показаний к оперативному вмешательству. До сих пор хирургическая декомпрессия чревного ствола вызывает множество тактических вопросов, хотя с развитием этой методики на многие из них уже найден ответ. На сегодняшний день очевидно, что оптимальным доступом для выполнения декомпрессии чревного ствола является лапароскопический.
Авторы заявляют об отсутствии конфликта интересов.
Как проводится стентирование чревного ствола и брыжеечной артерии
Перед операцией внутривенно или внутримышечно может быть введен успокоительный препарат, после чего пациент сопровождается в операционную, где готовят к хирургическому доступу его бедро или локтевой сгиб: обрабатывают кожу септиком, закрывают стерильными простынями операционное поле.
Хирург обезболивает место прокола, пунктирует артерию и устанавливает специальную трубку. Через трубку (интродюссер) врач вводит в аорту проводник, а по нему – катетер для контрастного исследования артерий. Заполняя кровеносное русло, рентгеноконтрастное вещество обозначает места сужения. Прямо во время исследования врач может завести проводник ниже места сужения, доставить туда баллон со стентом и раскрыть его, чтобы увеличить просвет сосуда. Стент поддерживает сосудистую стенку, а артерия начинает пропускать кровоток в нужной мере.
После вмешательства обязательно проведение контрольной ангиографии для исключения осложнений. Из сосуда извлекают катетер, интродюссер, место доступа подвергается компрессии для остановки кровотечения. Для ликвидации разреза используют также специальные сшивающие устройства.
Материал и методы
Начиная с 2005 г. в Институте хирургии им. А.В. Вишневского нами выполнено 21 лапароскопическое вмешательство по поводу экстравазальной компрессии чревного ствола. Результаты лечения прослежены в отдаленном периоде. Среди пациентов было 8 женщин и 13 мужчин. Возраст пациентов варьировал от 28 до 72 лет и в среднем составил 44 года. Продолжительность заболевания до момента постановки диагноза и оперативного лечения варьировала от 3 до 20 лет и в среднем составила 6 лет. Результаты оперативного лечения в отдаленном послеоперационном периоде были исследованы у 17 из 21 пациента. Характерная клиническая картина заболевания в виде выраженных абдоминальных болей в эпигастральной области, нейровегетативных расстройств, таких как приступы тахикардии, панические атаки, в той или иной степени отмечалась у всех пациентов. Диспептические явления в виде тошноты, рвоты, метеоризма, потери веса отмечались у 9 пациентов. Астено-ипохондрический синдром присутствовал у 6 пациентов. Следует отметить, что длительное течение любого заболевания, сопровождающегося хроническим болевым синдромом, может приводить к психическим и поведенческим расстройствам. Предшествующая постановке верифицированного диагноза длительная история заболевания сопровождается диагностикой у пациентов синдрома раздраженного кишечника, функциональных абдоминальных болей, рефрактерного гастропареза, аггравации на фоне лекарственной зависимости, соматоформных расстройств вегетативной нервной системы. В основе появления психогенных факторов лежат длительные страдания больного, «беспомощность» врачей и современной «диагностической машины». Результатом этого является отказ больного от еды, дабы исключить развитие вероятных болей в животе, и снижение качества жизни. Таким образом, при решении вопроса о проведении оперативного пособия по декомпрессии чревного ствола необходимо привлекать врача-психиатра как на дооперационном этапе, так и после операции, чтобы исключить вероятность развития ложного рецидива заболевания.
Во всех наблюдениях диагноз был установлен по данным ультразвукового дуплексного сканирования с измерением скорости кровотока при респираторных пробах, а также подтвержден данными КТ-ангиографии (рис. 1, 2,
Рис. 1. Ультразвуковое дуплексное сканирование. Уменьшение пиковой систолической скорости кровотока на вдохе до 150 см/с.
Рис. 2. Ультразвуковое дуплексное сканирование. Увеличение пиковой систолической скорости кровотока до 350 см/с на выдохе. рис. 3, 4).
Рис. 4. Экстравазальная компрессия чревного ствола (КТ-ангиография, 3D-реконструкция).
Рис. 3. КТ-ангиография. Экстравазальная компрессия чревного ствола. а — в сагитальной плоскости; б — в аксиальной плоскости.
Ультразвуковыми критериями экстравазальной компрессии чревного ствола являются: углообразная деформация чревного ствола в краниальном направлении в В-режиме, ускорение пиковой систолической скорости кровотока в чревном стволе в фазе глубокого выдоха более чем на 80% по сравнению с фазой глубокого вдоха, а также снижение пиковой систолической скорости кровотока. Для артериальных стенозов принято считать, что стенозы, редуцирующие просвет сосуда более чем на 50% по диаметру, являются, как правило, гемодинамически значимыми [6]. По мнению некоторых авторов, компрессию чревного ствола можно считать гемодинамически значимой при степени сужения просвета сосуда более 50%, при пиковой систолической скорости кровотока более 2 м/с и градиенте артериального давления в чревном стволе более 15 мм рт.ст. на максимальном вдохе [7].
У всех пациентов, по данным инструментальных методов исследования, показатели кровотока по чревному стволу укладывались в диапазон гемодинамической значимости. По данным дуплексного сканирования, в предоперационном периоде средняя степень сужения чревного ствола составляла 72,5%. Пиковая систолическая скорость кровотока в чревном стволе (Vs) составляла 312 см/с, а ускорение пиковой систолической скорости кровотока в фазе глубокого выдоха по сравнению с фазой глубокого вдоха (Vs выд — Vs вдох) составляло 144,5 см/с. Также перед операцией все пациенты были комплексно обследованы в институте хирургии им. А.В. Вишневского в объеме УЗИ-органов брюшной полости, эзофагогастродуоденоскопии, консультации терапевта и психиатра. Таким образом, связь клинической симптоматики абдоминальной ишемии с другими заболеваниями была исключена.
Всем пациентам выполнена лапароскопическая декомпрессия чревного ствола.
Методика операции
Пациенты располагались на столе с разведенными ногами в положении Фовлера. Устанавливались 5 троакаров (5 и 10 мм): 10 мм (оптический) — на середине расстояния между мечевидным отростком и пупком по срединной линии, 10 мм — в правом и левом подреберьях по среднеключичным линиям для печеночного ретрактора и рабочего инструмента соответственно, 5 мм — под мечевидным отростком по срединной линии и 5 мм — по передней подмышечной линии слева для зажима и рабочего инструмента соответственно.
Первым этапом всем пациентам выполнялась топическая диагностика чревного ствола с использованием лапароскопического УЗИ, с помощью которого также определяли протяженность, степень сужения и деформацию чревного ствола, характерное постстенотическое расширение.
Интраоперационная ультразвуковая навигация позволяет быстрее найти и выделить чревный ствол, что особенно актуально в ситуации анатомической аномалии расположения сосудов целико-мезентериального бассейна, что встречается в 45% случаев, а также в условиях выраженного абдоминального ожирения.
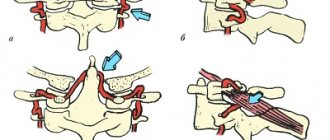
Использовались два типа доступа к срединной дугообразной связке диафрагмы: антеградный или ретроградный, при этом решение о выборе доступа принималось интраоперационно в зависимости от конкретной анатомической ситуации и расположения анатомических структур относительно друг друга. Антеградная диссекция заключалась в рассечении печеночно-желудочной связки в аваскулярной зоне с целью создания доступа к правой ножке диафрагмы, от которой диссекция продолжалась в каудальном направлении. Для идентификации мышечных волокон перекреста ножек диафрагмы проводилась диссекция в ретроэзофагеальном пространстве. Мышечные волокна перекреста диафрагмальных ножек рассекались крючком с использованием монополярной коагуляции для обнажения передней поверхности аорты. Важным моментом при использовании как антеградного, так и ретроградного доступа являлось протяженное рассечение мышечного перекреста диафрагмальных ножек над аортой до 3—4 см с целью профилактики возникновения рестеноза в послеоперационном периоде вследствие рубцевания рассеченных структур.
С целью лучшей визуализации срединной дугообразной связки производилась тракция желудка книзу и влево атравматичным зажимом. Пересечение волокон связки выполнялось крючком с использованием монополярной коагуляции. Оттягивание волокон связки от сосудистой стенки с помощью крючка позволяло избежать электротравмы аорты и чревного ствола. Особое значение уделялось полноценной диссекции и рассечению всех лимфатических и нервных волокон, а также нервных ганглиев, окружающих устье чревного ствола для достижения максимального эффекта от выполненной декомпрессии. Процедура считалась оконченной, когда чревный ствол был освобожден от любых внешних стенозирующих структур вплоть до его устья, что обязательно подтверждалось данными интраоперационного лапароскопического УЗИ.
В большинстве случаев проводилась ретроградная диссекция, которая отличалась от предыдущего доступа тем, что доступ к дугообразной связке осуществлялся с помощью диссекции основных стволов ветвления чревного ствола в ретроградном направлении до устья чревного ствола, при этом чаще всего идентифицировали и выделяли левую желудочную или общую печеночную артерию. Деликатная тракция выделенных стволов с использованием сосудистых держалок позволяла получить адекватную экспозицию устья чревного ствола и последующую декомпрессию.