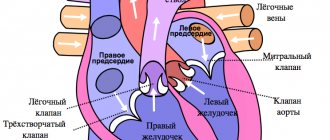
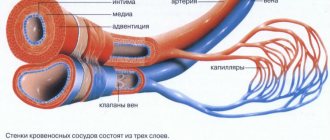
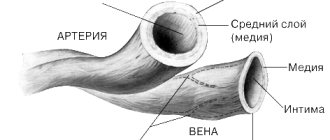
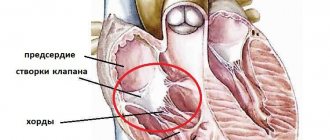
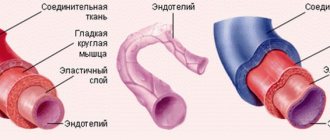
Вены, по которым насыщенная кислородом кровь от легких к сердцу.
| Легочные вены | |
Передний (фронтальный) вид открытого сердца. Белые стрелки указывают на нормальный кровоток. | |
| Схема альвеол с поперечным сечением и внешним видом. | |
| Подробности | |
| Предшественник | артериальный ствол |
| Система | Сердечно-сосудистая система |
| Сливает из | легкие |
| Сливает в | левое предсердие |
| Артерия | легочная артерия |
| Идентификаторы | |
| латинский | легочные вены |
| MeSH | D011667 |
| TA98 | А12.3.02.001 |
| TA2 | 4107 |
| FMA | 66643 |
| Анатомическая терминология [ редактировать в Викиданных ] | |
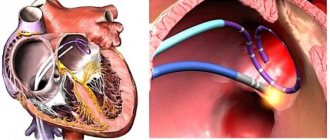
В легочных венах
являются венами , что передача окисленной крови от легких к сердцу . Самые большие легочные вены — это четыре
основные легочные вены
, по две от каждого легкого, которые впадают в левое предсердие сердца. Легочные вены являются частью малого круга кровообращения .
Структура [ править ]
Две главные легочные вены
выходят из каждого ворот легкого , принимая кровь из трех или четырех бронхиальных вен каждая и стекая в левое предсердие . Нижняя и верхняя главные вены дренируют каждое легкое, поэтому всего имеется четыре основных вены. [1]
У корня легкого правая верхняя легочная вена лежит впереди и немного ниже легочной артерии; нижняя расположена в самой нижней части ворот легкого. Позади легочной артерии находится бронх . [2] Правые главные легочные вены (содержащие насыщенную кислородом кровь) проходят позади правого предсердия и верхней полой вены ; слева перед нисходящей грудной аортой .
Вариант [ править ]
Иногда три долевые вены на правой стороне остаются отдельными, и нередко две левые долевые вены заканчиваются общим отверстием в левое предсердие. Следовательно, количество легочных вен, открывающихся в левое предсердие, может варьироваться от трех до пяти у здорового населения .
Две левые долевые вены могут быть объединены в одну легочную вену примерно у 25% людей; две правые вены могут быть объединены примерно на 3%. [2]
Медицинские интернет-конференции
Длина вен 2-го порядка (табл. 1) справа колеблется от 9,5 мм у вены нижней зоны до 14,6 мм у вены задней зоны, слева – от 10,8 мм у вены задней зоны до 14,2 мм у вены передней зоны. Статистически достоверно превышение длины правой вены задней зоны по сравнению с левой. Наименее изменчивой по длине среди вен 2-го порядка как справа, так слева является вена задней зоны, наиболее изменчивой вена верхней зоны. Левые вены менее изменчивы, чем правые.
Наименьший внутренний диаметр среди вен 2-го порядка справа (табл. 2) имеет вена задней зоны (2,5 мм), наибольший – вена верхней зоны (5,1 мм), слева минимальный внутренний диаметр – у вены передней зоны и вены задней зоны (3,2 мм), максимальный – у вены верхней зоны (5,6 мм). Диаметр всех левых вен 2-го порядка, за исключением вены передней зоны, превышает диаметр соответствующих правых вен. Статистически достоверно превышение диаметра левой вены задней зоны по сравнению с правой.
В правом легком наиболее вариабельной является вена задней зоны, наименее вариабельной – вена нижней зоны. Слева и справа самая изменчивая – вена передней зоны, менее изменчивая – вена нижней зоны.
Площадь поперечного сечения просвета вен 2-го порядка (табл. 3) колеблется справа от 5,7 мм2 у вены задней зоны до 22,4 мм2 у вены верхней зоны, слева – от 8,8 мм2 у вены передней зоны до 28,0 мм2 у вены верхней зоны.
Статистически достоверно превышение площади поперечного сечения левой зоны задней вены по сравнению с правой. Как справа, так и слева наименее изменчивой по площади поперечного сечения просвета является вена нижней зоны, наиболее вариабельна справа и слева – вена передней зоны.
Относительное поперечное сечение просвета вен 2-го порядка составляет справа от 11,4% у вены задней зоны до 38,2% у вены передней зоны, слева – от 13,7% у вены задней зоны до 40,8% у вены верхней зоны. Суммарное поперечное сечение просвета вен 2-го порядка равно справа 56,4 мм2, слева – 63,8 мм2.
Оценка диссимметрии параметров легочных вен второго порядка производилась на основании показателей диссимметрии. Эти показатели вычислялись по способу, предложенным В.С. Сперанским (1963), путем нахождения отношения величины признака (длина, диаметр сосуда) справа к величине этого же признака слева. Определялись показатели диссимметрии, формирования легочных вен второго порядка путем отношения числа диссимметричных признаков к общему числу изученных признаков. Определялась процентная частота, симметричных и несимметричных форм ветвления вен второго порядка. изучена (длина, диаметр, ППС) справа к величине этого изучена слева на каждом препарате, после чего определялись средняя арифметическая величина показателя диссимметрии. Данные о процентном соотношении симметричных, несимметричных, правосторонних, левосторонних форм длины, диаметра, площади поперечного сечения просвета легочных вен 2-го порядка представлены в таблицах 4 и 5. Симметричное образование вены верхней зоны наблюдалось на 20 препаратах из 43, диссимметричное – на 23 препаратах; слияние вены передней зоны было симметричным в 37 случаях из 41, несимметричным – в 4-х случаях; вена задней зоны формировалась симметрично на всех 45 препаратах; вена нижней зоны имела симметричное слияние на 23 препаратах из 45, диссимметричное – 22 препарата.
Показатели диссимметрии образования вен второго порядка у людей зрелого возраста 0,33. Отмечена более высокая частота диссимметричных вариантов образования вен верхней и нижней зон и преобладание симметричных по числу корней вариантов образования вен передней, задней зон.
Ссылки [ править ]
Эта статья включает текст, находящийся в открытом доступе, со страницы 642 20-го издания
«Анатомии Грея»
(1918 г.).
- Дрейк, Ричард Л .; Фогл, Уэйн; Тиббитс, Адам WM Митчелл; иллюстрации Ричарда; Ричардсон, Пол (2005). Анатомия Грея для студентов
(Pbk. Ed.). Филадельфия: Эльзевьер / Черчилль Ливингстон. ISBN 978-0-443-06612-2. - ^ a b Скандалакис, главный редактор Джон Э. (2004). «Глава 7. Перикард, сердце и большие сосуды грудной клетки». Хирургическая анатомия Скандалакиса: эмбриологические и анатомические основы современной хирургии
. Афины, Греция: PMP. стр. раздел «Легочные вены». ISBN 9603990744.CS1 maint: дополнительный текст: список авторов ( ссылка )
В настоящее время выявлены этиологические факторы многих генетических синдромов и семейных врожденных пороков сердца (ВПС), но генетические основы большинства «спорадических» ВПС до сих пор остаются неизвестными. Ведущие причины развития ВПС представлены на рис. 1.
Рис. 1. Этиология ВПС [3].
Определены многие гены, связанные с развитием сердца. Установлено, что ряд отдельных ВПС и генетических синдромов ассоциируется с мутациями в различных единичных генах [1].
Многие гены, кодируемые посредством транскрипционных факторов или сигнальных молекул, в настоящее время ассоциированы с ВПС у человека. Транскрипционные факторы являются белками, которые содержат ДНК-связывающие домены и играют фундаментальную регулирующую роль, контролируя экспрессию генов. Сигнальными молекулами являются белки, которые позволяют клеткам реагировать на их окружение и таким образом участвуют в регуляции многих важных биологических функций.
Фенотипы ВПС варьируют от небольших септальных дефектов, которые могут остаться незамеченными на протяжении всей жизни, до гемодинамически значимых аномалий, которые проявляются клинической симптоматикой. К ним относятся аномалии в диапазоне от персистенции фетального кровообращения (например, открытый артериальный проток) до сложных пороков, таких как транспозиция магистральных сосудов, единый желудочек, синдром гипоплазии левых отделов сердца и другие варианты гетеротаксии. В соответствии с патогенетической классификацией врожденных пороков сердечно-сосудистой системы существуют 6 причинных механизмов: аномалии миграции эктомезенхимальной ткани (аномалии дуги аорты), дефекты внутрисердечного кровотока (септальные дефекты и обструктивные пороки левых или правых отделов сердца), аномалии, связанные с гибелью клеток (септальные дефекты и аномалии клапанов), аномалии экстрацеллюлярного матрикса (дефекты атриовентрикулярного канала), аномальный рост (частичная или полная мальформация легочного венозного возврата и трехпредсердное сердце) и неправильная позиция и перекручивание, что включает нарушение лево-правой асимметрии [2].
Например, homeobox — содержащие белки, кодируемые генами группы NKX-2,5, играют важную роль в регулировании тканеспецифической экспрессии генов, необходимых для дифференцировки тканей, а также для определения временных и пространственных моделей развития. Исследования показали, что в последнее время несиндромные ВПС могут быть результатом дефекта одного гена. Исходя из этого, можно сделать вывод, что предрасположенность к ВПС является результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий (см. таблицу)
Генетические причины врожденных пороков сердца [3] [3].
Частичный аномальный дренаж легочных вен (ЧАДЛВ) — это врожденный порок сердца, характеризующийся тем, что одна или более (но не все) легочные вены впадают в правое предсердие, либо в полые вены, либо в их основные ветви [4].
Существуют четыре анатомические формы ЧАДЛВ, в основу которых положена локализация места впадения легочных вен: супракардиальный, интракардиальный, инфракардиальный и смешанный. Аномальный дренаж правых легочных вен встречается в 2 раза чаще, чем левых. Правые легочные вены могут дренироваться в верхнюю полую вену, что часто сочетается с дефектом венозного синуса (рис. 2, а),
Рис. 2. Схема вариантов ЧАДЛВ. а — дренирование правых легочных вен в ВПВ с дефектом венозного синуса; б — в НПВ; в — впадение левых легочных вен в безымянную вену; г — коронарный синус. a — right pulmonary veins drainage into SVC with sinus venosus ASD; b —into IVC; c — connection of left pulmonary veins with innominate vein; d — coronary sinus. или впадать в нижнюю полую вену (см. рис. 2, б) с интактной предсердной перегородкой и бронхолегочной секвестрацией. Левые легочные вены чаще дренируются в безымянную вену (см. рис. 2, в) или в коронарный синус (см. рис. 2, г). Дефект межпредсердной перегородки обычно сопровождается аномальным дренажем левых легочных вен [5].
Впервые порок был описан Winslow в 1739 г. При патологоанатомическом исследовании был обнаружен аномальный дренаж вены верхней доли правого легкого в верхнюю полую вену. Наиболее полно анатомию и клинику этого порока изучил Brody (1942 г.). Систематизировали анатомические варианты (типы) порока R. Darling и соавт. [4] в 1957 г.
Первая успешная операция коррекции частичного аномального дренажа с использованием закрытого метода «атриосептопексии» была выполнена W. Neptune в 1953 г. В 1956 г. J. Kirklin и соавт. [4] сообщили о 5 успешных операциях коррекции порока по полуоткрытому методу Гросса.
Конкретные причины возникновения ЧАДЛВ неизвестны. Они могут быть связаны с хромосомными аномалиями, выявляемыми при кариотипировании более чем у 1/3 больных с ВПС. Чаще всего это трисомия по 21, 18 и 13-й парам хромосом. Помимо болезни Дауна, существует около 20 наследственных синдромов, в большинстве случаев сопровождающихся различными ВПС. В общей сложности синдромальная патология обнаруживается у 6—36% больных. Моногенная природа ВПС доказана в 8% наблюдений; около 90% наследуются многофакторно, т. е. являются результатом сочетания генетической предрасположенности и воздействия факторов окружающей среды. Последние выступают в качестве провоцирующих, выявляющих наследственную предрасположенность при превышении порога их совместного действия [6, 7].
По данным различных исследований [8—10], частота встречаемости ЧАДЛВ среди всех врожденных пороков сердца находится в пределах от 0,7 до 9,4%. Из всех случаев аномального дренажа легочных вен около 2/3 из них приходится на ЧАДЛВ. Чаще в процесс вовлечены правые легочные вены. Верхняя полая вена является наиболее частым местом впадения аномальных правых легочных вен (35—57% от всех случаев ЧАДЛВ). Реже легочные вены впадают в непарную вену, крайне редкий вариант — впадение одной или всех легочных вен в безымянную или добавочную левую вену.
Второе место по частоте занимает интракардиальный тип правостороннего ЧАДЛВ. Аномальный дренаж левых легочных вен встречается крайне редко, при этом легочные вены впадают в коронарный синус или непосредственно в правое предсердие.
При инфракардиальном типе порока вены (чаще средней и нижней долей правого легкого) впадают в нижнюю полую вену (НПВ) сразу под диафрагмой [11].
ЧАДЛВ может также входить в состав более сложных ВПС. Около 20% пациентов с ЧАДЛВ имеют сопутствующие пороки сердца, например, тетраду Фалло, дефект межпредсердной (ДМПП) или межжелудочковой перегородки (ДМЖП), единый (общий) желудочек, общее предсердие, транспозицию магистральных сосудов и синдром гипоплазии левых отделов сердца [12]. Однако чаще всего ЧАДЛВ встречается в комплексе с ДМПП (более 50% случаев) [9].
Между 4-й и 5-й неделями эмбриогенеза в дорсальном мезокарде начинают формироваться легочные вены, исходящие из среднеглоточного эндотелиального стебля [13]. Формирование ЧАДЛВ происходит в результате атрезии крупной ветви общей легочной вены. Как только правая или левая часть общей легочной вены становится атрезированной, то персистенция легочно-системной венозной связи на этой стороне создает этиологическую основу для ЧАДЛВ [12].
Факторами риска развития ЧАДЛВ являются возраст матери выше 40 лет, токсикоз и угроза прерывания беременности в I триместре, наличие мертворождения в анамнезе, наличие детей с врожденными пороками развития у родителей и ближайших родственников [14].
Следует отметить, что у ближайших родственников пациента с аномалиями сердца частота ВПС в 2—5 раз выше [14]. Однако в доступной нам литературе семейной формы ЧАДЛВ описано не было.
Гемодинамика и клинические признаки при ЧАДЛВ соответствуют таковым при ДМПП. При рентгенологическом обследовании можно выявить расширение тени верхней полой вены (ВПВ) и корня правого легкого при аномальном дренаже в ВПВ. При впадении легочных вен в ВПВ в переднезадней проекции на фоне нижней доли правого легкого выявляется тень аномально идущего сосуда в виде «турецкой сабли» (С. Dolter, 1949). Увеличение сосудистого пучка влево позволяет заподозрить аномальное впадение левых легочных вен в левую безымянную вену [15].
В настоящее время эхокардиография (ЭхоКГ) является основным диагностическим методом исследования у пациентов с ЧАДЛВ, однако только компьютерная томография (КТ) с внутривенным контрастированием позволяет установить окончательный диагноз, уточнить анатомию врожденного порока и определить дальнейшую хирургическую тактику [16, 17].
Существует несколько описанных техник коррекции частичного правого аномального дренажа легочных вен: простая туннелизация (переключение легочных вен в левое предсердие заплатой), туннелизация с расширением ВПВ заплаткой, туннелизация с иссечением ВПВ и ее перемещением в правое предсердие (как правило, в ушко предсердия) [18].
Различий в результатах трех техник нет. Выбор техники оперативного вмешательства зависит от типа аномального дренажа и клиники порока [18].
Представляем клиническое наблюдение пациентки А
., 18 лет, поступившей в кардиохирургическое отделение с диагнозом: ВПС, ДМПП. Частичный аномальный дренаж правых верхних легочных вен в верхнюю полую вену. Легочная гипертензия I ст. Недостаточность кровообращения IIa степени, II функциональный класс.
На момент осмотра пациентка предъявляла жалобы на одышку и слабость при умеренных физических нагрузках. Из анамнеза известно, что диагноз ДМПП установлен в ноябре 2021 г. в возрасте 17 лет по данным ЭхоКГ. В январе 2021 г. выполнена мультиспиральная КТ (СКТ) сердца с в/в контрастированием, выявлены вторичный ДМПП без верхнего края, частичный аномальный дренаж правых легочных вен в ВПВ, расширение правых камер сердца.
По данным СКТ, три вены от верхней, средней и частично нижней правых легочных вен единым коллектором (диаметром 17 и 11 мм) от средней доли впадают в нижнюю треть ВПВ (рис. 3, 4).
Рис. 3. Пациентка А., 18 лет. СКТ с в/в контрастированием. 1 — ДМПП. CT-scan. 1 — atrial septal defect.
Рис. 4. Пациентка А., 18 лет. СКТ. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). CT-scan. Partial anomalous pulmonary venous return into SVC (arrow). Расстояние от верхнего края коллектора до уровня впадения ВПВ в правое предсердие составило 17 мм. Также вена от средней доли правого легкого диаметром 5,5 мм впадала в зону ДМПП. Определялся ДМПП без верхнего края размером 25×18 мм. Правая нижняя легочная вена, а также левые легочные вены впадают в левое предсердие.
Состояние пациентки при осмотре средней степени тяжести. АД 110/70 мм рт.ст., ЧСС 70 уд/мин. Тоны сердца ясные, ритмичные. Во втором межреберье слева выслушивается систолический шум. На ЭКГ отмечалась атриовентрикулярная блокада 1-й степени (интервал PQ 0,22 с), а также неполная блокада правой ножки пучка Гиса.
По данным ЭхоКГ, отмечались увеличение правых отделов сердца, дискинезия межжелудочковой перегородки, легочная гипертензия до 40 мм рт.ст. В области верхней трети МПП определялся сброс слева направо диаметром 12—13 мм.
Поступившая в наше отделение пациентка была оперирована. Интраоперационно: сердце увеличено в размерах за счет правых отделов. Экстраперикардиально визуализирован коллектор из трех легочных вен от верхней и средней долей правого легкого диаметром 4, 6 и 7 мм (рис. 5),
Рис. 5. Интраоперационное фото. Коллектор верхней, средней и частично нижней правых легочных вен, впадающий в ВПВ (указан стрелкой). Partial anomalous pulmonary venous return into SVC (arrow). впадающий в ВПВ на расстоянии 17 мм от ее устья, высота коллектора 14 мм. Вена от нижней доли правого легкого впадает в левое предсердие. Левые легочные вены также впадают в левое предсердие. При ревизии МПП отмечались дефект без верхнего края 2,5×1,8 см и открытое овальное окно. Нижний край дефекта соединен с открытым овальным окном с образованием ДМПП 3,5×2 см (рис. 6).
Рис. 6. Интраоперационное фото. 1 — ДМПП без верхнего края; 2 — открытое овальное окно. 1 — secundum atrial septal defect; 2 — primum atrial septal defect.
Была выполнена пластика дефекта туннелевидной заплатой из ксеноперикарда (рис. 7).
Рис. 7. Туннелевидная заплата из ксеноперикарда на ДМПП с перемещением устьев правых легочных вен в ЛП. МПП герметична. IAS is sealed.
Послеоперационный период протекал без особенностей и осложнений. Пациентка была выписана на 8-е сутки после операции в удовлетворительном состоянии. При выписке на ЭКГ нижнепредсердный, правильный ритм с частотой 75 уд/мин, а также неполная блокада правой ножки пучка Гиса.
Из анамнеза известно, что у отца пациентки в возрасте 15 лет также были выявлены ЧАДЛВ и ДМПП. Он был оперирован, и интраоперационно обнаружено аномальное впадение верхней правой легочной вены в устье ВПВ. Пациенту была выполнена пластика ДМПП с перемещением легочной вены от верхней доли правого легкого в левое предсердие.
Кроме того, двоюродная сестра пациентки была прооперирована в возрасте 8 мес по поводу ВПС. Были выявлены центральный дефект межпредсердной перегородки диаметром 15 мм и аномальный дренаж верхней правой легочной вены в правое предсердие, дефект закрыт заплатой из ксеноперикарда с перемещением устья легочной вены в левое предсердие.
В нашем центре им было выполнено МРТ сердца для визуализации анатомического строения и контроля отдаленных результатов операционного лечения пациентов (рис. 8),
Рис. 8. Пациент А. (отец пациентки). МРТ сердца. Верхние легочные вены, впадающие в левое предсердие у устья ВПВ (указаны стрелкой). MRI. Partial anomalous pulmonary venous return (arrow). по результатам которой у отца пациентки визуализирован коллектор правых легочных вен, впадающий в левое предсердие. Данных за реканализацию ДМПП, другие дополнительные патологические сбросы или обструкцию кровотока по легочным венам не выявлено в обоих случаях. Особенностью этих операций является наличие нижнепредсердного ритма с адекватной частотой, что связано с наложением швов в проекции синусового узла.
Предрасположенность к ВПС обусловливается результатом одиночных нуклеотидных полиморфизмов или мутаций ключевых генов, которые при взаимодействии с факторами окружающей среды нарушают нормальный морфогенез сердца, что приводит к развитию врожденных сердечных аномалий. Конкретные причины возникновения ЧАДЛВ неизвестны. Отклонения в эмбриогенезе и наличие ВПС у ближайших родственников увеличивают вероятность возникновения аномалии в развитии сердца. В приведенном выше клиническом наблюдении отмечено наличие ЧАДЛВ у отца пациентки и у двоюродной сестры. ЧАДЛВ чаще встречается в комбинации с ДМПП и зачастую представлен одной или несколькими аномально впадающими правыми легочными венами. По данным отдаленных результатов, оперативное вмешательство в виде туннелизации (перемещения устьев легочных вен в левое предсердие заплатой) является надежным и эффективным методом лечения ЧАДЛВ. В доступной литературе мы не встретили описания семейной формы ЧАДЛВ.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Иванов А.С.
— д.м.н., проф.; https://orcid.org/0000-0001-9645-7192;
Гламазда С.В.
— к.м.н.; https://orcid.org/0000-0002-7623-2954;
Луговский М.К.
— к.м.н.; https://orcid.org/0000-0001-6461-7008, e-mail;
Лебедева А.В.
— к.м.н.; https://orcid.org/0000-0001-7000-6254;
Говорова Т.Н.
— ординатор кардиохирургического отделения; https://orcid.org/0000-0001-6537-7173;
Сацюк О.В.
— сердечно-сосудистый хирург; https://orcid.org/0000-0001-8797-3283.
Иванов А.С., Гламазда С.В., Луговский М.К., Лебедева А.В., Абрамова Н.Н., Говорова Т.Н., Сацюк О.В. Семейная форма частичного аномального дренажа легочных вен. Кардиология и сердечно-сосудистая хирурги
я. 2019;12(1):53-59. https://doi.org/10.17116/kardio20191201153