В Инновационном сосудистом центре владеют всеми необходимыми технологиями для лечения острой и хронической окклюзии нижней полой вены. Наши специалисты имеют успешный опыт решения этой сложной проблемы.
Острый тромбоз нижней полой вены требует лечения в условиях специализированного стационара сосудистой хирургии. Задачей лечения является восстановление проходимости НПВ. Эта задача успешно решается с помощью методов эндоваскулярной хирургии. Существуют современные тромболитические препараты и эндоваскулярные зонды для удаления тромботических масс.
Причины СВПВ
Основная причина синдрома верхней полой вены – обструкция, в основе которой лежат такие патологические процессы, как:
- прорастание раковой опухолью стенки вены;
- сдавливание вены извне;
- тромбоз бесклапанного сосуда.
В 90% случаев причина обструкции заключается в наличии злокачественного процесса в организме. При этом на долю рака легкого приходится 85% опухолей (плоскоклеточный или мелкоклеточный рак). В более редких случаях причиной являются лимфомы и лимфогранулематоз (опухолевое заболевание лимфатической системы). Способствуют развитию СВПВ метастазы других злокачественных новообразований (молочной железы, яичка).
Среди причин Кава-синдрома также следует выделить:
- доброкачественные опухоли;
- аневризму аорты;
- увеличение щитовидной железы;
- фиброзный медиастинит (воспалительный процесс в клетчатке средостения).
Блокада оттока крови от бесклапанного сосуда и головы чревата развитием ряда патофизиологических эффектов. Ухудшается венозный возврат к правому желудочку, и снижаются показатели сердечного выброса. Также наблюдается системная гипотензия (снижение артериального) и повышение венозного давления в системе ВПВ, что чревато развитием тромбоза сосудов мозга. Из-за снижения артериально-венозного градиента могут развиться необратимые изменения в области головного мозга.
При онкологии легкого проходимость бесклапанного сосуда, как правило, сохраняется, несмотря на то, что инвазия уже произошла. Только 10-20% больных с опухолевым СВПВ живут больше 2 лет. Продолжительность жизни таких пациентов, в соответствии со статистикой, не превышает 10 месяцев.
Характерной особенностью рака почки является формирование опухолевого тромбоза нижней полой вены (до 25%), в ряде наблюдений распространяющегося на правое предсердие [10, 12, 14]. С 1913 г., когда А. Berg [9] впервые в мире сообщил о нефрэктомии в сочетании с опухолевой тромбэктомией из нижней полой вены (НПВ), прошло почти 100 лет. Однако лишь в 1972 г. была показана рациональность агрессивного хирургического подхода к курации подобных состояний (в сочетании с радикальной нефрэктомией тромбэктомия из НПВ обеспечивает 5-летнюю выживаемость 55% больных) [17]. Несмотря на это, особенно в случае протяженного тромбоза НПВ, все еще остается большое число нерешенных хирургических вопросов (доступ, экспозиция, целесообразность применения искусственного кровообращения — ИК), что делает данную проблему актуальной и по сей день.
R. Neves и H. Zinck [16] в 1987 г. при раке почки предложили разделить опухолевую инвазию НПВ и правого предсердия на
4 категории (рис. 1),
Рисунок 1. Типы опухолевой инвазии НПВ [15, 16] (схемы). наиболее трудоемкими в хирургическом плане считают типы III-IV.
В подобных ситуациях при отсутствии отдаленных метастазов (кроме единичных легочных метастазов), несмотря на увеличение операционного риска, целесообразна радикальная операция с применением кардиохирургических технологий, что дает единственный шанс на продление жизни больного [1-17].
Мы обладаем опытом хирургического лечения 7 больных с I-II типами опухолевой инвазии НПВ и 3 больных раком почки и опухолевым тромбозом правого предсердия (тип IV). Приводим пример.
Больная Е., 53 лет, оперирована в РНЦХ им. акад. Б.В. Петровского 26.06.11 с диагнозом: В1 верхнего полюса правой почки T3bN2M0. Опухолевый тромбоз НПВ и правого предсердия (хирург — акад. РАМН Ю.В. Белов). Произведены радикальная нефрэктомия, аортокавальная лимфодиссекция, тромбэктомия из правого предсердия и НПВ (рис. 2).
Рисунок 2. Компьютерные томограммы и этапы операции у больной Е. (фотографии). а — компьютерные томограммы органов брюшной и грудной полости. Визуализируется опухоль правой почки с тромбозом НПВ и правого предсердия.
Рисунок 2. Компьютерные томограммы и этапы операции у больной Е. (фотографии). б — хирургический доступ — стернолапаротомия.
Рисунок 2. Компьютерные томограммы и этапы операции у больной Е. (фотографии). в — аортокавальная лимфаденэктомия.
Рисунок 2. Компьютерные томограммы и этапы операции у больной Е. (фотографии). г — мобилизация печени.
Рисунок 2. Компьютерные томограммы и этапы операции у больной Е. (фотографии). д — продольная каватомия и удаление опухолевого тромба.
Рисунок 2. Компьютерные томограммы и этапы операции у больной Е. (фотографии). е — шов НПВ.
Рисунок 2. Компьютерные томограммы и этапы операции у больной Е. (фотографии). ж — фотография опухолевого тромба.
Доступ к сердцу и органам забрюшинного пространства осуществлен с помощью тотальной продольной стернолапаротомии. Вскрыт перикард, взят на держалки. Сагиттальная диафрагмотомия до устья НПВ после предварительного прошивания диафрагмальной вены. Рассечена брюшина правого бокового канала, мобилизованы двенадцатиперстная и восходящая ободочная кишки и отведены медиально. В проекции правой почки определяется плотноэластической консистенции опухоль размером 12×10 см, исходящая из верхнего полюса почки. Печень полностью мобилизована за счет рассечения всех ее связок таким образом, что она оставалась фиксированной лишь печеночно-дуоденальной связкой (последняя взята в турникет) и устьями печеночных вен. Типичная аортокавальная лимфодиссекция — из зоны аортокавального окна удален пакет увеличенных до 2 см лимфоузлов (6 штук). НПВ расширена до 6 см в ее ретропеченочном отделе: при пальпации определяется тромб плотноэластической консистенции. Прошита и пересечена правая почечная артерия у устья нитью этибонд 3/0. Прошита и пересечена яичниковая вена у ее устья нитью пролен 4/0. Прошита и пересечена надпочечниковая вена у места впадения в НПВ нитью пролен 4/0. При пальпации правого предсердия опухолевый тромб выше устья НПВ на 2 см. Решено оперировать без ИК. Большим аортальным зажимом пережато правое предсердие выше тромба. Зажим на НПВ в инфраренальном отделе, зажим на левую почечную вену. Затянут турникет на печеночно-дуоденальной связке. Печень отведена медиально. Продольная каватомия по переднелатеральной стенке ретропеченочного сегмента НПВ от ее устья до правой почечной вены (разрез выполнен латеральнее устья правой печеночной вены). Головка тромба «родилась» из правого предсердия. Из НПВ удален тромб длиной 12×5,5 см единым блоком. Устье правой почечной вены иссечено вследствие интимного спаяния тромба со стенкой вены. Разрез НПВ ушит продольным непрерывным швом нитью пролен 4/0. После профилактики материальной и воздушной эмболии сняты все зажимы — пуск кровотока по НПВ. Фибрилляция предсердий и гипотония до 60/40 мм рт.ст. Однократным разрядом дефибриллятора восстановлен стойкий синусовый ритм. Гемодинамика стабилизирована на уровне 120/80 мм рт. ст. Далее опухоль мобилизована единым блоком с надпочечником, паранефрием с помощью аппарата LigaSure. Правые мочеточник и яичниковые вены лигированы в нижней трети раздельно нитью викрил 3/0. Препарат удален. Гемостаз. Дренажи к зоне операции, в перикард, в плевральные полости. Типичное закрытие раны. Кровопотеря 4500 мл. Ишемия печени 18 мин. Послеоперационное течение без осложнений.
Гистологическое исследование: в почке обнаружен склероз и гиалиноз отдельных клубочков с наличием серозных кист, выстланных утолщенным эпителием. В лоханке почки отмечен рост опухоли, представленной разрастаниями раковых клеток со светлой цитоплазмой и плотным гиперхромным ядром. В лимфоузлах ворот и в клетчатке верхнего полюса почки обнаружены метастазы рака. Надпочечник с правильной структурой строения без прорастания его тканью опухоли. Заключение: почечно-клеточный рак (светлоклеточный тип) с метастазами в лимфоузлы ворот и клетчатку почки.
Необходимо акцентировать внимание на некоторых принципиальных моментах хирургического лечения подобного заболевания (типы опухолевой инвазии НПВ III-IV).
Хирургический доступ должен быть адекватным, создающим удобство экспозиции как правого предсердия, так и НПВ на всем протяжении. Авторы [15] предлагают использовать так называемый разрез «chevron» («mercedes») (рис. 3).
Рисунок 3. Хирургический доступ (с изменениями по [15], схема). Мы же считаем более «выгодной» и безопасной продольную стернолапаротомию как универсальный доступ ко всем органам грудной, брюшной полости и забрюшинного пространства. Кроме того, доступ дает возможность отлично экспонировать НПВ дистальнее ее «креста» для ее возможной канюляции второй венозной канюлей (поскольку типичное место канюляции второй «вены» выполнено опухолевым тромбом). Предлагаемые исследователями [7] торакотомию в сочетании с люмботомией считаем менее удобным доступом. Акад. М.И. Давыдов [4] предлагает выполнять подобные операции из срединной лапаротомии, им разработан доступ к правому предсердию и устью НПВ через сагиттальную диафрагмотомию. В данной статье мы намеренно не рассматриваем больных с I-II типами опухолевой инвазии НПВ, так как их с успехом оперируют, используя лапаротомию либо торакофренолапаротомию, при этом не требуется применения ИК.
Важным является полная мобилизация печени, которая должна быть выполнена так, чтобы лишь печеночные вены служили точками фиксации печени к НПВ (рис. 4).
Рисунок 4. Мобилизация печени и направление каватомии [15] (схема). При этом снизу печень остается фиксированной лишь на печеночно-дуоденальной связке, а сверху — на печеночных венах.
Нефрэктомия может быть выполнена как до, так и после тромбэктомии из НПВ [7, 12, 15]. При I-II типах и в части наблюдений при III типе опухолевого тромба последний может быть удален без использования ИК. У таких больных целесообразность технологий кровосбережения крайне актуальна.
В связи с этим считаем весьма важным, помимо использования Cell-Saver, применение маневра Pringle [15], т.е. пережатие турникетом печеночно-дуоденальной связки с проходящими в ней кровеносными сосудами (v. portae и a. hepatica).
Возникающая при пережатии печеночно-дуоденальной связки ишемия печени минимизирует кровопотерю из печеночных вен во время каватомии. Дополнительное снижение кровопотери во время основного этапа операции может быть достигнуто в том числе за счет предварительного лигирования почечной артерии [13]. Использование аппарата ИК с забором крови в кардиотомный резервуар коронарными отсосами делает тромбэктомию безопасной в плане геморрагических осложнений.
В мировой литературе имеются публикации, касающиеся хирургической тактики лечения подобных больных с применением различных схем полного сердечно-легочного обхода с остановкой кровообращения или без таковой [14], а также с использованием изолированного обхода правого сердца [7] и вено-венозного обхода [11]. С артериальной канюляцией проблем нет — стандартно канюлируется восходящая аорта в типичном месте. Для выхода на расчетную производительность аппарата ИК канюлируют правое предсердие либо специальной «basket-like» венозной канюлей [12], либо канюлируют верхнюю полую вену, а вторую венозную канюлю ставят либо в бедренную вену, либо в НПВ ниже пальпируемого в почечном ее сегменте тромба [15], либо в правое предсердие [10]. Основной этап вмешательства на НПВ выполняется в условиях глубокого гипотермического циркуляторного арреста 15-18 °С [12, 13], либо в условиях умеренной гипотермии 30-32 °С с применением маневра Pringle [15]. Использование глубокой гипотермии обеспечивает бескровное операционное поле, минимизирует риск тепловой ишемии висцеральных органов, уменьшает вероятность материальной опухолевой эмболии. В то же время глубокий гипотермический циркуляторный аррест требует более длительного времени ИК, затрачиваемого на охлаждение и согревание больного, более вероятна интра- и послеоперационная коагулопатия [12]. Тромбэктомия из правого предсердия выполняется в условиях холодовой кристаллоидной кардиоплегии на остановленном сердце [10, 12, 15]. G. Bisleri и соавт. [10], используя умеренную гипотермию во время арреста кровотока по органам и тромбэктомии из правого предсердия, предлагают перфузировать головной мозг по схеме верхняя полая вена — дуга аорты (последняя пережата дистальнее левой общей сонной артерии и проксимальнее артериальной канюли). После тромбэктомии вторую венозную канюлю устанавливают в НПВ, снимают зажимы с аорты и начинают согревание организма. Весьма интересным представляется предложение команды исследователей во главе с P. Shatapathy выполнять тромбэктомию из правого предсердия на работающем сердце в условиях нормотермии с помощью обхода правого сердца (канюляция по схеме ВПВ — НПВ ниже ее печеночного сегмента — правая легочная артерия») [7]. Акад. М.И. Давыдов [4] обладает опытом более 50 тромбэктомий из правого предсердия на работающем сердце через лапаротомный доступ с сагиттальной диафрагмотомией. В редких наблюдениях, когда опухоль пролабирует в правый желудочек, мы считаем эту процедуру опасной, так как возможна фатальная тромбоэмболия опухолевыми массами.
По данным современного обзора литературы [12], радикальная нефрэктомия с тромбэктомией из НПВ сопровождается 2,7-13% операционной летальностью и 5-летней выживаемостью 30-72% пациентов.
Таким образом, по нашему мнению, в случае опухолевой инвазии устья нижней полой вены и правого предсердия применение искусственного кровообращения для «безопасной» тромбэктомии как нельзя более оправдано. Однако показания к его применению, варианты подключения аппарата искусственного кровообращения, уровень гипотермии требуют уточнения.
Симптомы синдрома ВПВ
Симптомы синдрома верхней полой вены развиваются на фоне венозной гипертензии. Признаки патологических нарушений напрямую зависят от прогрессирования обструкции, ее степени и области локализации. Значение также имеет степень прогрессирования коллатералей (боковых или обходных путей кровотока). Компонентом СВПВ также является.
Течение болезни может быть как медленно прогрессирующим, так и острым. Жалобы бывают достаточно разнообразными, начиная от изменения внешности и легкого головокружения и заканчивая судорогами и обморочными состояниями. При проведении физикального обследования отмечается набухание и расширение вен на шее, руках и грудной стенке. Картина заболевания у многих больных бывает стертой. Физикальная диагностика включает тест Пембертона – поднятие рук вверх. При окклюзии бесклапанного сосуда наблюдается цианоз кожи шеи и лица, а также инъекции конъюнктивальных сосудов.
Клинические признаки синдрома верхней полой вены при раке условно делятся на несколько групп. Результат застойных явлений в поверхностных и глубоких структурах:
- отеки в области рук, лица и тела;
- асфиксия (удушье) – при переходе отека на голосовые связки;
- при сужении капилляров развивается цианоз, который характеризуется землисто-бледным окрасом кожи (возникает на фоне лимфостаза – патологического накопления жидкости, богатой белком).
Застойные явления в области головного мозга сопровождается общемозговыми симптомами: появляется характерная одышка, постоянные головные боли, частые приступы удушья. При длительных нарушениях отмечается усугубление отека гортани.
Вследствие происходящих нарушений в области головного мозга происходят кардинальные изменения, которые чреваты развитием эмоциональной утомляемости и сонливости. Приступы удушья сопровождаются потерей сознания, что является признаком гипоксии головного мозга, которая развивается на фоне происходящих циркуляторных нарушений. Среди наиболее частых проявлений патологического процесса следует выделить выраженную возникновение слуховых галлюцинаций и выраженную спутанность сознания.
Среди проявлений нарушения черепно-мозговых нервов следует выделить диплопию (двойное зрение) и выраженное ухудшение слуховых качеств. Подобные признаки обусловлены расстройством нервов и сопровождаются снижением зрительных функций и слезоточивостью. Не исключено повышение показателей внутриглазного давления.
Чтобы более полно характеризовать состояние пациента при СВПВ, следует изучить третью группу клинических признаков, обусловленных основной болезнью. Они проявляются в виде кашля, кахексии и кровохарканья. Синдром верхней полой вены в онкологии сопровождается носовыми и пищеводными кровотечениями, которые возникают вследствие истончения венозных стенок. При физических нагрузках отмечается достаточно быстрая утомляемость рук. Выполнять даже незначительную физическую работу становится трудно, что связано с приливом венозной крови к голове. Сердечные боли, повышенное сердцебиение и сдавливание за грудной клеткой – последствия нарушения процессов кровоснабжения сердечной мышцы и отека клетчатки средостения.
Осложнения
Зачастую при СВПВ наблюдается развитие кровотечений (пищеводных, носовых или легочных), которые развиваются вследствие разрыва сосудистых стенок. По причине нарушения венозного оттока в области головы происходит развитие церебральной симптоматики:
- спутанность сознания и обморочные состояния;
- судороги и слабость конечностей;
- частые боли в области головы.
При нарушении нервов происходит развитие экзофтальма (моно- или бинокулярного смещения глазного яблока кпереди), диплопия (двойное зрение), слезотечение, ухудшение зрения и быстрая утомляемость глаз. Не исключено нарушение слуха, шум в ушах и слуховые галлюцинации.
Диагностика Кава-синдрома
В диагностике используется два основных этапа. Это первичный осмотр в непрофильных клиниках. За основу берется классическая клиническая картина и результат рентгенографии в боковой и прямой проекции. При наличии патологических нарушений на снимке присутствует дополнительное затемнение. При подозрении на СВПВ пациент направляется в специализированное медицинское учреждение.
Диагностика синдрома верхней полой вены включает проведение:
- ФБС (фибробронхоскопия)
– назначается при топографо-анатомической локализации патологического процесса. - Инцизионная или пункционная биопсия
проводится при поражении периферических лимфатических узлов. - Ангиография
используется в редких случаях и направлена на определение степени области локализации обструкции.
Эффективность диагностических мер на втором этапе обследования определяется долей морфологически верифицированных диагнозов. Проведенные исследования доказывают, что возможность выполнения определенных диагностических процедур связана со степенью прогрессирования.
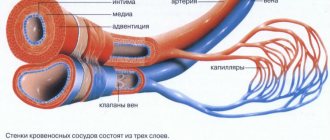
Анатомия полых вен
Верхняя находится в полости груди, а именно в верхней ее части. Она образуется слиянием двух вен – плечеголовых (правой и левой). Берет начало на уровне первого ребра справа от грудины, направляется вниз, впадает на уровне третьего правого ребра в правое предсердие. Она прилегает к правому легкому, левее от нее проходит аорта. Позади верхней полой находится корень правого легкого, на уровне второго правого ребра ее покрывает перикард. Перед ее входом в полость перикарда в нее впадают две вены: непарная и добавочная полунепарная.
Нижняя полая вена начинается в брюшной полости. Она образуется при слиянии подвздошных вен, идет вверх, отклоняется вправо от аорты в сторону диафрагмы. Она находится в забрюшинном пространстве позади внутренних органов. Через отверстие в диафрагме она направляется в грудную полость, оттуда идет к перикарду, впадает, так же как и верхняя полая, в правое предсердие. В НПВ впадают следующие вены:
- печеночные;
- диафрагмальные нижние;
- надпочечниковая правая;
- почечные;
- правая яичниковая или яичковая;
- поясничные.
Нижнюю полую вену принято делить на три отдела: инфраренальный, ренальный и печеночный.
Лечение синдрома верхней полой вены у онкобольных
При тяжелом состоянии больных требуется оказание неотложной помощи. В этом случае времени на проведение полного обследования и определения морфологии опухоли не остается. Лечебные меры включают принятие мер для улучшения венозного оттока по бесклапанному сосуду. Возникает необходимость в устранении дыхательной недостаточности, восстановлении мозгового кровообращения и купировании возможного отека легких.
При тяжелом течении назначается лечение, направленное на борьбу с опасной симптоматикой – врач назначает противоопухолевые препаратов, которые обладают эффективностью против большинства злокачественных новообразований. При правильном подходе состояние пациента быстро нормализуется.
Особенности лечения синдрома верхней полой вены:
- Симптоматическое
. Включает принятие мер, направленных на повышение функциональных резервов организма. Врач назначает низкосолевую диету, диуретики, кислородные ингаляции и глюкокортикоиды. - Патогенетическое
. Назначается после купирования основной причины патологического процесса. При лимфогранулематозе, лимфоме и раке легкого проводится лучевая и полихимиотерапия. При тромбозе проводится тромбэктомия, назначается тромболитическая терапия или осуществляется резекция сегмента ВПВ.
В случае экстравазальной компрессии проводится радикальной хирургическое вмешательство, которое подразумевает иссечение опухоли средостения, лимфомы, кист, доброкачественных новообразований и пр. Если выполнить радикальную операцию невозможно, тогда прибегают к паллиативным процедурам (обходное шунтирование, стентирование ВПВ, чрескожная баллонная ангиопластика).
В клинике «Медскан» в Москве лечение синдрома верхней полой вены проводится на основании международных протоколов. В медицинском центре используется новейшее оборудование экспертного класса. Врачи, имеющие большой практический опыт, постоянно проходят переквалификацию для повышения уровня компетенции. Результаты лечения СВПВ в первую очередь зависят от результативности радикальной терапии основного заболевания. Синдром верхней полой вены в детской онкологии неблагоприятный. Устранение причин Кава-синдрома позволяет купировать его последствия и предотвратить развитие возможных осложнений.
Лечение патологии
Целью лечебных мероприятий является избавление пациента от симптомов патологии. Но есть еще одна, первейшая цель – спасение жизни. Именно это необходимо сделать на первом этапе лечения. Положение больного с первичной патологией чрезвычайно серьезно, ему необходима реанимация онкологического характера.
В том случае, если патология является первым симптомом рака, то лечебные перспективы неплохие, так как ряд форм онкологии излечиваются под воздействием химиотерапии.
Если же после операции и терапевтического лечения пройдены, а патология не побеждена по причине того, что онкология прогрессирует, перспектив на излечение практически нет. Здесь надо добиваться улучшения качества жизни и продления ее.
В клинике интегративной онкологии Onco.Rehab созданы все условия для лечения разных патологий и их симптомов. Мы помогаем нашим пациентам.