Диагностика
Для того чтобы выявить атрезию легочной артерии, назначаются такие исследования:
- электрокардиография (тест дает получить сведения о патологическом состоянии правого желудочка и др.);
- рентгенография грудной клетки (дает представление о специфике сосудистого рисунка легких);
- фонокардиография (позволяет зарегистрировать патологические шумы);
- эхокардиография (дает возможность оценить нарушение строения одного из желудочков, а также получить данные о патологическом токе крови);
- ангиокардиографическое исследование (дает возможность изучить отделы сердца и крупные сосуды);
- зондирование сердца (в ходе исследования определяется давление в обоих желудочках и др.).
Частичный аномальный дренаж легочных вен: смешанный тип и синдром «ятагана». Клинические заметки
- Гаврилов Роман Юрьевич
Резюме
Частичный аномальный дренаж легочных вен характеризуется отсутствием соединения одной или нескольких вен с левым предсердием. Частота встречаемости — 0,3% всех врожденных пороков сердца. Синдром «ятагана» (Scimitar Syndrome, врожденный венолобарный синдром) является одной из наиболее редких и сложных для диагностики форм комбинации сосудистых аномалий. Он может сочетаться с другими врожденными пороками сердца и бронхолегочной системы. Представлено описание трех клинических случаев пациентов с частичным аномальным дренажем легочных вен, различающихся клиническим течением, анатомическими особенностями и вариантами хирургических решений. Описываются типичные проблемы, которые могут возникнуть после хирургического лечения частичного аномального дренажа легочных вен: синдром верхней полой вены, тромбоз протеза, обструкция системных вен. Использован весь спектр оперативных вмешательств, применяемых при первичной коррекции частичного аномального дренажа легочных вен и эндоваскулярные методики для устранения осложнений. Тщательное наблюдение за пациентами, перенесшими подобные вмешательства, позволит вовремя заметить патологические симптомы для более детального обследования, включающего ангиографию, мультиспиральную компьютерную или магнитно-резонансную томографию, и спланировать хирургическую коррекцию.
Ключевые слова:частичный аномальный дренаж легочных вен, синдром «ятагана»
Финансирование
. Исследование не имело спонсорской поддержки.
Конфликт интересов
. Автор заявляет об отсутствии конфликта интересов.
Для цитирования
: Гаврилов Р.Ю. Частичный аномальный дренаж легочных вен: смешанный тип и синдром «ятагана». Клинические заметки // Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. 2021. Т. 9, № 3. Приложение. С. 90-99. DOI: https://doi.org/10.33029/2308-1198-2021-9-3suppl-90-99
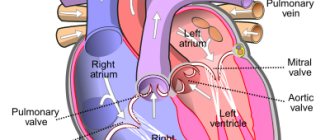
Частичный аномальный дренаж легочных вен (ЧАДЛВ) характеризуется отсутствием соединения одной или нескольких вен с левым предсердием. Частота встречаемости ЧАДЛВ — 0,3% от всех врожденных пороков сердца (ВПС). При этом легочные вены могут дренироваться в правое предсердие, коронарный синус, верхнюю или нижнюю полую вену. Различные комбинации аномального дренажа относят его к смешанному типу.
Синдром «ятагана» (Scimitar Syndrome, врожденный венолобарный синдром) является одной из наиболее редких и сложных для диагностики форм комбинации сосудистых аномалий и встречается в 1-3 случаях на 100 тыс. новорожденных [1].
К постоянным компонентам синдрома «ятагана» [2] относят гипоплазию (дисплазию) правого легкого и частичный или полный аномальный дренаж легочных вен (АДЛВ) правого легкого в нижнюю полую вену выше или ниже диафрагмы. При этом на рентгенограмме органов грудной клетки в прямой проекции можно увидеть изогнутую тень, идущую параллельно правому контуру сердца, которая внешне напоминает турецкую саблю, или ятаган. К непостоянным компонентам относят гипо- или аплазию легочной артерии, системное артериальное кровоснабжение легких и легочную секвестрацию.
Первое упоминание о синдроме «ятагана», основанное на материалах аутопсии, встречается в 1836 г. у G. Cooper и R. Chassinat. В 1912 г.
E. Park описал комплекс связанных между собой аномалий, состоящий из гипоплазии правого легкого, легочной артерии, АДЛВ и смещения сердца, симулирующего декстрокардию [3]. В 1956 г. C. Dotter и соавт. впервые поставили прижизненный диагноз, используя ангиографию [4]. В этом же году N. Halasz и соавт. описали аномальный венозный дренаж от правого легкого и сравнили его с турецкой саблей — ятаганом, но термин «синдром «ятагана»» был предложен C. Neill и соавт. в 1960 г. [5]. В 1962 г. H. Spencer описал сочетание синдрома «ятагана» с подковообразным легким, когда базальные отделы правого и левого легкого соединены перешейком паренхимы позади сердца [6, 7]. В 1973 г. B. Felson назвал данную аномалию врожденным венолобарным синдромом.
В тех случаях, когда нисходящая правая легочная вена проходит аномальным путем в правом легком, но впадает нормально в левое предсердие, говорят о ложном синдроме «ятагана». При синдроме «ятагана» имеется разной степени гипо- и дисплазия правого легкого, а характер ветвления бронхов напоминает правопредсердный изомеризм.
Встречается добавочный трахеальный бронх, относящийся к числу редких пороков развития бронхолегочной системы. Впервые описан Н. Chiari в 1889 г. Возникает из боковых выростов трахеи, которые в онтогенезе обычно подвергаются обратному развитию, чаще отходит от правой стенки трахеи. Частота аномалии, по данным разных авторов, составляет 0,5-2% наблюдений [8]. Добавочный трахеальный бронх может:
1) заканчиваться слепо дивертикулоподобным выпячиванием;
2) вентилировать часть верхней доли;
3) вентилировать добавочную (сверхкомплектную) долю легкого;
4) вентилировать добавочное третье легкое;
5) сообщаться с кистозной дегенеративной областью.
Встречается гипо- или аплазия правой легочной артерии, а также ее локальные стенозы. Возможны сужение аномальной вены в месте ее впадения в нижнюю полую вену и секвестрация легочной паренхимы в результате аномального системного артериального кровоснабжения части правого легкого (чаще нижней доли) из брюшной аорты. Двойное кровоснабжение легкого в сочетании с легочной венозной обструкцией может быстрее привести к застой ной сердечной недостаточности и легочной артериальной гипертензии.
Синдром «ятагана» может сочетаться с другими ВПС, среди которых дефекты перегородок, открытый артериальный проток, обструктивные пороки левого сердца, тетрада Фалло, единственный желудочек сердца, синдром Бланда-Уайта-Гарланда, двойное отхождение магистральных сосудов от правого желудочка и т.д. [9, 10].
Синдром «ятагана» может проявиться в периоде новорожденности тяжелыми симптомами или длительное время быть не диагностированным на фоне легкого течения заболевания [11, 12]. Частота респираторных инфекций зависит в том числе от степени гипоплазии легкого. Пренатально диагноз можно поставить на основании смещения сердца вправо, гипоплазии легкого и правой легочной артерии при отсутствии диафрагмальной грыжи.
С помощью эхокардиографии можно определить наличие дефекта межпредсердной перегородки (МПП), направление тока легочной венозной крови, уменьшение соотношения диаметров легочных артерий [13].
Типичный рентгенологический признак синдрома «ятагана» выявляется не более чем у У3 больных [14]. Для оценки всех компонентов синдрома и определения дальнейшей тактики используется катетеризация сердца с ангиографией, мультиспиральная компьютерная томография (МСКТ) или магнитно-резонансная томография (МРТ). Очень ценным является возможность одномоментного заполнения контрастным веществом всей системы венозного возврата, а также точная трехмерная оценка анатомии.
При синдроме «ятагана» возможно выполнение следующих видов оперативных вмешательств: 1) перевязка и пересечение аномальной вены и ее анастомозирование с левым предсердием; 2) перевод аномального дренажа в кардиальную форму с последующим направлением легочного венозного возврата в левое предсердие через дефект МПП с помощью заплаты из перикарда; 3) создание внутрипредсердного туннеля между устьем аномальной вены и дефектом МПП перегородки с расширением при необходимости устья нижней полой вены с помощью заплаты. В отдаленном послеоперационном периоде возможна обструкция длинного внутрипредсердного туннеля из-за его сложного пути и разворота на угол, приближающийся к 180°. При расположении аномальной вены позади корня легкого соединение ее с предсердием технически невыполнимо. В этом случае возможно удаление гипоплазированного правого легкого или его трансплантация. Компенсаторный рост левого легкого компенсирует отсутствие правого. Результаты хирургического лечения зависят от возраста пациента, анатомии порока, сопутствующих аномалий и вида оперативного вмешательства и не всегда являются удовлетворительными из-за появления признаков обструкции легочного венозного возврата.
Вариабельность клинического течения описываемой патологии, особенности хирургического лечения и дальнейшего наблюдения позволяют нам поделиться собственными наблюдениями.
Клинический случай 1. Пациенту Н.,
3 мес, при обследовании в ГБУЗ «ВОДКБ» был поставлен диагноз: «ВПС. Аневризма мембранозной части межжелудочковой перегородки. Мышечный дефект межжелудочковой перегородки. Сохранившееся овальное отверстие». Ребенок наблюдался в поликлинике по месту жительства. В возрасте 6,5 мес обследован в поликлинике ГБУЗ «ВОККЦ», поставлен диагноз: «ВПС. Аневризма мембранозной части межжелудочковой перегородки с двумя рестриктивными дефектами. Сохранившееся овальное отверстие».
К возрасту 1 год 5 мес дефекты межжелудочковой перегородки спонтанно закрылись, размеры аневризмы составляли 16×18 мм, без значимого нарушения фракции выброса левого желудочка. Размеры сердца были в норме.
По данным МСКТ грудной клетки с контрастированием выявлена аневризма базальных отделов межжелудочковой перегородки размерами 19x23x23 мм, а также частичный аномальный дренаж правых легочных вен: верхнедолевая правая легочная вена диаметром 9 мм впадает в верхнюю полую вену, от средней и нижней долей правого легкого вены собираются в единый коллектор диаметром 9 мм и впадают в нижнюю полую вену над диафрагмой. В устье коллектор имеет диаметр 6 мм. Две незначительные по диаметру легочные вены от S6 и S10 сегментов правого легкого впадают в левое предсердие. Кроме того, обнаружен правосторонний заднебоковой полупозвонок Т7 (аплазия левой половины тела и дуги с отсутствием вентрального ядра), сращение тел VI и VII ребер друг с другом, костная перемычка между их суставными головками.
Учитывая отсутствие клинических проявлений заболевания, удовлетворительное физическое развитие ребенка и отсутствие гемодинамических нарушений, от оперативного вмешательства решено было воздержаться.
В возрасте 2 года 11 мес был госпитализирован в ГБУЗ «ВОККЦ» в связи с появлением признаков недостаточности кровообращения I стадии (по Н.А. Белоконь).
По данным эхокардиографии выявлена дилатация правых отделов сердца. Аневризма базальных отделов межжелудочковой перегородки размерами 30×14 мм. Размеры левого предсердия находились на уровне верхней границы нормальных значений. Корень, восходящий отдел аорты не расширены. Легочный ствол не расширен. Аортальный клапан трехстворчатый, не изменен. Обратного тока нет. Створки митрального и трикуспидального клапанов не изменены. Папиллярные мышцы митрального клапана сближены и дистопированы. Митральная регургитация I степени. Трикуспидальная регургитация I степени. Расчетное систолическое давление легочной артерии 33 мм рт.ст. Qp/Qs
=1,9.
На основании клинических данных и результатов инструментальных исследований был поставлен диагноз: «ВПС. Частичный аномальный дренаж легочных вен, смешанный тип. Аневризма базальных и частично средних сегментов межжелудочковой перегородки. Недостаточность кровообращения (НК) I степени» и определены показания к оперативному лечению.
В ходе операции использовались стандартные методы интраоперационного мониторинга. После перикардиотомии выполнена ревизия сердца и правой плевральной полости, в ходе которой определено, что правая верхнедолевая легочная вена впадает в верхнюю полую вену, правые легочные вены от средней и нижней долей впадают в нижнюю полую вену на уровне диафрагмы. Выполнено подключение аппарата искусственного кровообращения по схеме «аорта — полые вены». Начато гипотермическое искусственное кровообращение с охлаждением до 30°. Защита миокарда проводилась с использованием интермиттирующей антеградной кровяной холодовой калиевой кардиоплегии. Доступ осуществлялся через правое предсердие разрезом от основания ушка по направлению к нижней полой вене. При ревизии полости правого предсердия обнаружено открытое овальное отверстие размерами 2×3 мм. При ревизии межжелудочковой перегородки отмечается ее аневризматическое выбухание в базальном отделе с частичным спаянием с септальной створкой трикуспидального клапана. Аневризма была плицирована тремя швами на прокладках из аутоперикарда. Выполнен транссептальный доступ к левому предсердию. При ревизии выявлены 2 устья левых легочных вен. Венозный коллектор диаметром 11 мм, над правым куполом диафрагмы выделен до ворот правого легкого. Аномальная вена прошита, пересечена и затем анастомозирована с левым предсердием. Аномальный дренаж в верхнюю полую вену устранен по классической методике H. Warden [14]. Операция закончена стандартно.
Послеоперационный период осложнился компенсированной сердечной недостаточностью, что потребовало назначения дофамина в дозе 4 мкг/кг в минуту, нарушениями ритма сердца: преходящая атриовентрикулярная блокада III степени в первые сутки после операции с переходом в атриовентрикулярную блокаду II степени, Мобитц 1, с периодикой Венкебаха, затем в атриовентрикулярную блокаду I степени. Синусовый ритм восстановился на 6-е сутки после операции. Ребенок экстубирован через 3 ч после операции и на следующий день переведен в детское кардиохирургическое отделение.
По результатам ЭхоКГ на 7-е сутки после операции сохранялась небольшая дилатация правого предсердия. Глобальная сократимость левого желудочка не нарушена. Митральная регургитация I степени. Трикуспидальная регургитация II степени. Расчетное систолическое давление в легочной артерии 35 мм рт.ст.
На контрольной МСКТ-ангиографии, выполненной через 5 мес после кардиохирургического вмешательства, определяется, что в левое предсердие от правого легкого идут 3 вены: 2 диаметром по 8 мм и одна 3,5 мм (рис. 1).
Рис. 1.
МСКТ-ангиография, VRT-реконструкция. Аномальный венозный коллектор правого легкого, дренирующийся в нижней полой вене и имеющий сужение в устье (желтые стрелки внизу): А — верхнедолевые легочные вены, впадающие в верхнюю полую вену (желтые стрелки сверху); Б — МСКТ органов грудной клетки. Фронтальный вид. Аномалии костного скелета; В — эхокардиография. Проекция 4 камер. Аневризма базальных отделов межжелудочковой перегородки; Г — МСКТ-ангиография. Аксиальный срез. Коллектор легочных вен, анастомозированный с левым предсердием (желтая стрелка)
Fig. 1.
MSCT angiography, VRT reconstruction. Abnormal venous collector of the right lung, draining into the IVC and having a narrowing at the orifice (yellow arrows below): А — upper lobe pulmonary veins flowing into the SVC (yellow arrows above); B — MSCT of the chest. Frontal view. Bone skeletal anomalies; C — echocardiography. 4 cameras projection. Aneurysm of the basal IVS; D — MSCT angiography. Axial slice. The pulmonary vein collector anastomosed to the left atrium (yellow arrow)
По результатам эхокардиографии через 3 года после операции камеры сердца не расширены. Глобальная сократимость левого желудочка не нарушена. Митральная и трикуспидальная регургитация приклапанная. Ускорения кровотока на устьях легочных вен нет. Скорость кровотока в устье верхней полой вены 0,75 м/с.
По результатам ЭКГ через 3 года после операции нарушений ритма не выявлено. Имеется неполная блокада правой ножки пучка Гиса.
Клинический случай 2
.
Пациентка С.
была направлена в поликлинику ГБУЗ «ВОККЦ» в возрасте 3 лет 3 мес. Поставлен диагноз: «ВПС. Вторичный дефект МПП. Частичный аномальный дренаж легочных вен в верхнюю полую вену. Сохранение левой верхней полой вены, впадающей в коронарный синус. НК0».
Учитывая отсутствие клинических проявлений заболевания, удовлетворительное физическое развитие ребенка и отсутствие гемодинамических нарушений, от оперативного вмешательства решено воздержаться.
В дальнейшем родители рекомендаций не выполняли, и на учете у детского кардиолога ребенок не состоял.
В возрасте 11 лет 2 мес повторно обследована в поликлинике ГБУЗ «ВОККЦ». Причиной обращения стали жалобы на повышенную утомляемость, одышку при физической нагрузке, частые респираторные инфекции.
По результатам ЭКГ регистрировался предсердный ритм с частотой 110 уд/мин.
По результатам ЭхоКГ выявлена дилатация правого предсердия и желудочка. В проекции полости правого предсердия отсутствовали патологические токи через межпредсердную перегородку. Имелась небольшая дилатация ствола легочной артерии со скоростью кровотока в нем 2,0 м/с. Ускорение кровотока в левой легочной артерии 2,7 м/с, в правой легочной артерии — 2,5 м/с.
По данным МСКТ грудной клетки с контрастированием, выявлен частичный аномальный дренаж правых легочных вен: верхнедолевая правая легочная вена диаметром 7 мм, впадает в верхнюю полую вену, от средней и нижней долей правого легкого вены собираются в единый коллектор диаметром 16 мм и впадают в нижнюю полую вену над диафрагмой. Правая верхняя полая вена имеет в устье диаметр 18 мм, левая верхняя полая вена (ЛВПВ) диаметром 10 мм впадает в расширенный коронарный синус. В левое предсердие слева впадают 2 легочные вены. Диаметр устья левой верхней легочной вены 12,5 мм, левой нижней легочной вены — 14 мм. Справа легочные вены не впадают. Правое легкое гипоплазировано, имеется добавочный трахеальный бронх, вентилирующий часть верхней доли (рис. 2).
Рис. 2.
МСКТ-ангиография: А — фронтальный срез. Коллектор легочных вен, впадающий в нижнюю полую вену (желтые стрелки); Б — фронтальный срез. Строение бронхиального дерева. Левый главный бронх (синяя стрелка). Правый главный бронх (красная стрелка). Добавочный трахеальный бронх (желтая стрелка)
Fig. 2
. MSCT angiography: А — frontal cut. The pulmonary vein collector that flows into the IVC (yellow arrows); B — frontal cut. The structure of the bronchial tree. Left main bronchus (blue arrow). Right main bronchus (red arrow). Accessory tracheal bronchus (yellow arrow)
На основании клинических данных и результатов инструментальных исследований был поставлен диагноз: «ВПС. Частичный аномальный дренаж легочных вен. Сохранение левой верхней полой вены, впадающей в коронарный синус. Хроническая сердечная недостаточность I функционального класса II по NYHA» и определены показания к оперативному лечению.
В связи с частыми острыми респираторными инфекциями и нарушением рекомендаций оперативное вмешательство несколько раз откладывалось и было выполнено в возрасте ребенка 13 лет 1 мес.
В ходе операции использовались стандартные методы интраоперационного мониторинга. После перикардиотомии была выполнена ревизия сердца и правой плевральной полости, в ходе которой определено, что сердце сильно смещено в правую сторону и ротировано, правая верхнедолевая легочная вена диаметром 8 мм впадает в верхнюю полую вену на 35 мм выше устья, правые легочные вены от средней и нижней долей впадают в нижнюю полую вену на уровне диафрагмы (рис. 3). Диаметр левой верхней полой вены 10 мм. Левая плечеголовная вена отсутствует. Выполнено подключение аппарата искусственного кровообращения по схеме «аорта — полые вены». Начато гипотермическое искусственное кровообращение с охлаждением до 30°. Венозный коллектор диаметром 16 мм над правым куполом диафрагмы выделен до ворот правого легкого.
Рис. 3.
Вид сердца во время операции. На держалку взят коллектор легочных вен, впадающий в нижнюю полую вену
Fig. 3.
View of the heart during surgery. The collector of the pulmonary veins, which flows into the IVC, was taken on the holder
Удаленность левого предсердия не позволила выполнить прямой анастомоз с коллектором. Принято решение об анастомозировании венозного коллектора с правым предсердием. Защита миокарда проводилась с использованием интермиттирующей антеградной кровяной холодовой калиевой кардиоплегии. Правое предсердие вскрыто разрезом от основания ушка по направлению к нижней полой вене. При ревизии полости правого предсердия было обнаружено устье коронарного синуса, расширенное до 18 мм. Дефекта МПП нет. Венозный коллектор прошит, отсечен от нижней полой вены и затем анастомозирован с правым предсердием. Учитывая особенности анатомии, создать дефект МПП необходимого диаметра не представлялось возможным. Принято решение использовать коронарный синус. ЛВПВ была пересечена дистальнее места канюляции. Ее проксимальная часть была вскрыта продольным разрезом с переходом на заднюю стенку левого предсердия. При ревизии выявлены 2 устья левых легочных вен. Стенка между левым предсердием и коронарным синусом иссечена. Выполнена пластика задней стенки левого предсердия заплатой из ксеноперикарда. Легочный венозный возврат направлен в левое предсердие через отверстие коронарного синуса с помощью заплаты из перикарда, с оставлением фенестрации 4 мм. ЛВПВ удлинена за счет тонкостенного протеза GORE-TEX, 10 мм. Аномальный дренаж в верхнюю полую вену устранен по методике H. Warden [14] с формированием Т-образного анастомоза между ушком правого предсердия, правой и левой полыми венами (рис. 4). Операция закончена стандартно.
Рис. 4
. Схема операции: A — общий вид после атриотомии; Б — процедура Warden (желтая стрелка). Отсечена левая верхняя полая вена (красная стрелка). Перемещен коллектор аномально АДЛВ (синяя стрелка); В — легочный венозный возврат направлен в левое предсердие через отверстие коронарного синуса с помощью заплаты из перикарда; Г — Т-образный вено-аурикулярный анастомоз (синие стрелки)
ЛВПВ — левая верхняя полая вена; ПВПВ — правая верхняя полая вена; АДЛВ — аномально дренирующаяся легочная вена; НПВ — нижняя полая вена; КС — коронарный синус.
Fig. 4
. Scheme of the operation. A — general view after atriotomy; B — Warden procedure (yellow arrow). The left superior vena cava was cut off (red arrow). The collector of abnormally draining pulmonary veins has been moved (blue arrow); C — Pulmonary venous return is directed to the left atrium through the coronary sinus opening using a pericardial patch; D — T-shaped venoauricular anastomosis (blue arrows)
LSVC — left superior vena cava; RSVC — right superior vena cava; ADPV — abnormally draining pulmonary vein; IVC — inferior vena cava; CS — coronary sinus.
Послеоперационный период протекал без особенностей. Экстубирована через 13 ч после операции и через 1 сут переведена в детское кардиохирургическое отделение.
На 5-е сутки после операции проведена ЭхоКГ. По ее результатам сохранялась небольшая дилатация правого предсердия. Глобальная сократимость левого желудочка не нарушена. Митральная и трикуспидальная регургитация I степени. Направление шунтирования крови через фенестру 4 мм слева направо. Ламинарные потоки крови в обоих предсердиях.
По результатам ЭКГ через 10 дней после операции нарушений ритма и проводимости не выявлено.
На контрольной МСКТ-ангиографии, выполненной через 5 мес после кардиохирургического вмешательства, определяется, что все легочные вены дренируются в левое предсердие. Имеется протяженный стеноз в области вено-аурикулярного анастомоза и стеноз анастомоза между левой верхней полой веной и протезом. Выполнена VRT-реконструкция для оценки послеоперационных изменений в анатомии сосудов легких (рис. 5).
Рис. 5
. Внутрипредсердный туннель к левому предсердию (зеленая стрелка). Правые легочные вены (синие стрелки). Протяженный стеноз в области веноаурикулярного анастомоза (красная стрелка). Стеноз анастомоза между левой верхней полой веной и протезом (желтая стрелка)
Fig. 5
. Intra-atrial tunnel to the left atrium (green arrow). Right pulmonary veins (blue arrows). Extended stenosis in the area of the veno-auricular anastomosis (red arrow). Stenosis of the anastomosis between the left superior vena cava and the prosthesis (yellow arrow)
На основании полученных данных планировалась эндоваскулярная балонная ангиопластика верхней полой вены, но на фоне удовлетворительного самочувствия ребенка родители откладывали госпитализацию, операция была выполнена через 2 года 10 мес. Причиной обращения стали жалобы на появление отечности верхней половины тела и периодические головные боли.
На контрольной МСКТ-ангиографии, выполненной через 3 года 2 мес после кардиохирургического вмешательства, определяется, что все легочные вены дренируются в левое предсердие. Имеется сужение анастомоза между верхней полой веной и ушком правого предсердия до 4 мм. Проксимальный сегмент правой верхней полой вены диаметром 18 мм. Левая верхняя полая вена окклюзирована.
По результатам ангиографии выявлена субокклюзия анастомоза между верхней полой веной и правым предсердием. Выполнена последовательная дилатация зоны сужения баллонами 8-20 (6 атм), 10-20 (12 атм) и 12-40 (14 атм) с имплантаций стента 10-19 (15 атм). Отмечена выраженная ригидность тканей в месте стеноза. По данным флебографии отмечается хорошее прилегание стента с остаточным стенозом 30%. ЛВПВ окклюзирована, имеется развитая коллатеральная сеть.
На фоне лечения на данном этапе достигнуто значительное клиническое улучшение в виде исчезновения отечности верхней половины туловища и головных болей. В дальнейшем планируется эндоваскулярное закрытие межпредсердного сообщения и повторная дилатация стента баллоном высокого давления для увеличения диаметра веноаурикулярного анастомоза.
Клинический случай 3
.
Пациентке Ж.,
11 лет, при обследовании в ГБУЗ «ВОДКБ» был поставлен диагноз: «Постоянная форма трепетания предсердий. Инвазивное электрофизиологическое исследование, радиочастотная катетерная абляция критической зоны петли ре-ентри 17.03.2017. Состояние после радикальной коррекции ВПС — пластики дефекта МПП с перемещением устьев правых легочных вен в левое предсердие 11.03.2015. Полная атриовентрикулярная блокада. Состояние после постоянной эндокардиальной стимуляции электрокардиостимулятором Advisa DR MRI (VVIR) 28.01.2016». До 2021 г. девочка проживала в Московской области и проходил лечение в ГБУЗ МО МОНИКИ им. М.Ф. Владимирского и Детском научно-практическом центре нарушений сердечного ритма ОСП НИКИП им. акад. Ю.Е. Вельтищева. Обследована в поликлинике ГБУЗ «ВОККЦ».
По данным эхокардиографии выявлена дилатация всех камер сердца. Глобальная сократимость левого желудочка снижена. Аневризматическое расширение базальных отделов правого желудочка. Корень, восходящий отдел аорты не расширены. Легочный ствол не расширен. Аортальный клапан трехстворчатый, не изменен. Обратного тока нет. Створки митрального и трикуспидального клапанов не изменены. Митральной регургитации нет. Трикуспидальная регургитация I степени. В проекции полости правого предсердия патологических токов не визуализируется. Расчетное систолическое давление в легочной артерии 37 мм рт.ст. Рекомендовано проведение МСКТ-ангиографии.
По результатам МСКТ грудной клетки с контрастированием выявлен ЧАДЛВ: все правые легочные вены собираются в единый коллектор диаметром 15 мм и впадают в нижнюю полую вену над диафрагмой (рис. 6). Ветви средней доли правого легкого диаметром 2 мм впадают в левое предсердие. Верхняя полая вена имеет в устье диаметр 13 мм, нижняя полая вена расширена до 26 мм. Печеночные вены диаметром 12 мм впадают в правое предсердие. В левое предсердие слева впадают 2 легочные вены. Диаметр устья левой верхней легочной вены 17,5 мм, левой нижней легочной вены — 14,5 мм. Правое легкое гипоплазировано с характерными изменениями бронхиального дерева.
Рис. 6.
МСКТ-ангиография, VRT- реконструкция. Вид сбоку. Коллектор правых легочных вен (зеленые стрелки) впадает в нижнюю полую вену (синяя стрелка)
Fig. 6.
MSCT angiography VRT reconstruction. Side view. The collector of the right pulmonary veins (green arrows) flows into the inferior vena cava (blue arrow)
По результатам зондирования подтвержден частичный аномальный дренаж правых легочных вен в нижнюю полую вену — синдром «ятагана». При манометрии среднее давление в легочной артерии 11 мм рт.ст., в правом желудочке — 9 мм рт.ст. Насыщение крови кислородом в верхней полой вене 79%, в нижней полой вене — 92%.
В ходе операции использовались стандартные методы интраоперационного мониторинга. Выполнено периферическое подключение аппарата искусственного кровообращения по схеме «бедренная артерия — бедренная вена». Рестернотомия. В переднем средостении и полости перикарда тотальный спаечный процесс. Выполнен субтотальный кардиолиз. Проведена ревизия сердца и правой плевральной полости, в ходе которой определено, что сердце сильно смещено в правую сторону, имеется выраженная дилатация правого желудочка. Подключение аппарата искусственного кровообращения по схеме «аорта — полые вены». Начато нормотермическое искусственное кровообращение. Все правые легочные вены собираются в единый коллектор и впадают в нижнюю полую вену на уровне диафрагмы. Венозный коллектор диаметром 15 мм над правым куполом диафрагмы выделен до ворот правого легкого. Удаленность левого предсердия не позволила выполнить прямой анастомоз с коллектором. Защита миокарда проводилась с использованием интермиттирующей антеградной кровяной холодовой калиевой кардиоплегии. Правое предсердие вскрыто разрезом от основания ушка по направлению к нижней полой вене. При ревизии полости правого предсердия было обнаружено самостоятельное впадение печеночных вен с расширенным до 16 мм устьем, дополнительно канюлировано. Дефект МПП не обнаружен. На межпредсердной перегородке множество проленовых швов. Учитывая особенности анатомии, принято решение о создании внутрипредсердного туннеля. Между предсердиями сформировано адекватное сообщение, эндокард предсердий сшит между собой. При ревизии выявлены 2 устья левых легочных вен и устье нижней базальной вены от правого легкого. Легочный венозный возврат направлен в левое предсердие через созданный дефект МПП с помощью внутрипредсердного туннеля, сформированного из перикардиальной заплаты. Устье нижней полой вены также расширено с помощью заплаты из перикарда. Операция закончена стандартно.
Послеоперационный период протекал без особенностей. Экстубирована через 12 ч после операции и на следующий день переведена в детское кардиохирургическое отделение.
По результатам ЭхоКГ на 4-е сутки после операции сохранялась дилатация правых отделов сердца. Глобальная сократимость левого желудочка снижена, на уровне дооперационной. Митральная и трикуспидальная регургитация I степени. В проекции полости правого предсердия патологических токов не визуализируется. Ламинарный поток крови на туннеле.
На контрольной МСКТ-ангиографии, выполненной через 14 дней после кардиохирургического вмешательства, определяется, что все легочные вены дренируются в левое предсердие (рис. 7).
Рис. 7.
МСКТ-ангиография, VRT-реконструкция. Вид сзади. Правые легочные вены через внутрипредсердный туннель дренируются в левое предсердие (желтые стрелки)
Fig. 7.
MSCT angiography VRT reconstruction. Back view. The right pulmonary veins are drained through the intra-atrial tunnel into the left atrium (yellow arrows)
В первом из представленных случаев поставить диагноз синдром «ятагана» нельзя из-за отсутствия гипоплазии правого легкого, хотя патологическая анатомия правых легочных вен и хирургическая тактика соответствует данному диагнозу. Даже рентгенологическая картина отражает типичный сосудистый рисунок с «ятаганом». И все же в первом случае мы имеем смешанный тип ЧАДЛВ. Во втором и третьем примере присутствуют постоянные компоненты синдрома «ятагана» — гипоплазия правого легкого и частичный или полный АДЛВ правого легкого в нижнюю полую вену выше уровня диафрагмы.
При лечении наших пациентов мы столкнулись с типичными проблемами, которые могут возникнуть после хирургического лечения ЧАДЛВ: синдром верхней полой вены, тромбоз протеза, обструкция системных вен, что потребовало повторных операций. Использованы весь спектр оперативных вмешательств, применяемых при первичной коррекции ЧАДЛВ, и эндоваскулярные методики для устранения осложнений. Надо сказать, что при выполнении подобных вмешательств у пациентов с более простыми видами АДЛВ мы ни разу не сталкивались с подобными осложнениями.
Тщательное наблюдение за пациентами, перенесшими подобные вмешательства, позволит вовремя заметить патологические симптомы для более детального обследования, включающего ангиографию, МСКТ-ангиографию или МРТ, и спланировать хирургическую коррекцию.
Литература
1. Meza R., Araujo J., Escobar A. et al. Successful surgical repair of scimitar syndrome in a 38-year-old adult // Int. J. Cardiovasc. Thorac. Surg. 2021. Vol. 5, N 6. P. 80-83.
2. Wang H., Kalfa D., Rosenbaum M.S., Ginns J.N., Lewis M.J., Glickstein J.S. et al. Scimitar syndrome in children and adults: natural history, outcomes, and risk analysis // Ann. Thorac. Surg. 2018. Vol. 105, N 2. P. 592-598.
3. Park E.A. Defective development of the right lung, due to anomalous development of the right pulmonary artery and vein: accompanied by dislocation of the heart simulating dextrocardia // Proc. N.Y. Pathol. Soc. 1912. Vol. 12. P. 88-92.
4. Dotter C.T., Hardisty N.M., Steinberg I. Anomalous right pulmonary vein entering the inferior vena cava: two cases diagnosed during life by angiocardiography and cardiac catheterization // Am. J. Med. 1949. Vol. 218. P. 31-36.
5. Neill C., Ferencz C., Sabiston D. et al. The familial occurrence of hypoplastic right lung with systemic arterial supply and venous drainage. «Scimitar syndrome» // Bull. Johns Hopkins Hosp. 1960. Vol. 107. P. 1-21.
6. Spencer H. Pathology of the Lung. 2nd ed. Oxford : Pergamon Press, 1968. P 73.
7. Figa F.H., Yoo S.J., Burrows PE., Turner-Gomez S., Freedom R.M. Horseshoe lung. A case report with unusual bronchial and pleural anomalies and a proposed new classification // Pediatr. Radiol. 1993. Vol. 23. P. 44-47.
8. Розенштраух Л.С., Рыбакова М.И., Винер М.Г Рентгенодиагностика заболеваний органов дыхания : руководство для врачей. 2-е изд., перераб. и доп. Москва : Медицина, 1987. С. 118-119.
9. Ruggieri M., Abbate M., Parano E., Distefano A., Guarnera S., Pavone L. Scimitar vein anomaly with multiple cardiac malformations, craniofacial, and central nervous system abnormalities in a brother and sister: familial scimitar anomaly or new syndrome? // Am. J. Med. Genet. 2003. Vol. 116A. P 170-175.
10. Azhari N., Al-Fadley F., Bulbul Z.R. Tetralogy of Fallot associated with scimitar syndrome // Cardiol Young. 2000. Vol. 10, N 1. P 70-72.
11. Melissa L. Rosado-de-Christenson. Diagnostic Imaging: Chest. 2nd ed. Salt Lake City : Amirsys, 2012. P 174-180.
12. Abbara S. Diagnostic Imaging: Chest. 2nd ed. Salt Lake City : Amirsys, 2013. P. 236-242.
13. Shibuya K., Smallhorn J.E., McCrindle B.W. Echocardiographic clues and accuracy in the diagnosis of scimitar syndrome // J. Am. Soc. Echocardiogr. 1996. Vol. 9. P. 174-181.
14. Gustainyte V., Miller M., Towbin R. et al. Scimitar syndrome // Appl. Radiol. 2021. Vol. 48, N 5. P. 37-39.
15. Warden H.E., Gustafson R.A., Tarnay T.J., Neal W.A. An alternative method for repair of partial anomalous pulmonary venous connection to the superior vena cava // Ann. Thorac. Surg. 1984. Vol. 38. P. 601-605.
Лечение
Выбор метода лечения атрезии легочной артерии непосредственно связан со специфическими характеристиками правого желудочка и легочной артерии. Самым эффективным является оперативное лечение.
- Медикаментозное лечение (не устраняет проблему, обычно назначается перед хирургическим лечением).
- Хирургическое лечение (часто проводится в несколько этапов, каждый их которых осуществляется через определенные промежутки времени):
- эндоваскулярные операции (через бедренную артерию к месту сужения канала, через который отходит кровь из правого желудочка, подводится балонный катетер; его раздувание приводит к улучшению гемодинамики);
- операции на открытом сердце (в процессе операции устанавливается соединение между правым желудочком и легочной артерией).
Атрезия легочной артерии : причины
Атрезия легочной артерии относится к наиболее сложным и опасным сердечным недугам. Частота данной патологии — примерно 7 случаев на 100 тысяч новорожденных. Среди всех врожденных патологий сердца заболевание составляет 1-3 %.
Формирование порока происходит при аномальном слиянии эндокардиальных валиков, которые являются зачатками полулунных клапанов. В дальнейшем это может вызвать заращение легочной артерии.
Этиология заболевания до сих пор не ясна. По одному из предположений, определенную роль играют неблагоприятные факторы, воздействующие на организм женщины в период беременности, в результате чего эмбриогенез нарушается. Например, негативное воздействие на развитие сердечной системы плода может оказать прием беременной женщиной гормональных лекарственных препаратов и антибиотиков, курение или употребление алкоголя и наркотиков.
В антенатальный период выброс крови в ствол легочной артерии из правого желудочка резко нарушается, что обусловлено слиянием заслонок легочного клапана. В результате давление в правом желудочке возрастает, наполнение эмбриональных синусоидно-коронарных сообщений правого желудочка увеличивается. Кровь оттуда может иметь выход только в случае трискупидальной недостаточности. Эта недостаточность и является причиной существенного увеличения размеров правого предсердия.
Симптомы атрезии легочной артерии
Симптомы болезни проявляются обычно в течение первых нескольких часов жизни ребенка. Иногда заболевание появляется через несколько дней после рождения. Основными его признаками являются:
- нарастающий синюшный оттенок кожи (цианоз);
- затрудненное учащенное дыхание;
- одышка;
- быстрая утомляемость при кормлении.
Продолжительность жизни малышей, родившихся с атрезией легочной артерии, в большей степени зависит от диаметра открытого артериального протока, через который поступает кровь в легочную артерию.