Коарктация аорты
Как и открытый артериальный проток, коарктация аорты, строго говоря, не является пороком самого сердца, так как находится вне его, затрагивает сосуды, вернее, аорту. Само сердце при этом нормально. Однако коарктацию всегда относят к порокам сердца, поскольку при ней страдает вся система кровообращения, а само формирование коарктации имеет прямое отношение к сердечным структурам и нередко сочетается с другими врожденными пороками сердца.
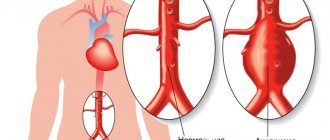
Слово коарктация означает сужение. В типичных, наиболее частых случаях, оно находится на месте перехода дуги аорты в ее нисходящий отдел, т.е. довольно далеко от сердца, рядом с артериальным протоком, на внутренней стороне задней поверхности грудной клетки, слева от позвоночника. Вариантов врожденного сужения аорты в этом месте может быть много, но во всех имеется препятствие кровотоку, выраженное в большей или меньшей степени, что и определяет степень тяжести клинических проявлений порока.
При очень резком сужении аорты левый желудочек, нагнетающий кровь в аорту, постоянно работает с повышенной нагрузкой. В результате артериальное давление в верхней половине (в сосудах шеи, головы, верхних конечностей) существенно выше, чем в нижней (в сосудах органов брюшной полости, нижних конечностей). Верхняя половина тела живет постоянно с «гипертонической болезнью», а нижняя — с постоянной гипотонией. Это не значит, что в нижние отделы поступает меньше крови, нет. Сердечный выброс остается достаточным. Сердце справляется, но за счет учащения ритма сокращений, увеличения объема левого желудочка, утолщения его стенок. Эти явления, особенно при резком сужении аорты, могут привести к тяжелым последствиям.
У новорожденных и младенцев первых месяцев жизни коарктация аорты может быть столь тяжелой, что кровоснабжение нижних отделов осуществляется только через открытый артериальный проток. Ситуация очень опасная, критическая. Признаки сердечной недостаточности и гипертонии в верхней половине тела, угрожающей необратимой травмой сосудов мозга, нарастают. Тут требуется неотложное вмешательство кардиохирурга.
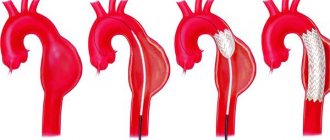
Сама операция заключается в устранении участка сужения аорты. Это можно сделать двумя способами: либо полностью убрать место коарктации и затем сшить оба здоровых участка аорты между собой («конец в конец»), или рассечь вдоль суженный участок и вшить в него заплату из собственной подключичной артерии ребенка или из синтетического материала. Оба метода примеряются достаточно широко и, судя по отдаленным результатам — 10-15 и более лет — ни один из них не имеет особых преимуществ. Дело в том, что у 20-25% всех больных, оперированных в раннем возрасте, в месте операции может вновь возникнуть сужение, независимо от метода. Проявиться это может через несколько лет.
Сегодня благодаря методам рентгенохирургии можно расширить повторное сужение путем введения в аорту катетера с баллончиком. В баллоне создается давление и суженное место расширяется. При рецидивах так часто и делают. Также суженный участок аорты у более взрослых детей можно стентировать, то есть в просвет аорты ставится трубчатая конструкция, так называемый «стент», которая своими стенками как каркасом, удерживает стенки аорты от стремления к сужению и возникновению рецидива коарктации. Но к каждой из данных методик есть свои показания и противопоказания, о которых вам расскажет ваш врач.
В любом случае, ребенок, перенесший операцию по поводу коарктации в младенчестве должен быть под наблюдением кардиологов в течение всей жизни. Но при этом надо всегда помнить, что когда-то, когда он был совсем маленьким, операция спасла ему жизнь.
У более старших детей, даже маленьких, но не новорожденных, коарктрация аорты может протекать достаточно спокойно и быть случайной находкой при очередном врачебном осмотре (конечно, в том случае, если будет прощупан пульс не только она руках, но и на бедренных артериях).
Показаниями к операции будет не столько сам диагноз коарктации, сколько нарушения кровообращения и степень артериальной гипертонии верхней части тела.
Операция будет носить плановый характер, а выбор метода зависит от конкретной ситуации. Об этом вам расскажет оперирующий хирург. Но не надо ждать долгие годы. Коарктация не пройдет и не уменьшится, а последствия сужения аорты будут только нарастать. У взрослых, в далеко зашедших случаях операция устранения коарктации сопряжена со значительно большим риском осложнений, чем у ребенка дошкольного возраста или даже подростка.
К сожалению, коарктацию аорты рентгенохирургическим путем пока устранить нельзя (только ее рецидив поддается этому методу). Но технология движется вперед с удивительной скоростью и, очень может быть, в ближайшем будущем такое лечение станет вполне возможным.
Симптомы
Симптомы зависят от тяжести заболевания. Симптомы у пациентов со значительным сужением появляются уже в детстве, в то время как небольшое сужение может не вызвать каких-либо изменений в организме достаточно долгое время. Как правило, тяжелые случаи проявляют себя сразу после рождения. Ребенок может внезапно стать бледным, раздражительным, усиливается потливость, возникает затруднение дыхания. Если оставить порок без коррекции, то это может привести к возникновению сердечной недостаточности и последующей смерти.
У детей старшего возраста и у взрослых симптомы стертые, так как сужение незначительное. Часто единственным признаком может быть повышенное давление, измеренное на руках. Другие симптомы:
- Одышка, преимущественно при физической нагрузке;
- Головная боль;
- Мышечная слабость;
- Похолодание конечностей;
- Носовые кровотечения;
Причины
Коарктация аорты связана с нарушением формирования аорты во время внутриутробного развития плода. В основном сужение располагается юкстадуктально, это значит рядом с артериальным протоком. Артериальный проток соединяет аорту и левую легочную артерию, и функционирует только внутриутробно, закрываясь после начала альвеолярного дыхания. Вероятно, в фетальный период часть тканей протока переходит на аорту, вовлекая в процесс закрытия и ее стенку, что, несомненно , приводит к сужению.
Редко, коарктация аорты возникает в течение жизни. Причинами может стать атеросклеротическое поражение аорты, травма или синдром Такаясу.
Факторы риска
У пациентов с синдромом Шерешевского-Тернера имеется генетическая предрасположенность к возникновению коарктации. У этих людей вместо 46 хромосом всего лишь 45. и у 1 из 10 пациентов сданным синдромом выявляют коарктацию аорты.
Также коарктация аорты может сочетаться и с другими врожденными пороками сердца.
→Двустворчатый аортальный клапан;
→Аортальный клапан отделяет аорту от левого желудочка. В норме он трехстворчатый;
→Дефект межжелудочковой перегородки — порок , при котором имеется сообщение между правым и левым желудочками, в следствие чего обогащенная кислородом кровь из левого отдела смешивается с венозной кровью из правого желудочка;
→Открытый артериальный проток. В норме артериальный проток закрывается сразу после рождения, если он остается открытым, то данный порок называется открытый артериальный проток.
→Стеноз отверстия аортального или митрального клапанов . Порок, при котором уменьшаются отверстия митрального клапана (клапан между левым предсердием и левым желудочком) и аортального клапана (клапан между левым желудочком и аортой).
Когда необходимо обратиться за помощью
Если у вас сильная загрудинная боль, внезапно возникшая одышка, вам срочно необходимо обратиться к вашему лечащему врачу или в службу 03; если вы или ваш врач зарегистрировали необъяснимое повышение артериального давления, которое сложно контролировать, — необходимо пройти обследование на предмет наличия у вас коарктации аорты, так как своевременное лечение позволит избежать драматического развития событий.
Диагностика
Возраст выявления патологии зависит от тяжести заболевания. Если степень сужения велика — диагностика возможна уже в раннем возрасте. Пациенты с незначительным сужением часто даже не знают о наличии у себя порока аорты. Заболевание часто является случайной находкой.
Врач может предположить наличие патологического сужения аорты при наличии:
- Высокого артериального давления,
- Разницы давлений на руках и ногах,
- Слабого пульс на ногах,
- Сердечного шума.
Инструментальные методы исследования
Рентгенография грудной клетки. Существуют определенные рентгенологические признаки, позволяющие установить правильный диагно).
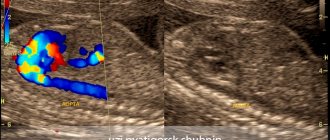
Эхокардиография. Метод, позволяющие визуализировать дефект, а также распознать сопутствующую сердечную патологию, например двустворчатый аортальный клапан
Электрокардиография . Так как сердечная мышца испытывает высокую нагрузку при данной патологии, то на электрокардиограмме врач определить признаки гипертрофии левого желудочка.
Магнитно-резонансная томография. Метод высокого разрешения, позволяющие определить точную локализацию коарктации.
Зондирование сердца также необходимо для определении тяжести поражения и анатомических особенностей порока.
Осложнения
Если не лечить коарктацию аорты , то со временем у вас могут возникнуть осложнения:
- Инсульт,
- Заболевания коронарных артерий,
- Разрыв аорты,
- Аневризма сосудов головного мозга,
Также в дополнении следует сказать, что внутренние органы плохо кровоснабжаются, так как есть препятствие току крови, что постепенно может привести к дегенеративным изменениям в них с последующим нарушением функции.
Лечение коарктации аорты
Хирургическое лечение
Существует несколько методов резекции и реконструкции аорты:
- Резекция коарктации аорты с анастомозом конец в конец. Данный метод возможен при наличии сужения на небольшой длине, когда возможно сопоставить концы нормальной неизмененной аорты.
- Пластика аорты при помощи сосудистого протеза. Данный метод используется в случае, если сужение захватывало длинный сегмент и сопоставление концов не возможно. Вместо резецированного патологического участка аорты вшивается сосудистый протез и специального синтетического материала.
- Ангиопалстика с использованием ткани левой подключичной артерии.
- Осуществление шунтирования суженного участка. Шунт вшивается проксимальнее и дистальнее суженного участка, таким образом, кровь свободно может обойти патологический участок аорты.
- Баллонная ангиопластика и стентирование. Часто данная методика используется в если после хирургической коррекции произошло сужение участка. Врач при помощи проводника вводит через сосуды в аорту специальный баллон, который раздувается и устраняется вновь возникшее сужение. Иногда приходится устанавливать стенты (своеобразный каркас), позволяющие фиксировать необходимы диаметр сосуда.
Медикаментозное лечение
Лечебные препараты не способны устранить сужение аорты, но принимаются до хирургической коррекции, а часто и длительное время после нее для контроля повышенного артериального давления.
Послеоперационный период
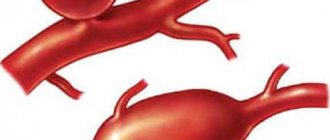
в послеоперационном периоде возможно то, что ваше артериальное давление еще какое-то время останется повышенным и вам необходимо будет принимать гипотензивные препараты. Также даже через несколько лет после операции может возникнуть расширение реконструированного участка (аневризма) или опять произойдет его сужение, что может потребовать проведения повторной операции.
Профилактика
Если в вашей семье высок риск возникновения данной патологии (в семье были случаи данной патологии) — вам необходимо пройти медико-генетическое консультирование и определить с врачом на сколько высок риск возникновения коарктации у ваших детей.
Это важно знать!
Во время беременности женщина с коарктацией аорты должна проходит тщательное наблюдение у врача кардиолога и акушера-гинеколога в связи с возможным развитием осложнений со стороны сердечно-сосудистой системы. А если имеет аневризма реконструированного участка аорты — то во время беременности и родов возможен разрыв данного участка. В связи с этим необходим строгий контроль показателей гемодинамики, а особенно вашего артериального давления.
Пациенты с коарктацией аорты находятся в зоне риска по возникновению инфекционного эндокардита, так как измененные ткани аорты в области коарктации являются благоприятной средой для развития патогенных организмов. Непременно посоветуйтесь с вашим врачом о возможной антибиотикопрофилактике перед стоматологическим процедурами для снижения риска возникновения эндокардита.
Как попасть на лечение в Научный центр им. А.Н. Бакулева?
Онлайн-консультации
Цель. Ввиду роста интереса клиницистов к коррекции коарктации аорты из срединной стернотомии с использованием искусственного кровообращения у новорожденных и грудных детей мы ретроспективно проанализировали собственный опыт резекции коррекции коарктации с расширенным анастомозом «конец-в-конец» из бокового доступа с акцентом на частоте реинтервенций и динамике роста поперечной дуги аорты в отдаленном периоде наблюдения.
Методы. В исследование включены 124 пациента в возрасте до 3 мес., перенесшие коррекцию коарктации аорты (с 2008 по 2021 гг.). У 43 (35%) пациентов коррекция коарктации сочеталась с дефектом межжелудочковой перегородки. 49 (39,5%) пациентов имели гипоплазию поперечной дуги аорты (Z-score менее –2). Все операции выполнены с использованием расширенного анастомоза «конец-в-конец» доступом из боковой торакотомии. У пациентов с дефектом межжелудочковой перегородки суживание легочной артерии предпринято одномоментно. Длительность послеоперационного наблюдения составила 3,6 (0,3–8,0) года.
Результаты. Госпитальная летальность составила 1,6%. Выживаемость на протяжении отдаленного периода наблюдения — 93,5%. Рекоарктация аорты диагностирована у 10 (8%) пациентов в среднем через 6,5 (3,5–15,0) мес. после операции. Баллонная ангиопластика зоны сужения была эффективна во всех наблюдениях и не имела осложнений. Мы наблюдали статистически значимый (р<0,001) рост поперечной дуги аорты в группе пациентов с исходной гипоплазией дуги.
Заключение. Резекция коррекции коарктации с расширенным анастомозом «конец-в-конец» из бокового доступа сопровождается низкой операционной летальностью, отличной выживаемостью и низкой частотой реинтервенций. В когорте пациентов с исходной умеренной гипоплазией дуги аорты в отдаленном периоде наблюдения отмечается рост дуги до нормальных значений. Эндоваскулярная баллонная дилатация зоны повторного сужения аорты в отдаленном послеоперационном периоде является высокоэффективной и безопасной процедурой.
Введение Хирургическая техника резекции коарктации аорты (КА) значительно изменилась за 70 лет с момента первого описания этой операции в 1945 г. [1, 2]. Первоначально она заключалась лишь в устранении суженного участка аорты. В связи с развитием неонатальной кардиохирургии появилась необходимость расширить возможности этой техники для устранения всего комплекса проблем с дугой аорты у новорожденных и младенцев, в частности при гипоплазии дуги аорты. Первых ощутимых успехов на этом пути добились коллективы, предложившие метод резекции КА с расширенным анастомозом «конец-в-конец» [3–5]. Этот метод в течение 30 лет получил широкое распространение в мире благодаря эффективности и безопасности [3–8]. Несколько позже появились попытки решать проблемы патологии дуги аорты у младенцев и другими хирургическими методами, в частности с применением искусственного кровообращения [9, 10]. Целью исследования является анализ собственного опыта применения хирургической методики резекции КА с расширенным анастомозом «конец-в-конец» из левосторонней торакотомии.
Методы Ретроспективному анализу подвергнуты данные историй болезни всех пациентов с КА, оперированных в отделении кардиохирургии и интенсивной терапии ГБУЗ «ДГКБ № 13 им. Н.Ф. Филатова ДЗМ» в период с 14 июля 2008 г. по 31 декабря 2021 г. В течение этого периода с применением метода резекции КА с расширенным анастомозом «конец-в-конец» доступом из левой заднебоковой торакотомии провели операцию 231 пациенту. Из них 124 человека, составившие настоящую группу наблюдения, были в возрасте не более 3 мес. Характеристика пациентов и особенности анатомии, которые мы оценивали, представлены ниже.
В исследование включены пациенты с изолированной коарктацией аорты и коарктацией в сочетании с дефектами межжелудочковой перегородки или двуотточным правым желудочком с подаортальным дефектом межжелудочковой перегородки. Пациенты, у которых КА сочеталась с транспозицией магистральных артерий, аномалией Тауссиг – Бинга и унивентрикулярной гемодинамикой, исключены из анализа. Двадцать пациентов имели синдромальную форму врожденного порока сердца, данные которых представлены ниже.
Основным диагностическим методом была трансторакальная эхокардиография. Абсолютные числовые значения, полученные при эхокардиографических измерениях, проанализированы с помощью Z-score калькулятора Boston Children’s Hospital (https://zscore.chboston.org). В качестве критерия гипоплазии дуги аорты и ее отделов применен показатель Z-score, меньший чем –2 [28]. Таких наблюдений было 39%.
Хирургическая техника Во всех наблюдениях резекцию КА с расширенным анастомозом «конец-в-конец» выполняли доступом из левой заднебоковой торакотомии при температуре тела пациента 35 °С. Сосудистый зажим на дугу аорты накладывали таким образом, чтобы не нарушить кровоток по брахиоцефальному стволу и поддержать нормальный уровень систолического артериального давления. Разрез на внутренней поверхности дуги аорты выполняли вплоть до точки проекции устья левой общей сонной артерии. Анастомоз дуги и нисходящей аорты выполняли обвивным полипропиленовым швом нитью 7/0 в течение 19 (15–33) мин. При сочетании коарктации с крупным дефектом межжелудочковой перегородки в ходе той же операции выполняли процедуру суживания легочной артерии лавсановой тесьмой по формуле Торонто-1. Таких наблюдений было 43 (35%).
Послеоперационное наблюдение Данные обследования пациентов в послеоперационном периоде были получены путем проспективного обследования или в результате анализа базы данных катамнестического наблюдения пациентов в отделении. Рутинное обследование включало физикальный осмотр, взвешивание, измерение роста, регистрацию артериального давления на правых руке и ноге методом Короткова и трансторакальную эхокардиографию. Доступны для анализа были протоколы трансторакальной эхокардиографии 118 (95,2%) выписанных из стационара пациентов. Четверо детей (3,2%) не являлись гражданами Российской Федерации, и после хирургического лечения связь с ними утрачена. Вместе с тем проанализированы все истории болезни детей с рекоарктацией аорты, по поводу которой им выполнялась транслюминальная баллонная ангиопластика, а также истории болезни детей с сопутствующими дефектами межжелудочковой перегородки, которым выполнялась радикальная коррекция порока. Медиана послеоперационного наблюдения составила 3,6 (0,3–8,0) года.
Статистический анализ Для сортировки вариационных рядов по признаку соответствия нормальному распределению мы использовали одновыборочный критерий Колмогорова – Смирнова. Данные, имеющие нормальное распределение, представлены в виде средних значений ± SD; не имеющие нормального распределения — в виде медианы вариационного ряда с указанием минимального и максимального значений. Сравнение средних значений выполнено с помощью t-критерия с проверкой гипотезы равенства дисперсий анализируемых выборок с применением критерия Ливиня. Анализ выживаемости и свободы от повторных операций проведен с помощью метода Каплана – Майера. Статистически значимым принято p<0,05. Данные обработаны с использованием программы SPSS Statistics 21.0 (IBM Corp., 2012). Этические аспекты исследования соответствуют принципам Хельсинской декларации Всемирной медицинской ассоциации.
Результаты Непосредственные результаты Госпитальная летальность в группе наблюдения составила 1,6% (n = 2). Один из пациентов, недоношенный ребенок весом 1,54 кг, с сочетанием КА, множественных дефектов межжелудочковой перегородки и умеренной гипоплазии левого желудочка с выраженной дисфункцией, оперированный по витальным показаниям, погиб на 2-е сут. после вмешательства от острой сердечной недостаточности в связи с развитием тяжелых нарушений ритма сердца. У второго пациента с трисомией 21, погибшего на 5-е послеоперационные сутки, КА также сочеталась с дефектом межжелудочковой перегородки, а соматическое состояние было осложнено внутриутробным инфицированием и тяжелым перинатальным повреждением почек. Нужно отметить, что коррекция изолированной КА сопровождалась 100% выживаемостью. Средняя продолжительность искусственной вентиляции легких после операции составила 26 ч, пребывания в палате интенсивной терапии — 4 сут. Ни одному пациенту не потребовалось внеплановых повторных вмешательств в срок до 30 сут. после резекции коарктации аорты. Преходящие осложнения раннего послеоперационного периода отмечены в 2,4% наблюдений: • неврологический дефицит с эпизодом клонико-тонических судорог (n = 1; 0,8%); • левосторонний хилоторакс (n = 1; 0,8%), подтвержденный цитологическим исследованием содержимого плевры; • парез левого возвратного гортанного нерва (n = 1; 0,8%) с клиникой стридорозного дыхания, подтвержденный фиброларингоскопией.
Результаты двухэтапной хирургической стратегии Медиана длительности межэтапного периода наблюдения у 41 пациента, выписанного из клиники после устранения КА и суживания легочной артерии, составила 9 (6–23) мес. В этот период один ребенок, получавший зондовое кормление, погиб дома в результате аспирации желудочным содержимым. Мы отметили спонтанное закрытие дефекта межжелудочковой перегородки у 5 (11,6%) пациентов этой когорты — вторым этапом удалили тесьму с легочного ствола без искусственного кровообращения. Тридцать пять пациентов перенесли коррекцию порока вместе с удалением тесьмы в условиях обычного искусственного кровообращения с поверхностной гипотермией. Продолжительность пережатия аорты и искусственного кровообращения в этой группе составила 56 (34–117) и 106 (70–174) мин соответственно. Медиана длительности искусственной вентиляции легких после второго этапа коррекции была 22 (4–96) ч, пребывания в палате интенсивной терапии после операции — 2 (1–5) сут. Второй этап коррекции сопровождался 100% выживаемостью. Общая выживаемость при использовании двухэтапной стратегии в группе из 43 пациентов с сочетанием КА и септальных дефектов составила 93%.
Отдаленные результаты В течение 8 лет послеоперационного наблюдения выживаемость в группе наблюдения составила 93,5% (рис. 1).
Погибли 8 детей, из которых четверо имели синдромальную форму врожденного порока сердца (синдромы Нунан, Холта – Орама, Дауна и делеции 22q11.2), шестеро — сопутствующие неврологические и соматические заболевания: церебральный паралич, эпилепсию, гидроцефальный синдром, хроническую почечную недостаточность (после перинатального острого повреждения почек), болезнь Гиршпрунга и атрезию двенадцатиперстной кишки, корригированную хирургически. Летальный исход был сопряжен либо с развитием инфекционных осложнений при госпитализации в другие стационары города Москвы, либо был результатом декомпенсации сопутствующих заболеваний.
Свобода от интервенций по поводу рекоарктации аорты на протяжении 8 лет послеоперационного наблюдения составила 92% (рис. 2). У 10 (8%) пациентов в среднем через 6,5 (3,5–15,0) мес. после операции диагностировано сужение дуги аорты со средним градиентом систолического давления, полученным методом Короткова, 42 (21–70) мм рт. ст. Из них у 5 детей исходно диагностирована гипоплазия дистальной части поперечной дуги аорты с Z-score –4,0 (от –4,7 до –3,3).
Всем пациентам с повторным сужением аорты выполнена баллонная ангиопластика зоны анастомоза «дуга – нисходящая аорта». Средний градиент давления, зарегистрированный при катетеризации аорты до процедуры, составил 37,0±3,8 мм рт. ст.; после выполнения баллонной дилатации — 8,2±1,4 мм рт. ст., p = 0,03. Осложнений не отмечено. На протяжении 3,5 (0,7–7,5) года катамнеза в этой когорте пациентов средний градиент между дугой и нисходящей аортой, зафиксированный с помощью трансторакальной эхокардиографии, составил 15,2±3,3 мм рт. ст. В группе пациентов с исходной гипоплазией дуги аорты мы зафиксировали статистически значимый рост диаметра поперечной дуги спустя 3,6 (0,3–8,0) года после создания расширенного анастомоза «конец-в-конец» (табл. 1).
Обсуждение
К настоящему моменту описано несколько хирургических методик коррекции КА. Это и простой анастомоз «конец-в-конец» [1, 2], истмопластика по Вальдхаузену [12, 13], резекция с реверсивной пластикой лоскутом левой подключичной артерии [14], баллонная дилатация зоны сужения [15, 16], а также методика коррекции коарктации аорты в условиях циркуляторного ареста или селективной церебральной перфузии доступом через срединную стернотомию [9, 10]. Метод резекции КА с расширенным анастомозом «конец-в-конец» из бокового доступа мы применяем на протяжении 10 лет. В проведенном исследовании мы продемонстрировали, что резекция коарктации аорты с расширенным анастомозом «конец-в-конец» доступом из боковой торакотомии сопровождается низкой операционной летальностью (1,6%), отличной отдаленной выживаемостью (93,5%) и низкой частотой реинтервенций (8%). Ряд авторов также отдают предпочтение резекции КА из бокового доступа с расширенным анастомозом «конец-в-конец», считая преимуществом данного метода возможность полной резекции всей зоны коарктации с максимальным иссечением дуктальной ткани и формирование широкого анастомоза дуги и нисходящей аорты, создающего возможность для роста дуги. Ими, как и в настоящей работе, отмечена низкая частота неблагоприятных исходов и рекоаркатций (табл. 2), что характеризует безопасность и эффективность этого метода [6–8].
Европейская база данных врожденных пороков сердца (англ. European Congenital Heart Surgeons Association, ECHSA Congenital Database; echsacongenitaldb.org) содержит сведения о непосредственных результатах 4 277 операций резекции коарктации аорты с расширенным анастомозом «конец-в-конец», проведенных в европейских госпиталях новорожденным и детям первого года жизни с изолированной КА и сочетанием КА и дефекта межжелудочковой перегородки с 1999 г. по настоящее время. График выполнен с использованием фильтров и инструментов базы данных (рис. 3). Учитывая тот факт, что отделение предоставляет в ECHSA Congenital Database сведения о выполненных операциях на регулярной основе, мы можем констатировать, что объем вмешательств превышает среднюю величину с летальностью ниже средней в госпиталях Европы, участвующих в данном проекте.
До 75% пациентов, нуждающихся в устранении КА, имеют некоторую степень гипоплазии дуги [3, 6, 7, 22]. У новорожденных детей коарктация аорты чаще, чем в других возрастных группах, сочетается с гипоплазией дуги различной степени выраженности, которая может формироваться вследствие ограничения прямого кровотока по дуге, в том числе вместе с другими внутрисердечными дефектами [23]. Достаточно изучены способности роста гипопластичной дуги, в том числе при устранении КА путем резекции и создания расширенного анастомоза из бокового доступа [7, 24–26]. Авторы продемонстрировали, что даже гипопластичная дуга адаптируется к возросшему объему кровотока, что сопровождается ее отчетливым ростом [27, 28].
J.Y. Liu с коллегами считают, что необходимо оценивать рост проксимальной и дистальной дуги отдельно, так как дистальная дуга демонстрирует более устойчивый рост, чем проксимальная [11]. В настоящем исследовании, однако, продемонстрирован адекватный рост гипопластичной дуги аорты как в проксимальном, так и в дистальном отделах поперечной дуги аорты. Мы полагаем, что эти данные позволяют для достижения положительных результатов во многих наблюдениях избежать операций с искусственным кровообращением в периоде новорожденности, которые могут сопровождаться серьезными осложнениями со стороны центральной нервной системы, снижающими качество жизни в целом [29–32]. У пациентов с выраженной гипоплазией всей поперечной дуги аорты при Z-score менее –6 вопрос об оптимальном способе хирургической коррекции должен решаться индивидуально [33].
Среди осложнений представленного метода хирургической коррекции КА в раннем послеоперационном периоде описаны кровотечение, парез возвратного нерва, сепсис, легочный гипертензионный криз, хилоторакс, неврологические события в виде судорожного синдрома [8]. Нами был отмечен незначительный процент (2,4%) послеоперационных осложнений, что также позитивно характеризует эту хирургическую технику. Рекоарктация аорты является самым распространенным осложнением отдаленного периода наблюдения после хирургической коррекции КА. По данным литературы, рекоарктация аорты возникает у 4–19% пациентов после операций в периоде младенчества [11, 17, 21]. Причины развития этого осложнения до конца не выяснены. Исследователи полагают, что более частое возникновение повторного сужения просвета аорты может быть связано с высоким исходным градиентом систолического артериального давления, дефектами хирургической техники, наличием резидуальной дуктальной ткани в просвете аорты или пролиферацией неоинтимы [11, 21, 34]. На возникновение повторного сужения также, безусловно, могут влиять исходная анатомия с гипоплазией дуги, степень ее выраженности и протяженности, варианты хирургической техники коррекции [6, 34]. Наибольшая частота возникновения рекоарктации аорты наблюдается у детей, оперированных в возрасте до 1 года, причем независимо от варианта хирургической техники [35, 36]. Анализируя частоту повторного сужения аорты после резекции КА из бокового доступа, мы отметили невысокую частоту этого осложнения, что сопоставимо с данными других исследователей [18–21, 33] (табл. 2). При анализе баллонной ангиопластики зоны повторного сужения аорты в отдаленном послеоперационном периоде мы, как и другие исследователи, отметили высокую эффективность и техническую простоту при устранении рекоарктации аорты [20, 37]. У пациентов с коарктацией и дефектом межжелудочковой перегородки двухэтапная хирургическая стратегия также сопровождалась отличными клиническими результатами в представленной популяции пациентов. Эта стратегия позволила нам избежать операции с искусственным кровообращением в периоде новорожденности и дала возможность пациентам с сопутствующей перинатальной, неврологической и соматической патологией между двумя хирургическими вмешательствами достичь устойчивой компенсации, что, есть основания полагать, улучшило результаты хирургического лечения.
Ограничения Исследование ограничено ретроспективным характером и выборкой изучаемых пациентов. Характеристика результатов резекции КА с расширенным анастомозом «конец-в-конец» дана в среднеотдаленном периоде наблюдения, при этом анатомические характеристики анализированы с использованием только трансторакальной эхокардиографии. Сведения, полученные с помощью ангиографии и магнитно-резонансной томографии в этой группе пациентов, могут способствовать дальнейшему детальному изучению результатов метода. Изучение отдаленных результатов устранения КА с применением метода резекции с расширенным анастомозом «конец-в-конец» является проспективным процессом, мы продолжим их анализ, в том числе с акцентом на потенциальный риск артериальной гипертензии, особенно в группе детей с исходной гипоплазией поперечной дуги и пациентов с повторными сужениями аорты.
Заключение Резекция КА с расширенным анастомозом «конец-в-конец» из бокового доступа сопровождается низкой операционной летальностью, отличной выживаемостью и низкой частотой реинтервенций в течение 8 лет послеоперационного наблюдения. В когорте пациентов с исходной гипоплазией поперечной дуги аорты отмечен рост дуги до нормальных значений. Эндоваскулярная баллонная дилатация зоны повторного сужения аорты в отдаленном послеоперационном периоде является эффективной и безопасной процедурой.
Финансирование Исследование не имело спонсорской поддержки.
Конфликт интересов Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов Концепция и дизайн: В.Н. Ильин Сбор и анализ данных: М.М. Беляева, О.Ю. Корноухов, Ю.Ю. Корноухов, О.И. Калинина Написание статьи: М.М. Беляева Исправление статьи: В.Н. Ильин., О.Ю. Корноухов Утверждение окончательной версии для публикации: М.М. Беляева, В.Н. Ильин, О.Ю. Корноухов, Ю.Ю. Корноухов, О.И. Калинина
КоА
Коарктация аорты — это порок развития сосудов, заключающийся в сужении или полном закрытии просвета аорты на ограниченном участке.
При этом происходит нарушение общего кровообращения.
Коарктация аорты является одним из частых врожденных пороков сердца.
С учетом локализации патологического сужения различают коарктацию в области перешейка, восходящей, нисходящей, грудной, брюшной аорты. Некоторые источники выделяют следующие анатомические варианты порока — предуктальный стеноз (сужение аорты проксимальнее впадения ОАП) и постдуктальный стеноз (сужение аорты дисталтнее впадения ОАП).
По критерию множественности аномалий сердца и сосудов А. В. Покровский классифицирует 3 типа коарктации аорты:
1 тип — изолированная коарктация аорты (73%);
2 тип – сочетание коарктации аорты с ОАП; с артериальным или венозным сбросом крови (5%);
3 тип – сочетание коарктации аорты с другими гемодинамически значимыми аномалиями сосудов и ВПС (12%).
В естественном течении коарктации аорты выделяют 5 периодов:
I (критический период) — у детей до 1 года; характеризуется симптомами недостаточности кровообращения по малому кругу; высокой смертностью от тяжелой сердечно-легочной и почечной недостаточности, особенно при сочетании коарктации аорты с другими ВПС.
II (приспособительный период) — у детей от 1 до 5 лет; характеризуется уменьшением симптоматики недостаточности кровообращения, которая обычно представлена повышенной утомляемостью и одышкой.
III (компенсаторный период) – у детей от 5 до 15 лет; характеризуется преимущественно бессимптомным течением.
IV (период развития относительной декомпенсации) – у пациентов 15-20 лет; в периоде полового созревания нарастают признаки недостаточности кровообращения.
V (период декомпенсации) – у пациентов 20-40 лет; характеризуется признаками артериальной гипертензии, тяжелой лево- и правожелудочковой сердечной недостаточности, высокой летальностью.
Прогноз коарктации аорты
Естественное течение коарктации аорты определяется вариантом сужения аорты, наличием других ВПС и в целом имеет крайне неблагоприятный прогноз. При отсутствии кардиохирургической помощи 40-55% больных погибает на первом году жизни. При своевременном хирургическом лечении коарктации аорты хороших отдаленных результатов удается достичь у 80-95% больных, особенно если операция проведена в возрасте до 10 лет.