Стремительное развитие реконструктивной кардиохирургии и появление современных каркасных перикардиальных биопротезов позволили получить отличные отдаленные результаты лечения пороков сердца и решить одну из серьезных проблем реконструктивной хирургии корня аорты [1]. На сегодняшний день для определения оптимальной тактики реконструктивной операции и получения хороших результатов в ближайшем и отдаленном периоде хирургу необходимы надежные критерии принятия решения в пользу установки каркасного протеза или осуществления реконструкции корня аорты. Отсутствие таких критериев приводит к тому, что нередко окончательное решение о возможности сохранения собственного аортального клапана (АК) хирург принимает только во время операции, руководствуясь при этом результатами визуальной оценки степени дегенеративно-дистрофических изменений стенки аорты и кальциноза полулунных заслонок, а не дооперационными геометрическими характеристиками АК [2]. До сих пор остается актуальной оценка взаимосвязи недостаточности клапана с величинами углов отклонения межзаслончатых структур А.К. Трудно переоценить важность выработки четких рекомендаций для достижения оптимальной замыкательной функции АК и критериев восстановления правильной геометрии структур корня аорты после реконструктивных операций. Клиническое значение имеет корреляция между морфометрическими характеристиками, которые можно оценить при интраоперационной ревизии, и геометрическими параметрами, полученными до операции [3]. Очевидно, что определение оптимального соотношения линейных и угловых характеристик АК позволит не только решить, подходит ли клапан для реконструкции, но и установить интервалы значений морфометрических параметров реконструированного корня аорты, в пределах которого будет сохраняться оптимальная кооптация заслонок после операции [4].
Известно, что дегенеративные изменения стенок восходящей части аорты приводят к ее дилатации и снижению прочностных характеристик, способствуют деформации АК с нарушением замыкательной способности полулунных заслонок [5, 6]. При этом риск развития подобных патологических изменений увеличивается, если полулунный клапан имеет две заслонки, что встречается в 1—2% в популяции [7]. Наличие двузаслончатого аортального клапана (ДАК) сочетается с дилатацией корня аорты и восходящей ее части, сопровождается цистомедианекрозом, фрагментацией эластических волокон и изменениями в ориентации гладкомышечных клеток в стенке артериальных сосудов [5]. Существует мнение, что при ДАК главным предиктором развития аортальной недостаточности является увеличение диаметра синусов корня аорты [8]. Другие исследователи считают, что, кроме этого, большое влияние на развитие нарушения функции ДАК оказывает не только увеличение диаметра синуса корня аорты, но и расширение восходящей аорты [9]. Кроме того, при наличии ДАК имеются нарушения свойств соединительной ткани, которые в любом случае влияют на деформационно-прочностные характеристики не только АК, но и стенки аорты [10].
Очевидно, что анатомо-клинические исследования морфометрических параметров клапана аорты позволят по-новому взглянуть на проблемы реконструктивной коррекции врожденных и приобретенных заболеваний клапанов аорты.
Цель работы — провести комплексное морфометрическое исследование линейных и геометрических параметров АК и определить, изменение каких параметров сочетается с неполным смыканием полулунных заслонок АК и дилатацией корня аорты.
УЗИ аорты в брюшной полости
УЗИ брюшной аорты показания, проведение, расшифровка результатов
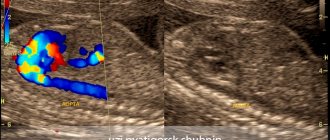
Для диагностики брюшной зоны аорты применяется УЗИ. Методика дает возможность узнать о наличии нарушений кровотока, повреждений или изменений стенок сосуда. Данная процедура выполняется с УЗДГ (допплерографией).
УЗИ брюшной аорты: что оно из себя представляет?
Во время процедуры врач-УЗИ будет исследовать зону от последнего грудного позвонка до крестца. Стандартное УЗИ не дает возможности оценить состояние сосудов в полном объеме, поэтому для диагностики аорты применяется допплерография. В её основе которой лежит возможность отражения волн ультразвука от предметов, находящихся в движении.
Во время допплерографии ветви аорты и она сама окрашиваются в разные цвета, что помогает специалисту УЗИ сделать заключение о состоянии кровотока.
В каких случаях проводится диагностика аорты?
Главной задачей в рамках проведения данной процедуры является обнаружение аневризмы. Для нее характерно истончение стенки сосуда и появление мешочка. Это приводит к неправильному кровотоку в сосуде. Заболевание опасно разрывом стенки сосуда и обильным кровотечением.
Диагностику брюшной аорты проводят в следующих случаях:
- Появление пульсирующей боли в голове;
- Наличие у пациента артериальной гипертензии;
- Сильные болевые ощущения в животе с левой стороны, переходящие в поясницу;
- Наличие проблем с памятью у пациента;
- Изменение формы живота;
- Беспричинная тошнота и многократная рвота;
- Наличие кровяных выделений в кале;
- Наличие пульсации в средней части живота;
- Понижение или повышение давления;
- Ранее перенесенный инфаркт или инсульт;
- Подозрение на аневризму у курящего пациента.
Как правильно подготовиться к процедуре?
Если вам было назначено исследование брюшной части аорты ультразвуковым методом, то к нему следует правильно подготовиться. Перед подобным УЗИ следует обязательно произвести очищение кишечника и провести профилактику метеоризма. При отсутствии подготовки исследование может быть неинформативным, так как исследуемый объект находится за кишечником, и, если он будет полон, увидеть артерию будет практически невозможно.
Начинать готовиться к УЗИ следует за 3 дня до предполагаемого исследования. В это время следует придерживаться определенных правил питания, а также принимать определенные лекарства. Из рациона нужно полностью исключить продукты, которые могут стать причиной появления газов: кисломолочные продукты, бобовые/горох, хлеб (черный), капуста.
При необходимости за 2 дня до исследования доктор порекомендует препараты, которые улучшают пищеварение.
За 1 день до УЗИ в вечернее время следует очистить кишечник естественным путем или при помощи клизмы.
Последний раз можно есть за 8 часов до УЗИ. Последний раз пить можно за 2 часа до исследования.
Подготовка не осуществляется только в случае поступления пациента в больницу с жалобами на острую боль в области живота. В таком случае может потребоваться экстренная помощь, а время на подготовку может отрицательно отразиться на здоровье пациента.
Как проводится УЗИ аорты?
Не стоит бояться, исследование полностью безболезненное и безопасное, проводится так же как простое УЗИ. Во время УЗИ пациент лежит на спине. Специалист УЗИ водит ультразвуковым датчиком по животу, осуществляя диагностику брюшного отдела аорты. Длительность процедуры около получаса.
За процессом процедуры исследуемый может наблюдать на большом экране, который находится напротив кушетки. При необходимости врач УЗИ задает необходимые вопросы и комментирует происходящее на экране. Сразу после исследования выдается заключение. Для назначения лечения или его корректировки необходимо обратиться к лечащему доктору, который направлял на УЗИ.
Заболевания, которые могут выявлены во время ультразвукового исследования брюшной части аорты: расслоение аорты (для которой характерен разрыв стенок); аневризма (будет отчетливо заметно истощение стенки брюшной артерии); окклюзия (нарушение проходимости сосудов, на снимке можно будет заметить обрыв кровотока); атеросклероз (появление холестериновых бляшек, специалист УЗИ их диагностирует по утолщению стенки артерии); стеноз (главная ветвь аорты сужается); кальциноз (образование солей кальция).
Как расшифровывать исследование?
Благодаря допплерографии можно получить информацию о точных размерах сосудов, выявить те или иные патологии, определить возможность риска их возникновения, понять скорость кровотока и детально изучить места с затрудненным кровотоком.
Брюшная аорта не должна быть больше 3 сантиметров в толщину. При меньшем диаметре высока вероятность наличия атеросклероза или стеноза. При диаметре более 3 сантиметров—подозрение на аневризму. Врач УЗИ осуществляет исследование аорты, диагноз ставит только врач, назначивший диагностику.
Если размер брюшной аорты будет превышать 5 сантиметров, будет назначена операция для того, чтобы убрать причину патологии. В ином случае она может быть опасна для жизни пациента.
Процедура назначается пациентам, предрасположенным к сердечно-сосудистым заболеваниям, а также в пожилом возрасте. При выявлении патологии на раннем этапе ее развития, и назначении соответствующего лечения, шансы на скорейшее выздоровление увеличиваются.
Запущенные патологии кровотока довольно сложно поддаются лечению и в большинстве случаев предполагают хирургическую операцию.
УЗИ брюшной аорты в Нижнем Новгороде.
В Нижнем Новгороде диагностика аорты посредством УЗИ проводится в клинике «Академия VIP». Исследование выполняется на новейшей УЗИ установке сертифицированным специалистом.
Стоимость ультразвукового исследования УЗИ брюшного отдела аорты.
Цена на УЗИ аорты в медицинском является среднегородской. Доступность данного метода диагностики позволяет своевременно выявить и предотвратить опасные для жизни заболевания. Для патологий брюшного отдела аорты характерны кровопотери, а также поражение жизненно важных органов организма. Именно благодаря своевременной качественной ультразвуковой диагностики и работе хирургов, во многих случаях пациентам удавалось сохранить жизнь.
При назначении врачом данной процедуры, ни в коем случае не следует его игнорировать.
Записаться на УЗИ брюшной аорты в клинику «Академия VIP» можно через администраторов по номеру: +7 (831) 200-47-38.
МСКТ аорты в Инновационном сосудистом центре
Мультиспиральная компьютерная ангиография брюшной аорты широко применяется врачами нашей клиники для предоперационной диагностики проблем с аортой и ее ветвями. Данная технология позволяет распланировать хирургическое вмешательство, подобрать правильный размер стент-графта при аневризме аорты и инструмент для прохождения хронических окклюзий. Мы так же используем МСКТ для оценки послеоперационных результатов после стентирования или резекции аневризмы аорты, состояния сосудистых реконструкций в отдаленном периоде.
Статистический метод. Статистические методы использовались для идентифицирования и оценки факторов риска для следующих прогнозов: ежегодный средний рост аневризмы, частота осложнений (острое расслоение и/или разрыв), смертность и выживаемость в отдаленные сроки.
Анализ выживания. Пятилетние оценки выживания были рассчитаны анализом таблицы жизни (Kaplan-Meier). Различия в выживании были проверены посредством LIFEREG процедуры в версии 6.07 SAS, 1994 (SAS Institute, Inc, Кари Н. С.).
График выживаемости Kaplan-Meier. Пятилетние оценки выживания иллюстрированы для пациентов с грудными аортальными аневризмами (ГАА) против общего (согласованного с возрастом и полом) населения (ОН).
Результаты и обсуждение. Joyce J.W. et al. [21] сообщили о пятилетней выживаемости при аневризмах восходящей грудной аорты с диаметром 6 см или меньше в 61% случаев; аневризмы больше чем 6 см имели пятилетнюю выживаемость в 38% случаях. Полное пятилетнее выживание в нашем ряде наблюдалось в 64% случаев. Смертность, как полагают, будет связана с аневризмой в огромном большинстве случаев, хотя адекватные детали для этого различия были часто недоступны. Выживание значительно ниже при аневризмах нисходящей аорты (39% за 5 лет) (p=0.031). Пациенты с расслоением имели более низкую выживаемость (46% за 5 лет).
Параметры роста. Определенный ежегодный рост для грудных аортальных аневризм составил 0,29 см/год. Это находится в близком соотношении с результатами, о которых сообщает Dapunt O.E. et al. [26] (0,32 см/год). Masuda Y. et al. [27] информировали о норме роста для грудных аортальных аневризм – 0,13 см/год. Hirose Y. et al. [28] приводят высокую ежегодную норму роста – 0,42 см/год для грудных аортальных аневризм. В последующем изучении, однако, Hirose Y. et al. [28] привели существенно более низкую норму.
Несоответствие в двух изучениях [28] может вполне объяснить различные использованные стратегии для оценки роста. В последних исследованиях Hirose Y. [28] применяемые регрессы приближаются к используемым Dapunt O.E. et al. [26] и в текущем изучении, при оценке роста грудной аортальный аневризмы. Более ранними изучениями группой Hirose Y. [28] вычислено, что рост равен различию между последним и первым измеренным размером, разделенным на продолжительность между исследованиями.
Размер традиционно рассматривался как важный фактор риска для осложнений (то есть острого расслоения и/или разрыва) у пациентов с грудными аневризмами, и это считалось самым важным независимым фактором в решении планового хирургического вмешательства. Влияние размера на величину роста аневризм – предмет дискуссий. Dapunt O.E. et al. [26] отмечают, что более интенсивные расширения были найдены у тех пациентов, у которых аортальный диаметр при диагнозе был >5 см. С другой стороны. Hirose Y. et al. [28] не нашли никакого существенного влияния размера на интенсивность ростa.
Dapunt O.E. et al. [26] сообщили, что наличие гипертонии, коррелирует с большим аортальным диаметром, но значительно не затрагивает норму роста аортального расширения. Masuda Y. et al. [27] сообщили о прямой связи между величиной диастолического давления и степенью аортального расширения.
Вероятность осложнений. Важно рассмотреть естественное течение болезни у пациентов с грудными аневризмами, т.е. случаи острого расслоения и/или разрыва у этого контингента. Pressler V., McNamara J.J. [22] сообщили, что у восьми из девяти случаев разрывов нисходящих грудных аортальных аневризм размеры аорты были больше 10 см. В последующих изучениях сообщается об осложнениях при намного меньших размерах. В исследованиях Gott V.L. et al [11], при аневризмах восходящей аорты у пациентов с синдромом Марфана, указывается средний размер – 7,8 см во время расслоения.
Однако у семи из 26 пациентов (26,9%) расслоения наблюдались при размерах аневризм 6,5 см или меньше. Кроме того, Crawford E.S. et al. [9] сообщили о среднем размере во время разрыва – 8,0см среди 117 пациентов с нисходящими грудными и торакоабдоминальными аневризмами. Dapunt O.B. et al. [26] информируют о разрывах грудных аневризм, встречающихся в еще меньших размерах, со средним размером 6,1см.
Эти наблюдения свидетельствуют о расслоениях или разрывах при расширяющихся размерах аневризм. Средним размером во время разрыва или расслоения было 6,0 см для восходящих аневризм и 7,2см для нисходящих. Производился многовариантный ретроспективный анализ с намерением изолировать факторы риска для острого расслоения или разрыва, который показал, что размер больше 6,0 см увеличивает вероятность расслоения или разрыва на 32,1 % для восходящих аневризм (p=0.005). Для нисходящих аневризм, эта вероятность увеличилась на 43 % при размере больше 7,0 см (p=0.006). Frist W.H. et al. [33] выдают следующие данные для восходящих и нисходящих аневризм: 6см для восходящей аорты и 7см для нисходящей.
Критерии для хирургического вмешательства.
Ниже мы попытались продемонстрировать важность грудного размера аневризмы при грозных осложнениях, таких как разрыв и расслоение аорты. Нашими наблюдениями мы пытаемся продемонстрировать четко увеличивающуюся частоту осложнений с увеличением аортального размера. Эти наблюдения показывают, что средний размер при разрыве и расслоении составляет 6,0 см для восходящих аневризм и 7,2 см для нисходящих. Многовариантный анализ факторов риска, влияющих на острое расслоение и/или разрыв, показывает, что размер больше 6,0 см является существенным фактором риска (p=0.005). Логистический анализ указывает 32,1% увеличение вероятности расслоения или разрыва для восходящих аневризм при среднем размере больше 6,0см (p=0.005) и 43,0% увеличение для нисходящих аневризм больше 7,0см (p=0.006).
Эти данные настоятельно требуют применения критерия размера для хирургической замены аневризматической аорты, чтобы предотвратить осложнения разрыва и расслоения. Кроме того, эти данные говорят о том, что следует применять более низкий критерий размера, чем предварительно зарекомендованные.
Если средний размер во время осложнения (в этом случае: 6,0см для восходящей и 7,2см для нисходящей аорты) будет применен как интервенционный критерий, то у половины пациентов во время вмешательства с большой вероятностью будут наблюдаться грозные осложнения. Соответственно, авторы предлагают вмешательство при критериях несколько ниже среднего размера во время осложнения. Предлагается, чтобы хирургическое вмешательство было применено при размере 5,5см для восходящей и 6,5см для нисходящей аортальных аневризм. Эти вышепредложенные критерии позволяют произвести вмешательство перед катастрофически увеличенной вероятностью разрыва и/или расслоения.
Эти рекомендации указывают, что плановая операция намного более безопасна, чем экстренное вмешательство. Для восходящих аневризм и аневризм дуги аорты, плановая операция была весьма безопасна (смертность 4,3%). Эти результаты смертности широко совместимы с теми, о которых сообщают и другие центры. Хотя операция на нисходящей аорте имеет более высокий риск (19%), но количество пациентов в этой категории является относительно меньшим, чтобы влиять на конечный результат.
Множество вышеприведенных данных показали, что операция на восходящей аорте более безопасна. ИК через левопредсердно-бедренную канюляцию с использованием центробежного насоса показал, что он является безопасным и надежным методом для предотвращения п/о осложнений: ишемизированные осложнения типа почечной недостаточности и повреждения спинного мозга. Кроме того, появление ингибитора протеазы (апротинин) п ривело к существенному сокращению потери крови в результате защиты рецепторов стенки тромбоцита в начале ИК. Выпуск пропитанного коллагеном дакронового протеза привел (Hemashield Meadox Medicals Inc, Окленд, N.J.) к улучшению хирургического гемостаза, фактически устраняя кровотечение через стенку протеза. Эти факты говорят в пользу приоритетного избирательного вмешательства для избежания разрыва и расслоения аневризм.
Для нисходящих аортальных аневризм нужно рассмотреть риск параплегии как существенное интраоперационное осложнение. Риск параплегии (спинномозгового генеза) в литературе остается между 2 и 20%, в этом случае составляет 4.0%. Очевидно, что пожилой возраст и сопутствующие болезни могут привести к частым осложнениям, при которых не показано хирургическое вмешательство. Таким образом, каждый пациент должен быть оценен индивидуально, и ожидаемый риск осложнений (особенно параплегия при нисходящих аортальных аневризмах) должен быть взвешен во избежание таких осложнений, как разрыв и расслоение. Кроме того, должен быть принят во внимание уровень врачей в рассматриваемом медицинском центре. Критерии размера, представленные здесь, предложены для менее тяжелых пациентов, вылеченных в более опытных центрах.
Исследования пациентов с синдромом Марфана.
Больше чем 90% смертельных случаев при синдроме Марфана связаны с осложнениями аневризм восходящей аорты. Поскольку большинство пациентов с синдромом Марфана имеет некоторую степень аортальной недостаточности (корень аорты – 6,0см), Готт, Лима и соавторы рекомендуют профилактическое лечение при аневризмах, достигающих 5,5–6,0см. Мы рекомендуем интервенционный критерий 5,0см для пациентов с синдромом Марфана, другими наследственными коллагеновыми заболеваниями сосудов или семейными случаями аортальной недостаточности.
Этот критерий размера несколько ниже, чем рекомендации для вмешательства при атеросклеротических аневризмах восходящей аорты. Опыт показывает, что у нескольких пациентов с синдромом Марфана расслоение или разрыв произошли при размерах меньше 5,0см. Эти молодые больные часто находились в тяжелом клиническом состоянии. Таким образом, профилактическое хирургическое лечение может существенно улучшить их клиническое состояние и прогноз.
Разработка интервенционных критериев – это комплекс исследовательских усилий. Исследование этой проблемы является важным для повышения выживаемости пациентов. Чтобы определить соответствующие критерии размера для вмешательства, мы прибегли к помощи статистического анализа. В этих интервенционных критериях должны учитываться возраст пациента, физическое состояние, ожидаемая продолжительность жизни, то есть приблизиться к критериям вмешательства, используя статистические методы с точки зрения предотвращения осложнений (расслоение и разрыв). Давление органа аневризмой, сопутствующая аортальная недостаточность и острое расслоение аорты являются широко принятыми общими признаками для хирургического вмешательства независимо от аортального размера.
Некоторые точки зрения все еще обсуждаются в хирургии хронической болезни восходящей аорты: какую методику использовать при лечении (открытый или методику обертки, прямая или опосредованная реимплантация коронарных артерий), как предохранять мозг во время восстановления дуги аорты. Когда корень аорты был включен в план операции, обычно исполнялась имплантация клапаносодержащего кондуита, используя методику обертки с реимплантацией коронарных артерий и дакроновый трансплантат (8мм). Только клапанное протезирование не предохраняет от рецидивов аневризмы восходящей аорты, ведя к повторной операции. При этом повторные операции имеют высокую смертность.
Некоторые авторы использовали методику обертки. По поводу кровотечения вероятность ранней повторной операции низка – 4,5% в этом ряде и может быть сравнена с данными Kouchoukos N. (2% — открытая методика). У исследуемых больных не было необходимости повторных операций при псевдоаневризмах восходящей аорты.
Реимплантация коронарных магистралей с использованием дакронового трансплантата (8мм) кажется более надежной и технически легко осуществимой, чем прямая реимплантация или реимплантация с аортальными пуговками. Kouchoukos N. [7] Taniguchi K. et al. [12] сообщается о появлении псевдоаневризм в коронарном устье после этих операций [12,13].
Поэтому есть мнение, что использование дакронового трансплантата предотвращает появление этих осложнений (как показано стандартной коронарографией). Образовавшиеся правопредсердные фистулы закрылись, за исключением одного случая, когда потребовалась повторная операция. В девяти случаях, когда был имплантирован трубчатый графт, была зафиксирована внезапная смерть от неизвестной причины (вскрытие трупов не было выполнено). Возможность ложных аневризм или фистул, приводящих к смерти, не исключалась.
Восстановление дуги аорты всегда показано, когда аневризма переходит на дугу аорты, когда участок расслоения простирается на дугу или когда разрыв интимы локализован на дуге (2 случая в этом ряде). Авторам кажется, что остановка гипотермического ИК приводит к неврологическим осложнениям. Griepp R.B. et al. сообщили о коэффициенте (5,6%) неврологических осложнений у 87 больных [15]. Авторы предпочитают остановку гипотермического ИК при выборочной катетеризации магистральных сосудов головного мозга.
30-дневная смертность отмечалась у 7,6 % больных и 6% — с протезированием (использовались клапаносодержащие кондуиты). Galloway A.C. et al. [6] было сообщено о похожих цифрах летальности, соответственно 5,3 и 5%.
Многие анализы также указывают, что сопутствующая трансплантация коронарных артерий и пожилой возраст являются главными факторами риска, что показано и другими авторами. Выживаемость оставляет желать лучшего у больных, которые подвергаются хирургическому вмешательству при хронической болезни восходящей аорты: 48% за 12 лет у Kouchoukos N.T. et al. [13] и 57% за 7 лет у Culliford A.T. [34]. В этом ряде полное выживание – 59,6%±3,7% за 9 лет для всех больных и 66,3%±4,5% за 9 лет для больных с протезированием клапаносодержащим кондуитом (включена также интраоперационная смертность).
Преобладающая причина поздней смертности не была обнаружена в этом ряде. Факторами, увеличивающими риск, что показано одномерным анализом, являются: время ИК, восстановление дуги аорты, хроническое расслоение аорты и пожилой возраст.
Заключение
Коарктация аорты у плода. Точность и ошибки диагностики
УЗИ аппарат HS40
Лидер продаж в высоком классе.
Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Большинство врожденных пороков сердца (ВПС) относятся к заболеваниям, ставящим под угрозу здоровье или жизнь новорожденного. Опыт российских и зарубежных коллег показывает, что частота врожденных пороков сердца колеблется от 10 до 13 случаев на 1000 новорожденных, из них 4:1000 составляют сложные ВПС. В нашей стране средняя частота ВПС колеблется от 8-9 до 11-13 случаев на 1000 живорожденных. От сердечной патологии в раннем младенчестве погибает до 50% новорожденных.
Распределение диагностики ВПС в зависимости от нозологической формы значительно варьирует. Определенные ВПС пренатальная диагностика позволяет выявить в 90% случаев. Цифры статистики неумолимо показывают низкий процент выявления ВПС (30%) по результатам скринингового исследования. В специализированных учреждениях частота выявления ВПС выше и достигает 54% [1, 2].
Точность ультразвуковой диагностики патологии плода за последние годы многократно подвергается критике со стороны акушеров-гинекологов и в большей степени педиатров. Порой клинические признаки интересуют специалистов значительно меньше, чем данные ультразвукового антенатального исследования плода.
В этой работе представлен анализ возможностей ультразвукового пренатального исследования при коарктации аорты. В работе учтены данные, имеющиеся в публикациях отечественных и зарубежных авторов, а также материал отделения функциональной диагностики Центра.
Латинский термин «сoarctatius» означает «суженный, стиснутый». Впервые его описал J.F. Meckel в 1750 году. Коарктация аорты — это патологическое сужение ее просвета, которое может возникнуть в любом месте по всей ее длине. Частота порока составляет 6,3%, по данным клинических наблюдений из выборки в 2000 случаев [3], и 8,4% по результатам патологоанатомического материала [4].
У детей первого года жизни коарктация аорты занимает четвертое место cреди ВПС. Как правило, она развивается дистальнее места ответвления левой подключичной артерии вблизи артериального протока (ductus arteriosus). В зависимости от локализации сужения аорты относительно артериального протока различают два классических типа коарктации: предуктальную и постдуктальную [5].
При наличии сужения аорты клиническая картина может нарастать как шквал после закрытия артериального протока. В течение первого года погибают 56% пациентов. В основном смертельный исход бывает вызван сочетанием коарктации с другими аномалиями сердца. Изолированная форма в первые недели и дни жизни также характеризуется высоким процентом смертности (34%). Если этот период дети переживают, то продолжительность жизни в среднем составляет 30-50 лет. Причиной смерти у новорожденных является сердечно-легочная недостаточность. При артериальной высокой гипертензии, как исключение, может быть кровоизлияние в мозг.
В ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В.И. Кулакова » Минсоцразвития РФ за двухлетний период (2010-2011) родились 27 детей с аномалиями аорты, от незначительного сужения до полного перерыва. В 15 наблюдениях в отделении функциональной диагностики диагноз был поставлен антенатально. Это были беременные, обратившиеся в поздние сроки от 35 до 39 нед гестации. Во всех наблюдениях патология аорты сочеталась с гипоплазией левого желудочка. Диагноз был подтвержден во всех случаях. В изолированном виде коарктация аорты за этот период была диагностирована в 6 наблюдениях. В 3 из них диагноз был поставлен антенатально, в 2 — сужение было выявлено у новорожденных на 3-5-е сутки после закрытия артериального протока. В одном случае после рождения был поставлен диагноз кинкинг аорты. Таким образом, наши данные свидетельствуют о сложности и невысоком проценте выявления изолированной коарктации аорты. Лишь в тех наблюдениях, когда имеются выраженные гемодинамические нарушения, приводящие к значительным анатомическим изменениям в виде гипоплазии левого желудочка, диспропорции желудочков сердца, увеличения диаметра легочной артерии диагноз с большой достоверностью может быть поставлен антенатально.
Первые работы по диагностике коарктации аорты у плода относятся к 1984 г. [6, 7]. По данным литературы, трансвагинальный доступ в 12-15 нед гестации позволяет диагностировать коарктацию аорты в 21,4% случаев [1]. При трансабдоминальном доступе частота выявления коарктации аорты увеличивается: в 16-30 нед она составляет 43%, после 30 нед, по мере прогрессирования гемодинамических нарушений, не превышает 54% [8].
Согласно результатам скринингового ультразвукового обследования 20 248 плодов при сроках 19-22 нед беременности в крупном регионе Германии (1990-1994) пренатальный диагноз коарктации аорты не был установлен ни в одном из 7 случаев. Аналогичные данные были получены в Норвегии, даже в специализированном центре пренатальной диагностики. Согласно данным мультицентрового анализа, проведенного в 12 европейских странах, точный пренатальный диагноз изолированной коарктации аорты в конце 90-х гг. был установлен только в 9 (15,8%) из 57 случаев [9]. Средний срок обнаружения изолированной коарктации составил 22 нед, при этом 7 из 9 случаев было выявлено до 24 нед. При сочетании коарктации аорты с экстракардиальными пороками и хромосомными аномалиями точность ее пренатальной диагностики была существенно выше за счет выраженности гемодинамических нарушений и расширенного эхокардиографического исследования плода и составила 52%.
По данным института сердечно-сосудистой хирургии им. А.Н. Бакулева, точность диагностики не превышает 27%. Как правило, патология наиболее часто отмечается при сочетании коарктации аорты с другими кардиальными аномалиями [10].
Таким образом, обобщая статистические данные материала Центра, публикации ведущих специалистов России и зарубежных коллег, можно отметить очень низкий процент диагностики коарктации аорты у плода.
В чем же причина столь низкого процента выявления коарктации аорты антенатально?
Существует несколько факторов, затрудняющих диагностику коарктации аорты антенатально.
Первая причина не диагностированной коарктации аорты это морфогенез патологии и теория первичного нарушения развития дуги аорты. Теория была предложена в 1828 г. [11]. Автор считает, что данная патология связана с недостаточным соединением 4 и 6 дуги аорты с нисходящим ее отделом. Поэтому перешеек — это место, где наиболее часто локализуется участок сужения [12], так как оба отдела образуются из разных эмбриональных зачатков. В норме область перешейка аорты равна 2/3 диаметра восходящего отдела аорты (рис. 1).
Рис. 1.
Восходящий отдел, дуга и нисходящий отдел аорты плода в режиме энергетического допплера в норме.
Согласно «теории дуктальной ткани» коарктация аорты возникает в результате миграции гладких мышечных клеток протока в предуктальную аорту, с последующей констрикцией и сужением просвета аорты [4]. При формировании коарктации аорты в области перешейка сохраняется сужение различной протяженности и формы (рис. 2, 3). Наиболее часто это проявляется в виде локальной перетяжки, выше или ниже которой диаметр аорты сохраняется в норме.
Рис. 2.
Ультразвуковое исследование восходящего отдела, дуги и нисходящего отдела аорты. Стрелкой указано место сужения.
Рис. 3.
Трехмерное изображение сердца и аорты плода в 16 нед беременности. Стрелкой указано место сужения аорты. AO DESC — нисходящий отдел аорты, COR — сердце.
Следовательно, оценка сужения аорты в типичном месте как признак развивающейся патологии не всегда представляется возможной в ранние сроки беременности. Поскольку речь идет о предуктальной коарктации аорты (сужение аорты локализовано проксимальнее протока), то, очевидно, что в период внутриутробной жизни в более поздние сроки отмечается снижение кровотока через левые отделы сердца и перешеек аорты и развивается гипоплазия левого желудочка и аорты. Это и способствует более позднему проявлению патологии и возможности ее ультразвуковой диагностики.
Вторая причина, затрудняющая диагностику коарктации аорты — это теория постнатального развития. У плода перешеек аорты узкий и после рождения и закрытия артериального протока он должен в норме расшириться для обеспечения адекватного кровотока в нисходящий отдел аорты. Таким образом, имеющееся физиологическое сужение перешейка аорты не позволяет предположить формирование коарктации аорты после рождения.
Постдуктальная коарктация развивается уже после рождения и практически всегда представляет собой изолированный дефект. Эта аномалия, вероятнее всего, является результатом разрастания мышечной ткани артериального протока в аорту плода. Когда же проток после рождения сужается, эктопическая ткань внутри аорты также сжимается, перекрывая, как тампоном, просвет сосуда по всей его окружности. В отличие от предуктальной коарктации в данном случае гипоплазия аорты не развивается. Закрытие артериального протока у некоторых детей приводит к наличию сужения аорты и развитию коарктации через 2-3 нед после рождения [13].
Третья причина не диагностированной коарктации аорты состоит в особенностях внутрисердечной гемодинамики у плода. Кровообращение плода, так же, как и взрослого, подчиняется ряду основных закономерностей физического и биологического воздействия. Поток крови движется из зоны высокого давления в область низкого давления. При выраженном потоке размеры увеличиваются, при уменьшении объема потока уменьшаются. Так, гипоплазия левого желудочка и коарктация аорты часто сопутствуют порокам со сниженным выбросом крови в аорту (стеноз аорты, дефект межжелудочковой перегородки) и практически не встречаются при пороках с большим объемом потока через аорту (при тетраде Фалло).
Исходя из особенностей внутрисердечной гемодинамики плода, для диагностики коарктации аорты были предложены косвенные признаки патологии в антенатальном периоде: дилатация правого желудочка и его гипертрофия (см. рис. 3), дилатация легочной артерии [6, 7, 14]. Авторы считают, что это достоверные признаки и встречаются они достаточно часто (в 18 из 24 случаев верифицированных диагнозов коарктации аорты). Поэтому была предложена оценка индексов отношения полости правого желудочка к левому (в норме — 1,1) и легочной артерии к аорте (у здоровых — 1,2). Исходя из увеличения этих параметров, можно предположить наличие затрудненного выброса в аорту или гипоплазию дуги аорты. Тем не менее, по данным предложивших эти косвенные признаки авторов, такие изменения выявляются только в 30% наблюдений (рис. 4).
Рис. 4.
Диспропорция размеров желудочков сердца при коарктации аорты. RV — правый желудочек; LV — левый желудочек; AO DESC — поперечное сечение нисходящего отдела аорты.
Во второй половине 90-х гг. было опубликовано несколько работ, посвященных изучению диагностической ценности увеличения правого желудочка и уменьшения левого желудочка при коарктации аорты. Авторы, опубликовавшие эти результаты [2], считают, что чем раньше проводится исследование (от 14-16 до 25 нед гестации), тем оно информативнее для диагностики коарктации аорты. Доказательством могут служить данные, полученные D. Brown и соавт. [15]. В представленных исследованиях коарктация аорты отмечена у 8 (62%) из 13 плодов с диспропорцией размеров желудочков до 34 нед и только у 6 (21%) из 29 плодов после 34 нед беременности. Несмотря на то, что более половины случаев коарктации аорты сопровождается диспропорцией размеров желудочков, что достаточно легко выявляется при изучении четырехкамерного среза сердца плода, во многих исследованиях в Норвегии она не была диагностирована, даже при обязательном скрининговом изучении размеров сердца до 18 нед беременности [9].
Такие прoтиворечивые результаты можно объяснить гемодинамической теорией [16, 17]. Внутриутробно в восходящий отдел аорты поступает 50% суммарного выброса крови, в нисходящую — 65%, а через перешеек аорты всего лишь 25%. Исходя из уменьшенного объема кровотока возникает его физиологическое сужение, которое усугубляется лишь после рождения.
Допплеркардиография, позволяющая оценить кровоток, информативна лишь при выраженном сужении аорты [18]. При этом возникает обратная зависимость максимальной скорости кровотока в восходящем и нисходящем отделах аорты. В норме скорость в восходящем отделе немного преобладает над скоростью нисходящего отдела.
При перерыве дуги аорты отмечается ретроградный кровоток заполнения участка дуги аорты после перерыва через открытый артериальный проток и отсутствие прямого кровотока на уровне перерыва.
И, наконец, последняя причина не диагностированной коарктации аорты заключается в частоте сочетания с другими аномалиями сердца. Изолированная коарктация аорты составляет всего лишь 15-18%. По данным M. Campell и P. Polani [19], процент сочетания коарктации аорты с кардиальными аномалиями колеблется от 13 до 18%. Наиболее часто (85%) коарктация аорты сочетается с двустворчатым аортальным клапаном [20], нередко сочетается с фиброэластозом эндомиокарда, распространяющимся на выходной тракт левого желудочка и на межжелудочковую перегородку. Возможно, при коарктации аорты аномальное отхождение правой подключичной артерии или обеих подключичных артерий от нисходящей аорты, дистальней коарктации (5%).
Наличие сопутствующей кардиальной патологии может нивелировать типичные для коарктации гемодинамические изменения со стороны сердца плода, на которые обязательно обращает внимание специалист при ультразвуковом исследовании.
Существует еще и понятие как псевдокоарктация, или «кинкинг» аорты — деформация аорты, аналогичная классической коарктации, но препятствие кровотоку незначительное, так как имеется простое удлинение и извилистость аорты (рис. 5).
Рис. 5.
Кинкинг аорты у плода в 34 нед беременности. Исследование в энергетическом режиме.
Итак, становится очевидным, что практически ни один из ультразвуковых признаков в антенатальном периоде не имеет высокой степени диагностической точности.
Известно, что диагноз данного порока сердца опирается на прямой признак — визуализацию места сужения аорты, и, возможно, расширение проксимального отдела аорты. Однако четко визуализировать участок сужения аорты у плода достаточно трудно и удается только в единичных наблюдениях. Порок можно увидеть лишь тогда, когда имеется уменьшение диаметра перешейка аорты более чем на 1/3 по сравнению с нормой для каждого срока беременности (см. рис. 2, 3).
Ключом к пренатальной диагностике коарктации аорты является комплексный учет данных, получаемых как при изучении четырехкамерного среза сердца (дилатация правого желудочка, гипоплазия левого желудочка), так и при оценке самих главных артерий. При наличии коарктации диаметр аорты в среднем в 2 раза меньше диаметра дилатированной легочной артерии. Поэтому для диагностики коарктации аорты следует использовать визуализацию самой аорты, что наиболее целесообразно при скрининговой оценке среза через три сосуда. Помощь в диагностике может оказать измерение диаметра артериального протока, который при коарктации аорты широкий.
Окончательный диагноз коарктации аорты устанавливается при использовании среза через дугу аорты, так как чаще всего сужение аорты отмечается в области ее перешейка — на уровне впадения артериального протока. Следует отметить, что сужение может охватывать большой участок аорты вплоть до тубулярной гипоплазии. Нормальный переход дуги аорты в артериальный проток в норме гладкий и плавный. Кроме того, при исследовании аорты по длинной оси наиболее надежным признаком следует считать гипоплазию поперечной части дуги аорты. Как один из косвенных признаков коарктации аорты можно использовать извилистость дуги аорты при изучении ее по длинной оси [2].
Важное дополнительное значение имеет допплерэхокардиографическое исследование, которое при коарктации орты позволяет выявить ускорение и турбулентный характер кровотока в аорте. Однако в антенатальном периоде этот признак может не проявиться [2]. Более надежно выявление левоправого шунта через овальное окно. Предполагается, что этот шунт является компенсаторным механизмом, обеспечивающим уменьшение потока крови в левый желудочек и аорту. G. Sharland и соавт. [18] отметили левоправый шунт через овальное окно у 7 из 12 плодов с коарктацией аорты. У оставшихся 5 плодов обнаруживалось как левоправое, так и праволевое направления потоков крови через овальное окно.
В случаях резко выраженных анатомических изменений аорты и функции левого желудочка с увеличением постнагрузки может наблюдаться сердечная недостаточность [21]. Нарушения гемодинамики и сердечная недостаточность характеризуются антенатально наличием выпота в перикарде, уменьшением сердечного выброса с уменьшением размеров левого желудочка [22].
После рождения и закрытия артериального протока весь поток крови поступает в восходящий отдел аорты и перешеек расширяется до нормального уровня. После рождения, когда проток перекрывается, коарктация аорты приводит к серьезными клиническим проявлениям.
Итак, анализ возможностей и ошибок ультразвуковой диагностики коарктации аорты в пренатальном периоде показывает насколько проблематично поставить диагноз во всех случаях данного порока сердца у плода. К сожалению, все эхокардиографические антенатальные признаки патологии не обеспечивают высокий процент диагностики.
Хочется надеяться, что развитие новых технологий и накопление позитивного и анализ негативного опыта позволят в будущем повысить процент диагностики такого сложного порока сердца с высокой неонатальной смертностью.
Литература
- Bronshtein M., Zimmer E.Z. Sonographic diagnosis of fetal coarctation of aorta at 14-16 weeks of gestation // Ultrasound Obstetric Gynecologie. 1998. N 11. Р. 254-257.
- Allan L.D., Cook A.C., Huggon I.C. Fetal Echocardiographiy. A practical guide. Cambridge University Press. 2009. P. 258.
- Frederiksen T. Coarctation of the aorta. A genetic study // Acta genet.1963. V. 13. Р. 263.
- Банкл Г. Врожденные пороки сердца и крупных сосудов. М.: Медицина, 1980.
- Oztunc F., Eroglu A.G., Aksoy F. et al. Antenatal diagnosis of posductal coarctation of the aorta report // Turk journal Pediatr. 2001. V. 43. N 1. P. 67-69.
- Allan L.D., Crawford D.C., Tynan M. Evolution of coarctation of the aorta in intrauterine life // Br. Heart J. 1984. V. 52. P. 471.
- Allan L.D., Crawford D.C., Anderson R.H. et al. Echocardiography and anatomical correlations in fetal congenital heart disease // Br. Heart J. 1984. V. 52. P. 542.
- Franklin O., Burch M., Manning N. et al. Prenatal diagnosis of coarctation of the aorta improves survival and reduces morbility // Heart. 2002. V. 87. N 11. P. 67-69.
- Norbenger L.K., Sahn D.J., Kleimann C.S. et al. Antenatal diagnosis of coarctation of the aorta: a multicenter experience // J. Am. Coll. Cardiologie. 1994. V. 23. P. 417-423.
- Беспалова У.Д., Суратова О.Г., Тюменева А.И., Гасанова Р.М. Ультразвуковая диагностика врожденных пороков сердца у плода / Под ред. Бокерия Л.А. М., 2009.
- Rosenberg H. Coarctation of the aorta; Morphology and pathogenesis considerations. In: Perspectives in Pediatric Pathology. V. 1. Chicago, Year Book, 1974.
- Patten B.M. The changes in circulation after birth // Am. Heart J. 1930. V. 6. P. 192.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. М.: Медицина, 1989.
- Allan L.D., Chita S.K, Anderson R.H, Fagg N., Crawford D.C., Tynan M.J. Coarctation of the aorta in prenatal life: and echocardiographic, anatomical and functional study // Brit. Heart J. 1988. V. 59. P. 356.
- Brown D.L., Durfee S.M., Hornberger L.K. Ventriculal disgrepancy as a sonographic sign of coarctation of the aorta: how reliable is it? // J. Ulytrasound Med. 1997. V. 16. N 2. P. 95-99.
- Rudolf A., Heyman M.A., Spitznas U. Hemodynamic consideratiоns in the developement of narrowing of the aorta // Am. J. Cardiolog. 1972. V. 30. P. 514.
- Palmer N.S., Berman M.A. Postnatal developement of obstruction in coarctation of the aorta; Role of the ductus arteriosus // Pediatrics. 1975. V. 56. P. 462.
- Sharland G.K., Chan K.Y., Allan L.D. Coarctation of the aorta:difficulties in prenatal diagnosis // Br. Heart J. 1994. V. 71. Р. 70-75.
- Campell M., Polani P.E. Etiology of coarctation of the aorta // Lancet. 1961. V. 1. P. 473.
- Edwards J.E., Burchell H.B. The pathologic anatomy of deficiency betwen the aortic rood and the heart including aortic sinus aneuvrysms // Thorax 1957. V. 12. P. 125.
- Rudolph A.M. Congenital Diseases of the Heart: Clinical-Physiologic Considerations in Diagnosis and Management. Chicago-Year Book. 1974.
- Kleimman C.S., Donnerstein R.L., De Vore G.R. et al. Fetal echocardiography for evaluation of in utero congestive heart failure: A technique for study of nonimmune fetal hydrops. N. Engl. J. Med. 1982.
УЗИ аппарат HS40
Лидер продаж в высоком классе.
Монитор 21,5″ высокой четкости, расширенный кардио пакет (Strain+, Stress Echo), экспертные возможности для 3D УЗИ в акушерско-гинекологической практике (STIC, Crystal Vue, 5D Follicle), датчики высокой плотности.
Материал и методы
Исследование проведено на 123 сердцах, взятых на вскрытии в городских патологоанатомических и судебно-медицинских отделениях от трупов больных обоего пола в возрасте от 28 до 87 лет (35 мужчин и 57 женщин), умерших от причин, не связанных с заболеваниями и ранениями сердца. Сердца извлекали единым комплексом вместе с легкими, средостением, диафрагмой и органами верхнего отдела брюшной полости. Камеры сердца промывали теплой водой для удаления тромбов и сгустков крови. Через канюлю, вставленную в грудную аорту, после перевязки крупных сосудов дуги аорты и коронарных артерий нагнетали раствор теплой воды под постоянным гидростатическим давлением 0,18 бар, что эквивалентно 140 мм рт.ст. с целью определения недостаточности АК. В случаях, когда давление в аорте быстро падало, такие сердца относили к группе с недостаточностью аортального клапана (2-я группа), составившей 15 сердец. Остальные сердца были отнесены к контрольной группе с сохраненной замыкательной функцией клапана (1-я группа), составившей 108 сердец. Фиксацию препаратов осуществляли методом непрерывной перфузии 8% раствора формалина, вводимого через канюлю в аорту под давлением 0,18 бар (140 мм рт.ст.) и в верхнюю полую вену под давлением 0,02 бар (15 мм рт.ст.) в течение 5 дней.
Для исследования использовали методы морфометрии на свежефиксированных препаратах, на препаратах, изготовленных методом силиконовой пластинации при комнатной температуре, а также на препаратах сердец, у которых камеры и крупные сосуды были заполнены полимеризовавшейся окрашенной силиконовой композицией с добавлением рентгеноконтрастного свинцового сурика. В дополнение к морфометрии инъецированные и пластинированные сердца исследовали методами компьютерной и магнитно-резонансной томографии.
Для приготовления инъекционной окрашенной рентгеноконтрастной силиконовой композиции использовали смесь 92 массовых частей силикона марки СКТН Е, 5 массовых частей свинцового сурика и 3 массовые части отвердителя К-1. Все компоненты тщательно перемешивали до получения однородной массы непосредственно перед инъекцией. Через канюлю, установленную в восходящую часть аорты, вводили рентгеноконтрастную композицию под давлением 100 мм рт. ст., что способствовало замыканию А.К. Левый желудочек и левое предсердие заполняли через канюлю, установленную в ушко левого предсердия, под давлением 20 мм рт.ст., что позволило заполнить левые камеры сердца и сохранить их естественную форму. Для ускорения полимеризации силикона органокомплекс сердца с легкими погружали в теплую воду на 3—4 ч. Эта методика инъекции позволяла сохранить взаимоотношения исходной геометрии корня аорты и внутрисердечных структур левых отделов сердца при закрытом А.К. После отвердения силикона выполняли компьютерную томографию инъецированного сердца, после которой применяли модифицированные методики препарирования и морфометрии.
На всех препаратах измеряли длину окружности поперечного сечения восходящей части аорты, синотубулярного соединения (СТС), базального кольца АК, длину основания и высоту межстворчатого треугольника АК (рис. 1),
Рис. 1. Фотография параметров межстворчатого треугольника А.К. Аорта и левые камеры инъецированы силиконом. 1 — длина основания межзаслончатого треугольника; 2 — высота межзаслончатого треугольника. а также величину угла отклонения межзаслончатого треугольника (рис. 2).
Рис. 2. Трехмерная реконструкция АК на мультиспиральной компьютерной томограмме. Угол отклонения (α) межзаслончатого треугольника АК от плоскости продольного сечения восходящей части аорты. Также рассчитывали площадь межзаслончатого треугольника и регургитации АК по формулам:
S
тр.=
p
(
p
–
a
)(
p
–
b
)(
p
–
c
),
S
рег.=π·
r
2,
где S
тр. — площадь треугольника;
а
,
b
,
с
— стороны треугольника;
p
— полупериметр треугольника; где
S
рег. — площадь регургитации;
r
— радиус регургитации.
Измерение угла отклонения межзаслончатых треугольников АК от плоскости продольного сечения корня аорты проводили с помощью мультиспиральной компьютерной томографии (МСКТ) препаратов (см. рис. 2). Основанием межзаслончатого треугольника является прямая линия, проведенная от нижней точки прикрепления одной полулунной заслонки к стенке аорты к нижней точке прикрепления другой. Вершиной межзаслончатого треугольника является верхняя точка комиссуры заслонки АК.
После проведения измерений оценивали заслонки АК на предмет наличия комиссуральных фенестраций. Особое внимание обращали на участки заслонок в месте их прикрепления к стенке аорты и к вершине межзаслоночного треугольника. Оценку морфологических изменений проводили по степени дегенеративных изменений: I степень — наличие изменений только в полулунных заслонках (истончение, изменение цвета, атеросклеротические изменения) без их кальциноза; II степень — наличие изменений в полулунных заслонках (истончение, изменение цвета, атеросклеротические изменения) в сочетании с фенестрациями в комиссуральных областях заслонок и/или наличие кальциноза стенки аорты; III степень — наличие изменений в полулунных заслонках (истончение, изменение цвета, атеросклеротические изменения) в сочетании с фенестрациями в комиссуральных областях заслонок и наличие кальциноза в межзаслончатых треугольниках.
Статистическую обработку полученных данных проводили с помощью программы IBM SPSS (Statistical Package for the Social Sciences) версия 20.0 для Windows. Применяли метод множественного логистического регрессионного анализа. Уровень статистической значимости различий принят за 0,05.