Сегодня для лечения многих заболеваний применяют не только медпрепараты, физиопроцедуры и оперативное вмешательство. Ежегодно появляются инновационные методы, и один из них – искусственные жидкости, аналоги натуральных человеческих. Именно о таком средстве и идет речь, когда говорят о «протезе синовиальной жидкости». Его введение в полость сустава не только купирует симптомы артроза, но и воздействует на первопричину.
Протезы на основе гиалуроновой кислоты выпускаются в одноразовых шприцах для однократного использования
Как это работает
Стерильный раствор протеза вводят внутрь суставной капсулы, где он становится заменителем естественной синовиальной жидкости. Средство улучшает физиологические характеристики сочленений, пораженных артрозом:
- нормализует эластичность и вязкость природной смазки;
- восстанавливает метаболизм в тканях и гидродинамику в суставах;
- улучшает питание тканей вокруг хрящей и костей;
- уменьшает механическое воздействие на сустав;
- поддерживает адекватную работу хряща.
Протез компенсирует недостаток естественной синовиальной жидкости в суставе
Как долго сохраняется эффект?
После прохождения курса внутрисуставных инъекций эффект сохраняется в среднем на несколько месяцев – от 6 до 12. Один курс предполагает 3-5 уколов с определенным интервалом. Как долго продлится лечебный эффект, зависит от тяжести поражения и молекулярной массы вещества.
Протезы синовиальной жидкости приносят максимальный положительный результат на начальных стадиях артроза. Если дегенеративно-дистрофические изменения серьезно прогрессировали, полностью восстановить хрящевую ткань не удастся. Восполнение объема и вязкости синовиальной жидкости смягчит симптоматику и предотвратит осложнения.
Протезы синовиальной жидкости помогают отсрочить оперативное вмешательство на суставе
Использованная литература
- Национальные клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Ассоциация флебологов России, 2013-2017. — 51 с.
- Зубаиров, Д.М. Молекулярные основы свертывания крови и тромбообразования, 2000. — 360 с.
- Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных, 2021. — 10 с.
- Egan, G., Ensom, M. Measuring anti-factor xa activity to monitor low-molecular-weight heparin in obesity: a critical review. Can J Hosp Pharm., 2015. — Vol. 68(3). — P. 33-47.
- Berges, A., Laporte, S., Epinat, M. et al. PROPHRE.75 Study Group. Anti-factor Xa activity of enoxaparin administered at prophylactic dosage to patients over 75 years old. Br J ClinPharmacol., 2007. — Vol. 64(4). — P. 428-38.
- Guyton, C., Hall, E. Textbook of Medical Physiology. 13th Edition, 2015. — P. 1075-1093
Кому показаны
С 2003 года ВОЗ официально рекомендует применять препараты на основе гиалуроновой кислоты для лечения легких и умеренных форм остеоартроза. Чаще всего к методике прибегают, когда консервативные способы оказываются малоэффективными.
Главные показания к применению протезов – дегенеративные и посттравматические заболевания суставов (артроз, остеоартроз, деформирующий артроз), которые сопровождаются болезненным дискомфортом и тугоподвижностью.
В целях профилактики инъекции назначают для того, чтобы приостановить прогрессирование в хряще деструктивных процессов, когда возрастные изменения в суставах приводят к дефициту естественной смазки.
Протезы синовиальной жидкости – настоящая находка для людей старшей возрастной категории
Гепарин гель я 1000ме/г 30г №1
Наименование
Гепарин гель 1000ЕД/1г 30г
Описание
Гель от бесцветного до светло-желтого цвета со специфическим запахом.
Основное действующее вещество
Гепарин натрия
Форма выпуска
Гель
Дозировка
1000ЕД/1г
Фармакологическое действие
Фармакологические исследования показывают, что при наружном применении гель Гепарин обладает выраженным противоэкссудативным, противоотечным, антигрануломатозным, противовоспалительным и антикоагулянтным действием.
Показания к применению
— симптоматическое лечение и уменьшение отеков и кровоподтеков после тупой травмы (например, после ушиба); — симптоматическое лечение заболеваний поверхностных вен (варикозное расширение, флебит, перифлебит, тромбофлебит), варикозных язв, варикофлебита, состояния после удаления большой подкожной вены бедра в составе комплексной терапии.
Способ применения и дозы
1-3 раза в день на пораженный участок кожи наносят 3-10 см геля и осторожно втирают. Из-за ограниченного опыта применения препарата у детей и по причине того, что имеется недостаточное количество данных исследований, использовать этот препарат при лечении детей не следует.
Применение при беременности и в период лактации
Применение при беременности возможно только по показаниям под медицинским контролем. Возможно применение при лактации по показаниям.
Влияние на способность к управлению автотранспортом и другими потенциально опасными механизмами
Препарат не влияет на способность управлять транспортными средствами и потенциально опасными механизмами.
Меры предосторожности
При наличии признаков кровотечения следует тщательно взвесить возможность применения геля Гепарин. Гель Гепарин не следует применять при кровотечениях, наносить на открытые раневые поверхности, мокнущую экзему или на слизистые оболочки, а также на инфицированные участки при наличии гнойных процессов. Проникновение гепарина в здоровую кожу описано в случае местного применения; поэтому при подозрении на тромбоэмболические осложнения должна быть проведена проверка количества тромбоцитов для дифференциальной диагностики гепарин-индуцированной тромбоцитопении типа II. Таким образом, регулярная проверка количества тромбоцитов у пациентов с тромбоэмболическими осложнениями в анамнезе необходима при каждом применении гепарина (перед началом приема гепарина, в первый день после начала применения и затем регулярно каждые 3-4 дня в ходе лечения вплоть до его окончания). Гель Гепарин содержит в качестве вспомогательных веществ метилпарагидроксибензоат и пропилпарагидроксибензоат, поэтому его нельзя применять у пациентов с аллергией на парабены.
Применение в педиатрии
Из-за ограниченного опыта применения препарата у детей и по причине того, что имеется недостаточное количество данных исследований, использовать гель при лечении детей не следует.
Взаимодействие с другими препаратами
Противосвертывающее действие гепарина усиливается при одновременном применении антикоагулянтов, антиагрегантов и нестероидных противовоспалительных препаратов. Алкалоиды спорыньи, тироксин, тетрациклин, антигистаминные средства и никотин уменьшают действие гепарина.
Противопоказания
— известная гиперчувствительность к гепарину или любому компоненту лекарственного средства; — гепарин-индуцированная тромбоцитопения типа II (ГИТ типа II, опосредованная иммунитетом) в анамнезе.
Состав
на одну тубу: активное вещество — гепарина (в виде гепарина натрия) — 1000 МЕ/г; вспомогательные вещества — карбопол 980 NF, левоментол, метилпарагидроксибензоат (Е-218), пропилпарагидроксибензоат (Е-216), спирт этиловый ректификованный из пищевого сырья, триэтаноламин, вода очищенная.
Передозировка
В связи с малой системной абсорбцией передозировка маловероятна. До настоящего времени явления передозировки при использовании геля Гепарин не описаны. При длительном применении на большие поверхности возможны геморрагические осложнения. Лечение: отмена препарата. При необходимости применяют антагонист гепарина — протамина сульфат (1% раствор).
Побочное действие
Аллергические реакции на гепарин после нанесения препарата на кожу очень редки. Однако в отдельных случаях могут наблюдаться реакции повышенной чувствительности, такие как покраснение кожи и зуд, которые быстро исчезают после прекращения применения препарата. Частота возникновения гепарин-индуцированной опосредованной антителами тромбоцитопении типа II (количество тромбоцитов
Условия хранения
Хранить при температуре не выше 25°C. Хранить в недоступном для детей месте.
Купить Гепарин гель д/нар.прим.1000МЕ/г в тубах 30г в уп №1 в аптеке
Цена на Гепарин гель д/нар.прим.1000МЕ/г в тубах 30г в уп №1
Инструкция по применению для Гепарин гель д/нар.прим.1000МЕ/г в тубах 30г в уп №1
Есть ли противопоказания
Инъекции препаратов на основе гиалуроновой кислоты противопоказаны, если:
- в суставе есть локальное воспаление, поскольку на фоне воспалительного процесса гиалуроновая кислота разрушается и не действует;
- в анамнезе есть аутоиммунные патологии, так как организм с нарушенным иммунным ответом может отреагировать на подобную терапию отрицательно;
- зафиксирована непереносимость синовиальной жидкости животного происхождения (чтобы предупредить серьезные аллергические реакции вплоть до анафилактического шока, необходимо пройти тест на переносимость аналога);
- пациенту еще не исполнилось 18 лет.
Во время беременности и лактации инъекции протезов гиалуроновой жидкости противопоказаны
Краткие сведения о гепарине
Гепарин производится российскими, украинскими и белорусскими фармакологическими предприятиями в форме геля и инъекционного раствора.
В качестве основного действующего компонента выступает гепарин натрия с добавлением дополнительных веществ.
Являясь антикоагулянтом прямого действия, гепарин совместно с другими лекарственными средствами способен устранить следующие проблемы:
- тромбы в сосудах;
- эмболию;
- мерцательную аритмию;
- нестабильную стенокардию;
- тромбогеморрагический синдром;
- митральный порок сердца;
- подкожные гематомы и прочее.
В силу своей способности поддерживать жидкое состояние крови, гепарин используется при ее очистке (гемодиализе), в процессе искусственного кровообращения и для проведения лабораторных исследований.
К основным противопоказаниям применениям гепарина относят:
- индивидуальную непереносимость;
- повышенную кровоточивость;
- патологические изменения в печени и почках;
- лейкозы;
- период беременности и кормления ребенка грудью;
- внутричерепные повреждения;
- язвенные поражения ЖКТ и др.
Гепарин назначается лечащим врачом, исходя из симптомов заболевания и отсутствия противопоказаний.
Применение Гепарина может привести к таким проблемам:
- аллергическим реакциям;
- тромбоцитопении;
- расстройству желудка, рвоте;
- кровотечениям;
- язвам и гематомам на кожной поверхности при применении средства местного воздействия.
При возникновении побочных эффектов, неэффективности препарата, а также возникновении побочных эффектов препарат следует заменить на лекарство с аналогичными характеристиками.
На полках аптек находится достаточное количество лекарственных средств, схожих по своему воздействию с гепарином.
К чему готовиться: бывают ли осложнения
Средства на основе гиалуроновой кислоты иногда вызывают нежелательные реакции:
- зуд и жар в месте инъекции;
- раздражение кожи;
- крапивница;
- припухлость мягких надсуставных тканей;
- болезненность в близлежащих мышцах;
- онемение и покалывание в конечности (при лечении гонартроза);
- местные воспалительные реакции;
- редко – анафилактический шок.
Каждый организм реагирует на терапию индивидуально, поэтому невозможно быть на 100 % уверенным в успехе лечения. Инъекции должны проводиться в условиях медкабинета, под наблюдением специалиста. Процедура технически отличается от стандартных внутримышечных инъекций и выполняется под контролем УЗИ. Делать ее должен ревматолог или травматолог-ортопед, имеющий соответствующие навыки.
Протезы чаще всего вводятся в коленные, тазобедренные и плечевые суставы
Подробное описание исследования
Система свертывания крови (гемостаз) осуществляет защиту организма от кровопотери. Как правило, процесс свертывания — коагуляции — активируется в результате повреждения кровеносных сосудов.
В основе системы свертывания лежит взаимодействие клеток крови (тромбоцитов) и специальных белков (факторов свертывания), которое приводит к образованию кровяного сгустка, остановке кровотечения и восстановлению целостности сосудов. К факторам свертывания относят: IIa (тромбин), XII, XI, X, Xa и др.
В норме с течением времени кровяной сгусток удаляется, и проходимость кровеносных сосудов восстанавливается. Вследствие некоторых заболеваний происходит образование патологических кровяных сгустков — тромбов. Тромбы, которые отделяются («отрываются») от сосудистой стенки и распространяются с током крови по организму, называют эмболами. Опасность эмболов заключается в том, что они могут перекрыть просвет сосуда и полностью остановить кровоток в органе или его части. К тромбоэмболическим осложнениям могут приводить следующие состояния и заболевания:
- Тромбозы вен нижних конечностей;
- Онкологические заболевания;
- Послеоперационный период, особенно после обширных хирургических вмешательств;
- Выраженная хроническая сердечная недостаточность, инфаркт миокарда;
- Заболевания легких с тяжелой дыхательной недостаточностью;
- Инфекционно-токсический шок (сепсис);
- Ожирение;
- Беременность и первые 6 недель после родов;
- Длительный постельный режим, гиподинамия;
- Нефротический синдром и др.
Для профилактики и лечения тромбообразования в клинической практике применяют различные препараты антитромботической группы, в частности, антикоагулянты — лекарства, уменьшающие свертываемость крови. К ним относят гепарины, которые, в свою очередь, подразделяются на нефракционированные (НФГ) и низмолекулярные (НМГ). Оба вида гепаринов препятствуют образованию и распространению тромбов, однако НФГ имеют больше нежелательных эффектов. Поэтому предпочтение в клинической практике отдается НМГ.
Механизм действия обоих препаратов основан на усилении противосвертывающей активности антитромбина III (белка плазмы) и на инактивации свертывающих факторов IIa, Xa и некоторых других. В результате этого свертывание крови уменьшается. Однако возникает риск развития кровотечений при минимальном повреждении стенки сосудов, что привело к необходимости контроля терапии у пациентов, получающих гепарин или НМГ.
Исследование анти-Xa-активности направлено на определение эффективности лечения препаратами из группы гепарина (НФГ и НМГ). Также проведение этого анализа актуально и у пациентов, которые принимают другие лекарственные средства, ингибирующие Xa-фактор — ривароксабан, апиксабан и другие пероральные антикоагулянты прямого действия.
В основе теста лежит т.н. хромогенная аналитика: в лабораторных условиях производят взаимодействие между исследуемым образцом плазмы с фактором Xa. На основе остаточного фактора Xa, выявленного при помощи хромогенного субстрата, определяют графическую кривую с количественным показателем препарата.
Полученный результат необходимо сопоставить с типом принимаемого антикоагулянта и его дозой. Для пациентов, принимающих низкомолекулярные гепарины, данный анализ является одним из базовых методов оценки эффективности терапии. Обычно исследование проводят спустя 3-4 часа после введения НМГ. Для пероральных антикоагулянтов прямого действия показатели могут изменяться — от 1-го до 4-х часов после применения препарата.
Производители протезов синовиальной жидкости на основе гиалуроновой кислоты
| Название продукта | Страна-производитель |
| Ферматрон | Великобритания |
| Синвиск | США |
| Гиалуром CS | Румыния |
| Синокорм | Австрия |
| Виско Плюс | Швеция |
| Гоу-он | Ирландия |
| Остенил | Германия |
| Гируан-Плюс | Корея |
| РусВиск, Гиастат | Россия |
Препараты на основе гиалуроновой кислоты очень разные по действию. Как отличаются между собой эти средства, насколько эффективны лекарства разных производителей – мнение специалиста, подкрепленное аргументами доказательной медицины:
Флеботоники в терапии хронической венозной недостаточности нижних конечностей
В настоящее время практикующие врачи становятся свидетелями бурного развития фармацевтического рынка в нашей стране. Новые препараты как зарубежного, так и отечественного производства появляются достаточно регулярно. Арсенал фармакологических средств, применяемых для лечения того или иного заболевания, постоянно растет, что создает определенные трудности в их выборе. Ситуация еще более осложняется тем, что различные фирмы-производители, как правило, дают свои наименования препаратам, в основе которых лежит одно и то же действующее вещество. В этом обилии информации первостепенно важным является знание и выделение основных звеньев патогенеза заболевания, на основе чего вырабатываются принципы и тактика лечения.
Сегодня все шире распространяется ошибочное мнение о всемогуществе лекарств. Причин для этого много, и не будет преувеличением в качестве основной из них назвать активную рекламу того или иного фармакологического препарата со стороны фирмы-производителя. Вследствие этого многие пациенты, особенно пожилого возраста, принимают с десяток различных препаратов, периодически путаясь в дозировках и частоте их применения, а с каждым посещением врача меняют этот «набор таблеток» и при этом несут весьма ощутимые денежные потери.
Проблема неадекватного назначения лекарственных препаратов не обошла стороной и сферу лечения хронической венозной недостаточности (ХВН) нижних конечностей. Если всего несколько десятилетий назад хирургический метод лечения был ведущим и даже более того считался единственным заслуживающим серьезного внимания, то сейчас нередко наблюдается другая крайность — попытки преподнести фармакотерапию как основу лечения, а остальные методы лечебного воздействия считать дополнением к «фармакотерапевтическому базису».
Учитывая вышесказанное, считаем необходимым определить тактику применения современных флеботропных препаратов у пациентов с ХВН нижних конечностей. Флеботропные препараты являются базисными в лечении ХВН. Безусловно, тяжелые нарушения оттока из нижних конечностей обусловливают необходимость применения препаратов других фармакологических групп — дезагрегантов, нестероидных противовоспалительных средств, антибиотиков, энзимов и др. Однако к их назначению следует подходить с осторожностью, а период их использования должен быть четко ограничен реализацией той или иной задачи лечения.
Основными целями медикаментозного лечения при ХВН нижних конечностей являются: купирование симптомов ХВН, предотвращение осложнений, профилактика в группах риска, предоперационная подготовка, послеоперационная реабилитация.
Исходя из патогенеза ХВН нижних конечностей, задачи консервативной терапии можно представить следующим образом: повышение тонуса венозной стенки, улучшение лимфооттока, воздействие на микроциркуляторные изменения, коррекция гемореологических нарушений, купирование воспалительных проявлений.
Как уже говорилось выше, флеботропные препараты являются основой медикаментозного лечения больных с ХВН. Это достаточно большая группа фармакологических препаратов, обладающих способностью увеличивать венозный отток из нижних конечностей. Данный эффект флеботропных препаратов достигается путем суммирования воздействий на различные звенья микроциркуляторного русла, а у многих из них — прямым действием на сократимость венозной стенки. Безусловно, флеботоническое воздействие следует признать основным эффектом флебопротективных препаратов. Однако все они обладают поливалентным механизмом действия: стимулируют лимфоотток, обладают противовоспалительной активностью, улучшают гемореологию. Именно эта особенность, позволяющая воздействовать на основные звенья патогенеза ХВН, объединила многие препараты в группу флебопротекторов и сделала их базовыми в консервативном лечении пациентов с ХВН нижних конечностей.
Когда следует назначать флеботропные препараты? Показанием к применению флебопротективных средств является наличие симптомов ХВН нижних конечностей. Необходимо сразу предостеречь врачей от весьма распространенной ошибки. Развитие острого нарушения оттока крови при тромбозе вен нижних конечностей не требует применения этой группы фармакологических средств. Более того, использование флеботоников следует считать противопоказанным у пациентов с острым венозным тромбозом. Венозная стенка при остром тромботическом процессе маловосприимчива к флеботоническому воздействию, а его реализация только усугубит остро возникшие нарушения оттока крови.
В дальнейшем, в случае развития посттромботической болезни, когда процессы посттромботической окклюзии и реканализации в различных венозных сегментах уравновесятся, когда сформируются патологические венозные рефлюксы крови и, следовательно, будет иметь место та или иная степень ХВН, показания к назначению флебоактивных препаратов следует считать оправданными.
Безусловным показанием к применению флебопротекторов являются так называемые функциональные (ортостатические и гормонпродуцируемые) флебопатии. В этих случаях изменение образа жизни с исключением продуцирующего фактора, прием флеботоников и эластическая компрессия дают отчетливый положительный эффект.
И наконец, использование флебопротективных препаратов, безусловно, показано при варикозной болезни вен нижних конечностей — заболевании, являющемся наиболее частой причиной развития ХВН.
У пациентов с ранними стадиями варикозной болезни, когда симптомов декомпенсации оттока крови еще нет, а превалируют жалобы эстетического характера, основной целью применения флебопротекторов является главным образом профилактика прогрессирования заболевания. Флеботоники таким пациентам целесообразно назначать короткими (1–1,5 мес) курсами. Интервал между курсами фармакотерапии должен составлять 3–4 нед.
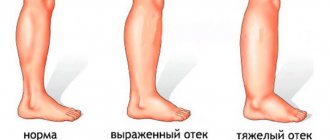
Появление отеков нижних конечностей — достоверный признак декомпенсации оттока крови. У больных с отечным синдромом задачами фармакотерапии являются: купирование проявлений ХВН (отеков, тяжести в нижних конечностях), улучшение лимфооттока, коррекция микроциркуляторных расстройств, профилактика прогрессирования заболевания. Больным с декомпенсацией оттока крови флеботоники назначают более длительными курсами (2–2,5 мес). Временной интервал между курсами не должен превышать 1 мес.
У пациентов с трофическими расстройствами мягких тканей нижних конечностей следует особо тщательно подходить к выбору программы консервативной терапии. Выраженность трофических изменений кожи диктует необходимость назначения препаратов, относящихся к различным фармакологическим группам, а стадийность раневого процесса и склонность больных к аллергическим реакциям — тщательного индивидуального подбора лекарственных средств. Показания к применению различных групп препаратов зависят от многих факторов, в том числе от стадии и тяжести течения заболевания, риска развития осложнений. Средства медикаментозного лечения должны назначаться в зависимости от фазы раневого процесса.
На первом этапе, когда преобладают проявления острого воспаления и деструкции мягких тканей, основными целями применения фармакологических препаратов являются быстрое устранение симптомов воспаления, борьба с инфекцией. В этот период проводят терапию нестероидными противовоспалительными средствами (диклофенак, индометацин, кетопрофен, мелоксикам и др.), дезагрегантами (ацетилсалициловая кислота, дипиридамол, клопидогрель), антигистаминными препаратами (кетотифен, клемастин, прометазин), антиоксидантами (витамин Е, эмоксипин, милдронат). Длительное время считалось, что для применения антибиотиков абсолютным показанием служит наличие трофической язвы нижних конечностей. В настоящее время взгляды на эту проблему несколько изменились. Показания к проведению антибактериальной терапии: обширные трофические нарушения, протекающие с выраженным перифокальным воспалением, наличие гнойного отделяемого из трофической язвы. Местное применение антибиотиков в настоящее время признано неэффективным. С учетом микробного пейзажа наиболее эффективными антибактериальными средствами являются полусинтетические пенициллины, цефалоспорины II, III поколений, фторхинолоны. Применение флеботропных препаратов в этот период считаем нецелесообразным.
Таким образом, основные цели фармакотерапии ХВН нижних конечностей в стадии трофических расстройств на первом этапе — это купирование воспаления в зоне трофических расстройств, лечение осложнений, остановка процесса деструкции тканей. Основные средства: антиагреганты, антибиотики, антигипоксанты, нестероидные противовоспалительные средства, антигистаминные препараты.
На втором этапе, когда остановлен процесс деструкции тканей и купированы явления острого воспаления, основной задачей фармакотерапии является коррекция микроциркуляторных расстройств. На данном этапе необходимо создать условия для «старта» регенерации тканей, перехода от катаболической фазы в фазу анаболизма. В этот период назначают поливалентные флеботропные препараты, а также продолжают применение дезагрегантов и антиоксидантную терапию.
Итак, основными целями фармакотерапии при ХВН нижних конечностей в стадии трофических расстройств на втором этапе являются: инициирование процессов репарации тканей, уменьшение симптомов венозной недостаточности. Основные средства: флеботропные препараты, антиагреганты, антиоксиданты.
Полное купирование воспалительных проявлений, начало активной эпителизации язвенного дефекта свидетельствуют об успешности проводимого лечения, и на этом, третьем этапе основная цель — это закрепление достигнутых эффектов, а основное средство — флеботропные препараты.
Необходимо отметить, что эффективное лечение ХВН нижних конечностей возможно лишь при использовании комплексного лечебного подхода с применением хирургических методов, эластической компрессии и современных фармакологических средств. Поэтому флеботропные препараты целесообразно использовать как до операции, так и в комплексе послеоперационного реабилитационного лечения.
Ниже мы более подробно остановимся на некоторых современных флебопротекторных препаратах, собственный опыт использования которых позволяет нам рекомендовать их для применения в лечении больных ХВН нижних конечностей.
В состав препарата детралекса входят 450 мг диосмина и 50 мг гесперидина.Основными механизмами действия данного препарата при ХВН являются: повышение тонуса вен, купирование воспалительных реакций, стимуляция лимфооттока, устранение микроциркуляторных расстройств.
По нашим данным, применение детралекса у более чем 250 пациентов с начальными формами ХВН в большинстве случаев (83%) вызывает существенное клиническое улучшение, а также оказывает положительное влияние на гемодинамику вен и эффективность икроножного насоса. Необходимо отметить также высокую безопасность данного флеботропного препарата. Даже при длительном (12 мес) приеме детралекса побочные проявления возникали крайне редко, переносимость лечения оценивали как умеренную и высокую 93% больных.
При исследовании микроциркуляторного кровотока с помощью лазерной допплеровской флоуметрии удалось выявить, что к окончанию курса консервативного лечения у пациентов с варикозной болезнью отмечается достоверное повышение исследуемого показателя, свидетельствующее об усилении перфузии мягких тканей (рис.).
| Рисунок. Динамика индекса микроциркуляции в основной и контрольной группах в различные сроки лечения |
Препарат гинкор форт содержит 14 мг экстракта гингко билоба, 300 мг троксерутина и 300 мг гептаминола гидрохлорида. Экстракт гингко билоба обладает антиоксидантным, антигипоксическим действием, реализующимся за счет подавления синтеза и высвобождения медиаторов воспаления и реакций окисления с участием свободных радикалов кислорода. Антиагрегационный и ангиопротекторный эффект препарата обусловлен подавлением выработки фосфодиэстеразы, что приводит к накоплению в гладких клетках циклогуанидинаминофосфорной кислоты и снижению тонуса артериол. Троксерутин относится к группе рутозидов. Его ангиопротективный эффект реализуется за счет блокирования гиалуронидазы и достигающейся тем самым стабилизации гиалуроновой кислоты — одной из основных составляющих клеточных мембран и межуточного вещества. Гептаминол, помимо воздействия на основной фактор венозного возврата — «мышечно-венозную помпу», повышает сократительную активность правых камер сердца, способствует адекватной оксигенации крови и защищает эндотелий сосудов от гипоксии.
Важной особенностью препарата гинкор форт является возможность его применения во II и III триместрах беременности. Проведенные исследования подтвердили эффективность этого препарата, применяющегося для купирования симптомов ХВН во время беременности.
В последнее время на отечественном рынке появился новый флеботропный препарат — антистакс. Действующим веществом данного лекарственного средства является экстракт красных листьев винограда, содержащий фармакологически активные биофлавоноиды, основными из которых являются кверцетин-глюкоронид и изокверцетин. Препарат оказывает защитное действие на эпителий сосудов, стабилизируя мембраны, увеличивает эластичность сосудов, нормализуя сосудистую проницаемость. Снижение проницаемости сосудистой стенки для плазмы, белков и воды из сосудов в окружающую ткань замедляет образование отеков и уменьшает уже существующие отеки.
Препарат выпускается в виде капсул, содержащих 180 мг действующего вещества. Показанием к применению являются начальные формы ХВН, проявляющиеся синдромом «тяжелых ног«, отеками, снижением толерантности к статическим нагрузкам. Препарат принимают по 1 капсуле 2 раза в сутки.
В зарубежной литературе опубликованы результаты нескольких крупных клинических исследований, посвященных эффективности препарата антистакса, применяющегося в лечении больных ХВН. Показано его положительное влияние на купирование отечного синдрома (по данным волюметрии) и других проявлений ХВН (боль, усталость, тяжесть в ногах).
Начальный опыт использования антистакса в отечественной клинической практике можно признать обнадеживающим. Следует отметить хорошую переносимость этого препарата и отсутствие значимых побочных эффектов.
Таким образом, современные флеботропные препараты благодаря поливалентному механизму действия, высокой биодоступности, незначительно выраженным побочным эффектам являются эффективным средством фармакологической коррекции ХВН. Их использование в комплексе с хирургическим лечением, эластической компрессией, склеротерапией, физиотерапией позволяет достичь хороших результатов в лечении пациентов с хроническим нарушением оттока крови из нижних конечностей.
Ю. М. Стойко, доктор медицинских наук, профессор Н. А. Ермаков, кандидат медицинских наук НМХЦ им. Н. И. Пирогова, Москва
Сравнение естественной и искусственной гиалуроновой кислоты по молекулярной массе
| Тип ГК | Молекулярная масса (ММ) | Характеристики |
| Естественная | 3 140 000 Да | Постоянно обновляется, в норме обладает отличными амортизационными и любрикационными свойствами |
| Искусственная с низкой ММ | 500 000 – 800 000 Да | Быстро выводится из сустава, поэтому требует большого количества инъекций и частых повторений курсов |
| Искусственная со средней ММ | 800 000 – 2 500 000 Да | Стандартный курс включает 5 инъекций, действует относительно недолго, применяется чаще всего |
| Искусственная с высокой ММ | Более 2 500 000 Да | Требует меньшего количества инъекций на курс и действует дольше |
Гепарин (Heparin)
Гепарин натрия вводят подкожно, внутривенно, болюсно или капельно.
Гепарин натрия назначают в виде непрерывной внутривенной инфузии или в виде регулярных внутривенных инъекций, а также подкожно (в область живота).
Гепарин натрия нельзя вводить внутримышечно из-за риска развития интрамускулярных гематом.
Обычным местом для подкожных инъекций является передне-латеральная стенка живота (в исключительных случаях вводят в верхнюю область плеча или бедра), при этом используют тонкую иглу, которую следует вводить глубоко, перпендикулярно, в складку кожи, удерживаемую между большим и указательным пальцами до окончания введения раствора. Следует каждый раз чередовать места введения (во избежание формирования гематомы). Первую инъекцию необходимо осуществлять за 1-2 часа до начала операции; в послеоперационном периоде — вводить в течение 7-10 дней, а в случае необходимости — более длительное время.
Начальная доза гепарина натрия, вводимого в лечебных целях, обычно составляет 5000 ME и вводится внутривенно, после чего лечение продолжают, используя подкожные инъекции или внутривенные инфузии.
Поддерживающие дозы определяют в зависимости от способа применения:
— при непрерывной внутривенной инфузии назначают по 1000-2000 МЕ/ч (24000- 48000 МЕ/сут), разводя гепарин натрия 0,9 % раствором натрия хлорида;
— при регулярных внутривенных инъекциях назначают по 5000-10000 ME гепарина натрия каждые 4-6 часов;
— при подкожном введении вводят каждые 12 часов по 15000-20000 ME или каждые 8 часов по 8000-10000 ME.
Лабораторный мониторинг эффективности и безопасности терапии гепарином натрия
Дозу гепарина натрия необходимо корректировать на основании лабораторных показателей свертываемости крови. При применении гепарина натрия необходимо контролировать активированное частичное тромбопластиновое время (АЧТВ) или время свертывания крови (ВСК). Вводимая доза гепарина натрия считается адекватной, если АЧТВ в 1,5-2,0 раза превышает нормальные значения или если ВСК пациента в 2,5-3,0 раза выше контрольных значений.
При непрерывной внутривенной инфузии гепарина натрия рекомендуется определить исходное АЧТВ, затем определять АЧТВ каждые 4 часа с последующим увеличением или уменьшением скорости инфузии гепарина натрия до достижения целевого уровня АЧТВ (в 1,5-2,0 раза выше нормы), в дальнейшем определять АЧТВ каждые 6 часов.
При болюсном внутривенном введении гепарина натрия рекомендуется определить исходное АЧТВ, затем определять АЧТВ перед каждым болюсным введением с последующим увеличением или уменьшением вводимой дозы гепарина натрия.
При подкожном введении гепарина натрия рекомендован контроль АЧТВ через 4-6 часов после инъекции с последующим увеличением или уменьшением вводимой дозы гепарина натрия.
При применении гепарина натрия в низких дозах для профилактики тромбоэмболических осложнений контролировать АЧТВ не обязательно.
Непрерывная внутривенная инфузия является наиболее эффективным способом применения гепарина натрия, лучшим, чем регулярные (периодические) инъекции, т.к. обеспечивает более стабильную гипокоагуляцию и реже вызывает кровотечения.
Применение гепарина натрия в особых клинических ситуациях
Первичная чрескожная коронарная ангиопластика при остром коронарном синдроме без подъема сегмента ST и при инфаркте миокарда с подъемом сегмента ST: гепарин натрия вводится внутривенно болюсно в дозе 70-100 МЕ/кг (если не планируется применение ингибиторов гликопротеиновых IIb/IIIа рецепторов) или в дозе 50-60 МЕ/кг (при совместном применении с ингибиторами гликопротеиновых IIb/IIIа рецепторов).
Тромболитическая терапия при инфаркте миокарда с подъемом сегмента ST: гепарин натрия вводится внутривенно болюсно в дозе 60 МЕ/кг (максимальная доза 4000 ME), с последующей внутривенной инфузией в дозе 12 МЕ/кг (не более 1000 МЕ/ч) в течение 24- 48 часов. Целевой уровень АЧТВ — 50-70 секунд, что в 1,5-2,0 раза выше нормы; контроль АЧТВ — через 3, 6, 12 и 24 часа после начала терапии.
Профилактика тромбоэмболических осложнений после хирургических вмешательств с применением низких доз гепарина натрия: гепарин натрия вводится подкожно, глубоко в складку кожи живота. Начальная доза 5000 ME за 2 часа до начала операции. В послеоперационном периоде: по 5000 ME каждые 8-12 часов в течение 7 дней или до полного восстановления подвижности пациента (в зависимости от того, что наступит раньше). При применении гепарина натрия в низких дозах для профилактики тромбоэмболических осложнений контролировать АЧТВ не обязательно.
При профилактике тромбообразования в послеоперационном периоде первую инъекцию необходимо осуществлять за 1-2 часа до начала операции; в послеоперационном периоде вводить в течение 7-10 дней, а в случае необходимости — более длительное время.
Применение в сердечно-сосудистой хирургии при операциях с использованием системы экстракорпорального кровообращения: начальная доза гепарина натрия — не менее 150 МЕ/кг. Далее гепарин натрия вводится путем непрерывной внутривенной инфузии со скоростью 15-25 капель/мин по 30000 ME на 1 л инфузионного раствора. Общая доза обычно составляет 300 МЕ/кг (если предполагаемая продолжительность операции менее 60 минут) или 400 МЕ/кг (если предполагаемая продолжительность операции 60 и более минут).
Применение при гемодиализе: начальная доза гепарина натрия — 25-30 МЕ/кг (или 10000 ME) внутривенно болюсно, затем непрерывная инфузия гепарина натрия 20000 МЕ/100 мл 0,9 % раствора натрия хлорида со скоростью 1500-2000 МЕ/ч (если иное не указано в руководстве по применению систем для гемодиализа).
Применение гепарина натрия в педиатрии: адекватные контролируемые исследования применения гепарина натрия у детей не проводились. Представленные рекомендации основаны на клиническом опыте.
Начальная доза: 75-100 МЕ/кг внутривенно болюсно в течение 10 минут. Поддерживающая доза: дети в возрасте 1-3 месяцев — 25-30 МЕ/кг/ч (800 МЕ/кг/сутки), дети в возрасте 4-12 месяцев — 25-30 МЕ/кг/ч (700 МЕ/кг/сутки), дети старше 1 года — 18- 20 МЕ/кг/ч (500 МЕ/кг/сутки) внутривенно капельно.
Дозу гепарина натрия следует подбирать с учетом показателей свертывания крови (целевой уровень АЧТВ 60-85 секунд).
Переход на терапию варфарииом: для обеспечения устойчивого антикоагулянтного действия следует продолжить терапию гепарином натрия в полной дозе до тех пор, пока не будет достигнут стабильный целевой уровень МИО (международное нормализованное отношение). После этого введение гепарина натрия необходимо прекратить.
Переход на терапию дабигатраном: непрерывное внутривенное введение гепарина натрия следует прекратить сразу же после приема первой дозы дабигатрана. При дробном внутривенном введении пациент должен принять внутрь первую дозу дабигатрана за 1-2 часа до запланированного введения очередной дозы гепарина натрия.
Есть ли альтернатива
В человеческом организме присутствует фермент гиалуронидаза, который расщепляет гиалуроновую кислоту даже с высокой молекулярной массой. Кроме того, препараты могут вызывать аллергические и инфекционные реакции за счет животного происхождения. Поэтому, несмотря на инновационный подход, не являются совершенным терапевтическим средством.
Более безопасно и эффективно использовать синтетический протез синовиальной жидкости «Нолтрекс». По показателям молекулярной массы (более 10 000 000 Да) он выигрывает абсолютно у всех средств на основе гиалуроновой кислоты. Поскольку специфические ферменты на полимер не действуют, остается в организме дольше остальных аналогов, при этом так же эффективно восстанавливает свойства суставной жидкости.
Noltrex уменьшает боль, улучшает биомеханику движений и стабилизирует сустав надолго – иногда срок действия достигает двух лет, чего добиться от гиалуроновой кислоты невозможно.
Применение низкомолекулярных гепаринов в акушерской практике
Д
о настоящего времени
тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран
. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
Даже при физиологически протекающей беременности, особенно в III триместре, наступает гиперкоагуляция, что в первую очередь связано с увеличением почти на 200% I, II, VIII, IX, X факторов свертывания крови в сочетании со снижением фибринолитической активности и естественной антикоагулянтной (антитромбин III и протеин S) активности. Помимо этого, в III триместре скорость кровотока в венах нижних конечностей уменьшается наполовину, что обусловлено частично механической обструкцией беременной маткой венозного оттока, частично — снижением тонуса венозной стенки из-за гормональной перестройки организма во время беременности.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза
, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам
относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают
2 типа ГИТ
: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины
их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• антифосфолипидный синдром
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные
. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Как известно, основные эффекты НГ — антитромбиновый и антитромбопластиновый
. В основе этих эффектов лежит взаимодействие комплекса гепарин-АТ III с тромбином и комплекса гепарин-АТ III с рядом факторов свертывания (Ха, XIIa, XIa, IXa). Для ингибирования тромбина необходимы, как минимум, 18 сахарных остатков в молекуле гепарина, что возможно при молекулярной массе не менее 5400 Д. Соотношение у НГ анти-IIa- и анти-Ха-активности составляет 1:1.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
При внутривенном введении время полужизни гепарина натрия составляет 2 ч, что требует частого введения препарата; при подкожном введении время полужизни НГ увеличивается из-за длительного всасывания из подкожного депо: в этом случае возможно применение НГ 2 раза в сутки через 12 ч. Терапевтический эффект НГ достигается при увеличении активированного частичного тромбопластинового времени (АЧТВ) в 1,5-2,5 раза по сравнению с нормой. Терапия НГ требует регулярного лабораторного контроля в связи с опасностью геморрагий — основного побочного эффекта НГ. К другим побочным влияниям НГ относятся остеопороз, алопеция, некроз кожи; возможно проявление реакции гиперчувствительности.
Последние 5-7 лет в клиническую медицину активно внедряются
низкомолекулярные гепарины
(НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ
не обладают антитромбиновым свойством и, следовательно,
не вызывают гипокоагуляции
. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Противотромботический эффект НМГ долго связывали исключительно с анти-Ха-активностью, пока не выяснилось, что только 30% активности НМГ осуществляется через АТ III, а 70% — через так называемый ингибитор внешнего пути свертывания TFPI, взаимодействие с гепарин-кофактором II, ингибицию прокоагулянтного действия лейкоцитов, активацию фибринолиза, модуляцию сосудистого эндотелия (рецепторно- и нерецепторно-обусловленную). Это объясняет, почему у пациентов сохраняется “антитромботическое состояние” после подкожного введения профилактической дозы НМГ в течение 24, ч несмотря на то, что уже через 12 ч после инъекции анти-Ха-активность не обнаруживается.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора
(ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина
. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Опыт применения НМГ надропарина кальция (Фраксипарина)
в акушерской практике свидетельствует о том, что НМГ являются препаратами выбора при профилактике тромбоэмболических осложнений у беременных с искусственными клапанами сердца, так как эти больные нуждаются в длительном (на протяжении всей беременности, родов) применении антикоагулянтов, а также у беременных с кава-фильтром, у больных с тромбозом в анамнезе и дефицитом естественных антикоагулянтов — АТ III и протеина С в качестве профилактики тромбоэмболических осложнений после кесарева сечения и в послеродовом периоде в группах высокого риска по этим осложнениям. НМГ дают положительный эффект у женщин с привычным невынашиванием беременности и АФС. Патогенетически это оправдано в связи с тем, что НМГ влияют на те нарушения гемостаза, которые индуцируются волчаночным антикоагулянтом, антикардиолипинами, их комплексами, а именно, на нарушение пути активации и действия протеина С, повреждение эндотелия и нарушение высвобождения АТ III, TFPI, простациклина и пр. Таким образом, НМГ препятствуют развитию микро- и макротромбозов при АФС.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами
. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Различают профилактические и лечебные дозы НМГ
. Важным остается вопрос о длительности терапии, которая зависит от основного заболевания. Так, у беременных с наследственными тромбофилиями необходимо применять НМГ на протяжении всей беременности. Учитывая, что при наследственных тромбофилиях, а также в ряде других случаев антикоагулянтная терапия необходима на протяжении всей беременности, НМГ является препаратом выбора еще и потому, что при длительной терапии не вызывает остеопении. У беременных с кава-фильтром НМГ применяют в III триместре, в родах и в послеродовом периоде; при сопутствующем АФС — на протяжении всей беременности с чередованием профилактических и лечебных доз; у беременных с искусственными клапанами сердца НМГ применяются с III триместра беременности.
Профилактика тромбоэмболических осложнений после кесарева сечения особенно актуальна при сочетании нескольких факторов риска: экстрагенитальных заболеваний (в частности, сердечной патологии), ожирения, АФС и пр. Ее продолжительность не меньше 10 дней. Профилактическая доза одного из первых и наиболее изученных НМГ — надропарина кальция (Фраксипарина) обычно составляет 150 ICU/кг 1 раз в сутки подкожно (как правило, это 0,3 мг). Следует отметить, что анти-Ха-активность надропарина кальция чаще измеряется в анти-Ха-единицах ICU. 1 ICU соответствует 0,41 международной единицы анти-Ха.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.
Надропарин кальция –
Фраксипарин (торговое название)
(Sanofi-Synthelabo)