Материал и методы
Критерием включения в исследование было наличие у пациентов облитерирующего атеросклероза, клинически проявлявшегося в виде критической ишемии нижних конечностей 3-4 стадии по Покровскому. При этом некротический процесс не должен был распространяться за пределы пальцев стопы. Подходившие под данные критерии пациенты были разделены в рандомизированном порядке на две группы: первая – контрольная (30 пациентов) и вторая, в которой применялся актовегин (30 пациентов). Благодаря случайности распределения, обе когорты оказались сравнимы по полу, возрасту, сопутствующей патологии и выраженности основного заболевания, что позволило, наряду с использованием современных методов медицинской статистики, получить достоверные результаты исследования.
Средний возраст больных составил 69,5±7,2 г. Мужчин было 34, женщин – 26. Учитывая преклонный возраст пациентов, сопутствующая патология при-сутствовала в пределах: мультифокальный атеросклероз (АТ) в 100 % случаев, гипертоническая болезнь (ГБ) – 82,4, ишемическая болезнь сердца (ИБС) у 88,1 % больных, хронической сердечной недостаточностью (ХСН) страдали 85 %, хроническая почечная недостаточность (ХПН) выявлена у 23,7 %, (рис. 1).
Лечение пациентов, находившихся в контрольной группе, заключалось в назначении курса стандартной консервативной терапии, применяемой в общехирургических стационарах при критической ишемии нижних конечностей. В данный комплекс входят препараты, улучшающие реологические свойства крови, спазмолитики, препараты для лечения атеросклероза (чаще из группы статинов). Схема была следующей: пентоксифиллин 15 мл, реополиглюкин 400,0 мл, антиагренганты (в некоторых случаях с двойной дезагрегантной терапией), низкомолекулярные гепарины в профилактических дозах, статины. Во второй группе к вышеуказанному комплексу подключался актовегин в дозе 1200 мг внутривенно, капельно на протяжении 15 суток. Затем аналогичная дозировка в таблетированной форме последующие 15 дней.
Эффективность лечения отслеживали путем оценки клинической картины (дистанция безболевой ходьбы), уровня микроциркуляции – напряжения кислорода в тканях (полярография, TSM-400, Дания) и показателей лазерной допплеровской визуализации на аппарате LDI фирмы AIMAGO (Швейцария). Для двойного контроля пользовались и морфологическими методами: цитологическими и гистологическими исследованиями, материал для которых брали после хирургического удаления сухих некрозов, либо в зоне демаркационной линии.
Достоверность результатов изучения микроциркуляции удалось достигнуть, используя индекс региональной перфузии тканей (ИРП tpO²). Последний представляет собой отношение абсолютного значения насыщения тканей кислородом в искомой точке (первый межпальцевой промежуток на стопе) к таковому в контрольной (локтевая ямка) точке (рис. 2).
Результаты оценивали до лечения, после курса парентерального введения актовегина (на 15 сутки), по завершению приема препарата (на 30 сутки), а так же на 60 сутки от момента начала лечения.Изучение микроциркуляци кожного покрова у наших пациентов осуществляли с помощью метода лазерной допплеровской визуализации на аппарате LDI фирмы AIMAGO (Швейцария). Технология LDI (LaserDopplerImaging) в русскоязычной литературе – лазерная допплеровская визуализация, позволяет проводить бесконтактное наблюдение за микрокровотоком на площади 100 см², с глубиной проникновения до 2 мм, одномоментной видеозаписью исследования и возможностью измерений сразу в нескольких близлежащих точках. При этом технически исследование настолько просто, что может быть выполнено средним медперсоналом, поскольку воспроизводимость практически не зависит от квалификации исследователя. Анализ полученного изображения производился в режиме реального времени. Полученные данные заносились в память прибора, что позволяло при необходимости повторно просмотреть видеозапись измерения. Параллельно учитывали число относительных перфузионных единиц (APU), отражающих количество крови протекающей в единицу времени в одной кубической единице объема ткани.
Нейропротекцию определяют как создание условий для адаптации нейрона к новым функциональным условиям и уменьшения повреждений мозговой ткани. В настоящее время доказана универсальность механизмов повреждения клеток при различных патологических процессах. Конечным звеном в этих случаях является нарушение окислительно-восстановительных процессов, нарушение метаболизма и энергетического обеспечения клеток [16]. Перспективным направлением в нейропротекции считается использование плейотропных препаратов. Плейотропный нейропротективный эффект предполагает одновременное модулирующее влияние на разные повреждающие патологические механизмы — эксайтотоксичность, воспаление, апоптоз, оксидантный стресс и др. [20].
На сегодняшний день существует несколько фармакологических групп препаратов нейрометаболического типа действия [15]. К ним относится и актовегин, особенностям клинического действия и механизмам его реализации пока уделяется недостаточно внимания, что послужило основанием для написания предлагаемого обзора.
Актовегин принадлежит к группе препаратов, активирующих обмен веществ без прямого вазодилатирующего воздействия [17]. Он представляет собой депротеинизированный гемодиализат высокой степени очистки, получаемый методом ультрафильтрации из крови молодых телят, в который входят более 200 биологических субстанций [1]. Актовегин в основном состоит из веществ с низким молекулярным весом, включая аминокислоты, биогенные амины и полиамины, сфинголипиды, гексозы, лактат, сукцинат, холин, витамины, аденозинмонофосфат и инозитолфосфоолигосахариды [20]. Препарат содержит также макроэлементы — магний, натрий, кальций, фосфор и нейроактивные микроэлементы — кремний и медь. Одним из наиболее важных макроэлементов является магний, входящий в состав многих белков и ферментов. Кроме того, магний входит в состав глутатионпероксидазы, принимающей участие в метаболизме Н2О2, приводящем к образованию глутатиона [6, 8, 9].
Доклинические испытания показали, что на молекулярном уровне актовегин улучшает захват и утилизацию кислорода и глюкозы [2, 10, 18]. Переносчики глюкозы играют важную роль в нейрональном гомеостазе и утилизации глюкозы, а изменение гомеостаза глюкозы в ЦНС приводит к нарушению нейрональной активности и когнитивных функций, что особенно опасно для гиппокампа, области мозга, связанной с процессами обучения и памяти [20]. В исследовании in vitro
P. Buchmayer и соавт. [18] было показано, что актовегин обладает нейропротективным действием: при его добавлении в культуру нейронов повышается число «живых» нейронов и синаптических контактов на их отростках. В условиях ишемии актовегин улучшает метаболический баланс путем повышения усвоения глюкозы и потребление кислорода тканями [17, 18]. Речь идет об антиоксидантном и антиапоптотическом механизмах действия актовегина, лежащих а основе их нейропротективных свойств, а также его способности влиять на нейропластичность, нейрогенез, трофическую функцию нервной системы. Именно многокомпонентная природа актовегина определяет его плейотропный нейропротективный механизм действия и клиническую эффективность [20].
Прежде чем перейти к изложению клинических исследований, касающихся цереброваскулярных заболеваний (ЦВЗ) напомним, что одним их наиболее часто встречающихся проявлений являются нарушение когнитивных функций. Они включают дефицит внимания, его концентрации, снижение способности быстрой ориентации в меняющейся обстановке; ухудшение памяти, особенно на текущие события; замедленность процессов мышления, быструю истощаемость при напряженной умственной работе; сужение круга интересов [15].
В. Янсен и соавт. [17] было проведено двойное слепое плацебо-контролируемое исследование терапевтического влияния актовегин-форте в форме драже (содержащие 200 мг активного вещества) на мнестико-интеллектуальные способности у больных с ЦВЗ. В исследование были включены 120 пациентов, возраст которых был 60-72 года (средний — 67 лет); средняя длительность заболевания составила 2,5 года. Все пациенты были рандомизированы в 3 группы: в 1-ю группу вошли 40 больных, лечившихся актовегином-форте по 3 драже 3 раза в день; пациенты 2-й группы (также 40 человек) получали плацебо в виде драже (по 2 драже 3 раза в день или по 3 драже 3 раза в день); 3-я группа (40 больных) принимала актовегин-форте по 2 драже 3 раза в день. Продолжительность терапии составила 12 нед. Состояние пациентов оценивалось до начала терапии и затем после 4, 8 и 12-й недель лечения. При обследовании больных использовался ряд нейропсихологических тестов, позволяющих оценить мнестико-интелектуальные функции: тест для оценки словарного запаса; короткий синдромальный тест; тест Паули; тест Бентона; тест с мозаикой; тест на анализ частоты мерцания света. Было установлено, что в группах пациентов, лечившихся актовегином, выросли успехи при выполнении задания в тесте с мозаикой, по сравнению с плацебо. К концу 12-недельного курса терапии актовегином в сравнении с плацебо исчезли имевшиеся у больных недостаточность концентрации мышления, внимания и волевые нарушения; повысились мнестико-интеллектуальные способности в целом. Авторы оценили эффективность 12-недельной терапии актовегином-форте в 92%, что послужило основанием рекомендовать этот препарат для длительного амбулаторного лечения пожилых пациентов с ЦВЗ.
Х. Летцел и соавт. [5] провели многоцентровое исследование эффективности актовегина у 1549 пациентов пожилого возраста (средний возраст 74,1 года) с нарушением церебральных функций. Включенным в исследование пациентам актовегин назначался по стандартной схеме: в течение 2 нед внутривенно по 10 мл раствора актовегина, затем 4 нед перорального приема таблеток актовегина (по 2 таблетки 3 раза в день). Пациенты обследовались до начала терапии, через 2 и 4 нед перорального приема препарата. Через 4 нед от начала терапии актовегином в 80% случаев было отмечено улучшение общего состояния: уменьшение выраженности (или прекращение) головной боли, головокружения, беспокойства и чувства страха, улучшение памяти и концентрации внимания (по данным психологического тестирования). В 10,9% при парентеральном применении препарата наблюдались нежелательные эффекты (ощущение жара и тошноты). Плохая переносимость препарата была отмечена в незначительном проценте (0,9%) случаев. Авторы подчеркивают важность проведения комбинированной терапии — стартовой с использованием внутривенного введения актовегина для достижения быстрого и хорошего ответа и последующего ее продолжения с применением перорального приема драже. Такая терапия была рекомендована для пожилых пациентов с органическим синдромом.
А.А. Федорович и соавт. [12, 13, 19] описывают ряд исследований, подтвердивших влияние актовегина на вазомоторную и метаболическую активность гладкомышечных клеток микрососудистого русла кожи у человека. Авторы проводили инфузию 250 мл раствора актовегина в кубитальную вену левой руки в дозах 1,0 г сухого вещества и 2,0 г сухого вещества со скоростью 2-2,5 мл/мин на протяжении 120-130 мин. В среднем прирост амплитуды эндотелиального (Аэ) ритма под воздействием первой дозы актовегина составил 75%, вклад эндотелия в модуляцию микрокровотока увеличился на 30%, а функциональный вклад в общий уровень тканевой перфузии увеличился на 65%. При пробе с бо’льшей дозой актовегина был показан наиболее выраженный прирост активности микрососудистого эндотелия: прирост Aэ в данной группе составил в среднем 191%, а вклад эндотелия в общий уровень тканевой перфузии — 163%. Максимальный пик активности препарата после внутривенного введения отмечен в интервале 2-6 ч. Через 2 ч после окончания инфузии было отмечено незначительное, но достоверное снижение диастолического АД и среднего АД. Указанные изменения были отмечены на фоне достоверного увеличения всех тонус-формирующих звеньев модуляции микрокровотока (эндотелиального, нейрогенного и миогенного), при этом наиболее существенный прирост наблюдался со стороны эндотелиальной активности. Прирост функционального вклада эндотелия в общую тканевую перфузию составил в среднем 79%. Авторы сделали вывод, что актовегин обладает не только ярко выраженным метаболическим действием, повышая функциональную активность микрососудистого эндотелия, но и оказывает влияние на вазомоторную функцию микрососудов, следствием чего является существенное улучшение функционального состояния гладкомышечного аппарата микрососудов.
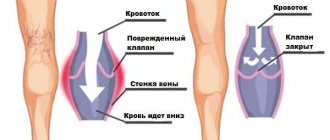
С учетом персистирующей гемодинамической церебральной недостаточности препаратом выбора лечения хронических ЦВЗ у больных с поражением миокарда может являться актовегин [11, 14]. Нейроэндокринный дисбаланс в виде активации локальных нейрогормональных систем и выраженной дисфункции эндотелия инициирует процессы сосудистого ремоделирования: толщина стенок артерий увеличивается, а просвет уменьшается. Изменения микроциркуляторного русла при атеросклерозе артерий мозга: редукция русла, как следствие гипоксии и микрососудистых конволютов, компенсирующих эту гипоксию. Низкий сердечный выброс, асимптомная церебральная микроэмболизация, колебания артериального давления с эпизодами гипотонии, метаболические сдвиги могут явиться причиной церебральных расстройств. Сужение просвета интракраниальных артерий наряду с нарушением функции эндотелия и ригидностью сосудистой стенки вызывают хроническую редукцию мозгового кровотока, появление диффузных или очаговых изменений вещества головного мозга и клинических признаков ЦВЗ. Все вышеперечисленные составляющие хронических цереброваскулярных расстройств являются прямым показанием для назначения препарата актовегин. Важно также подчеркнуть, что актовегин обладает удовлетворительным соотношением эффективность-безопасность.
В ряде клинических исследований последних лет было подтверждено положительное влияние актовегина на когнитивные функции. Как установила С.Г. Бугрова [3], это касается прежде всего легких и умеренных когнитивных нарушений при сосудистых заболеваниях. В работе Е.А. Деревянных и соавт. [4] было выявлено более широкое действие актовегина не только на когнитивные функции, но и на ЭЭГ и показатели кровоснабжения мозга, а также неврологические проявления хронической цереброваскулярной недостаточности. А.А. Скоромец и В.В. Ковальчук [7] при сопоставлении нескольких препаратов (актовегин, инстенон, берлитион, реополиглюкин, глиатилин) в процессе реабилитации больных с ишемическим и геморратическим инсультом установили, что при ишемическом инсульте положительное действие оказывают все перечисленные препараты, в то время как при геморрагическом — только актовегин.
Результаты
Изменения уровня перфузии кожи, возникшие в результате проведенного исследования у пациентов указаны в таб. 1.
Таблица 1. Кислородный режим тканей до и после лечения препаратом «Актовегин»
| Дни наблюдения | До лечения | 15 сутки | 30 сутки | 60 сутки |
| Контрольная группа | 0,41±0,03 | 0,46±0,02 | 0,46±0,09 | 0,42±0,08 |
| Группа актовегина | 0,43±0,04 | 0,51±0,03 | 0,52±0,02 | 0,54±0,09 |
До лечения обе группы были сопоставимы по исходному уровню микроциркуляции. В контрольной когорте пациентов, несмотря на проводимую стандартную терапию, статистически значимого улучшения транскутанного напряжения кислорода получено не было, что может косвенно свидетельствовать о том, что данные медикаментозные препараты не влияют на микроциркуляторное звено.
В группе актовегина перфузия кожи к 15 суткам наблюдения, в момент окончания парентерального курса улучшилась на 35 %. Данный результат удалось закрепить на достигнутом уровне к 30 и 60 суткам с помощью продолженного курса приема препарата в таблетированной форме (табл. 2)
Таблица 2. Влияние атовегина на микроциркуляции кожи стопы
| Время | Первая группа (n-30) (APU) | Вторая группа (n-30) (APU) |
| До лечения | 42±3.1 | 43±2.4 |
| 15 сутки | 45±2.8 | 62±1.7 |
| 30 сутки | 48±1.7 | 75±2.1 |
| 60 сутки | 53±1.4 | 89±2.6 |
После проведенных морфологических исследований в контрольной группе была выявлена тенденция к интенсификации и нарастанию воспаления в зоне демаркации с последующим развитием некробиотических, а затем и некро-тических изменений в данной области. Что макроскопически выражалось в проксимальном распространении области сухого некроза (гангрены).
К 15 суткам, по сравнению с исходными данными по данным гистологического исследования, наблюдалась активация репаративных процессов в виде усиления активности и увеличения числа макрофагов и фибробластов (рис. 4, рис.5).
В этот же временной промежуток данные цитологического исследования указывают на существенное снижение активности воспалительного процесса в виде уменьшения лейкоцитарной инфильтрации нейтрофилами в 3-4 раза (рис. 6, рис.7).
В группе актовегина значимые изменения были отмечены в период паренте-рального введения препарата, что явилось проявлением активации соответствующих звеньев метаболизма, на которые воздействует препарат на начальном этапе лечения. В последующие сроки наблюдалось закрепление результата на достигнутом уровне.
Актовегин в лечении заболеваний нервной системы
Лечение препаратом Актовегин больных с различными неврологическими заболеваниями рассмотрено в ряде обзоров [5,8,13,17]. Актовегин – это высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят. В состав препарата входят органические низкомолекулярные соединения, что исключает развитие прионных болезней, например болезни Крейцфельда–Якоба. Технология получения Актовегина исключает наличие белковых компонентов, обладающих антигенными и пирогенными свойствами. Актовегин содержит аминокислоты, олигопептиды, нуклеозиды, промежуточные продукты углеводного и жирового обмена, антиоксидантные ферменты, электролиты, микроэлементы. Точных данных о фармакокинетике Актовегина нет, так как он является многокомпонентным препаратом и в его состав входят вещества, исходно содержащиеся в организме человека. В экспериментальных работах показано, что действие Актовегина в отношении обмена глюкозы начинается через 5 мин., а пик действия проявляется через 120 мин. после внутривенного введения препарата. Антигипоксантное действие Актовегина связано с его способностью увеличивать поглощение тканями кислорода, что повышает устойчивость клеток к гипоксемии. В результате нормализации поступления кислорода и глюкозы в ткани возрастает образование маркроэргических фосфатов (АТФ, АДФ) и уменьшается энергетический клеточный дисбаланс. Увеличение поглощения кислорода сосудистой стенкой при введении Актовегина приводит к нормализации эндотелий–зависимых реакций и снижению периферического сосудистого сопротивления. Антиоксидантный эффект Актовегина обеспечивается наличием в составе препарата супероксиддисмутазы, что подтверждено методом атомно–эмиссионной спектрометрии, а также ионов магния, повышающих активность глутатионсинтетазы, которая осуществляет перевод глутатиона в глутамин [6]. Показано, что Актовегин способствует увеличению скорости окислительно–восстановительных процессов в гепатоцитах, уменьшает ультраструктурные и функциональные повреждения митохондрий кардиомиоцитов, повышает сниженный уровень метаболизма глюкозы при хроническом алкоголизме. Улучшение энергетических возможностей клеток различных органов и тканей, включая нервную систему, связано со способностью Актовегина улучшать перенос глюкозы внутрь клетки путем активации ее транспортеров (GluT) и инсулиноподобного действия одного из компонентов препарата – инозитолфосфоолигосахарида. За счет того что Актовегин модулирует активность внутриклеточного переноса глюкозы [21], происходит активизация липолиза. Рассматривается возможность применения Актовегина для лечения сахарного диабета и метаболического синдрома [12,15]. Одновременное назначение антигипертензивного препарата b–блокатора бисопролола и Актовегина приводит к увеличению мозговой перфузии у больных с метаболическим синдромом. Актовегин рекомендуется для широкого использования в самых различных областях медицины, например в виде 20% геля, 5% мази или крема при лечении дерматологической патологии. Основная задача наружной формы препарата – ускорение заживления тканей. Вместе с тем именно неврологические заболевания являются основным показанием для его применения. В неврологии Актовегин используется в виде внутривенных, внутримышечных растворов или драже для приема внутрь. В отделениях интенсивной терапии Актовегин в дозе 800–1200 мг назначается для профилактики синдрома реперфузии у больных с острым инфарктом миокарда, после проведения тромболитической терапии и баллонной ангиопластики, при лечении различных видов шока, после остановки кровообращения и асфиксии, при тяжелой сердечной недостаточности [14]. Рассматривается перспективность использования Актовегина на ранних стадиях формирования персистирующих вегетативных состояний, обусловленных мозговой гипоксией. При этом исходят из представления о том, что ведущим фактором сохранения нейроглиальных структур в условиях гипоксии и ишемии является поддержание стабильного церебрального кровотока, оксигенации и создания условий активации утилизации кислорода и глюкозы с целью обеспечения нормального функционирования цикла Кребса. В настоящее время Актовегин повсеместно используется для лечения сосудистых заболеваний головного мозга и когнитивных нарушений различной степени выраженности [17]. В исследовании эффективности влияния Актовегина на когнитивные функции у лиц пожилого и старческого возраста было выявлено, что уже через 2 недели начала терапии препаратом отмечалось статистически достоверное улучшение памяти, внимания и мышления. Клиническое улучшение состояния когнитивных функций, по данным нейропсихологического тестирования, сопровождается нормализацией электроэнцефалограммы и увеличением амплитуды вызванного когнитивного потенциала Р300, причем даже разовое введение препарата приводило к улучшению электрофизиологических показателей функции головного мозга [25,26]. В нескольких двойных слепых плацебо–контролируемых рандомизированных исследованиях изучалось действие Актовегина у больных с легкой или умеренной деменцией. После перорального приема Актовегина в дозе 2 таблетки 3 раза в сутки в течение 8 недель достоверно возрастала скорость психических процессов [24]. Исследование при участии 120 пациентов с цереброваскулярной недостаточностью и когнитивным дефицитом показало, что при длительной терапии дисциркуляторной энцефалопатии с синдромом когнитивных нарушений предпочтение следует отдавать пероральному приему Актовегина [19]. При парентеральном введении Актовегина у этой группы больных показано улучшение когнитивных функций, в первую очередь памяти и внимания, уменьшение выраженности аффективных нарушений и улучшение социальной адаптации. Особо следует отметить, что эффективность препарата возрастает при увеличении времени курса инфузионной терапии, причем не только при сосудистой деменции, но и при болезни Альцгеймера [2,23]. Курс инфузионной терапии Актовегином приводит к более выраженному и более быстро наступающему улучшению состояния больных с когнитивными нарушениями, поэтому рекомендуется начинать лечение с парентеральной формы препарата, а затем переходить на прием таблеток [3]. Представляет большой интерес возможность использования Актовегина, учитывая его влияние на утилизацию глюкозы, у больных СД 2 типа с диабетической энцефалопатией для лечения когнитивных нарушений. При исследовании 60 больных сахарным диабетом (СД) 2 типа, имевших когнитивные нарушения различной степени выраженности, внутривенное введение в дозе 400 мг в течение 3 недель привело к улучшению суммы баллов по шкале MMSE (25,50±2,52 балла до лечения и 26,47±2,50 балла после лечения, p<0,05), причем в наибольшей степени улучшалась память (рис. 1) [11]. Улучшение когнитивных функций не сопровождалось достоверным уменьшением депрессии и тревожности, а также изменением церебральной гемодинамики по данным дуплексного сканирования. Таким образом, можно предполагать, что клиническая эффективность Актовегина у больных СД 2 типа с когнитивными нарушениями обусловлена улучшением в первую очередь церебрального метаболизма. В пилотной работе, выполненной на 10 больных с тяжелой черепно–мозговой травмой (ЧМТ), получены данные о целесообразности применения Актовегина у данной группы больных. Однако эффективность препарата в лечении ЧМТ нуждается в подтверждении результатами двойных слепых плацебо–контролируемых рандомизированных исследований [4]. Гораздо меньше данных о возможности лечения Актовегином заболеваний периферической нервной системы. Вместе с тем сосудистый компонент присутствует при многих мононевропатиях, включая радикулопатии, множественные мононевропатии и полиневропатии. Представлены работы по лечению Актовегином, Ксефокамом и индометацином пожилых больных с дискогенными радикулопатиями, которые имеют интенсивный болевой синдром. При применении Актовегина у пациентов наступал более быстрый регресс болевого синдрома в сравнении с группами больных, получавших только Ксефокам или индометацин [16]. Кроме того, как показало катамнестическое исследование, у пациентов группы больных, получавших комбинированную терапию с Актовегином, на 43% реже возникала необходимость повторной госпитализации в связи с рецидивом болевого синдрома. Выраженность неврологического дефицита была значительно ниже в группе больных, получавших Актовегин, чем в других группах. Кроме того, в группе больных, лечившихся Актовегином, отмечено достоверное улучшение самочувствия, двигательной активности и сна. Сделан вывод о том, что включение Актовегина в комплекс терапии пожилых пациентов с дискогенной радикулопатией позволяет быстрее купировать болевой синдром, ускорить регресс неврологических нарушений и улучшить самочувствие больных. Существенно больше исследований по оценке эффективности Актовегина проведено при диабетическом поражении периферических нервов – диабетической дистальной симметричной сенсорно–моторной полиневропатии (ДПН) [5,18,22], что предопределено механизмами фармакологического действия препарата. Снижение кровотока в эндоневральных сосудах, обусловленное микроангиопатией, лежит в основе формирования ДПН. Можно согласиться с точкой зрения о том, что «начинается диабет как болезнь обмена, а заканчивается – как сосудистая патология» [1]. По современной точке зрения, развитие ДПН связано с оксидативным стрессом, возникающим в результате нарушений метаболизма глюкозы, а также слабостью собственных антиоксидантных систем [20]. Метаболические нарушения, вызывая изменение содержания в цитоплазме клеток фосфатных энергетических субстратов, приводят к развитию феномена «псевдогипоксии». Утолщение сосудистой стенки эндоневральных сосудов и изменение реологических свойств крови при СД формируют истинную гипоксию. Такое представление о метаболических и сосудистых процессах, лежащих в основе развития ДПН, делает целесообразным применение Актовегина, воздействующего на процессы развития гипоксии и обмен глюкозы, для лечения ДПН. W. Jansen и E. Beck изучили действие Актовегина у больных с ДПН в рамках контролируемого исследования: одна группа из 35 больных получала плацебо, другая группа из 35 больных – Актовегин в дозе 600 мг (2 таблетки) 3 раза в сутки в течение 24 недель [22]. Критериями оценки эффективности препарата служили клинические характеристики полиневропатии (сухожильные рефлексы, поверхностная и глубокая чувствительность, интенсивность болевого синдрома) и ЭМГ показатели функции периферических нервов (скорость распространения возбуждения (СРВ), а также расстояние, которое больные могли пройти без боли. Улучшение состояния больных в группе лечения Актовегином отмечено у большинства пациентов через 8 недель после начала лечения, а оптимальный эффект достигался через 16 недель лечения. Показано достоверное улучшение по сравнению с группой плацебо практически всех клинических показателей: расстояния ходьбы без боли, сухожильных рефлексов, поверхностной и глубокой чувствительности (р<0,01). СРВ достоверно (p<0,001) увеличивалась в группе Актовегина по сравнению с группой плацебо. Пациенты в группе Актовегина чувствовали себя лучше и предъявляли меньше жалоб на нарушение психоэмоционального статуса, что коррелировало с улучшением их физического состояния. В работе Яворской В.А. с соавт. [18] в рамках открытого исследования Актовегин применяли для лечения ДПН у 24 больных с СД 1 и 2 типов в виде ежедневных инфузий в течение 20 дней. Критериями эффективности служили клинические показатели, данные исследования периферического кровотока и результаты ЭМГ обследования. Отмечено улучшение клинического состояния больных в виде уменьшения болевого синдрома, улучшения чувствительности и сухожильных рефлексов, увеличения силы мышц. Реовазография показала улучшение кровотока в ногах, а ЭМГ обследование – увеличение амплитуды М–ответа и СРВ при стимуляции нервов ног. Применение Актовегина в комплексном лечении 33 больных с синдромом диабетической стопы различной тяжести по классификации Вагнера показало, что подключение препарата к традиционному лечению способствовало быстрому купированию болевого синдрома и ускорению процессов грануляции и эпителизации язвенных дефектов с их заживлением [7]. В исследовании Моргоевой Ф.Э. с соавт. изучена эффективность внутривенной монотерапии Актовегином больных с СД 2 типа [5]. В группу из 30 больных, получавших Актовегин один раз в сутки внутривенно капельно в дозе 400 мг, в 200 мл физиологического раствора в течение 3 недель (15 инфузий) вошли пациенты с длительностью СД не менее 10 лет в возрасте 58,94±1,29 лет (9 мужчин и 21 женщина). Наличие ДПН устанавливалось на основании неврологического осмотра, результатов ЭМГ, количественного сенсорного и автономного тестирования. В группу включались больные, имевшие 2а и 2b стадии ДПН по классификации P.J. Dyck и уровень HbA1C не более 10%. Оценка позитивной невропатической симптоматики (неприятные ощущения больных) проводилась с помощью шкалы TSS (Total Symptom Score – общий счет симптомов невропатии) с анализом выраженности боли, жжения, онемения и парестезий. Негативная невропатическая симптоматика (неврологический дефицит) оценивали по шкале NISLL (Neuropathy Impairment Score – счет невропатических нарушений для ног) с тестированием силы мышц, состояния рефлексов и чувствительности различной модальности. Исследование функционального состояния периферических нервов ног проводилось методом стимуляционной ЭМГ с тестированием двигательного (n. peroneus) и чувствительного (n. suralis) нервов. Количественную оценку поверхностной и глубокой чувствительности, а также автономной кардиоиннервации проводили на приборе CASE–IV (Medical Electronics, США) с определением порогов холодовой, температурной, болевой и вибрационной чувствительности. Об уровне оксидативного стресса судили по содержанию малонового диальдегида в сыворотке крови и гемолизате эритроцитов. Состояние микроциркуляции изучали в ногтевом ложе второго пальца кисти на компьютерном капилляроскопе GY–0,04 (Россия). Цифровой анализ изображения позволял определить скорость кровотока, количество «сладж–феноменов», величину периваскулярного отека. Обследование больных проводилось до и после курса лечения Актовегином. До лечения в группе больных СД с ДПН отмечено достоверное повышение уровня перекисного окисления липидов в плазме и мембранах эритроцитов по сравнению с группой из 15 здоровых добровольцев того же возраста, что свидетельствовало о выраженности оксидативного стресса. Лечение Актовегином привело к снижению уровня малонового диальдегида (МДА) в плазме и мембранах эритроцитов с последующей его нормализацией. Таким образом, Актовегин оказывал несомненный антиоксидантный эффект, действуя на патогенетические механизмы развития ДПН. Состояние реологических свойств крови оценивали методом компьютерной капилляроскопии до и после лечения Актовегином. После лечения Актовегином отмечено достоверное улучшение основных характеристик капиллярного кровотока, причем не только отражающих реологические свойства крови, но и состояние проницаемости стенки капилляра (рис. 2). До лечения выраженность позитивной невропатической симптоматики по шкале TSS была значительной (7,79 балла). После лечения отмечено достоверное уменьшение как суммы баллов по шкале TSS, так и баллов каждого из сенсорных симптомов в отдельности (p<0,001) (табл. 1). Уменьшение выраженности болезненных ощущений у больных после лечения Актовегином не было связано с психоэмоциональными нарушениями, так как не отмечено динамики выраженности депрессии и тревожности после лечения (табл. 2). При оценке до начала лечения выраженность негативной невропатической симптоматики была незначительной (сумма баллов по шкале NISLL – 2,27 балла), причем в основном выявлялись нарушения чувствительности и рефлексов. После лечения Актовегином отмечено достоверное уменьшение выраженности неврологического дефицита (p<0,05), но не отдельных групп симптомов (сила мышц, рефлексы, чувствительность) (рис. 3). При исследовании функционального состояния двигательного нерва не выявлено достоверных изменений основных электрофизиологических характеристик после лечения Актовегином. При исследовании функционального состояния чувствительного нерва выявлено достоверное увеличение амплитуды сенсорного ответа (3,87±2,43 мкВ до лечения и 6,19±3,16 мкВ после лечения, p<0,05) при неизменности СРВ (табл. 3). Исследование порогов температурной и болевой чувствительности методом количественного сенсорного тестирования показало, что после лечения Актовегином происходит уменьшение порогов чувствительности, связанной с состоянием тонких нервных волокон (р<0,05). Не выявлено достоверного увеличения порога вибрационной чувствительности (толстые волокна), хотя при ЭМГ обследовании получено достоверное увеличение амплитуды сенсорного ответа. Вариабельность сердечного ритма, по данным исследования R–R интервалов в покое и при пробе с глубоким дыханием, достоверно не изменилась после лечения Актовегином, хотя отмечена тенденция к нормализации. Таким образом, проведенное исследование показало, что лечение Актовегином, уменьшая выраженность оксидативного стресса и улучшая состояние системы микроциркуляции, приводит у больных СД 2 типа к регрессу клинических проявлений ДПН, что подтверждается улучшением объективных показателей функционального состояния периферических нервов (ЭМГ и количественное сенсорное тестирование). Несмотря на то что все исследования эффективности Актовегина при ДПН показали целесообразность его использования, имеется необходимость проведения масштабного контролируемого исследования с большим числом больных в группе лечения и группе плацебо. В 2007–2008 гг. под патронажем фармацевтической проводилось многоцентровое рандомизированное двойное слепое плацебо–контролируемое исследование с планируемым включением 550 больных («Актовегин против плацебо у больных с диабетической полиневропатией»). В настоящее время результаты статистически обрабатываются и будут предположительно опубликованы в конце 2008 года. Можно надеяться, что данное исследование позволит окончательно решить вопрос об эффективности и безопасности применения Актовегина для лечения ДПН. С патофизиологической точки зрения, не вызывает сомнения, что обладающий антигипоксантным и антиоксидантным действием Актовегин может применяться при широком круге неврологических заболеваний центральной и периферической нервной системы, в патогенезе которых играют роль гипоксия, ишемия и оксидативный стресс. Препарат может использоваться при сосудистых заболеваниях головного мозга, при когнитивных нарушениях, обусловленных сосудистыми или сосудисто–дегенеративными факторами. Заболевания периферической нервной системы, например, ишемические невропатии, тоннельные и радикулярные синдромы, в генезе которых сосудистый фактор играет важную роль, также являются возможной целью для применения Актовегина.
Литература 1. Ефимов А.С. Диабетические ангиопатии // М. «Медицина» – 1989. 2. Каммерер С. Раннее начало терапии у пациентов с деменцией // Русс.мед.журн. – 2003 – №10 – с.583–585. 3. Кунц Г., Шуман Г. Использование актовегина при умеренно выраженной деменции: результаты многоцентрового двойного слепого плацебо–контролируемого рандомизированного исследования // Неврологический журнал – 2004 – №1 – с.40–44. 4. Михалович Н., Хак Дж. Антигипоксанты в неотложной терапии черепно–мозговых травм // Русс. мед. журн. – 2004 – №10 – с.621–625. 5. Моргоева Ф.Э., Аметов А., Строков И.А. Диабетическая энцефалопатия и полиневропатия: терапевтические возможности Актовегина // Русс. мед.журн. – 2005 – № 6 – с.302–304. 6. Нордвик Б. Механизм действия и клиническое применение препарата актовегин // В сб. «Актовегин. Новые аспекты клинического применения» – М. – 2002 – с. 18–24. 7. Оболенский В.Н. Комплексное лечение больных с синдромом диабетической стопы // В сб. «Опыт клинического применения актовегина в эндокринологии» – М., 2005 – с.39–46. 8. Пирадов М.А., Румянцева С.А. РМЖ – 2005 – №15 – с.980–983. 9. Румянцева С.А. Фармакологические характеристики и механизм действия актовегина // В сб. «Актовегин. Новые аспекты клинического применения» – М. – 2002 – с. 3–9. 10. Румянцева С.А., Беневоленская Н.Г., Евсеев В.Н. Антигипоксанты в реаниматологии и неврологии // Русс. мед.журн. – 2004 – №22 – с.302–304. 11. Строков И.А., Моргоева Ф.Э., Строков К.И. и др. Терапевтическая коррекция диабетической полиневропатии и энцефалопатии Актовегином // Русс. мед.журн. – 2006 – №9 – с.698–703. 12. Сыч Ю.П., Зилов А.В. Возможности применения Актовегина в лечении сахарного диабета // Проблемы эндокринологии – 2003 – №3 – с.51–53. 13. Чугунов А.В., Камчатнов П.Р., Кабанов А.А. и др. Возможности метаболической терапии у больных с хроническими расстройствами мозгового кровообращения // Consilium medicum – 2006 – №2. 14. Шилов А.М. Антигипоксанты и антиоксиданты в кардиологической практике // Русс. мед. журн.– 2004 – №2 – с.112–114. 15. Шишкова В.Н. Перспективы применения препарата Актовегин у пациентов с метаболическим синдромом и предиабетом. Современные представления о нарушениях углеводного обмена // РМЖ – 2007 – № 27. 16. Шмырев В.И., Боброва Т.А. Актовегин и ксефокам в комбинированной терапии вертеброгенных болевых синдромов у пожилых // Лечение нервных болезней – 2002 – №1 – с.37–39. 17. Шмырев В.И., Остроумова О.Д., Боброва Т.А. Возможности препарата Актовегин в профилактике и лечении деменции // Русс.мед.журн. – 2003 – №4 – с.216–220. 18. Яворская В.А., Егоркина О.В., Машкин О.Н. и др. Клинический опыт применения Актовегина при диабетической полинейропатии // В сб. «Опыт клинического применения актовегина в эндокринологии» – М. – 2005 – ст.27–30. 19. Янсен В., Брукнер Г.В. Лечение хронической цереброваскулярной недостаточности с использованием драже Актовегин форте (двойное слепое плацебо–контролируемое исследование) // Русс. мед.журн. – 2002 – №12–13 –с.543–546. 20. Brownly M. Biochemistry and molecular cell biology of diabetic complications // Nature – 2001 – Vol.414 – P.813–820. 21. Jacob S., Dietze G.J., Machicao F. et al. Improvement of glucose metabolism in patients with type II diabetes after treatment with hemodialysate // Arzneimittelforschung – 1996 – №3 – P.269–272. 22. Jansen W., Beck E. Лечение диабетической полинейропатии. Контролируемое двойное слепое исследование // В сб. «Опыт клинического применения актовегина в эндокринологии» – М., 2005 – с.11–20. 23. Kinzler E., Lehmann E., Groth J. et al. Actovegin in der Behandlung geriatrischer Patienten mit hirnorganischem psychosyndrom // Munch Med Wochenschr – 1988 – Vol. 130 – P.644–646. 24. Oswald W.D., Steger W., Oswald B. et al. Die Verbesserung fluider kognitiver Leistungen als Indikator fur die klinische Wirksamkeit einer nootropen Substanz.Eine placebokontrollierte Doppelblind–Studie mit Actovegin // Z. Gerontopsychol.–psychiatrie. – 1991 – Vol.4 – P.209–220. 25. Saletu B., Grunberger J., Linzmayer L. et al. EEG brain mapping and psychometry in age–associated memory impairment after acute and 2–week infusions with the hemoderivative Actovegin: double–blind, placebo–controlled trials // Neurophychobiol. – 1990/1991 – Vol.24 – P.135–148. 26. Semlitsch H.V., Anderer P., Saletu B. et al. Topographic mapping of cognitive event–related potentials in a double–blind, placebo–controlled study with the hemoderivative Actovegin in age–associated memory impairment // Neurophychobiol. – 1990/1991 – Vol.24 – P.49–56.
Список использованной литературы
- Карпов Андрей Владимирович «Комплексное лечение больных с критиче-ской ишемией нижних конечностей». Автореферат на соискание ученой степени доктора медицинских наук. Санкт Петербург, 2007 г.;
- Морозов Михаил Юрьевич «Оценка эффективности мидокалма,эмоксипина и актовегина в комплексном лечении больных облитерирующим атеросклерозом нижних конечностей». Автореферат на соискание ученой степени кандидата медицинских наук. Саранск, 2007 г.;
- Майнугин С. В., Фомин А. А., Красавин В. А., Красавин В. Г., Аверин С. В., Каменский С. Ю., Худояров Т. А.. «Первый опыт использования технологии лазерной допплеровской визуализации при выборе уровня ампутации нижней конечности у больных с критической ишемией // Тромбоз, гемостаз и реология». – 2012 г., №3;
- Фомин А. А., Майнугин С. В., Красавин В. А., Казмирук Н. А., Каменский С. Ю., Худояров Т. А. «Лазерная допплеровская визуализация в практике отделения гнойной хирургии // Тромбоз, гемостаз и реология» – 2012 г. , №4;
- Brecht M., de Grool H. «Protection from hypoxic injury in cultured hepatocytes hy glycine, alanine and serine. Amino Acids». 1994. Vol.6. P. 25-35.
диабет ишемия ишемия нижних конечностей хирургия
Диабетическая полиневропатия: эффективность Актовегина
И.А. СТРОКОВ
1д.м.н., профессор,
А.С. ФОКИНА
2, О.C.
ФЕДОРОВА
3,
В.А. ГОЛОВАЧЕВА
1 1
Кафедра нервных болезней Первого МГМУ им. И.М. Сеченова
2
Кафедра эндокринологии Первого МГМУ им. И.М. Сеченова
3
ФГБУ «Федеральное бюро медико-социальной экспертизы», МоскваСахарный диабет (СД) имеет широкое распространение во всем мире, так, в США СД выявлен у 12% населения в возрасте 60 лет и старше, а в Европе в этой возрастной группе – у 8–10%. Распространенность СД постоянно растет, опережая самые пессимистические прогнозы начала века, к тому же наблюдается «омоложение» СД 2-го типа. При СД в результате нарушения метаболических процессов из-за гипергликемии и патологии кровотока в сосудах микроциркуляторной системы формируются разнообразные поражения большинства органов и систем организма. К «классическим» осложнениям СД относятся нефропатия, ретинопатия и дистальная симметричная сенсорно-моторная полиневропатия (ДПН), причем именно ДПН наиболее часто выявляется у больных СД [1].
Поражения периферических нервов у больных СД многообразны, что отражено в классификации диабетических невропатий [2]. Самым распространенным вариантом диабетической невропатии является ДПН (30–50% больных СД), другие диабетические невропатии (диабетические болевые тонковолоконные полиневропатии, диабетическая амиотрофия, диабетическая торако-абдоминальная невропатия, моторная диабетическая невропатия, диабетические мононевропатии) наблюдаются гораздо реже (1–3% больных СД). С. Тесфайе (S. Tesfaye) с соавтор. предлагает для ДПН термин «типичная» диабетическая полиневропатия, а для других вариантов диабетических полиневропатий (тонковолоконных) – термин «атипичная» [3, 4]. Едва ли это является оправданным, т. к. термин «типичный» подразумевает самый распространенный вариант заболевания, а термин «атипичный» предполагает необычное течение, симптоматику, тяжесть того же самого заболевания, т. е. имеющего аналогичные патофизиологические механизмы развития. Вместе с тем тонковолоконные диабетические полиневропатии имеют принципиально другие клинические проявления, иное начало, другие характеристики объективных методов исследования, состояния функции периферических нервов и, видимо, другие механизмы формирования [2, 5, 6]. Таким образом, речь идет о принципиально отличающихся от ДПН формах диабетических полиневропатий. В этой связи в настоящее время практическим врачам не следует использовать тиремин «атипичная диабетическая полиневропатия». Более целесообразно оставить прежние квалификационные названия: острая болевая диабетическая полиневропатия (синдром Элленберга) и острая болевая диабетическая полиневропатия, связанная с нормализацией углеводного обмена.
ДПН наиболее часто встречается в клинической практике врача невролога и эндокринолога, развивается медленно, имеет субклиническую фазу и при СД 2-го типа может быть манифестным его проявлением. Многие больные при наличии даже достаточно выраженного поражения периферических нервов не предъявляют жалоб, и полиневропатия может выявляться только при неврологическом осмотре и электрофизиологическом обследовании. ДПН относится к т. н. зависящим от длины нервов невропатиям, поэтому ее фенотип достаточно типичен: позитивная и негативная невропатическая симптоматика всегда преобладает в ногах, в дистальных отделах (пальцы, стопы, голени), а из-за поражения в первую очередь тонких волокон чувствительные нарушения всегда доминируют над двигательными. На поздних стадиях ДПН генерализованное поражение периферических нервов проявляется одновременным страданием соматических (двигательных и чувствительных) и автономных нервных волокон. Согласно классификации стадий ДПН, предложенной P.J. Dyck [7], выделяют состояния с отсутствием нейропатии – N0, субклиническую фазу ДПН, при которой нет позитивной и выраженной негативной невропатической симптоматики, однако при обследовании (ЭМГ, количественное сенсорное и автономное тестирование) выявляется нарушение функции соматических или автономных нервов – N1, причем стадия N1 устанавливается также в тех случаях, когда имеется какой-либо один симптом, указывающий на неблагополучие периферических нервов (только снижение ахилловых рефлексов или только снижение одной сенсорной модальности). При наличии типичных жалоб больных (боль, жжение, онемение, парестезии) и/или выраженного сенсорного неврологического дефицита определяют стадию симптомной ДПН – N2a, а при выявлении в клинике симптомов вовлечения двигательных волокон (больной не может стоять или ходить на пятках) – стадию N2b. В том случае, если поражение периферических нервов привело к нарушению социальной и трудовой адаптации больных (выраженный болевой синдром, диабетическая стопа, тяжелая ортостатическая гипотония), речь идет о стадии N3. Диагноз ДПН может быть поставлен только больным с установленным на основании международных критериев СД 1-го или 2-го типов. Среднее время развития ДПН – около 9 лет, поэтому раннее развитие полиневропатии должно заставлять исключать у больных другую природу формирования патологии периферических нервов. Приблизительно у 10% больных СД выявляются полиневропатии не диабетической этиологии [8]. Диагностика ДПН основывается на выявлении типичной позитивной невропатической симптоматики (боль, жжение, онемение, парестезии), а также позитивной невропатической симптоматики (снижение чувствительности различных модальностей (в первую очередь болевой, температурной и вибрационной), снижения или отсутствия сухожильных рефлексов на ногах, в первую очередь ахилловых). Дополнительными могут быть симптомы поражения периферических симпатических волокон на стопах: сухость кожи, мозоли, изменение температуры (повышение) и цвета кожи (покраснение). Для объективного подтверждения поражения соматических нервных волокон применяется ЭМГ, которая выявляет снижение скорости проведения возбуждения (СРВ) по двигательным (малоберцовый и большеберцовый нервы) и чувствительным (икроножный) нервам ног, снижение амплитуды моторного и сенсорного ответов, увеличение резидуальной латенции. Для выявления поражения автономных волокон используется изучение вариабельности сердечного ритма по R-R интервалам в покое, при глубоком дыхании, при ортостатической пробе, также применяется исследование спектра мощности высоких и низких частот ЭКГ при суточном мониторировании. С целью выявления поражения автономных нервов конечностей применяется исследование кожных вызванных симпатических ответов. При ДПН могут отсутствовать ответы или наблюдается значительное удлинение латенции [6]. Наиболее точно о наличии ДПН у пациентов с СД позволяет судить разработанный в клинике Мейо т. н. композиционный счет – NIS LL (Neuropathy Impairment Score Low Limb – счет невропатических симптомов в ногах) + 7 электрофизиологических тестов [11]. В последние годы самым ранним методом выявления патологии периферических нервов у больных СД считается конфокальная микроскопия тонких нервов роговицы и биопсия кожи стопы с исследованием состояния тонких эпидермальных волокон. К факторам риска развития ДПН относятся плохой контроль гликемии, 1-й тип и длительность СД, избыточный вес, кроме того, возможно, играют роль артериальная гипертензия, возраст, курение, дислипидемия, низкие уровни инсулина и С-пептида. Интенсивная терапия больных СД 1-го типа инсулином может уменьшить риск развития сосудистых нарушений и ДПН, хотя не в состоянии полностью исключить ее возникновение или привести к серьезному регрессу симптоматики [14]. В обзоре проспективных исследований влияния уровня гликемии на ДПН подчеркнуто, что длительное поддержание нормогликемии у больных СД 1-го типа способно улучшить функцию соматических и автономных нервов. При 2-м типе СД убедительных данных о возможности уменьшить риск развития ДПН на фоне интенсивной терапии инсулином к наcтоящему времени не получено. В то же время не вызывает сомнения, что хороший контроль СД является приоритетным в профилактике развития ДПН и обеспечении максимальной эффективности ее патогенетической терапии.
В 2001 г. М. Браунли в статье, опубликованной в журнале Nature, обобщил экспериментальные и клинические данные о молекулярных и биохимических основах патогенеза ДПН. В 2005 г. М. Браунли обобщил результаты экспериментальных и клинических исследований патогенеза поздних осложнений СД в Бентингской лекции [9, 10]. Согласно современным представлениям, в формировании патологического процесса в нервных волокнах, эндотелии и сосудистой стенке при ДПН ведущую роль играет блокада гексозоаминового пути утилизации глюкозы с накоплением промежуточных продуктов обмена глюкозы, в частности, глюкозо-6-фосфата и глицеральдегид-3-фосфата. Повышение концентрации промежуточных продуктов обмена запускает активацию протеинкиназы С и образование большого количества AGEs (Advanced Glycated end products), что приводит к нарушению эндотелий-зависимых реакций и функции структур нервных клеток, например, аксоплазматического тока. Причиной блокады обмена глюкозы является активизация специальных полимераз (PARP), возникающая в ответ на разрушение митохондриальной ДНК супероксидом. Оксидативный стресс, причиной развития которого при СД является образование большого числа свободных радикалов на фоне слабости собственной антиоксидантной системы (снижение содержания антиоксидантных ферментов), ответственен за нарушение обмена глюкозы в цитоплазме клеток. Эту теорию поддерживают факты, подтверждающие зависимость сроков развития ДПН у больных СД от полиморфизма определенных генов. Найдена ассоциация сроков развития ДПН с полиморфизмом генов митохондриальной и эндотелиальной супероксиддисмутазой и гена PARP, что хорошо согласуется с представлением о ведущей роли митохондриального супероксида в формировании поздних осложнений СД [12].
Поражение эндоневральных сосудов при СД возникает в результате метаболических нарушений, но в дальнейшем начинает играть самостоятельную роль в формировании патологии периферических нервов. Показано, что имеется корреляция между числом нервных волокон в периферическом нерве и толщиной стенки эндоневральных сосудов при СД и, таким образом, сосудистый компонент является основополагающим для развития ДПН [13]. По меткому выражению А.С. Ефимова, «начинается диабет как болезнь обмена, а заканчивается как сосудистая патология» [27], что необходимо учитывать при назначении патогенетической терапии больным с ДПН.
Лечение ДПН базируется на использовании препаратов, действующих на патогенетические механизмы ее формирования, симптоматическом лечении, например, применении противоболевых препаратов (антиконвульсанты, антидепрессанты, местные анестетики, опиоиды), профилактике поздних осложнений и исключении, по возможности, факторов риска их развития. Патогенетическая терапия ДПН определяется современными представлениями о механизмах формирования поздних осложнений СД, подчеркивающими взаимосвязь метаболических и сосудистых факторов, что неоднократно рассматривалось в литературе. В этой связи обсуждаются возможности применения: 1) блокаторов альдозоредуктазы с целью уменьшения утилизации глюкозы по полиоловому пути; 2) препаратов γ-линоленовой кислоты для нормализации обмена эссенциальных жирных кислот и синтеза простагландинов; 3) сосудорасширяющих препаратов и аналогов простагландинов, способствующих уменьшению гипоксии и увеличению эндоневрального кровотока; 4) ингибиторов протеинкиназы С для улучшения эндотелий-зависимых реакций сосудистой стенки; 5) факторов роста нервов; 6) ингибиторов образования и накопления конечных продуктов избыточного гликирования AGEs, 7) антиоксидантов,  тиамина. В настоящее время основными препаратами, доказавшими свою эффективность при ДПН, являются антиоксиданты, Актовегин и тиамин.
тиамина. В настоящее время основными препаратами, доказавшими свою эффективность при ДПН, являются антиоксиданты, Актовегин и тиамин.
Основной антиоксидантный препарат, используемый для лечения ДПН – α-липоевая (тиоктовая) кислота (АЛК), являющаяся мощным естественным жирорастворимым антиоксидантом. Эффективность АЛК при ДПН была показана в целом ряде клинических исследований, проведенных в рамках доказательной медицины, и подтверждена метаанализом четырех исследований эффективности АЛК при ДПН [15].
Еще одной возможностью влиять на патогенетические механизмы формирования ДПН является воздействие на активность фермента транскетолазы. Этот фермент способен уменьшать патологическое накопление промежуточных продуктов метаболизма глюкозы. Активность фермента прямо зависит от концентрации тиамина. В 2003 г. гипотеза о возможности тиамина уменьшать выраженность метаболических нарушений, вызванных гипергликемией, получила доказательство в экспериментальном исследовании, показавшем способность тиамина активировать транскетолазу и предотвращать сосудистое поражение сетчатки при СД [16, 17].
В последние годы получены данные об эффективности лечения ДПН Актовегином. Препарат Актовегин фирмы Takeda (Япония) содержит высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят. В состав препарата входят органические низкомолекулярные соединения, что исключает развитие прионных болезней, например болезни Крейцфельда-Якоба, при введении Актовегина в вену человека. Технология получения Актовегина исключает наличие белковых компонентов, обладающих антигенными и пирогенными свойствами. Актовегин представляет собой смесь природных веществ неорганической (электролиты – натрий, калий, кальций, магний, хлориды, соединения азота) и органической (ацетат, лактат, аминокислоты, нуклеозиды, гликосфинголипиды, промежуточные продукты углеводного и жирового обмена, антиоксидантные ферменты) природы. Точных данных о фармакокинетике Актовегина нет, т. к. он является многокомпонентным препаратом, и в его состав входят вещества, исходно содержащиеся в организме человека. Методика производства Актовегина и обсуждение исследований по изучению механизмов его действия детально обсуждаются в обзорах, посвященных почти полувековой истории этого препарата [18, 23]. Из экспериментальных работ известно, что активизация Актовегином захвата глюкозы клетками начинается через 5 минут после внутривенного введения препарата и пик его действия выявляется через 120 минут. В настоящее время считается, что инсулиноподобный эффект Актовегина и стимуляция метаболизма глюкозы связаны с инозитолфосфоолигосахаридами, которые содержатся в препарате. За счет того, что Актовегин модулирует активность внутриклеточного переноса глюкозы, происходит активизация липолиза [19]. Антигипоксантное действие Актовегина связано с его способностью увеличивать поглощение тканями кислорода, что повышает устойчивость клеток к гипоксемии [20, 21]. В результате поступления кислорода в ткани возрастает образование макроэргических фосфатов (АТФ, АДФ), активируются ферменты окислительного фосфорилирования, ускоряется синтез углеводов и белков и распад продуктов анаэробного гликолиза (лактата), уменьшается энергетический клеточный дисбаланс. Увеличение поглощения кислорода сосудистой стенкой при введении Актовегина приводит к нормализации эндотелий-зависимых реакций и снижению периферического сосудистого сопротивления. В результате в клеточных структурах повышается образование высокоэнергетических фосфатов. Улучшение кровотока в системе микроциркуляции под действием Актовегина, связанное с нормализацией эндотелий-зависимых реакций (вазодилятации) и снижением периферического сосудистого сопротивления, отражает увеличение кислородного метаболизма сосудистой стенки. Антиоксидантный эффект Актовегина обеспечивается наличием в составе препарата супероксиддисмутазы, что подтверждено методом атомно-эмиссионной спектрометрии, а также ионов магния, повышающих активность глутатионсинтетазы, осуществляющей перевод глутатиона в глутамин [22] (рис. 1).
В недавнем исследовании M.W. Еlminger выявлено, что Актовегин уменьшает апоптоз (по активности каспазы-3), увеличивает число синаптических связей и дозозависимо уменьшает оксидативный стресс в нейронах [24]. В исследовании A. Dieckmann с соавтор. обнаружено, что Актовегин улучшает проведение возбуждения по чувствительным волокнам и уменьшал апоптоз в волокнах седалищного нерва за счет уменьшения активности PARP, что подчеркивает влияние Актовегина на патогенетические механизмы формирования клеточного поражения при СД [25]. Актовегин применяется в виде 10- или 20%-ного раствора для внутривенного (в 250 мл физиологического раствора) или внутримышечного введения или драже по 200 мг для приема внутрь.
Побочные явления препарата в основном включают редкие аллергические реакции. В литературе имеется описание только одного случая анафилактического шока после внутривенного введения препарата с развитием поражения печени и почек, но не у больного при лечении врачом, а у спортсмена [26]. В этой связи можно думать, что были нарушены медицинские нормы при введении препарата. Интерес к применению Актовегина при ДПН связан с тем, что препарат обладает антиоксидантными свойствами и способностью улучшать утилизацию кислорода и глюкозы в клетки, что крайне важно при СД, когда в тканях формируется энергетическая недостаточность, связанная как с феноменом псевдогипоксии, так и с истинной гипоксией (рис. 2).
В работе В.А. Яворской с соавт. в открытом исследовании Актовегин применяли для лечения ДПН у 24 больных с СД 1-го и 2-го типов в виде ежедневных инфузий в течение 20 дней. Отмечено улучшение клинического состояния больных в виде уменьшения болевого синдрома, улучшения чувствительности и сухожильных рефлексов, увеличения силы мышц. Реовазография показала улучшение кровотока в ногах, а ЭМГ обследование увеличение амплитуды М-ответа и СРВ при стимуляции нервов ног [28]. Применение Актовегина в комплексном лечение 33 больных с синдромом диабетической стопы различной тяжести по классификации Вагнера показало в рамках открытого исследования, что подключение препарата к традиционному лечению способствовало быстрому купированию болевого синдрома и ускорению процессов грануляции и эпителизации язвенных дефектов с их заживлением [29].
В исследовании Ф.Э. Моргоевой с соавт. изучена в открытом исследовании эффективность внутривенной монотерапии Актовегином больных с СД 2-го типа [30]. В группу из 30 больных, получавших Актовегин один раз в сутки внутривенно капельно в дозе 400 мг, разведенном в 200,0 мл физиологического раствора, в течение 3 недель (15 инфузий) вошли пациенты с длительностью СД не менее 10 лет в возрасте 58,94 ± 1,29 лет (9 мужчин и 21 женщина). До лечения в группе больных СД с ДПН отмечено достоверное повышение уровня перикисного окисления липидов в плазме и мембранах эритроцитов по сравнению с группой из 15 здоровых добровольцев того же возраста, что свидетельствовало о выраженности оксидантного стресса. Лечение Актовегином привело к снижению уровня малонового диальдегида (МДА) в плазме и мембранах эритроцитов с его нормализацией. Таким образом, Актовегин оказывал несомненный антиоксидантный эффект, действуя на патогенетические механизмы развития ДПН. Состояние реологических свойств крови оценивали методом компьютерной капилляроскопии до и после лечения Актовегином. После лечения Актовегином отмечено достоверное улучшение основных характеристик капиллярного кровотока, причем не только отражающих реологические свойства крови, но и состояние проницаемости стенки капилляра. Клиническое исследование показало достоверное уменьшение позитивной и негативной невропатической симптоматики (p < 0,05) после лечения Актовегином. При исследовании функционального состояния чувствительного нерва выявлено достоверное увеличение амплитуды сенсорного ответа (3,87 ± 2,43 мкВ до лечения и 6,19 ± 3,16 мкВ после лечения, p < 0,05) при неизменности СРВ.
Исследование порогов температурной и болевой чувствительности методом количественного сенсорного тестирования показало, что после лечения Актовегином происходит уменьшение порогов чувствительности, связанной с состоянием тонких нервных волокон (р < 0,05). Таким образом, проведенное исследование показало, что лечение Актовегином, уменьшая выраженность оксидативного стресса и улучшая состояние системы микроциркуляции, приводит у больных СД 2-го типа к регрессу клинических проявлений ДПН, что подтверждается улучшением объективных показателей функционального состояния периферических нервов.
W. Jansen и E. Beck изучили действие перорального приема Актовегина на больных с ДПН в рамках контролируемого исследования: одна группа из 35 больных получала плацебо, другая группа из 35 больных – таблетки Актовегина (по 600 мг 3 раза в день) в течение 24 недель [31]. Критериями оценки эффективности препарата служили клинические характеристики полиневропатии (сухожильные рефлексы, поверхностная и глубокая чувствительность, интенсивность болевого синдрома) и ЭМГ показатели функции периферических нервов (скорость распространения возбуждения (СРВ), а также расстояние, которое больные могли пройти без боли. Улучшение состояния больных в группе лечения Актовегином отмечено у большинства пациентов через 8 недель после начала лечения, а оптимальный эффект достигался через 16 недель лечения (рис. 3). Показано достоверное улучшение на фоне лечения Актовегином по сравнению с группой плацебо практически всех клинических показателей: расстояния ходьбы без боли, сухожильных рефлексов, поверхностной и глубокой чувствительности (р < 0,01). СРВ достоверно (p < 0,001) увеличивалась в группе лечения по сравнению с группой плацебо. Пациенты группы лечения чувствовали себя лучше и предъявляли меньше жалоб на нарушение психоэмоционального состояния, что коррелировало с улучшением их физического состояния.
В 2009 г. опубликованы результаты многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования лечения больных СД 2 типа с ДПН препаратом Актовегин [32]. Многоцентровое двойное слепое плацебо-контролируемое рандомизированное клиническое исследование в параллельных группах проводилось в 26 клинических центрах в России, Украине и Казахстане. Целью исследования была оценка клинической эффективности и безопасности Актовегина по сравнению с плацебо у пациентов с СД 2-го типа и клиническими проявлениями периферической диабетической полиневропатии после внутривенных инфузий Актовегина или плацебо с последующим переходом на прием драже Актовегина. Всего в исследование включено 567 больных. 281 больному проведено сначала 20 внутривенных инфузий Актовегина (250 мл 20% раствора – 2,0 г), а затем в течение 140 дней пациенты получали драже Актовегина по 600 мг 3 раза в день (1 800 мг/день). 286 больных СД с ДПН получали внутривенную плацебо-терапию, а затем драже с плацебо. Критериями включения были: диагноз СД 2 типа, возраст 18–65 лет, уровень гликированного гемоглобина ниже 10%, наличие клинических проявлений ДПН, то есть оценка по шкале TSS ≥ 6 баллов и NIS-LL ≥ 2 баллов, порог вибрационной чувствительности ≤ 30В, адекватное кровоснабжение стопы, доказанное наличием пульса на задней большеберцовой артерии и тыльной артерии стопы. Основными критериями эффективности препарата в этом исследовании были положительная невропатическая симптоматика, которая оценивалась по шкале TSS, и порог вибрационной чувствительности, которая тестировалась в нескольких точках на ногах (лодыжка, пальцы стопы) с помощью биотензиометра. Вторичными критериями эффективности служили отдельные показатели шкалы TSS, шкала NIS LL и показатели качества жизни (краткая шкала – SF 36).
Наилучшие результаты отмечены в отношении позитивной невропатической симптоматики, причем улучшение отмечалось как по суммарной оценке всех симптомов, так и в отношении каждого конкретного симптома. Выявлено достоверное уменьшение сенсорного неврологического дефицита, в отношении изменения рефлексов и силы мышц отмечена положительная тенденция к улучшению, не достигающая степени достоверности. Возможно, это связано с тем, что рефлексы и особенно сила мышц были изменены у относительно небольшого числа больных. Объективные показатели состояния проприоцептивных нервных волокон оценивались с помощью оценки порогов вибрационной чувствительности. Уменьшение порога вибрационной чувствительности было высокодостоверным при использовании Актовегина по сравнению с плацебо (рис. 4). В течение всего исследования проводилось определение уровня глюкозы натощак и показателя 2-месячной компенсации СД (HbA1c). Полученные результаты свидетельствуют о том, что эффективность Актовегина связана с действием препарата, а не с изменением контроля СД.
В исследовании не отмечено значимых побочных явлений. Всего от 192 пациентов получено 386 сообщений о нежелательных явлениях (Актовегин – 186, плацебо – 198). Наиболее частыми нежелательными явлениями были головная боль (Актовегин – 22, плацебо – 19), гипогликемия (21/19), артериальная гипертензия (10/13), гипергликемия (6/16), повышение артериального давления (7/11) и инфекции дыхательных путей (8/5). Сообщалось о 21 серьезном нежелательном явлении, из которых 10 возникли у 7 пациентов, получавших Актовегин, и 11 у 10 пациентов, получавших плацебо. Причинная связь считалась возможной для 1 серьезного нежелательного явления (Актовегин: сердечная недостаточность) и для 1 – вероятной (плацебо: гиперчувствительность). Ни один пациент не умер в ходе исследования.
Данное исследование, проведенное в рамках (GCP – Good Clinical Practice (надлежащей клинической практики), положительно ответило на вопрос об эффективности и безопасности применения Актовегина для лечения ДПН. Были сделаны выводы, что последовательная внутривенная, а затем пероральная терапия Актовегином в течение 160 дней улучшила симптомы невропатии, снизила порог вибрационной чувствительности и улучшила сенсорную функцию у пациентов с СД 2-го типа и диабетической полиневропатией. Показано значимое улучшение качества жизни (по шкале психического здоровья) в группе Актовегина по сравнению с плацебо. Отмечено, что группы пациентов, получавших Актовегин и плацебо, имели сравнимый профиль безопасности.
Таким образом, с патофизиологической точки зрения не вызывает сомнения, что обладающий антигипоксантным и антиоксидантным действием Актовегин может применяться при ДПН, а также широком круге заболеваний центральной и периферической нервной системы, в патогенезе которых играет роль гипоксия, ишемия и оксидативный стресс.
Литература
1. Строков И.А., Мельниченко Г.А., Альбекова Ж.С. и др. Распространенность и факторы риска развития диабетической полиневропатии у стационарных больных сахарным диабетом 1-го типа // Нервно-мышечные болезни. – 2012. – №1. – С. 25–31. 2. Boulton A.J.M., Vinic A.I., Arezzo J.C. et al. Diabetic neuropathies: a statement by the American Diabetes Associacion // Diabetes Care 2005; 28: 956–962. 3. Tesfaye S., Boulton A.J.M., Dyck P.J. et al. Diabetic neuropathies: update on definitions, diagnostic criteria, estimation of severity, and treatments // Diabetes Care 2010; 33(10): 2285–2293. 4. Храмилин В.Н. Диабетическая полинейропатия. Обзор современных рекомендаций // РМД. Эндокринология 2012; 32:1580–1582. 5. Archer A.G., Watkins P.J., Thomas P.K. et al. The natural history of acute painful neuropathy in diabetes mellitus // J Neurol Neurosurg Psychiatry 1983; 46: 491–499. 6. Строков И.А. Диабетическая невропатия // Сахарный диабет 2 типа. Проблемы и решения. ГЭОТАР-Медиа 2011. – С. 506–529. 7. Dyck P.J. Detection, characterization and staging of polyneuropathy: assessed in diabetic. Muscle Nerve. 1998; 11(1): 21–32. 8. Dyck P.J., Davies J.L., Wilson D.M. et al. Risk factors for severity of diabetic polyneuropathy: intensive longitudinal assessment of the Rochester Diabetic Neuropathy Study cohort // Diabetes Care 1999; 22: 1479–1486. 9. Brownly M. Biochemistry and molecular cell biology of diabetic complications // Nature. – 2001. – Vol. 414 – P. 813–820. 10. Brownlee M. The pathobiology of diabetic complications. A unifying mechanism. Diabetes 2005; 54: 1615–1625. 11. Dyck P.J., Davis J.L., Litchy W. J. et al. Longitudinal assessment of diaberic polyneuropathy using a composite score in the Rochester Diabetic Neuropathy Study cohort. Neurology 1997; 49: 229–239. 12. Nikitin A.G., Chudakova D.A., Strokov I.A. et al. Leu54Phe and Val762Ala polymorphisms in the poly(ADP-ribose)polymerase-1 gene are associated with diabetic polyneuropathy in Russian type 1 diabetic patients.Diabetes Res Clin Pract 2008; 79 (3): 446–452. 13. Dyck P.J.B., Dyck P.J. Diabetic polyneuropathy. In Dyck P.J., Thomas P.K. ed. “Diabetic polyneuropathy”, 2nd ed, Philadelphia, Pa: W.B. Saunders 1999: 255–278. 14. DCCT Group. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993; 329: 977–986. 15. Ziegler D., H.-J. Tritschler, Строков И.А., Аметов А.С. Лечение диабетической полиневропатии тиоктовой кислотой (обзор литературы) // Фарматека. – 2008. – №17. – С. 28–35. 16. Строков И.А., Ахмеджанова Л.Т., Солоха О.А. Применение высоких доз витаминов группы В в неврологии // Трудный пациент. – 2009. – №10. – С. 17–22. 17. Строков И.А., Строков К.И., Альбекова Ж.С. Тиамин и бенфотиамин в лечении поздних осложнений сахарного диабета // Доктор.Ру. – 2009. – №6 (2). – С. 14–18. 18. Buchmayer F., Pleiner J., Elminger M.W. et al. Actovegin® : a biological drug for more than 5 decades // Wien Med Wochenschr – 2011 – Vol. 161 (3–4) – P. 80–88. 19. Jacob S., Dietze G.J., Machicao F. et al. Improvement of glucose metabolism in patients with type II diabetes after treatment with hemodialysate // Arzneimittelforschung. – 1996. – №3. – P. 269–272. 20. Kuninaka T, Senga Y, Senga H, Weiner M. Nature of enhanced mitochondrial oxidative metabolism by a calf blood extract. J Cell Physiol. 1991; 146(1): 148–155. 21. Reichel H., Weiss C., Leichweiss H.P. The effects of a blood extract on the oxygen uptake of isolated artificially perfused kidney and skeletal muscles in rats //Arzneimitte- Forschung / Drug Research 1968; 18: 1019–1021. 22. Нордвик Б. Механизм действия и клиническое применение препарата Актовегин // В сб. «Актовегин. Новые аспекты клинического применения». М., 2002 – С. 18–24. 23. Machicao F., Mureanu D.F., Hundsberger Y. и др. Плейотропный нейропротективный и метаболический эффект Актовегина // Нервно-мышечные болезни. – 2012. – № 4. – С. 3–10. 24. Elminger M.W., Kriebel M., Ziegler D. Neuroprotective and anti-oxidative effects of the hemodialysate actovegin on primary rat neurons in vitro // Neuromolecular Med 2011; 13(4): 266–274. 25. Dieckmann A., Kriebel M., Andriambeloson E. et al. Treatment with Actovegin® improves sensory nerve function and pathology in streptozotocin-diabetic rats via mechanisms involving inhibition of PARP activation // Exp Clin Endocrinol Diabetes 2011; 120(3): 132–138. 26. Mailo L. Anaphylactic shock with multiorgan failure in a cyclist after inravenous administration of Activegin // Ann Intern Med 2008; 148–407. 27. Ефимов А.С. Диабетические ангиопатии. М.: Медицина, 1989. 28. Яворская В.А., Егоркина О.В., Машкин О.Н. и др. Клинический опыт применения Актовегина при диабетической полинейропатии // В сб. «Опыт клинического применения Актовегина в эндокринологии» М. 2005: 27–30. 29. Оболенский В.Н. Комплексное лечение больных с синдромом диабетической стопы // В сб. «Опыт клинического применения Актовегина в эндокринологии» М., 2005: 39–46. 30. Моргоева Ф.Э., Аметов А., Строков И.А. Диабетическая энцефалопатия и полиневропатия: терапевтические возможности Актовегина // Русс. мед. журн. – 2005. №6. – С. 302–304. 31. Jansen W., Beck E. Лечение диабетической полинейропатии. Контролируемое двойное слепое исследование // В сб. «Опыт клинического применения Актовегина в эндокринологии». – М., 2005. С. 11–20. 32. Ziegler D., Movsesyan L., Mankovsky B. et al. Treatment of symptomatic polyneuropathy with actovegin in type 2 diabetic patients // Diabetes Care 2009; 32(8): 1479–1484.