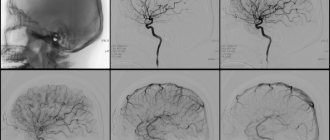
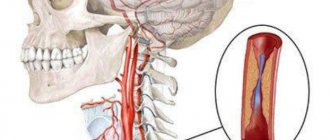
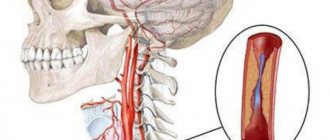
Под извитостью сонных и позвоночных артерий подразумевается их деформация, аномальные переплетение или изогнутость.
Как правило, подобные явления являются врождёнными. Наследственность патологии заключается в преобладании эластичных волокон над коллагеновыми, вследствие чего стенки артерий быстрее изнашиваются и начинают деформироваться. Также патологическая извитость сонных артерий может развиться и вследствие, например, длительной гипертонической болезни или атеросклероза.
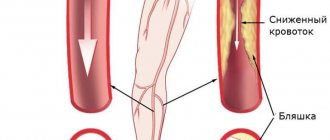
Определение «патологическая» обозначает угрозу, которую извитость артерий может нести здоровью и жизни человека. Затруднение кровоснабжения вследствие патологических деформаций сонных и позвоночных артерий ведёт к развитию угрозы инсульта.
Виды заболевания
Выделяют следующие виды патологической извитости сонных и позвоночных артерий:
- удлинение артерии. Наиболее часто встречается удлинение внутренней сонной или позвоночной артерии, которое приводит к образованию изгибов по ходу сосуда. Удлиненная артерия редко причиняет беспокойство и нередко обнаруживается лишь при случайном исследовании. С возрастом эластичность артериальной стенки меняется, и изгибы артерии могут стать перегибами, с развитием нарушений мозгового кровообращения;
- кинкинг — перегиб артерии под острым углом. Кинкинг может быть врожденным, но также появлению перегибов может способствовать артериальная гипертония или прогрессирующий атеросклероз во внутренней сонной артерии. Кинкинг сонной артерии проявляется преходящими нарушениями мозгового кровообращения. При кинкинге позвоночной артерии развивается вертебрально-базилярная недостаточность (обратимое нарушение функций мозга, вызванное недостатком кровоснабжения);
- койлинг — образование петли сонной или позвоночной артерии, ведущее к значительным изменениям кровотока в ней. Характер изгибов при койлинге может изменяться, в зависимости от положения тела, артериального давления. Кровоток принимает хаотичный характер, что приводит к снижению давления крови после петли и, соответственно, к снижению кровоснабжения мозга.
Патологическая извитость сонных артерий
Январь 6, 2016
Одним из наиболее малоизученных и загадочных заболеваний сонных и позвоночных артерий является патологическая извитость (кинкинг). У каждого третьего умершего от инсульта находили патологические изгибы сонных или позвоночных артерий. У 16-26% взрослого населения выявляются различные варианты удлинения и извитости сонных или позвоночных артерий на шее. Причина извитостей чаще всего врожденная, но нередко удлинение артерии развивается при гипертонической болезни. Долгое время извитость может не давать никакой симптоматики, но в какой то момент у пациента начинаются преходящие нарушения мозгового кровообращения. Ангиохирурги нашей клиники прицельно занимаются разработкой проблемы патологической извитости сонных и позвоночных артерий.
Виды патологической извитости сонных артерий
Удлинение артерии. Наиболее часто встречается удлинение внутренней сонной или позвоночной артерии, которое приводит к образованию плавных изгибов по ходу сосуда. Удлиненная артерия редко причиняет беспокойство и, как правило, обнаруживается при случайном исследовании. Важное значение удлинение артерии имеет для ЛОР-врачей, так как стенка артерии может аномально находится близко к небным миндалинам и при тонзилэктомии может случайно повреждаться. С возрастом эластичность артериальной стенки меняется и плавные изгибы артерии могут стать перегибами, с развитием картины нарушений мозгового кровообращения. При удлинении артерий без перегибов при ультразвуковом исследовании кровотока нарушений не определяется. Кинкинг — перегиб артерии под острым углом. Кинкинг может быть врожденным, когда с раннего детства определяются нарушения мозгового кровообращения и развиваться со временем из удлиненной сонной артерии. Формированию перегибов способствует артериальная гипертония, прогрессирование атеросклероза в внутренней сонной артерии. Клинически кинкинг внутренней сонной артерии проявляется преходящими нарушениями мозгового кровообращения. При кинкинге позвоночной артерии развивается вертебрально-базилярная недостаточность. Выявление кинкинга с мозговыми симптомами встает вопрос о хирургическом исправлении извитости. Койлинг — образование петли артерии. Несмотря на плавный ход петли, изменения кровотока в ней очень значительны. Характер изгибов при койлинге может изменятся в зависимости от положения тела, артериального давления. Наблюдается хаотичный характер кровотока, что приводит к снижению давления крови после петли и соответственно к снижению кровотока по мозговым артериям. Если у человека хорошо развит Виллизиев круг на нижней поверхности мозга, то он никогда и не узнает о существовании у себя петли или перегиба. Появление симптомов недостаточности мозгового кровообращения свидетельствует о нарушениях компенсации кровотока и диктует необходимость детального обследования и лечения.
Клинические проявления
Проявления патологической извитости разнообразны, наиболее часто встречаются: — Картина транзиторных ишемических атак в бассейне кровоснабжения извитой артерии с временным параличом половины тела или руки (гемипарез), нарушением речи и.т.д.); — Временная слепота на один глаз; — Шум в голове; — Головокружение; — Мелькание перед глазами; — Головные боли без четкой локализации; — Кратковременные потери сознания; — Падения без потери сознания; — Временные нарушения равновесия; — Мигренеподобные приступы.
Лечение патологической извитости
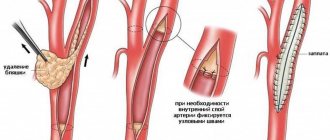
Патологическая извитость подлежит хирургическому лечению. Артерия расправляется, избыток ее отсекается, проходимость восстанавливается Результаты хирургического лечения хорошие. Симптомы мозговой сосудистой недостаточности полностью проходят у 96% пациентов. Риск операций менее 1%. Операции могут выполняться под местной анестезией. Лекарственное лечение патологической извитости не эффективно, так как от лекарств артерия расправиться не может. Важно четко определиться с диагнозом патологической извитости и доказать ее значение для мозгового кровообращения. Тогда результаты лечения будут радовать и пациентов и их врачей.
Симптомы
Симптоматика патологической извилистости сонных и позвоночных артерий разнообразна. Наиболее часто встречаются следующие признаки:
- так называемые транзиторные ишемические атаки (временные сбои кровоснабжения), сопровождающиеся временным параличом верхних конечностей, нарушениями речи, временной слепотой;
- шум в голове, головокружения;
- приступы мигрени;
- нарушения координации движений, падения без потери сознания;
- короткие обмороки.
Синдром позвоночной артерии (Барре — Льеу) — симптомы и лечение
При хронической боли в шее используются хирургические и фармакологические методы лечения, а также различные способы тракционной терапии — вытяжения позвоночника с помощью специальных приспособлений (блоков, поясов, колец) [12].
Эффективность методов мануальной терапии — мягких техник, постизометрической релаксации, растяжения мышц — ещё изучается. С этой целью в 2015 году было проведено два исследования. Метаанализ китайских учёных показал, что мануальные техники менее действенны при устранении болевого синдрома, чем тракция шейного отдела позвоночника [13]. Однако исследование канадских учёных выявило, что мануальная терапия становятся эффективнее в сочетании с другим методом активного лечения острой и хронической боли в шее. Также мануальные техники лучше справляются с хронической болью, чем массаж, и эффективнее борются с острой и подострой болью в шее, чем медикаментозное лечение. При этом из-за побочных эффектов от приёма препаратов мануальная терапия является предпочтительной. По эффективности мануальные методики схожи с мобилизацией шейного отдела позвоночника, однако мобилизация как отдельное вмешательство не уменьшает боль [14].
Что касается такого немедикаментозного метода лечения, как иглоукалываение, то метаанализ 2021 года показал его эффективность над фиктивной акупунктурой (иглоукалыванием неакупунктурных точек) и неактивным лечением [15].
Несомненным действенным методом лечения синдрома являются физические упражнения. Их эффективность в устранении острого и хронического болевого синдрома подтверждает обзор 2005 года. При этом стоит акцентировать внимание на растяжке шейного отдела, плечевого пояса и грудной клетки. А сочетание упражнений с мобилизацией и мануальными техниками на шейном отделе способствует уменьшению боли в краткосрочной и долгосрочной перспективе [16].
К операционным методам стабилизации позвоночника относят:
- пункционный межтеловой спондилодез — объединение и фиксирование нескольких позвонков во избежание их смещения;
- фенестрация — частичное удаление дужки межпозвоночного диска;
- аутодермопластика межпозвоночных дисков — замена диска собственными тканями.
При проведении операции вживляются пористые эксплантаты из сплава титана и никеля. За счёт пористости в них быстро прорастают костные ткани. Это позволяет сделать фиксацию прочной и значительно сократить срок нетрудоспособности пациента и нахождения шеи в неподвижном положении.
Помимо стабилизирующих операций шейного отдела позвоночника также проводятся и другие виды вмешательств:
- декомпрессивно-стабилизирующие — устранение сдавления с последующей фиксацией позвоночника;
- декомпрессивно-пластические (ламинопластика) — устранение сдавления путём увеличения позвоночного канала с сохранением целостности задних элементов позвонков;
- декомпрессирующие операции — удаление межпозвоночного диска или его дужки, сдавливающих артерию, и др. [9].
Имеется значительный опыт восстановления позвоночных артерий. Применяются следующие методы:
- транспозиция — смещение позвоночной артерии в подключичную (общую сонную);
- ангиопластика — расширение сосуда с помощью расширяющегося баллона;
- стентирование — расширение сосуда с помощью установки стента.
При одновременном поражении первого и второго сегментов позвоночной артерии выполняется шунтирование — создание обходного пути на уровне третьего сегмента [17].
Что такое непрямолинейность хода позвоночных артерий?
Позвоночные артерии тянутся от предпозвоночного до внутричерепного отдела, проходят в канале поперечно расположенных отростков шейного участка позвоночного столба. Если человек получил какую-либо травму, у него искривление позвоночника или другие заболевания, это сказывается и на позвоночной артерии – она искривляется. Кровоток нарушается, затылочная часть головного мозга недополучает питание и кислород. Неправильная извитость артерии и называется «непрямолинейность хода ПА». В большинстве случаев страдают обе артерии, но может появиться и непрямолинейность хода левой позвоночной артерии или непрямолинейность хода правой позвоночной артерии. Такое бывает после серьезной травмы или же разрастания костной мозоли.
Когда у человека – непрямолинейность хода ПА с обеих сторон, поставить диагноз легче, появляются яркие симптомы заболевания. Если эта патология развивается только с одной стороны, организм пытается сам справиться с проблемой, усиливая кровоток в другой позвоночной артерии. В этом случае симптомов заболевания практически не будет, но, если больной проходил обследование из-за другой болезни, доктор может заметить это отклонение.
Извитость магистральных артерий головы как фактор риска церебральной ишемии
Актуальность изучения цереброваскулярных заболеваний объясняется их весьма широкой рас-пространенностью, при этом 2/3 ишемических инсультов (ИИ) связаны с поражением экстра-краниальных артерий, прежде всего атеросклеротического генеза. Однако, до настоящего времени, не все специалисты уделяют должное внимание роли аномалий и деформаций сонных (СА) и позвоночных артерий (ПА) в генезе острой церебральной ишемии. Удлинение и извитость артерий являются результатом их приспособлений к патологи-ческим условиям регионарного кровообращения. Известным фактом является сочетание полной окклюзии сонной артерии на одной стороне с расширением и извитостью противоположной, по которой кровоток значительно усиливается и одновременно увеличивается нагрузка на стенки сосуда, что со временем приводит к его изгибу. Большее влияние на формирование извитости оказывает артериальная гипертензия, которая ускоряет процесс деформации сосуда в виде его извитости. При заболеваниях, ведущих к укорочению шейного отдела позвоночника, возникает «относительное» удлинение сонных и позвоночных артерий. Извитость может быть врожден-ной, нередко сочетаясь с другими сосудистыми аномалиям (у таких пациентов имеют место различные варианты мезенхимальной дисплазии — ложная хорда левого желудочка, пролапс митрального клапана, аномалия Киммерле, варикозная болезнь, миопия, плоскостопие и др. ). При поворотах головы, в случаях извитости артерий, вследствие их перегибов возможно раз-витие ИИ, возникающего по гемодинамическому типу (образование септального стеноза в мес-те перегиба с редукцией кровотока дистальнее стеноза). Возможен и тромботический генез ост-рой ишемии вследствие образования пристеночных тромбов в местах длительно существующих перегибов и петлях с развитием артерио-артериальной эмболии. Ряд специалистов придерживаются мнения, что различные типы извитости наблюдаются при любой сосудистой патологии головного мозга, и только при особых условиях могут при-вести к ИИ. Отдельные исследователи признают наличие извитости брахиоцефальных артерий (БЦА) самостоятельным фактором развития ИИ. Меньшая часть отрицает роль конфигураци-онных аномалий в генезе цереброваскулярной симптоматики. Несколько лет назад на базе трех неврологических отделений «КБ №1» неврологами больницы совместно с ангиохирургами проведено исследование, которое позволило оценить особенности мозгового кровотока у больных, перенесших ИИ на фоне извитости МАГ ; опре-делить признаки, указывающие на патологический характер извитости, уточнить критерии от-бора больных с извитостями МАГ для проведения реконструктивных операций, задачей кото-рых является восстановление нормального магистрального кровотока. На большом клиническом материале (592 пациента) нами показано, что имеется избира-тельность влияния различных видов извитостей на мозговую гемодинамику. Результаты исследования показали, что у 89% больных, перенесших инсульт и транзиторную ишемическую атаку, выявлены извитости магистральных артерий головы, из них гемодинами-чески значимые в 27%. Извитости МАГ преобладали в возрастной группе до 40 лет и старше 70 лет, преимущественно у женщин. Достоверно чаще встречались в позвоночных артериях. За критерий гемодинамически значимой извитости экстракраниального отдела сосуда при-нималось увеличение линейной скорости (ЛСК) у внутреннего радиуса извитости более чем в 2 раза от значений ЛСК до извитости, а так же наличие турбулентного кровотока в области извитости. По данным МРТ выявлялись следующие виды извитостей: «С» или «S»-образная извитость, петлеобразование – койлинг, перегиб сосуда под острым углом с образованием септального стеноза – кинкинг. Неврологические проявления у больных с извитостями ВСА: синкопальные состояния, нередко жалобы на шум в ушах, нарушения сна, расстройства внимания, боль в глазных ябло-ках. Клинически ТИА проявлялись преходящими зрительными нарушениями по типу гемиа-нопсий, фотопсий, монокулярной слепоты, гемипарезами и монопарезами, речевыми наруше-ниями по типу афазии (сенсорной, моторной), чувствительными расстройствами по гемитипу. У пациентов этой группы часто отмечались церебрастенические проявления, вестибулопатия, психо-вегетативный синдром. Для пациентов с извитостью ПА характерны обморочные состояния, головные боли затылоч-ной локализации, головокружения, расстройства слуха, возникающие или усиливающиеся при изменении положении я головы. Преобладали ТИА, ИИ встречались у пациентов с ТИА в вертебрально-базилярном бассейне проявлялись сочетанием преходящих двига-тельных расстройств; парестезий половины лица и (или) туловища, конечностей; зрительных расстройств (гомонимная гемианопсия, диплопия) ; приступов головокружений (часто сопро-вождающихся тошнотой, реже — рвотой) ; речевыми нарушениями по типу дизартрии; атаксией, неустойчивостью. Наиболее часто извитость ПА встречалась в V1 и V3 сегментах, что делает доступным проведение реконструктивных операций. В большинстве случаев ишемические очаги выявлялись в зоне кровоснабжения измененного сосуда. Однако, в 16% локализация инсульта оказывалась в области кровоснабжения интакт-ного сосуда ипсилатерально, либо в контрлатеральном полушарии. В тех случаях, когда ише-мический очаг не соответствовал зоне васкуляризации измененного сосуда, выявлялись анома-лии строения Виллизиева круга. Пациентам с гемодинамически значимыми извитостями, имевшими в анамнезе ТИА, с отсутствием при нейровизуализации очаговых изменений в веществе головного мозга, выпол-нялась ПЭТ для оценки уровня метаболизма. У большинства выявлены очаги депрессии мета-болизма, которые представляют собой объем будущего инфаркта мозга. Очаги снижения мета-болизма локализовались в ипсилатеральном полушарии при нормальном строении Виллизиева круга и в конрлатеральном –при разобщенном Виллизиеве круге. Особенностями изменений мозгового кровотока при гемодинамически значимых извитостях являются локальные нарушения гемодинамики в зоне извитости в виде турбулентности. Наибо-лее выражены местные гемодинамические нарушения в извитостях в виде кинкинга и койлинга. Изменения положения головы провоцируют возникновение септального стеноза, приводящего к редукции кровотока дистальнее извитости. Характерна межполушарная асимметрия ЛСК, с увеличением ее на стороне извитости. В большинстве случаев имеют место аномалии строения Виллизиева круга, в связи, с чем отсутствует возможность адекватного функционирования коллатералей. Клиническими особенностями ишемических поражений мозга при патологической извитости МАГ являются – преобладание транзиторных ишемических атак и инсультов по типу «малых» с умеренным неврологическим дефицитом и быстрым восстановлением функций, а так же воз-никновение цереброваскулярной симптоматики при изменении положения головы. В анамнезе больных с патологической извитостью нередки синкопальные состояния, обмороки. Полученные результаты позволили определить критерии патологической извитости МАГ — это гемодинамически значимая извитость, проявляющаяся симптомами нарушения мозгового кровообращения в данном или противоположном сосудистом бассейне, что зависит от осо-бенностей строения Виллизиева круга, при условии отсутствия значимого атеросклеротиче-ского поражения извитого сосуда. 80% больных с извитостями МАГ страдали гипертонической болезнью, причем в 30% случаев диагноз гипертонической болезни впервые был установлен после появления сим-птомов инсульта, т. е. артериальная гипертензия длительно протекала латентно. Наиболее эффективной мерой вторичной профилактики патологической извитости МАГ является хирургическое лечение. Основным показанием к оперативному лечению следует считать признание извитости патологической.
Проблемы лечения и профилактики цереброваскулярных болезней остаются одними из наиболее актуальных, поскольку нарушения мозгового кровообращения продолжают занимать лидирующее положение среди причин стойкой инвалидизации и смертности населения во всем мире. Сосудистые заболевания головного мозга являются главной причиной развития ишемического инсульта. Доказано, что поражения экстракраниальных отделов внутренней сонной (ВСА) и позвоночных артерий в 65—70% случаев приводят к ишемическим нарушениям мозгового кровообращения. Патологические деформации (ПД) ВСА являются одними из наиболее частых заболеваний брахиоцефальных сосудов, уступая по частоте лишь атеросклерозу. ПД ВСА приводят к нарушениям мозгового кровообращения разной степени выраженности [1—6]. Общая частота ПД ВСА среди взрослого населения, по данным результатов ангиографических и патоморфологических исследований, варьирует от 10 до 40%. У детей с проявлениями мозговой недостаточности эта патология встречается в 14—30% [2, 7, 8].
Этиология и патогенез ПД ВСА до конца не изучены. Большинство авторов считают, что их происхождение может иметь врожденный или приобретенный характер. Свидетельством врожденного происхождения ПД ВСА является наличие деформаций сонных артерий в детском и молодом возрасте, частое двусторонние поражение, сочетание поражения сонных артерий с другими проявлениями системной дисплазии соединительной ткани [9—11] — синдромами Марфана и Эларса-Данло [12], коарктацией аорты, гипоплазиями сосудов [13—16]. Причинами приобретенных ПД считают ослабление эластичного каркаса стенки артерии, атеросклероз, возрастные изменения шейного отдела позвоночника, гипертоническую болезнь, сахарный диабет, ожирение [1, 2, 5, 17, 18].
Врожденные ПД ВСА
занимают 1-е место среди причин нарушения мозгового кровообращения в детском возрасте. По данным Ю.В. Смирновой [8], ПД ВСА встречаются у 26,9% детей с неврологическими симптомами. М.А. Лобов и соавт. [7] выделяют ПД как одну из главных причин вазопатических головных болей в детском возрасте, регистрируя их в 1/3 случаев. Частота развития ПД у мальчиков и девочек сопоставима.
Начальные проявления недостаточности мозгового кровообращения обычно возникают у детей 4—6 лет. К ним относятся задержка речевого развития, позднее формирование навыков самообслуживания, нарушение адаптации в коллективе, гипервозбудимость и раздражительность. Позже, к 5—6 годам жизни, присоединяются головные боли. Описанные симптомы неспецифичны и могут маскировать сосудистые аномалии сонных артерий, поэтому ультразвуковое исследование сосудов шеи при наличии такой клиники является обязательным. Острые нарушения мозгового кровообращения у детей возникают довольно редко: преходящие нарушения мозгового кровообращения — в 4,3% случаев, ишемический инсульт с развитием очаговых поражений вещества мозга наблюдается еще реже — в 2,1% [7, 8, 10, 15—17]. Особенностью клинической картины ПД у детей являются эпилептические припадки (в 19,3% случаев).
Преобладающими типами ПД ВСА являются коулинг, C- и S-образные извитости (20—30%). Это объясняется нарушениями внутриутробного развития [1, 13, 18—20]. Еще в 1925 г. A. Kelly [21] считал, что петли формируются на 5—6-й неделе развития эмбриона. ВСА берет начало от III жаберной дуги и дорзальной аорты, на стыке которых образуется отчетливый перегиб, проявляющийся у 5-недельного эмбриона. В процессе дальнейшего развития плода в связи с опусканием сердца в грудную полость и вертикальным разворотом его по оси сонная артерия выпрямляется. Если это выпрямление или разворот оказываются неполными, это ведет к образованию изгибов, петель, перегибов разной степени выраженности. Другим способствующим деформациям фактором может быть более выраженный рост артерий дуги аорты по сравнению с ростом шеи. Это подтверждается наличием извитости ВСА у эмбрионов и детей на уровне расположения языко-глоточного нерва [13, 19]. Частота таких аномалий у новорожденных колеблется от 5 до 10% [2, 10, 11].
Данные об этиологических факторах, приводящих к дисэмбриогенезу и развитию врожденных сосудистых деформаций, в литературе отсутствуют. Следует отметить, что изгибы и петли можно также найти в мозговых, коронарных, ретинальных и позвоночных артериях, однако они чаще имеют приобретенный характер. Изгибы коронарных артерий связывают с гипертензией и инфарктом миокарда, ретинальных артерий — с ретинопатией при злокачественной гипертензии и сахарном диабете, капилляров мышц и сердца — с артериальной гипертензией и сахарным диабетом, вен — с варикозной болезнью [22].
B. Callewaert и соавт. [23] описывают особый «синдром извитости артерий» (arterial tortuosisty syndrome). Это — врожденное заболевание с аутосомно-рецессивным типом наследования (дефект гена SLC2A10
), которое характеризуется извитостью, удлинениями и формированием аневризм больших артерий вследствие нарушения строения эластических волокон медии сосудистой стенки. Сочетание извитости и аневризм артерий — главный признак синдрома Лоеса—Диетза (Loeys—Dietz), врожденного заболевания с мутацией в TGF β-рецепторе. При этом аневризма является первичной и становится фоном для развития извитости.
Ю.В. Смирновой [11] доказано, что признак извитой ВСА может передаваться по наследству по аутосомно-доминатному или аутосомно-рецессивному типу. Установлена ассоциация полиморфизма А80807Т гена транскрипционного фактора 8р4
с патологической извитостью сонных артерий. Вероятность иметь ПД ВСА у гомозигот А80807/А80807 по сравнению с носителями двух других генотипов (А80807/Т80807, Т80807/Т80807) в 1,64 раза выше.
М.А. Лобов и соавт. [10, 24] также указывают на наследственную детерминированость ПД ВСА у детей. По их данным, частота семейных случаев составляет 50%. Сегрегационный анализ этих случаев демонстрирует, что ПД ВСА может быть как изолированной, так и являться проявлением наследственной синдромальной патологии соединительной ткани. Сегрегационная частота составляет 45% [24]. Гипоплазии, аплазия и аномалии положения артерий исследователи расценивают как неспецифические признаки дизэмбриогенеза и относят к группе прецеребральных ангиодисплазий.
В последние годы обсуждается вопрос о роли врожденной неполноценности соединительной ткани в формировании ПД ВСА. Приводятся клинические наблюдения сочетания удлинения и деформаций сонных и позвоночных артерий с фенотипическими признаками наследственной патологии соединительной ткани, синдромами Эларса—Данло, Марфана, Штурге—Вебера [5, 9, 12, 15]. В то же время сочетания ПД ВСА с вышеперечисленными синдромами описываются в единичных случаях. Следует отметить более высокую встречаемость (60%) малых форм дисплазии соединительной ткани у детей с ПД ВСА, таких как гипермобильность суставов, гиперрастяжимость кожи, мышечная гипотония, нарушение осанки, плоскостопие, пролапс митрального клапана, аномальные хорды, неправильный рост и развитие зубов. Однако степень «фенотипической напряженности» признаков не достигает выраженности, соответствующей установленным критериям диагностики синдрома патологии соединительной ткани [24]. Поэтому вопрос, можно ли считать ПД ВСА у детей проявлением синдрома дисплазии соединительной ткани, остается открытым.
В пользу дизэмбриогенетической теории происхождения ПД ВСА свидетельствуют патоморфологические признаки, описанные П.О. Казанчяном и соавт. [1], включающие дегенеративные изменения эластических волокон, компенсаторный гиперэластоз, мультипликацию внутренней эластической мембраны, развитие мукоидного отека, пролиферацию гладкомышечных клеток.
Наиболее приемлемой гипотезой патогенеза аномалий сонных артерий является появление дефектов в структуре эластина и коллагена вследствие эндогенного или генетически детерминированного усиления активности деградативных энзимов — коллагеназы и эластазы [20, 25—27]. Целесообразно подчеркнуть, что такие же изменения структуры эластина и коллагена считаются главным патогенетическим фактором развития сосудистой патологии — как врожденной, так и приобретенной.
Возможной причиной развития ПД ВСА у детей может быть родовая травма, перерастяжение структур шеи в родах. Известно, что коллагеновые волокна в условиях одноосного растяжения являются главным фактором, препятствующим деформациям. Концентрация коллагена положительно коррелирует с пределом прочности и отрицательно — с максимальным относительным удлинением. В эксперименте доказано, что при удалении коллагена из сосудистой стенки снижаются предел прочности и жесткость, а при удалении эластина снижаются прочность стенки и относительная деформация. Значительное содержание эластина в стенке сонной артерии обусловливает ее бо́льшие резервы растяжимости по сравнению с позвоночной артерией. О.В. Калминым [28] предложена гипотеза о последовательности повреждений структур шеи при гиперэкстензии, гиперфлексии и продольном растяжении в родах. Нервные стволы обладают относительно небольшой растяжимостью и наименьшей жесткостью, а стенка общей сонной артерии (ОСА), наоборот, наибольшей растяжимостью и наименьшей жесткостью. При гиперэкстензии наибольший риск повреждения имеет диафрагмальный нерв, затем блуждающий, а повреждение стенки сонной артерии маловероятно. При гиперфлексии в первую очередь может повреждаться спинной мозг, и только после разрыва связок позвоночника произойдет массивное повреждение стенок артерий. При продольном растяжении шеи основная часть деформирующей нагрузки будет приходиться на позвоночный ствол и его связки, затем нервные стволы, позвоночную артерию и в последнюю очередь — сонную артерию. Наибольшим резервом удлинения — 33,8%, без нарушения структуры и функций структур шеи, обладает ОСА. Исходя из изложенного, следует, что повреждение ОСА в родах маловероятно [1, 18]. В то же время пока вне внимания исследователей остается ВСА. При продольном растяжении в родах наибольшая нагрузка, по нашему мнению, происходит на участок вхождения сонной артерии в череп, что может приводить к развитию деформаций.
Вопрос о целесообразности оперативного вмешательства при ПД ВСА у детей остается открытым. Есть данные, что у части детей в процессе роста происходит восстановление прямолинейности хода сосуда, а у некоторых пациентов деформация сохраняется с нивелированием локальных нарушений гемодинамики [1, 8]. Следует, учитывать, что генерализованные эпилептические припадки, нередко возникающие при аномалиях сонных артерий, являются противопоказанием к операции [6, 8, 11]. Приоритетным направлением лечения детей все же считается консервативная терапия [7, 15, 17]. При ее неэффективности, нарастании неврологической симптоматики и снижении скорости мозгового кровотока необходимо оперативное вмешательство. Реконструктивное устранение деформации приводит к уменьшению проявлений хронической мозговой недостаточности в ближайшем послеоперационном периоде у всех пациентов [2, 4]. В то же время среди данных литературы нами не найдено научных исследований с оценкой влияния оперативного или консервативного лечения детей с ПД ВСА на качество их жизни в послеоперационном периоде.
Приобретенные патологические деформации ВСА занимают 2-е место среди причин ишемических нарушений мозгового кровообращения, уступая лишь атеросклерозу [1, 4—6, 18, 20, 22, 25]. ПД ВСА встречаются преимущественно у пациентов после 60 лет. Считают, что кинкинг выявляется у 5—16% пациентов, чаще у мужчин [1, 4, 29, 30], хотя есть сообщения о превалирующем поражении у женщин, что объясняется повреждением эластического каркаса сосудов, связанного с гормональными изменениями [31—33]. L. Del Corso и соавт. [34] на основании исследования 469 больных с ПД (извитость, кинкинг и изгибы) подтверждают высокую частоту поражений среди женщин. E. Ballotta и соавт. [35] cчитают, что у женщин асимптомный каротидный кинкинг прогрессирует с возрастом и становится симптомным после 60 лет. Р. Zanetti и соавт. [6] указывает на то, что у взрослых изменения длины и формы сонных артерий наиболее часто проявляются на шестом десятилетии жизни, соотношение мужчин и женщин при этом составляет 4:1. Возможно, такие разногласия связаны с наличием у больных сопутствующей патологии — атеросклероза, гипертензии, сахарного диабета, гиперлипидемии, гормональных изменений, а также влиянием токсических веществ и курения.
Для клинической картины характерны нарушения мозгового кровообращения. Наиболее частыми симптомами являются головокружение, кохлеарные, чувствительные и когнитивные нарушения, ишемическая ретинопатия. Симптомы мозговой ишемии в полушарии на стороне извитости ВСА встречаются у 26% больных, общемозговые проявления — у 41,75%, их сочетание — у 27,5%. Есть данные о зависимости клинической картины от типа ПД ВСА. Асимптомно чаще всего протекают C- и S-деформации — около 70% случаев, выраженную клиническую симптоматику имеют кинкинг, петле- и спиралеобразные извитости — больше чем в 80% случаев [18, 35, 36]. Развитие симптомов зависит также от степени выраженности угла в сегменте кинкинга — чем угол острее, тем тяжелее поражения. При угле меньше 45° у всех пациентов наблюдается выраженная мозговая симптоматика, требующая оперативного вмешательства [18, 19, 36].
Среди типов ПД ВСА наиболее часто описывают кинкинг, удлинения и перегибы, что связано с особенностями происхождения приобретенных деформаций. Так, З.К. Мацкевичус и соавт. [37] выделяют группу причин возникновения ПД ВСА, подразделяя их на 2 подгруппы. Первая — перегиб на месте сонной артерии в зоне окончания атеросклеротической бляшки, вторая — перегибы и деформации на основе возрастных деструктивных изменений мышечно-эластического каркаса артериальной стенки. Появляющаяся с возрастом артериальная гипертензия способствует усугублению ПД, поскольку деформации сосудов становятся функциональным приспособлением для уменьшения пульсовой волны и обеспечения равномерности кровотока [4, 19, 25]. Однако П.А. Паулюкас и Э.М. Баркаускас [29] считают, что в этих случаях гипертензия является вторичной, имеет рефлекторный характер и развивается в ответ на ишемию мозга. Как показывают гемодинамические исследования, при устранении перегибов и петель брахиоцефальных сосудов снижается системное артериальное давление [5, 9, 18, 25].
По мнению Н.В. Верещагина и А.Н. Колтовер [20], гипертензия — первичная причина ПД ВСА. В ответ на повышенное давление в стенках сонных артерий возникают адаптивные изменения в виде очаговых и циркулярных мышечно-эластических утолщений интимы, склероза внутренней и средней оболочек с деструкцией эластического каркаса. По мере развития склеротических изменений утрачиваются мышечные и эластические элементы артерий, происходит потеря их тонуса, в результате чего на фоне артериальной гипертензии формируются патологические извитости и перегибы этих сосудов с выраженным септальным стенозом. Последний, ограничивая кровоток, может выступать в качестве самостоятельного патогенетического фактора нарушений мозгового кровообращения. Гипертензия, по мнению J. White и соавт. [27], приводит к растяжению гладкомышечных клеток медии сосуда, утрате эластина и фрагментации эластомеров. Прогрессирование этих процессов является причиной патологического удлинения сосуда. Данные P. Pancera и соавт. [38] демонстрируют явное преобладание гипертензии у пациентов с кинкингом по сравнению с лицами, не имеющими сосудистых аномалий. Тем не менее D. Radak и соавт. [39] считают, что четкого понимания патогенетической связи известных сосудистых факторов риска и развития кинкинга пока нет.
Главной причиной развития приобретенных ПД ВСА у пациентов старше 60 лет является атеросклероз. Открытым остается вопрос — что первично, атеросклероз или ПД? Среди исследователей нет единого мнения на этот счет. Одни считают, что атеросклероз приводит к развитию деструктивных изменений эластического каркаса сосуда и вместе с артериальной гипертензией способствует развитию деформаций, таких как удлинения и кинкинг [4—6, 19, 20, 22, 31, 32, 37, 40—42]. Другие авторы называют атеросклероз отягощающим заболеванием при ПД ВСА. Нарушение локальной гемодинамики в зоне изгиба деформированного сосуда приводит к травмированию интимы, повреждению эндотелия и запуску патологического процесса [1, 5, 20, 29, 34, 38]. Исходя из этого, в сонных артериях должен развиваться ранний атеросклероз, клинически и ангиографически проявляющийся в возрасте до 40 лет, что не подтверждается данными литературы [2, 19, 37, 40, 41]. Другими исследователями доказано, что при изгибе создается разница давления у наружного и внутреннего радиуса, приводящая к развитию завихрений гемодинамических потоков и, как следствие, разрастанию эндотелия и соединительной ткани в сосуде. При этом в сосуде находят признаки пролиферативно-склеротического ремоделирования вследствие активизации иммунной системы — высокой апоптической активности гладкомышечных клеток и развития хронического воспаления в зоне извитости [42]. В то же время в серии морфологических исследований отсутствуют данные о воспалении и наличии васкулита [20, 37, 38, 43].
Важно, что именно атеросклероз при ПД повышает риск развития инсульта в несколько раз. Такое сочетание наблюдается у 40—70% пациентов с нарушениями мозгового кровообращения [1, 4, 19, 22, 31, 34, 38, 41, 43].
Фибромышечную дисплазию считают одной из важных причин развития ПД ВСА. Точные данные о ее частоте дисплазии при ПД ВСА отсутствуют. Считается, что фибромышечная дисплазия и ПД ВСА чаще возникают у лиц среднего возраста, хотя есть данные и о больных старше 60 лет. Механизм развития деформаций сонных артерий при этом заболевании неизвестен. Фибромышечная дисплазия — это неатеросклеротическое и невоспалительное заболевание артерий с преобладающим поражением почечных артерий и ВСА, развивающееся преимущественно у молодых женщин. Преобладающим патоморфологическим вариантом поражения сонных артерий при фибромышечной дисплазии без ПД является медиальная фиброплазия. Для нее характерен фиброз с частичным или тотальным поражением медии, полной или частичной утратой эластических волокон. Это приводит к формированию множественных аневризм, вследствие чего сосуд напоминает «нитку бус». Кроме развития аневризм возможны расслоения сосудов, окклюзия сосудистого просвета, разрывы сосудов. Можно предположить, что общность патологического процесса при фибромышечной дисплазии и ПД ВСА — утрата эластического каркаса сосуда, вероятно, является значимым фактором для развития патологических изгибов при фибромышечной дисплазии [44—47].
Возрастные изменения позвонков шейного отдела позвоночника считают важным фактором в развитии ПД ВСА приобретенного характера. Вертеброгенная компрессия способствует гемодинамическим нарушениям и развитию ПД ВСА. У пациентов с извитостями отмечаются смещение головы вперед, сглаживание шейного лордоза, кифоз в грудном отделе, резко выраженное напряжение грудинно-ключично-сосцевидных, лестничных мышц и мышц, расположенных выше и ниже подъязычной кости. Укорочение мышц передней поверхности шеи и деформация фасций приводят к экстравазальному воздействию на сонные и позвоночные артерии [18, 48]. Таким образом, механические деформации фасции на фоне нарушений в шейном отделе позвоночника могут рассматриваться как одна из причин формирования деформаций артерии. R. Wirbel и соавт. [49] доказали, что гиперэкстензионные и ротационные воздействия на шейный отдел позвоночника, возникающие при проведении сеансов мануальной терапии, занятиях спортом, например борьбой, могут приводить к повреждению вертебрально-базилярных сосудов. Ряд авторов считают, что хотя большинство повреждений сосудов шеи происходит без видимой для больного причины, незначительная травма шейного отдела выявляется в 80% случаев [50]. При значительных смещениях позвонков или их частей обнаруживаются резкие изменения нормального хода сосудов, при этом макроскопически наблюдаются скручивание, уплотнение и перерастяжение позвоночных и сонных артерий.
Среди других причин ПД ВСА выделяют сахарный диабет, гиперлипидемию и другие сосудистые факторы риска [2, 5, 6, 20, 34, 38, 41].
Возможными факторами, способствующими развитию ПД ВСА, считают курение, прием контрацептивов, токсические влияния [5]. Согласно новой теории Д.Д. Зербино [51, 52] тяжелые металлы повреждают мышечно-эластический каркас артерий и приводят к развитию артериосклероза, артериальной гипертензии [51]. Доказано, что токсическое воздействие кадмия приводит к массивному эластолизису медии вследствие активизации эластаз и развитию аневризм аорты. Известно, что тяжелые металлы, содержащиеся в сигаретах, вызывают необратимые изменения в коронарных артериях, ведут к развитию атеросклероза и инфарктов миокарда у пациентов до 40 лет. Курение и многолетний профессиональный контакт с токсическими веществами — это важные причины развития сосудистой патологии в среднем возрасте.
Некоторые авторы среди возможных причин развития ПД ВСА у молодых пациентов упоминают васкулит [20, 37, 43]. З.К. Мацкевичус и П.А. Паулюкас [37] описывают ангиит vasa vasorum
, который объясняют ишемическими повреждениями
vasa vasorum
с развитием воспаления и последующего грубого склероза.
Остается неясным механизм развития ПД ВСА у пациентов 40—50 лет. В литературных источниках преобладает мнение, что они являются следствием нарушения эмбриогенеза [2, 5, 22, 32, 35, 43]. Исходя из вышеизложенного следует, что для врожденных деформаций у детей характерны петлеобразные девиации (коулинг), C- и S-образные извитости, а для пациентов старше 60 лет — кинкинг, удлинения и перегибы. Возможен ли переход одних типов ПД в другие, остается неизученным.
Ю.В. Родиным и соавт. [53] с помощью методов математического моделирования была дана гипотетическая оценка развития S-образной извитости — любой изгиб при определенных условиях стремится к ангулярному перегибу. Полученные результаты справедливы и для других типов извитости, поскольку они, как правило, содержат S-образную извитость. В то же время эта гипотеза полностью опровергает возможность перехода одних видов извитости в другие и требует дальнейших исследований.
Для патоморфологической картины ПД ВСА характерны выраженные склеротические изменения стенки сосуда, деструкция эластического каркаса, разрастание соединительной ткани вокруг сосуда [13, 20, 37, 38]. Поскольку такие изменения способствуют устойчивым необратимым деформациям, увеличивающимся с возрастом, вопрос — возможны ли изменения конфигурации деформаций, остается открытым.
Наиболее эффективным методом лечения приобретенных ПД ВСА признано хирургические вмешательство. Показанием к операции считается гемодинамически значимая ПД ВСА, соразмерная с циркуляторными расстройствами, характерными для стенозов 70% и более, независимо от наличия неврологической симптоматики и/или гемодинамически значимого атеросклеротического стеноза, а также эмбологенных бляшек, стенозирующих просвет более 50%, и бляшек с изъявленной поверхностью и пристеночным тромбозом. Известна высокая эффективность хирургического вмешательства у больных с симптомными ПД ВСА, в то же время вопрос целесообразности оперативного вмешательства у больных с асимптомными деформациями остается открытым [1, 3, 4, 6, 19, 29, 35, 36, 42, 54].
В заключение упомянем, что сравнительный анализ литературы о врожденных и приобретенных ПД ВСА показал, что они имеют много отличительных черт не только в происхождении и патогенезе, но и клинике, лечении и прогнозе. Уместным является предположение, что врожденные и приобретенные ПД ВСА — это два разных заболевания, связь между которыми не доказана.
Приводимый обзор литературы демонстрирует актуальность изучения этого заболевания, наличие неразрешенных и спорных вопросов не только в генезе, но и лечебной тактике ведения больных, необходимость комплексного клинико-патоморфологического исследования этой важной сосудистой патологии.
«Кинкинг» синдром экстракраниальных артерий головного мозга
Назад к программе
Юнусов Х. А., Султанов Д. Д., Садриев О. Н.
РНЦССХ;
Цель исследования. Изучить результаты реконструктивных операций при патологической извитости сонной и позвоночной артерий. Материал и метогды исследования. В отделении хирургии сосудов РНЦССХ за период 1995 – 2013 гг. находились на лечении с диагнозом «кинкинг» внутренней сонной артерии 27 больных и позвоночных артерий – 12 пациентов. Мужчин было 26, женщины – 13. Средний возраст составил 41+4,2 лет. Больным было проведено комплекс методов исследования: УЗДГ, дуплексное сканирование, ангиография. Для определения толерантности мозга к пережатию проводилась проба Матаса. Результаты исследования. У 85 % больных была выявлена гипертония длительным анамнезом. Среди больных с «кинкингом» внутренней сонной артерии (ВСА) перенесенный инсульт в анамнезе имело место у 4 больных, транзиторная ишемия – у 12, бессимптомное течение – у 11. Кинкинг позвоночной артерии у всех больных проявлялся клиникой вертебро-базиллярной недостаточности, в том числе у 4 – эпизодами транзиторной ишемической атаки. По данным ангиографииПо данным ангиографии встречались различные варианты «кинкинга» ВСА: петлеобразование – 7, S-извитость – 15, извитость с одним коленом – 5. В 14 случаях «кинкинг» сочетался со стенозом. Высокое расположение «кинкинга» отмечалось в 5 случаях. Извитость позвоночных артерий во всех случаях имели S-образный изгиб. Больные с «кинкингом» внутренней сонной артерии были оперированы под местной в комбинации регионарной анестезией. При кинкинге позвоночной артерии во всех случаях применялся общий эндотрахеальный наркоз. Вид реконструкции зависел от формы, протяженности «кинкинга». При петлеобразовании ВСА была произведена резекция измененной части ВСА с анастомозом конец в конец (7), при других формах редрессация «кинкинга» с наложением анастомоза в области устья ВСА. В 2 случаях дистальный конец резецированной ВСА был анастомозирован с наружной соннолй артерией. Редрессация «кинкинга» позвоночной артерии с реимплантацией в подключичную артерию была выполнена в 8 случаях. В 4 случаях из-за избыточной длины позвоночная артерия была имплантирована в сонную артерию. После операции в 1 случае (2,5%) развился ишемический инсульт в результате тромбоза анастомоза, у которого ВСА был анастомозирован с наружной сонной артерией. Выводы. Таким образом, реконструктивные операции при «кинкинг» синдроме магистральных артерий мозга являются эффективными в плане профилактики ишемических повреждений головного мозга.
Как лечить?
Если у вас – непрямолинейность хода позвоночных артерий, лечение зависит от степени выраженности симптомов. На ранних стадиях может помочь и консервативное лечение. Необходимо разобраться, что стало причиной появления патологии и сначала вылечить основное заболевание. Если причина появления данной патологии – спазм мышц шейного отдела, нужно его снять. Может помочь лечебная физкультура или же массаж. Не помогло консервативное лечение? Тогда доктор назначает операцию.
Медикаментозное лечение
Какие именно лекарства выписать, решает тоже врач, но чаще всего назначаются препараты, улучшающие венозный отток, обезболивающие, таблетки, снижающие АД и т.д. Такое лечение не может решить саму проблему, т.е. исправить изменения сосуда, но оно улучшает самочувствие больного.
Хирургическое
Операция назначается, если врач опасается, что у больного возникнет ишемический инсульт. Что именно предстоит сделать, решает хирург. Иногда он укорачивает и выпрямляет артерию, иногда проводит ее протезирование или же стентирование.
Причины патологии
Почему у человека может появиться данное заболевание? Непрямолинейность хода позвоночных артерий между поперечными отростками и на других участках (разливают несколько отделов ПА: предпозвоночный, шейный, шейно-затылочный, внутричерепной) появляется из-за ряда заболеваний:
- остеохондроз шейного отдела;
- врожденные аномалии;
- травмы, при которых пострадал шейный отдел позвоночника;
- переохлаждение, из-за чего бывает спазм мышц, что влияет на расположение артерии;
- опухоль;
- болезнь Бехтерева;
- рубцевание тканей после хирургической операции.
Это основные причины, но могут быть и другие.