Анемия при диабетической нефропатии
Сахарный диабет (СД) — распространенное заболевание, которым страдает около 5% населения Европы. Распространенность этого заболевания растет с каждым годом. Ожидается, что в ближайшие несколько лет число таких пациентов в Европе превысит 32 млн человек [1]. Характерным осложнением СД как 1, так и 2 типа является нефропатия. В индустриально развитых странах диабетическая нефропатия сегодня стала ведущей причиной терминальной стадии хронической болезни почек (ХБП) [2, 3]. По мере роста числа больных СД можно ожидать и пропорционального возрастания роли диабетической нефропатии в структуре больных терминальной почечной недостаточностью.
Примерно половина больных с ХБП страдает анемией [4, 5]. Соответственно, СД является одной из главных причин почечной анемии. При диабетической нефропатии анемия развивается раньше и чаще и протекает тяжелее, чем у больных с заболеваниями почек другой природы. Например, по данным эпидемиологического исследования NHANES III (National Health and Nutrition Examination Survey), проводившегося в США, частота анемии у больных ХБП III–IV стадий и СД была в 2 раза выше, чем у больных с сопоставимым нарушением функции почек, не страдающих СД [6].
Анемия оказывает нежелательное влияние на качество жизни больных, вызывает снижение работоспособности и толерантности к физической нагрузке, ухудшение сексуальной и когнитивной функций и сопровождается различными симптомами (одышка, головокружение, плохой аппетит и т. д.). Более того, анемия у больных СД позволяет предсказать повышенный риск неблагоприятных исходов (независимо от тяжести нефропатии) и, по-видимому, сама по себе способствует прогрессированию микро- и макроангиопатии. Тем не менее, врачи обычно не придают особого значения анемии у таких пациентов [7].
Ведущую роль в патогенезе почечной анемии играет дефицит эритропоэтина, вырабатывающегося почками. В этой связи высказано предположение о том, что его более раннее применение у больных диабетической нефропатией может привести к улучшению прогноза при этом состоянии.
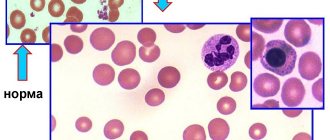
Частота анемии у больных сахарным диабетом
В соответствии с рекомендациями ВОЗ, критерием диагноза анемии является снижение уровня гемоглобина < 120 г/л у женщин и < 130 г/л у мужчин. Сходные критерии использованы в Европейских рекомендациях по лечению анемии у больных ХБП (гемоглобин < 115 г/л у женщин и < 135 г/л у мужчин в возрасте менее 70 лет и < 120 г/л у мужчин в возрасте старше 70 лет) [8]. Если использовать эти критерии, то анемией страдает примерно каждый четвертый больной СД 1 или 2 типа (около 23%) [9–11]. Более выраженное снижение уровня гемоглобина (< 110 г/л) наблюдается примерно у 7–8% пациентов.
Риск развития анемии значительно повышается при появлении признаков диабетической нефропатии (снижение функции почек и/или альбуминурия). Например, по данным M. Thomas, у 60% больных анемией, диагностированной на основании критериев ВОЗ, отмечалось снижение скорости клубочковой фильтрации < 60 мл/мин/1,73 м2 [12]. По мере ухудшения функции почек частота анемии экспоненциально увеличивается как у мужчин, так и у женщин. Уровень гемоглобина наиболее тесно ассоциируется со скоростью клубочковой фильтрации, в том числе у пациентов с нормальным сывороточным содержанием креатинина.
При диабетической нефропатии анемия развивается раньше, чем у пациентов с другими заболеваниями почек. D. Bosman и соавт. [13] сравнили распространенность анемии у больных СД 1 типа, осложнившимся нефропатией, и больных хроническим гломерулонефритом. Анемия была выявлена почти у половины больных с диабетической нефропатией и отсутствовала у всех больных группы сравнения. Более того, повышенную частоту анемии регистрируют у больных СД, не страдающих нарушением функции почек (скорость клубочковой фильтрации > 90 мл/мин/1,73 м2), хотя это не всегда указывает на реальное отсутствие нефропатии. Анемия ассоциируется с микроальбуминурией, которая является ранним маркером воспаления и повреждения микрососудов и предшествует ухудшению почечной функции.
СД способствует развитию более тяжелой анемии. E. Ishimura и соавт. [14] сопоставили уровни гемоглобина у больных СД 2 типа и пациентов с недиабетическими заболеваниями почек. Концентрация гемоглобина у пациентов с диабетом была значительно ниже, чем у больных контрольной группы (p < 0,01). По мнению авторов, СД наряду с сывороточным уровнем креатинина является независимым фактором риска развития анемии.
Роль дефицита эритропоэтина в развитии анемии у больных диабетом
Хотя почечная анемия у больных СД может быть обусловлена различными причинами (дефицит железа, скрытая кровопотеря, хроническая гипоксия и т. д.), ведущую роль в ее развитии играет недостаток эритропоэтина — гликопротеина, который регулирует образование эритроцитов и синтезируется перитубулярными фибробластами коркового слоя почек [15]. Ген, кодирующий эритропоэтин, находится на хромосоме 7q11–q22. Главным сигналом для его транскрипции служит гипоксия. Высказано предположение о том, что эритропоэтин обеспечивает координацию между объемом плазмы и эритроцитарной массой, необходимую для максимальной доставки кислорода в ткани [16].
Непосредственной причиной анемии при ХБП считают недостаточную выработку эритропоэтина в ответ на снижение уровня гемоглобина. У здоровых людей существует обратная зависимость между содержанием эритропоэтина и гемоглобина. При непочечных анемиях (железодефицитной, гемолитической) происходит компенсаторный рост секреции эритропоэтина, который усиливает эритропоэз. В то же время у больных почечной анемией уровни эритропоэтина остаются нормальными, что отражает относительный его недостаток [17]. A. Symeonidis и соавт. [18] сопоставили уровни эритропоэтина у больных с анемией различного происхождения, страдавших и не страдавших СД. Концентрация гемоглобина была сопоставимой в двух группах. Сывороточный уровень эритропоэтина у больных СД оказался значительно ниже, чем у пациентов без диабета (36,5 ± 61 и 69,4 ± 191 МЕ/мл, p < 0,0001), причем эта разница сохранялась при всех формах анемии, за исключением миелопролиферативных заболеваний и мегалобластной анемии. Авторы выявили отрицательную корреляцию между концентрацией эритропоэтина и уровнем гликозилированного гемоглобина (r = –0,446) и высказали предположение о том, что причиной снижения секреции эритропоэтина может быть повышение уровня гликированного гемоглобина.
Причиной нарушения секреции эритропоэтина у больных СД, вероятно, является поражение тубулоинтерстиция почек, которое, как и анемия, предшествует снижению скорости клубочковой фильтрации [12]. На начальных стадиях диабетической нефропатии, даже при отсутствии микроальбуминурии, выявляют утолщение базальной мембраны канальцев [19]. Можно предположить, что повреждение интерстициальных клеток, вырабатывающих эритропоэтин, или нарушение взаимодействия между канальцами, перитубулярными фибробластами и эндотелием, необходимым для нормального гемопоэза, способствуют ухудшению секреции эритропоэтина [12]. Некоторые авторы [20] предлагают рассматривать продукцию этого гормона как маркер тяжести тубулоинтерстициальных изменений при СД. К развитию анемии, вероятно, может привести не только повреждение клеток тубулоинтерстиция, но и нарушение механизмов обратной связи между оксигенацией ткани, эритропоэтином и гемоглобином [12]. В пользу этого свидетельствует сохранение ответной реакции на острую гипоксию у больных СД и анемией [21]. Ингибиция ангиотензин-превращающего фермента (АПФ) ведет к резкому повышению в крови у больных ХБП III–V стадий физиологического ингибитора эритропоэза — тетрапептида Ас-SDKP. Поэтому при лечении ингибиторами АПФ пациенты нуждаются в более высоких дозах эритропоэтина.
У больных с сохраняющимся нефротическим синдромом при развитии белково-энергетической недостаточности масса циркулирующих эритроцитов может значительно снизиться из-за уменьшения выработки эритропоэтина соответственно снижению основного обмена. Однако об истинной тяжести анемии можно судить только после восстановления нормального уровня альбумина в плазме [22].
Анемия как фактор риска
Анемия приводит к появлению ряда симптомов, которые ухудшают качество жизни больных, их физическую и когнитивную функцию, сон, аппетит, толерантность к физической нагрузке. Анемия сопровождается увеличением частоты сердечных сокращений и сердечного выброса, прогрессирующей гипертрофией миокарда и нарушением его диастолической функции. Установлено, что анемия является фактором риска развития сердечной недостаточности и ухудшает ее течение [23]. P. Srivastava и соавт. [24] при эхокардиографии выявили нарушения функции сердца у 94% больных СД 2 типа и анемией. Гипоксия тканей при анемии может способствовать обострению ишемической болезни сердца. Эта проблема особенно актуальна для больных СД 2 типа, который часто сочетается с сердечно-сосудистыми заболеваниями. Почечная недостаточность и сама по себе повышает риск их развития [25].
Анемия ассоциируется с повышенным риском развития сосудистых осложнений СД, в том числе нефропатии, ретинопатии и нейропатии [26, 27]. В исследовании RENAAL, в котором изучались нефропротективные свойства лозартана у больных СД 2 типа, низкая концентрация гемоглобина позволяла предсказать быстрое прогрессирование поражения почек [28]. В этом исследовании у пациентов, у которых были зарегистрированы удвоение сывороточного уровня креатинина, развитие ХБП V стадии или смерть, исходные концентрации гемоглобина оказались ниже, чем у остальных больных. Следует отметить, что анемия сама по себе не вызывает микроангиопатию, а может рассматриваться как ее проявление [29]. Это позволяет понять, почему анемия выступает в качестве маркера риска микрососудистых осложнений.
Однако нельзя исключить, что анемия может и сама способствовать развитию или прогрессированию микроангиопатии [30]. Анемия сопровождается гипоксией тканей, которая дает митогенные и фиброгенные эффекты, а также модифицирует экспрессию генов, регулирующих ангиогенез и проницаемость капилляров, вазомоторный ответ, гликолиз, апоптоз клеток и т. д. [31]. Кроме того, анемия вызывает активацию симпатической и ренин-ангиотензиновой системы, которая способствует развитию протеинурии и артериальной гипертонии у больных с ХБП [32].
Как указано выше, анемия вызывает различные нежелательные изменения сердечно-сосудистой системы, в частности гипертрофию левого желудочка и нарастание ишемии миокарда, и теоретически может быть фактором риска макрососудистых осложнений. Например, у больных сердечной недостаточностью анемия ассоциировалась с увеличением частоты госпитализаций и общей смертности [33]. В исследовании ARIC (Atherosclerosis Risk in Communities) анемия у больных с ХБП служила фактором риска сердечно-сосудистых осложнений [34]. Однако в исследовании NHANES II отсутствовала достоверная ассоциация между анемией и смертностью от ишемической болезни сердца (ИБС) [35].
P. Vlagopoulos и соавт. [36] изучали прогностическое значение анемии у 3015 больных СД, которые принимали участие в четырех крупных популяционных исследованиях, включая Фрамингемское. Анемия имелась у 8,1% из них, а ХБП (скорость клубочковой фильтрации 15–60 мл/мин/1,73 м2) — у 13,8%. Анализировали частоту комбинированной конечной точки (инфаркт миокарда/смерть от ИБС/инсульт/смерть) и отдельных ее компонентов. У больных с нефропатией анемия ассоциировалась с увеличением риска комбинированной конечной точки в 1,7 раза, инфаркта миокарда/смерти от ИБС — в 1,6 раза, инсульта — в 1,8 раза и смерти от любых причин — в 1,9 раза. В то же время у пациентов без нефропатии наличие анемии не сопровождалось увеличением риска каких-либо сердечно-сосудистых исходов. По мнению авторов, полученные результаты могут объясняться различными причинами. Во-первых, у больных с диабетической нефропатией нередко наблюдается поражение других органов, включая сердце, поэтому они могут быть более чувствительными к ишемии, индуцированной анемией. Во-вторых, почечная анемия обусловлена дефицитом эритропоэтина, который в опытах на животных оказывал благоприятное воздействие на сердечно-сосудистую систему (ограничение повреждения миокарда, путем подавления апоптоза эндотелиальных клеток и кардиомиоцитов, а также стимуляции ангиогенеза) [37]. Соответственно, причиной ухудшения прогноза может быть не только анемия, но и недостаток эритропоэтина. В-третьих, могли оказаться неучтенными некоторые факторы, оказывающие влияние на прогноз, например, тяжесть артериальной гипертонии или большая длительность диабета у больных с нефропатией.
Эритропоэтин в лечении анемии у больных сахарным диабетом
Основой лечения почечной анемии является применение рекомбинантного человеческого эритропоэтина, созданного с помощью генно-инженерного метода в конце 20 века. Современные препараты эритропоэтина — это высокоочищенные гликопротеиды, состоящие из полипептидных цепей и карбогидратной части (альфа или бета), на концах которой расположены сиаловые группы, предотвращающие инактивацию гормона. Выделяют эритропоэтины альфа и эритропоэтины бета. Препараты рекомбинантного человеческого эритропоэтина применяются внутривенно или подкожно. Подкожный способ введения эритропоэтина не уступает внутривенному по эффективности, в то же время является более безопасным и экономичным: коррекция анемии достигается в те же сроки, что и при внутривенном способе, но за счет применения меньших (в 1,5–2 раза) кумулятивных и поддерживающих доз [8]. Чаще всего для лечения почечной анемии используют эритропоэтин бета (Рекормон), который вводят подкожно или внутривенно три раза в неделю. В последние годы показана также возможность подкожного применения этих препарата один раз в неделю (суммарная недельная доза соответствует таковой при трех инъекциях), что значительно облегчает практическое применение препарата. Еще один препарат — дарбэпоэтин альфа (Аранесп) в России пока не зарегистрирован. В европейских рекомендациях по лечению почечной анемии эритропоэтин рекомендуется назначать всем больным с хронической болезнью почек, у которых уровень гемоглобина составляет < 110 г/л при двух измерениях подряд и исключены другие возможные причины анемии (прежде всего дефицит железа) [8, 39]. Предпочтение следует отдавать подкожному введению, так как оно позволяет снизить требуемую дозу эритропоэтина и, соответственно, затраты на лечение.
В последние годы большой интерес у исследователей вызывает раннее применение эритропоэтина в додиализном периоде. Высказываются предположения о том, что подобная терапия может задержать прогрессирование заболевания почек или снизить риск сердечно-сосудистых осложнений, хотя благоприятные эффекты эритропоэтина могут нивелироваться его способностью вызывать артериальную гипертензию. J. Cody и соавт. [40] провели метаанализ 15 контролируемых исследований рекомбинантного человеческого эритропоэтина у 461 больного почечной анемией, не получавшего лечение диализом. Терапия этим препаратом привела к значительному увеличению уровня гемоглобина (в среднем на 1,82 г/дл) и гематокритного числа (на 9,85%) и снижению потребности в гемотрансфузиях, а также улучшению качества жизни и толерантности к физической нагрузке. Существенного увеличения частоты нежелательных явлений или признаков ухудшения функции почек не выявили. Некоторым авторам удалось продемонстрировать благоприятные эффекты раннего применения эритропоэтина на функцию почек. Например, С. Gouva и соавт. [41] изучали этот препарат в рандомизированном исследовании у 88 больных с сывороточным уровнем креатинина 2–6 мг/дл и концентрацией гемоглобина 90–116 г/л. Лечение эритропоэтином оказывало благоприятное влияние и на функцию сердца у больных почечной анемией, в частности вызывало уменьшение гипертрофии миокарда.
В исследовании, проведенном в нашей клинике [42], у всех 34 больных с ХБП III–IV стадий при эхокардиографии и суточном мониторировании в динамике продемонстрировано благоприятное влияние эритропоэтина бета на функцию сердца. Через 5 мес после начала лечения выявили нормализацию сердечного выброса и диастолической функции, а также отчетливую тенденцию к обратному развитию гипертрофии миокарда. Ни у одного из 34 больных к моменту поступления на гемодиализ не сформировалась эксцентрическая гипертрофия левого желудочка.
J. Ayus и соавт. [43] проводили лечение эритропоэтином у 40 больных диабетической и недиабетической нефропатией и анемией (гемоглобин < 100 г/л). Через 6 месяцев индекс массы миокарда левого желудочка достоверно снизился (р = 0,007), а уровень гемоглобина увеличился (p = 0,001). В контрольной группе достоверных изменений этих показателей не выявили.
Получены убедительные данные, свидетельствующие о том, что эффекты эритропоэтина бета при ХБП не ограничиваются только стимуляцией гемопоэза. Так, Van der Meer P. и соавт. [44] на модели инфаркта миокарда у крыс показали, что этот препарат уменьшает зону повреждения кардиомиоцитов на 56% (p < 0,05) и подавляет их апоптоз на 15% (p < 0,05). Установлено, что эритропоэтин бета ускоряет пролиферацию кардиомиоцитов [45]. В связи с этим можно предположить, что влияние эритропоэтина бета на площадь инфаркта, с одной стороны, обусловлено подавлением апоптоза эндотелиальных клеток и кардиомиоцитов, с другой — увеличением пролиферации кардиомиоцитов.
В настоящее время начато несколько крупных контролируемых исследований, целью которых является изучение безопасности ранней терапии эритропоэтином и ее эффективности в профилактике сердечно-сосудистых осложнений и прогрессирования почечной недостаточности у больных с ХБП. Например, в исследовании CREATE (Cardiovascular Risk reduction by Early Anaemia Treatment with Epoetin beta) рандомизированы 600 больных с клиренсом креатинина 15–35 мл/мин и анемией (110–125 г/л) [46]. Цель исследования — сравнить отдаленные результаты ранней (целевой уровень гемоглобина 130–150 г/л) и отсроченной (при снижении уровня гемоглобина < 105 г/л, целевая его концентрация 105–115 г/л) терапии эритропоэтином бета. В исследовании ACORD (Anaemia CORrection in Diabetes) предполагается оценка эффективности ранней коррекции анемии с помощью эритропоэтина бета у 160 больных диабетической нефропатией. Пациенты основной группы начнут лечение эритропоэтином бета сразу после включения в исследование (целевой уровень гемоглобина 130–150 г/л), а больным контрольной группы планируется начинать стандартную терапию при уровне гемоглобина менее 105 г/л. В исследовании TREAT (Trial to Reduce cardiovascular Events with Aranesp Therapy), имеющем сходный дизайн, планируется изучение эффективности ранней терапии дарбэпоэтином альфа.
Выбор дозы и кратности введения эритропоэтина и препаратов железа
На додиализном этапе ХБП (III–IV стадии ХБП) эритропоэтин бета вводят больным подкожно в дозе 20 ЕД/кг 3 раза в неделю или 60 ЕД/кг 1 раз в неделю. При этом целевой уровень гемоглобина (120 г/л), соответствующего его полной коррекции, достигают за 4 мес. Баланс железа у больных с III стадией ХБП и СД можно поддерживать с помощью приема внутрь препаратов железа, например Мальтофера, который назначают 1 раз в сутки за 2 часа до еды, при этом доза элементарного железа должна быть не менее 200 мг/сут. В процессе лечения необходим постоянный контроль за остаточной функцией почек (динамика скорости клубочковой фильтрации и уровень креатинина крови), артериальным давлением (включая суточное мониторирование), объемом циркулирующей крови, сердечной гемодинамикой. Поэтому большое значение имеет комбинация эритропоэтина с антигипертензивной терапией, соблюдением малобелковой диеты (0,6 г белка на 1 кг массы тела) и ограничение потребления натрия.
В настоящее время выпускается система для подкожного введения Рекормона — шприц-ручка Реко-пен и картриджи с эритропоэтином бета по 10 000 МЕ и по 20 000 МЕ. Использование этой системы позволяет пациентам самостоятельно дозировать препарат, а очень тонкая игла сводит к минумуму дискомфорт, связанный с местными реакциями. Применение Реко-пена не только хорошо переносится пациентами, но и снижает затраты на лечение.
Медленный прирост уровня гемоглобина (менее 10 г/л в месяц или гематокритного числа менее 0,5% в месяц) является признаком снижения эффективности эритропоэтина. Самая частая причина снижения ответа на эритропоэтин — дефицит железа. Достижение и сохранение целевого уровня гемоглобина обеспечивается поддержанием нормального баланса железа: уровень ферритина 200–500 мкг/л, насыщение трансферрина (TSAT) 30–40%, количество гипохромных эритроцитов < 2,5%. Если у больного с хронической почечной недостаточностью со сниженным ответом на эритропоэтин отсутствуют признаки дефицита железа, необходим поиск других причин сниженного ответа на эритропоэтин. Среди них: бактериальные инфекции (включая туберкулез), хронические кровотечения, тяжелый уремический гиперпаратиреоз, онкологические заболевания (миеломная болезнь), влияние лекарств (ингибиторы АПФ, блокаторы рецепторов ангиотензина II, цитоcтатики, блокаторы Н2-рецепторов гистамина, теофиллин, витамин А). Индикатором текущего активного воспалительного процесса является повышение уровня С-реактивного белка (СРБ) крови более 50 мг/мл. Если у больного с резистентностью к эритропоэтину не выявляют скрытого желудочно-кишечного кровотечения, повышенного уровня СРБ, дозу эритропоэтина увеличивают на 50%.
Заключение
Анемию относят к числу наиболее частых проявлений ХБП. Главной причиной ее развития является недостаточная выработка эритропоэтина в ткани почек. При диабетической нефропатии анемия развивается чаще и раньше и протекает тяжелее, чем при ХБП другой этиологии. Почечная анемия ухудшает качество жизни больных СД 1 и 2 типа, их физическую и когнитивную функции, сон, аппетит, толерантность к физической нагрузке. Более того, она ассоциируется с повышенным риском микрососудистых и макрососудистых осложнений СД. Например, анемия в несколько раз увеличивает риск прогрессирования диабетической нефропатии до терминальной стадии ХБП при СД как 1 типа, так и 2 типа.
Эффективным методом коррекции анемии у больных с хронической болезнью почек, в том числе диабетической нефропатией, является подкожное применение эритропоэтина. Полагают, что раннее его назначение может привести к снижению риска сердечно-сосудистых заболеваний. В настоящее время эта гипотеза изучается в рандомизированных контролируемых исследованиях.
Литература
- Amos A., McCarty D., Zimmet P. The rising global burden of diabetes and its complications: estimates and projections of the year 2010 // Diabetic Med. 1997; 14 (5): S7–S85.
- Van Ypersele de Strihou C. Should anaemia in subtypes of CRF patients be managed differently? // Nephrol. Dial. Transplant. 1999; 14 (2): 37–45.
- Ведение больных сахарным диабетом с терминальной почечной недостаточностью на диализе. Методические указания под ред. И. И. Дедова и Н. А. Томилиной. 2004. 62 с.
- McClellan W., Aronoff S., Bolton W. et al. The prevalence of anemia in patients with chronic kidney disease // Curr. Med. Res. Opin. 2004; 20: 1501–1510.
- Добронравов В. А., Смирнов А. В. Анемия и хроническая болезнь почек // Анемия. 2005; 2: 2–8.
- Astor B., Muntner P., Levin A. et al. Association of kidney function with anemia: the Third National Health and Nutrition Examination Survey (1988–1994) // Arch. Intern. Med. 2002; 162: 1401–1408.
- Stevens P., O’Donogue D., Lameire N. Anemia in patients with diabetes: unrecognized, undetected and untreated? // Curr. Med. Res. Opin. 2003; 19: 395–401.
- Locatelli F., Aljama P., Barany P. et al. Revised European best practice guidelines for the management of anaemia in patients with chronic renal failure // Nephrol. Dial. Transplant. 2004; 19 (2): ii1–ii47.
- Thomas M., MacIsaac R., Tsalamandris C. et al. Unrecognized anemia in patients with diabetes: a cross-sectional survey // Diabetes Care. 2003; 26: 1164–1169.
- Thomas M., MacIsaac R., Tsalamandris C. et al. The burden of anaemia in type 2 diabetes and the role of nephropathy: a cross-sectional audit // Nephrol. Dial. Transplant. 2004; 19: 1792–1797.
- Thomas M., MacIsaac R., Tsalamandris C. et al. Anemia in patients with type 1 diabetes // J. Clin. Endocrinol. Metab. 2004; 89: 4359–4363.
- Thomas M., Cooper M., Rossing K. et al. Anaemia in diabetes: is there a rationale to TREAT? // Diabetologia. 2006; Apr. 4 .
- Bosman D., Winkler A., Marsden J. et al. Anemia with erythropoietin deficiency occurs early in diabetic nephropathy // Diabetes Care. 2001; 24: 495–499.
- Ishimura E., Nishizawa Y., Okuno S. et al. Diabetes mellitus increases the severity of anemia in non-dialyzed patients with renal failure // J. Nephrol. 1998; 11: 83–86.
- Maxwell P., Osmond M., Pugh C. et al. Identification of the renal erythropoietinproducing cells using transgenic mice // Kidney Int. 1993; 44: 1149–1162.
- Donnelly S. Why is erythropoietin made in the kidney? The kidney functions as a critmeter // Am. J. Kidney Dis. 2001; 38: 415–425.
- Thomas M., Cooper M., Tsalamandris C. et al. Anemia with impaired erythropoietin response in diabetic patients // Arch. Intern. Med. 2005; 165: 466–469.
- Symeonidis А., Kouraklis-Symeonidis А., Psiroyiannis А. et al. Inappropriately low erythropoietin response for the degree of anemia in patients with noninsulin-dependent diabetes mellitus // Ann. Hematol. 2006; 85 (2): 79–85.
- Brito P., Fioretto P., Drummond K. et al. Proximal tubular basement membrane width in insulin-dependent diabetes mellitus // Kidney Int. 1998; 53: 754–761.
- Inomata S., Itoh M., Imai H., Sato T. Serum levels of erythropoietin as a novel marker reflecting the severity of diabetic nephropathy // Nephron. 1997; 75: 426–430.
- Bosman D., Osborne C., Marsden J. et al. Erythropoietin response to hypoxia in patients with diabetic autonomic neuropathy and non-diabetic chronic renal failure // Diabet Med. 2002; 19: 65–66.
- Милованов Ю. С., Козловская Л. В., Милованова Л. Ю. Лечение анемии у больных хронической почечной недостаточностью на додиализном этапе // Лечащий Врач. 2006; 7: 12–23.
- Dries D., Sweitzer N., Drazner M. et al. Prognostic impact of diabetes mellitus in patients with heart failure according to the etiology of left ventricular systolic dysfunction // J. Am. Coll. Cardiol. 2001; 38: 421–428.
- Srivastava P., Thomas M., Calafiore P. et al. Diastolic dysfunction is associated with anaemia in patients with Type II diabetes // Clin. Sci. (Lond.). 2006; 110: 109–116.
- Томилина Н. А., Волгина Г. В., Бикбов Б. Т., Ким И. Г. Проблема сердечно-сосудистых заболеваний при хронической почечной недостаточности // Нефрология и диализ. 2003; 5 (1): 15–23.
- Ueda H., Ishimura E., Shoji T. et al. Factors affecting progression of renal failure in patients with type 2 diabetes // Diabetes Care. 2003; 26: 1530–1534.
- Qiao Q., Keinanen-Kiukaanniemi S., Laara E. The relationship between hemoglobin levels and diabetic retinopathy // J. Clin. Epidemiol. 1997; 50: 153–158.
- Keane W., Brenner B., de Zeeuw D. et al. The risk of developing end-stage renal disease in patients with type 2 diabetes and nephropathy: the RENAAL study // Kidney Int. 2003; 63: 1499–1507.
- Thomas M., Tsalamandris C., MacIssaac R., Jerums G. Anemia in diabetes; an emerging complication of microvascular disease. Current Diabetes Rev. 2005; 1: 107–126.
- Шестакова М. В., Кошель Л. В., Вагодин В. А., Дедов И. И. Факторы риска прогрессирования диабетической нефропатии у больных с длительным течением сахарного диабета по данным ретроспективного анализа // Тер. архив. 2006; 6: 34–39.
- Deicher R., Horl W. Anaemia as a risk factor for the progression of chronic kidney disease // Curr. Opin. Nephrol. Hypertens. 2003; 12: 139–143.
- Fine L., Bandyopadhay D., Norman J. Is there a common mechanism for the progression of different types of renal diseases other than proteinuria? Towards the unifying theme of chronic hypoxia // Kidney Int. Suppl. 2000; 75: S22–S28.
- Anand I., McMurray J., Whitmore J. et al. Anemia and its relationship to clinical outcome in heart failure // Circulation. 2004; 110: 149–154.
- Sarnak M., Tighiouart H., Manjunath G. et al. Anemia as a risk factor for cardiovascular disease in the Atherosclerosis Risk in Communities (ARIC) study // J. Am. Coll. Cardiol. 2002; 40: 27–33.
- Brown D., Giles W., Croft J. Hematocrit and the risk of coronary heart disease mortality // Am. Heart J. 2001; 142: 657–663.
- Vlagopoulos P., Tighiouart H., Weiner D. et al. Anemia as a risk factor for cardiovascular disease and all-cause mortality in diabetes: the impact of chronic kidney disease // J. Am. Soc. Nephrol. 2005; 16: 3403–3410.
- Van der Meer P., Voors A., Lipsic E. et al. Erythropoietin in cardiovascular diseases // Eur. Heart J. 2004; 25: 285–291.
- Милованов Ю. С., Козловская Л. В., Николаев А. Ю., Милованова Л. Ю. Анемия у больных с хронической почечной недостаточностью: принципы терапии // Лечащий Врач. 2005; 10: 18–24.
- Ермоленко В. М., Хасабов Н. Н., Михайлова Н. А. Рекомендации по применению препаратов железа у больных с хронической почечной недостаточностью // Анемия. 2005; 2: 9–25.
- Cody J., Daly C., Campbell M. et al. Recombinant human erythropoietin for chronic renal failure anaemia in pre-dialysis patients // Cochrane Database Syst. Rev. 2005; (3): CD003266.
- Gouva C., Nikolopoulos P., Ionnidis J., Siamopoulos K. Treating anemia early in renal failure patients slows the decline of renal function: a randomized controlled trial // Kidney Int. 2004; 66: 753–760.
- Козловская Л. В., Милованов Ю. С., Фомин В. В., Милованова Л. Ю. Сердечно-сосудистые эффекты эритропоэтина у больных с консервативной стадией хронической почечной недостаточности // Врач. 2004; 10: 57–59.
- Ayus J., Go A., Valderrabano F., Verde E. Effects of erythropoietin on left ventricular hypertrophy in adults with severe chronic renal failure and hemoglobin 10 g/dL // Kidney Int. 2005; 68 (2): 788–795.
- Van der Meer P., Lipsic E., Boer et al. A functional erythropoetin receptor in rat heart is linked to anti-apoptotic effects // J. Am. Coll. Cardiol. 2003; 41: 330A.
- Saraste A., Pulkki K., Kallajoki M. et al. Apoptosis in human acute myocardial infarction // Circulation. 1997; 95: 320–322.
- Eckardt K. The CREATE trial-building the evidence // Nephrol. Dial. Transplant. 2001; 16 (2): 16–18.
Ю. С. Милованов, доктор медицинских наук С. Ю. Милованова, кандидат медицинских наук ММА им. И. М. Сеченова, Москва
Какая норма сатурации у здорового человека?
Нормой для здорового человека считается SpO2 = 95-99 (или 100)%. Норма сатурации крови кислородом зависит от индивидуальных особенностей организма человека, например, от наличия или отсутствия анемии, апноэ, хронических заболеваний дыхательной и сердечно-сосудистой систем, вредных привычек, возраста. Ночью у каждого человека сатурация снижается, причем различия бывают существенными. Например у людей с хроническими заболеваниями дыхательной системе (ХОБЛ, апноэ), адаптировавшихся к постоянной нехватке кислорода, показатель может упасть до 90% (в глубокой фазе сна).*
По наблюдениям медиков, работающих в больницах с тяжелобольными пациентами, которые находятся «на кислороде», наиболее опасное время — с 3 до 7 часов ночи. В это время регистрируется наибольшее количество летальных исходов из-за снижения сатурации, точнее из-за кислородной гипоксемии.
R.E. Gries, L.J. Brooks, Normal oxyhemoglobin saturation during sleep. How low does it go? K. Szabó, F. Ihász, The effect of reduced oxygen saturation during sleep on depression, 2020
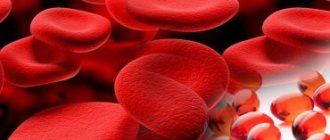
Какие продукты повышают гемоглобин
Для улучшения самочувствия и нормализации обменных процессов нужно знать, как повысить гемоглобин при сахарном диабете. Для этого в рацион необходимо включать такие продукты:
- Печень говяжья и куриная.
- Телятина и говядина.
- Индейка.
- Яичный желток.
- Кальмары, мидии.
- Бобовые – фасоль, горошек зеленый
- Петрушка, шпинат.
- Кунжут, семечки подсолнечника и тыквы.
- Грецкие орехи.
- Черника.
- Абрикосы и сливы.
- Сухофрукты
- Малина.
- Гречневая крупа и отруби пшеничные.
Во всех этих продуктах содержится много железа, но лучше всего оно усваивается из животных продуктов. Усиливает его всасывание аскорбиновая кислота из отвара шиповника, яблочного или черносмородинового сока, а тормозит кофе, чай и молочные продукты.
Бобовые богаты железом и белком, но для его лучшего усвоения нужно их замачивать на ночь, а затем промывать. Так уходит фитиновая кислота, тормозящая всасывание железа.
Можно приготовить смесь из сухофруктов и грецких орехов, измельченных в блендере, лимонов. Все нужно взять в равных частях. Принимать по столовой ложке утром натощак, запивая отваром шиповника.
Профилактика изменений в крови
Однажды столкнувшись с анемией стоит придерживаться общих рекомендаций в течении всей жизни:
- Два раза в год проходить медицинское обследование
- Формировать сбалансированную, разнообразную диету.
- Контролировать режим труда и отдыха, выполнять прогулки на свежем воздухе.
- Исключить вредные привычки
- Поддерживать нормальный вес тела.
Прогулки — хорошая профилактика
Дизайн исследования
В популяционном когортном исследовании использовали данные Swedish National Diabetes Registry (1998-2017 гг.).
Участниками исследования стали 10 398 детей и взрослых с СД 1 типа, за которыми наблюдали с момента установления диагноза до конца 2021 года.
В качестве основой конечной точки
было выбран относительный риск (отношение шансов) ретинопатии и нефропатии для различных уровней гликированного гемоглобина.
Результаты анализов
Интерпретировать результаты анализов может только врач, так как он оценивает их в комплексе с другими симптомами, весом, наследственностью, состоянием. Так у беременных может повышаться уровень сахара в крови и врач решает требуется корректировка или нет. Если диагноза диабет удалось избежать, многие могут обнаружить у себя предиабет, нарушенную толерантность к глюкозе и метаболический синдром.
Одним из наглядных способов для коррекции питания, уровня физической нагрузки может стать использование глюкометра Contour Plus с тест-полосками в комплекте. Маленькая капля крови — точный способ измерения позволят увидеть на дисплее результаты усилий и привить новые привычки здорового образа жизни. Это может помочь избежать многих проблем в будущем.