Жировые дистрофии связаны с избыточным накоплением в цитоплазме паренхиматозных клеток липидов (нейтральных жиров, триглицеридов, фосфолипидов, холестерина), либо с появлением их в тех клетках, где они в норме не встречаются, либо с появлением в цитоплазме клеток липидов аномального состава. Потребность человека в жирах составляет 80—100 г в сутки.
Основные функции липидовв организме:
- структурная — липиды составляют основу клеточных мембран;
- регулирующая;
- энергообеспечивающая, поскольку липиды являются одним из главных источников энергии.
В зависимости от клинических проявлений выделяют:
- липидозы;
- ожирение;
- истощение.
Причинами приобретенных липидозов наиболее часто служат гипоксия и различные интоксикации. Поэтому жировые дистрофии являются компонентом заболеваний, сопровождающихся ки-i слородным голоданием. — ишемической болезни сердца, гипертонической болезни, пороков сердца, хронических заболеваний легких (бронхоэктатическая болезнь, туберкулез, эмфизема легких). приводящих к развитию легочно-сердечной недостаточности. Кроме того, жировую дистрофию вызывают различные инфекции и интоксикации, которые сопровождаются как гипоксией, так и блокадой токсинами ферментов, катализирующих в клетках метаболизм липидов. Липидозы иногда могут быть связаны с недостатком витаминов и некоторых аминокислот.
В патологии наибольшее значение имеют жировые дистрофии миокарда, печени и почек.
Рис. 3. Жировая дистрофия миокарда. а — кардиомиоциты с жировым включениями; б — венулы; в — кардиомиоциты, свободные от жировых включений.
Жировая дистрофия миокарда развивается путем декомпозиции жиробелковых комплексов мембран внутриклеточных структур, а также в результате инфильтрации кардиомиоцитов липидами. Вне зависимости от механизма дистрофии в клетках миокарда вначале появляются мелкие включения жира (пылевидное ожирение), затем они сливаются в капли (мелкокапельное ожирение), которые постепенно заполняют всю саркоплазму и могут приводить к гибели клеток (рис. 3).
на для резкого снижения функции сердца и развития сердечной недостаточности.
Жировая дистрофия печени, или жировой гепатоз
Рис. 4. Жировая дистрофия миокарда («тигровое сердце»). Под эндокардом видны желто-белые полоски, соответствующие участкам включения липидов в кардиомиоцитах.
Вместе с тем при многих интоксикациях и инфекциях возможен механизм декомпозиции мембран внутриклеточных структур с распадом их жиробелковых комплексов. Наконец, жировой гепатоз развивается в результате трансформации белков и углеводов в липиды, что наблюдается, например, при хронической алкогольной интоксикации. В любом случае в цитоплазме гепатоцитов, в основном периферии печеночных долек, развивается вначале пылевидное ожирение, которое трансформируется в мелкокапельное, а затем — в крупнокапельное. При этом ядро и внутриклеточные структуры оттесняются на периферию клеток, которые нередко гибнут. В этих случаях жировые включения погибших гепатоцитов сливаются, образуя жировые кисты. Макроскопические изменения печени зависят от степени выраженности дистрофии. В тяжелых случаях, например при алкоголизме, печень увеличена в размере, дряблая, на разрезе охряного цвета — «гусиная печень». При менее выраженной жировой дистрофии печень также увеличена в размере, на разрезе желтовато-серого цвета. При жировых гепатозах функция печени долго сохраняется, однако по мере прогрессирования основного заболевания и жировой дистрофии она снижается, иногда весьма значительно.
Жировая дистрофия почек развивается путем инфильтрации эпителия канальцев при гиперлипидемии, наблюдающейся, в частности, при нефротическом синдроме. В этой ситуации липиды оказываются в первичной моче (гиперлипидурия) и усиленно реабсорбируются клетками эпителия канальцев, но в таких больших количествах, что эти клетки не способны метаболизировать попавшие в них липиды — развивается мелкокапельное ожирение эпителия канальцев. Обычно оно сочетается с их гиалиново-капельной дистрофией. Почки при этом внешне изменены мало, но при тяжелом течении основного патологического процесса они приобретают серовато-желтый цвет, а на разрезе их пирамиды могут принимать желтую окраску.
Исход паренхиматозной жировой дистрофии зависит от степени ее выраженности — пылевидное и мелкокапельное ожирение обратимо при ликвидации вызвавшей его причины, крупнокапельное ожирение может закончиться гибелью клеток.
Тиреотоксикоз
Гормоны щитовидной железы (трийодтиронин, тироксин) стимулируют обмен веществ, их избыток приводитк повышению потребности в кислороде и энергии. Сердечная мышца к этому особенно чувствительна и начинает страдать в первую очередь: развивается дистрофия миокарда, как следствие – специфическая кардиомиопатия (“тиреотоксическое сердце”). Тиреоидные гормоны также оказывают на сердце “подстегивающее” влияние: увеличивают частоту сердечных сокращений, сердечный выброс.
Возможно развитие следующих симптомов:
- ощущение сердцебиения, учащенный пульс даже в состоянии покоя, выраженная утомляемость;
- повышение артериального давления, в особенности – систолического (“верхнее” давление), обычно стабильное, без кризов;
- нередко отмечается существенный разброс между значениями систолического и диастолического давления;
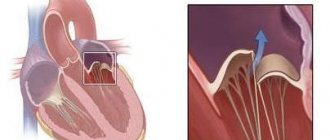
- при выслушивании сердечных тонов врач может определить характерные шумы, а ультразвуковое исследование сердца часто обнаруживает пролапс (провисание, выпячивание) митрального клапана;
- чаще всего присутствует т.н. синусовая тахикардия;
- если у пациента изначально имелась сердечная патология, на фоне тиреотоксикоза она усугубляется: приступы стенокардии, мерцательная аритмия, устойчивая к лекарственной терапии (у пожилых это иногда единственный симптом тиреотоксикоза).
Со временем стенки сердца утолщаются, расширяются его полости, сердечная мышца частично замещается соединительной тканью, формируется фиброз, нарушается сократительная способность сердца, что может привести к сердечной недостаточности, фибрилляции предсердий.
Лечение:
- медикаментозное – тиреостатики, бета-блокаторы, сердечные гликозиды, диуретики, антиагреганты и др.;
- радиойодтерапия;
- к хирургическому вмешательству прибегают в тяжелых случаях, при низкой эффективности консервативного лечения – выполняется так называемая субтотальная резекция щитовидной железы – т.е. удаление большей ее части. Гипотиреоз
При пониженной функции щитовидной железы частота сердечных сокращений, сердечный выброс, артериальное давление, напротив, снижаются. Изменяется липидный состав крови, отмечается повышенное содержание холестерина, распространенный атеросклероз, в особенности сосудов сердца. Формируется специфическая кардиомиопатия – «гипотиреоидное» или «микседематозное сердце».
Возможно появление следующих симптомов:
- редкий слабый пульс;
- боли в области сердца;
- систолическое давление обычно понижено, в то время как диастолическое может оставаться нормальным;
- иногда возможно развитие сопутствующей гипертонии;
- общая отечность;
- слабость, вялость, остановки дыхания во сне;
- рентгенографическое исследование выявляет увеличение размеров сердца.
Самым распространенным видом аритмии при гипотиреозе является синусовая брадикардия.
Страдает сократительная функция сердца, есть риск развития сердечной недостаточности. В мышечной стенке и в сердечной сумке скапливается слизистая жидкость, развивается муцинозный отек, также затрудняющий кровоснабжение сердца, все это может приводить к появлению очагов ишемии, повышению риска развития инфаркта.
Лечение:
- Основное лечение – заместительная терапия тиреоидными гормонами;
- При сопутствующей артериальной гипертензии – гипотензивные препараты, диуретики;
- Существуют и хирургические инновационные методы – например, трансплантация донорских клеток щитовидной железы.
ВРОЖДЕННЫЕ ПАРЕНХИМАТОЗНЫЕ ЛИПИДОЗЫ
Врожденные паренхиматозные липидозы являются наследственными ферментопатиями, наследуемыми по аутосомно-рецессивному типу, и характеризуются накоплением в клетках липидов, повреждающих структуры клеток и сопровождающихся нередко гибелью самих клеток. Наиболее часто встречаются следующие липидные тезаурисмозы:
- Болезнь Гоше вызвана отсутствием фермента бета-глюкоцереброзидазы. В результате глюкоцереброзиды накапливаются в печени, селезенке, костном мозге, в головном мозге, эндокринных железах и лимфатических узлах, что приводит к гибели клеток этих органов и к прогрессирующему слабоумию, увеличению массы печени, селезенки и истощению (кахексии).
- Болезнь Нимана—Пика развивается при отсутствии фермента сфингомиелиназы, расщепляющей сфингомиелин, входящий в состав многих тканей, но особенно нервной ткани. У больных детей он накапливается в клетках большинства органов и при этом происходит увеличение массы печени и селезенки (гепато- и спленомегалия), отставание в психическом развитии, появляются неврологическая симптоматика, гипотония, истощение. Дети погибают в возрасте 2—3 лет.
УГЛЕВОДНЫЕ ДИСТРОФИИ
Углеводные дистрофии связаны с накоплением в клетках бел-ково-полисахаридных комплексов (гликоген, гликопротеины), либо с образованием этих веществ в тех клетках, где их нет в норме, либо с изменением их химического состава.
Углеводы — обязательный и наиболее значительный компонент пищи. В сутки человек потребляет 400—600 г различных углеводов. Они являются необходимым элементом метаболизма, важным компонентом структуры клеток и межклеточного вещества и одним из главных источников энергии для обеспечения жизнедеятельности организма.
ПРИОБРЕТЕННЫЕ УГЛЕВОДНЫЕ ДИСТРОФИИ
Гипогликемии — состояния, характеризующиеся снижением содержания глюкозы в крови ниже 65 мг%, или 3,58 ммоль/л. В норме уровень глюкозы крови натощак колеблется в диапазоне 65—110 мг%, или 3,58—6,05 ммоль/л.
Причинами гипоглюкемии являются заболевания печени — xpонические гепатиты, циррозы печени, ее жировая дистрофия, а также длительное голодание.
Результаты заболеваний:
- нарушение транспорта глюкозы из крови в гепатоциты, снижение уровня образования в них гликогенеза и в связи с этим отсутствие депонированного гликогена;
- торможение процесса образования гликогена и транспорта глюкозы из гепатоцитов в кровь.
Последствия гипогликемии
- Гипогликемический синдром — стойкое снижение содержания глюкозы в крови ниже нормы (до 60—50 мг%, или 3,3—2,5 ммоль/л), приводящее к расстройству жизнедеятельности организма.
- Гипогликемическая кома — состояние, характеризующееся: — падением концентрации глюкозы в крови ниже 40—30 мг%, или 2.0—1.5 ммоль/л);
- — потерей сознания;
- — опасными для жизни расстройствами функций организма.
Гипергликемии — состояния, характеризующиеся увеличением
содержания глюкозы в крови выше нормы (более 120 мг%, или 6,05 ммоль/л натощак).
Причины гипергликемии:
- патология эндокринной системы, сопровождающаяся избытком гормонов, стимулирующих поступление углеводов в кровь (глюкагона, глюкокортикоидов, катехоламинов, тиреоидных гормонов, соматотропного гормона) либо недостатком инсулина или снижением его эффективности;
- нейро- и психогенные расстройства, например реактивные психозы, стресс-реакции и подобные им состояния, характеризующиеся активацией органов эндокринной системы;
- переедание, прежде всего длительное избыточное потребление кондитерских изделий;
- заболевания печени, при которых гепатоциты теряют cпособность трансформировать глюкозу в гликоген.
Последствия
- Гипергликемический синдром — состояние сопровождающееся значительным увеличением содержания глюкозы в крови выше нормы (до 190—210 мг%, 10,5—11,5 ммоль/л и более), приводящее к расстройствам жизнедеятельности организма.
- Гипергликемическая кома, характеризующаяся потерей сознания, снижением или утратой рефлексов, расстройствами дыхания и кровообращения, нередко заканчивающаяся смертью больного.
Наиболее часто гипергликемия наблюдается при сахарном диабете, развивающемся в результате абсолютной или относительной инсулиновой недостаточности (см. главу 19).
Дистрофия миокарда
Дистрофия миокарда – поражение сердечной мышцы невоспалительного характера, вызванное нарушением обмена веществ в организме.
Причинами болезни могут послужить следующие факторы:
- Авитаминоз;
- Нарушение углеводного, белкового, жирового обменов (при печеночной недостаточности, уремии, диабете и т.д.);
- Расстройства эндокринной системы (тиреотоксикоз, гипотиреоз, нарушения функций гипофиза);
- Нарушения обмена электролитов (при содержании в организме калия и кальция выше или ниже нормы);
- Системные нервно-мышечные сбои (миастения, миопатия);
- Кислородное голодание (при легочной и сердечной недостаточности);
- Интоксикация (отравление организма опасными веществами, в том числе при алкогольном опьянении, передозировке лекарственных средств, а также в случае почечной и печеночной недостаточности и др.).
- Инфекции (острые и хронические);
- Нейрогенные воздействия (стресс, симпатикотомия).
- Анемия;
- Физическое перенапряжение.
Дистрофия миокарда не имеет четких симптомов, так как представляет собой сопутствующий диагноз, и во многом самочувствие больного определяется течением основного заболевания. Жалобы пациента сводятся к неприятным ощущениям, тупым болям в области сердца, одышке, сердцебиению, быстрой утомляемости. При этом недуге нарушается способность сердечной мышцы к сокращению, что обуславливает легкую и, гораздо реже, умеренную формы сердечной недостаточности. Кардиологи выделяют три стадии развития дистрофии миокарда:
- Нейрофункциональную (когда еще нет отклонения от нормы, но напряжение метаболического характера уже существует);
- Обменно-структурную или органических изменений (уже имеются признаки изменения миокарда);
- Стадия сердечной недостаточности (выраженные изменения структуры и функций сердечной мышцы).
Считается, что дистрофия миокарда имеет обратимый характер. Лечение этого заболевания направлено на воздействие на метаболические процессы, нарушение проводимости, сердечную недостаточность.
Так, широко применяются лекарственные препараты, воздействующие на электролитный обмен. В основном это соли калия, магний и фосфорилированные витамины В и В6.
Популярным средством является анаболические гормоны, показавшие свою действенность при нарушении белкового обмена, питания сердечной мышцы. К этой группе препаратов относится метандростенолон, пиридиновые (оротаткалия) и пуриновые (рибоксин, инозид) мононуклеотиды, АТФ и АМФ.
Важную роль в лечении дистрофии миокарда играет систематическое посещение санаториев, специализирующихся на лечении сердечно-сосудистых заболеваний. Минеральные воды, богатые калием, кальцием и магнием и другими необходимыми веществами, восполнят биохимический дисбаланс в организме, восстанавливают электролитный обмен.