В группе врожденных пороков сердца тетрада Фалло занимает устойчивое десятое место. Распространенность среди «синих» пороков составляет половину. В медицинской отчетности и справочной литературе нередко применяется аббревиатура ВПС, что является синонимом термина «порок сердца врожденного характера».
В Международной классификации болезней МКБ-10 он включен в группу врожденных аномалий под кодом Q21.3. Необычное сочетание нарушения формирования сердца и главных сосудов описал в 1888 году А. Фалло как отдельный синдром. Его имя осталось в истории медицины.
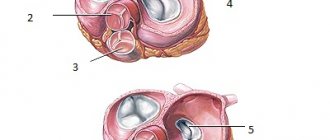
Из каких аномалий состоит синдром, особенности анатомии
Тетрада Фалло включает сочетание четырех аномалий:
- дефекта в межжелудочковой перегородке;
- правосторонней позиции аорты (как бы «сидит верхом» на обоих желудочках);
- стенозирования или полного заращения легочной артерии, она удлиняется и сужается за счет поворота дуги аорты;
- выраженной правожелудочковой гипертрофии миокарда.
Среди сочетаний пороков со стенозом легочной артерии и дефектами перегородок имеется еще 2 формы, описанные тоже Фалло.
Триада состоит из:
- отверстия в межпредсердной перегородке;
- стеноза легочной артерии;
- правожелудочковой гипертрофии.
Пентада — к первому варианту добавляет нарушенную целостность межпредсердной перегородки.
В большинстве случаев аорта получает большой объем крови из правых отделов сердца без достаточной концентрации кислорода. Гипоксия формируется по циркуляторному типу. Синюшность выявляется у новорожденного ребенка или в первые годы жизни малыша.
В результате сужается воронка правого желудочка, над ним образуется полость, похожая на дополнительный третий желудочек. Повышенная нагрузка на правый желудочек способствует его гипертрофии до толщины левого.
Единственным компенсаторным механизмом в этой ситуации можно считать появление значительной коллатеральной (вспомогательной) сети вен и артерий, подающих кровь в легкие. Открытый боталлов проток временно поддерживает и улучшает гемодинамику.
Для тетрады Фалло типично сочетание с другими аномалиями развития:
- незаращением боталлова протока;
- добавочной верхней полой веной;
- дополнительными венечными артериями;
- синдромом Денди Уокера (гидроцефалия и недоразвитие мозжечка);
- у ¼ пациентов сохраняется эмбриональная правая дуга аорты (болезнь Корвизара);
- врожденной карликовостью и олигофренией детей (синдром Корнелии де Ланге);
- пороками внутренних органов.
Рекомендации протезирования клапана легочной артерии
Рекомендации Американской ассоциации сердца (2008 г.)
Протезирование клапана легочной артерии следует проводить при тяжелой легочной регургитации и при появлении клинических симптомов или сниженой толерантности к физическим нагрузкам (класс I, уровень доказательности B).
Протезирование клапана легочной артерии нужно проводить при отсутствии симптомов в одном из следующих случаев (класс IIa, уровень доказательности B/C):
— от умеренной до тяжелой степени дисфункции правого желудочка.
— от умеренной до тяжелой степени дилатации правого желудочка.
— развитие предсердной или желудочковой аритмии.
— от умеренной до тяжелой степени трикуспидальной регургитации.
Протезирование клапана легочной артерии при обструкции пути оттока из правого желудочка необходимо проводить в следующих случаях (класс IIa, уровень доказательности C):
— пиковый градиент давления по данным ЭхоКГ >50 мм рт.ст.
— давление в правом желудочке более 0,7 давления в левом желудочке.
— прогрессирующая или тяжелая дилатация правого желудочка.
Рекомендации Канадской ассоциации сердца (2009 г.)
Легочная регургитация, вызывающая тяжелую дилатацию правого желудочка (КДО правого желудочка >170 мл/м2) (класс IIa, уровень доказательности C).
Умеренная или тяжелая дисфункция правого желудочка (класс IIa, уровень доказательности C).
Трикуспидальная регургитация, аритмии или симптомы, связанные со снижением толерантности к физической нагрузке (класс IIa, уровень доказательности C).
Остаточный стеноз легочной артерии с давлением не менее 2/3 системного (класс IIa, уровень доказательности C).
Европейские рекомендации (2010 г.)
Протезирование клапана легочной артерии следует выполнять при наличии симптомов у пациентов с тяжелой легочной регургитацией или стенозом легочной артерии (систолическое давление в правом желудочке >60 мм рт.ст. и скорость трикуспидальной регургитации >3,5 м/с) (класс I, уровень доказательности C).
Протезирование клапана легочной артерии при отсутствии симптомов у пациентов нужно рассматривать в одном из следующих случаев (класс IIa, уровень доказательности C):
— объективное снижение толерантности к физической нагрузке.
— прогрессирующая дилатация правого желудочка.
— прогрессирующая систолическая дисфункция правого желудочка.
— прогрессирующая трикуспидальная регургитация (умеренная или тяжелая).
— обструкция выходного тракта правого желудочка, систолическое давление в правом желудочке >80 мм рт.ст. и скорость трикуспидальной регургитации >4,3 м/с).
— устойчивые предсердные или желудочковые аритмии
Хирургическое лечение
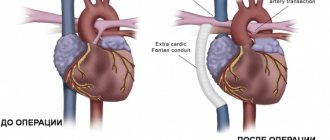
Вопрос выбора оптимального кондуита для реконструкции выводного тракта правого желудочка по-прежнему остается открытым. Среди всего многообразия имеющихся в наличии кондуитов нет ни одного кондуита, отвечающего параметрам идеального протеза. Подвергаясь агрессивному воздействию окружающих тканей, в результате дегенеративных процессов кондуит со временем теряет свои исходные свойства, его функция нарушается [35].
Легочный гомографт является «золотым стандартом» в реконструкции выводного тракта правого желудочка, однако ранняя кальцификация графта, высокая стоимость и ограничение в размерах кондуита заставляли искать альтернативу [36]. Для решения этой проблемы в 1999 г. был разработан ксенокондуит из яремной вены быка Contegra, приобретенный в 2001 г. . За последнее десятилетие ксенокондуит Contegra широко применялся многими хирургами во всем мире благодаря наличию спектра размеров от 12 до 22 мм, относительно низкой стоимости, а также низкой частоте кальцификации [37]. T. Breymann и соавт. [38] сообщают о низкой частоте реопераций у пациентов с Contegra в отличие от пациентов с имплантированными гомографтами после 4 лет наблюдения. J. Brown и соавт. [40] описали отличные ранние и среднесрочные результаты реконструкции выходного отдела правого желудочка ксенокондуитом Contegra. Авторы рекомендуют использовать Contegra как кондуит выбора при операциях формирования пути оттока из правого желудочка [37—39].
Несмотря на обнадеживающие первичные результаты, многие центры отметили частые дистальные стенозы ксенокондуита. B. Meyns и соавт. [41] наблюдали у 51% пациентов с ксенокондуитом Contegra выраженные дистальные стенозы через 2 года после операции. V. Gober и соавт. [42] сообщают о суправальвулярных стенозах, которые потребовали повторных вмешательств у 15,8% у пациентов с Contegra со средней продолжительностью наблюдения 18 мес. В метаанализе [42] и ряде других работ [43, 44] было отмечено, что наиболее частой причиной дисфункций кондуита, развивающихся в течение первого года после операции, является стеноз дистального анастомоза, обусловленный гиперплазией псевдоинтимы. Это осложнение развивается тем чаще, чем младше возраст пациента и меньше диаметр кондуита [45]. Кроме того, помимо стенозов кондуитов, некоторые центры описывают аневризмы ксенокондуита, тромбозы и эндокардиты [26, 45].
Еще один тип кондуита, который используется в хирургии выходного отдела правого желудочка, это дакроновые графты со встроенными биологическими клапанами. Главным преимуществом таких кондуитов является полная комплектация всех размеров и относительно невысокая цена. A. Corno и соавт. [46] считают, что недостатками таких графтов являются частые стенозы за счет разрастания псевдоинтимы и кальциноза створок биологического клапана. В раннем послеоперационном периоде в этих кондуитах могут отмечаться тромбозы более часто, чем в гомографте или Contegra, из-за особенностей строения стенки, поэтому таким пациентам антикоагулянтная терапия должна подбираться более тщательно. Несмотря на эти данные, E. Belli и соавт. [47] отмечают отсутствие необходимости реопераций при использовании Hancock до 98% в течение 1 года и 81% в течение 5 лет. Основной причиной развития стенозов кондуита авторы называют разрастание псевдоинтимы. K. Vitanova и соавт. [36], сравнивая Hancock, Contegra и гомографты, выявили, что стеноз через 5 лет отсутствовал у 69,1±7,9% больных для Hancock, 75,1±9,1% для Contegra и 85,4±5,6% для гомографтов. Недостаточность клапана кондуита составила 91,7±4% для гомографтов, 74,6±9,1% для Contegra и 86,9±7,4% для Hancock в течение 5 лет. Единственным фактором риска дисфункции кондуита авторы называют гетеротопическую позицию графта. В заключение авторы отмечают, что сроки репротезирования кондуитов Contegra, Hancock и гомографтов сравнимы между собой.
Транскатетерные вмешательства
С момента первой процедуры в 2000 г. чрескожное транскатетерное протезирование клапана легочной артерии получило широкое распространение в качестве миниинвазивной альтернативы у пациентов после радикальной коррекции тетрады Фалло [48]. В настоящее время наиболее применяемые транскатетерные клапаны имеют ряд недостатков, таких как перелом стента, ограниченные размеры и невозможность установки системы в нативный путь оттока, это послужило стимулом для производства новых устройств с большей линейкой размеров и более прочной конструкцией стента. В табл. 2 приведены характеристики клапанов, которые тестируются или уже доступны на рынке.
Таблица 2. Характеристики транскатетерных клапанов легочной артерии
Исследования, проведенные после установки транскатетерных клапанов, показывают хорошие краткосрочные и среднесрочные результаты [7]. S. Virk и соавт. [49] в своем исследовании показали, что после имплантации транскатетерных клапанов повышается толерантность к физическим нагрузкам и происходит восстановление функций правого желудочка, а процедура сопровождается низким уровнем осложнений. В настоящее время нет исследований, сравнивающих транскатетерные технологии и кондуиты для протезирования пути оттока из правого желудочка; при этом функциональное состояние правого желудочка, по данным МРТ, кажется сопоставимым [50, 51]. При большом количестве положительных качеств транскатетерных технологий существует один важный нерешенный вопрос — инфекционный эндокардит после установки клапана. Впервые это было отмечено в обзоре J. Buber и соавт. [52], в котором из 155 пациентов у 5 был выявлен инфекционный эндокардит. Более поздние исследования показали, что развитие эндокардита при транскатетерном вмешательстве составляет 10—15% по сравнению с открытым хирургическим вмешательством, после которого частота инфекционного эндокардита не превышает 2% [53, 54]. Основными факторами риска авторы называют диспозицию стента, обструкцию пути оттока из правого желудочка и резкое прекращение приема аспирина [54].
Еще одним нерешенным вопросом в транскатетерной хирургии являются сроки имплантации клапана. Исторически сложилось, что главная цель повторного вмешательства после радикальной коррекции тетрады Фалло — избежать дисфункции или дилатации правого желудочка (при позднем вмешательства) и необходимости повторных хирургических вмешательств (при раннем вмешательстве). В настоящее время показания к эндоваскулярному протезированию клапана легочной артерии такие же, как и к открытому хирургическому вмешательству. Однако некоторые авторы рекомендуют выполнять операцию в более раннем периоде, не дожидаясь развития клинических симптомов. Они устанавливают клапан максимально допустимого для пациента размера, понимая, что при его дисфункции возможно избежать открытой операции и имплантировать клапанный протез с помощью транскатетерной методики «клапан в клапан» [7, 54, 55].
Таким образом, современные методы и технологии кардиохирургических вмешательств предоставляют широкий спектр параметров для предупреждения и коррекции развившейся дисфункции правого желудочка у пациентов после радикальной коррекции тетрады Фалло. Стремительное распространение и развитие транскатетерной хирургии позволяет достичь удовлетворительных непосредственных и среднесрочных результатов, сравнимых с таковыми после повторных открытых вмешательств, подвергая пациентов меньшему риску. При этом в настоящее время дискутабельными остаются вопросы о четких критериях и сроках повторного вмешательства. Возможно, более широкое внедрение в повседневную практику МРТ-методов диагностики сердца и тщательное наблюдение пациентов в отдаленном послеоперационном периоде позволят своевременно выявлять нарушение функции правого желудочка на раннем этапе и определять точные рамки необходимого вмешательства.
Причины
Причинами аномалии считаются воздействия на плод в ранние сроки беременности (со второй по восьмую неделю):
- инфекционные заболевания будущей матери (краснуха, корь, грипп, скарлатина);
- прием алкоголя или наркотиков;
- лечение гормональными препаратами, седативными и снотворными лекарствами;
- токсическое действие никотина;
- интоксикация промышленными ядовитыми веществами на вредных производствах;
- возможна наследственная предрасположенность.
Применение ядохимикатов в саду и огороде без защиты органов дыхания влияет не только на здоровье женщины, но и на ее потомство
Важно то, что на малом сроке женщина может не заметить беременность и самостоятельно спровоцировать патологию плода.
Разновидности тетрады Фалло
Принято различать 4 типа тетрады Фалло по особенностям анатомических изменений.
- Эмбриологический — сужение вызвано смещением перегородки кпереди влево и низкой локализацией. Максимальное стенозирование совпадает с уровнем анатомического разграничительного мышечного кольца. При этом структуры легочного клапана практически не изменены, возможна умеренная гипоплазия.
- Гипертрофический — к механизму предыдущего типа добавляется выраженная гипертрофия зоны выхода из правого желудочка и разделительного мышечного кольца.
- Тубулярный — обструкция обусловлена неправильным делением в эмбриональном периоде общего артериального ствола, из-за чего легочный конус (будущее легочной артерии) оказывается недоразвитым, суженным и коротким. Одновременно возможно изменение клапанного аппарата.
- Многокомпонентный — в формировании участвуют частично все перечисленные факторы.
Введение
Тетрада Фалло относится к группе часто встречающихся врожденных пороков сердца, частота у новорожденных и младенцев этого порока составляет 5,6—14% случаев [1—3]. Естественное течение при этом неблагоприятное, поэтому хирургическое лечение пациентам выполняют в младенчестве. При значительном улучшении непосредственных результатов хирургического лечения тетрады Фалло отдаленные результаты по-прежнему нельзя назвать удовлетворительными [4, 5]. Основная причина осложненного течения отдаленного периода — дисфункция правого желудочка из-за длительно существующей выраженной легочной регургитации [6]. В настоящее время актуальной темой дискуссий, посвященных врожденным порокам сердца, является адекватная стратегия хирургического лечения дисфункции правого желудочка [7]. На протяжении многих лет единственным способом лечения дисфункции правого желудочка было формирование пути оттока из правого желудочка ксено- или гомографтом, однако с развитием эндоваскулярной хирургии появились транскатетерные технологии, которые служат альтернативным способом лечения. В этой статье рассмотрены текущие проблемы и подходы к лечению дисфункции выходного отдела правого желудочка после радикальной коррекции тетрады Фалло.
Данные EACTS, ECHSA и STS Congenital Database
В 2012 г. в EJCTS впервые опубликованы данные European Congenital Database. В исследование включены 6654 пациента, оперированных по поводу тетрады Фалло в период с 1999 по 2011 г. В исследовании участвовало 119 центров, 27 из которых были за пределами Европы. В 57,5% наблюдений выполнена трансаннулярная пластика, в 19,7% — радикальная коррекция без трансаннулярной пластики, но с применением вентрикулотомии, в 18,2% — трансатриальная — транспульмональная коррекция без вентрикулотомии. Таким образом, частота вентрикулотомии при радикальной коррекции тетрады Фалло составила 77%, общая госпитальная летальность — 2,58%. В исследовании показано, что после трансаннулярной пластики риск осложнений течения раннего и отдаленного послеоперационного периода достоверно больше, чем после использования других видов реконструкции [8]. Аналогичные данные получены и при анализе STS Database. Частота вентрикулотомии составила 52% при госпитальной летальности 1,3% и высокой частоте осложнений в отдаленном периоде [9].
В заключении настоящего анализа авторы отмечают очевидную неясность оптимальной и общепринятой стратегии хирургического лечения тетрады Фалло и необходимость проведения дальнейших современных исследований [9].
Современная стратегия хирургического лечения тетрады Фалло
Современная концепция хирургического лечения тетрады Фалло преследует цель минимизировать неврологические проблемы частоты вентрикулотомии и реопераций, показателя периоперационной летальности и тяжести течения послеоперационного периода [10]. Кроме того, в отдаленные сроки эта концепция должна способствовать минимизации ввраженности в первую очередь недостаточности клапана легочной артерии и дисфункции правого желудочка и аритмии.
В настоящее время такой подход становится все более популярным, многие крупные центры приняли и разрабатывают эту стратегию [11—13]. Преимущества данного подхода заключаются в сохранении собственных структур правого желудочка, снижении легочной регургитации и правожелудочковой дисфункции [11]. Как правило, Z score легочного кольца более –3 позволяет практически у всех пациентов выполнить радикальную коррекцию такого типа без каких-либо существенных проблем [11, 12]. Довольно узкое сохраненное кольцо может способствовать увеличению остаточного градиента [11], однако в некоторых исследованиях до 30% пациентов имели отношение RV/LV более 0,7 (0,7—0,9) без увеличения летальности, и это практически не влияло на тяжесть послеоперационного периода [14]. Во многих исследованиях отмечался факт снижения динамической обструкции пути оттока из правого желудочка после операции, в том числе за счет роста и развития исходно узкого клапанного кольца легочной артерии. Существуют свидетельства и того, что такой подход не влияет на частоту реопераций, не превышающей 5% [11].
Современные работы, посвященные оценке стратегии сохранения нативного пути оттока из правого желудочка, единичны, ближайшие результаты очень оптимистичны, отдаленные результаты практически не изучены, поэтому данное направление является наиболее актуальным и перспективным для изучения в хирургическом лечении тетрады Фалло.
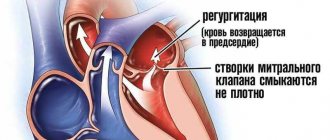
Дисфункция клапана легочной артерии
Хирургическое лечение тетрады Фалло направлено на закрытие дефекта межжелудочковой перегородки и устранение обструкции пути оттока из правого желудочка. При наличии выраженной гипоплазии кольца клапана легочной артерии требуется выполнение массивной инфундибулэктомии и трансаннулярной пластики, которая приводит к развитию выраженной легочной регургитации [15]. Последняя ведет к хронической объемной перегрузке правого желудочка, приводящей к прогрессирующей дилатации и дисфункции правого желудочка [6, 7, 15, 16]. Со временем у пациентов снижается толерантность к физической нагрузке, развиваются предсердные и желудочковые аритмии, а также появляется высокий риск внезапной сердечной смерти в течение 3—4 десятков жизни [17].
В случае коррекции тетрады Фалло с аномалиями коронарных артерий, ветви которых пересекают выходной отдел правого желудочка, единственной доступной опцией является имплантация кондуита. С течением времени происходит деформация и стеноз кондуита, который вследствие перегрузки давлением приводит к концентрической гипертрофии правого желудочка, повышению диастолического давления в его полости и повышению давления в правом предсердии [7]. Перегрузка давлением и гипертрофия правого желудочка — это факторы риска неблагоприятного исхода, включая устойчивую желудочковую тахикардию и случаи внезапной сердечной смерти в отдаленном периоде после радикальной коррекции тетрады Фалло [18].
Сроки имплантации клапана легочной артерии
В настоящее время существует большое количество публикаций, в которых отмечается связь дилатации и дисфункции правого желудочка в отдаленном периоде с выраженной легочной регургитацией [6, 7, 15, 16, 19] (см. рисунок). Особое внимание уделяют оптимальным срокам лечения легочной регургитации. Хирургическое лечение показано пациентам, имеющим клинические симптомы, в то время как относительно бессимптомного течения процессов в общепринятой тактике не наблюдается. Сторонники ранней коррекции опираются на патогенетическое влияние остаточной регургитации системных клапанов на желудочки сердца. Опыт изучения механизма воздействия хронической аортальной недостаточности на левый желудочек показывает, что после компенсаторной фазы, которая длится в течение многих лет, наступает фаза декомпенсации — развиваются необратимые изменения миокарда, характеризующиеся его дисфункцией и даже образованием рубцов. С учетом этого лечение хронической недостаточности клапана легочной артерии следует проводить в ранние сроки, до развития необратимых изменений миокарда на клеточном уровне.
Исходы массивной легочной регургитации.
Дисфункция правого желудочка
J. Therrien и соавт. [20] ввели понятие «слишком поздняя операция» для восстановления или поддержания нормальной сократимости правого желудочка, функция которого ухудшилась на фоне массивной легочной регургитации. Эти данные подтверждены в недавно проведенном метаанализе Ferraz Cavalcanti и соавт. [21], показавших отсутствие увеличения фракции выброса правого желудочка после коррекции легочной регургитации. T. Geva и соавт. [22] также считают, что фракция выброса правого желудочка менее 45% является основным предиктором развития постоянной дисфункции правого желудочка в отдаленном послеоперационном периоде. Тем не менее имеются исследования, в которых указывается на увеличение фракции выброса после устранения легочной регургитации [23]. В настоящее время доказано, что правожелудочковая недостаточность опосредованно влияет на функцию левого желудочка и риск возникновения внезапной сердечной смерти. Большое проспективное многоцентровое исследование, в котором у 873 пациентов выполнялось МРТ-исследование сердца для оценки функции правого желудочка, показало, что дисфункция правого желудочка является предиктором внезапной сердечной смерти, устойчивой желудочковой тахикардии в сочетании с дисфункцией левого желудочка, мерцательной аритмии и гипертрофии правого желудочка [18]. В связи с этим оперативное лечение должно проводиться до развития дисфункции правого желудочка.
Ремоделирование правого желудочка
Одна из важных тем в последнее десятилетие — долгосрочное сохранение функции правого желудочка и выявление ранних предикторов ремоделирования правого желудочка. С развитием МРТ-технологий появилась возможность определения точной анатомии правого желудочка и его функции. МРТ-технологии помогли выявить пороговые значения размера правого желудочка, при которых коррекция легочной регургитации приведет к обратному ремоделированию правого желудочка и восстановлению его функции. J. Therrien и соавт. предложили в качестве пороговых значений индекс конечного диастолического объема (КДО) правого желудочка 170 мл/м2 или индекс конечного систолического объема (КСО) 85 мл/м2, однако в дальнейшем исследователи предлагали меньшие значения этих показателей, склоняясь к более раннему хирургическому вмешательству (табл. 1) [23—25]. В последнее время большее внимание уделяется конечному систолическому объему как более чувствительному маркеру сохранения функции и ремоделирования правого желудочка [26].
Таблица 1. Эволюция пороговых значений размера правого желудочка для коррекции остаточной легочной регургитации при тетраде Фалло
Показания к протезированию клапана легочной артерии
В дополнение к приведенным ранее параметрам правого желудочка — КДО, КСО и фракция выброса — нужно ориентироваться на следующие факторы: соотношение КДО правого желудочка должно превышать в 2 раза КДО левого желудочка, фракция выброса левого желудочка менее 55%, аневризма пути оттока из правого желудочка, QRS более 160 м/с, устойчивая тахиаритмия [30].
При стенозе клапана легочной артерии показанием к оперативному лечению является повышение давления в правом желудочке, превышающее 2/3 системного давления [31]. Оперативное лечение следует начинать с баллонной дилатации клапана и лишь при неудачной вальвулопластике выполнять открытое хирургическое вмешательство [31].
При комбинированном поражении клапана легочной артерии показания к операции до сих пор являются дискутабельной темой. Большинство авторов рекомендуют выполнять операцию при появлении симптоматики доминирующего поражения легочного клапана [31, 32]. Однако Y. Kim и E. Ruckdesche [7[ советуют использовать индивидуальный подход к каждому пациенту, объясняя это более ранней дисфункцией правого желудочка при комбинированном поражении.
Особенности гемодинамики
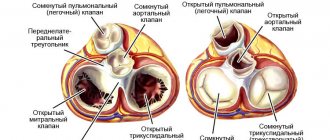
Тяжесть порока обусловлена степенью сужения диаметра легочной артерии. Для диагностики и определения тактики лечения важно выделение трех типов аномалии:
- с полным заращением (атрезией) просвета артерии: наиболее тяжелое нарушение, при большом межжелудочковом отверстии смешанная кровь обоих желудочков направляется преимущественно в аорту, кислородная недостаточность ярко выражена, в случае полной атрезии кровь в легкие поступает по открытому артериальному протоку или по коллатеральным сосудам;
- ацианотичная форма: при умеренном стенозе препятствие на пути кровотока из правого желудочка может быть преодолено более низким давлением, чем в аорте, тогда сброс крови пойдет благоприятным путем из артерии в вену, вариант порока называют «белым», поскольку не образуется цианоз кожи;
- цианотичная форма при стенозе различной степени: вызвана прогрессированием обструкции, сбросом крови справа налево; это вызывает переход от «белой» формы к «синей».
Морфология и нарушения гемодинамики при тетраде Фалло
Она включает 4 анатомических компонента:
- Декстрапозиция аорты (правопозиция) – аорта частично отходит от правого желудочка, но с поддержанием кровотока в ней доминантно из левого желудочка.
- Гипертрофия правого желудочка – она развивается с возрастом.
- Сужение легочного ствола.
- Дефект межжелудочковой перегородки – большой и нерестриктивный дефект, через который сообщаются правый и левый желудочки с нарушением гемодинамики.
Нарушения гемодинамики при пороке Фалло обусловлены тем, что кровь из правого желудочка (венозная) по время его систолы в недостаточном количестве и с трудом попадает в легочный ствол, после чего возникает недостаток объема циркулирующей крови в малом кругу кровообращения. В то же время большая часть той самой венозной крови через дефект в межжелудочковой перегородке попадает в левый желудочек, а затем и аорту, смешивается с артериальной кровью, обусловливаяпоявление цианоза кожи.
Симптомы
Клиническая картина проявляется:
- значительным цианозом — расположен вокруг губ, в верхней половине тела, усиливается при плаче ребенка, кормлении, натуживании;
- одышкой — носит приступообразный характер, связанный с физической нагрузкой, ребенок принимает наиболее удобную позу «на корточках», объясняется временным рефлекторным дополнительным спазмом легочной артерии и прекращением насыщения крови кислородом в 2 раза;
- пальцами в форме «барабанных палочек»;
- физическим недоразвитием и слабостью детей; бег, подвижные игры вызывают повышенную усталость, головокружение;
- судорогами — связаны с гипоксией мозговых структур, сгущением крови, склонностью к тромбозам сосудов мозга.
Форма болезни зависит от возраста ребенка, а он определяет достаточность компенсации, у новорожденного цианоз виден на лице, руках и стопах
Различают:
- ранние проявления в виде цианоза сразу после рождения или в первые 12 месяцев жизни;
- классическим течением считается проявление цианоза в двух-трехлетнем возрасте;
- тяжелую форму — приступообразная клиника с одышкой и цианозом;
- позднюю — цианоз появляется только к 6 или 10 годам;
- ацианотичную форму.
Приступ одышки может возникнуть в покое: ребенок становится беспокойным, усиливается цианоз и одышка, повышается частота сердцебиений, возможна потеря сознания с судорогами и последующими очаговыми проявлениями в виде неполного паралича конечностей.
Степени острой сердечной недостаточности:
I степень — отмечается цианоз слизистых (исчезает после кислородотерапии), глухость сердечных тонов, расширение границ сердечной тупости. Частота сердечных сокращений на 20-30 % выше нормы, одышка на 30-50 % больше нормы,
II степень — характеризуется выраженным цианозом слизистых, акроцианозом, периорбитальными отёками, глухостью сердечных тонов, расширением границ сердца, увеличением печени на 2-3 см. ЧСС возрастает на 30-50 %, ЧД – на 50-70 %. Отмечаются проявления застойных явлений в малом круге кровообращения, на фоне олигоурии развитие периферических отёков.
III степень — продолжает нарастать симптоматика, сопровождающаяся тахикардией (увеличение ЧСС на 50-60 %), тахипноэ (ЧД – на 70-100 % и выше), развивается клиническая картина предотёка лёгких. В терминальном периоде развивается брадикардия, брадипноэ, мышечная гипотония, арефлексия, АД снижается.
Неотложная помощь при острой левожелудочковой недостаточности:
- придать больному возвышенное положение, полусидя с опущенными ногами; можно наложить венозные жгуты на нижние конечности на 15-20 мин.;
- обеспечить проходимость верхних дыхательных путей. На этапе ”скорой” помощи – ингаляция увлажнённого кислорода;
- ввести 1 % р-р фуросемида (лазикса) 0,1-0,2 мл/кг (1-2 мг/кг) в/мышечно или в/венно струйно. При отсутствии эффекта через 15-20 мин. – повторить введение препарата;
- при высоком или нормальном АД – глицерил тринитрат (нитроглицерин) по ½ (0,25 мг) – 1 таб. (0,5 мг) под язык детям старше 12 лет.
- при высоком АД и гиперкинетическом варианте миокардиальной недостаточности по прибытии бригады ”скорой помощи”:
- ввести глицерил тринитрат 2-5 мкг/кг в/венно;
- ввести 0,25% р-р дроперидола 0,1 мл/кг в/венно или в/мышечно;
- по показаниям однократное введение 2,5% р-ра бензогексония детям 1-3 лет в дозе 1-3 мг/кг, старше 3 лет – 0,5-1 мг/кг;
- при снижении АД – ввести 3 % раствор преднизолона 2-3 мг/кг (или гидрокортизона 5-15 мг/кг) в/венно струйно. При нарастании клиники отека легких – 4 % р-р допамина в/венно титрованно 3-6 мкг/кг/мин (дозировка подбирается индивидуально);
- при возбуждении ребенка – ввести 0,5 % р-р диазепама (седуксена) 0,02-0,05 мл/кг (0,1-0,3 мг/кг) в/мышечно;
- при выраженной брадикардии или выраженном бронхоспазме – ввести 2,4 % р-р аминофиллина 0,15 мл/кг (4 мг/кг) в/венно.
Госпитализация срочная в реанимационное отделение. Транспортировка больного осуществляется в положении полусидя, на фоне оксигенотерапии.
Диагностика
Диагноз ставится по наблюдению за ребенком и наличию объективных признаков. Учитываются сведения от родственников о развитии и активности, приступах с потерей сознания и цианозом.
При осмотре у детей обращает внимание цианотичность губ, измененная форма конечных фаланг пальцев рук. Редко формируется «сердечный горб».
Перкуторно границы сердца не изменены или расширены в обе стороны. При аускультации выслушивается слева от грудины в четвертом межреберье грубый систолический шум за счет прохождения потока крови сквозь отверстие в межжелудочковой перегородке. Лучше выслушивать пациента в положении лежа.
На рентгенограмме контуры сердечной тени напоминают «башмак», направленный влево
Из-за отсутствия дуги легочной артерии возникает втянутость в месте, где обычно расположены сосуды. Обедневшее легкое выглядит более прозрачным. Увеличения сердца до крупных размеров не бывает.
В общем анализе крови определяется адаптационная реакция на гипоксию в виде увеличения количества эритроцитов и роста гемоглобина.
Ультразвуковая диагностика с помощью обычного УЗИ-аппарата или допплерографического исследования позволяет точно определить изменения камер сердца, аномальное развитие сосудов, направление и величину кровотока.
На ЭКГ имеются признаки правосторонней гипертрофии сердца, возможна блокада правой ножки пучка Гиса, значительно отклонена вправо электрическая ось.
Зондирование полостей сердца с замером давления в камерах и сосудах проводят в специализированных клиниках при решении вопроса об оперативном лечении.
Реже может потребоваться коронарография, магниторезонансная томография.
В дифференциальной диагностике необходимо исключить ряд заболеваний:
- транспозиция легочной артерии вызывает с ростом ребенка значительное увеличение сердца;
- заращение на уровне трехстворчатого клапана способствует гипертрофии не правого, а левого желудочка;
- тетрада Эйзенменгера — порок, сопровождающийся не заращением, а расширением легочной артерии, ее пульсация и характерный рисунок легочных полей определяются на рентгеновском снимке;
- стеноз просвета легочной артерии не сопровождается картиной «башмака».
Атипичные формы помогает отличить допплерографическое заключение.
Лечение
Медикаментозная терапия пациента с тетрадой Фалло проводится только с целью подготовки к операции или в послеоперационном периоде. Единственная цель — поддержать миокард, профилактика возможных тромбозов после приступов и нарушенного коронарного и мозгового кровообращения.
Больному показаны:
- ингаляции кислородно-воздушной смеси через носовые катетеры или в кислородной палатке, новорожденных содержат в специальных реанимационных боксах для уменьшения гипоксии;
- внутривенно вводится раствор Реополиглюкина, Эуфиллин (при отсутствии тахикардии);
- в связи с тканевым ацидозом необходим раствор бикарбоната натрия.
Без хирургической помощи в лечении пациента не обойтись
Операции могут быть:
- экстренной мерой временной помощи;
- шунтирующего типа для сброса кровотока по новому руслу;
- радикальным выбором с коррекцией дефекта межжелудочковой перегородки и расположения аорты.
В виде экстренной помощи применяют создание искусственного соединения (анастомоза) между аортой и легочной артерией с помощью протеза.
Его применяют как первый этап оперативного вмешательства новорожденным и детям младшего возраста. Считается, что подобные действия позволяют подготовить ребенка и избежать осложнений при дальнейшем лечении, снизить риск до 5–7%.
Решать вопрос об окончательной плановой коррекции порока необходимо в возрасте до трех лет. Временные анастомозы могут накладываться между подключичной и легочной артериями.
Радикальная операция включает пластику выходного конуса правого желудочка, устранение отверстия в межжелудочковой перегородке, вальвулотомию (рассечение заросшего клапана легочной артерии). Проводится на открытом сердце, нуждается в применении аппарата искусственного кровообращения.
Первые дни после операции уже показывают улучшение гемодинамики
Хирургическое лечение тетрады Фалло у взрослых.
К.Б. Бабаджанов, Ф.Ф. Тураев, А.А. Джуманиязов, Н.Ш. Бахритдинов.
Республиканский специализированный центр хирургии им. акад. В. Вахидова, г. Ташкент, Узбекистан.
Тетрада Фалло (ТФ) является врожденным пороком сердца, с обедненным легочным кровотоком. Составляет 25–40 % от всей патологии сердечно-сосудистой системы и представляет одну из наиболее актуальных проблем современной кардиохирургии [1, 18, 20]. Больных с ТФ в основном оперируют в детском возрасте, однако примерно 17–20 % из них по различным причинам обращаются за хирургической помощью поздно [2, 16, 19]. По данным Европейского эпидемиологического журнала (1993), частота возникновения ТФ составляет 2,2 случая на 10 000 новорожденных. М. Norgaard в 1999 г. приводит цифру 0,1 случая на 1000 живорожденных. ТФ с большей частотой встречается у детей, родившихся с низким весом и меньшим гестационным возрастом при соотношении полов 2,5 с преимуществом в сторону мужского пола [18, 19]. До настоящего времени остаются спорными взгляды на возрастные ограничения в показаниях к хирургическому вмешательству, этапы и методы операции.
В 1888 г. Марсельский патологоанатом Etinne-Louis Arthur Fallot описал клиническую картину и патологическую анатомию врожденного порока сердца, для которого характерно сочетание четырех анатомических признаков: а) сужение легочной артерии (ЛА), б) дефект мембранозной части межжелудочковой перегородки (ДМЖП), в) смещение устья аорты в сторону правого желудочка (ПЖ), г) гипертрофия миокарда ПЖ [5, 15, 21].
Результаты морфологического изучения ТФ в Институте сердечно-сосудистой хирургии им. А.Н. Бакулева показали, что типичными анатомическими признаками порока являются: 1) смещение конусной перегородки кпереди и влево; 2) нарушение в развитии структур ПЖ; 3) наличие стеноза выходного отдела ПЖ, а также стеноза кольца и ствола ЛА; 4) нерестриктивный ДМЖП; 5) декстропозиция аорты, под которой следует понимать смещение устья по отношению к межжелудочковой перегородке и ротацию артериального конуса против часовой стрелки; 6) наличие митрально-аортального фиброзного контакта; 7) гипертрофия миокарда ПЖ [4].
Особенностью ТФ у взрослых больных (старше 16 лет по классификации А.Ф. Тур, 1988) из вышеуказанных анатомических признаков является большой подаортальный нерестриктивный ДМЖП, выраженная гипертрофия миокарда ПЖ [4, 19]. По данным J.K. Kirklin (1983), расположение предсердно-желудочкового пучка при ТФ у взрослых больных также имеет свои особенности, а именно: он располагается вдоль основания частично сформированной перепончатой части межжелудочковой перегородки [18, 19]. Проекция разветвления предсердно-желудочкового пучка на ножки приходится соответственно на наиболее низлежащую часть кпереди от конусной сосочковой мышцы, либо в месте прикрепления комиссуры между передней и перегородочной створками трехстворчатого клапана к гребню межжелудочковой перегородки. Знание этих ориентиров дает возможность хирургу избежать повреждения проводящей системы при пластике ДМЖП [18, 25]. У больных с ТФ развито коллатеральное кровообращение между большим и малым кругом кровообращения, которое особенно выражено у взрослых больных, что необходимо учитывать во время оперативного вмешательства [15, 18, 19].
Установлено, что у больных с ТФ гипертрофия миокарда ПЖ появляется уже с первого года жизни и в последующем нарастает, при этом у больных дошкольного возраста она связана с ускоренным ростом кардиомиоцитов на фоне продолжения дифференцировки, а у больных старше 16 лет – с гипертрофическим ростом уже зрелых дифференцированных кардиомиоцитов [2, 3, 5, 7].
Номенклатура порока складывается из топики стеноза ЛА, который может быть клапанным, подклапанным (инфундибулярным), надклапанным, смешанным, и его степени [4, 7, 22, 26]. При этом у взрослых превалирует инфундибулярный тип (86,6 %), что определяет хирургическую тактику у этих больных [17, 23, 24]. Степень стеноза варьирует в разных пределах. Так, соотношение диаметров аорты и легочного ствола в норме составляет 0,98–1,00, а при ТФ – 0,16– 0,70. Если диаметр легочного ствола составляет менее 60 % диаметра восходящей аорты, это свидетельствует о его гипоплазии [7, 26].
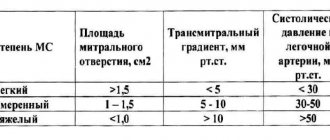
В зависимости от величины сброса через ДМЖП J. Kirklin делит больных с ТФ на три группы [18, 19]:
- 1-я группа (тяжелая форма порока) – больные, у которых объем право-левого шунта составляет 45 % и более минутного объема большого круга кровообращения;
- 2-я группа (умеренная форма порока) – больные с объемом шунта 25–45 %;
- 3-я группа (легкая форма порока) – объем шунта – 10–25 % большого круга.
Н.М. Амосов (1983) по степени тяжести порока выделяет 4 стадии [1]:
- умеренной тяжести – нет или почти нет цианоза в покое, умеренно ограничена физическая активность, дети редко присаживаются на корточки, содержание гемоглобина в крови не выше 10,5 ммоль/л (17 г%);
- средней тяжести – значительное ограничение физической активности, частая поза на корточках, цианоз, наличие ногтевых фаланг в форме «барабанных палочек», содержание гемоглобина в крови в пределах 10,5–12,4 ммоль/л (17–20 г%);
- тяжелая – ограничение возможности передвижения, выраженный цианоз, частые одышечно-цианотические приступы (ОЦП), содержание гемоглобина в крови 12,4–14,3 ммоль/л (20–23 г%).
- крайней тяжести – ОЦП возникают при минимальной физической нагрузке, больные практически лишены возможности передвижения, резкий цианоз, содержание гемоглобина в крови выше 14,3 ммоль/л (23 г%), нередко отсутствует систолический шум.
Особенности внутрисердечной гемодинамики при ТФ у взрослых таковы, что желудочки функционируют в принципиально различных гемодинамических состояниях. ПЖ работает под постоянной перегрузкой давлением и с течением времени гипертрофируется. Левый желудочек (ЛЖ), напротив, работает в условиях волюметрической недогрузки, и его полость бывает малой [9, 11, 12]. Н.А. Белоконь (1991) считает, что функциональная недогруженность левых отделов сердца при ТФ является причиной относительной гипоплазии ЛЖ, которая отсутствует у взрослых больных с выраженным коллатеральным кровообращением. По этим коллатералям в малый круг кровообращения может поступать так много крови, что даже при атрезии устья ЛА больные имеют довольно умеренную степень цианоза [1, 19, 20, 24].
Клинические проявления ТФ у взрослого пациента зависят от степени выраженности двух анатомических дефектов: стеноза легочного ствола и ДМЖП [3, 18].
У 49,4 % детей с ТФ отмечают цианоз с рождения. По мере роста ребенка, увеличения его двигательной и эмоциональной активности, а также в связи с облитерацией артериального протока цианоз с течением времени у взрослых больных становится более выраженным (91,2 %) [18, 19, 23]. Резкий цианоз отмечается примерно в 14 % случаев. Часто при клиническом исследовании цианоз может и не диагностироваться. Это бывает у пациентов с так называемой бледной (ацианотичная, розовая) формой ТФ, когда легочный кровоток снижен до приемлемых величин. Однако в таких случаях аускультативно выявляется систолический шум на ЛА [3, 15].
У 40–81,5 % больных с ТФ в раннем детском возрасте периодически возникают ОЦП – эпизоды пароксизмального диспноэ с выраженным цианозом, который является патогномоничным признаком заболевания [3, 13]. Обычно они появляются в возрасте 2 мес, а затем могут исчезать (обычно с двух лет) вследствие развития коллатерального кровообращения. Особенно часто ОЦП бывают у взрослых больных [14, 16, 23]. Этиологическая причина приступов при ТФ неясна. Wario (1957) высказал предположение о происхождении приступов в связи со спазмом мышечных волокон на месте сужения выходного тракта ПЖ, из-за чего прекращается поступление крови в ЛА [5]. В последнее время исследователи склоняются к мнению, что это один из видов механо-кардиальных рефлексов из ПЖ. Плач, дефекация, кормление, жаркая погода, инфекция, катетеризация сердца, суправентрикулярная тахикардия могут играть роль триггерных механизмов [16, 17, 21].
Основными жалобами больных с ТФ являются одышка, слабость, головные боли, головокружение. Толерантность к физической нагрузке, как правило, снижена. Больные дети часто присаживаются на корточки, что приводит к увеличению общего периферического сопротивления и уменьшения право-левого шунта. Характерные изменения концевых фаланг пальцев конечностей или симптомы «часовых стекол» и «барабанных палочек» появляются в зависимости от степени гипоксемии в среднем на 1–2-м году жизни, а у взрослого контингента больных вышеуказанные изменения пальцев определяются почти у всех (99,8 %) [18, 19]. Типичными аускультативными признаками порока у взрослых больных являются низкоамплитудный первый тон, акцентированный второй тон, который представлен аортальным компонентом, и систолический шум большой амплитуды с эпицентром во 2–3-м межреберье слева у грудины. Интенсивность и продолжительность систолического шума находится в обратной зависимости от тяжести порока и выраженности стеноза ЛА [20, 21].
Помимо общепринятых клинических методов исследования, установить точный диагноз ТФ возможно только с помощью специальных методов исследования, основными из которых являются трансторакальная эхокардиография и катетеризация полостей сердца. Эхокардиография как неинвазивный метод исследования позволяет непосредственно определить величину смещения аорты, ДМЖП, степень легочного стеноза и гипертрофии ПЖ. Во время зондирования определяется нормальное или сниженное давление в ЛА, градиент систолического давления между ЛА и ПЖ, равное давление в обоих желудочках, сброс артериальной крови на уровне ПЖ, архитектоника легочного ствола и его ветвей. Использование метода ангиокардиографии позволило разработать ряд диагностико-прогностических критериев, позволяющих не просто поставить или подтвердить диагноз ТФ, но и определить оптимальную тактику лечения в каждой конкретной анатомической ситуации. S. Nakata для определения степени сужения ветвей легочного ствола стал вычислять индекс ЛА. Индекс представляет собой отношение суммы площадей поперечных сечений правой и левой ветви ЛА к площади поверхности тела. Согласно этим исследованиям, в норме индекс Nakata должен составлять (330±30) мм2/м2.
Наконец, визуализировать структуры сердца можно, прибегнув к методу магнитного резонанса, который в последние 15 лет приобрел большую популярность у кардиологов [6, 13]. Этот неинвазивный метод позволяет получать адекватную, а порой и уникальную информацию, по сравнению со ставшими рутинными эхоскопией и рентгенокардиоангиографией. Магниторезонансная томография позволяет выполнять точные измерения размеров ПЖ и особенно его выходного тракта, вычислять показатели диастолической функции ПЖ, определять массу миокарда, а также обеспечивает количественную оценку объема регургитации на клапане ЛА, что особенно важно для оценки результата радикальной коррекции порока в отдаленные сроки [6].
Все виды оперативных вмешательств при ТФ можно разделить на две большие группы: паллиативные и радикальные. Паллиативными операциями называют хирургические вмешательства, которые направлены на облегчение состояния больного и на устранение угрожающих жизни симптомов и состояний. К паллиативным операциям относится подключично-легочный анастомоз по Blalock–Taussing, дополненный другими оригинальными разработками. Так, в 1960 г. А.А. Вишневским выполнен анастомоз с помощью артериального лиофилизированного гомотрансплантата. В 1962 г. J. Klinner описал технику такого анастомоза тефлоновой трубкой, a de Leval в 1980 г. – протезом из политетрафторэтилена (Core-Тех). Другая часть разработок касалась поиска новых мест создания соединения между двумя кругами кровообращения. Основные из них: анастомоз по Potts между нисходящей грудной аортой и левой ветвью ЛА, анастомоз по Waterstone–Cooley между восходящей аортой и правой ветвью ЛА и анастомоз по Schumaher между восходящей аортой и правой ЛА с использованием сосудистого протеза.
Паллиативная операция показана у детей с тяжелыми, рецидивирующими приступами гиперцианоза; в случае, когда венечная артерия пересекает выводной тракт ПЖ (ВТПЖ), радикальная операция может быть отложена до достижения ребенком возраста, при котором возможно создание сообщения между ПЖ и легочным стволом; при гипоплазии ЛА; в случае, когда ассоциированные с ТФ пороки сердца препятствуют выполнению радикальной операции. Паллиативные операции позволяют больному пережить критический период [1, 2, 4, 19].
Применительно к ТФ таким путем можно рассматривать и двухэтапный метод лечения [4]. Системно-легочный анастомоз устраняет такие важные факторы риска, как гипоксемию, ОЦП, необходимость приема b-адреноблокаторов. Вследствие увеличения притока крови к левым отделам сердца происходит их адаптация к возросшей нагрузке. Повышение насыщения артериальной крови кислородом активизирует метаболизм. Все это существенно повышает шансы больного успешно перенести радикальную операцию.
Но по данным Pacifico (1990) и Ilbavi (1990), лучше предпринимать первичную радикальную коррекцию порока в раннем детском и грудном возрасте, так как метод одноэтапной коррекции дает возможность избежать дополнительного риска двух операций, возникновения ранних и поздних осложнений шунтирующих операций (тромбоз анастомоза, частичная или полная окклюзия ветви ЛА, развитие легочной гипертензии при гиперфункции анастомоза) [2, 16, 19]. Но при этом они отмечают позднюю обращаемость больных в 17–20 % случаях за хирургической помощью по различным причинам.
Методика радикальной операции у пациентов с ТФ была впервые предложена Lillehei в 1955 г. и соавторами. Она заключается в закрытии ДМЖП синтетической заплатой и устранении обструкции путей оттока из ПЖ. В последующем техника операции была усовершенствована J. Kirklin и стала называться классической, после устранения стеноза ВТПЖ стенка его не ушивалась, а подвергалась пластике заплатой подходящих размеров. У взрослых больных из-за выраженной инфундибулярной обструкции ВТПЖ во время оперативного вмешательства наиболее часто приходится делать продольный разрез ВТПЖ, что приводит к дополнительной травматизации сердца, удлинению времени искусственного кровообращения, а также в связи с выражено развитой коллатеральной сетью кровообращения возникают технические трудности с гемостазом [21, 22].
С целью улучшения техники устранения инфундибулярного стеноза используют заплаты из перикарда для пластики ВТПЖ [18, 19]. В 1963 г. был предложен трансатриальный доступ для радикальной коррекции ТФ [2, 12], который существенно снизил частоту осложнений и летальности у взрослых больных. Суть его заключалась в том, чтобы избежать выполнения вентрикулотомии, а значит, и травмы миокарда ПЖ. Эта методика предполагала закрытие межжелудочкового дефекта и резекцию гипертрофированного миокарда доступом через правое предсердие и правое атриовентрикулярное отверстие. Затем для большей радикальности инфундибулярной резекции было предложено сочетать чреспредсердный доступ с чрезлегочным [3]. Метод получил широкое распространение в ИССХ АМН Украины с 1995 г. (В.В. Лазоришинец и соавт.). Однако адекватное применение его возможно только у 30–40 % пациентов с ТФ.
По данным В.П. Подзолкова и соавторов (2004), у оперированных взрослых больных с ТФ хороший результат, по соотношению давления в ПЖ к давлению в ЛЖ менее 0,5, был получен в 57,6 % случаях, удовлетворительный (0,5–0,7) – в 32,6 % случаях. И лишь у 9,8 % пациентов был зарегистрирован плохой гемодинамический результат, то есть соотношение давления в ПЖ и аорте было более 0,7. На госпитальном этапе летальность по причине острой сердечной недостаточности, сепсиса, тромбоэмболии ЛА и тяжелых поражений головного мозга составила 8,3 %. В сроки от 1 до 18 лет было обследовано 74,4 % больных, которые подверглись радикальной коррекции ТФ в возрасте старше 18 лет. На основании данных обследования 58,9 % больных были отнесены к I функциональному классу, 34,4 % – ко II функциональному классу и 6,7 % – к III функциональному классу по классификации NYHA. Основными причинами неудовлетворительных результатов были: реканализация ДМЖП, высокий остаточный градиент ПЖ-ЛА (выше 60 мм рт. ст.) и низкая фракция выброса.
Анализ данных литературы свидетельствует о том, что до настоящего времени остаются спорными взгляды на возрастные ограничения в показаниях к хирургическому вмешательству, этапы и методы операции, а также об актуальности диагностики и хирургического лечения тетрады Фалло в возрасте старше 18 лет, а реабилитация взрослых, перенесших операцию, в отличие от детей, перерастает в сложную медико-социальную проблему.
Литература
- Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. – К., 1983. – С. 68-80.
- Амосов Н.Н., Зиньковский Н.Ф. Хирургическое лечение тетрады Фалло. – К.: Здоровье, 1982. – С. 151-158.
- Бураковский В.И., Бокерия Л.А. Сердечно-сосудистая хирургия. – 1996. – С. 167-188.
- Бураковский В.И., Бухарин В.А., Подзолков В.П., Плотникова Л.Р. Радикальное хирургическое лечение тетрады Фалло // Последние достижения хирургии на открытом сердце. – М., 1988. – С. 10-29.
- Вишневский А.А., Галанкин Н.К., Крымский Л.Д. Тетрада Фалло. – М., 1969.
- Дынник И.Б. Методы радиологической диагностики при тетраде Фалло // Вестник рентгенологии и радиологии. – 1989. – № 1. – С. 28-32.
- Егорова И.Ф. и др. Грудная и сердечно-сосудистая хирургия. – № 4. – 2001. – С. 9.
- Anderson R.H., Devine W.A., Del-Nido R. The Surgical anatomy of tetralogy of Fallot with pulmonary atresia rather than pulmonary stenosis see comments // J. Card. Surg. – 1991. – Vol. 6. – № l. – P. 41-58.
- Bastos P., Campos J., Cunha D. Left ventricular function after total correction of tetralogy of Fallot // Eur. Heart J. – 1991. – Vol. 12. – P. 1089-1097.
- Borow K.M., Green L.H., Castaneda A.R. et al. Left ventricular function after repair of tetralogy of Fallot and its relationship to age at surgery // Circulation. – 1990. – Vol. 61. – P. 1150-1158.
- Dubost Ch., Blondesu Ph., D Allaines С. et al. Results a long terme de la reparation complete de la tetralogie de Fallot Coeur. – 1977. – Vol. 8, № 3. – P. 697-707.
- Ergin M.A., Griepp B.B. Total correction of tetralogy of Fallot // J. Thorac. Cardiovasc. Surg. – 1979. – Vol. 77. – № 3. – P. 469-473.
- Fogelman R., Nykanen D., Smallhorn J. et al. // Circulation. – 1995. – Vol. 92. – P. 881-885.
- Gustafson R.A., Murray G.F., Warden H.E. et al. Early primary repair of tetralogy of Fallot // Ann. Thorac. Surg. – 1988. – Vol. 45. – P. 235-241.
- Hammon J.D., Henry C.I., Merril W.H. et al. Tetralogy of Fallot; selective surgical management can minimize operative mortality // Ann. Thorac. Surg. – 1985. – Vol. 40. – P. 280.
- Hu D.G., Seward J.B., Puga F.J. et al. Total correction of tetralogy of Fallot at age 40 years and older: long-term follow-up // J. Amer. Coll. Cardiology. – 1985. – Vol. 5. – P. 40-44.
- Hughes C.F., Lim Y.C., Cartmill T.B. et al. Total intracardiac repair for tetralogy of Fallot in adults // J. Thorac. Surg. – 1987. – Vol. 43, № 6. – P. 634-638.
- Kirklin J.K. Tetralogy of Fallot: Principles of surgical management // Mod. Probl. Paediat. – 1983. – Vol. 22. – P. 139-151.
- Kirklin J.W., Barratt-Boyes G.G. Cardiac Surgery. – N.-Y.: Wiley, 1986.
- Malm J.M., McMicholas K.W. Tetralogy of Fallot // J. Jap. Ass.Thorac.Surg. – 1980. – Vol. 28, № 4. – P. 493-505.
- Mattila S., Luosto R., Ketonen P. et al. Total correction of tetralogy of Fallot in adults // Scand. J. Thor. Cardiovasc. Surg. – 1984. – Vol. 12. – P. 654-663.
- Oelert H.R., Hetser J., Luhmer B. et al. Criteria for and against primary correction of Fallots tetralogy // J. Thorac. Cardiovasc. Surg. – 1984. – Vol. 32. – № 4. – P. 215-220.
- Pacifico A.D., Kirklin J.W., Blackstone E.H. Surgical management of pulmonary stenosis in tetralogy of Fallot // J. Thorac. Cardiovaac. Surg. – 1977. – Vol. 74, № 3. – P. 382-395.
- Presbitero P., Demarie D., Aruta E. et al. Results of total correction of tetralogy of Fallot performed in adults // Ann. Thor. Surg. – 1988. – Vol. 46, № 3. – P. 297-301.
- Rizzoli G.,Massucco A.,Bramana T. et al. The risk of surgical treatment of tetralogy of Fallot; an appoisal // Int. J. Cardiol. – 1985. – Vol. 9, № 1. – P. 7-22.
- Takauchi Y. The study on right to left ventricular peak systolic pressure ratio
Укркардіо