Формы стенокардии напряжения
ИБС стенокардия напряжения подразделяется на формы:
- Впервые возникшая. Диагноз выставляется, если от момента приступа прошло не более одного месяца. Течение заболевания протекает в двух вариантах – стенокардия регрессирует (исчезает) или переходит в стабильную стенокардию. Первые признаки патологии могут быть предвестниками инфаркта.
- ИБС стабильная стенокардия напряжения. Устойчивая форма заболевания с приступами, продолжающимися более одного месяца. Характеризуется появлением у пациента стереотипных симптомов на нагрузку одной силы.
- Прогрессирующая стенокардия напряжения. На ее развитие указывает усиление тяжести и увеличение продолжительности и частоты болевых приступов при воздействии на организм обычной нагрузки.
Стенокардия напряжения стадии или иначе функциональные классы (ФК):
- 1 (первый) ФК. Обычная нагрузка изменений в самочувствии не вызывает. Болевые приступы возникают на фоне чрезмерных нагрузок – после подъема на несколько пролетов лестницы, при быстрой ходьбе.
- Второй ФК. Физическая активность пациента ограничена. Спровоцировать приступ может ходьба на 500 и более метров, преодоление 1-2 пролетов лестницы, прогулка в ветреную погоду и при морозе, психоэмоциональное возбуждение.
- Третий ФК. Физическая активность пациента сведена к минимуму. Приступ появляется после ходьбы на расстояние от 100 метров, при преодолении одного лестничного пролета.
- Четвертый ФК. Физическая активность ограничена. Болевой приступ возникает и в покое.
Стенокардия напряжения ФК (функциональные классы) позволяет врачу верно определить объем физнагрузок и подобрать лекарства.
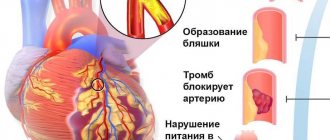
Суть и типология форм заболевания
Сердце, главная мышца организма, получает питание за счет поступления кислорода и полезных веществ через артерии. Суточная потребность может увеличиваться, если человек выполняет определенную физическую нагрузку. Соответственно, приток крови к главному органу увеличивается.
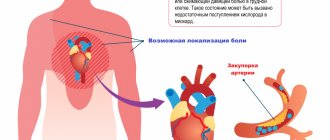
Коронарные и венечные артерии, которые «обслуживают» сердце, идут от аорты. Если они не в норме, кровоток нарушается. А это значит, что определенный отдел сердечной мышцы недополучит свой кислород и необходимые вещества для нормального функционирования.
Такая недостаточность называется ишемией. Если это состояние длится больше 30 минут, в сердце начинают гибнуть кардиомиоциты, что влечет за собой инфаркт миокарда. Патология может активизироваться при превышении допустимого уровня физической активности и сопровождаться болью.
Выделяют 4 функциональных класса заболевания (ФК). Основной критерий разграничения – тяжесть формы и допустимость физических нагрузок:
- ФК 1 – это сравнительно легкая степень болезни, при которой допускаются умеренные занятия спортом. Приступ возможен только в случае крайнего физического напряжения.
- ФК 2 предполагает ограничения физической активности. К этому классу относят пациентов, у которых приступ стенокардии начинается после пройденных 500 м или при подъеме на второй этаж по лестнице. Кроме того, больным не рекомендуются прогулки в холодную и ветреную погоду, активность сразу после пробуждения ото сна или эмоциональное перенапряжение. Все это также может спровоцировать ухудшение самочувствия.
- ФК 3 существенно ограничивает человека в плане физической активности. Приступ может спровоцировать ходьба со средней скоростью на 100-500 м и подъем по лестнице на пролет.
- ФК 4 – самая тяжелая форма. Это инвалидность, при которой приступы могут случаться даже при пребывании в спокойном состоянии.
Более всего среди сердечников распространена форма ФК 3, которая расценивается среди медиков как инвалидность. В совокупности с другими заболеваниями, например, тахикардией или аритмией, ИБС стенокардия напряжения может провоцировать приступы без видимых на то причин, когда больной пребывает в состоянии покоя.
Стоит также отметить, что пациенты с формой заболевания ФК 3, как правило, могут хорошо контролировать свои возможности. Они также способны предчувствовать приближения приступов. Это помогает заранее нейтрализовать их и свести интенсивность на нет.
Причины стенокардии напряжения
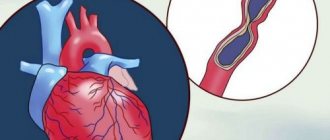
Одна из основных причин развития стенокардии напряжения – атеросклероз. Выделяют ряд факторов риска, под воздействием которых болезнь не только начинается, но и прогрессирует.
Неустранимые факторы стенокардии напряжения – генетическая предрасположенность, пол человека и его возраст. Примерно до 50-55 лет стенокардии напряжения больше подвержены мужчины. После наступления менопаузы у женщин, то есть после 50 лет, процентное соотношение пациентов разного пола выравнивается.
Устранимые факторы риска:
- Курение.
- Гиподинамия.
- Сахарный диабет. Заболевание невозможно победить до конца, но выполнение рекомендаций врача снижает его тяжесть и соответственно уменьшает вероятность изменений в сосудах.
- Артериальная гипертензия. Также как и с сахарным диабетом, контроль над течением болезни снижает риски развития осложнений.
- Ожирение.
- Психоэмоциональные стрессы.
- Высокий уровень холестерина.
Стабильная стенокардия напряжения: оценка прогноза и лечение
Наиболее частодиагностируемой формой ИБС является стабильная стенокардия. Стабильная стенокардия – клинический синдром, характеризующийся дискомфортом в груди, который возникает при физическом напряжении или эмоциональном стрессе. Приступ возникает при одном и том же уровне нагрузки и проходит в течение 1–5 мин. после ее прекращения.
Считается, что пациенты со стабильной стенокардией имеют относительно хороший прогноз. По данным клинических испытаний антиангинальной и профилактической терапии и/или реваскуляризации, частота ежегодной смертности составляет 1,2–2,4% в год [1–6], с ежегодным уровнем сердечной смерти 0,6–1,4% и нефатального инфаркта миокарда (ИМ) между 0,6% в исследовании RITA-2 (Second Randomized Intervention Treatment of Angina) [4] и 2,7% – в исследовании COURAGE (Clinical Outcomes Utilizing Revascularization and Aggressive Drug Evaluation) [1].
Однако индивидуальный прогноз конкретного больного стабильной стенокардией может значительно варьировать в зависимости от его основных клинических, функциональных и анатомических характеристик.
Это иллюстрируется данными регистра REACH (Reduction of Atherothrombosis for Continued Health) [7]: у пациентов высокого риска, с заболеванием периферических артерий, постинфарктным кардиосклерозом, сахарным диабетом (СД) ежегодная смертность составила 3,8%, тогда как у пациентов низкого риска – 0,63%.
Прогностическая оценка – важная часть диагностики при стабильной стенокардии. С одной стороны, необходимо идентифицировать пациентов с более серьезными формами болезни, у которых результат может быть улучшен при более агрессивном ведении, включая реваскуляризацию. С другой стороны, также важно выявлять пациентов с менее тяжелой формой болезни и хорошим прогнозом, таким образом избегая ненужных агрессивных тестов и процедуры реваскуляризации.
Прогноз определяется несколькими факторами:
1. коронарным резервом, т. е. возможностью адекватного увеличения коронарного кровотока при возрастании работы левого желудочка и количеством миокарда, получающего недостаточное кровоснабжение. В условиях энергетического голода сократительная способность миокарда может существенно снижаться, приводя к возникновению сердечной недостаточности при ишемии большой части левого желудочка или не очень большой, но оказывающейся достаточной для падения насосной функции, усугубляя имеющиеся нарушения сократимости вследствие предшествующего повреждения миокарда.
2. факторами риска, которые ускоряют прогрессирование атеросклероза и формирование нестабильных бляшек, ответственных за развитие нестабильной стенокардии и острые коронарные эксцессы, обусловленные внезапным разрывом атероматозной бляшки и не связанные с серьезностью ранее существовавшего стеноза.
Согласно рекомендациям ЕОК по диагностике и лечению стабильной стенокардии 2013 г., как только диагноз стабильной ИБС поставлен и оптимальная медикаментозная терапия (OMT) назначена, выполняется стратификация риска коронарных эксцессов, обычно на основе доступных неинвазивных тестов, чтобы выбрать пациентов, которые могут получить выгоду от реваскуляризации. В зависимости от серьезности симптомов ранняя коронарная ангиография может быть выполнена с соответствующим подтверждением значения стенозов и последующей реваскуляризацией, минуя неинвазивное тестирование. Реваскуляризация приносит явную прогностическую выгоду только пациентам высокого риска и практически отсутствует улучшение прогноза у тех, у кого он и так благоприятный.
Ранее, в рекомендациях ЕОК [8], годовой риск сердечной смерти более 2% считался порогом, за которым было рекомендовано выполнение реваскуляризации. В рекомендациях 2013 г. [9] произведена переоценка тяжести стенокардии, при которой хирургическое лечение улучшает прогноз в большей мере, чем медикаментозное, и пациентами высокого риска предложено считать лиц, имеющих вероятность сердечной смерти > 3% в год.
Дополнительные исследования показали, что как ишемия, так и анатомически-ориентированные индексы приводят к схожим заключениям при идентификации пациентов, имеющих «высокий риск эксцессов» только при медикаментозном лечении, у которых реваскуляризирующие процедуры приводят к улучшению прогноза.
Для неинвазивной оценки прогноза у пациентов с вероятной или установленной ИБС имеется несколько подходов, наиболее широкое распространение из которых получил подсчет баллов, предложенный D.B. Mark и соавт., он называется тредмил-индексом Университета Дюка (Duke tredmil score) (табл. 1). Авторами проанализированы исходы у 2842 лиц с вероятной или установленной ранее ИБС, которым тредмил-тест был проведен перед диагностической коронарографией. Баллы подсчитываются следующим образом:
тредмил-индекс Дюка = время нагрузки в минутах – 5 × величина отклонения ST в мм – 4 × индекс стенокардии (индекс стенокардии: 0 – стенокардии не было, 1 – стенокардия появилась, 2 – стенокардия явилась причиной прекращения теста).
Ориентировочная оценка риска развития инфаркта миокарда и летального исхода по тредмил-индексу Дюка (табл. 2) помогает выбрать дальнейшую тактику ведения пациентов:
- пациентам с низким риском последующее проведение стресс-визуализирующих методик и коронарографии считается нецелесообразным, им рекомендуется медикаментозное лечение;
- пациентам с высоким риском показана реваскуляризация;
- пациентам со средним риском целесообразно проведение стресс-визуализирующих методик (табл. 2), при этом нормальная или близкая к нормальной перфузия миокарда при нагрузке в сочетании с нормальными размерами сердца считается признаком благоприятного прогноза и этим пациентам рекомендуется медикаментозное лечение, а при наличии дисфункции левого желудочка – реваскуляризация [10, 11].
В рекомендациях ЕОК предложены некоторые изменения в тактике медикаментозного лечения стабильной стенокардии:
- профилактику приступов рекомендовано начинать с назначения b-блокаторов и/или блокаторов кальциевых каналов;
- в качестве препаратов второго ряда рекомендуется добавлять длительно действующие нитраты, ивабрадин, никорандил или ранолазин, в соответствии с ЧСС, АД и переносимостью препаратов;
- в качестве второй ступени лечения может быть рассмотрено также применение триметазидина;
- в соответствии с сопутствующей патологией/толерантностью у определенных пациентов возможно использование препаратов второго ряда как средств первого ряда;
- у асимптоматичных пациентов с большой зоной ишемии (>10%) в первую очередь должна быть рассмотрена возможность применения b-блокаторов.
β-адреноблокаторы (БАБ) – эффективные антиангинальные средства, которые устраняют симптомы, увеличивают переносимость нагрузок и сокращают потребление короткодействующих нитратов [12]. Они уменьшают потребность в кислороде, урежая ЧСС, снижая кровяное давление и сократимость миокарда. Перфузия ишемизированных областей улучшается за счет удлинения диастолы (т. е. времени перфузии) и устранения коронарного обкрадывания вследствие увеличения сосудистого сопротивления в неишемизированных областях.
Обычно используются β1-блокаторы, доказавшие высокую антиангинальную эффективность, – метопролол, атенолол и бисопролол. Чтобы достигнуть круглосуточного антиангинального эффекта, назначают β1–блокаторы с длинным периодом циркуляции в плазме (например, бисопролол) или лекарственные формы, обеспечивающие поддержание концентрации препарата в плазме (например, метопролол CR). Для поддержания равномерной концентрации в плазме атенолола (период полувыведения – 6–9 ч) оптимальным является двукратный ежедневный прием, но следует иметь в виду, что при увеличении дозы препарата возрастает и продолжительность β-блокирующего действия. На эффект БАБ при стабильной стенокардии можно рассчитывать лишь в том случае, если при их применении достигают отчетливого эффекта блокады β-адренорецепторов. Для этого необходимо поддерживать в состоянии покоя ЧСС в пределах 55–60 уд./мин. Более точно степень достигнутой блокады β-адренергических рецепторов может быть оценена пробой с нагрузкой [8].
Метаанализ, изучавший влияние различных БАБ на смертность, показал существенное сокращение смертности при длительном их применении после перенесенного инфаркта миокарда. На основании этих данных было предположено, что БАБ могут оказать кардиопротективное действие также и у пациентов со стабильной коронарной болезнью. Однако это не было доказано в плацебо-контролируемом испытании [13].
Большие исследования эффективности терапии БАБ при стабильной стенокардии – APIS [14] и TIBET [15] – не показали существенного отличия результатов между пациентами, лечившимися БАБ или блокаторами кальциевых каналов, нифедипином или верапамилом. Эти исследования подтвердили выгодные антиангинальные свойства β-блокатора, но не дали ответа, изменяет ли лечение прогноз пациентов со стабильной стенокардией.
В рекомендациях Европейского общества кардиологов БАБ (если нет противопоказаний) предлагаются в качестве средства первого ряда для лечения стабильной стенокардии [8, 9].
Блокаторы кальциевых каналов (БКК) – гетерогенный класс лекарств, которые расширяют коронарные и другие артерии путем блокирования притока Са через каналы L-типа. Антиангинальное действие БКК связано с уменьшением работы сердца вследствие системной вазодилатации, а также коронарной вазодилатации и противодействия вазоспазму [12].
При сравнении антиангинальной эффективности верапамила и метопролола при стабильной стенокардии получены схожие результаты [14]. Их сопоставление у пациентов с артериальной гипертензией (АГ) и ИБС показало у получавших верапамил меньшую частоту новых случаев СД, приступов стенокардии [16] и психической депрессии [17].
Неселективные или пульс-урежающие БКК (верапамил и дилтиазем) в некоторой степени снижают сократимость миокарда и атриовентрикулярную проводимость. Даже вазоселективные дигидропиридиновые БКК (нифедипин, амлодипин и фелодипин) могут вызвать некоторую кардиодепрессию, но этому противодействует рефлексогенная симпатическая активация сердца с легким увеличением ЧСС, которая спадает со временем.
БКК пролонгированного действия (например, амлодипин) или формы замедленного высвобождения БКК короткого действия (нифедипин, фелодипин, верапамил и дилтиазем) предпочтительны для минимизирования колебаний плазменной концентрации и сердечно-сосудистых эффектов.
В исследовании ACTION – крупном плацебо-контролируемом испытании нифедипина длительного действия при стабильной стенокардии – доказана его безопасность и способность снижать потребность в коронарной ангиографии и сердечно-сосудистых вмешательствах [18].
В исследовании CAMELOT у пациентов с ИБС и нормальным АД сравнение амлодипина с плацебо выявило значительное снижение частоты госпитализаций вследствие стенокардии, а также потребности в коронарной реваскуляризации в течение 2 лет наблюдения [19].
В исследовании CAPE [20] лечение амлодипином в сравнении с плацебо привело к умеренному, но значительно большему снижению ишемии при холтеровском мониторировании после 7 нед. лечения. Пациенты сообщали о большем уменьшении ангинозных атак (70 против 44%) и более явном снижении потребления нитроглицерина (67 против 22%) в течение 10 нед. лечения амлодипином по сравнению с плацебо. Профиль побочных эффектов амлодипина был благоприятным и в CAMELOT, и в CAPE.
Некоторые исследователи сообщают о более эффективном на фоне терапии амлодипином уменьшении выраженности ишемии, вызванной нагрузкой, чем β–блокатором атенололом, и о возрастании антиишемического эффекта при их комбинированном применении [21].
Нитраты – наиболее старые из всех антиангинальных препаратов, используются в клинической практике более 100 лет. Они уменьшают потребность миокарда в кислороде за счет системного расширения вен и артерий, которое снижает пред- и постнагрузку левого желудочка и таким образом уменьшает работу миокарда. Нитраты также действуют непосредственно на коронарное кровообращение.
EDRF (или NO) – важный вазодилататор, продуцируемый эндотелием. Нитраты метаболизируются в NO в эндотелиальных клетках, и они поставляют NO непосредственно сосудистым гладкомышечным клеткам. Несмотря на нарушение эндотелийзависимой вазодилатации при ИБС, нитраты эффективны в пораженных атеросклерозом коронарных артериях и увеличивают поток крови к ишемизированным областям миокарда.
Почти все пациенты со стенокардией нуждаются в короткодействующих нитратах. Для сублингвального приема обычно используются таблетки нитроглицерина (0,5–1 мг). Хорошим купирующим эффектом обладают аэрозольные формы нитратов (нитроглицерин и изосорбида динитрат). Раствор разбрызгивается в полости рта. Антиангинальный эффект наступает быстрее, чем при приеме таблеток под язык. Изосорбида динитрат оказывает более длительное (до 90 мин.), чем нитроглицерин (до 15 мин.), действие. Эти же препараты могут использоваться как профилактика стенокардии в течение ожидаемого краткосрочного физического или эмоционального напряжения. Развитие толерантности не является проблемой для короткодействующих нитратов [22].
В рекомендациях ЕОК 2013 г. нитраты пролонгированного действия отнесены к антиангинальным препаратам второго ряда [9].
Наибольшее распространение получили долгодействующие пероральные нитраты, содержащие или изосорбида динитрат (ИСДН), или изосорбида-5-мононитрат (ИСМН) – основной активный метаболит ИСДН.
Лекарственные формы ИСДН могут быть в виде обычных таблеток с естественным высвобождением препарата и таблеток с замедленным его высвобождением, обеспечивающих приблизительно на 30% большую продолжительность действия. Минимальная эффективная разовая доза ИСДН при приеме внутрь – 20 мг. С этой дозы обычно начинают лечение. При недостаточном терапевтическом эффекте целесообразно увеличивать разовую дозу ИСДН до 30–40 и даже 60 мг [23].
Хорошо известно, что больные могут по-разному реагировать на равные дозы одного и того же препарата. Тем не менее, индивидуальная чувствительность игнорируется, и препараты обычно назначаются шаблонно – по 1 таблетке 3–4 р./сут. Чтобы определить у конкретного больного возможность увеличения дозы нитратов, рекомендуется, измерив исходное систолическое АД, дать препарат и повторить измерение на пике проявления гемодинамического действия препарата (обычно через 1–2 ч). Если систолическое АД снижается на 15–20 мм рт. ст., то дальнейшее увеличение разовой дозы обычно не дает существенного увеличения антиангинального действия, а вероятность проявления побочных эффектов становится высокой [24]. Кратность приема препарата определяется длительностью его действия и продолжительностью временного интервала, на протяжении которого необходимо обеспечить повышение толерантности к нагрузке. С увеличением дозы ИСДН отмечается нарастание не только выраженности, но и длительности антиангинального действия. Антиангинальное действие после однократного приема 20 мг ИСДН составляет 5 ч, 40 мг – 6 –7 ч , 60 мг – 8–9 ч.
Изосорбида-5-мононитрат, содержащийся в таблетке с естественным высвобождением препарата (20 мг и 40 мг), после приема внутрь быстро и полностью всасывается из ЖКТ. Максимальная концентрация препарата в плазме крови достигается через 1 ч после приема. Продолжительность антиангинального действия – до 8 ч – обеспечивается свойствами самого действующего вещества.
Таблетки и капсулы с замедленным высвобождением препарата, содержащие обычно 50 мг изосорбида-5-мононитрата, обеспечивают двухфазное поступление препарата в кровоток: 30% дозы высвобождается быстро, а 70% – постепенно, обеспечивая длительное поддержание терапевтической концентрации препарата в крови. По антиангинальной эффективности эти препараты такие же, как формы с естественным высвобождением, содержащие 20 мг изосорбида-5-мононитрата, длительность же антиангинального эффекта возрастает до 16–24 ч [23, 24].
Все длительно действующие препараты изосорбида динитрата и изосорбида-5-мононитрата одинаково эффективны при применении в эквивалентных дозах.
Профилактическое применение нитратов в адекватных дозах существенно улучшает качество жизни у пациентов со значительно ограниченной из-за стенокардии переносимостью физических нагрузок. Именно эти пациенты наиболее высоко оценивают пользу от применения препарата. Правильное определение показаний для назначения нитратов и выбор достаточно эффективной дозы обеспечивают высокую эффективность лечения. Продолжительность действия нитратов должна соответствовать потребности конкретного больного, т. е. времени выполнения физических нагрузок, которые могут вызвать приступ стенокардии. Пациенты, принимающие долгодействующие нитраты, должны ежедневно иметь свободный от нитратов интервал, чтобы избежать возможного развития толерантности и сохранить их терапевтическую эффективность при длительном применении [8, 9].
Молсидомин. Этот донатор NO групп оказывает такой же антиишемический эффект, как изосорбида динитрат [25]. Прием пролонгированной формы, содержащей 16 мг препарата, так же эффективен, как прием 8 мг 2 р./сут.
Ивабрадин. Ивабрадин селективно и специфически ингибирует If-каналы синусного узла, контролирующие спонтанную диастолическую деполяризацию в синусовом узле и регулирующие ЧСС. Не оказывает влияния на время проведения импульсов по внутрипредсердным, предсердно-желудочковым и внутрижелудочковым проводящим путям, процессы реполяризации желудочков, а также сократительную способность миокарда. Дозозависимо снижает ЧСС, что уменьшает риск развития тяжелой брадикардии (ЧСС менее 40 уд./мин). Уменьшает потребность миокарда в кислороде, не влияя на его сократительную способность и уровень АД [26]. Одобрен Европейским медицинским агентством (ЕМА) для лечения стабильной стенокардии у пациентов, не переносящих β-блокаторы или при недостаточной их эффективности, когда частота сердечных сокращений при синусовом ритме превышает 60 уд./мин. [26].
Ивабрадин так же эффективен при стабильной стенокардии напряжения, как атенолол или амлодипин. Добавление к терапии атенололом 7,5 мг ивабрадина 2 р./сут позволяет значительно лучше контролировать ЧСС и выраженность стенокардии [26, 27]. В исследовании антиангинальной эффективности ивабрадина – BEAUTIFUL, включавшем 1507 пациентов, показано снижение сердечно-сосудистой смертности, частоты госпитализаций в связи с развитием инфаркта миокарда или сердечной недостаточности. Эффект был наиболее выраженным у пациентов с ЧСС ≥70 уд./мин.
Никорандил. Никорандил открывает АТФ-зависимые калиевые каналы гладкомышечных клеток сосудистой стенки, что сопровождается дилатацией мелких сосудистых ветвей. Высвобождающийся оксид азота обусловливает расширение крупных коронарных сосудов. Гемодинамический эффект никорандила наступает через 1–2 мин. после внутривенного введения препарата и спустя 30–60 мин. – после его перорального приема, сохраняясь в течение 12 ч (при дозировке 40–60 мг). Пероральный прием никорандила рекомендуется при любых видах стенокардии. По уменьшению симптомов стенокардии, повышению толерантности к физической нагрузке и улучшению качества жизни пациентов пероральный прием никорандила сравним с β–блокаторами, нитратами и антагонистами кальция. В проспективном исследовании никорандила при стабильной стенокардии (IONA) в течение 1,6 года у 5126 пациентов отмечено снижение частоты сердечно-сосудистых катастроф на 14% [28]. Профиль безопасности никорандила оказался выше, чем у препаратов упомянутых групп (отсутствие воздействия на показатели АД, ЧСС).
Согласно обновленному Руководству по лечению стабильной стенокардии NICE 2011 г. (National Institute for Health and Clinical Excellence, Великобритания), никорандил рекомендован к назначению в качестве монотерапии при непереносимости β-адреноблокаторов и антагонистов кальция, наличии противопоказаний к их применению или как дополнительное лекарственное средство при их недостаточной эффективности.
Ранолазин. Ранолазин является селективным ингибитором поздних натриевых каналов, уменьшает нарушения желудочковой реполяризации и сократимости, связанные с ишемией миокарда. Дозы 500–2000 мг/сут уменьшают выраженность стенокардии и увеличивают переносимость физических нагрузок без изменения ЧСС или АД. Назначение больным со стабильной стенокардией ранолазина в дозах 400 мг 3 р./сут оказывало антиишемический эффект, сопоставимый с эффектом атенолола в суточной дозе 100 мг [29, 30].
ЕМА одобрило применение ранолазина в 2009 г. в качестве дополнительного лечения стабильной стенокардии у пациентов с недостаточным ее контролем или при непереносимости препаратов первого ряда (β-блокаторы и/или антагонисты Са) [31].
В исследовании TERISA показано снижение частоты приступов стенокардии при терапии ранолазином у 949 больных СД, уже получавших один или два антиангинальных препарата. Эффект оказался нагляднее у пациентов с более высоким уровнем гликированного гемоглобина (HbA1c). Эти результаты позволяют рекомендовать дополнять этим препаратом недостаточно эффективную антиангинальную терапию, особенно у пациентов с высокими уровнями HbA1c [32].
Уровень ранолазина в плазме крови увеличивается при одновременном приеме блокаторов цитохрома P3A (CYP3A), таких как дилтиазем, верапамил, макролидные антибиотики, грейпфрутовый сок. Клиренс ранолазина снижается при нарушении функции почек и печени [29]. Ранолазин увеличивает продолжительность QT, поэтому необходима осторожность при его применении у пациентов с удлинением QT или при использовании с другими препаратами, вызывающими удлинение QT [29].
Триметазидин. Триметазидин – антиишемический модулятор метаболизма [33] с антистенокардической эффективностью в дозе 20 мг 3 р./сут, аналогичной пропранололу. ЧСС и двойное произведение в состоянии покоя и при пиковых нагрузках оставались неизменными в группе триметазидина, таким образом показывая немеханическое антиишемическое действие [34, 35]. Комбинированное применение триметазидина в дозе 35 мг 2 р./сут с β-блокатором (атенолол) уменьшало выраженность индуцируемой нагрузкой ишемии миокарда в сравнении с приемом одного атенолола [36].
У больных СД триметазидин уменьшает уровень гликемии и HbA1c [37]. Триметазидин противопоказан при болезни Паркинсона и двигательных нарушениях: тремор (дрожание), мышечная ригидность, расстройства ходьбы и синдром беспокойных ног. Триметазидин еще не оценен в больших исследованиях у пациентов со стабильной стенокардией.
Оптимальный вариант лечения включает хотя бы один препарат для устранения стенокардии/ишемии плюс лекарства для профилактики коронарных эксцессов.
С целью снижения риска развития коронарных эксцессов и прогрессирования атеросклероза рекомендуется назначать:
- Низкие дозы ацетилсалициловой кислоты (АСК) для ежедневного приема всем пациентам со стабильной стенокардией.
- Клопидогрел показан как альтернатива в случае непереносимости АСК.
- Статины всем пациентам со стабильной стенокардией. Цель лечения – достижение уровня ХС-ЛПНП < 1,8 ммоль/л и/или 50% снижение, если целевой уровень не может быть достигнут.
- Назначение ингибиторов АПФ (или БРА), если имеются сердечная недостаточность, АГ или СД.
Ингибиторы АПФ (иАПФ) снижают общую смертность, частоту ИМ и инсульта у пациентов с сердечной недостаточностью, с одним только сосудистым заболеванием или с высоким риском СД. Следовательно, целесообразно рассмотреть применение иАПФ для лечения больных стабильной стенокардией, особенно с сопутствующей АГ, ФИ ≤40%, СД или хронической болезнью почек (ХБП), если нет противопоказаний.
Однако не все клинические испытания показали, что иАПФ снижают смертность, частоту нефатального ИМ, инсульта и сердечной недостаточности у пациентов с атеросклерозом и сохранной функцией ЛЖ.
Лечение антагонистами рецепторов ангиотензина (АРБ) может быть альтернативой терапии для пациентов со стабильной стенокардией, когда иАПФ показаны, но не переносятся. Однако нет результатов клинических исследований, показывающих положительный эффект АРБ при стабильной стенокардии.
Блокада альдостерона спиронолактоном или эплереноном рекомендуется для использования у пациентов после инфаркта миокарда без значительного нарушения функции почек или гиперкалиемии, кто уже принимает терапевтическую дозу ингибитора АПФ и β-блокаторов, имеют ФИ ≤40%, СД или сердечную недостаточность.
Таким образом, рекомендации врача больному ИБС со стабильной стенокардией должны основываться на следующих положениях:
- Прекращение курения, ежедневные тренирующие физические нагрузки, прием антитромбоцитарных средств, лечение дислипидемии и высокого кровяного давления являются основными мероприятиями, направленными на уменьшение частоты смерти и инфаркта миокарда, и показаны большинству пациентов со стабильной стенокардией.
- Терапия нитратами короткого действия должна назначаться всем пациентам для немедленного устранения острых симптомов.
- Если стенокардия, ограничивая переносимость привычных нагрузок, ухудшает качество жизни, необходимо назначение систематической антиангинальной терапии. Основой фармакологического лечения хронической стабильной стенокардии остаются β-блокаторы и антагонисты кальциевых каналов. Оба класса антиангинальных средств эффективны в профилактике стенокардии, и исследования не показали преимущества какого-либо одного из них.
- Препараты второго ряда могут использоваться как дополнительные к основной терапии или как ее замещение, когда основные препараты не могут быть применены.
- Лечение следует начинать с монотерапии, прибегая к комбинации препаратов лишь при отсутствии необходимого эффекта. Дозирование одного лекарственного средства должно быть оптимизировано перед добавлением другого.
- Пациенты, у которых симптомы плохо контролируются применением двух антиангинальных препаратов, должны оцениваться как кандидаты на реваскуляризацию, если она доступна.
При определении показаний к хирургическому лечению пациентов следует подразделять по риску развития ИМ и смерти. К категории высокого риска отнесены пациенты, имеющие вероятность сердечно-сосудистой смерти более 3% в год, риск сердечно-сосудистой смерти менее 1% в год считается низким и 1–3% – промежуточным.
Реваскуляризация приносит явную прогностическую выгоду только в подгруппах высокого риска и практически отсутствует улучшение прогноза у тех, у кого он и так благоприятный [38].
Литература
- 1. Boden W.E., O’Rourke R.A., Teo K.K., Hartigan P.M. et al. Optimal medical therapy with or without PCI for stable coronary disease // N. Eng. J. Med. 2007. Vol. 356. P.1503–1516.
- 2. Chung S.C., Hlatky M.A., Faxon D., Ramanathan K. et al. The effect of age on clinical outcomes and health status BARI 2D (Bypass Angioplasty Revascularization Investigation in Type 2 Diabetes) // J. Am. Coll. Cardiol. 2011. Vol. 58. P. 810–819.
- 3. Frye R.L., August P., Brooks M.M., Hardison R.M. et al. A randomized trial of therapies for type 2 diabetes and coronary artery disease // N. Eng. J. Med. 2009. Vol. 360. P. 2503–2515.
- 4. Henderson R.A., Pocock S.J., Clayton T.C., Knight R. et al. Seven-year outcome in the RITA-2 trial: coronary angioplasty versus medical therapy // J. Am. Coll. Cardiol. 2003. Vol. 42. P. 1161–1170.
- 5. Poole-Wilson P.A., Lubsen J., Kirwan B.A., van Dalen F.J. et al. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial): randomised controlled trial // Lancet. 2004. Vol. 364. P. 849–857.
- 6. Steg P.G., Greenlaw N., Tardif J.C., Tendera M. et al. Women and men with stable coronary artery disease have similar clinical outcomes: insights from the international prospective CLARIFY registry // Eur. Heart J. 2012. Vol. 33. P. 2831–2840.
- 7. Steg P.G., Bhatt D.L., Wilson P.W., D’Agostino R. Sr. et al. One-year cardiovascular event rates in outpatients with atherothrombosis // JAMA. 2007. Vol. 297. P. 1197–1206.
- 8. Guidelines on the management of stable angina pectoris: executive summary // Eur. Heart J. 2006. Vol. 27, № 11. P.1341–1373.
- 9. 2013 ESC guidelines on the management of stable coronary artery disease. https://www.escardio. org/guidelines-surveys/esc-guidelines/Pages/GuidelinesList.
- 10. Ong P., Athanasiadis A., Borgulya G. et al. High prevalence of a pathological response to acetylcholine testing in patients with stable angina pectoris and unobstructed coronary arteries. The ACOVA Study (Abnormal Cоronary Vаsomotion in patients with stable angina and unobstructed coronary arteries) // J. Am. Coll. Cardiol. 2012. Vol. 59. P. 655–662.
- 11. Kitta Y., Obata J.E., Nakamura T., Hirano M. et al. Persistent impairment of endothelial vasomotor function has a negative impact on outcome in patients with coronary artery disease // J. Am. Coll. Cardiol. 2009. Vol. 53. P. 323–330.
- 12. Thadani U. Selection of optimal therapy for chronic stable angina // Curr. Treat. Options Cardiovasc. Med. 2006. Vol. 8(1). P. 23–35.
- 13. Yusuf S., Wittes J., Friedman L. Overview of results of randomized clinical trials in heart disease. I. Treatments following myocardial infarction // JAMA. 1988. Vol. 260. P. 2088–2093.
- 14. Rehnqvist N., Hjemdahl P., Billing E. et al. Effects of metoprolol vs verapamil in patients with stable angina pectoris. The Agina Pectoris Study in Stockholm (APIS) // Eur. Heart J. 1996. Vol. 17. P. 76–81
- 15. Dargie H.J., Ford I., Fox K.M. Total Ishemic Burden European Trial (TIBET). Effects of ischemia and treatment with atenolol, nifedipine SR and their combination on outcome in patients with chronic stable angina. The TIBET Study Group // Eur. Heart J. 1996. Vol. 17. P. 104–112.
- 16. Pepine C.J., Handberg E.M., Cooper-DeHoff R.M. et al. A calcium antagonist vs a noncalcium antagonist hypertension treatment strategy for patients with coronary artery disease. The International Verapamil-Trandolapril Study (INVEST): a randomized controlled trial // JAMA. 2003. Vol. 290. P. 2805–2816.
- 17. Ried L.D., Tueth M.J., Handberg E. et al. A Study of Antihypertensive Drugs and Depressive Symptoms (SADD-Sx) in patients treated with a calcium antagonist versus an atenolol hypertension Treatment Strategy in the International Verapamil SR-Trandolapril Study (INVEST) // Psychosom. Med. 2005. Vol. 67. P. 398–406.
- 18. Poole-Wilson P.A., Lubsen J., Kirwan B.A., van Dalen F.J. et al. Effect of long-acting nifedipine on mortality and cardiovascular morbidity in patients with stable angina requiring treatment (ACTION trial): randomised controlled trial // Lancet. 2004. Vol. 364. P. 849–857.
- 19. Nissen S.E., Tuzcu E.M., Libby P., Thompson P.D. et al. Effect of antihypertensive agents on cardiovascular events in patients with coronary disease and normal blood pressure: the CAMELOT study: a randomized controlled trial // JAMA. 2004. Vol. 292. P. 2217–2225.
- 20. Deanfield J.E., Detry J.M., Lihtlen P.R. et al. Amlodipine reduces transient myocardial ishemia in patients with coronary artery disease : doubl-blind Circadian Anti-Ishemia Program in Europe (CAPE Trial) // J.Am. Coll. Cardiol. 1994. Vol. 24. P. 1460–1467.
- 21. Haasenritter J., Bosner S., Vaucher P., Herzig L. et al. Ruling out coronary heart disease in primary care: external validation of a clinical prediction rule // Br. J. Gen. Pract. 2012. Vol. 62. P. e415–e421.
- 22. Henderson R.A., O’Flynn N. Management of stable angina: summary of NICE guidance // Heart. 2012. Vol. 98. P. 500–507.
- 23. Кириченко А.А. Стабильная стенокардия и острый коронарный синдром. М., 2001.
- 24. Марцевич С.Ю. Роль нитратов в современной терапии ишемической болезни сердца // Русский медицинский журнал. 2002. № 21. Т. 10. С. 955–957.
- 25. Wagner F., Gohlke-Barwolf C., Trenk D. et al. Differences in the antiischaemic effects of molsidomine and isosorbide dinitrate (ISDN) during acute and short-term administration in stable angina pectoris // Eur. Heart J. 1991. Vol.12. P. 994–999.
- 26. Tardif J.C., Ford I., Tendera M. et al. Efficacy of ivabradine, a new selective I(f) inhibitor, compared with atenolol in patients with chronic stable angina // Eur. Heart J. 2005. Vol. 26. P. 2529–2536.
- 27. Tardif J.C., Ponikowski P., Kahan T. Efficacy of the I(f) current inhibitor ivabradine in patients with chronic stable angina receiving beta-blocker therapy: a 4-month, randomized, placebo-controlled trial // Eur. Heart J. 2009. Vol. 30. P. 540–548.
- 28. Effect of nicorandil on coronary events in patients with stable angina: the Impact Of Nicorandil in Angina (IONA) randomised trial // Lancet. 2002. Vol. 359. P. 1269–1275.
- 29. Jerling M. Clinical pharmacokinetics of ranolazine // Clin. Pharmacokinet. 2006. Vol. 45. P. 469–491.
- 30. Timmis A.D., Chaitman B.R., Crager M. Effects of ranolazine on exercise tolerance andHbA1c in patients with chronic angina and diabetes // Eur. Heart J. 2006. Vol. 27. P. 42–48.
- 31. Ranexa (Ranolazine). https://www.ema.europa.eu/docs/en_GB/document_ library/EPAR_-_Summary_for_the_public/human/000805/WC500045940. pdf (23 August 2013).
- 32. Kosiborod M., Arnold S.V., Spertus J.A., McGuire D.K. et al. Evaluation of Ranolazine in Patients with Type 2 Diabetes Mellitus and Chronic Stable Angina. Results from the TERISA randomized clinical trial // J. Am. Coll. Cardiol. 2013. Vol. 61(20). P. 2038–2045.
- 33. Tuunanen H., Engblom E., Naum A., Nagren K. et al. Trimetazidine, a metabolic modulator, has cardiac and extracardiac benefits in idiopathic dilated cardiomyopathy // Circulation. 2008. Vol. 118. P. 1250–1258.
- 34. Detry J.M., Sellier P., Pennaforte S. et al. Trimetazidine: a new concept in the treatment of angina. Comparison with propranolol in patients with stable angina. Trimetazidine European Multicenter Study Group // Br. J. Clin. Pharmacol. 1994. Vol. 37. P. 279–288.
- 35. El-Kady T., El-Sabban K., Gabaly M. et al. Effects of trimetazidine on myocardial perfusion and the contractile response of chronically dysfunctional myocardium in ischemic cardiomyopathy: a 24-month study // Am. J. Cardiovasc. Drugs. 2005. Vol. 5. P. 271–278.
- 36. Questions and answers on the review of medicines containing trimetazidine (20 mg tablets, 35 mg modified release tablet and 20 mg/ml oral solution). .https://www. ema.europa.eu/ docs/en_GB/document_library/Referrals_document/Trimetazidine_31/ WC500129195.pdf (9 March 2012).
- 37. Fragasso G., Piatti Md P.M., Monti L. et al. Short- and long-term beneficial effects of trimetazidine in patients with diabetes and ischemic cardiomyopathy // Am. Heart J. 2003. Vol. 146. P. e18.
- 38. Demosthenes G., Katritsis John P.A. Ioannidis, MD Percutaneous Coronary Intervention Versus Conservative Therapy in Nonacute coronary Artery Disease. A Meta-Analysis.// Circulation. 2005. Vol. lll. P. 2906–2912.
Признаки стенокардии напряжения
Стенокардия напряжения степени определяют клиническую картину заболевания. Но основным проявлением для всех стадий заболевания является приступ болей. Типичное протекание болевого приступа:
- Боль начинается на фоне выполнения физической работы, в момент стресса. Характерно возникновение приступа на морозе или в ветреную погоду.
- Боль чаще всего сосредоточена за грудиной с иррадиацией в лопатку, шею, нижнюю челюсть. Боли пациентами описываются как сжимающие, жгучие, режущие.
- Длительность болей от 2-х до 15 минут. При длительном приступе не исключается вероятность развития инфаркта.
- Интенсивность приступа снижается после приема нитроглицерина, при прекращении физической работы.
Стенокардия напряжения симптомы — это и слабость, одышка, перебои в работе сердца, снижение или нарастание АД, холодный пот. У части больных отмечается бледность кожных покровов, учащение мочеиспускание, сухость ротовой полости.
Приступы могут повторяться как от нескольких раз за день, так и до двух-трех эпизодов в месяц. Нестабильная стенокардия напряжения проявляется ярче, ее симптомы раз от раза усиливаются.
Прогнозы и профилактика
Последствия первичной стенокардии напряжения непредсказуемы, а в случае со стабильной — это могут быть инфаркт миокарда, многососудистое поражение коронарных артерий, кардиосклероз, стойкое сужение основного ствола венечной артерии. Среди трех процентов пациентов наблюдается летальный исход.
Главные способы профилактики:
- снижение веса;
- отказ от курения;
- сбалансированное питание;
- избавление от артериальной гипертензии;
- профилактический прием назначенных лекарств.
Люди, страдающие стенокардией напряжения, должны обязательно обращаться к кардиохирургу, который решит вопрос о необходимости оперативного вмешательства.
Лечение стенокардии напряжения
План лечения больного составляется индивидуально. В первую очередь назначается стандартная терапия ИБС с использованием b-адреноблокаторов, антиагрегантов, средств, снижающих содержание холестерина в крови.
В момент приступа болевые ощущения помогает снять нитроглицерин. При частых эпизодах обострения назначают нитраты пролонгированного (длительного) действия — Изосорбида мононитрат, Изосорбида динитрат, нитроглицериновую мазь или пластырь.
В комплексную терапию входит устранение всех факторов риска заболевания, диетотерапия, выбор оптимальной физической нагрузки.
Почему развивается стенокардия 3 ФК?
Основная причина прогрессирования кардиологических заболеваний, связанных с нехваткой кислорода в миокарде, это атеросклеротические бляшки, появляющиеся из-за повышенного уровня холестерина в крови. Они и забивают сосуды, не позволяя крови нормально циркулировать. Спровоцировать атеросклероз могут несколько факторов:
- Повышенное АД – стенки сосудов становятся тоньше, сильнее подвержены повреждениям, что упрощает формирование бляшек;
- Мужской пол – еще один фактор риска. Если у женщин в крови находится гормон эстроген, способствующий выведению холестерина, то у мужчин это вредное вещество накапливается в организме;
- Неправильное питание – основная причина. Пациенты, чье состояние сердца требует диагностики и лечения, обычно злоупотребляют жирной, копченой, жареной пищей. Они не следят за тем, что едят, могут иметь избыточный вес, постоянно переедать;
- Сердечно-сосудистые заболевания являются одним из провокаторов приступов, нередко носят наследственный характер;
- Недостаточный уровень физических нагрузок;
- Учащенное сердцебиение – когда ритм увеличивается, организму требуется больший объем кислорода. Приступ может спровоцировать занятие спортом, эмоциональное потрясение и даже обычная прогулка медленным шагом.
Однако пациенту недостаточно убрать физические напряжения – боль будет продолжаться, несмотря на снижение нагрузок. В самых тяжелых случаях, когда приступ возникает в состоянии покоя, а в функциональный класс 3 изменяется на ФК 4, требуется хирургическое вмешательство.