Что такое кардиогенный шок
Кардиогенный шок развивается в основном на фоне мелкоочагового или обширного инфаркта миокарда. Вследствие этого резко нарушается кровообращение по всему организму. При развитии этого состояния спасти жизнь пациента удается лишь в 10% случаев, несмотря на своевременную помощь и реанимационные мероприятия.
Возникает опасное состояние из-за резкого нарушения сократительной функции миокарда. Спровоцировать это может инфаркт миокарда, дилатационная кардиомиопатия, аортальный стеноз, повреждение межжелудочковой перегородки и другие заболевания. Кардиогенный шок влечет за собой критическое снижение артериального давления. Вместе с этим происходит активация симпатической нервной системы, что провоцирует возбуждение сердечной деятельности.
Резкое снижение сердечного выброса сопровождается уменьшением количества крови в артериях, это влечет за собой задержку жидкости в организме, нагрузка на сердечную мышцу увеличивается, развивается отек легких. В свою очередь, скопление недоокисленных продуктов метаболизма вызывает метаболический ацидоз.
Публикации в СМИ
Кардиогенный шок — шок, развивающийся в результате внезапного снижения сердечного выброса.
Этиология • Как правило, он возникает при обширном ИМ на фоне многососудистого поражения венечных артерий. Шок развивается при вовлечении более 40% массы миокарда, и наблюдается у 5–20% больных с инфарктом • Другие причины •• Острый миокардит •• Выраженный, остро возникший аортальный или митральный стеноз •• Выраженная, остро возникшая аортальная или митральная недостаточность •• Разрыв межжелудочковой перегородки •• Аритмии.
Факторы риска • Пожилой возраст • Снижение фракции выброса левого желудочка ниже нормы (по данным ЭхоКГ) • Обширный ИМ (по данным ЭКГ инфарктные изменения в 8–9 отведениях; большая зона акинезии по данным ЭхоКГ), • Предшествующий ИМ • СД.
Патогенез. Тяжёлое нарушение сократительной функции миокарда с дополнительным присоединением усугубляющих ишемию миокарда факторов.
• Активация симпатической нервной системы вследствие падения сердечного выброса и снижения АД приводит к учащению ритма сердца и усилению сократительной деятельности миокарда, что увеличивает потребность сердца в кислороде.
• Задержка жидкости из-за снижения почечного кровотока и увеличение ОЦК, что усиливает преднагрузку на сердце, способствует отёку лёгких и гипоксемии.
• Увеличение ОПСС из-за вазоконстрикции, приводящее к увеличению постнагрузки на сердце и увеличению потребности миокарда в кислороде.
• Нарушение диастолического расслабления левого желудочка миокарда из-за нарушения его наполнения и снижения податливости, что вызывает увеличение давления в левом предсердии и способствует усилению застоя крови в лёгких.
• Метаболический ацидоз вследствие длительной гипоперфузии органов и тканей.
Клинические проявления
• Артериальная гипотензия — систолическое АД менее 90 мм рт.ст. или на 30 мм рт.ст. ниже обычного уровня в течение 30 мин и более. Сердечный индекс менее 1,8–2 л/мин/м2.
• Нарушение периферической перфузии •• почек — олигурия •• кожи — бледность, повышенная влажность •• ЦНС — загруженность, сопор.
• Отёк лёгких, как проявление левожелудочковой недостаточности.
При обследовании больного обнаруживают холодные конечности, нарушение сознания, артериальную гипотензию (среднее АД ниже 50–60 мм рт.ст.), тахикардию, глухие тоны сердца, олигурию (менее 20 мл/мин). При аускультации лёгких могут быть выявлены влажные хрипы.
Специальные методы исследования
• Установка катетера Суона–Ганца с целью контроля центральной гемодинамики, измерение сердечного выброса — по ЭхоКГ или инвазивно.
• Артериовенозная разница по кислороду более 5,5 мл%.
Диагностика. Необходимо исключить другие причины артериальной гипотензии: гиповолемию, вазовагальные реакции, электролитные нарушения (например, гипонатриемию), побочные эффекты лекарств, аритмии (например, пароксизмальные наджелудочковые и желудочковые тахикардии).
ЛЕЧЕНИЕ
Неотложное состояние, необходимо экстренное проведение лечебных мероприятий. Основная цель терапии — повышение АД.
Лекарственная терапия. Используют следующие ЛС (предпочтительно введение через специальные дозаторы). С их помощью АД следует повышать до 90 мм рт.ст. и выше • Добутамин (селективный b1-адреномиметик с положительным инотропным эффектом и минимальным положительным хронотропным эффектом, т.е. эффект увеличения ЧСС выражен незначительно) в дозе 2,5–10 мкг/кг/мин • Допамин (обладает более выраженным положительным хронотропным эффектом, т.е. может увеличить ЧСС и соответственно потребность миокарда в кислороде, несколько усугубив тем самым ишемию миокарда) в дозе 2–10 мкг/кг/мин с постепенным увеличением дозы каждые 2–5 мин до 20–50 мкг/кг/мин • Норэпинефрин в дозе 2–4 мкг/мин (до 15 мкг/мин), хотя он, наряду с усилением сократимости миокарда, в значительной степени увеличивает ОПСС, что также может усугубить ишемию миокарда.
Внутриаортальная баллонная контрпульсация (механическое нагнетание крови в аорту с помощью насоса во время диастолы, что способствует увеличению кровотока в венечных артериях). Проводят при наличии соответствующего оборудования и неэффективности лекарственного лечения кардиогенного шока.
Чрескожная транслюминальная коронарная ангиопластика — восстановление проходимости венечных артерий с её помощью в первые 4–8 ч от начала инфаркта не только сохраняет миокард, но и прерывает порочный круг патогенетических механизмов кардиогенного шока.
Наблюдение. При кардиогенном шоке рекомендуется постоянный контроль АД, ЧСС, диуреза (постоянный мочевой катетер), давления заклинивания лёгочных капилляров (баллонный катетер в лёгочной артерии), а также контроль сердечного выброса с помощью ЭхоКГ или методом радионуклидной ангиографии.
Прогноз. Смертность при кардиогенном шоке составляет 50–90%.
МКБ-10 • R57.0 Кардиогенный шок
Как распознать опасное состояние
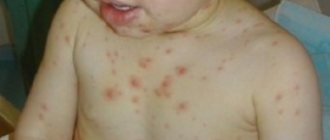
Чем раньше оказана помощь при кардиогенном шоке, тем больше шансов сохранить жизнь пациента. Клиника всегда зависит от состояния, вызвавшего шок. При инфаркте миокарда человек испытывает сильную боль в грудной клетке, появляется чувство страха, паника. При сбоях сердечного ритма больной отмечает болевой синдром за грудиной, возникает замирание сердца или, наоборот, учащение сердечного ритма. Если причиной кардиогенного шока становится тромбоэмболия легочной артерии, человек задыхается, появляется слабость, иногда кашель с кровью.
Кардиогенный шок вызывает острую боль в груди и другие симптомы
Дальнейшее развитие шока сопровождается такими признаками:
- появлением холодного липкого пота;
- посинением губ, носа, кончиков пальцев;
- бледностью кожных покровов;
- беспокойством больного или его заторможенностью;
- набуханием шейных вен;
- снижением температуры конечностей;
- чувством паники и страха.
При легочной тромбоэмболии кожа на голове, в области груди и шеи становится землистого или мраморного оттенка.
Важно! При отсутствии необходимой помощи больной теряет сознание, прекращается сердечная и мозговая деятельность, наступает смерть.
Помощь при кардиогенном шоке, профилактика
Медицинская помощь заключается в повышении артериального давления до нормальных показателей. С этой целью применяют допамин или добутамин. При фибрилляции желудочков проводят дефибрилляцию, а при остановке сердца – непрямой массаж сердца.
Помощь при кардиогенном шоке в условиях стационара: оксигенотерапия, назначение вазопрессоров, сердечных гликозидов, анальгетиков, преднизолона, гепарина, диуретиков. Дозировка и схема лечения расписывается врачом в каждом конкретном случае индивидуально.
Профилактика:
- здоровый образ жизни, отказ от вредных привычек;
- рациональное питание;
- полноценный сон, борьба со стрессами;
- умеренные физические нагрузки;
- своевременное лечение любой сердечной патологии.
Раз в год проходите профосмотр у кардиолога. При наличии сердечных заболеваний профилактическое обследование рекомендовано раз в шесть месяцев. В нашем центре вы сможете пройти полное обследование организма и получить расшифровку результатов. Во время консультации врач ответит на ваши вопросы и расскажет о симптомах кардиогенного шока при инфаркте миокарда. Запись в режиме онлайн и по телефону.
Доврачебная неотложная помощь
При обнаружении признаков кардиогенного шока необходимо как можно скорее вызвать скорую помощь, оказать человеку неотложную помощь. Для этого следует выполнить такие действия:
- Больного уложить на любую поверхность, тело должно находиться в горизонтальном положении, ноги слегка приподняты. Такая позиция обеспечивает лучший приток крови к головному мозгу.
- Во время оказания экстренной помощи важно обеспечить доступ свежего воздуха в комнату. Для этого нужно открыть форточку или входную дверь. Нельзя допускать столпотворения возле пострадавшего.
- Шею и грудь человека нужно освободить от одежды. Если есть тесный воротник, галстук, шарф или другие предметы, их нужно снять.
- На начальном этапе нужно измерить артериальное давление пациента. При кардиогенном шоке оно всегда понижено. Чтобы нормализовать показатели, нужно дать больному препарат, в состав которого входит допамин, метазон или гидрокартизон.
- Если человек в сознании, допускается прием анальгезирующих лекарств.
После этого следует дождаться карету скорой помощи, после приезда врачей сообщить им, при каких обстоятельствах развился шок.
Доврачебная помощь при развитии шока должна быть немедленной
Реанимационные мероприятия
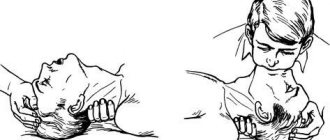
При потере сознания и остановке дыхания необходимо выполнить срочные реанимационные мероприятия. Искусственное дыхание выполняется рот в рот. Для этого голову человека нужно запрокинуть назад, подложив под шею валик из полотенца или любой другой ткани. Человек, выполняющий реанимацию, должен вдохнуть воздух, закрыть нос пострадавшего пальцами, выдохнуть воздух через рот пострадавшего. За одну минуту необходимо выполнить до 12 вдохов.
Во время оказания доврачебной помощи необходимо следить за пульсом больного. Если человек теряет сознание и сердечные удары не прослушиваются, нужно выполнить непрямой массаж сердца. Для его выполнения пациента кладут на спину, поверхность должна быть твердой. Человек, выполняющий массаж, должен расположиться сбоку от больного. Основания ладоней должны надавливать на область грудной клетки посредине. Толчки выполняются прямыми руками, сгибать их не нужно. Частота нажатий – не менее 60 толчков в минуту. Если реанимируется пожилой человек, количество толчков в минуту составляет до 50, у детей – 120 нажатий. Важно! При одновременном выполнении искусственного дыхания и непрямого массажа сердца следует чередовать 2 вдоха с 30 толчками.
Помощь больному в условиях стационара
Алгоритм действий врачей зависит от особенностей состояния больного. Первые медицинские мероприятия проводятся еще в машине скорой помощи. Здесь используют такие методы:
- использование оксигенотерапии – процедура помогает поддержать дыхание пациента, сохранить жизненно важные функции до приезда в больницу;
- применение наркотических анальгетиков. Это мероприятие помогает снизить сильный болевой синдром. Здесь используются такие лекарства, как Дроперидол, Промедол, Фентанил и другие;
- чтобы исключить риск образования тромбов в артериях, человеку вводят гепарин;
- нормализовать частоту сердечных сокращений помогают растворы Добутамина, Дофамина, Норадреналина;
- улучшить питание сердечной мышцы помогает введение инсулина с глюкозой;
- устранить тахиаритмию помогают Панангин, Гилуритмал, Лидокаин;
- раствор натрия гидрокарбоната вводится для налаживания метаболических процессов организма.
Дальнейшее лечение кардиогенного шока в условиях клиники подразумевает продолжение терапии, начатой в домашних условиях и в карете скорой помощи. При поступлении больного в больницу проводится немедленное комплексное обследование организма. Это помогает выявить противопоказания и риск развития побочных эффектов, которые могут спровоцировать осложнение ситуации.
В условиях стационара проводятся реанимационные мероприятия, направленные на восстановление жизненно важных функций пациента
Дальнейший стандарт оказания помощи зависит от заболевания, вызвавшего развитие шока:
- состояние, при котором возникает отек легких, требует назначения Нитроглицерина, использования спиртовых растворов, мочегонных препаратов;
- сильная боль снимается с помощью сильных наркотических анальгетиков, к которым относят Морфин, Промедол, Фентанил;
- лечение сильно пониженного артериального давления проводится с помощью раствора Допамина;
- для сохранения дыхания у пациента в бессознательном состоянии проводится интубация трахеи;
- предотвратить кислородное голодание головного мозга и других органов помогает оксигенотерапия.
При тяжелом состоянии человека необходимо использование аппарата искусственного кровообращения и искусственной вентиляции легких. В этот период больному должна быть оказана необходимая сестринская помощь. Заключается она в выполнении гигиенических процедур, регулярном измерении артериального давления, температуры тела и кормлении пациента.
Как лечить кардиогенный шок при инфаркте миокарда?
Н
есмотря на значительные успехи в лечении больных острым инфарктом миокарда (ИМ), что позволило значительно снизить летальность при этом заболевании,
кардиогенный шок
(КШ)
по-прежнему остается основной причиной смерти больных ИМ даже в так называемую «тромболитическую эру»
. Встречается КШ в среднем у 5-10% больных ИМ. По данным Golbert (1991 г.) летальность у больных с ИМ, осложненным КШ, в период с 1975 г. по 1988 г. составила 78%. А результаты Национального регистра инфаркта миокарда (NRMI 2), в котором прослежены исходы ИМ у 23 тыс. больных с КШ в 1400 госпиталях США за период с 1994 г. по 2001 г., показали, что летальность в последние годы снизилась незначительно и составляла около 70%.
КШ — это осложнение ИМ, связанное со снижением сердечного выброса при адекватном внутрисосудистом объеме, приводящее к гипоксии органов и тканей. Как правило, шок развивается у больных в результате серьезного нарушения функции левого желудочка в связи с существенным повреждением миокарда. На аутопсии у больных, погибших от КШ, размеры ИМ составляют от 40 до 70% массы миокарда левого желудочка. В этой статье будут обсуждены принципы лечения больных с истинным КШ. Другие клинические варианты КШ, например, связанные с развитием ари шок, или гиповолемии, а также с внутренними или наружными разрывами миокарда и острой митральной регургитацией, требуют других патогенетических подходов к лечению.
Критерии диагностики кардиогенного шока:
- систолическое АД составляет менее 90 мм рт.ст. на протяжении 1 часа и более;
- признаки гипоперфузии — цианоз, холодные влажные кожные покровы, выраженная олигурия (мочеотделение менее 20 мл в час), застойная сердечная недостаточность, ментальные расстройства;
- частота сердечных сокращений выше 60 уд. в мин;
- гемодинамические признаки — давление заклинивания в легочной артерии более 18 мм рт.ст., сердечный индекс менее 2,2 л/мин/кв.м.
Стандартное лечение кардиогенного шока
Больные ИМ, осложненным КШ, должны находиться в палате интенсивного наблюдения и требуют тщательного постоянного контроля за целым рядом параметров: общим клиническим состоянием; уровнем кровяного АД — предпочтительно прямым методом, используя, например, катетеризацию лучевой артерии; водным балансом — с обязательным измерением почасового диуреза; мониторированием ЭКГ. При возможности целесообразно контролировать параметры центральной гемодинамики с использованием катетера Swan-Ganz или хотя бы центрального венозного давления.
Общепринятая терапия КШ включает в себя оксигенотерапию
. Кислород больные должны получать через интраназальные катетеры или маску, а в случаях грубых нарушений функции дыхания переводиться на искусственную вентиляцию легких. Как правило, больные нуждаются в терапии инотропными препаратами:
в/в инфузия допамина
со скоростью, необходимой для контроля уровня АД (в среднем она составляет 10-20 мкг/кг в мин); при недостаточной эффективности и высоком периферическом сопротивлении подключается
инфузия добутамина
5-20 мкг/кг в мин. В последующем возможна замена одного из этих препаратов на норадреналин в возрастающих дозах от 0,5 до 30 мкг/кг в мин или адреналин. В ряде случаев эти препараты позволяют поддерживать кровяное давление на уровне не менее 100 мм рт. ст. При высоком давлении заполнения левого желудочка, как правило, назначаются
диуретики
. Применения нитропрепаратов и других периферических дилататоров следует избегать из-за их гипотензивного действия. КШ является абсолютным противопоказанием для применения b-блокаторов.
Надо сказать, что стандартная медикаментозная терапия, как правило, оказывается либо неэффективной, либо дает кратковременный эффект, поэтому не будем подробно останавливаться на детальной характеристике общеизвестных препаратов – обсудим те способы лечения, которые по современным представлениям могут изменить прогноз у больных с КШ.
Тромболитическая терапия
Чаще всего КШ развивается при тромботической окклюзии крупной субэпикардиальной коронарной артерии, приводящей к повреждению миокарда и ишемическому некрозу. Тромболитическая терапия (ТЛТ) — один из современных способов лечения
, позволяющий восстановить перфузию в очаге ишемии и спасти жизнеспособный (гибернированный) миокард. Первые обнадеживающие результаты были получены в крупномасштабном исследовании
GUSTO-I
(1997 г.), где обследовалось более 40 тыс. больных ИМ. Оказалось, что у пациентов, получавших терапию тканевым активатором плазминогена (t-PA), шок в стационаре развился в 5,5% случаев, а в группе леченных стрептокиназой — в 6,9% случаев (p<0,01). 30-ти дневная летальность составила 57% и 58%, соответственно. То есть терапия t-PA способна предупреждать развитие КШ у больных ИМ в стационаре. Следующие генерации тканевого активатора плазминогена — альтеплаза и ретиплаза, обладающие рядом преимуществ перед t-PA (быстрота разрушения тромба и удобство введения), были изучены в исследовании
GUSTO-III
(1999 г.). При введении альтеплазы и ретиплазы шок в условиях стационара развивался в 5,3 и 5,5% случаев, а 30-дневная летальность составила 65% и 63%, соответственно. Таким образом, тромболитики следующего поколения оказались не столь эффективными, как ожидалось, в плане предупреждения развития КШ у больных в стационаре. Среди пациентов, включенных в GUSTO-I и в GUSTO-III, при поступлении в стационар признаки КШ зарегистрированы в 0,8% и в 11%, соответственно. Летальность у них составила: в группе t-PA — 59%, стрептокиназы — 54%, ретиплазы — 58%. Тромболитическая терапия несколько снижает летальность больных с ИМ, осложненным КШ, а t-PA, по-видимому, уменьшает частоту его развития. Исследования в этом направлении продолжаются. Возможно, что не только использование новых тромболитиков (молекул-мутантов и др.), но и другие способы оптимизации лечения больных могут улучшить исход заболевания. Известно, что сочетанная терапия тромболитиками и низкомолекулярными гепаринами, например, эноксапарином (АSSENT-3, AMI-SK, HART II), существенно улучшала прогноз ИМ, уменьшая смертность, количество повторных ИМ и необходимость проведения реваскуляризации. Не исключено, что лечение КШ с использованием тромболитических препаратов и низкомолекулярных гепаринов окажется более эффективным, хотя на сегодня это пока только гипотетическое соображение.
Применение тромболитиков при кардиогенном шоке может улучшить выживаемость у больных ИМ, а в некоторых случаях предупредить развитие этого осложнения. Однако использование только этого метода лечения вряд ли сможет существенно изменить существующую ситуацию. Связано это с тем, что низкое системное давление приводит к низкому перфузионному давлению в коронарных артериях и значительному снижению эффективности тромболизиса.
Внутриаортальная баллонная контрапульсация
Внутриаортальная баллонная контрапульсация (ВАБК) применяется для того, чтобы стабилизировать состояние больных с КШ и повысить эффективность тромболитической терапии. Связано это с тем, что ВАБК улучшает перфузию миокарда в диастолу, уменьшает систолическую постнагрузку и при этом не изменяет потребность миокарда в кислороде. В исследовании GUSTO-I было показано уменьшение смертности к 30-му дню ИМ и через 1 год заболевания в тех случаях, когда использовали ВАБК у больных с КШ. Анализируя результаты NRМI-2
, сравнили эффективность лечения больных с КШ с использованием ВАБК и без нее. Следует отметить, что эти данные получены в результате лечения КШ у более чем 20 тыс. больных не в специально спланированном исследовании, а в практике здравоохранения США за последние 6 лет. Данные о проценте больных, получавших тромболитики, первичную ангиопластику (ТБКА) или не получавших «реперфузионной» терапии, представлены на рисунке 1. Оказалось, что в группе получавших тромболитическую терапию применение ВАБК позволило достоверно снизить госпитальную смертность с 70% до 49%. Использование ВАБК при проведении первичной ангиопластики существенно не изменило летальность в стационаре. Смертность при КШ (рис. 2) у больных после первичной коронарной ангиопластики составила 42% и была ниже, чем при использовании любых других методов лечения.
Рис. 1. Процент больных, леченных с использованием ТЛТ либо первичной ТБКА, либо без этих вмешательств, в зависимости от проведения ВАБК NRMI 2
Рис. 2. Госпитальная смертность в группе больных с ТЛТ или первичной ТБКА в зависимости от проведения ВАБК NRMI 2
Таким образом, применение ВАБК при КШ позволяет не только стабилизировать состояние больных в период ее проведения, но и существенно улучшить эффективность тромболитической терапии и выживаемость больных.
Немедикаментозное восстановление коронарного кровотока
Возможности немедикаментозного восстановления кровотока при ИМ, осложненным КШ, в первую очередь с помощью первичной коронарной ангиопластики и экстренного проведения АКШ активно изучаются в последнее десятилетие. Известно, что при удачной первичной ангиопластике удается добиться более полного восстановления коронарного кровотока, меньшего диаметра резидуального стеноза и улучшения выживаемости больных с КШ (S-MASH, GUSTO-1).
Наиболее убедительные результаты были получены в многоцентровом исследовании SHOCK
, проведенном в 30 центрах США и Канады с 1993 г. по 1998 г. 302 больных с истинным КШ были рандомизированы в группы — интенсивного медикаметозного лечения (n=150) и ранней реваскуляризации (n=152). Больные 1 и 2 групп получали терапию иноторопными препаратами в 99%, ВАБК в 86% и тромболитиками в 63% и 49% случаях, соответственно. Во второй группе у 97% была проведена экстренная коронарная ангиография и в 87% случаев достигнута ранняя реваскуляризация (внутрикоронарное вмешательство — 64%, хирургическое — 36%).
Смертность у больных в группе медикаментозного лечения к 30 дню ИМ составила 56%, а в группе ранней реваскуляризации 46,7%. К 6 месяцу болезни смертность во 2 группе оказалась существенно ниже (63% и 50%, соответственно), и различия эти сохранялись до 12 месяца болезни (рис. 3). Анализ эффективности агрессивного ведения больных ИМ с КШ показал, что результаты выживаемости больных оказались лучше в случаях реваскуляризации
почти во всех подгруппах (рис. 4). Исключение составили больные пожилого возраста (старше 75 лет) и женщины, у которых медикаментозное лечение оказалось предпочтительным. Исследование SHOCK было блестяще организовано. Например, среднее время от принятия решения до начала ангиопластики составило 0,9 часа, а до проведения операции на коронарных сосудах — 2,7 часа.
Рис. 3. Смертность больных в группах медикаментозного лечения (группа 1) и ранней реваскуляризации (группа 2) Исследование SHOCK
Рис. 4. Сравнительный риск 30-дневной смерти в подгруппах Исследование SHOCK
Таким образом, ранняя реваскуляризация у больных ИМ, осложненным КШ, приводит, по-видимому, к восстановлению функции гибернированного миокарда и позволяет добиться значительного снижения летальности у этих пациентов. Следует отметить, что 55% больных с КШ в исследовании SHOCK переводились в специализированные центры, где им и были проведены соответствующие инвазивные вмешательства. Такая тактика ведения больных с КШ может оказаться наиболее перспективной и в нашей стране.
Метаболическая терапия
При окклюзии коронарной артерии происходят серьезные нарушения структуры и функций миокарда. Нарушения метаболизма миокарда, развивающиеся при продолжительной ишемии и системной гипотонии даже при восстановлении коронарного кровотока, могут препятствовать нормализации восстановления функции сердца. В связи с этим предпринимались многочисленные попытки восстановить метаболизм миокарда у больных с КШ с помощью целого ряда препаратов — глюкозо-инсулин-калиевая смесь, аденозин, блокаторы Na+H+-каналов, L-карнитин. Предполагалось, что они помогут увеличить жизнеспособность ишемизированного миокарда. Несмотря на теоретические предпосылки сегодня с позиций доказательной медицины не получено данных, которые позволили бы рекомендовать использование в клинической практике метаболических препаратов для лечения больных с КШ.
Новые подходы к лечению
Обнадеживающие результаты получены при использовании антиагрегантных препаратов последнего поколения — блокаторов IIb-IIIa гликопротеиновых рецепторов тромбоцитов. Применение эптифибатида
в подгруппе больных с КШ в исследовании
PURSUIT
(2001 г.) у больных с острыми коронарными синдромами без элевации ST привело к существенному, по сравнению с контрольной группой, увеличению выживаемости. Возможно, эффект этот частично связан со способностью данной группы препаратов улучшать кровообращение в микроциркуляторном русле за счет устранения тромбоцитарных агрегатов.
Лечение после выписки из стационара
Значительные нарушения сократительной способности миокарда у большинства выживших больных ИМ, осложненным КШ, сохраняются. Поэтому они нуждаются в тщательном медикаментозном контроле и активной терапии после выписки из стационара. Минимально возможная терапия, целью которой является уменьшение процессов ремоделирования миокарда и проявлений сердечной недостаточности (ингибиторы АПФ, диуретики, b-блокаторы и сердечные гликозиды), снижение риска тромбозов и тромбоэмболий (ацетилсалициловая кислота, производные кумарина — варфарин и др.), должна использоваться лечащим врачом в отношении каждого пациента с учетом складывающейся клинической ситуации.
Экстренное операционное лечение
Если состояние пациента при кардиогенном шоке не улучшается после использования медикаментозной терапии и реанимационных мероприятий, врачи применяют хирургическое вмешательство, помогающее спасти жизнь человеку. Проводится операция исключительно в условиях стационара с использованием необходимого медицинского оборудования.
Для борьбы с симптомами кардиогенного шока используют следующие методики:
- аортокоронарное шунтирование – заключается в создании дополнительного кровеносного русла, которое используется в качестве моста перед предстоящей трансплантацией миокарда;
- внутриаортальная баллонная контрпульсация – методика проводится с помощью введения специального баллона, который раздувается при сокращении сердечной мышцы. Проводится процедура для нормализации кровяного давления;
- чрескожная транслюминальная коронарная ангиопластика – подразумевает восстановление целостности кровеносных сосудов, что обеспечивает нормальную сократительную функцию сердца, поддержание жизненно важных процессов организма на должном уровне.
При отсутствии своевременных реанимационных мероприятий развиваются тяжелые последствия кардиогенного шока. К ним относят сердечную недостаточность, тромбоз вен головного мозга, трофические язвы желудка, кишечника и другие состояния. Даже при своевременной и грамотной медицинской помощи в 90% случаев наступает летальный исход. Объясняется это тяжелым течением кардиогенного шока и его частыми осложнениями. Чтобы избежать этого состояния, необходимо направить усилия на его профилактику. В данном случае профилактические мероприятия должны быть направлены на первопричину, то есть на предотвращение патологий, вызывающих риск развития шока. Правильное лечение сердечно-сосудистых заболеваний и своевременное обращение за медицинской помощью поможет значительно снизить риск кардиогенного шока.
Несмотря на многочисленные исследования, применение новейших современных лекарственных препаратов, технологий и устройств, кардиогенный шок (КШ) остается главной и основной причиной смерти пациентов с острым инфарктом миокарда (ОИМ) и рядом других острых заболеваний сердца [12, 14]. Это тяжелое кардиальное осложнение является IV стадией острой сердечной недостаточности по классификации T. Killip (1967), для которой характерно систолическое артериальное давление менее 90 мм рт.ст., признаки системной гипоперфузии и периферической вазоконстрикции, олигурия, цианоз, потливость. Легочные хрипы могут выслушиваться, но могут и отсутствовать. У ⅓ пациентов с КШ ни клинически, ни по данным инструментальных методов отек легких не диагностируется [24, 30].
Частота развития КШ у пациентов с ОИМ с подъемом сегмента ST (ОИМпST) по данным различных авторов, исследований и международных регистров различна и варьирует от 3,4 до 15% [60]. Наиболее крупные исследования (NRMI-2, 3, 4), в которых проанализированы данные 1 970 000 пациентов в США с ОИМпST, полученные в 1994-2004 гг., продемонстрировали общую частоту КШ в 8,6% без тенденции к уменьшению или увеличению за указанный период [3].
Несколько меньшая частота развития КШ отмечается у пациентов с ОИМ без подъема сегмента ST (ОИМбпST). В исследовании GUSTO IIb, включившего 7986 пациентов с ОИМбпST, КШ развился у 2,6% [26], такую же частоту развития КШ (2,5%) при ОИМбпST указывают в исследовании PURSUIT [19]. В более позднем регистре GRACE частота развития КШ за 6-летний период (1999-2006) уменьшилась c 2,1 до 1,8% [13].
Летальность при КШ колеблется от 50 до 90% во всех возрастных группах [12], при этом большинство пациентов с КШ — женщины, лица пожилого и старческого возраста, пациенты с сопутствующим сахарным диабетом и артериальной гипертензией [14].
К сожалению, общепринятая оптимальная тактика лечения пациентов с КШ до сих пор не выработана [29].
Реваскуляризация миокарда — чрескожные коронарные вмешательства (ЧКВ) или аортокоронарное шунтирование (АКШ) — одни из основных и определяющих моментов в лечении больных с ОИМ, осложненного КШ. Реваскуляризация позволяет значительно снизить летальность и улучшить результаты лечения в этой группе больных [12, 29, 57] как в раннем послеоперационном периоде, так и в отдаленные сроки [24, 33]. Согласно рекомендациям ACC/AHA от 2013 г. по лечению ОИМпST, срочная реваскуляризация в объеме ЧКВ или АКШ при КШ рекомендована всем подходящим для этого вмешательства больным с явлениями КШ независимо от сроков начала заболевания (уровень доказательности IB). В случае невозможности выполнения реваскуляризации миокарда любым способом и в отсутствие противопоказаний рекомендовано проведение тромболитической терапии (уровень доказательности IB) [36].
Нерешенной остается проблема, касающаяся объема реваскуляризации миокарда при КШ. В рекомендациях ACC/AHA/SCAI от 2012 г. указано, что при многососудистом поражении реваскуляризация инфаркт-несвязанных артерий может быть необходима для максимальной перфузии миокарда. Как альтернативная стратегия в данном случае предпочтительнее выполнение АКШ [32]. Полная реваскуляризация миокарда при КШ по данным D. Mylotte и соавт. [33] улучшает 6-месячную выживаемость: 43,9% (реваскуляризация осуществлялась только инфаркт-связанной артерии — ИСА) против 20,4% (p
<0,002).
В исследовании GUSTO-I ЧКВ привело к 22% снижению 30-дневной летальности. При этом летальность была ниже как среди пациентов, у которых КШ развился до поступления, так и в группе больных, у которых КШ возник после поступления [25]. При анализе 2000 пациентов с КШ продемонстрировано преимущество стратегии реваскуляризации миокарда: 30-дневная летальность в группе ЧКВ и АКШ составила 38%, в то время как медикаментозная терапия сопровождалась 62% летальных исходов [4]. По данным недавнего регистра [60], в котором анализировалась госпитальная смертность среди 1333 пациентов с КШ, подвергшихся первичному ЧКВ, летальность составила 46%. Однако все эти исследования и работы были нерандомизированными. Кроме того, пациенты, включенные в группу реваскуляризации, были заведомо моложе, и соответственно с меньшим риском развития летального исхода, что и влияло на результаты лечения [21]. При анализе регистра SHOCK показано, что летальность у пожилых пациентов (76%) была выше, чем у пациентов более молодого возраста (55%; p
<0,001). Однако летальность оперированных пациентов старческого и пожилого возраста была значительно меньше, чем у больных той же возрастной категории, но без реваскуляризации миокарда: 48% против 81%;
p
=0,0002 [11].
По мнению J. Hochman и соавт. [24], критериями исключения для выполнения ЧКВ при КШ являются стеноз ИСА менее 70% с кровотоком по ней TIMI III, а также ангиографическая картина поражения с возможным высоким риском развития синдрома микроциркуляторной обструкции (no-reflow). Поражение ствола левой коронарной артерии, неподходящая анатомия для ЧКВ, множественное поражение коронарных сосудов, механические осложнения ОИМ или неудача при выполнении ЧКВ служат показанием к выполнению АКШ [24].
Однако существуют работы, в которых не продемонстрированы преимущества инвазивного лечения при КШ. Одно из небольших рандомизированных исследований SMASH (The Swiss Multicenter trial of Angioplasty Shock), включившее 55 пациентов, было досрочно приостановлено: 30-дневная летальность в группе ЧКВ составила 69% против 78% у пациентов, которым проводилась медикаментозная терапия. Спустя 12 мес летальность составила 74 и 83% соответственно. Авторам не удалось продемонстрировать преимущества экстренного ЧКВ в улучшении результатов выживаемости при КШ [53].
В исследовании SHOCK были рандомизированы 302 пациента: экстренная реваскуляризация (ЧКВ или АКШ) с медикаментозной стабилизацией (тромболитическая терапия, инотропная и вазопрессорная поддержка) и последующей отдаленной реваскуляризацией. Статистически значимых различий по 30-дневной летальности между группами реваскуляризации и медикаментозной стабилизации получено не было: 46,7% против 56% (p
=0,11).Однако в течение 6 мес и на протяжении года различия по смертности между этими двумя группами приобрели статистически значимый характер в пользу больных с экстренной реваскуляризацией: 53% против 66% (
p
<0,03) [23].
Несмотря на то что ЧКВ и АКШ являются общепринятыми подходами в лечении поражений коронарных артерий, каждая из этих стратегий реваскуляризации миокарда имеет различные задачи у пациентов с КШ. Стентирование коронарных артерий не всегда достигает высокого процента технического успеха, сопровождаясь в ряде случаев развитием синдрома no-reflow, что только ухудшает результаты ЧКВ у больных с КШ [22]. Так, кровоток TIMI III у 1333 больных с КШ, по данным немецких авторов, достигнут лишь в 75,2% случаев [60]. По данным I. Porto и соавт. [38], дополнительное периоперационное повреждение миокарда в результате дистальной эмболии (исследовали с помощью магнитно-резонансной томографии) при ЧКВ диагностировано у 23% пациентов, еще в 11% случаев причиной периоперационного инфаркта миокарда послужил механизм «snow-plowing», когда в результате имплантации стента происходит смещение атеросклеротической бляшки с компрометацией устий боковых ветвей ИСА или коллатералей [38]. Кроме того, большинство пациентов с КШ имеют трехсосудистое поражение или поражение ствола левой коронарной артерии, что делает их кандидатами для АКШ [24, 56]. Дополнительными преимуществами АКШ при КШ, по мнению ряда авторов, являются защита пораженного и ишемизированного миокарда при помощи кардиоплегии, кардиопульмональный обход для разгрузки обеих желудочков сердца и реваскуляризация неинфарктных областей сердца. Хронические окклюзии коронарных артерий, механические осложнения ОИМ также с успехом подвергаются коррекции благодаря открытой кардиохирургии [24]. В исследовании SHOCK АКШ было выполнено 47 пациентам с КШ, что составило 36% от общего числа больных, подвергшихся реваскуляризации. Выживаемость после АКШ в течение 30 сут (57,4%) не отличалась от таковой в группе ЧКВ (55,4%; p
=0,86). Спустя год выживаемость после АКШ составила 46,8% против 51,9% у пациентов после ЧКВ (
p
=0,71) [58]. По мнению J. Hochman и соавт. [24], в будущем при развитии анестезиологического пособия преимущества кардиоплегии, разработка новых и усовершенствование имеющихся устройств для поддержки кровообращения позволят значительно улучшить результаты кардиохирургического лечения при КШ [24].
Немаловажным моментом в лечении больных с ОКС является выделение факторов, наличие которых увеличивает риск развития КШ [37]. Клиническими прогностическими факторами возникновения КШ ряд авторов называют женский пол, пожилой и старческий возраст, острое нарушение мозгового кровоснабжения, стенокардию и ОИМ в анамнезе, низкую фракцию выброса левого желудочка (<35%), обширный характер инфаркта (по данным динамической оценки кардиоферментов), заболевания периферических артерий и сахарный диабет [18, 31]. В исследовании PURSUIT были оценены факторы риска развития КШ у больных с ОКС без подъема сегмента ST. Депрессия сегмента ST на исходной электрокардиограмме также является фактором риска развития КШ [19]. По данным исследования GUSTO-I [45], блокада ветвей пучка Гиса у пациентов с ОИМ приводила к более высоким летальности и частоте развития КШ. Резкое увеличение частоты развития КШ (12% против 6%; p
<0,035) отмечено у пациентов с повышенной концентрацией глюкозы в крови при поступлении. По данным проведенного анализа гипергликемия явилась наиболее сильным прогностическим фактором развития КШ [59].
В ряде работ проведены попытки выявления различных прогностических факторов летального исхода у больных с КШ. Среди независимых факторов, влияющих на летальность при КШ, разными авторами [1, 14] указываются возраст, стенокардия в анамнезе, уровень креатинина и гиперлипидемия. Кровоток по ИСА TIMI 0-I после тромболизиса и кровоток TIMI менее 3 после ЧКВ также являются неблагоприятными прогностическими факторами у пациентов с КШ [14]. Старческий возраст, поражение ствола левой коронарной артерии, трехсосудистое коронарное поражение и значительный период от начала возникновения шока до ЧКВ по данным другого регистра также являются независимыми прогностическими факторами летального исхода [60]. В работе R. Andrié и соавт. [1] проанализированы различные факторы, в том числе гуморальные, способные влиять на результаты (в первую очередь 30-дневную летальность) лечения при КШ. Среди плазменных факторов авторами выделены интерлейкин-6, прокальцитонин и N-концевой предшественник мозгового натрийуретического пептида. Концентрацию данных маркеров у шоковых больных, подвергшихся реваскуляризации и внутриаортальной баллонной контрпульсации (ВАБК), определяли при поступлении, через 24 и 72 ч. Интерлейкин-6 оказался наиболее значимым прогностическим фактором ранней послеоперационной летальности при КШ [1]. Среди других факторов, влияющих на результаты лечения при КШ, ряд авторов выделяют интерферон-γ, α-фактор некроза опухоли, макрофагальный воспалительный белок-1β, гранулоцитарный колониестимулирующий фактор и др. [41].
В отдаленном периоде после ЧКВ прогностическими факторами неблагоприятного исхода являются возраст старше 65 лет, высокие исходные уровни креатинина и глюкозы [5].
Ряд работ [14, 57] посвящен применению различных препаратов в лечении больных с КШ. Инотропная поддержка (добутамин, норепинефрин) является необходимым компонентом в комплексном лечении КШ, в случае резистентного к катехоламину КШ рекомендуется назначение левосимендана [57].
Применение блокаторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов по данным ряда работ улучшает результаты лечения ОИМпST, однако роль его в комплексном лечении ОИМ, осложненного КШ, остается неизвестной [2, 9, 16, 27]. В исследовании PURSUIT [19] показано, что шоковые пациенты, получавшие эптифибатид, имели 50% снижение 30-дневной летальности. В другой работе [2] в группе пациентов с абциксимабом 30-дневная летальность составила 18% против 42%, где данный препарат не применялся. A. Chan и соавт. [9] сравнили эффективность абциксимаба в 4 группах пациентов с КШ: группа стентирования + абциксимаб, группа изолированного стентирования, группа баллонной ангиопластики + абциксимаб и группа изолированной баллонной ангиопластики. Оценивали эффективность за 2,5 года. Летальность за указанный промежуток времени составила 33, 43, 61 и 68% соответственно. Кровоток TIMI III по ИСА достигался чаще у пациентов с использованием абциксимаба: 85% против 65%; p
=0,048 [9]. Положительные результаты применения абциксимаба (по частоте достижения кровотока TIMI III, летальности, повторным инфарктам) были также получены в работе S. Giri и соавт. [16]. Однако в исследовании P. Tousek и соавт. [51], в котором сравнивалась эффективность абциксимаба в 2 группах (обычное применение и селективное использование), преимущество его обычного введения не было продемонстрировано ни по одному из показателей 30-дневных результатов (смерть, повторный инфаркт, инсульт, почечная недостаточность). Однако значимые геморрагические осложнения встречались более чем в 2 раза чаще у пациентов с обычным применением абциксимаба: 17,5% против 7,5% (
p
=0,31) [51]. Несмотря на большинство положительных эффектов блокаторов IIb/IIIa рецепторов в лечении КШ, рандомизированных исследований по данному вопросу не проводилось.
Применению ВАБК при КШ также посвящено множество исследований, результаты которых носят противоречивый характер [10, 12, 20, 39]. Класс рекомендаций I и уровень доказательности С пользы применения ВАБК в комплексном лечении КШ имеется по данным Европейских рекомендаций, в то время как рекомендации ACC/AHA указывают на класс IIa и уровень B, в случае если КШ рефрактерен к медикаментозному лечению [36]. Внутриаортальный баллон устанавливается в нисходящей аорте, тотчас же ниже отхождения левой подключичной артерии. Принцип работы устройства заключается в механическом нагнетании крови как в проксимальном, так и в дистальном направлении, благодаря раздуванию баллона во время диастолы. Это приводит к увеличению кровотока по коронарным артериям, перфузии миокарда и обеспечению поддержки насосной функции левого желудочка. Резкое сдувание баллона во время пресистолы снижает посленагрузку на левый желудочек сердца, снижая потребление миокарда в кислороде. Частота использования ВАБК у пациентов с КШ колеблется от 20 до 98% [47, 50, 58]. В Германии ВАБК применяется примерно у ¼ пациентов с КШ [61]. В работе G. Fornaro и соавт. [12] приведен опыт лечения 20 пациентов с КШ, которым реваскуляризацию миокарда (эндоваскулярные вмешательства или АКШ), устранение дефектов межпредсердной перегородки и митральной недостаточности осуществляли на фоне ВАБК. Летальность составила 35%: умерли 7 пациентов (4 — от КШ, 1 — в результате геморрагического осложнения, 1 — от септического шока, 1 — от сердечной недостаточности после АКШ). По мнению авторов, ВАБК является полезным и необходимым компонентом в комплексном лечении больных с КШ, позволяя стабилизировать их состояние и улучшать результаты реваскуляризации миокарда [12]. В исследовании IABP SHOCK Trial пациенты с ОИМ, осложненным КШ и подвергшихся ЧКВ, были рандомизированы на 2 группы: с ВАБК и без нее. Показано, что применение ВАБК оказывало умеренное положительное влияние на состояние пациентов в соответствии со шкалой APACHE II, улучшало сердечный индекс, снижало системный воспалительный ответ, уменьшало содержание мозгового натрийуретического пептида по сравнению с больными, у которых ВАБК не применялась [39]. В более поздней работе авторами был оценен эффект применения ВАБК у 40 пациентов с КШ, которым также выполнена ЧКВ. Вызывая временное улучшение основных параметров гемодинамики у пациентов с КШ, ВАБК не приводила к статистически значимым различиям этих параметров между пациентами с ВАБК и получавшими только медикаментозное лечение. По мнению авторов [40], эффективность использования ВАБК у пациентов с КШ остается неизвестной [40].
В исследовании, проведенном T. Sanborn и соавт. [43], сравнивались четыре группы пациентов с КШ: 1-й — без тромболитической терапии и ВАБК, 2-й — только с ВАБК, 3-й — только с тромболизисом и 4-й — с ВАБК и тромболитической терапией. Тромболизис по сравнению с его отсутствием снижал госпитальную летальность (54% против 64%; p
=0,005). Такая же ситуация прослежена у пациентов с КШ и ВАБК, у которых смертность (50%) была ниже, в отличие от пациентов с КШ и без ВАБК (72%) [43]. K. Sjauw и соавт. [47] продемонстрировали опыт лечения 292 пациентов с КШ. В группе больных (
n
=93), у которых ВАБК не применялась, летальность составила 47%, в то время как среди больных (
n
=199) с ВАБК — 28%. Среди 199 больных с ВАБК также выделено две группы: 1-я — с ВАБК до выполнения ЧКВ и 2-я — ВАБК после ЧКВ, при этом летальность была выше в 1-й группе: 62% против 40% [47]. Одно из последних и наиболее крупных исследований (проспективное, открытое, многоцентровое и рандомизированное), посвященных оценке эффективности ВАБК у шоковых больных, проведено H. Thiele и соавт. [50]. В работе проанализированы результаты лечения двух групп: 1-я (
n
=298) — с применением ВАБК и 2-я (
n
=300) — оптимальная медикаментозная терапия. Реваскуляризация миокарда осуществлялась у всех изучаемых пациентов. При этом ни по 30-дневной летальности, ни по частоте развития геморрагических и ишемических осложнений, сепсиса или инсульта достоверных различий между двумя группами не получено. Применение ВАБК не снижало 30-дневную летальность при КШ (39,7% против 43,1%;
p
=0,69) [34]. Отсутствие снижения летальности, частоты различных кардиальных и сосудистых осложнений в случае применения ВАБК продемонстрированы и в других работах. В свою очередь целесообразность применения ВАБК при КШ на фоне механических осложнений ОИМ (разрыв межжелудочковой перегородки, отрыв хорды и др.) не вызывает сомнений [7].
В последних работах ставится под сомнение эффективность ВАБК в лечении КШ, а области ее применения могут максимально сократиться [20, 61].
A. Jacobs и соавт. [29] сравнили результаты лечения КШ у 881 пациента с ОИМпST (n
=729) и ОИМбпST (
n
=152). Авторы выявили, что у больных с КШ и ОИМбпST было значительно более тяжелое клиническое состояние и отягощенный анамнез: это пациенты более старших возрастных групп, которые чаще переносили ОИМ, сердечную недостаточность, реконструктивные сосудистые операции, заболевания периферических артерий в анамнезе. Реваскуляризация миокарда проводилась в обеих группах примерно в одинаковой пропорции: 36,8% при ОИМбпST и 41,9% при ОИМпST (
p
=0,277). Летальность в группе ОИМбпST составила 62,5%, что статистически значимо не отличалось от показателя при ОИМпST (60,4%). Несмотря на практически одинаковую летальность, авторы [29] указывают на пациентов с ОИМбпST и КШ как на наиболее сложную когорту больных, нуждающихся в более раннем вмешательстве и агрессивной реперфузионной терапии.
В последние годы появились работы, демонстрирующие одинаковую эффективность и безопасность радиального доступа по сравнению с феморальным для ЧКВ в лечении больных с КШ [5, 15, 42]. Помимо сравнимой эффективности использования радиального доступа, по данным T. Fujii и соавт. [15], он также продемонстрировал меньшее количество осложнений. Летальность при КШ в группе радиального доступа не отличалась от таковой у пациентов с бедренным доступом: 28,9% против 25,5% (p
=0,7) [15]. Сравнив оба доступа при лечении пациентов с КШ, I. Bernat и соавт. [5] показали, что радиальный доступ эффективен и безопасен более чем у 50% пациентов, поступающих с клиническими признаками КШ. Кроме того, применение радиального доступа привело, по данным авторов [5], к снижению годичной смертности с 64% для бедренного доступа до 44% при радиальном (
p
=0,0044). По данным O. Rodriguez-Leor и соавт. [42], радиальный доступ был успешно применен у ⅔ пациентов с КШ, продемонстрировав преимущество перед феморальным доступом по частоте развития осложнений в месте пункции, необходимости в переливании компонентов крови, летальности (32,5% против 64,3%;
p
=0,001), а также по частоте развития основных сердечно-сосудистых осложнений (смерть, инфаркт, инсульт, тяжелые кровотечения и постгипоксическая энцефалопатия) — 43,8% против 73,8% (
p
=0,001).
Применению экстракорпоральной мембранной оксигенации (ЭКМО) при КШ также посвящен ряд работ, однако большинство из них изучают применение этого метода при тяжелых респираторных расстройствах или посткардиотомическом КШ [6, 44, 49, 52]. Прибор забирает венозную кровь, насыщает ее кислородом при помощи мембранного оксигенатора и возвращает в системный артериальный кровоток. Методика является наиболее подходящей в случаях тяжелой праволевожелудочковой и сердечно-легочной недостаточности, остановки сердца. Периферическая канюляция подразумевает доступ через бедренную или яремную вену с дренированием крови в бедренную артерию; в случае центральной канюляции (преимущественно в кардиохирургии) венозная кровь забирается из правого предсердия с последующим дренированием в восходящую аорту [24]. Комбинированное применение ЭКМО и ВАБК у пациентов с КШ, леченных при помощи ЧКВ, способствовало повышению годичной выживаемости до 63,4%, в то время как изолированное использование ВАБК сопровождалось лишь 24% выживаемостью в течение года [52]. В необходимости использования ЭКМО с целью улучшения результатов лечения КШ при тромбозе ствола левой коронарной артерии указывают F. Hussain и соавт. [28]. Среди 105 пациентов технический успех применения ЭКМО достигнут у 95%, общая летальность при этом составила 7,6%, в то время как среди пациентов моложе 75 лет и без вмешательства на стволе левой коронарной артерии летальность составила 2,6% [55]. По данным F. Shawl и соавт. [46], зачастую ЭКМО является единственной альтернативой в лечении рефрактерного КШ, позволяя ⅓ пациентов быть выписанными из стационара. Недостатками данной методики являются высокий риск развития геморрагических и ишемических осложнений, обусловленный большим диаметром используемых устройств, которые устанавливаются в сосуды (16-18 F) [24].
Умеренная гипотермия (32-34 °С) в комплексном лечении больных с КШ начинает занимать уверенные позиции, демонстрируя эффективность как в экспериментальных, так и в клинических условиях. Существуют инвазивные методы (с помощью специальных теплообменных катетеров, установленных в бедренную вену) и неинвазивные способы осуществления гипотермии, когда холодная вода циркулирует через специальное теплообменное одеяло, покрывающее не менее 70% тела пациента [8, 17, 35, 48]. Умеренная гипотермия улучшает результаты лечения при КШ путем снижения потребления кислорода и использования вазопрессорной поддержки, что позволяет рекомендовать применение метода у гемодинамически нестабильных пациентов [62]. Методика также улучшает метаболические и гемодинамические параметры у пациентов с КШ [54], позитивно влияя на выживаемость при КШ [48]. Тем не менее эффективность применения гипотермии при лечении пациентов с КШ недостаточно доказана.
Таким образом, кардиогенный шок по-прежнему остается тяжелым и в большинстве случаев фатальным осложнением ОИМ и ряда других заболеваний сердца. Несмотря на развитие интервенционной кардиологии, кардиохирургии и появление различных устройств вспомогательного кровообращения, кардиогенный шок и методы его лечения нуждаются в дальнейшем изучении с проведением дополнительных рандомизированных исследований.