Признаки и симптомы ишемии головного мозга у новорожденных
Заболевание проявляет себя явными симптомами, которые обращают на себя внимание.
- Ребенок легко возбудим, плачет без причин, плохо спит, вздрагивает, у него наблюдается тремор.
- Мышечный тонус понижен, малыш мало двигается, с трудом сосет и глотает.
- Родничок увеличен, внутричерепное давление повышено из-за того, что в головном мозге скапливается жидкость.
- Возникают судороги, подергивания конечностей и головы, а также коматозные состояния с потерей координации движений, сознания.
- Кожа новорожденного приобретает мраморный оттенок.
- Нарушается работа ЖКТ – наблюдаются вздутие, запор, понос.
Церебральная ишемия при недоношенности и у доношенных детей
При доношенности и при недоношенности характер повреждений головного мозга разный. Если ребенок не выношен положенные 9 месяцев, у него есть риск перивентрикулярной лейкомаляции (ПВЛ). Это означает, что белое вещество мозга, находящееся близ желудочков, отмирает, там образуются кисты.
ПВЛ становится причиной слабоумия и детского церебрального паралича у тех, кто родился раньше 31-й недели гестации.
А у тех, кто пробыл в животе матери весь срок, в основном происходит повреждение коры мозга, то есть серого вещества. От того, где находится некротическая зона, и насколько она большая, будут зависеть последствия для ребенка. При острой и тяжелой асфиксии (удушье) вероятно повреждение ствола мозга. Потому у ребенка будут проблемы с биением сердца и с дыханием, что в части случаев вызывает летальный исход, то есть смерть.
Как возникает церебральная ишемия?
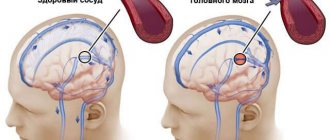
В 70% случаев ишемия возникает у плода еще в утробе матери и связана с образованием тромба в одном из сосудов, питающих головной мозг, или с недостаточным развитием сосуда. Чаще всего заболевание диагностируют у недоношенных детей, у которых сосудистая система еще не полностью сформирована.
В результате в жизненно важный орган поступает недостаточное количество крови, а вместе с ней – кислорода. Промедление с оказанием медицинской помощи ведет к поражению более крупных участков головного мозга, кровоизлиянию в мозг и другим тяжелым последствиям.
Механизм развития
Нарушение метаболизма мозговых клеток при ишемии приводит к необратимым процессам разрушения нервных структур и расстройству их деятельности. Как правило, в основе механизма формирования патологического процесса лежит стремительное снижение уровня аденозинтрифосфорной кислоты, которая является главным энергетическим источником в организме.
Нарушение мозгового кровообращения создает благоприятные условия для формирования ишемии
Для полноценного функционирования нейронов необходим баланс между концентрацией внутриклеточных и внеклеточных ионов, проникающих сквозь оболочки. Длительный дефицит кислорода создает дисбаланс трансмембранных компонентов мозга, что в дальнейшем резко изменяет концентрацию калия и натрия. Это приводит к снижению мембранных потенциалов. Параллельно с этими процессами отмечается увеличение уровня кальция, что позволяет высвободить нейромедиатор глутамат, который избыточно стимулирует мозговые рецепторы, тем самым способствуя структурным и функциональным изменениям в головном мозге.
Первой ответной реакцией организма на перинатальную недостаточность кислорода выступает увеличение кровоснабжения главных органов. Последующая артериальная гипотензия приводит к пропускному снижению церебрального кровотока.
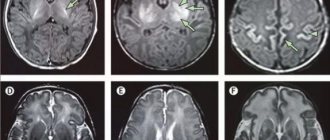
Патологические изменения головного мозга у новорождённого
Таким образом, в механизме развития патологии выделяют следующие этапы:
- Внутриутробный дефицит кислорода.
- Снижение поступления кислорода к мозгу и увеличение концентрации углекислоты.
- Увеличение кислотно-щелочной среды у плода.
- Отек внутриклеточных компонентов.
- Увеличение мозговых тканей в объеме.
- Местное снижение мозгового кровообращения.
- Общий мозговой отек.
- Повышение уровня черепного давления.
- Общие нарушения кровотока.
- Отмирание клеток головного мозга.
Механизм формирования ишемии зависит от срока рождения ребенка, что связанно с возрастными особенностями строения мозга.
Причины
В подавляющем большинстве случаев причины церебральной ишемии у новорожденных заключаются в различных нарушениях вынашивания плода в последние недели, а также в нестандартных ситуациях при родах.
- Отслоение плаценты или нарушение кровотока в ней.
- Пережатие пуповины, удушье плода.
- Врожденные пороки сердца.
- Проблемы кровообращения.
- Внутриутробная гипоксия.
- Занесение инфекции при родах.
- Открытость артериального протока.
- Острая плацентарная недостаточность.
Факторы риска
Различные сосудистые и неврологические патологии, проблемы с артериальным давлением (особенно наследственные) у матери должны насторожить врача, который ведет беременность. Также факторами риска возникновения у ребенка церебральной ишемии являются:
- возраст матери более 35 лет;
- эндокринные заболевания;
- преждевременные, затяжные роды;
- многоплодная беременность;
- поздний токсикоз;
- несоблюдение матерью здорового образа жизни;
- обострение хронических или острые заболевания у матери при вынашивании плода.
Диагностика
В основном заболевание диагностируют в течение первых нескольких часов.
О наличии патологии свидетельствуют отклонения при проверке рефлексов, общем анализе крови. Обычно анализ показывает повышенное содержание в организме углекислого газа.
При обнаружении явных симптомов тяжелого заболевания проводят магнитно-резонансную томографию, а также электроэнцефалографию, выявляющие скрытые судороги и др. отклонения в работе головного мозга.
Диагностика инфаркта миокарда у детей
Инфаркт миокарда — острое заболевание, обусловленное возникновением одного или нескольких очагов ишемического некроза в сердечной мышце в связи с абсолютной или относительной недостаточностью коронарного кровотока. Большинство педиатров и кардиологов считают, что инфаркт миокарда в детском возрасте относится к разделу казуистики. Атеросклероз коронарных артерий, являющийся основной причиной инфаркта миокарда у взрослых, у детей практически не встречается, за исключением случаев семейной гиперлипидемии [3, 6]. Именно поэтому у многих педиатров отсутствует настороженность при постановке данного диагноза. Интересно отметить, что Национальная медицинская библиотека США специально регистрирует каждый случай инфаркта миокарда у детей, описанный в мировой медицинской литературе [5].
Частота инфарктов миокарда у детей неизвестна. Однако это заболевание встречается значительно чаще, чем принято считать. Известно, например, что при врожденных пороках сердца, даже при отсутствии структурных аномалий коронарных сосудов на аутопсии, инфарктные участки в миокарде выявлялись в 75% случаев, при этом половина из них могла быть диагностирована клинически [4].
Если у взрослых основная причина инфаркта миокарда заключается в атеросклеротическом поражении коронарных артерий, то у детей этот этиологический фактор по степени распространенности занимает последнее место. Наиболее частыми причинами инфаркта миокарда являются воспалительные заболевания коронарных артерий — коронариты и аномалии развития коронарных артерий. Перечислим основные причины инфаркта миокарда у детей.
- Коронариты, в том числе: при неревматических кардитах, при инфекционных заболеваниях, болезнь Кавасаки, болезнь Такаясу, системная красная волчанка, узелковый периартериит, неспецифический аортоартериит.
- Аномалии коронарных артерий, в том числе: отхождение левой коронарной артерии от легочной (синдром Бланда-Уайта-Гарленда), аномалии числа коронарных артерий, другие аномалии коронарных артерий.
- Травма сердца и коронарных артерий.
- Феохромоцитома.
- Врожденный порок сердца (надклапанный стеноз аорты).
- Гипертрофическая кардиомиопатия.
- Опухоль сердца.
- Инфекционный эндокардит.
В настоящее время выделяют инфаркт миокарда с Q-зубцом (трансмуральный инфаркт миокарда) и инфаркт миокарда без Q-зубца (мелкоочаговый, субэндокардиальный, интрамуральный). В первом случае на ЭКГ формируется патологический зубец Q или комплекс QS, во втором — изменения касаются лишь зубца T и сегмента S-T.
В диагнозе инфаркта миокарда указываются также особенности его течения (первичный, повторный, рецидивирующий) и осложнения.
По локализации выделяют: передний (верхушечный, боковой, септальный, распространенный передний), нижний (диафрагмальный), задний и нижнебазальный. Указанные локализации относятся к левому желудочку, наиболее часто страдающему при этом заболевании. Инфаркт правого желудочка развивается крайне редко.
Клиника
Клинические проявления инфаркта миокарда любой этиологии у детей сходны: это приступы внезапного беспокойства у детей раннего возраста и типичный ангинозный статус у старших. Значительно реже инфаркт протекает без болевого синдрома. У детей при осмотре, как правило, отмечаются бледность кожных покровов, цианоз, похолодание конечностей, потливость, тахипноэ или диспноэ, артериальная гипотензия. У некоторых детей могут отмечаться признаки дисфункции желудочно-кишечного тракта, имеющие рефлекторное происхождение, — боли в животе, тошнота, рвота, диарея. Развиваются признаки недостаточности кровообращения преимущественно по малому кругу (тахикардия, одышка, кашель). Несколько реже у больных выявляется увеличение печени, реже — отеки ног, что свидетельствует о присоединении правожелудочковой недостаточности.
У некоторых детей возможно развитие кардиогенного шока (холодная кожа серо-бледного цвета, покрытая липким потом, олигоанурия, нитевидный пульс, уменьшение пульсового давления менее 20—30 мм рт. ст., снижение систолического давления). Возникающее при кардиогенном шоке снижение коронарного кровотока усугубляет снижение насосной функции сердца и течение кардиогенного шока, развития отека легких — главных причин смерти при инфаркте миокарда.
Течение инфаркта миокарда может осложняться возникновением аритмий (экстрасистолия, мерцательная аритмия, пароксизмальные тахикардии, фибрилляция желудочков), тромбоэмболиями, развитием острой и формированием хронической аневризмы сердца.
Диагностические критерии
Диагноз инфаркта миокарда подтверждается с помощью инструментальных и лабораторных методов исследования.
Известно, что электрокардиография имеет наибольшее значение для диагностики ишемии [5]. На ЭКГ в ишемической стадии отмечаются подъем сегмента S-T в так называемых «прямых» отведениях (в этих отведениях в дальнейшем будет формироваться патологический зубец Q или комплекс QS) и реципрокное снижение сегмента S-T в отведениях, в которых изменения комплекса QRS не будет. В острую фазу в «прямых» отведениях при трансмуральном инфаркте миокарда резко снижается или полностью исчезает зубец R и формируется комплекс QS. При меньшей глубине поражения некрозом стенки миокарда в «прямых отведениях» появляется патологический зубец Q (равный по амплитуде 1/3 зубца R или более, длительностью 0,04 с и более). В дальнейшем сегмент S-T возвращается к изолинии и в «прямых» отведениях формируется отрицательный «коронарный» зубец Т (рис. 1).
| Рисунок 1. ЭКГ больного с трасмуральным инфарктом миокарда нижней стенки левого желудочка и реципрокными изменениями в грудных отведениях |
При субэндокардиальном инфаркте на ЭКГ изменения ограничиваются депрессией сегмента S-T и инверсией Т в «прямых» отведениях (рис. 2).
При локализации некроза в области передней стенки левого желудочка характерны изменения на ЭКГ в отведениях I, aVL, V1-6: для инфаркта боковой стенки — в отведениях I, aVL, V5,6, при поражении области перегородки выявляют изменения в отведениях V1,2(3), при инфаркте в области верхушки сердца — в отведениях V3,4. Для инфаркта нижней стенки характерны изменения в отведениях II, III, aVF.
| Рисунок 2. ЭКГ (грудные отведения) при переднем инфаркте миокарда ез Q-зубца |
Признаком, позволяющим предположить наличие аневризмы, является так называемая «застывшая» ЭКГ: сохранение подъема сегмента S-T в сочетании с комплексом QS в «прямых» отведениях, при этом может о зубец Т.
Резорбционно-некротический синдром при инфаркте миокарда подтверждается результатами общеклинического и биохимического исследований крови: лейкоцитоз со сдвигом лейкоцитарной формулы влево, увеличения СОЭ с третьего–пятого дня, повышения в крови активности креатинфосфокиназы (КФК) и ее МВ-фракции, аминотрансфераз (особенно аспарагиновой и в меньшей степени аланиновой) и лактатдегидрогеназы (общей) и ее первого, второго изоферментов. Оценка состояния системы гемостаза и фибринолиза позволяет выявить гиперкоагуляционные изменения.
В последние годы широко используются новые маркеры — тропонин Т, тропонин I и миоглобин. Тропонин является белковым комплексом, регулирующим мышечное сокращение, и состоит из 3 субъединиц — тропонин Т, тропонин C и тропонин I. В начале 90-х гг. были разработаны иммунологические методы, позволяющие с помощью моноклональных антител различать тропонины Т и I кардиомиоцитов и других поперечно-полосатых мышечных волокон. Считается, что тропонины Т и I являются наиболее информативными и чувствительными маркерами некроза сердечной мышцы. Их уровень повышается в крови уже через 2-3 ч после инфаркта миокарда, может увеличиваться в 300–400 раз по сравнению с нормой и сохраняется повышенным в течение 10 –14 дней. К сожалению, эти методы еще очень редко используются в диагностике инфарктов миокарда у детей.
Диагноз инфаркта миокарда подтверждается данными эхокардиографии. Критериями диагностики является наличие зон акинезии (область некроза), гипокинезии, асинхронности сокращений отдельных сегментов левого желудочка в области ишемического повреждения. В дальнейшем у некоторых больных может выявляться аневризма левого желудочка. В зонах неповрежденных сегментов определяются явления дискинезии или гиперкинезии компенсаторного характера. В тех случаях, когда не удается четко визуализировать начальные участки отхождения левой коронарной артерии, можно думать об аномалии коронарных артерий. Рентгенография грудной клетки малоинформативна для диагностики инфаркта миокарда. Кардиомегалия свидетельствует об основном заболевании (кардит, врожденный порок сердца, аномальное отхождение коронарных артерий), а также может быть связана с аневризмой сердца. У пациентов с левожелудочковой недостаточностью отмечается усиление сосудистого рисунка.
Известно, что коронарография и вентрикулография дают наиболее точную диагностику поражения коронарных артерий [2]. Эти исследования позволяют четко установить локализацию, характер и степень поражения коронарных артерий, выявить снижение сократительной способности миокарда, иногда аневризму левого желудочка. К сожалению, они недостаточно используются в детской кардиологии.
В последнее время для диагностики инфаркта миокарда стали применять сцинтиграфию миокарда или позитронно-эмиссионную томографию миокарда. Эти методы позволяют неинвазивно оценить перфузию миокарда, объем и локализацию деструктивных изменений, выявить метаболические нарушения.
Воспалительные заболевания коронарных сосудов
Одной из наиболее частых причин инфаркта миокарда у детей являются воспалительные заболевания коронарных артерий — коронариты. Истинная распространенность коронаритов в связи со сложностью диагностики не известна, в большинстве случаев этот диагноз ставят на аутопсии. Воспалительный процесс чаще захватывает одновременно 3 оболочки сосуда [1]. Коронариты нередко сопутствуют кардитам и могут привести к развитию инфаркта миокарда [4]. Так, по нашим данным, у 6 детей раннего возраста на фоне течения острого кардита возникла клиника типичного инфаркта миокарда.
Острые коронариты могут встречаться при различных инфекционных заболеваниях (грипп, скарлатина, тифы и др.). Мы наблюдали мальчика С., 6 мес., с генерализованной формой сальмонеллезной инфекции, у которого через 2 нед. от начала заболевания отмечался трансмуральный инфаркт миокарда левого желудочка, с последующим развитием аневризмы левого желудочка. На рисунке 3 представлена электрокардиограмма больного С., 6 мес., с трансмуральным инфарктом миокарда, причиной которого был коронарит, возникший на фоне генерализованной сальмонеллезной инфекции.
| Рисунок 3. ЭКГ больного С., 6 месяцев |
Нередко причиной инфаркта миокарда может быть болезнь Кавасаки. Отсутствие статистических данных относительно этой болезни в России связано с недостаточной осведомленностью педиатров. Болезнь Кавасаки включена в МКБ-10 под названием «слизисто-кожно-лимфонодулярный синдром» (шифр 178.010). В настоящее время болезнь Кавасаки рассматривают как васкулит неизвестной этиологии с синдромом лихорадки и преимущественным поражением коронарных артерий, встречающийся чаще у детей раннего возраста [2, 7].
Основными критериями постановки диагноза болезни Кавасаки являются лихорадка свыше 38°С и выше на протяжении 5 дней и более в сочетании хотя бы с 4 из 5 перечисленных ниже симптомов:
- полиморфная экзантема;
- поражение слизистых оболочек полости рта (диффузная эритема слизистых полости рта, катаральная ангина и/или фарингит, «земляничный» язык, сухость и трещины губ);
- двусторонний катаральный конъюнктивит;
- острый негнойный шейный лимфаденит;
- изменение кожных покровов конечностей (гиперемия и/или отечность ладоней и стоп, шелушение кожи конечностей).
Перечисленные симптомы наблюдаются в первые 2–4 нед. заболевания. Поражение сердца может быть по типу миокардита и/или коронарита с развитием множественных аневризм и окклюзий коронарных артерий, что в последующем может привести к инфаркту миокарда. Под нашим наблюдением находились 3 ребенка с болезнью Кавасаки, коронаритом, инфарктом миокарда.
Причинами коронаритов могут быть неспецифический аортоартериит, узелковый периартериит, инфекционный эндокардит, геморрагический васкулит.
Неспецифический аортоартериит (болезнь Такаясу, болезнь отсутствия пульса, панартериит множественный облитерирующий) характеризуется воспалительными и деструктивными изменениями в стенке дуги аорты и ее ветвей, сопровождающимися их стенозированием и ишемией кровоснабжающих органов. При этом нередко отмечается и поражение коронарных артерий. В начале заболевания возникают слабость, похудание, головокружение, боль в груди и конечностях, анемия, лихорадка, перикардит, иридоциклит, отеки. В дальнейшем могут появиться жалобы на онемение конечностей, в ряде случаев присоединяется неврологическая симптоматика. При обследовании выявляется отсутствие пульса, чаще всего в зоне радиальной, ульнарной и сонной артерий. Характерна асимметрия давления. Диагностике артериита помогает аускультация сонных, подключичных артерий и брюшной аорты. Заподозрить сопутствующий коронарит помогают упорные боли в сердце, ишемические и рубцовые изменения на ЭКГ.
В патогенезе инфаркта миокарда при болезни Такаясу, наряду с коронаритом и последующим стенозированием левой или правой коронарных артерий, имеют значение артериальная гипертензия, а также относительная коронарная недостаточность из-за гипертрофии миокарда.
Мы наблюдали 2 случая инфаркта миокарда у детей с аортоартериитом. Мальчик 11 лет был направлен в стационар с подозрением на феохромоцитому. При обследовании диагноз не подтвердился. Был выявлен неспецифический аортоартериит с поражением дуги аорты, окклюзией чревного ствола, левой подключичной и обеих почечных артерий. Была произведена операция трансаортальной эндартериэктомии из аорты (супра-, интер- и инфраренальных отделов), чревного ствола, верхней брызжечной и обеих почечных артерий, пластика аорты синтетической заплатой. Через 3 нед. после операции появились жалобы на «сжимающие» боли в сердце, ребенок вновь был госпитализирован. Смерть наступила от обширного инфаркта миокарда заднебоковой стенки левого желудочка, возникшего вследствие поражения коронарных артерий.
При аортоартериите в процесс может вовлекаться и клапанный аппарат сердца. Так, у 10-летней девочки отмечались аортальная регургитация, возникшая вследствие воспаления аорты и кольца аортального клапана, поражения митрального клапана, явления миокардита с последующей трансформацией в дилатационную кардиомиопатию, с признаками недостаточности кровообращения IIБ степени. Инфаркт миокарда возник на фоне злокачественной артериальной гипертензии, обусловленной стенотической и тромботической окклюзией сонных и почечных артерий.
Поражение коронарных артерий может возникать при диффузных заболеваниях соединительной ткани. Мы наблюдали девочку С., 15,5 лет, с системной красной волчанкой (больна в течение 7 лет). У пациентки возникли давящие боли в области сердца, которые врач поликлиники объяснил остеохондрозом. И только через 2 дня была сделана ЭКГ, на которой были выявлены изменения, свидетельствующие о субэндокардиальном инфаркте миокарда боковой стенки и верхушки левого желудочка. Проведенное обследование исключило наличие антифосфолипидного синдрома как возможной причины инфаркта миокарда у больной с системной красной волчанкой. По всей вероятности, инфаркт миокарда в данном случае был связан с хроническими воспалительными изменениями в мелких или крупных венечных сосудах, которые могли привести к постепенному сужению просвета и тромбозу. Нужно заметить, что через год после перенесенного инфаркта миокарда отмечалась полная нормализация картины ЭКГ.
Аномалии коронарных артерий
Другой наиболее частой причиной развития инфаркта миокарда у детей являются врожденные аномалии развития коронарных артерий. Они могут встречаться в изолированном виде и в сочетании с врожденными пороками сердца (стеноз и коарктация аорты, тетрада Фалло и др.). Встречающиеся нередко (0,3% из общего числа невыборочных аутопсий) аномалии коронарных артерий представлены необычным числом сосудов, их устьев, расположением основных стволов. Объяснение высокой частоты врожденных аномалий можно найти в особенностях эмбрионального развития коронарной системы. Отличиями в развитии коронарных артерий в сравнении с сосудистыми образованиями в любых других органах являются слияние проксимальных (из аортолегочного ствола) и дистальных (вторичные и третичные сосуды из миокардиальных синусоидов) артерий, а также зависимость роста сосуда от роста самого миокарда. Возникновение инфаркта миокарда при врожденных аномалиях коронарных артерий обусловлено: непосредственным дефицитом перфузии миокарда; феноменом «обкрадывания» (steal-феномен); функционированием коронарной артерии в качестве венозного дренажа (коронарный свищ).
Наиболее распространенной врожденной патологией коронарных сосудов является аномальное отхождение левой коронарной артерии от легочной (АОЛКА от ЛА) — синдром Бланда-Уайта-Гарленда. Частота этого синдрома, по данным литературы, составляет 0,25—0,5% от всех врожденных пороков сердца [1, 4]. Согласно одной из гипотез, в основе данной патологии лежит неправильная закладка одной из коронарных артерий в той части ствола, из которой в дальнейшем образуется легочная артерия, деление основного ствола не нарушено. Мы наблюдали 7 больных в возрасте от 2 мес. до 6 лет, причиной инфаркта миокарда у которых являлись аномалии коронарных артерий, из них у 5 детей — аномальное отхождение левой коронарной артерии от легочной — синдром Бланда-Уайта-Гарленда.
Вопросы гемодинамики при АОЛКА от ЛА до сих пор остаются спорными. Раньше считалось, что единственным фактором, вызывающим ишемию миокарда, является снижение давления в легочной артерии после рождения, ведущее к падению перфузионного давления в аномальной левой коронарной артерии. С помощью коронарографии удалось показать, что кровь в левую коронарную артерию поступает не из легочной артерии, а через межкоронарные анастомозы из правой коронарной артерии, отходящей от аорты, т. е. возникает сброс из области высокого давления (аорта, правая коронарная артерия) в область более низкого давления (левая коронарная артерия, легочная артерия). В связи с этим выживание больных с этой патологией определяет коллатеральный кровоток в миокарде к моменту рождения и в дальнейшем. Нужно отметить, что хорошо развитые межкоронарные анастомозы не всегда способны предотвратить ишемию миокарда из-за низкого перфузионного давления в результате ухода крови через коллатерали из правой в левую коронарную артерию и далее в легочную (коронарный steal-синдром). При выраженном «синдроме обкрадывания» особенно страдает субэндокардиальный кровоток. Это является одной из причин фиброэластоза эндомиокарда при данном заболевании.
По клинико-инструментальным показателям и прогнозу выделяют 2 типа синдрома Бланда-Уайта-Гарленда: «инфантильный», с плохо развитыми коллатералями коронарных артерий, и «взрослый», при котором имеется большое количество межкоронарных анастомозов, обеспечивающих длительное выживание.
Первые клинические проявления у большинства больных можно отметить уже в первые 3 мес. жизни, реже во втором полугодии. У всех наблюдаемых нами детей с АОЛКА от ЛА отмечались приступы внезапного беспокойства, одышки, потливости, нитевидный пульс, страдальческое выражение лица. Такие приступы названы в литературе «angina pectoris» из-за сходства с клиникой стенокардии у взрослых [1]. Между приступами дети выглядели спокойно, но сохранялась одышка. Дети отставали в физическом развитии. При осмотре отмечался левосторонний сердечный горб. Границы сердца были расширены влево, верхушечный толчок разлитой, ослабленный, смещенный в шестое-седьмое межреберье. Тоны сердца приглушены, выслушивался шум недостаточности митрального клапана, причина которого, по всей вероятности, была связана с ишемией или инфарктом папиллярных мышц, дилатацией полости левого желудочка, деформацией створок митрального клапана.
Важное место в диагностике АОЛКА от ЛА отводится методу электрокардиографии. Как правило, на ЭКГ отмечается отклонение электрической оси сердца влево из-за блокады передней левой ветви пучка Гиса и выявляются характерные электрокардиографические изменения: глубокий, уширенный зубец Q в отведениях I, aVL, V5-6, максимально в aVL (рис. 4). В стадии декомпенсации изменения нередко сочетаются с подъемом сегмента S-Т выше изолинии на 3—6 мм и уменьшением амплитуды зубца R, что соответствует картине острого инфаркта. Диагностическую значимость при АОЛКА от ЛА имеет «провал» амплитуды зубца R в отведениях V3 и V4 (морфология желудочкого комплекса становится rS, QS, Qr), свидетельствующий о перенесенном инфаркте.
| Рисунок 4. ЭКГ ребенка Г., 3 мес., с АОЛКА от ЛА и верхушечно-боковым инфарктом миокарда |
На рентгенограмме органов грудной клетки у детей с АОЛКА от ЛА отмечается кардиомегалия, преимущественно за счет левых отделов. Косвенным свидетельством аномального отхождения коронарных артерий является отсутствие возможности четко визуализировать начальные участки левой коронарной артерии при ЭхоКГ [2].
Диагноз подтверждается с помощью селективной коронарографии (контрастное вещество вводят через расширенный ствол правой коронарной артерии, при этом видно ретроградное заполнение системы левой коронарной артерии через межкоронарные анастомозы, с последующим контрастированием легочной артерии).
Прогноз при АОЛКА от ЛА без операции в большинстве случаев неблагоприятный. Продолжительность жизни определяется выраженностью межкоронарных анастомозов, «синдрома обкрадывания», кардиосклероза и фиброэластоза. Если больные переживают критический период жизни (1-2 года), то в дальнейшем им проводят операцию. Дети старше 2 лет хорошо переносят перевязку левой коронарной артерии. Радикальная операция при АОЛКА от ЛА заключается в пересадке левой коронарной артерии в аорту непосредственно или через протез. Эта операция более физиологична, так как сохраняет двухкоронарную систему кровоснабжения сердца. Однако из-за анатомических особенностей она не всегда выполнима у маленьких детей.
Травма сердца и коронарных артерий
Причиной инфаркта миокарда у детей могут быть закрытые травмы сердца и коронарных артерий. Мы наблюдали 2 таких детей. Так, у 3-летнего мальчика инфаркт миокарда развился через 7 дней после сдавления грудной клетки огромной собакой. В состоянии крайней тяжести ребенок был доставлен в стационар машиной «Скорой помощи» с ошибочным диагнозом «пневмония». На ЭКГ регистрировались признаки трансмурального инфаркта миокарда передней стенки левого желудочка. Патогенез развития инфаркта миокарда при травме сердца, по всей вероятности, связан с кровоизлиянием в миокард, которое могло распространиться и на коронарные артерии с последующим развитием склеротических изменений и стенозированием. Так, у второго мальчика, 13 лет, возникло субинтимальное кровоизлияние с умеренной окклюзией левой коронарной артерии после закрытой травмы грудной клетки при автомобильной катастрофе. Особенностью этого случая явилось отдаленное (через 3 года) развитие инфаркта миокарда во время интенсивной физической нагрузки. По данным литературы, возможны также полные или частичные разрывы коронарных артерий с образованием аневризмы артерии или коронарной фистулы [8]. Сужению просвета коронарных артерий при травмах способствуют спазм и повышение агрегации тромбоцитов [9].
Следует помнить, что при закрытой травме сердца может быть повреждена проводящая система, хотя нередко признаки ее повреждения (внутрижелудочковая блокада, полная и неполная атриовентрикулярная блокада) могут появиться только через несколько месяцев или лет после травмы. Это диктует необходимость регулярного осмотра врачом в течение длительного времени (включая электрокардиографическое обследование) детей с травмами грудной клетки.
Иногда инфаркт миокарда может возникать у больных с феохромоцитомой. Развитию инфаркта миокарда в этих случаях способствует длительная гиперкатехоламинемия, которая сопровождается высокой артериальной гипертензией, гипертрофией миокарда левого желудочка, утолщением стенок коронарных артерий. Определенное значение в развитии инфаркта миокарда имеют также явления коронароспазма и гиперкоагуляционные изменения, связанные с гиперкатехоламинемией. По нашим наблюдениям, феохромоцитома была причиной развития инфаркта миокарда у мальчика 11 лет.
Нередко инфаркт миокарда встречается у детей с врожденными пороками сердца (стеноз аорты). Он может возникать вследствие дефицита коронарного кровотока. Мы наблюдали в течение нескольких лет больного с синдромом Вильямса-Бойрена, врожденным пороком сердца (надклапанный стеноз аорты), у которого в 13 лет развился инфаркт миокарда с летальным исходом.
Мы наблюдали также нескольких пациентов, у которых инфаркт миокарда осложнил течение таких тяжелых заболеваний, как гипертрофическая кардиомиопатия, опухоль сердца, инфекционный эндокардит. Так, у девочки 4 лет с инфекционным эндокардитом и крупными вегетациями на аортальном клапане течение болезни осложнилось эмболией левой коронарной артерии и развитием острого трансмурального инфаркта миокарда. Инфаркт миокарда на фоне опухоли сердца (миксома левого предсердия) развился у мальчика 6 лет.
Таким образом, другие заболевания могут осложнять развитие инфаркта миокарда, который, в свою очередь, способен влиять на течение многих серьезных заболеваний. Поэтому со стороны врачей требуется повышенное внимание в таких случаях.
По вопросам литературы обращайтесь в редакцию.
Л. В. Царегородцева, кадидат медицинских наук, доцент РГМУ, Москва
Церебральная ишемия 2 степени
Опасная форма заболевания. Для нее характерны:
- выраженные апноэ (остановки дыхания во сне);
- снижение хватательных, сосательных рефлексов;
- слабый мышечный тонус;
- увеличение формы головы за счет скопления жидкости;
- нарушение координации;
- потери сознания;
- изменения цвета кожи.
Чаще всего ишемия 2 степени проявляет себя в первые сутки жизни новорожденного, а симптомы могут наблюдаться в течение 2-4 недель. В это время за ребенком тщательно наблюдают врачи, он проходит курс терапии. При необходимости проводят хирургическую операцию по удалению тромба.
Церебральная ишемия 3 степени
Наиболее тяжелая форма, при которой:
- у младенца отсутствуют рефлексы;
- ребенок впадает в кому;
- нарушается ритм сердца;
- резко повышается артериальное давление;
- возникают проблемы с самостоятельным дыханием;
- наблюдается косоглазие.
Опытный врач уже в первые 5 минут жизни новорожденного может определить наличие признаков и симптомов церебральной ишемии 3 степени. В этом случае ребенка отправляют в реанимацию, при необходимости подключают к аппарату искусственной вентиляции легких.
Лечение церебральной ишемии у новорожденных
Цель лечения – восстановить нормальное кровообращение в тканях головного мозга, не допустить патологических изменений и устранить последствия ишемии. Для болезни 1-й степени лечение обычно заключается в назначении массажа для улучшения кровообращения.
При заболеваниях 2-ой и 3-ей степени применяют медикаментозную терапию и хирургическое вмешательство для удаления тромба в сосуде и восстановления структуры сосудистого русла. В сложных случаях младенец проходит восстановительный курс интенсивной терапии.
Лечение
На сегодня специфическая терапия, «оживляющая» умершие клетки головного мозга, не разработана. Существуют медицинские методы, которые останавливают процесс гипоксии и отмирания, чтобы ребенок не умер.
Лечение острого ишемического периода
Как уже было отмечено, церебральная ишемия тяжелая и средняя дают о себе знать сразу, симптомы специфичны. При отсутствии самостоятельного дыхания в первые 2 минуты жизни (а также при отсутствии дыхания с кислородной маской) нужно проводить реанимацию. делают интубацию и ИВЛ. Если повреждены небольшие участки мозга, то через 2-3 минуты после начала реанимации малыш уже дышит сам. Тогда ребенка дают маме. Такого маленького пациента наблюдают.
Если же реанимация занимает больше времени, то малыша относят в отделение интенсивной терапии. Там нужно постоянно следить за показаниями состояния организма, в том числе, за количеством глюкозы и гемоглобина в крови, за уровнем газов, за процессами кровообращения и биения сердца новорожденного. Для этого существует специальная аппаратура.
Противосудорожная терапия заключается в назначении специальных препаратов, например, фенитоина. Доза подбирается врачом индивидуально. Это помогает остановить судороги, и мозг не повреждается в дальнейшем. Поскольку ишемия оказывает негативное влияние не только на мозг, а страдает и сердце, то нужна специальная терапия и для этого органа. Чтобы сердечко маленького пациента не остановилось, ему вводятся добутамин и допамин.
На сегодня актуальны данные исследований о том, что температура, которая на 3-4 градуса меньше нормальной, может спасти участки мозга от отмирания, что предупреждает инвалидизацию и летальный исход. Этот метод получил название гипотермической терапии. Она практикуется не так давно, всего лишь с 2010-го года. Нужно, чтобы процесс контролировали опытные врачи. Пациента согревают постепенно.
Лечение последствий
Как уже было сказано выше, для ребенка всегда есть последствия при церебральной ишемии тяжелой и даже средней степени. Это может быть только синдром дефицита внимания. Но в других случая отмечают умственную отсталость и ДЦП. Если есть судороги, применяются специальные препараты, купирующие их. Назначаются врачом в индивидуальной дозировке, самолечение категорически запрещено.
Если у малыша появился тяжелый церебральный паралич со спастичностью конечностей, то для облегчения ситуации принимают миорелаксанты. Какие бы последствия ни были, лекарствами лечение не ограничится. Важна ежедневная реабилитация. Детям с ДЦП проводят специальные курсы массажа. Это должен делать специалист. В домашних условиях можно делать лишь часть упражнений, которые покажут родителям специалисты. Детям более старшего возраста, которые имеют диагноз ДЦП вследствие церебральной ишемии, нужна ЛФК.
Коррекция неправильные поз проводится с помощью специальных приспособлений: колясок, валиков, лонгет, специальных стульев. Если есть спастичность, ручки и ножки больного малыша могут стать не физиологично. Этого лучше избежать.
В нашей стране мало специалистов, которые могут адекватно вылечить последствия церебральной ишемии у новорожденных. Имеет место гипердиагностика. У детей в возрасте до 6 мес могут быть симптом Грефе, повышение тонуса мышц и вздрагивания. И доктора могут подумать, что это проявления энцефалопатии. Соответственно, назначат ненужное на самом деле лечение.
Новорожденных нельзя осматривать, когда они находятся в сонном состоянии или чем-то испуганы. Тогда также можно диагностировать неврологические патологии, которых нет. К ненужным препаратам, которые могут назначаться по ошибке, относятся:
- сосудистые
- ноотропы
- гомеопатия
Прогноз и последствия церебральной ишемии
Гораздо эффективнее ликвидировать саму ишемию после рождения младенца, нежели лечить ее осложнения. Среди последствий церебральной ишемии 2 степени:
- нарушения сна;
- головные боли;
- раздражительность;
- замкнутость;
- гиподинамия.
- Заболевание 3 степени имеет сложнейшие последствия:
- ДЦП;
- синдром дефицита внимания;
- умственная отсталость;
- симптом Грефе и др.
Если же все действия по устранению ишемии были проведены врачами своевременно, то симптомы проходят в течение реабилитационного периода, длящегося обычно 6-12 месяцев.
О профилактике
Для недопущения развития ишемических проявления у будущего малыша женщина обязана:
- Тщательно планировать беременность.
- Проходить необходимые обследовательские процедуры во время беременности.
- Если требуется, то по назначению доктора принимать железосодержащие препараты.
- Полностью отказаться от пагубных привычек.
- Выполнять умеренную физкультуру.
- Сбалансированно питаться, следить за режимом дня, своевременно отдыхать.
- Если беременность тяжёлая, то следует лечиться в стационаре.
Только так можно минимизировать вероятность появления церебральной ишемии ребёнка.