Софья Касацкая «Природа» №2, 2016
Об автореСофья Алексеевна Касацкая — младший научный сотрудник лаборатории геномики адаптивного иммунитета Института биоорганической химии им. академиков М. М. Шемякина и Ю. А. Овчинникова РАН. Область научных интересов — Т-клеточный иммунитет, нейро- и онкоиммунология. Победитель конкурса «Био/мол/текст» 2015 г. в номинации «Лучшая статья по иммунологии». |
Адекватная защитная реакция организма на вторжение вирусов, бактерий и других патогенов — уничтожить пораженные клетки, не допустив распространения инфекции и гибели большого числа собственных клеток. Если инфицированная вирусом клетка его заметила, запускаются процессы врожденного иммунитета: аутофагия (утилизация внутренних компонентов клетки с помощью ферментов лизосом) и апоптоз (запрограммированная гибель клеток). Однако патогенных вирусов и бактерий очень много, к тому же они постоянно меняются до неузнаваемости. Чтобы справиться с ними, подключается система адаптивного иммунитета и его главные участники — лимфоциты. Вершиной эволюции адаптивного иммунитета стал цитотоксический Т-лимфоцит, или Т-киллер. Для распознавания фрагмента вируса (антигена) на зараженной клетке он использует Т-клеточный рецептор (T cell receptor
, TCR), случайно и независимо собирающийся на каждой Т-клетке в вилочковой железе (тимусе). Механизм сборки TCR уникален и присущ только иммунной системе позвоночных животных. Считается, что эти преимущества впервые получили примитивные рыбы около 500 млн лет назад, когда в результате ретровирусной инфекции в их гаметы внедрились гены, кодирующие особые белки (рекомбиназы), ответственные за рекомбинацию генов TCR.
Классическая иммунология человека построена на изучении иммунных клеток крови просто потому, что образец крови можно взять у любого пациента и исследовать в норме и в патологии. Именно на клетках крови была выстроена классификация Т-лимфоцитов — деление на Т-киллеры и Т-хелперы, которые проверяют антигенную специфичность Т-киллеров, выдают им «лицензию на убийство» и способны управлять всем ходом иммунного ответа через сигнальные растворимые молекулы, цитокины. Позднее из ветви Т-хелперов была выделена группа регуляторных Т-клеток, подавляющих избыточный адаптивный иммунитет.
Но, как нам напоминает реклама йогурта, значительная часть клеток иммунной системы сосредоточена вокруг слизистой оболочки пищеварительного тракта и в других тканях. В то время как в 5–6 л крови взрослого человека находится около 6–15 млрд T-лимфоцитов, в эпидермисе и коже — 20 млрд Т-клеток [], в печени — еще 4 млрд []. Достаточно ли изучения образцов крови для полного описания функций Т-клеток, если в периферических органах Т-клеток больше, чем в кровотоке? И достаточно ли классических субпопуляций, чтобы описать все типы Т-клеток, находящихся в организме человека?
Т-киллеры:
Т-киллеры – самая известная субпопуляция лимфоцитов. Они обладают способностью разрушать неполноценные клетки организма, вступая с ними в непосредственный контакт. Их еще называют цитотоксические лимфоциты: «цито» в переводе означает «клетка», значение слова «токсические» объяснять не надо.
Т-киллеры, строго осуществляющие иммунный надзор, агрессивно реагируют на чужеродный белок. Именно они вызывают реакцию отторжения трансплантата при пересадке органов. По этой причине при пересадке человеку любого органа ему некоторое время дают специальные медикаменты, которые угнетают иммунную систему: уменьшают повышенное содержание лимфоцитов и нарушают их взаимодействие. Иначе любая подобная операция заканчивалась бы отторжением нового органа или ткани, а может, даже гибелью пациента, которому такое вмешательство проводится.
Интересен механизм работы этих клеток. В отличие от фагоцитов, активно атакующих, пожирающих и переваривающих чужеродные частицы, Т-киллеры ведут себя на первый взгляд достаточно сдержанно. Своими отростками они прикасаются к объекту, а затем разрывают контакт и «уходят по своим делам». Клетка же, к которой прикоснулся лимфоцит, спустя какое-то время погибает… Отчего?
Дело в том, что во время своего «смертельного поцелуя» Т-киллеры оставляют на поверхности уничтожаемой ими клетки частицы своей мембраны. В местах контакта частицы «разъедают» поверхность объекта нападения. В результате в обреченной на гибель клетке фактически образуется сквозное отверстие. Она теряет ионы калия, внутрь нее входят ионы натрия и вода – так как клеточный барьер нарушается, ее внутренняя среда начинает напрямую сообщаться с внешней… В исходе клетка раздувается проникшей внутрь ее водой, из нее выходят белки цитоплазмы, органеллы разрушаются… Она погибает, а дальше к ней подходят фагоциты и пожирают ее остатки. Вот такое страшное наказание готовит организм всем клеткам, которые были распознаны иммунитетом как «неправильные» или чужеродные.
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава Т-лимфоцитов (CD3, CD4, CD8, CD45), количества Т-регуляторных лимфоцитов (T-reg. Cells) соотношения Т – хелперы/Т – цитотоксические клетки и Т-клеток, несущих на своей поверхности маркеры активации CD38, HLA-DR. Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Синонимы русские
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-хелперы, Т-цитотоксические клетки, Т-регуляторных лимфоциты.
Синонимы английские
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells, Cytotoxic T cells, T-reg Cells, Activation markers.
Метод исследования
Проточная цитометрия.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Общая информация об исследовании
Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека — основной компонент в оценке иммунного статуса — выполняется методом проточной цитофлуориметрии.
Иммунофенотипирование — характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD-антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD-антигены (англ. cluster of differentiation antigens) — это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
СD3
Этот маркер позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов. Количественная оценка субпопуляции CD3+ лимфоцитов имеет диагностическую значимость в следующих случаях:
— первичные и вторичные иммунодефициты;
— острые вирусные инфекции, включая ВИЧ;
— внутриклеточные бактериальные и паразитарные инфекционные заболевания (например, туберкулез, лепра, лейшманиоз);
— злокачественные новообразования;
— реакции отторжения трансплантатов и болезни «трансплантат против хозяина»;
— лимфопролиферативные расстройства (острый Т-лимфобластный лейкоз).
При сахарном диабете довольно часто наблюдается снижение у больных процентного содержания и абсолютного числа СD3+ лимфоцитов.
СD4
Использование МКА к CD4 антигену дает возможность количественно охарактеризовать особый клон клеток, получивших название Т-хелперов/индукторов. СD4+ клетки в функциональном отношении делятся на два вида хелперных лимфоцитов: Т-хелперы 1-го порядка (Th1-клетки) и 2-го порядка (Th2-клетки). Различные CD4+ Т-клетки продуцируют разные наборы цитокинов. Th1-клетки (их называют еще клетками гиперчувствительности замедленного типа – ГЗТ) – цитокины для клеточного иммунного ответа: интерлейкин 2 (IL-2), IL-3, g-IFN, TNF-a, TNF-b, — среди которых дискриминантным цитокином является g-IFN. Th2 секретируют набор цитокинов, необходимый для гуморального иммунного ответа: IL-3, 4, 5, 6, 10, 13, TNF-b, — среди которых дискриминантным цитокином является IL-4.
Определение количества CD4+ клеток имеет значение в диагностике состояний, связанных с дефектами антителопродукции и реакций клеточноопосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
СD8
Дифференцировочная молекула CD8 представляет собой гликопротеин, обнаруживаемый на поверхности тимоцитов и Т-лимфоцитов и участвующий в распознавании антигенных пептидов в контексте с молекулами главного комплекса гистосовместимости (MHC) класса I.
Клиническая значимость определения количества СD8+ лимфоцитов:
- вирусные инфекции (при определенной модификации имеется возможность количественной оценки вирусоспецифических цитолитических CD8+ Т-лимфоцитов);
- при ряде заболеваний большое прогностическое значение имеет соотношение между CD4- и CD8-субпопуляциями Т-лимфоцитов (иммунорегуляторный индекс CD4/CD8); например, прогрессирующее снижение иммунорегуляторного индекса у ВИЧ-инфицированных больных может свидетельствовать о переходе в СПИД;
- злокачественные новообразования;
- оценка эффективности проведенной вакцинации (в особенности противовирусными вакцинами).
До недавнего времени приписываемая субпопуляции CD8+ клеток супрессорная активность сейчас практически полностью отвергается. По данным большинства экспериментальных и клинических исследований считается, что существование какой-либо отдельной популяции Т-супрессорных клеток, даже без привязки к CD8-маркеру, маловероятно.
При аутоиммунных тиреоидитах, в частности при диффузном токсическом зобе (ДТЗ), в реакциях клеточного иммунитета отмечается снижение субпопуляции CD8+ лимфоцитов и снижение функциональной активности цитотоксических лимфоцитов.
При сахарном диабете также отмечается уменьшение функциональной активности и количества CD8+ лимфоцитов.
Снижение фракции СD8+ лимфоцитов наблюдается также у больных с первичной хронической недостаточностью коры надпочечников (болезнь Аддисона).
Анти-HLA—DR
Молекула HLA-DR также является маркером активации и принадлежит к МНС II класса. Она представляет собой трансмембранный гликопротеин, состоящий из a- и b-субъединиц, имеющих молекулярный вес 36 и 27 кД. Анти-HLA-DR реагирует только с эпитопом HLA-DR и не имеет перекрестных реакций с молекулами HLA-DQ и HLA-DP. Он экспрессируется на В-лимфоцитах, моноцитах, макрофагах, активированных Т-лимфоцитах.
Имеются данные о том, что молекула HLA-DR экспрессируется примерно на 10 % Т-лимфоцитах ПК, однако при активации клеток митогеном количество и плотность ее экспрессии резко возрастает. Существует предположение, что молекула HLA-DR на Т-клетках может выступать в качестве рецептора, участвующего в трансдукции сигнала активированными Т-лимфоцитами. Это наводит на мысль о ее возможной роли в качестве «профессиональной» АПК, участвующей в поддержании иммунной памяти.
HLA-DR также может присутствовать на клетках эпителия тимуса, на клетках В-лимфоцит-зависимых полей селезенки и лимфатических узлов, В-клеточной лимфомы. Этот антиген имеет коэкспрессию с CD1а антигеном на клетках Лангерганса.
CD25
Антиген CD25 известен как низкоаффинный рецептор ИЛ2, имеющий молекулярную массу 55 кД.
Молекула CD25, ассоциированная с b-цепью (CD122) и общей g-цепью (CD132), формирует высокоаффинный комплекс рецептора ИЛ-2. В процессе воспаления может вырабатываться растворимая форма ИЛ-2R. Маркер CD25 присутствует на субпопуляцях Т- и В-лимфоцитов периферической крови, в том числе на активированных макрофагах, НK. Его экспрессия резко возрастает при активации ФГА и КонА на поверхности CD3-активированных Т-лимфоцитов, на Т-клетках из смешанной культуры лимфоцитов, на инфицированных HTLV Т-лимфоцитах лейкемической линии при Т-лимфоцитарной лейкемии.
Метод позволяет определить количественное соотношение основных популяций Т-лимфоцитов:
- Т-лимфоциты (CD3+CD19-);
- Т-хелперы/индукторы (CD3+CD4+CD45+);
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3+CD8+CD45+);
- соотношение Т-хелперы/ Т-цитотоксические лимфоциты (CD3+CD4+/ CD3+CD8+).
малые клеточные популяции, а также изучить их функциональную активность:
- активированные Т-лимфоциты (CD3+HLA—DR+CD45+);
- регуляторные Т-хелперные клетки (CD4+CD25brigCD45+), выполняющие иммуносупрессорную функцию
- активированные цитотоксические Т-лимфоциты (CD3+CD8brightCD38+) (% от всех Т-лимфоцитов)
- активированные Т-лимфоциты, экспрессирующие a-цепь рецептора ИЛ-2 (CD3+CD25+CD45+).
Когда назначается исследование?
Являясь реальными супрессорами, Т-регуляторные клетки играют ведущую роль во многих иммунологических процессах: регулируют Т-клеточный гомеостаз, предотвращают аутоиммунные заболевания, аллергии, гиперчувствительность, реакцию «трансплантат против хозяина». Вместе с тем регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к инфекциям.
Особый интерес представляют исследования, связанные с изучением соотношения аутоактивных клонов В-клеток и регуляторных Т-клеток при различной патологии воспалительного генеза. Так, при осложненном течении ряда патологических воспалительных процессов сохранение высокого уровня Т-reg и В1- клеток к 30-м суткам характеризует сохранение напряженности воспалительного процесса и, возможно, начало формирования дефекта функционирования Т-reg клеток, которое впоследствии может привести к хронизации воспаления и к развитию аутоиммунного процесса.
Таким образом, наличие и количественные характеристики этой популяции служат важным диагностическим признаком.
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции (сепсис, гнойные менингиты).
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит;
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
| Субпопуляция лимфоцитов | Повышение показателя | Снижение показателя |
| T-лимфоциты (CD3+CD19-) | • Острые и хронические инфекции; • гормональный дисбаланс; • длительный прием лекарственных препаратов (особенно монотерапия); • прием биологически активных добавок; • интенсивные занятия спортом; • беременность; • Т-клеточные лейкозы. | • Некоторые виды инфекций; • иммунодефицитные состояния; • алкогольный цирроз печени; • карцинома печени; • аутоиммунные заболевания; • прием иммуносупрессивных препаратов. |
| Т-хелперы (CD3+CD4+CD45+) | • Ряд аутоиммунных заболеваний; • гормональный дисбаланс; • некоторые инфекции; • отдельные Т-клеточные лейкозы; • отравление солями бериллия. | • Иммунодефицитные состояния (основной лабораторный признак вторичного иммунодефицита); • алкогольная болезнь печени; • аутоиммунные заболевания; • прием иммуносупрессивных препаратов или стероидов. |
| Т-цитотоксические лимфоциты (CD3+CD8+CD45+) | • Некоторые вирусные инфекции; • ряд Т-клеточных лейкозов; • наркоз; • острая фаза аллергии; • ряд аутоиммунных патологий. | • Некоторые виды аутоиммунных, аллергических заболеваний; • иммуносупрессивная терапия. |
| T-reg. (регуляторные Т-клетки (CD4+CD25brightCD45+) | • Различные новообразования; • лимфопролиферативные процессы; • инфекционные заболевания. | • Аутоиммунная патология (сахарный диабет 1-го типа, рассеянный склероз, ревматоидный артрит, аутоиммунный тиреоидит, неспецифический язвенный колит, болезнь Крона, миастения); • аллергические заболевания (бронхиальная астма, атопический дерматит, пищевая аллергия). |
| Активированные Т-лимфоциты (CD3+HLA-DR+CD45+) | • Инфекции; • аутоиммунная патология; • аллергия; • онкологические заболевания; • алкогольный цирроз печени; • беременность. | Не имеют диагностического значения. |
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Т-хелперы:
Задача хелперов на первый взгляд тоже довольно очевидна. Это клетки-помощники («help» значит «помогать»). А кому или чему они помогают? Они индуцируют, стимулируют иммунный ответ: под их влиянием усиливают свою работу цитотоксические лимфоциты. Также хелперы передают информацию о присутствии в теле чужеродного белка В-лимфоцитам, которые выделяют против них защитные антитела. Наконец, хелперы оказывают стимулирующее действие на работу фагоцитов, главным образом моноцитов.
Т-хелперы
Циркулирующие иммунные комплексы (ЦИК)
ЦИК – циркулирующие иммунные комплексы, уровень которых повышается при острых инфекциях, аутоиммунных заболеваниях. Циркулирующие иммунные комплексы (ЦИК) присутствуют у многих людей, страдающих системной красной волчанкой (СКВ) и ревматоидным артритом (РА), особенно в тех случаях, когда есть осложнения в виде васкулитов. Существует положительная корреляция (* систематическая и обусловленная связь) между активностью заболевания и уровнем ЦИК в крови. Формирование ЦИК представляет собой физиологический механизм защиты, приводящий к быстрому устранению либо эндогенных, либо экзогенных антигенов (например, микроорганизмы, вирусы, паразиты, растительные антигены, антигены грибов, пыльцы или пищевых продуктов) через ретикуло-эндотелиальную систему. Высокий уровень ЦИК в сыворотке и/или в других биологических жидкостях наблюдается при многих воспалительных и злокачественных заболеваниях, что может стать причиной развития патологии. Определение ЦИК в сыворотке — важный маркер для оценки активности заболевания, особенно при аутоиммунных заболеваниях.
Лимфоциты-амплификаторы:
После того как в организм проник агрессор, в крови и тканях отмечается повышенное содержание лимфоцитов. Их число возрастает буквально в течение нескольких часов и может увеличиваться более чем в 2 раза. Отчего же нарастание количества клеток происходит так быстро? Просто в организме имеется их некоторый запас.
В селезенке и тимусе живут зрелые, полноценные лимфоциты. Их отличие от остальных состоит лишь в том, что они «не определились», к какому виду лимфоцитов принадлежат. Это и есть клетки-амплификаторы, при необходимости они участвуют в увеличении численности других Т-лимфоцитов.
Использованная литература
- Литвинова, Л.С., Гуцол, А.А., Сохоневич Н.А. и др. Основные поверхностные Маркеры функциональной активности Т-лимфоцитов. Медицинская иммунология, 2014. — №1.
- Гистология (введение в патологию) / под ред. Э.Г. Улумбекова, Ю.А. Челышева, 1997. — С. 15-17, 532 -546.
- Энциклопедия клинических лабораторных тестов / под ред. Н.У. Тица. — М. : Лабинформ, 1997. — С. 214-215.
- Saraiva, D., Jacinto, A., Borralho, P. et al. HLA-DR in Cytotoxic T Lymphocytes Predicts Breast Cancer Patients’ Response to Neoadjuvant Chemotherapy. Front Immunol., 2021. — Vol. 9. — P. 2605.
Т-клетки памяти:
Справившись с очередной угрозой, лимфоциты ее запоминают. В организме человека образуется особый клон клеток, которые и хранят эти «воспоминания». Каждый клон несет в себе информацию об определенном виде угрозы. Если какой-то агрессор, с которым иммунная система уже встречалась, проникает в тело, то соответствующий клон размножается и быстро формирует вторичный иммунный ответ.
Разговор о разновидностях лимфоцитов и их функциях достаточно долгий. Здесь эта тема была представлена в максимально приемлемой и простой форме, без загрузки специфическими терминами и непонятными названиями. Будем надеяться, что любой читатель, даже не имеющий медицинского образования, примерно разобрался в том, как функционируют в его организме разные виды Т-лимфоцитов.
Из всего этого можно сделать очевидный вывод: для того чтобы жить полноценной здоровой жизнью, надо быть обладателем крепкой иммунной системы. Необходимо, чтобы процессы, о которых многие не задумываются, а еще большее количество людей даже не знает, происходили как надо.
Если природа не наградила вас устойчивым иммунитетом, вам следует задуматься о том, чтобы самостоятельно взяться за его укрепление. Для этого можно начать прием препарата Трансфер Фактор. В нем содержатся информационные молекулы, при помощи которых лимфоциты в норме общаются друг с другом, управляют различными процессами и координируют их. Восполняя недостаток естественных информационных молекул, средство является одним из самых рекомендуемых и эффективных препаратов для нормализации работы иммунитета, улучшения здоровья и профилактики заболеваний.
Клетки иммунитета обладают памятью и передают друг другу информацию
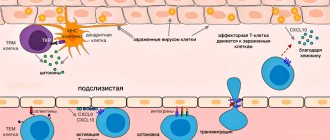
Работа резидентных Т-клеток: не стоит путать туризм с эмиграцией
Мышиные резидентные клетки тканей в нормальной ситуации почти не перемещаются внутри нелимфоидной ткани и достаточно прочно прикреплены молекулами адгезии к строме органа. Когда резидентные макрофаги той же ткани секрецией цитокинов инициируют реакцию воспаления, ТRM приобретают большую подвижность и патрулируют близлежащий эпителий в поисках зараженных клеток.
Если воспалительная реакция усиливается, то клетки понимают это как сигнал о подкреплении: к работе патрульных TRM подключаются вновь прибывающие из крови TCM- и TEM-клетки. Эти клетки крови куда более подвижны и лучше перемещаются в эпителии. Значит ли это, что именно в крови находятся готовые действовать Т-киллеры среди TEM, а CD8+ TRM выполняют в ткани хелперные и регуляторные функции?
С одной стороны, Т-хелперы по спектру Т-клеточных рецепторов более тканеспецифичны, т.е. пересечений между репертуарами TCR клеток, взятых из разных тканей, совсем мало, тогда как клетки одного клона Т-киллера встречаются в разных тканях среди TEM []. Спектр функций и репертуар антигенной специфичности TRM еще предстоит исследовать, но способности к уничтожению зараженных клеток тканей у TRM-киллеров точно есть. Более того, в модели мышиной инфекции полиомавирусом, протекающей в ткани головного мозга, аффинность вирусоспецифичных Т-клеточных рецепторов резидентных киллерных клеток выше, чем у вирусоспецифичных клеток центральной памяти [].
Однако размер популяции Т-клеток зависит не только от специфичности TCR к инфекциям, которые раньше протекали в данном органе, но и от гомеостатической пролиферации Т-клеток — размножения более удачливых клеток для заполнения емкости органа по числу Т-лимфоцитов. По маркерам CD28 и CD127 на поверхности клеток можно отличить недавно и давно активированные через TCR клетки от тех, которые получили только гомеостатический сигнал к пролиферации от фактора роста IL-7. При старении ткани гомеостатическое размножение клеток начинает преобладать над пролиферацией активированных через TCR клеток.
Независимо от Т-клеточных рецепторов часто функционируют NKT-клетки, тип резидентных клеток печени, встречающихся и в других тканях. Они могут быть активированы NK-клеточными рецепторами через распознавание не индивидуальных антигенов, а общих молекулярных паттернов опасности и тканевого стресса. При активации CD8+ NKT-клетки выделяют цитотоксические гранулы и лизируют подозрительные клетки ткани, к примеру единичные опухолевые клетки и зараженные вирусами клетки, экспрессирующие и выставляющие на внешней мембране стрессорные молекулы. При старении тенденция TRM к активации без Т-клеточного рецептора, через NK-клеточные рецепторы или цитокиновые сигналы, может приводить к ошибочному лизису клеток ткани, недостаточному контролю над хронически зараженными или перерождающимися участками эпителия.
Патологические проявления, связанные с работой резидентных Т-клеток, включают органоспецифичные аутоиммунные синдромы и синдромы хронического воспаления в ткани. Примеры хронического воспаления, поддерживаемого резидентными Т-лимфоцитами, — контактный дерматит и псориаз, а механизмом служит выделение воспалительных факторов IL-17 резидентными Т-киллерами и IL-22 резидентными Т-хелперами дермы. CD8+ эффекторные Т-киллеры, находящиеся в головном мозге, похожи по совокупности мембранных молекул-маркеров на TRM кожи, кишечника и легких и способны подталкивать развитие перемежающегося рассеянного склероза при периодических выбросах воспалительных цитокинов. Неясно, однако, есть ли в норме в головном мозге популяция TRM или же это Т-лимфоциты, оставшиеся в ткани после нейротропной вирусной инфекции [].
Функции резидентных клеток памяти в норме — при отсутствии инфекции или хронического воспаления — могут включать cross-talk
(взаимную регуляцию преимущественно через секрецию цитокинов и костимуляторные молекулы) с неклассическими малоизученными лимфоидными клетками. Ими могут быть ассоциированные со слизистыми γ/δ Т-клетки, несущие альтернативный вариант сборки Т-клеточного рецептора, или лимфоидные клетки врожденного иммунитета (
Innate Lymphoid Cells
, ILC), которые делят с Т- и В-лимфоцитами общие черты эпигенетического ландшафта, но не имеют Т-/В- или NK-клеточных рецепторов [, ].
Предполагаемые функции резидентных Т-лимфоцитов тканей. Часть функций может выполняться во взаимодействии с резидентными макрофагами
TRM клетки контактируют с антигенпрезентирующими клетками тканей — дендритными клетками кожи и резидентными макрофагами тканей. Резидентные миелоидные клетки в разных тканях дифференцированы и слабо похожи друг на друга. К примеру, макрофаги маргинальной зоны селезенки, макрофаги печени и микроглия (макрофаги мозга) будут сильно отличаться и по морфологии, и по спектру функций. Кроме обнаружения антигенов в ткани, резидентные макрофаги заняты регуляцией процессов старения и самообновления тканей, в частности, выделяют факторы роста и цитокины, стимулирующие деление стволовых клеток тканей. В жировой ткани, к примеру, макрофаги стимулируют дифференцировку новых жировых клеток, но при переходе в активированное M1-состояние запускают воспаление и вместо дифференцировки заставляют увеличиваться и набухать имеющиеся жировые клетки. Сопутствующие изменения метаболизма жировой ткани приводят к накоплению жировой массы и в последние годы связываются с механизмами развития ожирения и диабета II типа. В коже цитокины, выделяемые макрофагами и резидентными γ/δ Т-клетками, стимулируют деление стволовых клеток при регенерации эпидермиса и стволовых клеток волосяных фолликулов [, ]. Можно предположить, что хелперные TRM-клетки при патрулировании эпителия и образовании контактов с тканевыми макрофагами могут модулировать спектр и объем выделяемых последними факторов роста для стволовых клеток, воспалительных цитокинов и факторов ремоделирования эпителия — и тем самым участвовать в обновлении тканей.
Т-клетки считаются чрезвычайно важными в борьбе с аутоиммунными заболеваниями
Т-клетки считаются чрезвычайно важными в борьбе с аутоиммунными заболеваниями, особенно в случаях вируса иммунодефицита человека (ВИЧ) и синдрома приобретенного иммунодефицита (СПИД). Многие из методов лечения этих вирусов, используемых в настоящее время, включают стимуляцию производства этих клеток и их реакцию для борьбы с вредными последствиями этих состояний. Встречающиеся в природе «убийственные» Т-клетки не способны эффективно бороться с ВИЧ, поэтому ученые разработали множество методов, чтобы улучшить клетки и сделать рецепторы клеток более чувствительными к этому смертельному вирусу.
Поскольку изучение клеточных функций все еще является относительно новым, до сих пор многие ученые не понимают, что такое Т-клетки и как они работают. По мере того, как исследователи продолжают изучать эти полезные клетки, многие полагают, что станет возможным уменьшить клеточный отторжение трансплантата и улучшить лечение аутоиммунных заболеваний.
Что ещё назначают с этим исследованием?
Активированные лимфоциты (Т-лимфоциты, Т-хелперы, Т-цитотоксические клетки, иммунорегуляторный индекс, Т-активированные, NK- и B-активированные клетки)
17.54. Вен. кровь 3 дня
5 540 ₽ Добавить В корзину
Гуморальный иммунитет (иммуноглобулины IgA, IgM, IgG, IgE, циркулирующие иммунокомплексы, компоненты комплемента С3, С4)
17.51. Вен. кровь 8 дней
2 180 ₽ Добавить В корзину
Иммунный статус (скрининг) (Фагоцитарная активность лейкоцитов, клеточный иммунитет, иммуноглобулин IgE общий, иммуноглобулины IgA, IgM, IgG)
27.960. Вен. кровь 3 дня
5 450 ₽ Добавить В корзину
Клеточный иммунитет (Т-лимфоциты, Т-хелперы, Т-цитотоксические клетки, Иммунорегуляторный индекс, B-лимфоциты, NK-T-клетки, NK-клетки, Лейкоцитарная формула)
17.50. Вен. кровь 3 дня
4 140 ₽ Добавить В корзину