Инфаркт миокарда
— это острая форма ишемической болезни сердца. Суть патологии заключается в резком нарушении кровоснабжения тканей сердца и возникновении участка некроза. Современные методики позволяют своевременно реагировать на болезнь, есть эндоваскулярные и медикаментозные методы восстановления кровотока. Остается открытым вопрос своевременной постановки диагноза — ведь именно от этого зависит начало эффективных лечебных мер. Для того, чтобы определить наличие инфаркта, используется ряд методик, включая оценку клинической картины, инструментальные и лабораторные методы.
Клиническая картина патологии
Симптомы инфаркта могут быть разнообразными. Первый и главный признак — давящая боль за грудиной, которая имеет сжимающий характер, нередко пациент отмечают, что она жгучая и очень интенсивная. Боль возникает на высоте эмоционального напряжения или физической нагрузки. Её резкое возникновение приводит к общей слабости, перебоям в дыхании.
Кроме боли могут наблюдаться следующие симптомы:
- тошнота;
- потеря сознания;
- слабость;
- повышенная потливость;
- бледность.
Боль, как правило, локализуется за грудиной, но может иррадиировать в левую руку, плечо, межлопаточную область, челюсть, верхнюю часть живота. Это зависит от локализации некроза.
Различают клинические формы инфаркта:
- астматическая
У пациента наблюдается сухой кашель, одышка, боль в груди.
- абдоминальная
Боль размещена в верхней части живота, наблюдается сильная тошнота.
- аритмическая
Наблюдается сбой сердечного ритма, слабость, кратковременная потеря сознания.
церебральная
У пациента появляются жалобы на выраженную головную боль.
Есть бессимптомные формы инфаркта, они наблюдаются при сахарном диабете, а также у пациентов, которые злоупотребляют алкоголем. В таком случае может наблюдаться общая слабость и нарушения сознания, но нет типичной боли, которая характерна для инфаркта.
Растворимый ингибитор онкогенности 2
Источником sST2 является рецептор семейства интерлейкина-1, который экспрессируется в кардиомиоцитах и фибробластах при их механическом напряжении и, таким образом, рассматривается как биомаркер фиброза миокарда, растяжения сердца и ремоделирования сердечно-сосудистой системы [19–21]. Обнаружено, что sST2 имеет диагностическую и прогностическую ценность у пациентов с дестабилизированной СН, острым коронарным синдромом [21] и тяжелой хронической СН, и он был включен в рекомендации американской ассоциации кардиологов 2013 г. для дополнительной стратификации риска у пациентов с острой и хронической СН [23]. Однако диагностическая полезность sST2 у пациентов с HFpEF изучена недостаточно хорошо. K.B. Shah et al. [19] предоставили первые доказательства того, что уровни sST2 могут иметь значение у пациентов с HFpEF. Y.C. Wang et al. [24] обследовали 107 пациентов с гипертонической болезнью и HFpEF. Среди них 68 имели симптомы HFpEF. Интересно, что концентрация sST2 была значительно ниже у пациентов с E/E′ <8 по сравнению с пациентами, имевшими E/E′ 8–15 или >15. Многофакторный анализ показал, что sST2 >13,5 нг/мл связан с наличием HFpEF. P.S. Jhund et al. [25] исследовали 296 пациентов, проходивших лечение по поводу HFpEF ингибитором ангиотензинового рецептора неприлизином и блокатором рецепторов ангиотензина II с измерением sST2 (PARAMOUNT). Более высокий уровень этого биомаркера был связан с более старшим возрастом, высоким классом СН, высоким содержанием NT-proBNP, мужским полом, фибрилляцией предсердий, более низкой скоростью клубочковой фильтрации. Повышение уровня sST2 было связано с более высоким значением E/E′ и бóльшим размером ЛП. P.S. Jhund et al. [25] также выявили связь между более высоким уровнем sST2 и мужским полом, повышением класса СН и объемом ЛП.
Подводя итог исследованиям роли концентрации sST2 в HFpEF, можно заключить, что измерение его уровней полезно для стратификации риска смерти и прогноза пациентов с СН, помимо других факторов риска сердечно-сосудистых заболеваний [26]. Концентрация sST2 показала слабую корреляцию с функциональным классом СН, фракцией выброса ЛЖ, другими показателями сердечной деятельности и функцией почек [27, 28]. Таким образом, растворимый ингибитор онкогенности можно использовать в качестве биомаркера для прогнозирования HFpEF, однако необходимо больше исследований для выявления дополнительных корреляций между концентрацией sST2 в крови и другими маркерами HFpEF.
Современные методы диагностики
Если возникли подозрения на счет инфаркта, есть анамнестические данные про ишемическую болезнь сердца и характерные клинические признаки, врач назначает диагностическую программу. Она состоит из таких методов:
- электрокардиограмма;
- лабораторная диагностика.
Рассмотрим подробнее данные методы исследования.
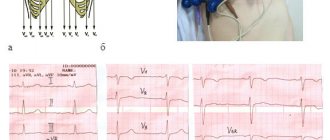
Электрокардиограмма представляет собой графическое изображение проведения импульса по волокнам миокарда. Если за счет некроза проводимость нарушена — это отобразится на записи. По изменениям на ЭКГ можно различить локализацию зоны некроза. Также, на графике можно увидеть фазу инфаркта — острую или подострую.
Общий анализ крови
В общем анализе крови не наблюдается специфических изменений и поэтому на его основе нельзя выставить диагноз. При инфаркте развивается лейкоцитоз, который возникает через несколько часов после начала процесса и достигает максимума к концу суток. Повышенный показатель удерживается несколько дней и постепенно возвращается к норме. Лейкоциты не повышаются сильно, как, например, при инфекционной патологии, что позволяет провести дифференциальную диагностику. Это важно при атипичной клинической картине инфаркта миокарда, когда врач может подозревать несколько патологий. В общем анализе крови можно также увидеть повышенный показатель СОЭ, который остается таким на протяжении нескольких недель. Повышаются и эозинофилы, они остаются повышенными около недели.
Биохимический анализ крови
Аланинаминотрансфераза (АЛТ)
Показатель разрушения гепатоцитов и кардиомиоцитов. Повышается при гепатитах различной этиологии, инфаркте, токсических поражениях внутренних органов. АЛТ — это активный компонент обмена веществ в печени, фермент, который ускоряет метаболизм аминокислот. Наибольшая концентрация вещества находится в клетках печени, почек, сердца, а также в скелетной мышечной ткани. Так как его локализация — цитоплазма, в кровь он выходит при разрушении клеточной мембраны. Чем массивнее участок разрушения, тем выше концентрация фермента в крови. Пик активности фермента при инфаркте — 12 часов.
Повышение или нормализация уровня АЛТ — маркер состояния пациентов различного профиля с заболеваниями внутренних органов и мягких тканей. В зависимости от заболевания АЛТ может повышаться умеренно или остро, например, наивысшая степень концентрации наблюдается при гепатитах.
При инфаркте применяется коэффициент де Ритиса, который состоит из сопоставления активности АСТ и АЛТ. Если показатель превышает норму, это говорит об инфаркте, а если ниже её значения — возможно развился некроз почечной ткани или активная фаза гепатита. Естественно, на основании показателя АЛТ не происходит постановка диагноза. Для этого применяются более специфические маркеры. Уровень трансаминаз проверяют в общем биохимическом анализе, для дифференциальной диагностики и контроля общего состояния пациента.
Аспартатаминотрансфераза (АСТ)
Маркер состояния тканей сердца, печени. Повышается при вирусных гепатитах, токсических поражениях тканей сердца и гепатоцитов. применяется также при профилактическом обследовании, при необходимости подтвердить или исключить инфаркт. Это вещество ответственно за обмен аминокислот в клетках, поэтому наибольшее его количество находится в клетках печени, сердца, скелетных мышцах и эритроцитах. Если клетки данных органов повреждены — происходит выход трансаминазы в кровь, где можно обнаружить её повышение. Есть допустимый уровень фермента в крови, ведь клетки органов периодически разрушаются, но при патологических состояниях этот показатель возрастает в разы и десятки раз. Пик максимальной концентрации в крови — через 12 часов после начала инфаркта. Применяется также сравнение показателей АЛт и АСТ. Каждый из этих ферментов повышается при отдельных патологиях, а при инфаркте оценивается их соотношение. АСТ не является специфическим показателем при инфаркте, он дополняет общую картину лабораторного исследования.
Креатинкиназа MB
Это вещество является изоферментом, маркером состояния сердечной мышцы. Принимает участие в метаболизме креатина и креатинфосфата. Это вещество содержится только в миокарде, поэтому повышается при его заболеваниях — миокардитах, инфаркте, рабдомиолизе, перикардитах. Уровень вещества является маркером при острой и подострой фазе процесса. Кратковременное увеличение показателя наблюдается при хирургических вмешательствах на сердце, что отражает реакцию миокарда на лечение. Максимум концентрации при инфаркте наблюдается через 12 часов после начала. Высокая активность говорит о значительном размере участка поражения. Сравнивают повышение данной фракции КФК с общим показателем вещества по организму. В принципе, оценка уровня КФК МВ применяется для ранней диагностики поражения миокарда, а также для дифференциации состояния с другими заболеваниями. Повышение маркера может говорить, кроме инфаркта, о таких состояниях, как шок, отравления и интоксикации, инфекционные поражения тканей сердца.
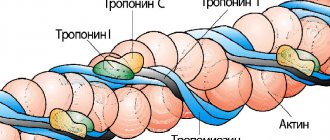
Тропонин I
Белок, который в высоком количестве содержится в скелетных мышцах и миокарде. Существуют разновидности этого белка, которые отвечают за разные фазы сокращения мышц. Все эти белки являются кардиоспецифическими и говорят о состоянии миокарда. Повреждение миоцитов сердца приводит к выходу вещества в кровь, где его можно обнаружить с помощью лабораторного исследования. Площадь некроза влияет на уровень повышения показателя тропонинов в крови. Тропонин I является наиболее чувствительным и специфическим при инфаркте. Повышенный тропонин удерживается в течении 5-6 дней после начала патологического процесса.
Миоглобин
Это белок, который находится в мышечных клетках и содержит молекулы железа. Аналогичен по строению с гемоглобином — железосодержащим белком крови. Функция миоглобина также похожа — он транспортирует кислород в миоциты, клетки мышц. При некрозе происходит разрушение мышечных клеток, миоглобин освобождается и попадает в кровоток, где его и можно обнаружить. Белок из крови выводится вместе с почками. Определить его в крови можно уже через несколько часов после начала патологического процесса, в течении 2-3 суток его все еще можно определить. Этот маркер реагирует одним из первых, что повышает его диагностическую ценность. При некротических изменениях он повышается в 7-10 раз, в зависимости от площади участка некроза. Для сравнения, период пикового повышения остальных маркеров — 12 часов, тогда как для миоглобина — 6 часов. Так же быстро происходит и нормализация анализов. Они могут оставаться повышенными дольше суток если наступили осложнения, например, расширение участка некроза. Иногда случаются новые очаги, тогда миоглобин повышается снова, что требует динамического контроля показателя. Важен также отрицательный результат исследования, что, в сопоставлении с клинической картиной позволяет исключить патологию. Кроме инфаркта, миоглобин может говорить о синдроме длительного сдавления. патологии мышц, воспалительных процессов.
Многообразие биомаркеров повреждения и ремоделирования миокарда
В настоящее время в диагностике HFpEF уделяется большое внимание биохимическим исследованиям, позволяющим оценить активность повреждения и ремоделирования миокарда. Было показано, что плазматические биомаркеры точно отражают изменения гемодинамической нагрузки на сердечную мышцу, фиброз миокарда, поэтому они могут являться значимыми для диагностики и ведения пациентов с HFpEF [4]. Например, матриксные металлопротеиназы, их тканевые ингибиторы и белки, обрабатывающие коллаген, пропептиды коллагена и телопептиды коллагена отражают изменения в гомеостазе коллагена и переход от артериальной гипертензии без поражения органов-мишеней к клинически симптоматическому HFpEF [4, 5]. Галектин-3 и растворимый ингибитор онкогенности 2 (sST2 — soluble suppression of tumorigenicity 2) отражают общую степень фиброза и тяжесть HFpEF, что позволяет их использовать для определения ранней стадии развития СН, вызванной фиброзом. Помимо вышеупомянутых маркеров, ростовой фактор дифференцировки 15 (GDF-15 — growth differentiation factor 15) и микроРНК являются перспективными новыми биомаркерами для выявления фиброза [4–7]. Рассмотрим подробнее наиболее актуальные из биомаркеров HFpEF.
Что может влиять на результат?
На результаты анализов влияет время проведения диагностики, которое прошло с момента начала заболевания. Также, изменения зависят от распространенности зоны некроза, локализации процесса. Многие лабораторные показатели, которые наблюдаются при инфаркте, могут сопровождать и другие патологические состояния. К примеру, трансаминазы повышаются при заболеваниях внутренних органов, нарушении функции печени, гепатитах различной этиологии, на фоне употребления алкоголя. Тропонин повышается при воспалительных процессах в миокарде. Креатинкиназа и миоглобин могут колебаться при нарушении структуры мышечной ткани, рабдомиолизе, различных воспалительных процессах, миозитах. Многие их этих показателей остаются повышенными после перенесенного хирургического вмешательства, что следует учитывать при сборе анамнеза у пациента.
Если есть такая возможность, анализ желательно сдавать натощак, перед сдачей крови из вены стоит немного отдохнуть. Хорошо, если до исследования удается исключить употребление алкоголя, никотина и физические нагрузки. Нужно сказать врачу, какие препараты принимались, так как они также могут отразиться на результатах анализов.
Своевременная диагностика инфаркта позволяет вовремя начать лечение. В случае с инфарктом, это особенно важно, так как счет времени идет иногда на часы. Эффективная терапия или хирургическое вмешательство могут продлить жизнь пациента, улучшить её качество и снижают риск осложнений. Необходимо доверять свое здоровье проверенным медицинским учреждениям, где есть условия для точной диагностики за короткий срок.
Введение
Несмотря на то, что сердечная недостаточность (СН) с сохранной фракцией выброса (HFpEF — heart failure with preserved ejection fraction) является весьма распространенным заболеванием во всем мире и численность пациентов с данной патологией с каждым годом лишь возрастает, многие вопросы, касающиеся наилучшего диагностического подхода, остаются без ответа. Диагностика HFpEF часто становится клинической проблемой, и это особенно актуально для амбулаторных больных на ранней стадии заболевания без явных признаков СН [1].
Согласно рекомендациям Европейского сообщества кардиологов необходимыми компонентами для постановки диагноза HFpEF являются [2]:
повышение уровня натрийуретического пептида (BNP ≥35 пг/мл или уровень NT-proBNP ≥125 пг/мл);
сохраненная фракция выброса (ФВ) левого желудочка (ЛЖ) более 50% (ФВЛЖ ≥50%);
дополнительные нарушения структуры и/или функции сердца;
индекс объема левого предсердия (ЛП) >34 мл/м2;
индекс массы ЛЖ ≥115 г/м2 для мужчин и ≥95 г/м2 для женщин;
отношение E к E′ ≥13, где Е — ранняя диастолическая скорость потока крови на митральном клапане, E′ — ранняя диастолическая скорость движения фиброзного кольца митрального клапана по результатам тканевой допплерографии;
средняя E′ в перегородке и боковой стенке ЛЖ <9 см/с.
В случае диагностических сомнений пациенту могут быть выполнены стресс-тесты или инвазивное измерение повышенного давления наполнения ЛЖ [3].
Адреномедуллин
Обращает внимание на себя малоизученный биомаркер, связанный с симпатической активностью, обладающий вазодилатирующим, иммуномодулирующим, антипролиферативным и антиапоптотическим эффектами, — адреномедуллин (ADM). [39] В настоящее время имеется не много данных относительно корреляции ADM и HFpEF. В крупном исследовании F.P. Brouwers и et al. [40] сообщали, что концевой фрагмент данной молекулы MR-proADM (mid-regional pro-adreomedullin) может помочь в диагностике и выявлении новых пациентов с HFpEF, но только после определения базового профиля сердечно-сосудистого риска в популяции HFpEF. С.М. Yu et al. [41] показали, что ADM может специфически реагировать на диастолическую дисфункцию.
Ростовой фактор дифференцировки 15
Другим биомаркером, который может быть применим в диагностике HFpEF, является GDF-15 — член суперсемейства трансформирующих факторов роста: цитокинов и маркеров повреждения клеток и воспаления. GDF-15 может быть использован в качестве нового биомаркера для оценки фиброза миокарда. В исследовании Y.M. Zhou et al. [42] после линейного корреляционного анализа было обнаружено, что экспрессия GDF-15 положительно связана со степенью фиброза сердца у больных с фибрилляцией предсердий. У пациентов с терминальной стадией неишемической дилатационной кардиомиопатии уровень GDF-15 в сыворотке коррелировал с тяжестью фиброза миокарда [43]. Экспрессия GDF-15 сильно индуцируется в кардиомиоцитах в ответ на метаболический стресс, такой как ишемия сердца, повреждение ткани или состояние перегрузки давлением [12, 44, 45]. Y. Izumiya et al. [8] выявили положительную корреляцию между концентрацией GDF-15 в сыворотке крови и функциональным классом СН, а также уровнями BNP в плазме и высокочувствительными уровнями тропонина T в сыворотке у 150 пациентов с HFpEF.
С. Sinning et al. [9] предложили формулу расчета индекса, основанного на концентрации С-реактивного белка (CRP), GDF-15, sST2 и NT-proBNP, который позволяет отличить HFpEF от HFrEF:
(CRP + GDF – 15 + sST2) / NT-proBNP.
Прогностическая ценность GDF-15 также подтверждена в недавних исследованиях. GDF-15 оставался значимым независимым предиктором СН даже после корректировки, учитывающей важные клинические предикторы, включая высокочувствительный тропонин T и NT-proBNP [46, 47]. В целом GDF-15 может служить в качестве биомаркера, помогающего дифференцировать HFpEF и HFrEF, а также как дополнительный индикатор прогноза сердечно-сосудистых осложнений.