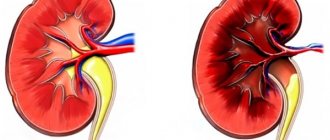
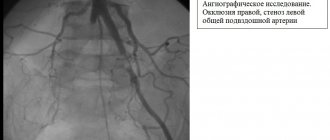
Причины вазоренальной гипертензии
Сужение почечной артерии приводит к недостаточности кровоснабжения почечной ткани. Кровоснабжение почки критически важно для организма, иначе не образуется моча и развивается почечная недостаточность. При недостатке кровотока в почке происходит высвобождение специального почечного гормона ренина, который способствует превращению ангиотензина I в ангиотензин II, что вызывает сильное сужение артерий и высвобождение гормона альдостерона, способствующего задержке натрия и увеличению объема циркулирующей крови и задержке воды.
Если вторая почка функционирует нормально, то этот эффект может нивелироваться и застоя жидкости в системном кровообращении не будет, однако при двустороннем поражении объем жидкости в организме и уровень артериального давления возрастают.
Основные заболевания ведущие к вазоренальной гипертензии
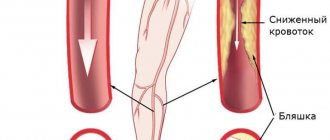
- Облитерирующий атеросклероз аорты и почечных артерий. Чаще всего атеросклероз является причиной вазоренальной гипертензии у пожилых мужчит. При обследовании выявляются мультифокальные атеросклеротические поражения в коронарных артериях, сосудах нижних конечностей.
- Фиброзно-мышечная дисплазия — развитие сужений артерий за счет соединительной ткани, без атеросклеротической бляшки. В пораженном сегменте развивается равномерное сужение, которое дальше может переходить в расширение. Чаще всего страдают молодые женщины.
- Аневризма почечной артерии. Приводит к постоянной эмболизации почечной ткани микротромбами, что приводит к развитию вазоренальной гипертензии.
- Коарктация аорты — врожденное сужение в грудной аорте ведет к снижению перфузии органов ниже сужения. Чаще всего артериальная гипертензия при коарктации аорты имеет смешанное происхождение.
Артериальная гипертензия при хронической болезни почек: современное состояние проблемы
Резюме. Артериальная гипертензия (АГ) является значимой проблемой системы здравоохранения. Это основной модифицируемый фактор риска развития сердечно-сосудистых заболеваний (ССЗ), инсульта и почечной недостаточности. Длительная и устойчивая АГ ускоряет прогрессирование заболевания почек до терминальной стадии, а прогрессирующее снижение функции почек, наоборот, способствует повышению артериального давления (АД) и ухудшению его контроля. Хроническая болезнь почек (ХБП) является как распространенной причиной гипертонии, так и осложнением неконтролируемой АГ. АГ и ХБП тесно связаны смешанными причинно-следственными связями. Поскольку АГ может быть причиной и следствием ХБП, распространенность ее выше и контролировать ее сложнее. Взаимодействие между АГ и ХБП является сложным и повышает риск неблагоприятных сердечно-сосудистых и цереброваскулярных исходов. Патофизиология АГ при ХБП сложна и представляет собой следствие множества факторов, включая снижение массы нефронов, повышенную задержку натрия и расширение внеклеточного объема, гиперактивность симпатической нервной системы, активацию гормонов, включая ренин-ангиотензин-альдостероновую систему, и эндотелиальную дисфункцию. Пациенты с ХБП чаще имеют АГ высокого риска: скрытую, резистентную и ночную гипертензию. Настоящий обзор литературы посвящен современным представлениям о распространенности, патогенезе, течении, контроле, принципах лечения АГ при ХБП. Актуальность данной проблемы связана с ростом числа больных с АГ и ХБП во всем мире и их высокой заболеваемостью и смертностью. Двунаправленный характер взаимосвязи АГ и ХБП делает перспективным изучение этих двух состояний с целью замедления темпов прогрессирования почечной и кардиальной дисфункций.
В настоящее время хроническая болезнь почек (ХБП) признана всемирной эпидемией. ХБП приводит к терминальной стадии почечной недостаточности (ТПН) и требует значительных затрат здравоохранения. По мере снижения функции почек наблюдается рост артериальной гипертензии (АГ), сопутствующей ХБП [1, 2]. АГ – глобальная проблема медицины. Это основной модифицируемый фактор риска развития сердечно-сосудистых заболеваний (ССЗ) и инсульта. ХБП является как распространенной причиной АГ, так и ее осложнением при неконтролируемом течении. Взаимодействие между АГ и ХБП является сложным, что повышает риск неблагоприятных сердечно-сосудистых и цереброваскулярных исходов [3]. Частота встречаемости кардиальных и почечных осложнений обуславливает АГ и ХБП как значимые проблемы медицины [4–6].
Распространенность АГ составляет 25–30%, ХБП – 15% среди взрослого населения [1, 5].
Частота АГ у больных с ХБП значительно выше, чем в популяции. По оценкам эпидемиологических исследований 67–71% больных этой категории имеют АГ, а у пожилых она встречается в 82% случаев [1, 7]. На поздних стадиях ХБП АГ обнаруживается у 90% больных [8]. АГ широко распространена у получающих заместительную почечную терапию (ЗПТ) [5, 7]. Встречаемость АГ у пациентов на диализе варьирует из-за различий в методах контроля артериального давления (АД): до или после диализа либо амбулаторное. Согласно многочисленным исследованиям 50–60% (до 85%) пациентов, находящихся на гемодиализе, и почти 30% больных на перитонеальном диализе страдают АГ [9, 10]. Поскольку АГ может быть причиной и следствием ХБП, распространенность ее выше и контролировать ее сложнее. На распространенность, тяжесть и контроль АГ влияют: этиология ХБП, наличие и степень альбуминурии, генетические, социально-экономические факторы и образ жизни. Кроме того, существуют расовые и этнические различия в распространенности, лечении, рисках и исходах АГ у пациентов с ХБП [5].
Патофизиология АГ при ХБП
Причинно-следственная природа АГ и ХБП носит двунаправленный характер, это тесно взаимосвязанные патофи-зиологические состояния [11–13]. Пациенты с ХБП чаще имеют фенотипы АГ высокого риска, такие как скрытая, резистентная и ночная гипертензия. При скрытой АГ чаще встречаются повреждения органов-мишеней и иные неблагоприятные события. Недавние исследования показали, что скрытая АГ при ХБП связана с повышенным риском развития гипертрофии левого желудочка (ГЛЖ), протеинурии и снижения расчетной скорости клубочковой фильтрации (СКФ). Также скрытая АГ ассоциируется с высокой ССЗ, терминальной стадией ХПН и смертностью от всех причин. Требуется дальнейшее изучение скрытой АГ, поиск рациональных методов диагностики и лечения [12–14]. Резистентную АГ определяют, когда при использовании трех антигипертензивных препаратов разных классов в оптимальных дозах (один из которых диуретик) АД сохраняется выше целевого уровня при «офисном» и «внеофисном» контроле [14–17].
Патофизиология АГ при ХБП сложна, многофакторна и представляет собой следствие множества механизмов: снижение количества нефронов, повышенная задержка натрия и увеличение внеклеточного объема, активация симпатической нервной системы и ренин-ангиотензин-альдостероновой системы, эндотелиальная дисфункция [3, 12, 18]. В последние годы появилась новая информация о гомеостазе и регуляции натрия и воды. Обсуждаются мультиорганные эффекты вазопрессина, высокосолевой диеты, ограниченного потребления воды, а также значение накопления натрия и ритмичность его выведения с мочой. Получены данные о том, что дисрегуляция обмена натрия и воды может оказывать сильное воздействие на почки и сосуды. Дезадаптация к высокосолевой диете может быть связана с неуклонным ростом частоты АГ и ХБП [19]. Хорошо известна связь между препаратами эритропоэтина (ЭПА) и АГ при ХБП. Как показывают исследования, механизм этой связи многофакторный. Так, часть пациентов с ХБП имеют ограниченную способность приспосабливаться к быстрому увеличению объема эритроцитов из-за снижения СКФ, роста сосудистого сопротивления и наличия ГЛЖ. Кроме того, существует вероятность прямого сосудосуживающего эффекта и развития индуцированной ЭПА АГ. Рекомендуется соблюдать осторожность при применении ЭПА у пациентов с резистентной АГ и отслеживать скорость повышения гемоглобина при неконтролируемом АД [20]. К основным причинам АГ у пациентов на диализе относят: увеличение объема жидкости, симпатическую гиперактивность, активацию ренин-ангиотензин-альдостероновой системы, атеросклероз, воздействия вазоактивных пептидов, происходящих из эндотелия, увеличение внутриклеточного кальция и снижение фермента реналазы, выделяющегося почкой в ответ на выброс катехоламинов [21]. Хорошо известна связь между мочевой кислотой и системной гипертензией, заболеваниями почек и ССЗ. Недавние исследования подтверждают роль изменения активности некоторых ферментов, индуцируемых мочевой кислотой, в патогенезе АГ и ХБП [22]. Все больше появляется данных относительно участия микробиоты кишечника в регуляции АД и ухудшении прогноза ХБП. Так, например, при АГ снижается количество короткоцепочечных жирных кислот, что приводит к ухудшению микробного баланса, нарушению целостности эпителиального барьера и развитию воспаления кишечника. Эти изменения нарушают регуляцию АД и, как следствие, способствуют повреждению органов-мишеней, в том числе почек. С другой стороны, при ХБП накопление уремических токсинов в кишечнике вызывает изменения в составе его микробиоты и метаболитов, способствует транспорту эндотоксинов в кровоток, усиливает воспаление, повреждение почек и ухудшает прогноз ХБП [23].
Контроль и целевое АД у пациентов с ХБП
Несмотря на то, что осведомленность о лечении АГ у пациентов с ХБП улучшается, контроль АД на всех стадиях ХБП остается неоптимальным [5]. Для диагностики АГ могут применяться как случайные, так и амбулаторные измерения АД. Использование амбулаторного мониторинга обеспечивает дополнительную оценку суточных вариаций АД, обычно наблюдаемых при ХБП [3, 7]. Контролируют АД небольшой процент больных, это определяет недостаточную приверженность к лекарственным препаратам, неоптимальный контроль объемной перегрузки и, следовательно, недостаточное лечение [18]. Около 30–60% пациентов с АГ не достигают целевых показателей АД и остаются в группе риска повреждения органов-мишеней [17]. Однако контроль за АД в популяции больных ХБП позволяет снизить риск неблагоприятных сердечно-сосудистых и церебральных событий, летальность и прогрессирование почечной недостаточности [7, 12]. Большинство современных рекомендаций касаются интенсивного контроля АД и активного антигипертензивного лечения [12, 24]. Повышение качества ведения пациентов с АГ играет важную роль в замедлении прогрессирования, улучшении прогноза и предотвращении осложнений ХБП [2]. Оптимальная цель АД при лечении АГ в целом и при ХБП в частности остается предметом дискуссий и споров, несмотря на данные многочисленных клинических исследований [3]. К наиболее значимым рекомендациям по профилактике и лечению АГ при заболеваниях почек относят те, что исходят от Инициативы по улучшению глобальных исходов заболеваний почек – Kidney Disease Improving Global Outcomes (KDIGO) (2012) и Национального почечного фонда США – United States NKF KDOQI (2004) [2]. В клинических рекомендациях KDIGO-2012 верхний уровень рекомендуемого целевого АД < 140/90 мм рт. ст. при альбуминурии < 30 г/сут и до 130/80 мм рт. ст. при альбуминурии более 30 мг/сут [1]. Совсем недавно (2017 г.) руководство Американской коллегии кардиологов (American College of Cardiology, ACC) и Американской ассоциации кардиологов (American Heart Association, AHA) по АГ установило для пациентов с ХБП и лиц с повышенным сердечно-сосудистым риском целевое АД < 130/80 мм рт. ст. На эти рекомендации повлияло исследование SPRINT (Systolic Blood Pressure Intervention Trial) [25]. Согласно SPRINT в группе недиабетических пациентов с высоким сердечно-сосудистым риском, многие из которых имели ХБП, при интенсивной антигипертензивной терапии (целевой уровень АД < 120 мм рт. ст.) кардиоваскулярные события и летальность от любой другой причины была существенно ниже, чем в группе со стандартной терапией (целевой уровень АД < 140 мм рт. ст.). Однако при изучении влияния на почечные исходы наблюдалось существенное снижение СКФ, возрастала частота гипотензии, острого повреждения почек (ОПП) у лиц на интенсивной терапии без предшествующей ХБП [25, 26]. Таким образом, АД < 130/80 мм рт. ст. является научно обоснованным, целевым АД у пациентов с ХБП [25]. Сопоставимые результаты получили D. Ettehad и соавт. при метаанализе MEDLINE. Уменьшение систолического АД сопровождалось снижением риска ССЗ и смертности от всех причин. Однако в отношении почечной недостаточности эффект оказался не значимым. Следовательно, жесткий контроль АД в отношении кардиоваскулярных исходов оправдан, но как мера нефропротекции сомнителен. Независимо от этиологии ХБП и уровня протеинурии не рекомендуется добиваться снижения АД до уровня < 120/70 мм рт. ст. При использовании тактики жесткого контроля АД необходим тщательный контроль функции почек [27].
Принципы лечения АГ при ХБП
К актуальным вопросам ведения АГ относят: контроль циркадного ритма АД, целевые показатели АД, оценку вторичных форм, ограничение потребления соли, дозирование антигипертензивных препаратов [11]. Медикаментозная терапия пациентов с ассоциированной с ХБП АГ – трудная и сложная задача, поскольку причин для развития АГ значительно больше, чем у пациентов с АГ без ХБП. Кроме того, может потребоваться исключение псевдорезистентности и других вторичных причин [3]. Информации о тактике лечения резистентной АГ на фоне ХБП в современной литературе недостаточно. Имеющиеся данные касаются поэтапной оценки питания, образа жизни, приверженности к антигипертензивной терапии. Некоторые авторы отмечают необходимость исследования роли диуретиков и антагонистов минералокортикоидных рецепторов, а также современных методов лечения, таких как денервация почек и стимуляция барорецепторов [17]. Ключевым моментом в терапии АГ у пациентов с ХБП является использование комбинации антигипертензивных препаратов с оценкой СКФ [3]. К основным подходам лечения АГ при ХБП относят: ограничение поступления соли с пищей, лечение ингибиторами ангиотензинпревращающего фермента (иАПФ) или блокаторами рецепторов ангиотензина (БРА), диуретическую терапию [11, 12]. Перспективной является разработка клинических рекомендаций по дозированию антигипертензивных препаратов перед сном у пациентов с ХБП, что поможет восстановить ночные колебания АД. [11]. Воздействие на РААС является первоочередным компонентом нефропротективной терапии. Согласно последним рекомендациям в качестве препаратов первой линии у пациентов со СКФ выше 30 мл/мин/1,73 м2 следует использовать иАПФ [1, 24]. БРА тоже относят к препаратам первой линии, применяемым в случае непереносимости иАПФ [1, 3]. БРА как в качестве монотерапии, так и при комбинированной терапии оказывают благоприятное влияние на протеинурию, очевидна их потенциальная польза в лечении АГ и ХБП. Есть данные исследования о том, что существенных изменений расчетной СКФ во время терапии БРА не наблюдается [28]. иАПФ и БРА замедляют прогрессирование ХБП за счет снижения внутриклубочкового давления и темпов развития гломерулосклероза [25]. Одновременное использование двух блокаторов РААС не показано [14]. Для достижения целевого уровня АД наряду с иАПФ рекомендуется комбинированная терапия с использованием блокаторов кальциевых каналов (БКК) и диуретиков [24]. Недигидропиридиновые БКК уменьшают альбуминурию и замедляют снижение функции почек. Дигидропиридиновые БКК не рекомендуется применять в качестве монотерапии у пациентов с протеинурической ХБП, лучше в комбинации с блокаторами РААС. Диуретики широко используются при лечении пациентов с ХБП [1]. При СКФ < 30 мл/мин/1,73 м2 тиазидные диуретики заменяются петлевыми [14]. Все остальные группы препаратов следует назначать, когда лечение первичными не эффективно [1]. Снижение АД в начале лечения АГ при ХБП приводит к уменьшению почечного перфузионного давления до 10–20%. При этом необходим тщательный контроль электролитов крови и СКФ. Снижение СКФ обычно происходит в течение первых двух недель лечения и потом стабилизируется. Если снижение СКФ имеет более тяжелый характер, лечение рекомендуется прекратить и исключить реноваскулярную патологию [14]. К новым перспективным методам лечения АГ при ХБП относят применение рекомбинантной реналазы и ее аналогов для стимуляции деградации катехоламинов, а также пребиотиков и пробиотиков для нормализации микробиоты кишечника [23, 29].
Дополнительно в комплексную терапию больных ХБП следует включать немедикаментозные подходы к лечению АГ (модификация образа жизни, диетическое ограничение соли) [1, 3]. Устранение солевой чувствительности имеет решающее значение для управления АД, поскольку наиболее частой причиной АГ при ХБП является снижение способности почек выводить соль [11]. В последнее время уделяется внимание вопросу о роли физических упражнений при ХБП. Распространенность гиподинамии у пациентов с ХБП на 12–50% выше, чем в общей популяции. По данным когортного исследования этой проблемы у больных на гемодиализе доказано преимущество аэробных нагрузок в улучшении качества жизни и здоровья. Есть данные о том, что комбинированная аэробная нагрузка помогает уменьшить воспаление и инсулинорезистентность у пациентов с АГ на ранних стадиях ХБП [4].
Для больных с ТПН, получающих лечение гемодиализом, характерны колебания АД во время процедуры. Интрадиализная гипотензия и гипертензия — это особые ситуации, связанные с повышенным риском смертности. Пациенты с интрадиализной гипертензией имеют не совсем объяснимое увеличение сосудистого сопротивления во время диализа, и в качестве первоочередного метода лечения рекомендуется более агрессивное управление объемной перегрузкой [7, 10, 30].
Интрадиализная АГ регулярно встречается у 10–15% пациентов на гемодиализе. Пациенты с интрадиализной АГ обычно имеют небольшой междиализный прирост массы тела, но регулярное превышение внеклеточного объема по данным биоимпедансной спектроскопии. У пациентов с интрадиализной АГ наблюдается более низкий уровень альбумина и преддиализной мочевины, что может способствовать снижению осмолярности плазмы, препятствующей снижению АД. Также эндотелин-1 может являться медиатором интрадиализных скачков АД. Снижение целевой «сухой» массы тела, удаление избыточного натрия, снижение натрия в диализате могут препятствовать повышению и способствовать нормализации АД у более 60% пациентов [7, 30]. Антигипертензивные препараты этой категории больных следует назначать при стойко повышенном амбулаторном АД > 140/90 мм рт. ст. [30].
Литература/References
- Kalaitzidis R. G., Elisaf M. S. Treatment of Hypertension in Chronic Kidney Disease // Curr Hypertens Rep. 2018; 20 (8): 64. DOI: 10.1007/s11906-018-0864-0.
- Cai G., Chen X. Hypertension in patients with CKD in China: clinicalcharacteristics and management // Front. Med. 2017; 11 (3): 307–309. DOI: 10.1007/s11684-017-0578-8.
- Hamrahian S. M., Falkner B. Hypertension in Chronic Kidney Disease // Adv Exp Med Biol. 2017; 956: 307-325. DOI: 10.1007/5584_2016_84.
- Barcellos F. C., Del Vecchio F. B., Reges A., Mielke G., Santos I. S., Umpierre D. et al. Exercise in Patients With Hypertension and Chronic Kidney Disease: A Randomized Controlled Trial // J Hum Hypertens. 2018; 32 (6): 397–407. DOI: 10.1038/s41371-018-0055-0.
- Horowitz B., Miskulin D., Zager P. Epidemiology of Hypertension in CKD // Adv Chronic Kidney Dis. 2015; 22 (2): 88-95. DOI: 10.1053/j.ackd.2014.09.004.
- Зуева Т. В., Жданова Т. В., Уразлина С. Е. Коморбидность почечной и кардиальной патологии // Медицинский вестник Северного Кавказа. 2019; 14 (4): 711–717. // Meditsinsky vestnik Severnogo Kavkaza. 2019; 14 (4): 711–717 (In Russ)]. DOI: https://doi.org/10.14300/mnnc.2019.14178.]
- Peco-Antic A., Paripovic D. Renal Hypertension and Cardiovascular Disorder in Children With Chronic Kidney Disease // Srp Arh Celok Lek. 2014; 142 (1–2): 113–117. DOI: 10.2298/sarh1402113p.
- Valika A., Peixoto A.J. Hypertension Management in Transition: From CKD to ESRD // Adv Chronic Kidney Dis. 2016; 23 (4): 255–61. DOI: 10.1053/j.ackd.2016.02.002.
- Agarwal R., Flynn J., Pogue V., Rahman M., Reisin E., Weir M.R. Assessment and management of hypertension in patients on dialysis // J Am Soc Nephrol. 2014; 25: 1630–646. DOI: 10.1681/ASN.2013060601.
- Van Buren P. N., Inrig J. K. Special Situations: Intradialytic Hypertension/Chronic Hypertension and Intradialytic Hypotension // Semin Dial. 2017; 30 (6): 545–552. DOI: 10.1111/sdi.12631.
- Judd E., Calhoun D. A. Management of Hypertension in CKD: Beyond the Guidelines // Adv Chronic Kidney Dis. 2015; 22 (2): 116–122. DOI: 10.1053/j.ackd.2014.12.001.
- Ku E., Lee B. J., Wei J., Weir M. R. Hypertension in CKD: Core Curriculum 2021 // Am J Kidney Dis. 2019; 74 (1): 120–131. DOI: 10.1053/j.ajkd.2018.12.044.
- Babu M., Drawz P. Masked Hypertension in CKD: Increased Prevalence and Risk for Cardiovascular and Renal Events // Curr Cardiol Rep. 2019; 21 (7): 58. DOI: 10.1007/s11886-019-1154-4.
- Williams B., Mancia G., Spiering W., Agabiti Rosei E., Azizi M., Burnier M., et al. 2021 ESC/ESH Guidelines for the management of arterial hypertension // Eur Heart J. 2018; 39: 3021-3104. DOI: 10.1093/eurheartj/ehy339.
- Carey R. M., Calhoun D. A., Bakris G. L., Brook R. D., Daugherty S. L., Dennison-Himmelfarb C. R., et al. Resistant Hypertension: Detection, Evaluation, and Management: A Scientific Statement From the American Heart Association // Hypertension. 2018; 72 (5): 53–90. DOI: 10.1161/HYP.0000000000000084.
- Whelton P. K., Carey R. M., Aronow W. S., Casey D. E. Jr., Collins K. J., Dennison Himmelfarb C., et al. 2017 ACC/AHA/AAPA/ABC/ACPM/AGS/APhA/ASH/ASPC/NMA/PCNA Guideline for the Prevention, Detection, Evaluation, and Management of High Blood Pressure in Adults: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines // Hypertension. 2018; 71 (6): 13–115. DOI: 10.1161/HYP.0000000000000065.
- Braam B., Taler S. J., Rahman M., Fillaus J. A., Greco B. A., Forman J. P., Reisin E. et al. Recognition and Management of Resistant Hypertension // Clin J Am Soc Nephrol. 2017; 12 (3): 524–535. DOI: 10.2215/CJN.06180616.
- Schmid H., Schiffl H., Lederer S. R. Erythropoiesis-stimulating Agents, Hypertension and Left Ventricular Hypertrophy in the Chronic Kidney Disease Patient // Curr Opin Nephrol Hypertens. 2011; 20 (5): 465–470. DOI: 10.1097/MNH.0b013e3283497057.
- Qian Q. Salt. Water and Nephron: Mechanisms of Action and Link to Hypertension and Chronic Kidney Disease // Nephrology (Carlton). 2018; 23 (Suppl 4): 44–49. DOI: 10.1111/nep.13465.
- Boyle S. M., Berns J. S. Erythropoietin and Resistant Hypertension in CKD // Semin Nephrol. 2014; 34 (5): 540–549. DOI: 10.1016/j.semnephrol.2014.08.008.
- Nongnuch A., Campbell N., Stern E., El-Kateb S., Fuentes L., Davenport A. et al. Increased postdialysis systolic blood pressure is associated with extracellular overhydration in hemodialysis outpatients // Kidney Int. 2015; 87: 452–457. DOI: 10.1038/ki.2014.276.
- Sharaf E. I. Din UAA, Salem M. M., Abdulazim D. O. Uric Acid in the Pathogenesis of Metabolic, Renal, and Cardiovascular Diseases: A Review // J Adv Res. 2017; 8 (5): 537–548. DOI: 10.1016/j.jare.2016.11.004.
- Felizardo R. J. F., Watanabe I. K. M., Dardi P., Rossoni L. V., Camara N. O. S. The Interplay Among Gut Microbiota, Hypertension and Kidney Diseases: The Role of Short-Chain Fatty Acids // Pharmacol Res. 2019; 141: 366–377. DOI: 10.1016/j.phrs.2019.01.019.
- Huang Q. F., Hoshide S., Cheng H. M., Park S., Park C. G., Chen C. H. et al. Characteristics On the Management of Hypertension in Asia-Morning Hypertension Discussion Group (COME Asia MHDG) Management of Hypertension in Patients With Chronic Kidney Disease in Asia // Curr Hypertens Rev. 2016; 12 (3): 181–185. DOI: 10.2174/1573402113666161122114854.
- Chang A. R., Lóser M., Malhotra R., Appel L. J. Blood Pressure Goals in Patients With CKD: A Review of Evidence and Guidelines // Clin J Am Soc Nephrol. 2019; 14 (1): 161–169. DOI: 10.2215/CJN.07440618.
- The SPRINT Research Group. A randomized trial of intensive versus standard blood-pressure control // Vnitr Lek. 2016; 62 (1): 44–47.
- Ettehad D., Emdin C. A., Kiran A., Anderson S. G., Callender T., Emberson J. et al. Blood pres-sure lowering for prevention of cardiovascular disease and death: a systematic review and meta-analysis // The Lancet. 2016; 387 (5): 957–967.
- Burnier M., Lin S., Ruilope L., Bader G., Durg S., Brunel P. Effect of Angiotensin Receptor Blockers on Blood Pressure and Renal Function in Patients With Concomitant Hypertension and Chronic Kidney Disease: A Systematic Review and Meta-Analysis // Blood Press. 2019; 28 (6): 358–374. DOI: 10.1080/08037051.2019.1644155.
- Ficek J., Malyszko J., Chudek J. Renalase and its role in the development of hypertension in patients with chronic renal failure // Przegl Lek. 2015; 72 (6): 306–308.
- Van Buren P. N. Pathophysiology and Implications of Intradialytic Hypertension // Curr Opin Nephrol Hypertens. 2017; 26 (4): 303-310.
Т. В. Зуева1, кандидат медицинских наук Т. В. Жданова, доктор медицинских наук, профессор
ФГБОУ ВО УГМУ, Екатеринбург, Россия
1 Контактная информация
DOI: 10.26295/OS.2020.19.20.002
Артериальная гипертензия при хронической болезни почек: современное состояние проблемы/ Т. В. Зуева, Т. В. Жданова Для цитирования: Лечащий врач № 9/2020; Номера страниц в выпуске: 11-14 Теги: сердечно-сосудистые заболевания, почки, обмен натрия, риск
Механизм развития
На первом этапе, немедленное повышение артериального давления является прямым следствием повышения уровня ренина в ответ на нарушение почечного кровотока. В течение нескольких недель, артериальное давление остается повышенным, однако эффект повышенного уровня ренина зависит от функции контралатеральной почки.
Нормальное функционирование контралатеральной позволяет избежать увеличение объема циркулирующей крови несмотря на повышенный уровень ренина. Обе почки находятся в оппозиции: со стороны стенозированной почки происходит удержание натрия и выделение избытка ренина в ответ на ишемию почек, в то время как не пораженная почка выводит из организма избыток натрия и воды, чтобы поддерживает нормальный объем жидкости в организме. Таким образом, имеются симптомы гипертензии и повышенного уровня ренина без существенного повышения объема циркулирующей крови (ОЦК).
На втором этапе, ишемия пораженной почки приводит к удержанию натрия и воды, что увеличивает ОЦК и позволяет поддерживать перфузионное давление в почке. Гипертония становится менее зависимой от ангиотензина II и связана с увеличением уровня натрия и воды. Уровень ренина на этом этапе может снижаться.
Если кровообращение почек удается восстанавить в течение этих двух этапо, то артериальное давление вскоре возвращается к нормальному уровню.
В третьей фазе развития вазоренальной гипетензии развиваются изменения в почечной паренхиме, поэтому даже устранение стеноза почечной артерии уже не приводит к полной нормализации системного артериального давления.
Повышение артериального давление при сужении почечной артерии является компенсаторным механизмом, позволяющим поддерживать фильтрационную и выделительную функцию почки в условиях снижения ее перфузии. Поэтому использование для снижения артериального давления препаратов, блокирующих выработку ангиотензина II (ингибиторов АПФ) может привести к развитию почечной недостаточности.
История
История изучения артериальной гипертензии берет начало в 40-х годах XVIII века. Тогда англичанин С. Хейлс определил высоту столба крови в стеклянной трубке, введенной в сонную артерию животных и человека. Через 100 лет Карл Фридрих Вильгельм Людвиг изобрел ртутный манометр для регистрации АД, а Гольдблат создал модель хронической артериальной гипертензии на собаке. В 1922 году Г. Ф. Ланг создал нейрогенную теорию артериальной гипертензии, 1948 году он же предложил термин «гипертоническая болезнь». Схема манометра Карла Людвига. copyright Farzan Filsoufi. Артериальная гипертензия является социально значимым заболеванием и важнейшим фактором риска возникновения сердечно-сосудистых осложнений. Частота в РФ составляет 39% у мужчин и 46% у женщин. При этом у мужчин артериальная гипертензия чаще наблюдается в возрасте до 40 лет, а у женщин в возрасте старше 50. А. Л. Мясников называл гипертоническую болезнь «болезнью ХХ века», в этом есть доля истины, ведь в районах современного мира, где сохраняются примитивные черты хозяйства, отмечается низкий уровень распространенности АГ.
Осложнения вазоренальной гипертензии
Вазоренальная гипертензия приводит как к осложнениям, характерным для артериальной гипертонии, так и к специфическим проблемам, связанным с плохим кровотоком в почечных артериях. При плохом контроле артериального давления могут развиться следующие осложнения:
- Аневризма аорты
- Инфаркт миокарда
- Сердечная недостаточность
- Хроническая болезнь почек
- Инсульт
- Проблемы со зрением (ретинопатия)
- Плохое кровоснабжение в ногах — критическая ишемия.
Диагностика
В большинстве случаев пациенты обращаются с жалобой на повышенное артериальное давление. Если состояние сопровождают поражения паренхимы почек или ее сосудов, врач ставит вопрос о реноваскулярной природе нарушения. Для диагностики специалист назначает следующие исследования:
- клинический анализ крови;
- общий анализ мочи;
- биохимия крови;
- проба Реберга;
- экскреторная урография;
- УЗИ почек;
- допплерография почечных сосудов;
- артериография и аортография почечных сосудов;
- спиральная КТ или МРТ.
При подозрении на онкологические заболевания почек специалист будет настаивать на проведении биопсии и гистологическом обследовании.
Прогноз
Прогноз у больных с вазоренальной гипертензией трудно определить, и он зависит от степени атеросклеротического поражения других бассейнов, индивидуальной чувствительности к антигипертензивной терапии, эффективности хирургического вмешательства. У пациентов с артериальной гипертензией, наличие атеросклероза почечной артерии является фактором значительного увеличения смертности по сравнению с общей популяцией. При развитии почечной недостаточности риск смерти возрастает еще в большей степени.
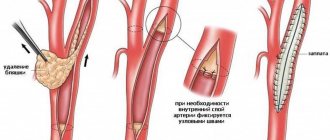
Хирургическое вмешательство на почечных артериях (ангиопластика и стентирование) дает очень хороший прогноз для пациентов с вазоренальной гипертензией. Более чем у 70% пациентов артериальное давление нормализуется, без потребности в приеме лекарственных препаратов. Еще у 25% уровень артериальной гипертензии снижается, но все же требует некоторой медикаментозной терапии. Таким образом, менее чем у 5% пациентов восстановление кровотока по почечной артерии является неэффективным.
Клиническая картина
Для почечной артериальной гипертензии характерны значительное повышение АД и сопутствующие этому состояния. Пациенты жалуются на следующие недомогания:
- постоянная жажда;
- общая слабость;
- боли в пояснице;
- частое мочеиспускание;
- повышение температура тела;
- боли при мочеиспускании.
Кроме этого, патология может сопровождаться дискомфортом, характерным для повышенного АД: головная боль, одышка, рвота, тошнота, головокружение и ухудшение зрения.
Важно понимать, что симптомы почечной артериальной гипертензии требуют медицинской помощи. Лечение по рекомендациям друзей или советам из Сети могут привести к быстрому прогрессу заболевания. Серьезное ухудшение в работе почек будет заметно уже через несколько месяцев. Такие состояния очень трудно поддаются медикаментозному лечению, поэтому своевременное обращение к врачу является залогом успешной терапии.
Стадии заболевания
Нормальное артериальное давление – 120/80 мм рт.ст. Повышение показателя до 139/89 мм рт.ст. рассматривается как пограничное состояние, а давление выше 140/90 мм рт.ст. является признаком артериальной гипертензии. Стоит отметить, что первая цифра означает степень давления в артериях при выталкивании в них крови во время сокращения сердечной мышцы. Вторая цифра относится к давлению в момент расслабления сердца.
Степень хронической почечной недостаточности оценивается по скорости клубочковой фильтрации (СКФ):
- Нулевая степень – СКФ ˃ 90 мл/мин;
- І степень – СКФ 60–89 мл/мин;
- II степень – СКФ 30–59 мл/мин;
- III степень – СКФ 15–30 мл/мин;
- IV степень – СКФ ˂ 15 мл/мин.
Кроме того, выделяют 4 стадии заболевания по клиническим проявлениям. Латентной называется стадия, на которой болезнь никак себя не проявляет. Далее следуют компенсированная и интермиттирующая стадии. Терминальная стадия характеризуется необратимыми изменениями.