Повышение моноцитов в анализе вызывает беспокойство пациентов. Опытные доктора знают, что по содержанию только одного типа клеток крови нельзя делать никакого заключения о состоянии здоровья. На вопрос, почему одни клетки повышены, а другие снижены, однозначных ответов нет.
Любые изменения анализа крови применяются в качестве дополнения к симптомам болезни, учитываются при дифференциальной диагностике и назначении лечения.
Чтобы понять, когда и какими способами повышенный уровень моноцитов вызывает патологию в организме, нужно вспомнить о роли этих клеток в поддержке здоровья.
Основные фуникци моноцитов
Повышенный уровень моноцитов в крови
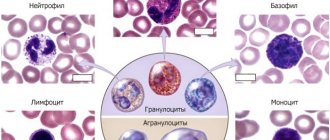
Моноциты – одноклеточные зрелые лейкоциты, образовываются в костном мозге, продолжительность их жизни не превышает трех дней. В кровяном русле они достигают максимально активного состояния. Здесь же они растут, функционируют, а по истечении примерно 70 часов перерождаются в макрофаги, после чего проникают в ближайшие ткани.
Защитно-очистительная – именно такая функция является их основной. Двигаясь по потоку крови, они находят инородные тела такие как: раковые клетки инфекции, вирусы, паразиты и пытаются их уничтожить. Для это клетка подбирается близко к обнаруженной проблеме, своим телом обволакивает ее, обезвреживает и выводит из организма. Точно также моноциты уничтожают бактерии, отмершие клетки и другие субстанции которые загрязняют человеческий организм.
Макрофаги действуют по тому же принципу, но для уничтожения вредоносных клеток им требуется больше времени.
Также моноциты принимают участие в синтезе интерферона, что делает клетки невосприимчивыми к вирусу, тем самым усиливает у организма защитные функции.
Таким образом повышение содержания моноцитов значит, что есть заболевание, с которым организм ведет усердную борьбу путем увеличения защитных клеток.
Подробное описание исследования
В случае повреждения сосудистой стенки активируется процесс свертывания крови. В этом сложном процессе задействованы многочисленные факторы свертывания крови, которые вырабатываются в основном печенью и клетками сосудистой стенки (эндотелием).
Важным моментом для остановки кровотечения является формирование «пробки», состоящей из тромбоцитов и специальных белков крови, в месте повреждения. Тромбоциты направляются к поврежденному участку, слипаются и закрывают его. Активируется каскад свертывания крови.
По мере того как каскад приближается к завершению, растворимый белок фибриноген трансформируется в нерастворимые нити фибрина. Эти нити соединяются, образуя фибриновую сетку, которая закрепляется на поврежденном участке сосуда.
Для образования стабильного фибринового сгустка в организме должно быть достаточное количество тромбоцитов и факторов свертывания крови. Но в определенный момент этот процесс должен остановиться, во избежание излишнего тромбообразования.
Чтобы контролировать процесс свертывания крови и препятствовать чрезмерному тромбообразованию, в организме есть т.н. фибринолитическая система. Одним из ее компонентов является белок плазминоген.
Плазминоген — предшественник белка плазмина. Он синтезируется преимущественно гепатоцитами. Плазминоген активируется рядом ферментов и трансформируется в плазмин, основная функция которого — растворение нитей фибрина в фибриновом сгустке. Также плазмин обеспечивает заживление поврежденных участков слизистых оболочек и кожи, очищая поверхность раны от излишков фибрина.
Плазминоген является одноцепочечным гликопротеином. Его рецепторы находятся на поверхности клеток различных типов, таких как моноциты, макрофаги, тромбоциты, фибробласты, эндотелиальные и др.
Нарушения фибринолиза (растворения фибриновых сгустков) могут провоцировать тромбозы или кровотечения.
Определение активности плазминогена в сыворотке крови используют для оценки функциональной активности фибринолитической системы крови.
Активность плазминогена увеличивается при:
- Острых воспалительных реакциях (инфекции, вирусы, травмы);
- Хирургических вмешательствах;
- Беременности.
Активность плазминогена снижается при заболеваниях печени, ДВС-синдроме (патологический процесс, характеризующийся сбоем в работе свертывающей и противосвертывающей систем крови), а также при длительной тромболитической терапии.
Также в ряде случаев у человека может быть врожденный (наследственный) дефицит плазминогена.
В норме плазминоген у беременных женщин физиологически повышается в каждом триместре. Это связано с изменением в системе гемостаза под действием гормональных факторов и необходимо для полноценного кровоснабжения плода.
Исследование уровня плазминогена необходимо для оценки нарушений системы гемостаза и определения тактики дальнейшей терапии для предотвращения возможных осложнений.
Оценку/контроль состояния фибринолитической системы проводят в процессе планирования и во время беременности.
Как определяется уровень моноцитов в крови?
Для того, чтобы установить количество моноцитов, содержащихся в крови, достаточно сдать общий анализ крови. Моноциты – это вид лейкоцитов, высчитывается лаборантом при помощи специальной лейкоцитарной формуле. Различают два показателя моноцитов:
- Абсолютное количество
– обозначается как «моноциты абс» или «моноциты mono», в расчет берется среднее количество клеток на 1 мкл (микролитр).
- Относительное количество
– обозначается как «значение» мнл/л, исчисляется в процентах
Когда необходимо обратиться к врачу и сдать ОАК?
Каких-либо специфических признаков, указывающих на то, что моноциты повышены, нет. Но при этом моноцитоз сопровождается другими болезнями, по симптомам которых можно косвенно предполагать об изменениях количество лейкоцитов.
Обратиться к врачу с последующей сдачей анализа следует в случае:
- Снижения или полной потери аппетита.
- Повышенной утомляемости и беспричинной слабости.
- Отвращения к мясным блюдам.
- Резкой потере веса.
- Бессонницы и сонливости.
- Раздражения, апатии, нервных срывов.
- Повышенной психоэмоциональной возбудимости.
- Громкой моторики ЖКТ.
- Постоянного чувства тревоги.
- Непонятных болевых ощущений в животе.
- Панических атак.
- Появления пенистых испражнений.
- Расстройства стула.
- Появления боли в суставах и мышцах.
- Кровянистых примесей в каловых массах.
- Появления прыщей на слизистых оболочках.
- Кожные высыпания.
- Наличия долгого сухого кашля с кровянистой мокротой.
- Высыпаний и покраснений на гениталиях, а также в случае обильных выделений из половых путей.
- Дискомфорта и болезненных ощущений при половом акте.
Отклонения и нормальные значения
В период от рождения до достижения 16-ти лет нормы моноцитов в крови меняются. Абсолютные значения в основном понижаются, в отличии от относительных значений, которые до 16 лет могут то понижаться, то повышаться.
| Возраст человека | Норма параметров MON |
| У новорожденного | 3-12% |
| Первые две недели жизни | Показатель увеличивается до 5-12% |
| К году | Снижается 4-10% |
| К 2-м годам | Составляет 3-10% |
| С 3-х до 16 лет | Нижняя граница остается 3%, а верхняя снижается до 1% |
| От 16 лет и до старости | от 3-11% |
Абсолютные показатели от рождения до 16 лет должны понижаться, имея первоначально от 1,9-2,4 млн./л, в конечном результате снижаются до 0,004-0,08 млн./л
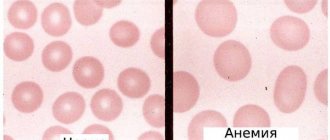
Пониженный уровень моноцитов в крови называется – моноцитопенией, повышенный – моноцитозом.
Очаг воспаления и повышенный уровень моноцитов в расшифровке обозначится как mono. Абсолютный моноцитоз – увеличение абсолютного числа моноцитов.
Процент изменения моноцитов, относительно общего числа лейкоцитов называется относительным моноцитозом. Периодически такой показатель может увеличиваться в процентном соотношении по разным причинам, к примеру очень плотный завтрак. Именно поэтому несущественные отклонения от нормы не имеют диагностического значения.
Но увеличение белых телец в пределах 13-17% могут говорить об очаге воспаления, а о серьезном инфекционно-воспалительном процессе свидетельствует показатель 18-24%.
Нормативы
Нормы у женщин и мужчин практически не отличаются. Определение абсолютного (абс.) значения на 1 л крови проводится по общему анализу и исследованию окрашенного мазка. Содержание моноцитов относительно общей суммы лейкоцитов рассчитывается в процентах и называется уровнем.
Для оценки результата важны оба показателя. При резком колебании количества других клеток, входящих в лейкоцитарную формулу, может изменяться (выше нормы или снижаться) уровень моноцитов. Хотя их абсолютное значение останется неизменным.
Анализ связи с возрастной категорией показал повышенный уровень у детей до 6-ти лет по сравнению с содержанием у взрослого человека. Более подробно о нормах количества моноцитов в крови ребенка можно почитать здесь.
Для взрослых нормальным абсолютным показателем считаются значения от нуля до 0,08х109/л, для ребенка допустимо от 0,05 до 1,1 х 109/л.
В формуле лейкоцитов нормальным считается процент моноцитов у детей – 2-12% после рождения, в первые 2 недели – 5–15%, у взрослых – 3-11%. Аналогичный показатель при беременности не выходит за пределы нормы:
- первый триместр в среднем 3,9%;
- второй — 4,0;
- третий — 4,5.
Любой показатель, превышающий верхнюю границу, называется моноцитозом и имеет свои физиологические и патологические причины
Причины повышения моноцитов
Абсолютный моноцитоз может развиться у взрослого человека в следующих случаях:
- При хронических заболеваниях кишечника, таких как болезнь Крона, язвенные колики, воспаление тонкого кишечника.
- Тяжелых хронических заболеваний: ревматоидный или псориатический артрит, красная волчанка.
- Отравление веществами в состав которых входят: фосфор, хлор или их соединения.
- Заражения инфекционными заболеваниями: бруцеллез, сифилис, сальмонеллез, туберкулез, ветрянка, дизентерия, краснуха, грипп, коклюш.
- Ревматологических заболеваний.
- Ревматизма, эндокардита.
- Болезней крови: хронический миелолейкоз, остеомиелофиброз, полицитемия, тромбоцитопеническая пурпура, острый лейкоз.
- Развитие сепсиса или наличие гнойных очагов.
- Проникновение в организм паразитов и вирусов.
- Травм.
- Злокачественных новообразований лимфосистемы: лимфомы, лимфогранулематоза.
- Инфаркта миокарда.
- Развития грибковых заболеваний.
Также превышение нормы моноцитов наблюдается у пациентов в послеоперационный период и в восстановительный период после перенесенных инфекционных заболеваний. Недосыпания, стрессы, сытная еда перед сдачей анализа, чрезмерные физические нагрузки могут являться причиной увеличения моноцитов. Поэтому необходимо учитывать эти данные во время сдачи ОАК.
У мужчин
Никаких специфических причин повышающих уровень моноцитов у мужчин нет. Страдать моноцитозом могут мужчины которые часто испытываю стресс, очень много работают, и работа тесно связано с психическими напряжениями и чрезмерными нервами.
У женщин
Повышенные моноциты в организме женщины говорят о наличии инфекционных заболеваний, а также различных воспалительных процессах. Нормы отклонения лейкоцитов не зависят от пола, однако у женщин в отличие от мужчин моноциты могут увеличиваться из-за особенностей репродуктивной системы: при менструации или овуляции это связано с гормональным скачком.
У беременных
В период беременности и лактации уровень лейкоцитов имеет особо важное значение для организма женщины. Это связано с тем, что теперь защитную функцию нужно выполнять не только для материи, но и для плода внутри нее, а после появления малыша на свет они помогают женщине восстановить силы быстрее. Во время беременности в организме женщины происходит перестройка иммунной и эндокринной системы, а также часто меняется гормональный фон, так соотношение всех типов лейкоцитов изменяется.
Уровень нижних моноцитов в первом триместре беременности падает до 1%. Но спустя всего несколько недель снова увеличивается до 3%, таким показатель остается до последнего триместра, в котором из-за изменения гормонального фона в связи с подготовкой организма к родам, уровень моноцитов может возрасти. Сразу после родов уровень падает, но позже снова поднимается, что означает что организм начал восстанавливаться после родов.
У детей
Нормы содержания моноцитов в крови у детей в сравнении со взрослыми завышены, самый высокий наблюдается у новорожденных. Однако волноваться не о чем если возрастные нормы не превышены или уровень отклонения не выше 10%. Увеличение такое показателя может говорить о наличии инфекционных или вирусных заболеваний, заражении гельминтами. Зачастую причиной увеличения лейкоцитарных норм могут стать смена молочных зубов на коренные, это связано с образованием новых тканей.
Также повышение моноцитов может быть связано с наследственными факторами, с послеоперационным периодом и наличием более тяжелых заболеваний, например, лейкоза. Стоит обратить внимание, что у детей чаще наблюдается пониженный уровень лейкоцитов (моноцитопения), чем моноцитоз, это является более опасным и может говорить об истощении организма и слабой сопротивляемости к вредным факторам.
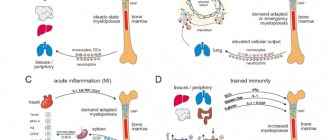
В соответствии с «М1/М2» парадигмой выделяют два подтипа активированных макрофагов – классически активированные (М1) и альтернативно активированные (М2), которые экспрессируют различные рецепторы, цитокины, хемокины, факторы роста и эффекторные молекулы. Однако данные последних лет указывают на то, что в ответ на изменение сигналов микроокружения, макрофаги могут проявлять уникальные свойства, не позволяющие отнести их ни к одному из этих подтипов.
Макрофаги играют главную роль в реакции организма на имплантируемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты. Макрофаги фагоцитируют частицы износа поверхности суставных протезов, инициируют воспаление в зоне протезирования и остеолиз, управляют процессами образования фиброзной капсулы вокруг инородных тел. Представлен краткий обзор факторов, вызывающих миграцию, адгезию и активацию макрофагов, анализ их функциональных характеристик на различных поверхностях, включая биодеградирующие и не деградирующие материалы in vivo и in vitro.
Введение
Современную медицину в настоящее время невозможно представить без применения имплантируемых изделий, устанавливаемых в организм на различные сроки с целью восстановления анатомии и функции утраченных или пораженных патологическим процессом органов и тканей. Биосовместимость синтетических материалов или тканеинженерных конструкций является основной проблемой, влияющей на результаты таких имплантаций. Реакция на протезирующий материал развивается в следующей последовательности: альтерация тканей, инфильтрация клетками острого, затем хронического воспаления с формированием грануляционной ткани и фиброзной капсулы. Степень выраженности этих реакций определяет биосовместимость имплантируемого изделия. Макрофаги играют главную роль в реакции организма на устанавливаемый материал – катетеры, стенты, эндопротезы, дентальные имплантаты и др.
Морфология макрофагов
Макрофаги – это гетерогенная клеточная популяция. Макрофаг имеет неправильную, звездчатую, многоотростчатую форму, складки и микроворсинки на поверхности клеток, обилие эндоцитозных микровезикул, первичных и вторичных лизосом. Округлое или эллипсовидное ядро расположено центрально, гетерохроматин локализован под ядерной оболочной. Структурные особенности клетки во многом зависят от ее органной и тканевой принадлежности, а также от функционального статуса. Так, для клеток Купфера характерен гликокаликс, альвеолярные макрофаги содержат ламеллярные (сурфактантные) тельца, хорошо развитый комплекс Гольджи, шероховатый эндоплазматический ретикулум и множество митохондрий, в то время как в клетках микроглии митохондрии немногочисленны. В цитоплазме перитонеальных и альвеолярных макрофагов присутствует большое количество липидных телец, содержащих субстраты и ферменты генерации простагландинов[1]. Адгезирующиеся и движущиеся макрофаги формируют короткоживущие, содержащие актин структуры – подосомы – в виде плотной центральной части с радиально отходящими от них микрофиламентами. Подосомы могут сливаться, формируя структуры более высокого порядка – розетки, которые эффективно разрушают белки подлежащего внеклеточного матрикса[2].
Функции макрофагов
Макрофаги фагоцитируют чужеродный материал и клеточно-тканевый детрит, стимулируют и регулируют иммунный ответ, индуцируют воспалительную реакцию, участвуют в репаративных процессах и обмене компонентов внеклеточного матрикса. Многообразие осуществляемых функций объясняет экспрессию этими клетками большого числа рецепторов, связанных с плазматической мембраной, внутриклеточных и секретируемых. Рецепторы врожденного иммунитета РRR (pattern-recognition receptors, образ-распознающие рецепторы) активируются широким спектром лигандов (исключение – CD163), обеспечивая узнавание высоко консервативных структур большинства микроорганизмов, так называемых PAMP (pathogen-associated molecular patterns, патоген-ассоциированные образы) и схожих с ними эндогенных молекулярных структур DAMP (damage-associated molecular patterns), образующихся в результате повреждения и гибели клеток, модификации и денатурации белковых структур внеклеточного матрикса. Большинство из них опосредует эндоцитоз и элиминацию потенциально опасных эндогенных и экзогеннных агентов, однако вместе с тем, многие из них выполняют сигнальные функции, регулируя синтез провоспалительных медиаторов, способствуя адгезии и миграции макрофагов (табл.)[3–7].
На плазматической мембране моноцитов/макрофагов экспрессируются также специализированные рецепторы, связывающие один или несколько близких по строению лигандов: Fc-фрагмент иммуноглобулина G, факторы роста, кортикостероиды, хемокины и цитокины, анафилотоксины и костимулирующие молекулы. Функции многих из этих рецепторов опосредованы не только связыванием лигандов, но и взаимодействием с другими рецепторами (C5aR-TLR, MARCO-TLR, FcγR-TLR), что обеспечивает тонкую регуляцию синтеза прои противовоспалительных медиаторов[2, 6, 8, 9]. Особенностью макрофагальной рецепторной системы является наличие рецепторов-ловушек провоспалительных цитокинов и хемокинов (Il-1R2 на М2а макрофагах; CCR2 и CCR5 на М2с макрофагах), активация которых блокирует внутриклеточную передачу соответствующего провоспалительного сигнала. Экспрессия клеточных рецепторов видо-, органо- и тканеспецифична и зависит от функционального статуса макрофагов. Детально изученные клеточные рецепторы макрофага приведены в таблице.
Миграция моноцитов/макрофагов
Тканевые макрофаги происходят преимущественно из моноцитов крови, которые мигрируют в ткани и дифференцируются в различные популяции. Миграция макрофагов направляется хемокинами: ССL2 CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, ССL15, ССL19, CXCL10, CXCL12; факторами роста VEGF, PDGF, TGF-b; фрагментами системы комплемента; гистамином; белками гранул полиморфноядерных лейкоцитов (ПМЯЛ); фосфолипидами и их производными.
На начальных этапах воспалительного ответа ПМЯЛ организуют и модифицируют сеть хемокинов путем секреции CCL3, CCL4 и CCL19 и выброса преформированных в гранулы азуросидина, белка LL37, катепсина G, дефензинов (НNP 1-3) и протеиназы 3, которые обеспечивают адгезию моноцитов к эндотелию, тем самым проявляя свойства хемоаттрактантов. Кроме того, белки гранул ПМЯЛ индуцируют секрецию хемокинов и другими клетками: азуросидин стимулирует продукцию CCL3 макрофагами, а протеиназа-3 и HNP-1 вызывают синтез ССL2 эндотелием. Протеиназы ПМЯЛ способны активировать многие хемокины белковой природы и их рецепторы. Так, протеолиз ССL15 катепсином G многократно усиливает его аттрактивные свойства. Апоптозные нейтрофилы привлекают моноциты через сигналы, предположительно, опосредованные лизофосфатидилхолином[10].
Любое повреждение тканей приводит к аккумуляции макрофагов. В зоне травмы сосудов кровяной сгусток и тромбоциты выделяют TGF-β, PDGF, CXCL4, лейкотриен B4 и IL-1, обладающие выраженными хемоаттрактивными свойствами в отношении моноцитов/макрофагов[11–13]. Поврежденные ткани являются источником так называемых аларминов, к которым относятся компоненты разрушенного внеклеточного матрикса, белки теплового шока, амфотерин, АТФ, мочевая кислота, IL-1a, IL-33, митохондриальная ДНК клеточного детрита и др. Они стимулируют оставшиеся жизнеспособными клетки поврежденных тканей и эндотелий кровеносных сосудов к синтезу хемокинов, некоторые из них являются прямыми факторами хемотаксиса[13, 14]. Инфицирование тканей приводит к появлению так называемых патогенассоциированных молекул: липополисахаридов, углеводов клеточной стенки и нуклеиновых кислот бактерий. Связывание их мембранными и внутриклеточными рецепторами макрофагов запускает процесс экспрессии генов хемокинов, обеспечивающих дополнительное рекрутирование фагоцитов[11, 15].
Активация макрофагов
Макрофаги активируются под действием множества сигнальных молекул, вызывающих их дифференцировку в различные функциональные типы (рис. 1). Классически активированные макрофаги (М1 фенотип) стимулируются IFNg, а также IFNg совместно с LPS и TNF. Их основные функции – уничтожение патогенных микроорганизмов и индукция воспалительной реакции. Поляризация в М1 направлении сопровождается секрецией провоспалительных медиаторов. Они экспрессируют рецепторы к IL-1 – IL-1R1, TLR и костимулирующие молекулы, активация которых обеспечивает амплификацию воспалительного ответа. Наряду с провоспалительными цитокинами макрофаги секретируют и антивоспалительный цитокин – IL-10, при характерном высоком соотношении IL-12/IL-10[11, 13, 16–18]. Бактерицидные свойства М1 макрофагов определяются продукцией свободных радикалов азота и кислорода, генерируемых iNOS и НАДФН-оксидазным комплексом[19, 20]. Являясь эффекторными клетками в реакции организма на бактериальную инфекцию, они, в то же время, подавляют адаптивный иммунный ответ за счет торможения пролиферации стимулированных Т-клеток. Секретируемый М1 макрофагами IL-12 играет ключевую роль в Тх1 поляризации, а IL-1b и IL-23 направляют иммунный ответ по Тх17 пути.[11, 18]. Исследования последних лет показали, что М1 макрофаги помимо провоспалительных проявляют репаративные свойства: секретируют VEGF, стимулирующий ангиогенез и образование грануляционной ткани[21].
Альтернативная активация макрофагов (М2 фенотип) наблюдается при стимуляции их интерлейкинами, глюкокортикоидами, иммунными комплексами, агонистами TLR и др. Они мигрируют в зоны инвазии гельминтами, скапливаются в локусах фиброза, в заживающих ранах кожи и неопластических образованиях. М2 макрофаги способны к активной пролиферации in situ. Они проявляют большую по сравнению с М1 макрофагами способность к фагоцитозу и экспрессируют большее количество связанных с ним рецепторов: СD36 – рецептор скавенджер апоптозных клеток; CD206 – маннозный рeцептор; CD301 – рецептор остатков галактозы и N-ацетилглюкозамина; СD163 – рецептор к гемоглобин-гаптоглобиновому комплексу. Для макрофагов этого типа характерно низкое отношение IL-12/IL-10[11, 22–25].
Альтернативно активированные макрофаги подразделяют на подтипы: М2а, М2b и М2с. Примером М2а фенотипа макрофагов являются клетки, скапливающиеся вокруг личинок гельминтов и простейших, аллергены которых индуцируют иммунный Тх2 ответ, сопровождающийся продукцией IL-4 и IL-13[23]. Они не секретируют значительные количества провоспалительных цитокинов, синтезируют особый спектр хемокинов и мембранных рецепторов[11, 17, 22]. Считается, что для них характерен синтез IL-10[13], однако in vitro макрофаги не всегда продуцируют этот цитокин и могут проявлять высокую транскрипционную активность генов IL-12 и IL-6[17, 26]. Важной характеристикой этой популяции является синтез антагониста рецептора IL-1 (IL-1ra), который, связываясь с IL-1, блокирует его провоспалительное действие[27].
М2а макрофаги подавляют воспалительную реакцию, блокируя формирование М1 популяции через цитокины рекрутированных ими Тх2-лимфоцитов, либо за счет вырабатываемого хемокина ССL17, который совместно с IL-10 ингибирует дифференцировку макрофагов в М1 направлении[11]. Клетки М2а фенотипа считают типичными репаративными макрофагами. Синтезируемый ими хемокин CCL2 является хемоаттрактантом предшественников миофибробластов – фиброцитов[28, 29], они секретируют факторы, обеспечивающие ремоделирование соединительной ткани[20, 22, 24, 30–32].
Поляризация в направлении М2b осуществляется стимуляцией рецептора к Fcg вместе с агонистами ТLR и лигандами к рецептору IL-1. Функционально они близки к М1 макрофагам, продуцируют провоспалительные медиаторы и монооксид азота (NO), но вместе с тем для них характерен высокий уровень синтеза IL-10 и сниженная продукция IL-12[16, 17]. М2b макрофаги усиливают продукцию антител. Синтезируемый ими хемокин ССL1 способствует поляризации лимфоцитов в Тх2 направлении[11, 13]. М2с макрофаги обладают супрессивными свойствами – тормозят активацию и пролиферацию СD4+-лимфоцитов, вызванную антигенной стимуляцией и способствуют элиминации активированных Т-клеток[33]. In vitro М2с подтип получают стимуляцией мононуклеарных фагоцитов глюкокортикоидами, IL-10, TGF-β, простагландином Е2 и др. Они не обладают бактерицидной активностью, продуцируют незначительное количество цитокинов, секретируют факторы роста и некоторые хемокины[7, 13, 17, 21, 31]. М2с макрофаги экспрессируют рецепторы фагоцитоза и многих провоспалительных хемокинов, которые, предположительно, служат не для возбуждения соответствующих сигналов, а являются ловушками провоспалительных медиаторов, блокируя их функции[11].
Характер активации макрофагов не является жестко детерминированным и стабильным. Показана возможность трансформации М1 фенотипа в М2 при изменении спектра стимулирующих цитокинов и вследствие эффероцитоза. После поглощения апоптозных клеток макрофаги резко снижают синтез и секрецию медиаторов воспаления ССL2, ССL3, CXCL1, CXCL 2, TNF-a, MG-CSF, IL-1b, IL-8 и многократно усиливают продукцию TGF-b[20, 25, 27]. Обратная трансформация М2 фенотипа в М1 предполагается при развитии ожирения.
Многие авторы ставят под сомнение существование в организме двух четко различимых популяций макрофагов М1 и М2. Сочетание признаков классической и альтернативной активации характерно для макрофагов кожных ран человека. Так, наряду с типичными для M1 макрофагов цитокинами TNF-a и IL-12, они демонстрируют синтез маркеров М2 макрофагов: IL-10, СD206, СD163, CD36 и рецепторов к IL-4[34]. Отличный от М1/М2 тип макрофагов с выраженной фибринолитической активностью обнаружен в печени мышей на модели обратимого фиброза и в ткани печени человека при циррозе. В них экспрессируются гены аргиназы 1, маннозных рецепторов и IGF, они секретируют ММП-9, ММП-12, проявляют выраженную способность к пролиферации и фагоцитозу, но не синтезируют IL-10, IL-1ra, TGF-b[35]. Особая популяция макрофагов формируется в селезенке мыши при инфицировании микобактериями. Они тормозят пролиферацию Т-лимфоцитов и секрецию ими как Тх1, так и Тх2 цитокинов, стимулируя поляризацию в Тх17. направлении. Супрессивные макрофаги обладают уникальным фенотипом – экспрессируют гены активные в М1 макрофагах – IL-12, IL-1b, IL-6, TNF-a, iNOS и одновременно гены CD163, IL-10, маннозных рецепторов и других маркеров М2 макрофагов[19].
Эти исследования наглядно показывают, что формирующиеся в естественных условиях популяции макрофагов значительно отличаются от получаемых in vitro М1 и М2 популяций. Воспринимая множество активирующих сигналов, макрофаг отвечает «по запросу», секретируя медиаторы адекватно изменению окружающей среды, поэтому в каждом конкретном случае формируется свой фенотип, иногда, возможно, даже уникальный.
Реакция макрофагов на чужеродный материал
Контакт макрофагов с чужеродным материалом, как в виде мелких частиц, так и в виде обширных поверхностей, приводит к их активации. Одной из серьезных проблем в травматологии и ортопедии, связанной с реакцией на инородное тело, является развитие нестабильности сустава после эндопротезирования, которая выявляется, по некоторым данным, у 25–60% больных в первые годы после выполненной операции и не имеет тенденции к снижению[36].
Поверхность ортопедических протезов изнашивается с образованием частиц, инфильтрирующих мягкие ткани. Химические свойства материала определяют возможность опсонизации частиц белками плазмы крови и тип поверхностных рецепторов, инициирующих фагоцитоз. Так, полиэтилен, активирующий комплемент, подвергается опсонизации и «узнается» рецептором к комплементу СR3, в то время как частицы титана поглощаются клеткой через опсонин-независимый рецептор MARCO. Фагоцитоз макрофагами частиц металла, синтетических полимеров, керамики, гидроксиапатита запускает процесс синтеза провоспалительных медиаторов и индуктора остеокластогенеза RANKL. Секретируемый макрофагами ССL3 вызывает миграцию остеокластов, а IL-1b, TNF-a, ССL5 и PGE2 стимулируют их дифференцировку и активацию. Остеокласты резорбируют кость в зоне протезирования, но новообразование костной ткани подавлено, поскольку корпускулярный материал ингибирует синтез коллагена, тормозит пролиферацию и дифференцировку остеобластов и индуцирует их апоптоз[37, 38]. Вызванный частицами износа воспалительный ответ считается основной причиной остеолиза.
Контакт тканей с материалом, который не может быть фагоцитирован, инициирует каскад событий, известный под названием реакции организма на инородное тело, или тканевой реакции. Она заключается в адсорбции белков плазмы, развитии воспалительного ответа, первоначально острого, впоследствии хронического, пролиферации миофибробластов и фибробластов и формировании фиброзной капсулы, отграничивающей инородное тело от окружающих тканей. Основными клетками персистирующего воспаления на границе материал/ткань являются макрофаги, его выраженность определяет степень фиброза в зоне контакта. Интерес к исследованию тканевой реакции связан в первую очередь с широким применением синтетических материалов в различных областях медицины[12, 39, 40].
Адсорбция белков плазмы крови является первой стадией взаимодействия имплантируемых материалов с тканями организма. Химический состав, свободная энергия, полярность поверхностных функциональных групп, степень гидрофильности поверхности определяют количество, состав и конформационные изменения в связываемых белках, являющихся матриксом для последующей адгезии клеток, в том числе макрофагов. Наиболее значимыми в этом плане являются фибриноген, IgG, белки системы комплемента, витронектин, фибронектин и альбумин.
Слой фибриногена быстро образуется на практически всех чужеродных материалах. На гидрофобных поверхностях фибриноген образует монослой из прочно связанного, частично денатурированного белка, эпитопы которого открыты для взаимодействия с клеточными рецепторами. На гидрофильных материалах фибриноген чаще осаждается в виде рыхлого мультислойного покрытия, причем наружные слои слабо или практически не подвергаются денатурации, оставляя сайты связывания недоступными для клеточных рецепторов макрофагов и тромбоцитов[41, 42].
Многие синтетические полимеры обладают способностью к сорбции компонентов системы комплемента и ее активации с формированием С3-конвертазного комплекса. Генерируемые им фрагменты С3а, С5а являются хемоаттрактантами и активаторами фагоцитов, iC3b выполняет роль лиганда рецептора клеточной адгезии. Запуск каскада активации возможен как по классическому (опосредованному адсорбированными молекулами JgG), так и по альтернативному путям[43]. Последний инициируется связыванием компонента С3 поверхностями, несущими функциональные группы, например – ОН-, вызывающими его гидролиз. Альтернативный путь может включаться также после классического пути или вместе с ним за счет работы С3-конвертазы классического пути, генерирующей фиксирующиеся на поверхностях фрагменты С3b – пускового фактора амплификационной петли. Однако сорбция и даже начавшийся гидролиз С3 не всегда приводят к возникновению амплификационного сигнала. Например, С3 сильно сорбируется поливинилпирролидоном, однако протеолиз его на этой поверхности слабо выражен. Слабо активируют комплемент фторированные поверхности, силикон и полистирен. Для клеточных реакций на чужеродных поверхностях значение имеет не только активация системы комплемента, но опосредованное ее фрагментами связывание других белков.
Роль альбумина заключается в его способности связывать белки системы комплемента[12]. Oн не способствует адгезии макрофагов и, в отличие от фибриногена, не индуцирует синтез ими TNF-a[44]. На имплантированных материалах обычно обнаруживают фибронектин и витронектин – белки богатые RGD-последовательностями (участками из аминокислот ARG-GLY-ASP).
В отношении витронектина неизвестно, адсорбируется ли он непосредственно на поверхности материала или входит в состав фиксированного на нем инактивированного мебранноатакующего комплекса комплемента. Значимость его для развития тканевой реакции состоит в том, что он обеспечивает наиболее прочную и длительную адгезию макрофагов. Взаимодействие макрофагов с субстратом обеспечивают клеточные рецепторы к белкам-интегринам (avβ3, a5β1, CR3), богатым RGDпоследовательностями (табл.). Блокада адгезии макрофагов растворимыми RGD-миметиками, либо удаление с их поверхности рецептора CR3 снижает интенсивность тканевой реакции, уменьшая толщину формирующейся фиброзной капсулы[12, 41, 45].
Прикрепившиеся макрофаги сливаются, образуя многоядерные клетки (гигантские клетки инородных тел – ГКИТ). Индукторами этого процесса являются IFNg, IL-1, IL-2, IL-3, IL-4, IL-13 и GM-CSF, стимулирующие экспрессию маннозных рецепторов, которые играют важную роль в слиянии клеток[12]. ГКИТ функционируют как макрофаги – обладают способностью к фагоцитозу, генерации радикалов кислорода и азота, синтезу цитокинов и факторов роста. Характер синтетической активности этих клеток зависит, по-видимому, от их «возраста»: на ранних этапах развития тканевой реакции экспрессируются IL-1a, TNF-a, а позднее происходит переключение на антивоспалительные и профиброгеннные медиаторы – IL-4, IL-10, IL-13, TGF-β[46, 47].
Реакция макрофагов на чужеродные материалы исследуется в различных условиях in vitro и in vivo. В экспериментах in vitro принимается во внимание интенсивность их адгезии на изучаемой поверхности и образования ГКИТ, число «включающихся» генов, количество синтезируемых и секретируемых ферментов, цитокинов и хемокинов. В монокультурах мононуклеарных фагоцитов, адгезированных на различных поверхностях, происходит не поляризация их в М1 и М2 направлениях, а формирование макрофагов смешанного типа, секретирующих как про-, так и противовоспалительные медиаторы со сдвигом в сторону последних при длительном культивировании[12, 48, 49]. Отсутствие «золотого стандарта» – стабильного контрольного материала, хорошо зарекомендовавшего себя при имплантации в живой организм, с которым можно было бы сравнивать тестируемые материалы, а также использование не стандартизированных клеточных линий макрофагов, разные способы их дифференцировки затрудняют сравнение результатов работ разных авторов. Тем не менее, исследования in vitro дают возможность судить о цитотоксичности материалов, определить реакцию макрофагов на их химическую модификацию. Ценные сведения были получены при изучении активации макрофагов на поверхности различных коллагенов – нативных и химически измененных. Нативные коллагены индуцируют in vitro синтез макрофагами сигнальных молекул, как стимулирующих воспалительный ответ (TNF-a, IL-6, IL-8, IL-1β, IL-12, CCL2), так и подавляющих его (IL-1ra, IL-10), а также матриксных металлопротеаз и их ингибиторов.[48-50]. Провоспалительные свойства таких материалов зависят от способа децеллюляризации и стерилизации исходного сырья, в значительной степени изменяющих его характеристики. Полученные по разным технологиям коллагеновые эндопротезы из нативного коллагена по способности вызывать экспрессию провоспалительных цитокинов варьируют от практически инертных до высокоактивных[51]. Прошивка коллагена различными химическими веществами изменяет характер реакции макрофагов. Обработка глутаральдегидом приводит к цитотоксичности, проявляющейся в повреждении цитоплазматической мембраны, нарушении адгезии, снижении жизнеспособности макрофагов. При этом продукция ими IL-6, TNF-a повышена, а синтез IL-1ra подавлен в сравнении с макрофагами, адгезированными нативным и прошитым карбодиимидом коллагеном. Обработка карбодиимидом обеспечивает оптимальные свойства коллагену, который не обладает цитотоксичностью, не вызывает существенного повышения секреции провоспалительных цитокинов и металлопротеаз и не подавляет синтез IL-10 и IL-1ra в сравнении с нативным[49].
С целью снижения тканевой реакции в коллагеновые материалы вводят компоненты межклеточного матрикса, нативные или модифицированные. J. Kajahn с соавт. (2012) создали in vitro имитацию провоспалительного микроокружения эндопротезов, что способствовало дифференцировке моноцитов в М1 направлении[50]. В этих же условиях дополнительно сульфатированная гиалуроновая кислота, введенная в коллагеновый субстрат, снизила секрецию макрофагами провоспалительных цитокинов и повысила продукцию IL-10. По мнению авторов это свидетельствует о М2 поляризации макрофагов, способствующих регенерации и восстановлению функциональных свойств окружающих тканей. Реакция макрофагов на медленно деградируемые и стабильные материалы in vitro в целом однородна и аналогична реакции на биоматериалы, хотя некоторая специфичность ответа все же заметна. Титан, полиуретан, полиметилметакрилат, политетрафторэтилен являются слабыми индукторами медиаторов воспаления, хотя титан способствует более высокой секреции TNF-a и IL-10, чем полиуретан, а особенность полипропилена заключается в стимулировании продукции профиброгенного хемокина ССL18[52-54]. PEG, предлагаемый в качестве субстрата для переноса клеток, вызывает резкое, но быстро проходящее усиление экспрессии IL-1β, TNF-a, IL-12, однако его сополимеризация с олигопептидом клеточной адгезии улучшает биосовместимость материала, в значительной степени снижая экспрессию провоспалительных цитокинов[55].
Реакция макрофагов на различные материалы in vitro не в полной мере характеризует их поведение в организме. В монокультурах отсутствуют факторы взаимодействия с другими клеточными популяциями и не учитывается фенотипический полиморфизм – в естественных условиях к имплантату мигрируют не только моноцитарные предшественники, но и зрелые тканевые макрофаги, ответ которых может существенно отличаться от рекрутируемых из крови. Исследование секреторной активности макрофагов, окружающих инсталлированные в ткани животных и человека эндопротезы, представляет большую сложность. Основным методом, позволяющим характеризовать макрофаги на основании парадигмы М1-М2 in situ, стали данные иммуноцитохимии маркерных белков iNOS, CD206, CD163, CD80, CD86. Постулируется, что наличие этих маркеров у макрофагов in vivo определяет их поляризацию в М1 и М2 направлениях с синтезом соответствующих спектров цито- и хемокинов, но, учитывая возможность существования макрофагов смешанного типа[34], такая характеристика не вполне корректна.
Тем не менее, эксперименты in vivo дают возможность проследить судьбу имплантированного материала и динамику реакции макрофагов в течение длительного периода, что особенно важно для пожизненно установленных эндопротезов и устройств. Наиболее изученными в данном аспекте являются деградирующие биоматериалы на основе коллагена. Первыми клетками воспаления, мигрирующими к таким материалам, являются ПМЯЛ, однако этот эффект транзиторный и популяция второй волны представлена макрофагами[56, 57]. Их реакция зависит от физико-химических свойств коллагена. Чем жестче химическая обработка, тем больше отличается коллаген от нативного, тем более «чужим» он становится для макрофага и тем сильнее выражена тканевая реакция. Установленные между мышечными слоями брюшной стенки крысы фрагменты имплантатов из медленно деградирующего прошитого коллагена способствуют формированию ГКИТ и инкапсуляции материала. Мигрирующие макрофаги, судя по экспрессии рецепторов ССR7 и CD206, можно отнести в ряде случаев к М1 фенотипу, но во многих случаях определить их принадлежность к известным фенотипам не представляется возможным.
С течением времени вокруг имплантата появляются М2 макрофаги, которые располагаются преимущественно в фиброзной капсуле[58]. Эндопротезы из непрошитого коллагена свиньи, человека и быка[58] и прошитый диизоцианатом коллаген овцы[59], быстро разрушающиеся в организме крысы, стимулируют новообразование полноценной соединительной и мышечной тканей. Они не способствуют образованию ГКИТ и не инкапсулируются. Часть мононуклеарных фагоцитов, скапливающихся на границе ткань/материал, не имеет маркеров М1/М2 фенотипа, часть содержит оба маркера, а часть является М2 макрофагами. Субпопуляция М1 макрофагов на таких имплантатах отсутствует[58–60]. Гистоморфометрический анализ показал положительную корреляцию между количеством макрофагов, несущих маркеры М2 фенотипа на ранних этапах развивающейся тканевой реакции, и показателями успешного ремоделирования тканей в зоне имплантации[58].
Тканевая реакция на недеградируемые материалы существует в течение всего времени присутствия их в организме[61]. Ее интенсивность модулируется физико-химическими свойствами материалов: в ряду полиэстер, политетрафторэтилен, полипропилен – первый полимер вызывает максимально выраженное воспаление и слияние макрофагов, последний – минимальное, а выраженность фиброза для всех перечисленных материалов положительно коррелирует с количеством ГКИТ на поверхности синтетических полимеров[40]. Несмотря на большое количество работ, в которых исследована воспалительная реакция на различные материалы, характеристики аккумулирующихся на них макрофагов изучены недостаточно. M.T. Wolf и соавт. (2014) показали, что на нитях и между узлами полипропиленовой сетки, имплантированной в брюшную стенку крысы, скапливаются преимущественно макрофаги с маркерами М1 фенотипа (СD86+CD206-)[57].
Нанесенный на полипропилен гель из межклеточного матрикса соединительной ткани снижает число М1 макрофагов и ГКИТ и одновременно тормозит рост микрососудов. Это явление хорошо согласуется с результатами работ, демонстрирующими экспрессию ангиогенных факторов М1 макрофагами ран и подавление васкулогенеза при их блокаде[21, 52]. О синтетической активности макрофагов, спектре их биологически активных молекул, обеспечивающих тканевую реакцию, известно мало. У мыши на периферии зоны имплантации нейлоновой сетки скапливаются макрофаги, секретирующие IL-6 и ССL2, IL-13 и TGF-β и в то же время в популяции клеток, в том числе и в ГКИТ, адгезированных на волокнах эндопротеза, экспрессируются IL-4, IL-10, IL-13 и TGF-β[47]. IL-4 и IL-13 – мощные профиброгенные медиаторы, они не только поляризуют макрофаги в М2а направлении, способствуя продукции факторов роста, но и через индукцию экспрессии фибробластами TGF-β, стимулируют синтез ими коллагена. Профиброгенным эффектом обладают также IL-10 и CCL2, обеспечивающие хемотаксис предшественников миофибробластов – фиброцитов[29, 30, 62, 63]. Можно предположить, что именно макрофаги создают среду, способствующую развитию фиброза вокруг недеградирующих материалов.
Образование фиброзной ткани может оказывать как негативное, так и позитивное влияние на результаты лечения пациентов. В герниологической практике фиброзная трансформация тканей, связанная с имплантацией полипропиленового эндопротеза, является одной из основных проблем (рис. 2, собственные данные), которая на фоне нерациональной оперативной тактики в 15–20% случаев приводит к развитию рецидивов грыж различных локализаций[39, 64].
В последние годы особенно интенсивно развиваются технологии дентальной имплантации, основанные на интеграции установленных конструкций за счет развития соединительной ткани (рис. 3, собственные данные). Несмотря на то, что фиброинтеграция имплантатов рядом специалистов признается как допустимый вариант, поиск новых материалов, способствующих процессам остеоинтеграции, продолжается[65].
В этой связи существенное значение приобретают изучение клеточных популяций в зоне протезирования, разработка методов и подходов к блокированию чрезмерной воспалительной реакции с исходом в фиброз и стимуляция репаративной регенерации в месте имплантации различных материалов.
Заключение
Макрофаги – полиморфная популяция клеток, фенотип которых определяется сигналами микроокружения. Они играют решающую роль в реакции организма на чужеродный материал, используемый для эндопротезирования, катетеризации, стентирования и др. видов лечения. Характер реакции и степень ее выраженности зависят как от размера имплантируемого материала, так и от его физикохимических свойств и могут иметь как положительное, так и отрицательное значения для организма пациента. Для деградируемых материалов на основе коллагена показана зависимость типа активации макрофагов и скорости регенерации соединительной ткани от способа обработки коллагенового сырья. Это открывает широкие возможности для специалистов, разрабатывающих новые методы децеллюляризации тканей, химической модификации и стерилизации коллагеновых материалов в целях получения имплантатов для регенеративной медицины.
Проблемы, связанные с активацией макрофагов недеградирующими материалами, по-видимому, должны решаться иначе. Макрофаги, фагоцитирующие микрочастицы износа поверхности суставных эндопротезов, и макрофаги, мигрирующие к обширным поверхностям синтетических имплантов, инициируют длительно персистирующее воспаление, остеолиз в первом случае и фиброз во втором. Нивелирование этого эффекта, скорее всего, будет достигнуто путем блокады направленной миграции, адгезии и активации моноцитов/макрофагов, что потребует более глубоких знаний об этих процессах, чем те, которыми мы располагаем в настоящее время.
Чем опасно повышение моноцитов?
Увеличение моноцитов в организме в большинстве случаев свидетельствует о наличии патологии. При появлении инфекционного заболевания организм начинает упорную борьбу с ним путем дополнительной выработки белых телец для активной борьбы с болезнью. Кажется, что чем больше моноцитов, тем лучше, ведь так можно быстрее справиться с недугом. На деле же есть и обратная сторона, так как чрезмерное их количество может и само спровоцировать воспаление.
Большие скопления белых телец в сосудах могут:
- Нарушить кровоток.
- Усилить атеросклероз.
- Уменьшить поступление крови к сердечной мышце.
- Спровоцировать повреждение стенки сосуда.