Алгоритм выбора антигипертензивной терапии при метаболическом синдроме и артериальной гипертензии
С.В. Недогода, Т.А. Чаляби, А.С. Саласюк, И.Н. Барыкина. Д.А.Почепцов, А.А. Ледяева, В.В. Цома, Е.В. Чумачек,
Волгоградский государственный медицинский университетИАПФ и блокаторы рецепторов ангиотензина II принадлежат к основным классам антигипертензивных препаратов, применяемых при лечении артериальной гипертензии у пациентов с метаболическим синдромом. У каждого из представителей этой группы существуют клинико-фармакологические особенности и нюансы клинического применения. На основании их анализа предлагается алгоритм дифференцированного выбора конкретного препарата.
Известно, что при артериальной гипертензии на фоне метаболического синдрома выявляются выраженная дисфункция эндотелия сосудов (избыток вазоконстрикторов и дефицит вазодилататоров,прежде всего оксида азота), повышение активности ренин-ангиотензин-альдостероновой и симпато-адреналовой систем (высокий уровень лептина), спазм сосудов на фоне увеличения сердечного выброса, усиление реабсорбции натрия в канальцах нефрона (за счет гиперинсулинемии и сдавления почек жировой тканью), задержка жидкости и гиперволемия, повышенное содержание натрия и кальция в стенке сосудов, ночное обструктивное апное. У подавляющего числа пациентов имеется инсулинорезистентность. У них наблюдаются раннее поражение органов-мишеней (гипертрофия левого желудочка, быстро приводящая к диастолической дисфункции миокарда, повышение жесткости крупных артерий, гипофильтрация в почках и микроальбуминурия). Типичными метаболическими нарушениями при артериальной гипертензии являются нарушение толерантности к глюкозе, повышение уровня триглицеридов, холестерина и мочевой кислоты. Все эти особенности существенно влияют на выбор гипотензивного препарата для коррекции артериального давления (АД) у больных с метаболическим синдромом.
Для пациентов с артериальной гипертензией и метаболическим синдромом представляется принципиально важным обеспечить положительное влияние гипотензивных препаратов на адипокины, продуцируемые жировой тканью, которая сегодня рассматривается уже не как энергетическое депо, а как эндокринный и паракринный орган, оказывающий гуморальное, протромбогенное и провоспалительное действие на другие органы и системы организма. Среди более чем 50 адипокинов при ожирении наибольшая роль в патогенезе как самого ожирения, так и ассоциированных с ним заболеваний и состояний отводится резистину, грелину, висфатину, апелину, адипонектину, ФНО-альфа и интерлейкину 6. Однако безусловно наиболее изученным и важным адипокином при ожирении является лептин — гормон, продуцируемый жировыми клетками и циркулирующий в крови в свободной и связанной формах. Через влияние на специфические рецепторы гипоталамуса лептин изменяет экспрессию нейропептидов, регулирующих потребление и расход энергии в организме. При ожирении развивается компенсаторная резистентность гипоталамуса к центральному действию лептина с развитием через механизм обратной связи лептинорезистености (гиперлептинемии). Лептин обладает целым рядом эффектов, которые могут усугублять имеющиеся нарушения при артериальной гипертензии и ожирении (стимуляция симпато-адреналовой системы, повышение скорости фиброза сердечной мышцы, усиление агрегации тромбоцитов, задержка натрия, усиление инсулинорезистентности).
Представляется клинически важным найти препарат-«лидер», поскольку пациент с сочетанием артериальной гипертензии и метаболического синдрома требует не только нормализации АД, но и максимально возможной коррекции всех других модифицируемых факторов риска (рис. 1 и 2). Последние европейские рекомендации 2013 г. по лечению артериальной гипертензии (ESH/ESC Guidelines for the management of arterial hypertension) декларируют, что, поскольку метаболический синдром часто расценивается как «предиабетическое» состояние, то предпочтение отдается блокаторам ренин-ангиотензиновой системы и антагонистам кальция, так как они потенциально могут улучшать или, по крайней мере, не ухудшать чувствительность к инсулину, в то время как бета-блокаторы (за исключением бета-блокаторов с вазодилатирующими свойствами) и диуретики должны рассматриваться как дополнительные препараты, использовать которые предпочтительно в низких дозах. В рекомендациях в разделе «Препараты, которым отдается предпочтение в определенных ситуациях» также указывается на то, что ИАПФ, блокаторы рецепторов ангиотензина II (БРА) и антагонисты кальция являются препаратами выбора при метаболическом синдроме [1].
Таким образом, если с классами антигипертензивных препаратов, которые имеют преимущества у пациентов с артериальной гипертензией и метаболическим синдромом, есть некая определенность, то в отношении конкретных их представителей она отсутствует. При этом вполне очевидно, что так называемые «класс-специфические эффекты» все больше ставятся под сомнение. Именно поэтому представляется целесообразным все же уточнить возможности конкретных препаратов при данной патологии и предложить врачу алгоритм дифференцированного их применения.
Ингибиторы АПФ
Неслучайно, что в лечении артериальной гипертензии у больных с метаболическими нарушениями важная роль отводится ИАПФ. Это связано с их положительным влиянием на ключевые звенья патогенеза заболевания. Представители данной группы лекарственных средств снижают активность РААС как в плазме, так и в тканях, замедляют инактивацию брадикинина и уменьшают активность симпатической нервной системы (прежде всего за счет уменьшения инсулинорезистентности и уровня постпрандиальной гликемии).
Несомненное достоинство препаратов этой группы – отсутствие негативного влияния на углеводный, липидный и пуриновый обмены. В крупных многоцентровых исследованиях SOLVD, ASCOT, HOPE выявлено значимое снижение числа новых случаев СД среди больных, длительно получавших ИАПФ.
Указанные препараты обладают органопротективным эффектом: уменьшают гипертрофию миокарда левого желудочка, замедляют ремоделирование и фиброз миокарда, снижают МАУ, протеинурию, предотвращают нефроангиосклероз и ХПН. Высокая эффективность ИАПФ в замедлении прогрессирования заболевания почек и снижении риска сердечно-сосудистых осложнений показана в исследованиях AIRE, REIN, PROGRESS, ADVANCE. Вазопротективный эффект ИАПФ заключается в улучшении функции эндотелия сосудистой стенки, антипролиферативном и антиатерогенном действии. В крупных клинических исследованиях (PHYLLIS, SECURE) установлено, что терапия ИАПФ может уменьшить толщину комплекса интима-медиа сонной артерии у пациентов с бессимптомным или манифестированным атеросклерозом.
Важное преимущество ИАПФ — способность предотвращать развитие сердечно-сосудистых осложнений у пациентов высокого и очень высокого риска, в том числе у больных АГ с МС, а также с СД. В исследованиях SOLVD, EUROPA, PROGRESS, FACET, ADVANCE показано, что лечение ИАПФ снижает риск развития повторного мозгового инсульта, ишемических событий, госпитализаций в связи с декомпенсацией ХСН и других сердечно-сосудистых осложнений и смерти от них.
Выделяют 3 группы ИАПФ в зависимости от химической структуры: содержащие SH-группу (каптоприл, зофеноприл), карбоксильную группу (эналаприл, квинаприл, рамиприл, периндоприл (Престариум А®), трандолаприл, спираприл, цилазаприл, лизиноприл), фосфинильную группу (фозиноприл). Поскольку при артериальной гипертензии с метаболическими нарушениями часто имеет место увеличение объема жировой ткани, то выбор конкретного ИАПФ должен учитывать его липофильность, поскольку более высокий уровень липофильности определяет более значительную тканевую аффинность препарата (т.е. способность оказывать влияние на активность АПФ не только в циркуляции, но и непосредственно в тканях). Большинство ИАПФ элиминируется почками, только 4 препарата (зофеноприл, фозиноприл, трандолаприл, спираприл) имеют двойной путь выведения — через печень и почки.
Высокой липофильностью обладают активные метаболиты фозиноприла, квинаприла, трандолаприла, рамиприла и периндоприла (Престариум А®); умеренной — эналаприла, моэксиприла и каптоприла; лизиноприл относится к гидрофильным соединениям. Именно высокая липофильность предопределяет предпочтительный выбор препарата при сочетании у больного артериальной гипертензии и метаболического синдрома, так как только в этом случае возможно заблокировать выброс вазаоактивных гуморальных субстанций (прежде всего ангиотензина II и провоспалительных цитокинов) из адипоцита. В настоящее время при отсутствии большой доказательной базы по дифференцированному применению антигипертензивных средств существуют две полярные точки зрения на выбор оптимального препарата в зависимости от липо- и гидрофильности. Сторонники преимущественного использования гидрофильных ИАПФ при лечении пациентов с ожирением и артериальной гипертензией считают, что липофильные ИАПФ распределяются в жировой ткани, в связи с чем приходится увеличивать их дозировку для достижения желаемого терапевтического эффекта. Они считают, что лизиноприл, который является единственным гидрофильным ИАПФ и не «поглощается» жировой тканью, оказывается более эффективным в этой клинической ситуации. Кроме этого, в пользу лизиноприла выдвигается следующий аргумент: у больных с ожирением часто имеются сопутствующие заболевания печени (стеатоз и стеатогепатит), и поэтому предпочтение надо отдавать ИАПФ, не метаболизирующимся в печени, а именно лизиноприлу, который является единственным ИАПФ с отсутствием печеночного метаболизма. Однако необходимо отметить, что в пользу применения липофильных ИАПФ также имеется достаточно веская аргументация. Во-первых, сегодня жировую ткань рассматривают как эндокринноактивную ткань, в которой секреция адипокинов тесно связана с активностью РАСС (прежде всего ангиотензина). Поэтому именно действие ИАПФ на уровне самого адипоцита способно положительно влиять на продукцию адипокинов, что гидрофильные ИАПФ по определению сделать не могут.
Среди ИАПФ с высокой липофильностью наиболее изученными при лечении артериальной гипертензии и метаболического синдрома являются периндоприл (Престариум А®) и рамиприл.
Периндоприл (Престариум А®) наглядно продемонстрировал свои преимущества перед эналаприлом и лозартаном в нескольких исследованиях [3, 4, 5]. Было показано, что терапия периндоприлом (Престариум А®) больных с артериальной гипертензией и метаболическим синдром позволяет достичь лучшего, чем при использовании эналаприла и лозартана, контроля АД, более выраженной кардио-, ангио- и нефропротекции, улучшения показателей липидного, углеводного обменов, уменьшения инсулинорезистентности и воспаления, а также положительного влияния на один из ключевых адипокинов при ожирении — лептин.
Рамиприл продемонстрирвал свои преимущества у пациентов с артериальной гипертензией и метаболическим синдромом в международном исследовании MICRO-HOPE и российском исследовании ХАРИЗМА.
Блокаторы рецепторов ангиотензина II
Известно, что БРА (сартаны) более полно, чем ИАПФ подавляют активность ренин-ангиотензин-альдостероновой системы и не влияют на систему брадикинина. По антигипертензивной эффективности ИАПФ и БРА равнозначны, но последние имеют лучший профиль переносимости, т.к. не вызывают кашель, ангионевротический отек. БРА обеспечивают более высокую приверженность к терапии среди больных с АГ из-за лучшего профиля переносимости, отсутствия «ускользания» гипотензивного эффекта.
БРА обладают выраженным кардио- и нефропротективным действием: предотвращают гипертрофию левого желудочка, увеличивают продолжительность периода удержания синусового ритма при пароксизмальной форме фибрилляции предсердий, уменьшают степень микроальбуминурии и протеинурии, замедляют прогрессирование сердечной и почечной недостаточности. При длительном приеме БРА уменьшают толщину интимы-медии сонных артерий и объем крупных атеросклеротических бляшек (исследование МORE с телмисартаном).
Значимое снижение риска развития СД при терапии БРА установлено также в исследованиях LIVE, VALUE, CHARM, ALPIN. В исследовании LIFE снижение относительного риска развития новых случаев СД на фоне приема лозартана составило 25%, в SCOPE при терапии эпросатартаном — 20% и в CHARM при терапии кандесартаном — 22%. Данные мета-анализа также показали, что терапия БРА сопровождается снижением развития новых случаев СД [2].
При этом отмечено значимое снижение частоты развития сердечно-сосудистых осложнений при лечении БРА больных АГ с СД (LIFE, IDNT, RENAAL).
Важным преимуществом терапии БРА в свете эпидемии метаболического синдрома является то, что число АТ1-рецепторов и их чувствительность к ангиотензину II резко возрастает при ожирении, гиперинсулинемии и дислипидемии.
Важным механизмом действия БРА является модуляция активности PPARγ-рецепторов, ответственных за гомеостаз глюкозы, метаболизм липидов и регулирование уровня АД. Этот эффект обеспечивает не только снижение АД, но и нормализацию уровней глюкозы, инсулина и триглицеридов. Причем результаты ряда исследований свидетельствуют об уменьшении инсулинорезистентности тканей за счет стимуляции ядерных PPARγ-рецепторов клеток жировой, мышечной тканей и гепатоцитов, и этот эффект сопоставим с действием пероральных гипогликемических препаратов.
Таким образом, существуют убедительные предпосылки к широкому использованию класса БРА при метаболическом синдроме. В то же время перед практическим врачом встает проблема дифференцированного выбора конкретного препарата для конкретного пациента. В связи с этим целесообразно рассмотреть клинико-фармакологические особенности представителей БРА. Тем более что существенные внутриклассовые различия между ними находят новые подтверждения [5]. Так, в клиническом исследовании сравнивали два препарата из группы БРА (телмисартан и лозартан). В ходе исследования было установлено, что телмисартан, в отличие от лозартана, уменьшает концентрацию свободной глюкозы крови, несвязанного инсулина и HbA1c, тем самым выявляя основные внутриклассовые различия между препаратами по потенциальному улучшению метаболических нарушений у больных с МС [6]. Лозартан
В течение последнего десятилетия появились многочисленные и убедительные данные о тесной взаимосвязи между повышением уровня мочевой кислоты и увеличением риска сердечно-сосудистых осложнений при артериальной гипертензии, метаболическом синдроме, сахарном диабете 2 типа. При этом доказана связь меду нарушением обмена мочевой кислоты и эндотелиальной дисфункцией [7]. По данным PIUMA Study, наличие гиперурекемии повышает риск кардиоваскулярных осложнений в 1,73 раза, а риск смертности — в 1,96 раза. Распространенность ГУ при сочетании артериальной гипертензии и метаболического синдрома составляет 37,8%, а при его отсутствии — 22% [8]. При этом длительность заболеваний не влияет на частоту ГУ. У пациентов с уровнем мочевой кислоты свыше 300 мкмоль/л более выражены метаболические факторы риска, которые находятся в прямой зависимости от степени повышения мочевой кислоты. Лозартан блокирует две основные транспортные системы эпителиоцитов дистальных канальцев, участвующих в реабсорбции уратов (урат/лактат и урат/хлорид), и защищает структуры почечного тубулоинтерстиция от повреждающего действия уратов. При применении лозартана экскреторный пул мочевой кислоты увеличивается только за счет торможения реабсорбции уратов без увеличения фильтрации, что принципиально отличает его от классических урикозурических средств, при применении которых фильтрация уратов возрастает и повышается риск развития нефролитиаза. Показано, что урикозурической активностью обладает сам лозартан, а не его активный метаболит E–3174 [9]. Следовательно, она обусловлена особенностями молекулы, а не блокадой АТ1–рецептора, что принципиально важно при анализе класс-специфических эффектов этой группы антигипертензивных средств. Исследование LIFE, которое оценивало влияние лозартана и атенолола на сердечно-сосудистые осложнения и смертность у больных артериальной гипертензией с высоким риском и с гипертрофией левого желудочка, также позволило изучить связь исходного уровня мочевой кислоты с другими факторами риска и прогнозом заболевания и стало первым крупномасштабным исследованием, продемонстрировавшим, что снижение уровня мочевой кислоты при терапии лозартаном связано с положительным влиянием на частоту осложнений при лечении артериальной гипертензии.
Валсартан
В исследовании NAVIGATOR study было показано, что у пациентов с нарушением толерантности к глюкозе и факторами риска терапия валсартаном приводит к относительному снижению на 14% и абсолютному снижению на 3,8% частоты новых случаев СД [10].
Отличительной чертой валсартана является его положительное влияние на сексуальную функцию у мужчин и женщин [11,12]. Это обусловлено его способностью проявлять прямой вазодилатирующий эффект, улучшать эндотелиальную функцию и микроциркуляцию, снижать объем соединительной ткани в кавернозных телах, повышать уровень тестостерона у мужчин и опосредованно через метаболиты ангиотензина II (ангиотензин IV) влиять на дофаминергическую систему, участвующую в регуляции полового поведения.
Кандесартан
Метаболические эффекты длительной гипотензивной терапии кандесартаном изучались в исследовании ALPINE [13]. При сравнении с гидрохлортиазидом в группе кандесартана было выявлено снижение уровня инсулина, глюкозы в крови, триглицеридов и повышение ЛПВП. В группе гидрохлортиазида по сравнению с группой кандесартана было также отмечено повышение соотношений ХС ЛПНП/ХС ЛПВП и аполипопротеин В/аполипопротеин А-I, что указывает на ухудшение липидного профиля. На фоне этих изменений сахарный диабет был диагностирован у 4,1% больных в группе гидрохлортиазида и лишь у 0,5% больных в группе кандесартана, а метаболический синдром был диагностирован у 18 больных в группе гидрохлортиазида и лишь у 5 больных в группе кандесартана. Отличительной чертой препарата является наличие доказательной базы эффективного применения при хронической сердечной недостаточности, в том числе в подгруппе пациентов с нарушением углеводного обмена.
Ирбесартан
Нефропротективный эффект и способность препарата уменьшать альбуминурию доказана в крупных исследованиях (IRMA, IDNT). Но важной особенностью ирбесартана является его способность обеспечивать достижение целевого АД при метаболическом синдроме у 70 % пациентов. При этом у всех отмечено уменьшение окружности талии, снижение исходно повышенных уровней инсулина, глюкозы и липидов крови. Причем необходимо отметить, что эти сдвиги наиболее выражены при сочетании у больного артериальной гипертензии и метаболического синдрома [14]. Схожие результаты были получены и в другом исследовании [15]. Кроме того, недавние исследования показали, что ирбесартан и телмисартан действуют как частичные агонисты γ-рецептора активатора пролиферации пероксисом (PPARγ) в концентрациях, достигаемых при пероральном приеме, и дозах, рекомендуемых для лечения АГ, что делает возможным их использование для повышения чувствительности к инсулину [16]. Телмисартан
Телмисартан проявляет максимальную активность в отношении PPAR по сравнению с другими БРА и обладает максимальной липофильностью. PPARγ играют ключевую роль в метаболизме и энергообмене жировой ткани – создании запаса липидов в белой жировой ткани и усилении расхода энергии в буром жире. PPARγ участвуют также в дифференцировке адипоцитов и в регуляции метаболизма глюкозы посредством улучшения чувствительности к инсулину, являясь связующим звеном в метаболизме липидов и углеводов. Применение телмисартана может предотвращать развитие атеросклероза путем снижения содержания висцерального жира, подавления воспаления сосудов и повышения уровня адипонектина, особенно у пациентов с метаболическим синдромом.
В недавно опубликованном мета-анализе 10 рандомизированных исследований с участием 546 пациентов с метаболическим синдромом было показано, что телмисартан достоверно снижает уровень глюкозы натощак, гиперинсулинемию, гликированный гемоглобин и повышает чувствительность к инсулину и уровень адипонектина [17].
Важно отметить, что такое же положительное влияние на все указанные показатели, а также на липиды и резистин телмисартан оказывает и на фоне терапии розиглитазоном [18]. Кроме этого, только телмисартан в сочетании с розувастатином уменьшает инсулинорезистетность и уровень С-реактивного белка в отличие от комбинации этого статина с ирбесартаном и олмесартаном [19].
Таким образом, анализ доказательной базы применения БРА при метаболическом синдроме, особенностей их клинической фармакологии и опыта практического применения позволяет предложить практическому врачу простой алгоритм их дифференцированного применения при этом состоянии (рис. 3). Антагонисты кальция
Как известно, в этой группе выделяют дигидропиридиновые (нифедипидин, амлодипин, фелодипин, лацидипин) и недигидропиридиновые (верапамил и дилтиазем) антагонисты кальция. Представители первой подгруппы на фоне снижения АД, развивающегося за счет периферической вазодилатации, могут увеличивать частоту сердечных сокращений (ЧСС) и способствовать активации САС. Представители второй группы, сохраняя выраженную антигипертензивную активность, обладают значительно менее выраженным периферическим вазодилатирующим действием, чем дигидропиридиновые антагонисты кальция. Более того, они способны уменьшать ЧСС (за счет подавления активности автоматизма синусового узла) и уменьшать активность САС (данные исследования VAMPHYR), что важно для пациентов с ожирением. Необходимо отметить, что, по данным многих крупных исследований, антагонисты кальция достоверно снижают число новых случаев сахарного диабета (INVEST, INSIGHT, ALLHAT), способны уменьшать гипертрофию левого желудочка и обладают антисклеротическим эффектом (VHAS).
Диуретики
Одним из основных механизмов повышения АД при артериальной гипертензии на фоне метаболического синдрома является гиперволемия, возникающая вследствие повышенной реабсорбции натрия и воды в проксимальных отделах почечных канальцев на фоне гиперинсулинемии и повышения сосудистого сопротивления. Поэтому, диуретики могли бы стать одним из основных классов антигипертензивных препаратов, применяющихся при данной патологии. Однако несомненные достоинства классических тиазидных диуретиков оказываются явно недостаточными для того, чтобы компенсировать их негативные (прежде всего метаболические эффекты — гипокалиемию, ухудшение углеводного, липидного и пуринового обменов).
Согласно результатам клинических наблюдений, все тиазидные диуретики ухудшают углеводный обмен, даже в суточной дозе 12.5 мг. При этом чем выше исходный уровень гликемии, тем в большей степени он повышается на фоне их применения. У лиц молодого возраста нарушение толерантности к глюкозе развивается в среднем через 5 лет непрерывного приема тиазидных диуретиков, а у лиц пожилого возраста — через 1 – 2 года после начала их применения. В случае сопутствующего сахарного диабета показатели гликемического контроля ухудшаются уже в течение первых нескольких дней от начала приема тиазидных диуретиков. Помимо неблагоприятного влияния на углеводный обмен тиазидные диуретики могут оказывать негативное действие на липидный и пуриновый обмены.
Особняком среди диуретиков стоит индапамид ретард (Арифон ретард), который в отличие от классических тиазидных диуретиков не оказывает отрицательного влияния на метаболизм глюкозы, липидов и мочевой кислоты. Так, по данным российского многоцентрового исследования МИНОТАВР (619 пациентов с метаболическим синдромом и артериальной гипертензией) он проявил себя как препарат, способный эффективно снижать уровень АД и оказывать положительное влияние на показатели углеводного, липидного и пуринового обмена. При этом необходимо иметь в виду, что индапамид ретард (Арифон ретард) обладает доказанным и выраженным кардио-, ангио- и нефропротективным действием, что делают его в группе диуретиков препаратом выбора для лечения пациентов с ожирением и нарушениями углеводного, липидного и пуринового обмена как при моно-, так и при комбинированной терапии.
Бета-адреноблокаторы
Повышение активности САС у пациентов с ожирением диктует необходимость применения β — блокаторов. Однако неселективные β — блокаторы (атенолол, пропранолол) негативно влияют на углеводный и липидный обмен. Кроме этого, β — блокаторы (в том числе и селективные β1-блокаторы в высоких дозах), блокируя β — адренорецепторы поджелудочной железы, тормозят высвобождение инсулина. Так как β-блокаторы вызывают развитие НТГ и прибавку в весе, их использование при неосложненной гипертензии и ожирении не рекомендуется в качестве первой линии терапии. Однако эта группа препаратов может применяться при ожирении и артериальной гипертензии в тех случаях, когда не удается добиться целевого уровня АД из-за выраженной активации САС и тахикардии.
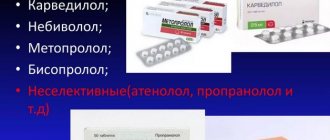
«Новые» высокоселективные β1-блокаторы (бисопролол, карведилол, небиволол) практически лишены тех неблагоприятных побочных эффектов, которые ограничивали их широкое применение у пациентов с нарушением углеводного и липидного обмена. Кроме этого, небиволол обладает уникальным свойством увеличивать продукцию NO и уменьшать проявления эндотелиальной дисфункции, которая характерна для пациентов с ожирением. Помимо этого, препарат оказывает благоприятное влияние на показатели углеводного обмена (снижение уровня триглицеридов) и церебральную гемодинамику, что позволяют существенно расширить возможности его применения при артериальной гипертензии на фоне метаболического синдрома. У небиволола отсутствует «антилипазный» эффект и он снижает общее и периферическое сосудистое сопротивление, улучшает регионарный кровоток, почечную перфузию, скорость клубочковой фильтрации, повышает чувствительность периферических тканей к инсулину. Поэтому среди бета-адреноблокаторов препаратом выбора при сочетании артериальной гипертензии и метаболического синдрома является небиволол.
Агонисты имидазолиновых рецепторов
Предпосылкой к назначению агонистов I2-имидазолиновых рецепторов пациентам с ожирением и артериальной гипертензией является их способность повышать чувствительность тканей к инсулину и улучшать углеводный обмен. При этом, по данным российского многоцентрового исследования АЛМАЗ, у больных с метаболическим синдромом терапия моксонидином достоверно улучшала показатели липидного и углеводного обмена, чувствительность тканей к инсулину, способствовала снижению массы тела и уровня лептина в крови и улучшению функции эндотелия сосудов. Причем эти положительные изменения были сопоставимы по своей выраженности с терапией метформином.
Альфа – адреноблокаторы
Альфа-адреноблокаторы (несмотря на результаты исследования ALLHAT) сохраняют свой терапевтический потенциал при лечении артериальной гипертензии у больных с ожирением, благодаря своей способности уменьшать инсулинорезистентность, улучшать углеводный и липидный обмен и оказывать положительное влияние на почечную гемодинамику. Однако применение должно ограничиваться только использованием его в комбинации с другими антигипертензивными средствами.
В результате анализа данных клинических исследований, доказательной базы и особенностей клинической фармакологии антигипертензивных препаратов можно предложить практическому врачу алгоритм дифференцированного их применения при артериальной гипертензии и метаболическом синдроме (рис. 4).
Литература
1. ESH/ESC Guidelines for the management of arterial hypertension . Journal of Hypertension 2013; 31:1281–1357. 2. Elliott W., Meyer P. Incident diabetes in clinical trials of antihypertensive drugs: a network meta-analysis. Lancet 2010; 369: 201 – 207. 3. Krysiak1 R., Sierant1 M.., et al. The effect of angiotensin-converting enzyme inhibitors on plasma adipokine levels in normotensive patients with coronary artery disease. Pol J Endocrinol 2010; 61 (3): 280–286 4. Krysiak1 R., Sierant1 M.., et al. The effect of perindopril and enalapril on plasma resistin levels in normotensive patients with coronary heart disease. Pol J Endocrinol 2010; 61 (6): 683–690 5. Nedogoda S., Ledyaeva A.,Chumachok E., Tsoma V., Mazina G., Salasyuk A., Barykina I. Randomized Trial of Perindopril, Enalapril, Losartan And Telmisartan in Overweight or Obese Patients With Hypertension // Clin Drug Investig 2013, 33:553–561 6. Vitale С., Mercuro G., et al. Metabolic effect of telmisartan and losartan in hypertensive patients with metabolic syndrome. Cardiovascular Diabetology 2005; 4:6-11. 7. Лебедева М.В., Стахова Т.Ю., Минакова Е.Г., Зайцева Л.И., Северова М.М., Пулин А.А. Функция эндотелия у больных с артериальной гипертензией и нарушением обмена мочевой кислоты // Вестник Российской АМН. 2010. №12. С. 44-46. 8. Кобалава Ж.Д., Котовская Ю.В., Толкачева В.В., Мальто А.С. Мочевая кислота – ключевой компонент кардиоренометаболического континуума // Кардиоваскулярная терапия и профилактика 2008. №4.95-106. 9. Alderman M., Aiyer K.J. Uric acid: role in cardiovascular disease and effects of losartan. Curr Med Res Opin 2004; 20 (3): 369–379. 10. NAVIGATOR Study Group. Effect of valsartan on the incidence of diabetes and cardiovascular events. N Engl J Med 2010; 366:1477-90. 11. Dusing R. Effect of the angiotensin II antagonist valsartan on sexual function in hypertensive men. Blood Press Suppl 2003;2:29-34. 12. Fogari R., Preti P., Derosa G. et al. Effect of antihypertensive treatment with valsartan or atenolol on sexual activity and plasma testosterone in hypertensive men. Eur J Clin Pharmacol 2002;58(3):177-80. 13. Lindholm L.H., Persson M., Alaupovic P., Carlberg B. Metabolic outcome during 1 year in newly detected hypertensives: results of the Antihypertensive Treatment and Lipid Profile in a North of Sweden Efficacy Evaluation (ALPINE study). J Hypertension 2003;21(8):1563-1574. 14. Мамирбаева К.М., Мычка В.Б., Сергиенко В.Б., Чазова И.Е. Метаболический синдром и антагонисты рецепторов ангиотензина II. // Кардиоваскулярная терапия и профилактика 2007. №2. С.42-51. 15. Kintscher U., Bramlage P., et al. Irbesartan for the treatment of hypertension in patients with the metabolic syndrome: A sub analysis of the Treat to Target post authorization survey. Prospective observational, two armed study in 14,200 patients. Cardiovascular Diabetology 2007; 6: 12-16. 16. Benson SC, Pershadsingh HA, Ho CI, Chittiboyina A, Desai P, Pravenec M, Qi N, Wang J, Avery MA, Kurtz TW: Identification of telmisartan as a unique angiotensin II receptor antagonist with selective PPARgamma-modulating activity. Hypertension 2004, 43(5):993-1002 17. Takagi H, Niwa M, Mizuno Y, Goto SN, Umemoto T; ALICE (All-Literature Investigation of Cardiovascular Evidence) Group. Telmisartan as a metabolic sartan: the first meta-analysis of randomized controlled trials in metabolic syndrome. J Am Soc Hypertens. 2013,7(3):229-35 18. Derosa G., Fogari D., et al. Metabolic effects of telmisartan and irbesartan in type 2diabetic patients with metabolic syndrome treated with rosiglitazone. Journal of Clinical Pharmacy and Therapeutics 2007; 32: 261–268. 19. Rizos CV, Milionis HJ, Kostapanos MS, et al. Effects of rosuvastatin combi-ned with olmesartan, irbesartan, or telmisartan on indices of glucose metabolism in Greek adults with impaired fasting glucose, hypertension, and mixed hyperlipidemia: a 24-week, randomized, open-label, prospectivestudy. Clin Ther 2010; 32:492-505.
ШПОРЫ. Фармакология. / агонисты к имидазолиновым рецепторам
Агонисты имидазолиновых рецепторов
Механизм действия
Имидазолиновые рецепторы локализуются как в ЦНС (в ядрах ретикулярной формации, ростральной вентролатеральной области продолговатого мозга) — подтип 1, так и на периферии (например, в почках, поджелудочной железе) — подтип 2. Последние найдены также на митохондриях. Описан еще один тип рецепторов, не относящихся ни к одному из упомянутых типов и локализующихся в симпатических нервных окончаниях. Их активация приводит к снижению выработки норадреналина.
Активация имидазолиновых рецепторов приводит к увеличению синтеза арахидоновой кислоты и ингибированию Na+/H+ ионообменных каналов. Активация центральных I1-рецепторов приводит к снижению АД и уменьшению частоты сердечных сокращений, вследствие центрального подавляющего воздействия на периферическую симпатическую нервную систему. Различия в терапевтическом и гемодинамическом эффекте лекарств центрального действия обусловлено неодинаковой аффинностью к разным типам рецепторов. Препарат центрального действия первого поколения клонидин обладает сродством к двум типам рецепторов — центральным а-адеронорецепторам и имидазолиновым рецепторам. Его гипотензивный эффект в большей степени связан со стимуляцией имидазолиновых рецепторов, в то время как основные побочные эффекты опосредуются кортикальными a1-адренорецепторами.
Рилменидин и моксонидин обладают высокой селективностью в отношении I1-рецепторов. Их аффинность к I1-рецепторам более чем в 100 раз превосходит сродство к а2-адренорецепторам. Для обоих лекарств характерен выраженный гипотензивный эффект, иногда сопровождающийся незначительным седативным действием. Гипотензивное действие агонистов имидазолиновых рецепторов и вызываемое ими снижение периферического сосудистого сопротивления связаны с их выраженной периферической симпатолитической активностью. При этом стимуляция I1-рецепторов вызывает лишь незначительное уменьшение частоты сердечных сокращений (ЧСС). Показано, что брадикардия при применении клонидина в большей степени связана со стимуляцией а-адренорецепторов.
Фармакокинетика
Рилменидин (1-2 мг/сут однократно, Биодоступность 100% Связывание с белками плазмы 10% Т_ — около 8 ч, Основной путь элиминации — через почки в неизменном виде, Начало действия — через 1 -1,5 ч, Максимум — 2-5 ч Продолжительность — 24 ч, Нет синдрома отмены и ортостатической гипотонии)
Моксонидин (0,2-0,4 мг/сут однократно, Биодоступность 90% Связывание с белками плазмы — 8%, T — 2-3 ч, Основной путь элиминации почечная экскреция, Начало действия — 0,5 ч Максимум действия — 2-5 ч Продолжительность — 24 ч, Отсутствие толерантности при длительном применении Отсутствие синдрома отмены
Оба агониста I1-рецепторов обладают сходными фармакокинетическими характеристиками. Следует отметить, что несмотря на относительно короткий период полувыведения, гипотензивный эффект препаратов при однократном приеме сохраняется в течение суток. Максимальное снижение диастолического АД на пике концентрации составляло 30,9 мм. рт. ст. Однократный прием моксонидина, по данным суточного мониторирования АД, обеспечивая длительный гипотензивный эффект, не изменяет циркадный ритм АД [14]. Длительность терапевтического действия имидазолиновых агонистов связывают с их накоплением в ядрах головного мозга.
Побочные эффекты, переносимость
Наиболее частыми побочными эффектами рилменидина являются сухость во рту (4,9%), астения (4,1%), бессонница (4,5%) . Их выраженность зависит от дозы препарата и уменьшается при длительной терапии. При применении моксонидина чаще всего отмечалась сухость во рту (у 12,9% пациентов). Однако в целом многочисленные регистрационные и постмаркетинговые исследования свидетельствуют об очень хорошей переносимости моксонидина — он вызывал сухость во рту и седативный эффект менее чем у 10% больных, что значительно реже, чем при применении других антигипертензивных препаратов центрального действия. Помимо сухости во рту и седативного действия, при применении моксонидина наблюдались бессонница (5-8%) и головная боль (6%). Наибольшей частота побочных эффектов была у больных старших возрастных групп.